Dernière mise à jour le 01/12/2025
SALBUTAMOL TEVA 2,5 mg/2,5 mL, solution pour inhalation par nébuliseur en récipient unidose
Indications thérapeutiques
Le médicament que vous prenez est dénommé SALBUTAMOL TEVA, solution pour inhalation par nébuliseur en récipient unidose. La substance active est le salbutamol. Le salbutamol appartient à un groupe de médicaments appelés bêta-mimétiques (ou bêta-2 agonistes).
Le salbutamol est un bronchodilatateur qui augmente le calibre des bronches et vous aide à respirer plus facilement. SALBUTAMOL TEVA, solution pour inhalation par nébuliseur en récipient unidose est utilisé pour soulager les crises d'asthme et les bronchospasmes survenant malgré le traitement de fond, chez l’adulte, l’adolescent, l’enfant et le nourrisson à partir de 18 mois.
Présentations
> 60 récipient(s) unidose(s) polyéthylène basse densité (PEBD) de 2,5 ml
Code CIP : 389 536-8 ou 34009 389 536 8 8
Déclaration de commercialisation : 14/08/2009
Cette présentation est agréée aux collectivités
- Prix hors honoraire de dispensation : 10,81 €
- Honoraire de dispensation : 1,02 €
- Prix honoraire compris : 11,83 €
- Taux de remboursement :65%
Service médical rendu (SMR)
Amélioration du service médical rendu (ASMR)
Ce médicament étant un générique, l'ASMR n'a pas été évalué par la commission de la transparence (CT), il est possible de se référer à la /aux spécialité(s) de référence du groupe générique auquel appartient ce médicament (cliquez ici pour aller à la rubrique des groupes génériques)
Autres informations
- Titulaire de l'autorisation : TEVA SANTE
- Conditions de prescription et de délivrance :
- liste I
- prescription réservée aux spécialistes et services PEDIATRIE
- prescription réservée aux spécialistes et services PNEUMOLOGIE
- réservé à l'usage en situation d'urgence selon l'article R5121-96 du code de la santé publique
- réservé à une structure d'assistance médicale mobile ou de rapatriement sanitaire
- Statut de l'autorisation : Valide
- Type de procédure : Procédure décentralisée
- Code CIS : 6 803 634 8
ANSM - Mis à jour le : 08/03/2024
SALBUTAMOL TEVA 2,5 mg/2,5 mL, solution pour inhalation par nébuliseur en récipient unidose
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Chaque récipient unidose de 2,5 mL contient 3 mg de sulfate de salbutamol équivalant à 2,5 mg de salbutamol (1,2 mg/mL de sulfate de salbutamol correspondant à 1 mg/mL de salbutamol).
Pour la liste complète des excipients, voir rubrique 6.1.
Solution pour inhalation par nébuliseur en récipient unidose.
Solution claire et incolore à jaune claire.
4.1. Indications thérapeutiques
Remarque : SALBUTAMOL TEVA 2,5 mg/2,5 mL, solution pour inhalation par nébuliseur utilisé pour le traitement de la crise d’asthme aiguë grave doit être associé à une oxygénothérapie et une corticothérapie par voie systémique.
SALBUTAMOL TEVA 2,5 mg/2,5 mL, solution pour inhalation par nébuliseur en récipient unidose est indiqué chez les adultes, les adolescents, les enfants et les nourrissons âgés de 18 mois et plus.
4.2. Posologie et mode d'administration
Le salbutamol est un bronchodilatateur de courte durée (4 à 6 heures) à action rapide (débutant dans les 5 minutes suivant l'inhalation).
La dose sera adaptée individuellement en fonction de l’état clinique.
Adultes (y compris les personnes âgées) :
2,5 mg ou 5 mg à inhaler à l’aide d’un appareil de nébulisation adapté.
Adolescents, enfants et nourrissons (âgés de 18 mois et plus) :
Une seule dose de SALBUTAMOL TEVA 2,5 mg/2,5 mL, solution pour inhalation par nébuliseur en récipient unidose ou SALBUTAMOL TEVA 5 mg/2,5 mL, solution pour inhalation par nébuliseur en récipient unidose.
La nébulisation peut être renouvelée 4 fois par jour. En cas d'asthme aigu grave, les nébulisations peuvent être répétées à des intervalles de 1 à 2 heures si besoin.
Chez l’adulte, la posologie journalière maximale usuellement préconisée est de 20 mg. Si besoin, la dose peut être augmentée à 40 mg par jour dans les cas sévères, sous surveillance médicale stricte en milieu hospitalier.
Chez l’enfant, la séance de nébulisation devra être supervisée par un adulte.
Population pédiatrique
La sécurité et l’efficacité de SALBUTAMOL TEVA 2,5 mg/2,5 mL, solution pour inhalation par nébuliseur n’a pas été établie chez les nourrissons âgés de moins de 18 mois. Une hypoxémie transitoire étant possible, une oxygénothérapie doit être envisagée.
Mode d’administration
L’inhalation sera réalisée en position assise ou debout, le buste étant à la verticale.
SALBUTAMOL TEVA, solution pour inhalation par nébuliseur sera administré à l'aide d’un appareil pour nébulisation adapté ou avec un ventilateur mécanique à pression positive intermittente, en versant le contenu de l’ampoule unidose dans la cuve du nébuliseur. Se conformer aux instructions figurant sur la notice délivrée par le fabricant de l’appareil de nébulisation utilisé. La durée de la séance de nébulisation devra être limitée à environ 10 minutes.
La dose de SALBUTAMOL TEVA, solution pour inhalation par nébuliseur délivrée à l’embout buccal de l’appareil de nébulisation peut varier selon le nébuliseur utilisé. De ce fait, la dose nécessaire peut être différente en fonction de l’appareil de nébulisation utilisé.
La solution contenue dans les récipients unidoses est destinée à une utilisation par voie inhalée et ne doit pas être administrée ni par voie orale ni par voie parentérale.
Pour consulter les instructions concernant la dilution du médicament avant administration, voir rubrique 6.6.
Hypersensibilité à la substance active ou à l'un des excipients mentionnés à la rubrique 6.1.
4.4. Mises en garde spéciales et précautions d'emploi
Il a été démontré que le recours à une association d’agents anticholinergiques et de sulfate de salbutamol en nébulisation précipite l’apparition d’un glaucome aigu à angle fermé. Par conséquent, l’association de salbutamol nébulisé et d’agents anticholinergiques nébulisés doit être utilisée avec prudence.
Il convient d’avertir le patient de la nécessité d’empêcher la solution ou la brume de pénétrer dans ses yeux.
Les bronchodilatateurs ne constituent pas le traitement de l’asthme persistant à eux seul.
Les patients présentant un asthme sévère sont d’autant plus exposés au risque d’asthme aigu grave pouvant engager le pronostic vital et nécessitent tout particulièrement un suivi médical régulier.
Chez ces patients, les médecins doivent envisager d’utiliser la dose maximale recommandée d’une corticothérapie par voie inhalée et/ou d’une corticothérapie orale.
Dans les crises d’asthme sévères, le traitement bronchodilatateur doit être associé à une oxygénothérapie afin de pallier au risque d’hypoxémie, en particulier chez le jeune enfant.
Chez les patients asthmatiques, la nébulisation de salbutamol ne doit pas retarder la mise en route d’une corticothérapie par voie inhalée en traitement de fond.
La tenue par le patient d’un carnet de suivi quotidien du contrôle des symptômes contribue à la surveillance de l’évolution de l’asthme et des effets du traitement bronchodilatateur et anti-inflammatoire en cours.
Il doit être conseillé aux patients chez qui un traitement anti-inflammatoire régulier est prescrit (ex : corticostéroïdes par voie inhalée), de continuer à prendre leur traitement anti-inflammatoire même si les symptômes s’améliorent, et qu’ils n’ont pas besoin de SALBUTAMOL TEVA, solution pour inhalation par nébuliseur.
L’augmentation de la consommation de bronchodilatateurs de courte durée d’action (en particulier les bêta-2 agonistes utilisés pour soulager les symptômes) indique une détérioration du contrôle de l’asthme, et les patients doivent être avertis qu’ils doivent alors consulter un médecin dès que possible. Dans ces conditions, la thérapeutique du patient doit être réévalué.
Une augmentation de la corticothérapie inhalée ou l’instauration d’un traitement de courte durée par corticoïdes oraux peuvent s’avérer nécessaires.
Si, au cours d’une crise d’asthme, les symptômes ne régressent pas ou l’état clinique s’aggrave malgré une deuxième nébulisation, un avis médical est requis en urgence.
La surutilisation de bêta agoniste de courte durée d’action peut masquer la progression de la pathologie sous-jacente et contribuer à la détérioration du contrôle de l’asthme, entrainant une augmentation du risque d’exacerbations graves d’asthme et de la mortalité.
Les patients qui prennent du salbutamol « à la demande » plus de deux fois par semaine (en plus des administrations en traitement préventif de l’asthme induit par l’effort) sont à risque de surutilisation de salbutamol et doivent donc être réexaminés (symptômes diurnes, réveils nocturnes, limitation des activités due à l’asthme) afin de réajuster leur traitement.
SALBUTAMOL TEVA, solution pour inhalation par nébuliseur, doit être administré avec prudence en cas d’affection cardiovasculaire grave, de cardiomyopathie obstructive hypertrophique, de tachyarythmie, d'hypertension artérielle sévère et non traitée, d'anévrisme, de thyrotoxicose ou d'hypokaliémie non traitée, d'hyperthyroïdie, de diabète mal contrôlé et de phéochromocytome.
Le salbutamol doit être administré avec prudence chez les patients présentant une thyrotoxicose.
Les béta-2-mimétiques par voie parentérale ou par nébulisation peuvent être à l’origine d’une hypokaliémie potentiellement significative. Lors d’une crise d’asthme sévère, il convient de rester vigilant, cet effet pouvant être potentialisé par un traitement concomitant par les dérivés de la xanthine, les stéroïdes et les diurétiques et par une hypoxie associée. Dans de telles situations, une surveillance des concentrations sériques de potassium est préconisée.
Chez les patients diabétiques, une surveillance de la glycémie peut être préconisée lors du traitement par SALBUTAMOL TEVA, solution pour inhalation par nébuliseur, en raison du risque d’augmentation de la glycémie lié à l’effet du bêta-2 agoniste. Des cas isolés d’acidocétoses ont été rapportés. L’administration concomitante de corticostéroïdes peut exacerber cet effet.
La prudence est nécessaire lors du traitement des crises d’asthme aiguës ou de l’exacerbation d’un asthme sévère, car une augmentation des taux sériques de lactate et, rarement, une acidose lactique, ont été signalées après l’utilisation de doses élevées de salbutamol dans des situations d’urgence. Ce phénomène est réversible lors de la réduction de la dose de salbutamol.
Des effets cardiovasculaires peuvent être associés aux médicaments sympathomimétiques, y compris le salbutamol. Les données issues de la pharmacovigilance et de la littérature rapportent de rares cas d'ischémie du myocarde associés à l’administration de salbutamol. Les patients atteints d’une affection cardiovasculaire grave sous-jacente (par exemple, cardiopathie ischémique, arythmie ou insuffisance cardiaque grave) et traités par salbutamol pour une maladie respiratoire, devront être informés de la nécessité de consulter immédiatement un médecin en cas de douleurs thoraciques ou autres symptômes évocateurs d’une aggravation de la pathologie cardiaque. Il convient d’être prudent lors de l’évaluation de symptômes de type dyspnée et douleur thoracique, car ceux-ci peuvent être d’origine respiratoire ou cardiaque.
Comme avec tout autre traitement par inhalation, un bronchospasme paradoxal peut survenir dans de très rares cas. Dans ce cas, le traitement devra être interrompu immédiatement et, le cas échéant, remplacé par un autre traitement.
Les modalités d’emploi de SALBUTAMOL TEVA, solution pour inhalation par nébuliseur, et de l’appareil de nébulisation doivent être clairement explicitées au patient pour une utilisation adaptée. Chez l’enfant, l’utilisation d’un embout buccal plutôt qu’un masque facial sont à encourager le plus tôt possible.
L'utilisation de SALBUTAMOL TEVA, solution pour inhalation par nébuliseur peut induire une réaction positive des tests pratiqués lors des contrôles antidopage.
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
Le propranolol et d’autres bêtabloquants non cardio-sélectifs peuvent contrer l’action du salbutamol et ne doivent donc pas être administrés de façon concomitante. Chez les sujets asthmatiques, le risque de bronchospasme d’évolution sévère peut être majoré en cas de traitement concomitant par bétabloquants.
L’administration d'anesthésiques halogénés, tels que l'halothane, le méthoxyflurane ou l'enflurane, chez des sujets traités par salbutamol peut entraîner une augmentation du risque de survenue de troubles du rythme cardiaque sévère et d’hypotension. Si une anesthésie par un anesthésique halogéné est envisagée, il convient de prévoir l’interruption du traitement par salbutamol au moins 6 heures avant.
Le risque d’hypokaliémie liée à l’administration de salbutamol (voir rubriques 4.4 et 4.8) peut être majoré par l'administration concomitante d'autres médicaments tels que les dérivés de la xanthine, les glucocorticoïdes et les diurétiques. Les glycosides cardiaques doivent être utilisés avec prudence.
Les inhibiteurs de la monoamine oxydase et les antidépresseurs tricycliques peuvent augmenter le risque d'effets indésirables cardiovasculaires.
Des cas isolés de glaucome à angle fermé ont été rapportés chez les patients traités par une association de salbutamol et d'ipratropium en nébulisation ; cette association doit par conséquent être utilisée avec prudence et, en particulier, tout contact avec les yeux doit être évité.
4.6. Fertilité, grossesse et allaitement
Grossesse
L’administration de médicaments au cours de la grossesse ne doit être envisagée que si le bénéfice attendu pour la mère est plus important que le risque potentiel pour le fœtus. Néanmoins, comme pour la majorité des médicaments, il existe peu de données publiées concernant leur sécurité d’emploi dans les premiers stades de la grossesse. Cependant, des études menées chez l’animal ont mis en évidence certains effets délétères sur le fœtus à des doses élevées.
Le salbutamol peut être excrété dans le lait maternel. On ignore si le salbutamol a un effet délétère sur le nouveau-né. Par conséquent, SALBUTAMOL TEVA, solution pour inhalation par nébuliseur en récipient unidose, ne sera utilisé en cas d’allaitement que si le bénéfice pour la mère est plus important que le risque potentiel pour le nouveau-né.
Fertilité
Aucune donnée concernant les effets du salbutamol sur la fertilité n’est disponible.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
Le risque d’effets indésirables est fonction de la dose administrée et de la sensibilité individuelle. Les effets indésirables le plus fréquemment rapportés sont : altération du goût (mauvais goût ou goût désagréable ou inhabituel), réactions locales au site d'application (irritation de la bouche et de la gorge, sensation de brûlure de la langue), tremblements des extrémités (généralement des mains), nausées, transpiration, agitation, céphalées et étourdissements. Ces effets indésirables peuvent régresser en 1 à 2 semaines avec la poursuite du traitement.
La fréquence des effets indésirables est classée en appliquant la convention suivante : très fréquent (≥ 1/10) ; fréquent (≥ 1/100, < 1/10) ; peu fréquent (≥ 1/1 000, < 1/100) ; rare (≥ 1/10 000, < 1/1 000) ; très rare (< 1/10 000) ; fréquence indéterminée (ne peut être estimée sur la base des données disponibles).
|
Classe de systèmes d’organes |
Fréquence |
Effets indésirables |
|
Affections du système immunitaire |
Très rare |
Réaction d'hypersensibilité, incluant : angio-œdème, urticaire, prurit, bronchospasme, hypotension artérielle et collapsus |
|
Troubles du métabolisme et de la nutrition |
Rare |
Hypokaliémie |
|
Très rare |
Acidose lactique *voir rubrique 4.4 |
|
|
Affections psychiatriques |
Très rare |
Hyperactivité (en particulier chez les enfants) |
|
Affections du système nerveux |
Fréquent |
Tremblements musculaires, céphalées |
|
Affections cardiaques |
Fréquent |
Tachycardie |
|
Peu fréquent |
Palpitations |
|
|
Très rare |
Arythmie cardiaque incluant : fibrillation auriculaire, tachycardie supraventriculaire et extrasystoles |
|
|
Fréquence indéterminée |
Ischémie myocardique# *voir rubrique 4.4 |
|
|
Affections vasculaires |
Rare |
Vasodilatation périphérique |
|
Affections respiratoires, thoraciques et médiastinales |
Très rare |
Bronchospasme paradoxal |
|
Affections gastro-intestinales |
Peu fréquent |
Irritation de la bouche et de la gorge |
|
Affections musculo-squelettiques et systémiques |
Peu fréquent |
Crampes musculaires |
#* déclaré spontanément depuis la commercialisation. De ce fait, la fréquence est considérée comme indéterminée.
Population pédiatrique
Il existe des rapports concernant les effets stimulants sur le système nerveux central après inhalation de salbutamol se manifestant pas de l’hyperexcitabilité, un comportement hyperactif, des troubles du sommeil et des hallucinations. Ces observations ont principalement été réalisées chez les enfants jusqu’à l’âge de 12 ans.
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr/.
La tachycardie constitue le symptôme le plus significatif d’un surdosage important. Les autres symptômes caractéristiques sont : palpitations, arythmie, agitation, troubles du sommeil, douleur thoracique et tremblements vigoureux, en particulier des mains mais pouvant s’étendre à l’ensemble du corps.
Le traitement d’un surdosage en agonistes des récepteurs bêta sympathomimétiques est essentiellement symptomatique.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Mécanisme d’action
Le salbutamol est un agoniste sélectif des récepteurs bêta-2 adrénergiques exerçant un effet bronchodilatateur.
Effets pharmacodynamiques
La bronchodilatation apparaît quelques minutes après l'inhalation et atteint généralement son effet maximal en 30 à 60 minutes. L'effet persiste au moins 4 heures. Il n’y a pas de corrélation entre l’effet sur la bronchodilatation et la concentration plasmatique après administration par voie inhalée.
Le salbutamol administré à l’aide d’un nébuliseur est indiqué pour les formes graves de bronchoconstrictions. Ce mode d’administration dispense un traitement par bêta-2 mimétique à dose intensive. Durant la nébulisation, l’humidification produite est favorable à l'élimination des sécrétions. La préparation nébulisée peut être administrée avec ou sans pression positive.
5.2. Propriétés pharmacocinétiques
Par voie inhalée, 10 à 20 % de la dose atteignent les voies respiratoires basses. La quantité restante est déglutie, puis absorbée au niveau du tractus gastro-intestinal et subit un effet de premier passage hépatique avec métabolisation en sulfate de phénol. Au niveau des voies respiratoires, le salbutamol est absorbé dans les tissus pulmonaires et la circulation.
Distribution
Le salbutamol est lié aux protéines plasmatiques à raison de 10 %.
Biotransformation
Le salbutamol subit un métabolisme hépatique. Après l’absorption de la fraction au niveau du tractus gastro-intestinal, le salbutamol subit un effet de premier passage hépatique avec métabolisation en sulfate de phénol.
Élimination
La majorité de la substance active est excrétée dans l'urine sous forme inchangée et sous forme de sulfate de phénol. Environ 10 % sont excrétés dans les selles.
Le salbutamol administré par voie intraveineuse a une demi-vie de 4 à 6 heures et est éliminé en partie par les reins et en partie par métabolisation en 4’-O-sulfate inactif (sulfate de phénol) qui est, lui aussi, principalement éliminé dans l’urine. La majeure partie d’une dose de salbutamol administrée par voie intraveineuse, par voie orale ou par inhalation est excrétée dans les 72 heures.
5.3. Données de sécurité préclinique
Chez les souris CD-1 ayant reçu par voie sous-cutanée une dose comprise entre 0,025 à 2,5 mg/kg, des fentes palatines ont été observées chez 4,5 % et 9,3 % des fœtus aux doses de 0,25 et 2,5 mg/kg, respectivement (approximativement 0,1 et 1 fois la posologie inhalée maximale quotidienne recommandée calculée en mg/m²). Une étude de la reproduction chez le lapin a révélé une malformation osseuse du crâne chez 37 % des fœtus ayant reçu 50 mg/kg de salbutamol par voie orale (approximativement 80 fois la dose clinique sur la base proposée ci-dessus).
Dans une étude évaluant la fertilité et la capacité générale de reproduction chez le rat aux doses de 2 et 50 mg/kg/jour, à l’exception d’une réduction du nombre de ratons survivant au 21ème jour post-partum à la dose de 50 mg/kg/jour, aucun effet indésirable sur la fertilité, le développement embryo-fœtal, la taille de la portée, le poids à la naissance ou le taux de croissance n’a été rapporté.
Des doses élevées d'agonistes des récepteurs bêta-adrénergiques ont induit des léiomyomes mésovariens chez le rat. Aucun de ces résultats n'a été observé chez l’homme.
Les résultats des études de tératogénicité chez le lapin exposé à une dose systémique élevée et l'induction de léiomyomes mésovariens bénins chez le rat n’ont pas de valeur significative en clinique.
Acide sulfurique dilué (pour ajustement du pH).
Eau pour préparations injectables.
2 ans.
Utiliser le contenu d'un récipient unidose immédiatement après ouverture. Ne jamais utiliser un récipient unidose déjà ouvert, ou contenant une solution décolorée ou trouble. Jeter tout récipient unidose partiellement utilisé, ouvert ou endommagé.
6.4. Précautions particulières de conservation
A conserver à une température ne dépassant pas 25° C.
A conserver dans l'emballage d'origine à l’abri de la lumière.
6.5. Nature et contenu de l'emballage extérieur
2,5 mL de solution dans un récipient unidose (LDPE).
Boîtes de 15, 20, 25, 30, 40, 50 ou 60 récipients unidoses.
Toutes les présentations peuvent ne pas être commercialisées.
6.6. Précautions particulières d’élimination et de manipulation
Le contenu d’un récipient unidose (2,5 mL) est prêt à l'emploi et ne doit pas être dilué. Dans le cas de petits volumes et si une administration prolongée est requise, SALBUTAMOL TEVA 2,5 mg/2,5 mL, solution pour inhalation par nébuliseur pourra être dilué dans du sérum physiologique immédiatement avant l'administration.
Tout médicament non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
100-110, Esplanade du Général de Gaulle
92931 Paris La Défense Cedex
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· 34009 389 531 6 9 : 15 récipients unidoses (LPDE).
· 34009 389 532 2 0 : 20 récipients unidoses (LPDE).
· 34009 389 533 9 8 : 25 récipients unidoses (LPDE).
· 34009 389 534 5 9 : 30 récipients unidoses (LPDE).
· 34009 389 535 1 0 : 50 récipients unidoses (LPDE).
· 34009 389 536 8 8 : 60 récipients unidoses (LPDE).
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
[à compléter ultérieurement par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE
[à compléter ultérieurement par le titulaire]
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Sans objet.
Liste I.
Médicament à prescription réservée aux spécialistes en pneumologie ou en pédiatrie. Médicament pouvant être administré par tout médecin intervenant en situation d’urgence ou dans le cadre d’une structure d’assistance médicale mobile ou de rapatriement sanitaire (article R. 5143-5-8 du code de la santé publique).
ANSM - Mis à jour le : 08/03/2024
SALBUTAMOL TEVA 2,5 mg/2,5 mL, solution pour inhalation par nébuliseur en récipient unidose
Salbutamol
· Gardez cette notice. Vous pourriez avoir besoin de la relire.
· Si vous avez d’autres questions, interrogez votre médecin ou votre pharmacien.
· Ce médicament vous a été personnellement prescrit. Ne le donnez pas à d’autres personnes. Il pourrait leur être nocif, même si les signes de leur maladie sont identiques aux vôtres.
· Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
1. Qu'est-ce que SALBUTAMOL TEVA 2,5 mg/2,5 mL, solution pour inhalation par nébuliseur en récipient unidose et dans quels cas est-il utilisé ?
2. Quelles sont les informations à connaître avant d'utiliser SALBUTAMOL TEVA 2,5 mg/2,5 mL, solution pour inhalation par nébuliseur en récipient unidose ?
3. Comment utiliser SALBUTAMOL TEVA 2,5 mg/2,5 mL, solution pour inhalation par nébuliseur en récipient unidose ?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver SALBUTAMOL TEVA 2,5 mg/2,5 mL, solution pour inhalation par nébuliseur en récipient unidose ?
6. Contenu de l’emballage et autres informations.
1. QU’EST-CE QUE SALBUTAMOL TEVA 2,5 mg/2,5 mL, solution pour inhalation par nébuliseur en récipient unidose ET DANS QUELS CAS EST-IL UTILISE ?
Le médicament que vous prenez est dénommé SALBUTAMOL TEVA, solution pour inhalation par nébuliseur en récipient unidose. La substance active est le salbutamol. Le salbutamol appartient à un groupe de médicaments appelés bêta-mimétiques (ou bêta-2 agonistes).
Le salbutamol est un bronchodilatateur qui augmente le calibre des bronches et vous aide à respirer plus facilement. SALBUTAMOL TEVA, solution pour inhalation par nébuliseur en récipient unidose est utilisé pour soulager les crises d'asthme et les bronchospasmes survenant malgré le traitement de fond, chez l’adulte, l’adolescent, l’enfant et le nourrisson à partir de 18 mois.
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT D’UTILISER SALBUTAMOL TEVA 2,5 mg/2,5 mL, solution pour inhalation par nébuliseur en récipient unidose ?
· si vous êtes allergique au salbutamol ou à l’un des autres composants contenus dans ce médicament, mentionnés dans la rubrique 6 ;
· pour le traitement de la menace d'accouchement prématuré au cours de la grossesse.
Avertissements et précautions
Adressez-vous à votre médecin ou pharmacien avant d’utiliser SALBUTAMOL TEVA 2,5 mg/2,5 mL, solution pour inhalation par nébuliseur en récipient unidose :
· si vous avez des antécédents de problèmes cardiaques, par exemple de rythme cardiaque rapide ou irrégulier ou d'angine de poitrine ;
· si vous souffrez de problèmes thyroïdiens ;
· si vous souffrez d'hypertension artérielle ;
· si vous utilisez des anticholinergiques en nébulisation (tels que le bromure d'ipratropium) pour traiter votre asthme, veillez à ce que la brume ne pénètre pas dans vos yeux ;
· si vous êtes diabétique.
L'utilisation de salbutamol peut induire une réaction positive des tests pratiqués lors des contrôles antidopage.
L'utilisation de salbutamol à des fins de dopage peut nuire à votre santé.
Autres médicaments et SALBUTAMOL TEVA 2,5 mg/2,5 mL, solution pour inhalation par nébuliseur en récipient unidose
Informez votre médecin ou pharmacien si vous prenez, avez récemment pris ou pourriez prendre tout autre médicament.
Certains médicaments peuvent interagir avec SALBUTAMOL TEVA, solution pour inhalation par nébuliseur en récipient unidose et peuvent en aggraver les effets indésirables ou réduire son effet. Informez votre médecin si vous prenez l’un des médicaments suivants :
· des bêta-bloquants, y compris le propranol, et des glycosides cardiaques, y compris la digoxine, qui sont des médicaments généralement utilisés dans le traitement de maladies cardiaques telles que l’angine de poitrine (douleur thoracique d’origine cardiaque survenant notamment lors de la réalisation d’un effort physique), les arythmies cardiaques ou irrégularité du rythme des battements cardiaques, et l'hypertension artérielle ;
· des diurétiques ;
· d'autres médicaments destinés au traitement de l'asthme (autres bêta-mimétiques, bromure d’ipratropium, théophylline et stéroïdes) ;
· des antidépresseurs (inhibiteurs de la monoamine oxydase et antidépresseurs tricycliques).
Vous ne devez pas utiliser SALBUTAMOL TEVA, solution pour inhalation par nébuliseur pendant une période d’au moins 6 heures avant une intervention chirurgicale nécessitant l’administration d’un anesthésique (par exemple, enflurane).
SALBUTAMOL TEVA 2,5 mg/2,5 mL, solution pour inhalation par nébuliseur en récipient unidose avec des aliments et boissons
Sans objet.
Grossesse, allaitement et fertilité
Si vous êtes enceinte ou que vous allaitez, si vous pensez être enceinte ou planifiez une grossesse, demandez conseil à votre médecin ou pharmacien avant de prendre ce médicament. SALBUTAMOL TEVA, solution pour inhalation par nébuliseur ne doit être utilisé pendant la grossesse et l’allaitement que sur recommandation d’un médecin.
Conduite de véhicules et utilisation de machines
SALBUTAMOL TEVA 2,5 mg/2,5 mL, solution pour inhalation par nébuliseur en récipient unidose n’a pas d’effets ou des effets négligeables sur l’aptitude à conduire des véhicules et à utiliser des machines.
SALBUTAMOL TEVA 2,5 mg/2,5 mL, solution pour inhalation par nébuliseur en récipient unidose contient
Sans objet.
3. COMMENT UTILISER SALBUTAMOL TEVA 2,5 mg/2,5 mL, solution pour inhalation par nébuliseur en récipient unidose ?
Posologie
La dose recommandée est de 2,5 mg jusqu’à trois ou quatre fois par jour. Votre médecin peut augmenter cette dose à 5,0 mg trois ou quatre fois par jour.
La dose délivrée de SALBUTAMOL TEVA, solution pour inhalation par nébuliseur en récipient unidose peut varier selon l’appareil de nébulisation utilisé. Des ajustements de doses peuvent être nécessaires. Si vous pensez que l'effet de SALBUTAMOL TEVA, solution pour inhalation par nébuliseur en récipient unidose est trop fort ou trop faible, contactez votre médecin.
SALBUTAMOL TEVA, solution pour inhalation par nébuliseur en récipient unidose doit être utilisé en fonction des besoins, plutôt qu’en prises régulières.
Si votre asthme est instable (par exemple si vos symptômes ou vos exacerbations d’asthme sont fréquents, comme un souffle court qui rend la parole, l’alimentation ou le sommeil difficile, une toux, des sifflements lorsque vous respirez, si vous ressentez un serrement dans la poitrine ou si vos capacités physiques sont limitées par un essoufflement), vous devez avertir immédiatement votre médecin qui débutera ou augmentera les doses d’un traitement pour contrôler votre asthme, comme les corticostéroïdes par voie inhalée.
Avertissez rapidement votre médecin si votre médicament ne vous soulage pas aussi bien que d’habitude (par exemple si vous avez besoin de doses plus importantes pour soulager vos difficultés respiratoires ou si votre inhalateur ne parvient pas à vous soulager pendant au moins trois heures) car votre asthme pourrait s’aggraver et vous pourriez avoir besoin d’un médicament différent.
Si vous utilisez SALBUTAMOL TEVA, solution pour inhalation par nébuliseur en récipient unidose plus de deux fois par semaine pour traiter vos symptômes d’asthme (en plus des utilisations en prévention avant un exercice physique) cela indique que votre asthme est mal contrôlé, ce qui pourrait augmenter le risque de crise d’asthme sévère (aggravation de l’asthme), entrainer des complications graves et pourrait menacer votre pronostic vital, voire être fatale. Vous devez alors contacter votre médecin au plus vite pour modifier votre traitement pour l’asthme.
Si vous utilisez quotidiennement un médicament destiné à traiter l’inflammation des bronches (par exemple des « corticostéroïdes inhalés ») il est important de continuer à prendre ce médicament anti-inflammatoire régulièrement, même si vous vous sentez mieux.
Mode d’administration
Pour inhalation.
Vous ne devez utiliser SALBUTAMOL TEVA, solution pour inhalation par nébuliseur en récipient unidose qu’avec un appareil de nébulisation (nébuliseur). Le nébuliseur diffuse la solution en une fine brume, que vous pouvez alors inhaler en respirant. Lisez les instructions du fabricant et assurez-vous que vous savez utiliser le nébuliseur avant de prendre votre traitement.
· Assurez-vous que le nébuliseur est prêt à l’emploi selon les instructions figurant sur la notice du fabricant.
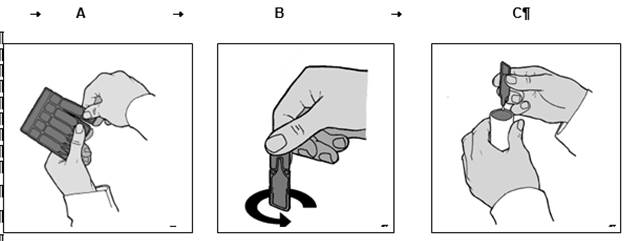
· Détachez un récipient unidose en opérant un mouvement de torsion et de traction (Schéma A).
· Tenez le récipient unidose vertical (embout vers le haut) et détachez l’embout par torsion (Schéma B).
· Remplissez la cuve du nébuliseur comme indiqué sur le Schéma C.
· Utilisez le nébuliseur conformément aux instructions figurant sur la notice du fabricant.
· Une fois la séance de nébulisation terminée, la solution non utilisée restant dans la cuve de l’appareil de nébulisation ne doit pas être conservée mais doit être jetée.
· Après emploi, nettoyez soigneusement votre nébuliseur.
Utilisation chez les enfants et les adolescents
En cas d’utilisation chez l’enfant, il est recommandé qu’un adulte supervise la séance de nébulisation.
Si vous avez pris utilisé plus de SALBUTAMOL TEVA 2,5 mg/2,5 mL, solution pour inhalation par nébuliseur en récipient unidose que vous n’auriez dû
Contactez immédiatement votre médecin ou rendez-vous au service des urgences de l'hôpital le plus proche. Emportez cette notice pour la montrer au médecin.
Si vous prenez une dose plus importante qu'à l'accoutumée, il est possible que vous ressentiez une accélération de votre rythme cardiaque ou que vous vous sentiez un peu tremblant. Ces effets se dissipent généralement en quelques heures.
Si vous oubliez de prendre SALBUTAMOL TEVA 2,5 mg/2,5 mL, solution pour inhalation par nébuliseur en récipient unidose
Ne prenez pas de dose double pour compenser la dose que vous avez oublié de prendre.
Si vous arrêtez de prendre SALBUTAMOL TEVA 2,5 mg/2,5 mL, solution pour inhalation par nébuliseur en récipient unidose
Sans objet.
Si vous avez d’autres questions sur l’utilisation de ce médicament, demandez plus d’informations à votre médecin ou à votre pharmacien.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
Les effets indésirables les plus fréquemment signalés sont une altération du goût (mauvais goût ou goût désagréable dans la bouche), une irritation de la gorge et/ou de la bouche, de légers tremblements, une agitation, des maux de tête et des vertiges. En outre, l’apparition de nausées et de sueurs est possible. Ces effets disparaissent généralement après 1 à 2 semaines de traitement continu.
Fréquents : pouvant affecter jusqu’à 1 patient sur 10
· tremblements musculaires ;
· maux de tête ;
· tachycardie (accélération du rythme cardiaque).
Peu fréquents : pouvant affecter jusqu’à 1 patient sur 100
· irritation de la bouche et de la gorge ;
· palpitations (battements du cœur devenant soudain plus perceptibles et régulièrement accompagnés d’une sensation de martèlement ou de légers tremblements) ;
· crampes musculaires.
Rares : pouvant affecter jusqu’à 1 patient sur 1 000
· faible taux de potassium dans votre sang ;
· bouffées vasomotrices.
Très rares : pouvant affecter jusqu’à 1 patient sur 10 000
· réactions allergiques pouvant comprendre œdème du visage, rougeurs de la peau, bronchospasme (sensation d’oppression thoracique et difficulté respiratoire) appelé angio-œdème ;
· hypotension artérielle et étourdissements ou collapsus ;
· acidose lactique (pouvant causer des douleurs d’estomac, une hyperventilation, un essoufflement, une froideur des pieds et des mains, une irrégularité des battements cardiaques ou une soif) ;
· hyperactivité (en particulier chez les enfants) ;
· bronchospasme paradoxal (sensation d’oppression thoracique et difficulté respiratoire) ;
· anomalies du rythme cardiaque.
Fréquence indéterminée : ne peut être estimée sur la base des données disponibles
· ischémie myocardique (insuffisance du flux sanguin vers le muscle cardiaque pouvant provoquer des douleurs à la poitrine).
L'utilisation de SALBUTAMOL TEVA, solution pour inhalation par nébuliseur, peut induire une diminution du taux de potassium dans le sang, votre médecin peut donc être amené à vérifier régulièrement votre taux de potassium dans le sang.
Effets indésirables supplémentaires chez les enfants
SALBUTAMOL TEVA, solution pour inhalation par nébuliseur peut rarement entraîner une hyperactivité et des problèmes de sommeil chez les enfants jusqu’à 12 ans.
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr/
En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.
5. COMMENT CONSERVER SALBUTAMOL TEVA 2,5 mg/2,5 mL, solution pour inhalation par nébuliseur en récipient unidose ?
Tenir ce médicament hors de la vue et de la portée des enfants.
N’utilisez pas ce médicament après la date de péremption indiquée sur la boîte après EXP. La date de péremption fait référence au dernier jour de ce mois.
A conserver à une température ne dépassant pas 25°C.
A conserver dans l'emballage d'origine à l’abri de la lumière.
Chaque récipient unidose est réservé à un usage unique. N’utilisez jamais un récipient unidose si celui-ci a déjà été ouvert. Jetez tous les récipients unidoses partiellement utilisés, ouverts ou endommagés. N’utilisez pas ce médicament si vous remarquez que la solution est décolorée ou trouble.
Ne jetez aucun médicament au tout-à-l’égout ou avec les ordures ménagères. Demandez à votre pharmacien d’éliminer les médicaments que vous n’utilisez plus. Ces mesures contribueront à protéger l’environnement.
6. CONTENU DE L’EMBALLAGE ET AUTRES INFORMATIONS
· La substance active est : le sulfate de salbutamol.
Chaque mL de solution pour inhalation par nébuliseur contient 1,2 mg de sulfate de salbutamol correspondant à 1 mg de salbutamol.
· Les autres composants sont : le chlorure de sodium, l’acide sulfurique (pour ajustement du pH) et l’eau pour préparations injectables.
Bandes de 5 récipients unidoses emballés dans des boîtes en carton de 10, 15, 20, 25, 30, 40, 50 ou 60. Toutes les présentations peuvent ne pas être commercialisées.
Titulaire de l’autorisation de mise sur le marché
100-110, Esplanade du Général de Gaulle
92931 Paris La Défense Cedex
Exploitant de l’autorisation de mise sur le marché
TEVA SANTE
100-110, Esplanade du Général de Gaulle
92931 Paris La Défense Cedex
Ludwig-Merckle-Str. 3,
89143 Blaubeuren
ALLEMAGNE
Noms du médicament dans les Etats membres de l'Espace Economique Européen
Ce médicament est autorisé dans les Etats membres de l'Espace Economique Européen sous les noms suivants : Conformément à la réglementation en vigueur.
[À compléter ultérieurement par le titulaire]
La dernière date à laquelle cette notice a été révisée est :
[à compléter ultérieurement par le titulaire]
< {MM/AAAA}>< {mois AAAA}.>
Des informations détaillées sur ce médicament sont disponibles sur le site Internet de l’ANSM (France).