Dernière mise à jour le 03/09/2025
MYCOHYDRALIN 500 mg, comprimé vaginal
Indications thérapeutiques
Classe pharmacothérapeutique - code ATC : dérivés imidazolés - G01AF02
ANTIFONGIQUE LOCAL (G : Système génito-urinaire et hormones sexuelles).
Ce médicament est indiqué dans le traitement des mycoses vaginales à levures sensibles (affections dues à des champignons microscopiques).
En cas d’atteinte vulvaire associée, il est recommandé de compléter le traitement vaginal par l’application d’une crème au clotrimazole à 1% sur les lésions.
Ce médicament est réservé à l’adulte.
Vous devez vous adresser à votre médecin si vous ne ressentez aucune amélioration ou si vous vous sentez moins bien après 7 jours.
Présentations
> plaquette(s) polyamide aluminium PVC de 1 comprimé(s) avec applicateur(s)
Code CIP : 279 658-1 ou 34009 279 658 1 4
Déclaration de commercialisation : 01/04/2015
Cette présentation est agréée aux collectivités
Service médical rendu (SMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprès de la HAS (plus d'informations dans l'aide). Les avis et synthèses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur du SMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| Modéré | Avis du 18/02/2015 | Inscription (CT) | Le service médical rendu par MYCOHYDRALIN 500 mg, comprimé vaginal est modéré dans le traitement local des mycoses vaginales à levures sensibles, notamment à candida. |
Amélioration du service médical rendu (ASMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprés de la HAS (plus d'informations dans l'aide). Les avis et synthéses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur de l'ASMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| V (Inexistant) | Avis du 18/02/2015 | Inscription (CT) | Cette spécialité est un complément de gamme qui n’apporte pas d’amélioration du service médical rendu (ASMR V) par rapport à la présentation déjà agréée. |
ANSM - Mis à jour le : 30/05/2024
MYCOHYDRALIN 500 mg, comprimé vaginal
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Clotrimazole..................................................................................................................... 500,00 mg
Pour un comprimé vaginal.
Pour la liste complète des excipients, voir rubrique 6.1.
Comprimé vaginal.
4.1. Indications thérapeutiques
Traitement local des mycoses vaginales à levures sensibles, notamment à Candida.
En cas d’atteinte vulvaire associée, il est recommandé de compléter le traitement vaginal par l’application d’une crème au clotrimazole à 1% sur les lésions.
Ce médicament est réservé à l’adulte.
4.2. Posologie et mode d'administration
Posologie
Un comprimé vaginal le soir au coucher, en administration unique, introduit profondément dans le vagin, de préférence en position allongée.
Si les symptômes persistent au-delà de 3 jours, un deuxième comprimé vaginal peut être administré.
Si les symptômes persistent au-delà de 7 jours, un avis médical doit être sollicité.
Mode d’administration
Utilisation sans applicateur :
Après un lavage complet des mains, introduire profondément le comprimé dans le vagin, de préférence le soir au coucher et en position allongée. La façon la plus facile de procéder est de vous allonger sur le dos, les genoux repliés et écartés.
Utilisation avec applicateur :
Utilisez l’applicateur pour introduire le comprimé aussi haut que possible dans le vagin de préférence le soir au coucher. La façon la plus facile de procéder est de vous allonger sur le dos, les genoux repliés et écartés.
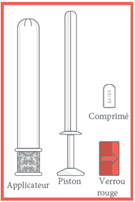
1. Sortez l’applicateur de son emballage. Retirez le piston et le verrou rouge de l’applicateur.
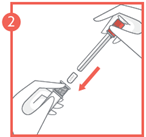
2 - Placez le comprimé vaginal, bord arrondi vers le bas, dans l'extrémité ouverte de l’applicateur. Poussez le piston, sur lequel est placé le verrou, dans l’applicateur, jusqu'à ce que vous sentiez un clic.
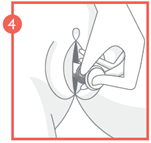
3 - Une fois que vous avez senti le clic, retirez le verrou du piston, puis insérez délicatement l'applicateur dans le vagin jusqu'à la zone de préhension à motifs.
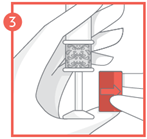
4 - Tenez le corps de l'applicateur au niveau de la zone de préhension à motifs et poussez doucement le piston jusqu'au bout jusqu'à ce qu'il s'arrête pour insérer le comprimé vaginal.
5 - Après utilisation, démontez toutes les parties de l’applicateur pour le nettoyage et lavez-les soigneusement à l'eau savonneuse tiède (non bouillante), rincez pendant 30 secondes et essuyez soigneusement chaque partie. Conservez-les dans un endroit propre et sûr.
Après l'utilisation finale, jetez l'applicateur dans un endroit sûr, hors de la portée des enfants.
L’applicateur ne doit pas être jeté dans les toilettes.
Afin de bien se dissoudre au niveau vaginal, le comprimé Mycohydralin nécessite un minimum d’hydratation au niveau local. En cas de sécheresse vaginale, il est possible que le comprimé ne se désagrège pas convenablement. Le comprimé doit être introduit profondément au niveau vaginal, en position couchée.
Hypersensibilité à la substance active ou à l’un des excipients mentionnés à la rubrique 6.1.
4.4. Mises en garde spéciales et précautions d'emploi
NE PAS AVALER, LE COMPRIME DOIT ETRE PLACE AU FOND DU VAGIN.
Mises en gardes spéciales
Un avis médical est nécessaire si l’épisode de mycose s’accompagne d’un des symptômes suivants :
· Fièvre, nausée, vomissement
· Douleurs abdominales basses
· Douleurs au dos ou aux épaules
· Sécrétions vaginales accompagnées de mauvaises odeurs
· Hémorragie vaginale
Précautions d’emploi
En cas de candidose, il est déconseillé d’utiliser un savon à pH acide (pH favorisant la multiplication du Candida).
Les douches vaginales doivent être évitées.
L’utilisation de tampons internes, de spermicides, de préservatifs ou de diaphragmes doit être évitée pendant le traitement avec Mycohydralin (risque de rupture du préservatif ou du diaphragme)
Il est recommandé d’éviter les rapports sexuels en cas de mycose vulvo-vaginale afin de réduire le risque d’infection du partenaire.
Afin d’éviter une recontamination, le traitement du partenaire sexuel pourrait être envisagé.
L’utilisation de l’applicateur est déconseillée pendant la grossesse.
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
L’utilisation concomitante de clotrimazole et de Tacrolimus ou de Sirolimus peut engendrer une augmentation du niveau plasmatique. Les patients concernés doivent être étroitement surveillés afin de prévenir le risque de surdosage en Tacrolimus ou en Sirolimus. Si nécessaire, la détermination des niveaux plasmatiques respectifs peut être conduite.
4.6. Fertilité, grossesse et allaitement
Grossesse
Des études épidémiologiques portant sur l’utilisation du clotrimazole par voie vaginale chez la femme enceinte ne mettent pas en évidence un risque tératogène ou foetotoxique Les études effectuées chez l’animal n’ont pas mis en évidence une toxicité sur la reproduction (voir rubrique 5.3).
La prescription de MYCOHYDRALIN peut être envisagée pendant la grossesse si nécessaire.L’utilisation de l’applicateur est déconseillée pendant la grossesse.
Allaitement
Les données pharmacodynamiques et toxicologiques chez l’animal ont montré une excrétion du clotrimazole et de ses métabolites dans le lait. Il n'y a pas de données sur l'excrétion du clotrimazole dans le lait maternel. Aucun effet sur chez les nouveau-nés/nourrissons allaités n’est attendu dans la mesure où l’exposition systémique de la femme qui allaite au clotrimazole administré par voie vaginale est négligeable.
Le clotrimazole peut être utilisé pendant l'allaitement.
Fertilité
Aucune étude humaine des effets du clotrimazole sur la fertilité n'a été réalisée, cependant, les études animales n'ont démontré aucun effet de ce médicament sur la fertilité.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
Sans objet.
Du fait du faible taux de résorption du clotrimazole sur une peau saine, on peut pratiquement exclure le risque d'apparition d'effets systémiques.
Cependant, sur une peau où la barrière cutanée est lésée, une résorption plus importante peut exister. Il faut être attentif à cette éventualité et à la possibilité de survenue d’effets systémiques.
Les notifications spontanées recueillies depuis la mise sur le marché du clotrimazole ont permis d’identifier les effets indésirables suivants. Leur fréquence est indéterminée (ne peut être définie sur la base des données disponibles :
Affections du système immunitaire :
· Réactions d’hypersensibilité incluant réaction anaphylactique et angioedemes,
Affections de la peau et du tissu sous-cutané :
· Urticaire, rash
Troubles généraux et anomalie au site d’administration :
· Irritations au site d’application, œdème, douleur au site d’application
Affections vasculaires :
· Syncope, hypotension.
Affections respiratoires, thoraciques et médiastinales :
· Dyspnée.
Affections des organes de reproduction et du sein :
· Pertes vaginales, hémorragie vaginale, douleurs vulvo-vaginales, inconfort vulvo-vaginal, prurit vulvo-vaginal, érythème vulvo-vaginal, sensations de brûlures vulvo-vaginales.
Affections gastro-intestinales :
· Douleurs abdominales, nausées.
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : www.signalement-sante.gouv.fr.
Aucun cas de surdosage n’a été rapporté à ce jour.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Classe pharmacothérapeutique : DERIVES IMIDAZOLE, code ATC : G01AF02.
G : SYSTEME GENITO URINAIRE ET HORMONES SEXUELLES
Les azolés (par exemple le clotrimazole) sont généralement recommandés pour le traitement local de la candidose vulvo-vaginale caractérisée par des symptômes vulvo-vaginaux tels que démangeaisons, brûlures, écoulement, rougeur, gonflement et douleur.
Le clotrimazole est un dérivé imidazolé synthétique ayant un effet antifongique à large spectre. Il est actif sur les dermatophytes, les moisissures, les levures, etc.
En fonction de sa concentration au site d’infection, le clotrimazole peut avoir un effet fongistatique ou fongicide. Il agit en inhibant la synthèse de l’ergostérol provoquant des dysfonctionnements structurels et fonctionnels de la membrane cytoplasmique. In vitro l’activité est limitée aux éléments favorisant la prolifération fongique ; les spores sont légèrement sensibles.
In vitro, le clotrimazole inhibe la multiplication des corynébactéries et des cocci à gram positif (à l’exception des entérocoques) et ce à des concentrations allant de 0.5 à 10µg de clotrimazole par millilitre de substrat.
En plus de son action antimycotique, le clotrimazole agit aussi sur les microorganismes à gram positif (Streptocoques, staphylocoques, Gardnerella vaginalis), et sur bactéries à gram négatif (Bactéroides).
Il est très rare d’observer des souches résistantes appartenant à des espèces de champignons sensibles, le développement des résistances secondaires lors d’utilisation thérapeutique n’a été observé que dans des cas isolés.
5.2. Propriétés pharmacocinétiques
Absorption
La résorption du clotrimazole par la muqueuse vaginale est très faible. Elle est de l’ordre de 3 à 10 %.
5.3. Données de sécurité préclinique
L’étude des données précliniques (toxicité à dose répétée, génotoxicité, carcinogénicité, reprotoxicité) ne révèlent aucun risque particulier chez l’Homme.
Les études effectuées chez l’animal ont démontré l’absence d’effet du médicament sur la fertilité. Cependant, chez l’humain, aucune étude des effets du clotrimazole sur la fertilité n’a été conduite.
Lactose, amidon de maïs, acide lactique, stéarate de magnésium, silice colloïdale anhydre, crospovidone, hypromellose, cellulose microcristalline, lactate de calcium.
Sans objet.
4 ans.
6.4. Précautions particulières de conservation
A conserver à une température ne dépassant pas 25°C.
6.5. Nature et contenu de l'emballage extérieur
Boîte de 1 comprimé vaginal sous plaquette (PA/aluminium/PVC) avec applicateur.
6.6. Précautions particulières d’élimination et de manipulation
Pas d’exigences particulières pour l’élimination
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
BAYER HEALTHCARE SAS
1 rue Claude Bernard
59000 Lille
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· 34009 279 658 1 4 : 1 comprimé sous plaquette (PA/aluminium/PVC) avec applicateur
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
[à compléter ultérieurement par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE
[à compléter ultérieurement par le titulaire]
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Sans objet.
Médicament non soumis à prescription médicale.
ANSM - Mis à jour le : 30/05/2024
MYCOHYDRALIN 500 mg, comprimé vaginal
Clotrimazole
Veuillez lire attentivement cette notice avant d’utiliser ce médicament car elle contient des informations importantes pour vous.
Vous devez toujours utiliser ce médicament en suivant scrupuleusement les informations fournies dans cette notice ou par votre médecin ou votre pharmacien.
· Gardez cette notice. Vous pourriez avoir besoin de la relire.
· Adressez-vous à votre pharmacien pour tout conseil ou information.
· Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
· Vous devez vous adresser à votre médecin si vous ne ressentez aucune amélioration ou si vous vous sentez moins bien après 7 jours
1. Qu'est-ce que MYCOHYDRALIN 500 mg, comprimé vaginal et dans quels cas est-il utilisé ?
2. Quelles sont les informations à connaître avant d'utiliser MYCOHYDRALIN 500 mg, comprimé vaginal ?
3. Comment utiliser MYCOHYDRALIN 500 mg, comprimé vaginal ?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver MYCOHYDRALIN 500 mg, comprimé vaginal ?
6. Contenu de l’emballage et autres informations.
1. QU’EST-CE QUE MYCOHYDRALIN 500 mg, comprimé vaginal ET DANS QUELS CAS EST-IL UTILISE ?
Classe pharmacothérapeutique - code ATC : dérivés imidazolés - G01AF02
ANTIFONGIQUE LOCAL (G : Système génito-urinaire et hormones sexuelles).
Ce médicament est indiqué dans le traitement des mycoses vaginales à levures sensibles (affections dues à des champignons microscopiques).
En cas d’atteinte vulvaire associée, il est recommandé de compléter le traitement vaginal par l’application d’une crème au clotrimazole à 1% sur les lésions.
Ce médicament est réservé à l’adulte.
Vous devez vous adresser à votre médecin si vous ne ressentez aucune amélioration ou si vous vous sentez moins bien après 7 jours.
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT D’UTILISER MYCOHYDRALIN 500 mg, comprimé vaginal ?
N’utilisez jamais MYCOHYDRALIN 500 mg, comprimé vaginal :
· si vous êtes allergique à la substance active ou à l’un des autres composants contenus dans ce médicament, mentionnés dans la rubrique 6.
Ce médicament NE DOIT PAS ETRE UTILISE avec un préservatif masculin ou un diaphragme en latex.
Avertissements et précautions
Adressez-vous à votre médecin ou pharmacien avant d’utiliser MYCOHYDRALIN 500 mg, comprimé vaginal.
NE PAS AVALER, LE COMPRIME DOIT ETRE PLACE AU FOND DU VAGIN.
Si vous présentez l’un des symptômes suivants avant ou au cours de l’utilisation de MYCOHYDRALIN 500 mg, comprimé vaginal, veuillez demander conseil à votre médecin :
· Fièvre, nausée, vomissement
· Douleurs abdominales basses
· Douleurs au dos ou aux épaules
· Sécrétions vaginales accompagnées de mauvaises odeurs
· Hémorragie vaginale
En cas de candidose, il est déconseillé d’utiliser un savon à pH acide (pH favorisant la multiplication du Candida).
Les douches vaginales doivent être évitées.
L’utilisation de tampons internes, de spermicides, de préservatifs ou de diaphragmes doit être évitée pendant le traitement avec MYCOHYDRALIN 500 mg, comprimé vaginal (risque de rupture du préservatif ou du diaphragme).
Il est recommandé d’éviter les rapports sexuels en cas de mycose vulvo-vaginale afin de réduire le risque d’infection du partenaire.
Votre médecin pourra traiter également votre partenaire sexuel afin d’éviter qu’il ne vous recontamine.
Le traitement peut entraîner des sensations de brûlures locales et une augmentation des démangeaisons. Généralement, ces phénomènes cèdent spontanément à la poursuite du traitement. Si les symptômes persistent au-delà de 24 à 48 heures, consultez votre médecin.
En cas d’utilisation pendant la grossesse, les comprimés vaginaux doivent être insérés sans applicateur (voir section Grossesse et allaitement).
Enfants
Sans objet.
Autres médicaments et MYCOHYDRALIN 500 mg, comprimé vaginal
Ne pas utiliser avec des produits spermicides (risque d’inactivation), ni avec un préservatif ou un diaphragme en latex (risque de rupture du préservatif ou du diaphragme).
Le clotrimazole est susceptible d’interagir avec le métabolisme du Tacrolimus et du Sirolimus. Afin de prévenir tout risque de surdosage en Tacrolimus ou en Sirolimus, informez votre médecin ou votre pharmacien avant d’utiliser Mycohydralin.
Informez votre médecin ou pharmacien si vous utilisez, avez récemment utilisé ou pourriez utiliser tout autre médicament.
MYCOHYDRALIN 500 mg, comprimé vaginal avec des aliments, boissons et de l’alcool
Sans objet.
Grossesse et allaitement
Si vous êtes enceinte ou que vous allaitez, si vous pensez être enceinte ou planifiez une grossesse, demandez conseil à votre médecin ou pharmacien avant de prendre ce médicament.
L’utilisation de MYCOHYDRALIN 500 mg, comprimé vaginal est possible pendant la grossesse si votre médecin vous l’a prescrit.
En cas d’utilisation pendant la grossesse, les comprimés vaginaux doivent être insérés sans applicateur.
L’utilisation de MYCOHYDRALIN 500 mg, comprimé vaginal est possible pendant l'allaitement.
Demandez conseil à votre médecin ou à votre pharmacien avant de prendre tout médicament.
Conduite de véhicules et utilisation de machines
Sans objet.
3. COMMENT UTILISER MYCOHYDRALIN 500 mg, comprimé vaginal ?
Ce médicament est réservé à l’adulte
Veillez à toujours utiliser ce médicament en suivant exactement les instructions de cette notice ou les indications de votre médecin ou pharmacien. Vérifiez auprès de votre médecin ou pharmacien en cas de doute.
Posologie
Voie vaginale, NE PAS AVALER.
Administration unique d’un comprimé le soir à placer au fond du vagin.
Si les symptômes persistent au-delà de 3 jours, un deuxième comprimé vaginal peut être administré.
Si les symptômes persistent au-delà de 7 jours, consultez votre médecin.
Veillez à toujours utiliser ce médicament en suivant exactement les indications de votre médecin ou pharmacien. Vérifiez auprès de votre médecin ou pharmacien en cas de doute.
Mode d’administration
Utilisation sans applicateur :
Après un lavage complet des mains, introduire profondément le comprimé dans le vagin, de préférence le soir au coucher et en position allongée. La façon la plus facile de procéder est de vous allonger sur le dos, les genoux repliés et écartés.
Utilisation avec applicateur :
Utilisez l’applicateur pour introduire le comprimé aussi haut que possible dans le vagin de préférence le soir au coucher.
La façon la plus facile de procéder est de vous allonger sur le dos, les genoux repliés et écartés.
|
1-Sortez l’applicateur de son emballage. Retirez le piston et le verrou rouge de l’applicateur.
|
|
|||
|
2- Placez le comprimé vaginal, bord arrondi vers le bas, dans l'extrémité ouverte de l’applicateur. Poussez le piston, sur lequel est placé le verrou, dans l’applicateur, jusqu'à ce que vous sentiez un clic.
3- Une fois que vous avez senti le clic, retirez le verrou du piston, puis insérez délicatement l'applicateur dans le vagin jusqu'à la zone de préhension à motifs
|
|
|||
|
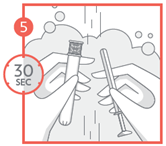
5- Après utilisation, démontez toutes les parties de l’applicateur pour le nettoyage et lavez-les soigneusement à l'eau savonneuse tiède (non bouillante), rincez pendant 30 secondes et essuyez soigneusement chaque partie. Conservez-les dans un endroit propre et sûr.
Après l'utilisation finale, jetez l'applicateur dans un endroit sûr, hors de la portée des enfants. |
Si vous avez utilisé plus de MYCOHYDRALIN 500 mg, comprimé vaginal que vous n’auriez dû
Aucun cas de surdosage n’a été rapporté à ce jour.
Si vous oubliez d’utiliser MYCOHYDRALIN 500 mg, comprimé vaginal
Sans objet.
Si vous arrêtez d’utiliser MYCOHYDRALIN 500 mg, comprimé vaginal
Sans objet.
Si vous avez d’autres questions sur l’utilisation de ce médicament, demandez plus d’informations à votre médecin, à votre pharmacien.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
Comme tous les médicaments, ce médicament peut provoquer des effets indésirables, mais ils ne surviennent pas systématiquement chez tout le monde.
Les effets indésirables suivants ont été rapportés, après la commercialisation de MYCOHYDRALIN, leur fréquence ne peut être définie sur la base des données disponibles :
· réactions allergiques : choc anaphylactique, œdème de Quincke,
· réactions cutanées: démangeaison, rougeur, éruption cutanée,
· au site d’application : irritations, gonflement ou rougeur, douleur
· baisse de la tension artérielle, perte de connaissance,
· sensation d’étouffement,
· pertes vaginales, saignement vaginal
· Au niveau de la vulve et du vagin : douleur , sensation d’inconfort, démangeaison, rougeur, sensation de brûlures,
· Douleurs abdominales, nausées
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet: www.signalement-sante.gouv.fr
En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.
5. COMMENT CONSERVER MYCOHYDRALIN 500 mg, comprimé vaginal ?
Tenir ce médicament hors de la vue et de la portée des enfants.
N’utilisez pas ce médicament après la date de péremption indiquée sur la boite après EXP. La date de péremption fait référence au dernier jour de ce mois.
A conserver à une température ne dépassant pas 25°C.
Ne jetez aucun médicament au tout-à-l’égout ou avec les ordures ménagères. Demandez à votre pharmacien d’éliminer les médicaments que vous n’utilisez plus. Ces mesures contribueront à protéger l’environnement.
6. CONTENU DE L’EMBALLAGE ET AUTRES INFORMATIONS
Ce que contient MYCOHYDRALIN 500 mg, comprimé vaginal
· La substance active est :
Clotrimazole.................................................................................................................. 500 mg
Pour un comprimé vaginal.
· Les autres composants sont : Lactose, amidon de maïs, acide lactique, stéarate de magnésium, silice colloïdale anhydre, crospovidone, hypromellose, cellulose microcristalline, lactate de calcium.
Qu’est-ce que MYCOHYDRALIN 500 mg, comprimé vaginal et contenu de l’emballage extérieur
Ce médicament se présente sous forme de comprimé vaginal. Boîte de 1 comprimé avec applicateur.
Titulaire de l’autorisation de mise sur le marché
BAYER HEALTHCARE SAS
1 RUE CLAUDE BERNARD
59000 LILLE
Exploitant de l’autorisation de mise sur le marché
BAYER HEALTHCARE SAS
33, RUE DE L’INDUSTRIE
74240 GAILLARD
FRANCE
GP GRENZACH PRODUKTIONS GMBH
EMIL-BARELL-STRASSE 7
79639 GRENZACH-WYHLEN
ALLEMAGNE
Noms du médicament dans les Etats membres de l'Espace Economique Européen
Sans objet.
La dernière date à laquelle cette notice a été révisée est :
[à compléter ultérieurement par le titulaire]
Des informations détaillées sur ce médicament sont disponibles sur le site Internet de l’ANSM (France).
CONSEIL D’EDUCATION SANITAIRE
a/ Qu'appelle-t-on une mycose vulvo-vaginale ?
Les mycoses vulvo-vaginales sont des infections fréquentes des muqueuses au niveau des parties intimes de la femme (vulve et vagin) causées le plus souvent par un champignon nommé Candida albicans. Ce champignon est naturellement présent dans l’organisme mais certains facteurs peuvent provoquer une prolifération anormale du champignon et entrainer une infection. Ce déséquilibre de la flore vaginale se traduit par une mycose vaginale pouvant être associée à une mycose de la vulve.
Les facteurs qui peuvent favoriser l’apparition d’une mycose vulvo-vaginale sont nombreux :
· La prise de certains médicaments : antibiotiques, corticoïdes etc.
· Diabète
· Facteurs hormonaux : contraception hormonale, ménopause, grossesse
· Hygiène mal adaptée
b/ Comment reconnaître une mycose vulvo-vaginale ?
Les principaux symptômes des mycoses vaginales sont les suivants :
· Démangeaisons
· Sensation de brûlure des parties intimes
· Pertes de couleur blanche
· Douleur pendant ou après les relations sexuelles
c/ Conseils en cas de mycoses vulvo-vaginales :
· Toilette intime avec un savon basique. Eviter les savons acides dont le pH favorise la multiplication de Candida albicans.
· L’utilisation de tampons internes, de spermicides, de préservatifs ou de diaphragmes doit être évitée pendant le traitement avec MYCOHYDRALIN 500 mg, comprimé vaginal (risque de rupture du préservatif ou du diaphragme).
· Il est recommandé d’éviter les rapports sexuels en cas de mycose vulvo-vaginale afin de réduire le risque d’infection du partenaire.
d/ Conseils pour éviter les mycoses vulvo-vaginales :
· Eviter les savons trop détergents, l’hygiène excessive, les douches vaginales et les sprays intimes.
Afin d’éviter une recontamination, le traitement du partenaire sexuel doit être envisagé.