Dernière mise à jour le 02/03/2026
SOMATULINE L.P. 30 mg, poudre et solvant pour suspension injectable (IM) à libération prolongée
Ce médicament n'est ou ne sera bientôt plus disponible sur le marché.
Si vous prenez actuellement ce médicament, il vous est recommandé d'en parler avec votre médecin
ou avec votre pharmacien qui pourra vous orienter vers un autre traitement.
Indications thérapeutiques
Classe pharmacothérapeutique : antihormones de croissance, Code ATC : H01CB03.
SOMATULINE L.P. 30 mg, poudre et solvant pour suspension injectable (I.M.) à libération prolongée est utilisé :
· Dans le traitement de l’acromégalie lorsque la sécrétion de l’hormone de croissance n’est pas normalisée après d’autres traitements ou lorsque ceux-ci ne peuvent pas être utilisés.
· Dans le traitement des symptômes provoqués par certaines maladies digestives appelées tumeurs carcinoïdes.
· Dans le traitement des adénomes thyréotropes primitifs (tumeur de l’hypophyse provoquant une hyperthyroïdie).
Service médical rendu (SMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprès de la HAS (plus d'informations dans l'aide). Les avis et synthèses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur du SMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| Important | Avis du 16/12/2015 | Renouvellement d'inscription (CT) | Le service médical rendu par SOMATULINE LP 30 mg, 60 mg 90 mg et 120 mg reste important dans : • le traitement de l'acromégalie lorsque les taux circulants d'hormone de croissance (GH) et d'IGF-1 ne sont pas normalisés après chirurgie et/ou radiothérapie ou lorsque la chirurgie et/ou la radiothérapie ne peuvent pas être envisagés, • le traitement des symptômes cliniques des tumeurs carcinoïdes. Le service médical rendu par SOMATULINE LP 60 mg 90 mg et 120 mg reste important dans le traitement des symptômes cliniques au cours de l’acromégalie. Le service médical rendu par SOMATULINE LP 30 mg reste important dans le traitement des adénomes thyréotropes primitifs responsables d’une hyperthyroïdie : en préparation ou en complément de la chirurgie et/ou de la radiothérapie, ou lorsque ces thérapeutiques ne sont pas appropriées. |
Amélioration du service médical rendu (ASMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprés de la HAS (plus d'informations dans l'aide). Les avis et synthéses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur de l'ASMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| V (Inexistant) | Avis du 02/07/2003 | Extension d'indication | La spécialité SOMATULINE LP 30 mg, poudre et solvant pour suspension injectable (IM) à libération prolongée n'apporte aucune amélioration du service médical rendu dans l'indication sollicitée par rapport à SANDOSTATINE LP 10 mg, 20 mg, 30 mg. |
ANSM - Mis à jour le : 24/10/2019
SOMATULINE L.P. 30 mg, poudre et solvant pour suspension injectable (IM) à libération prolongée
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Acétate de lanréotide correspondant à lanréotide.................................................................... 0,03 g*
Pour un flacon
* Compte tenu des caractéristiques de la forme pharmaceutique chaque flacon contient une quantité d'acétate de lanréotide correspondant à 0,04 g de lanréotide.
Chaque flacon contient 2,64 mg de sodium.
Pour la liste complète des excipients, voir rubrique 6.1.
Poudre et solvant pour suspension injectable (IM) à libération prolongée.
Poudre : lyophilisat blanchâtre avec présence de bulles à la surface. La poudre est constituée de microsphères lyophilisées.
4.1. Indications thérapeutiques
Lorsque les taux circulants d'hormone de croissance (GH) et d’IGF-1 ne sont pas normalisés après chirurgie et/ou radiothérapie ou lorsque la chirurgie et/ou la radiothérapie ne peuvent pas être envisagés.
Traitement des symptômes cliniques des tumeurs carcinoïdes.
Traitement des adénomes thyréotropes primitifs responsables d’une hyperthyroïdie
En préparation ou en complément de la chirurgie et/ou de la radiothérapie, ou lorsque ces thérapeutiques ne sont pas appropriées.
4.2. Posologie et mode d'administration
Le traitement doit être adapté pour chaque patient, en milieu spécialisé.
Posologie
Compte tenu du caractère variable de la sensibilité des tumeurs aux analogues de la somatostatine, il est recommandé de commencer le traitement par une injection test pour évaluer la qualité de la réponse (sécrétion de GH, symptômes en rapport avec la tumeur carcinoïde, sécrétions tumorales...). Une non réponse à cette première injection doit remettre en cause l'intérêt du traitement.
Dans l'acromégalie
Le rythme d'administration de la forme à libération prolongée peut être fixé initialement à 1 injection intramusculaire tous les 14 jours. En cas de réponse insuffisante, jugée sur les taux d'hormone de croissance et d'IGF-1 (mesurés avant l'injection suivante), ce rythme peut être porté à 1 injection tous les 10 jours.
Dans les tumeurs carcinoïdes
Le rythme d'administration de la forme à libération prolongée peut être fixé initialement à 1 injection intramusculaire tous les 14 jours. En cas de réponse insuffisante, jugée sur les symptômes cliniques (flushes, selles diarrhéiques), ce rythme peut être porté à 1 injection tous les 10 jours.
Dans les adénomes thyréotropes primitifs responsables d’une hyperthyroïdie
Le rythme d'administration de la forme à libération prolongée peut être fixé initialement à 1 injection intramusculaire tous les 14 jours. En cas de réponse insuffisante, jugée sur les taux d’hormones thyroïdiennes et la TSH, ce rythme peut être porté à 1 injection tous les 10 jours.
Insuffisance rénale et/ou hépatique
Chez les patients présentant une insuffisance rénale ou hépatique, il n’est pas nécessaire d’ajuster la posologie (voir section 5.2).
Sujets âgés
Chez le sujet âgé, aucun ajustement posologique n’est nécessaire (voir section 5.2).
Pédiatrie
En l’absence de données de sécurité et d’efficacité, l’utilisation de SOMATULINE L.P. 30 mg n’est pas recommandée chez l’enfant et l’adolescent
Mode d’administration
SOMATULINE L.P. 30 mg doit être administré par voie intramusculaire, dans le quadrant supero-externe de la fesse.
Les injections intramusculaires seront réalisées alternativement du côté droit et du côté gauche.
Pour les instructions concernant la reconstitution du produit avant administration, son utilisation, sa manipulation et son élimination, voir section 6.6.
4.4. Mises en garde spéciales et précautions d'emploi
· Des études de pharmacologie animale et humaine ont montré que le lanréotide, comme la somatostatine et ses autres analogues, inhibe la sécrétion d’insuline et de glucagon. Ainsi, une hypoglycémie ou une hyperglycémie peuvent survenir chez les patients traités par lanréotide. La glycémie doit être surveillée lors de l’initiation du traitement par lanréotide et lors de toute modification de posologie. Le traitement antidiabétique sera adapté en conséquence. Chez le diabétique insulino-traité, les doses d'insuline seront a priori réduites de 25%, puis adaptées aux glycémies, qui devront être contrôlées attentivement chez ces patients dès l'instauration du traitement.
· Chez le patient acromégale traité par lanréotide, on a pu observer une légère diminution de la fonction thyroïdienne s’accompagnant rarement d’hypothyroïdie clinique. Un examen de la fonction thyroïdienne est recommandé selon la pertinence clinique.
· Chez l’acromégale et chez les patients présentant un adénome thyréotrope primitif, l’utilisation du lanréotide ne dispense pas de la surveillance du volume tumoral hypophysaire.
· Chez le patient sans pathologie cardiaque sous-jacente, le lanréotide peut entraîner une diminution du rythme cardiaque, sans atteindre nécessairement le seuil de bradycardie. En cas de problèmes cardiaques préexistants, une bradycardie sinusale peut survenir. Chez les patients souffrant de bradycardie, il convient d’être prudent lors de l’initiation du traitement par lanréotide (voir section 4.5).
· L'apparition d'une élévation franche et durable de la stéatorrhée justifie la prescription complémentaire d'extraits pancréatiques.
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
Associations faisant l'objet de précautions d’emploi
+ Ciclosporine (voie orale)
Baisse des concentrations sanguines de ciclosporine (diminution de son absorption intestinale). Augmentation des doses de ciclosporine sous contrôle des concentrations plasmatiques et réduction de la posologie après l’arrêt du traitement.
+ Insuline, glitazones, répaglinide et sulfamides hypoglycémiants
Risque d’hypoglycémie ou d’hyperglycémie : diminution des besoins en traitement antidiabétique par diminution ou augmentation de la sécrétion de glucagon endogène.
Renforcer l’autosurveillance glycémique et adapter si besoin la posologie du traitement antidiabétique pendant le traitement par lanréotide.
· L’administration concomitante de médicaments induisant une bradycardie (ex : bétabloquants) peut avoir un effet additif sur la légère diminution du rythme cardiaque associée au lanréotide. Un ajustement posologique de ces médicaments peut être nécessaire (voir rubrique 4.4).
· Selon des données limitées de la littérature, les analogues de la somatostatine peuvent diminuer la clairance métabolique des produits métabolisés par le système enzymatique cytochrome P450, ce qui pourrait être lié à la suppression de l’hormone de croissance. Cet effet ne pouvant être exclu avec le lanréotide, les médicaments métabolisés principalement par le CYP3A4 et possédant un faible index thérapeutique (ex : quinidine,) doivent être utilisés avec prudence.
Autres informations
Les interactions avec les médicaments fortement liés aux protéines plasmatiques sont peu probables compte tenu de la liaison modeste du lanréotide aux protéines plasmatiques
4.6. Fertilité, grossesse et allaitement
Grossesse
Les études effectuées chez l’animal n’ont pas mis en évidence d’effet tératogène lié au lanréotide au cours de l’organogénèse.
Il existe un nombre très limité de grossesses exposées au lanréotide. En conséquence, le lanréotide ne doit être utilisé au cours de la grossesse qu’en cas de stricte nécessité.
Il n’y a pas de données disponibles sur l’excrétion du lanréotide dans le lait maternel.
Comme de nombreux médicaments sont excrétés dans le lait maternel, la prudence s’impose en cas d’administration du lanréotide au cours de l’allaitement.
Fertilité
Une diminution de la fertilité a été observée chez la rate en raison de l’inhibition de la sécrétion de GH, à des doses supérieures à celles utilisées chez l’homme en thérapeutique.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
Les effets indésirables rapportés au cours des études cliniques lors du traitement de l’acromégalie et des tumeurs neuroendocrines gastro-entéro-pancréatiques par le lanréotide sont listés par classe-organe selon les fréquences suivantes : très fréquent (≥1/10) ; fréquent (≥1/100 à <1/10) ; peu fréquent (≥1/1000 à <1/100).
Les effets indésirables les plus fréquents lors du traitement par lanréotide sont les troubles gastro-intestinaux (le plus souvent diarrhée et douleurs abdominales, habituellement légères à modérées et transitoires), la lithiase biliaire (souvent asymptomatique) et les réactions au site d’injection (douleur, nodule et induration).
Le profil de tolérance observé dans toutes les indications est similaire.
|
Système Classe Organe |
Très fréquent (≥ 1/10) |
Fréquent (≥ 1/100 à < 1/10) |
Peu fréquent (≥ 1/1000 à < 1/100) |
Expérience post-commercialisation (fréquence inconnue) |
|
Infections et infestations |
|
|
|
Abcès au site d’injection |
|
Troubles du métabolisme et de la nutrition |
|
Hypoglycémie, appétit diminué**, hyperglycémie, diabète |
|
|
|
Affections psychiatriques |
|
|
Insomnie* |
|
|
Affections du système nerveux |
|
sensations vertigineuses, céphalées, léthargie** |
|
|
|
Affections cardiaques : |
|
bradycardie sinusale* |
|
|
|
Affections vasculaires |
|
|
bouffées de chaleur* |
|
|
Affections gastro-intestinales |
diarrhée, selles molles*, douleurs abdominales |
nausées, vomissements, constipation, flatulence, distension abdominale, inconfort abdominal, dyspepsie, stéatorrhée** |
décoloration des selles* |
pancréatite |
|
Affections hépatobiliaires |
lithiase biliaire |
dilatation biliaire* |
|
cholécystite cholangite |
|
Affections musculo-squelettiques et du tissu conjonctif |
|
douleurs musculo-squelettiques**, myalgie** |
|
|
|
Affections de la peau et du tissu sous-cutané |
|
alopécie, hypotrichose* |
|
|
|
Troubles généraux et anomalies au site d’administration |
|
asthénie, fatigue, réactions au point d’injection (douleur, induration, nodule, prurit) |
|
|
|
Investigations |
|
élévation des ALAT*, anomalies des ASAT et des ALAT*, élévation de la bilirubinémie*, élévation de la glycémie*, élévation de l’hémoglobine glycosylée*, perte de poids, enzymes pancréatiques diminuées** |
élévation des ASAT*, élévation des phosphatases alcalines*, anomalies de la bilirubinémie*, diminution de la natrémie* |
|
|
Affections du système immunitaire |
|
|
|
réactions allergiques (incluant angio-œdème, anaphylaxie, hypersensibilité) |
* sur la base d’un ensemble d’études effectuées dans l’acromégalie
** sur la base d’un ensemble d’études effectuées dans les tumeurs neuroendocrines gastro-entéro-pancréatiques
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : www.signalement-sante.gouv.fr.
En cas de surdosage, un traitement symptomatique est recommandé.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Classe pharmacothérapeutique : antihormones de croissance, Code ATC : H01CB03
Le lanréotide est un octapeptide, analogue de la somatostatine naturelle. Comme la somatostatine, le lanréotide est un inhibiteur de différentes fonctions endocrines, neuroendocrines, exocrines et paracrines. Il présente une forte affinité pour les récepteurs à la somatostatine humaine (SSTR) 2 et 5 et une affinité faible pour les SSTR 1, 3 et 4. L’inhibition de l’hormone de croissance s’expliquerait principalement par cette activité au niveau des récepteurs SSTR 2 et 5.
Sa sélectivité marquée vis-à-vis de la sécrétion de l'hormone de croissance par rapport à celle de l'insuline en fait un produit adapté au traitement de l'acromégalie.
En inhibant la synthèse de l’hormone thyréotrope (TSH), le lanréotide permet également de normaliser la fonction thyroïdienne chez des patients porteurs d’adénomes thyréotropes sécrétants.
L'action inhibitrice du lanréotide sur la sécrétion exocrine intestinale, les hormones digestives et les mécanismes de prolifération cellulaire est particulièrement intéressante pour son application au traitement symptomatique des tumeurs endocrines digestives, notamment carcinoïdes.
Comme la somatostatine, le lanréotide a une action anti-sécrétoire exocrine générale. Il inhibe la sécrétion basale de motiline, de peptide inhibiteur gastrique et de polypeptide pancréatique, mais n’a pas d’action significative sur la sécrétion à jeun de sécrétine ou de gastrine. Le lanréotide inhibe l’augmentation du débit sanguin de l’artère mésentérique supérieure et de la veine porte en post-prandial. Le lanréotide diminue significativement la sécrétion hydro-électrolytique jéjunale (eau, sodium, potassium, chlorures) stimulée par la prostaglandine E1. Le lanréotide diminue les taux de prolactine chez les patients acromégales traités au long cours.
Le lanréotide est nettement plus actif que la somatostatine naturelle et présente une durée d'action beaucoup plus longue.
Une étude randomisée contre placebo a étudié les effets du lanréotide LP 30 mg administré en complément des traitements en cours (comprenant corticoïdes IV, inhibiteurs de la pompe à protons, antispasmodiques, antiémétiques et analgésiques), tous les 10 jours chez 80 patients présentant une occlusion intestinale haute d'origine maligne due à une carcinose péritonéale confirmée. Les patients étaient traités dans un contexte de soins palliatifs, présentaient au moins 2 épisodes de vomissement par jour ou étaient porteurs d’une sonde nasogastrique et étaient considérés inopérables à la suite d’un avis chirurgical récent. Les patients présentant une occlusion intestinale susceptible d’être d’origine non-maligne étaient exclus de l’étude.
L'objectif principal était d'évaluer la proportion de patients répondeurs 7 jours après injection unique de lanréotide LP 30 mg versus placebo. La réponse au traitement était définie par une fréquence des épisodes de vomissements ≤ 1 par jour pendant au moins 3 jours consécutifs ou une absence de récurrence des vomissements pendant au moins 3 jours consécutifs pour les sujets chez lesquels la sonde nasogastrique avait été retirée.
Dans la population en Intention de Traiter (ITT), le taux de répondeurs basé sur les fiches de suivi des patients évaluées au jour 7 a été plus élevé dans le groupe lanréotide que dans le groupe placebo mais la différence n’était pas statistiquement significative (41,9% [18/43] versus 29,7% [11/37], odds ratio = 1,75 [IC 95%: 0,68, 4,49, p = 0,24]).
Dans la population Per Protocole (PP), le taux de répondeurs basé sur les fiches de suivi des patients était significativement plus élevé dans le groupe lanréotide que dans le groupe placebo (respectivement 57,7% [15/26] et 30,4% [7/23], [OR = 3,60, IC 95% 1,03, 12,62, p = 0,045]).
5.2. Propriétés pharmacocinétiques
Au cours des études d’élimination, moins de 5 % du lanréotide était excrété par voie urinaire et moins de 0,5 % était retrouvé sous forme inchangée dans les fèces, indiquant une excrétion biliaire.
La cinétique plasmatique d’une dose unique de lanréotide à partir de SOMATULINE L.P. 30 mg, administré par voie intramusculaire chez le volontaire sain est caractérisée par une première phase de libération rapide, correspondant au relargage du peptide lié à la surface des microsphères, puis par une seconde phase de libération, suivie d'une décroissance très lente induite par la libération prolongée du principe actif capturé à l’intérieur des microparticules.
Après un premier pic sérique de 8,5 ± 4,7 ng/ml survenant 1 à 2 heures après administration, les taux sériques diminuent pendant 1 à 3 jours puis augmentent du jour 3 à 5 jusqu’au jour 14-21, marquant un pseudo-plateau, avec des taux sériques se situant majoritairement autour de 1 ng/ml au cours de cette période.
La libération prolongée se traduit par un temps de résidence moyen de 15,0 ± 1,6 jours et une demi-vie de 5,0 ± 2,3 jours.
Le profil pharmacocinétique observé chez le patient acromégale après administration d’une dose unique de SOMATULINE LP 30 mg est comparable à celui observé chez le volontaire sain.
Le profil pharmacocinétique a été également étudié après administrations répétées chez les patients acromégales. L’état d’équilibre est atteint après la 4ème administration consécutive, avec un pic de 10,9 ± 4,4 ng/ml observé environ 2 heures après administration, puis un pseudo-plateau suivi d’une cinétique de premier ordre. Les concentrations sériques minimum et moyenne à l’état d’équilibre sont respectivement de 2,2 ± 0,7 et 2,8 ± 0,8 ng/ml. Aucune accumulation significative n’est observée (Rac = 2,2).
Insuffisance hépatique/rénale :
En cas d’insuffisance rénale sévère, on observe une réduction de moitié environ de la clairance sérique totale du lanréotide, avec pour conséquence une augmentation de la demi-vie et l’ASC. En cas d’insuffisance hépatique modérée à sévère, on observe une diminution de la clairance de 30 %. Le volume de distribution et le temps de résidence moyen augmentent quel que soit le degré d’insuffisance hépatique.
Il n’est pas nécessaire de modifier la dose initiale en cas d’insuffisance hépatique ou rénale, dans la mesure où les concentrations sériques de lanréotide attendues chez ces patients restent dans la fourchette des concentrations bien tolérées chez le volontaire sain.
Sujets âgés :
Une augmentation de la demi-vie et du temps de résidence moyen est observée chez le sujet âgé comparativement aux sujets sains jeunes. Il n’est pas nécessaire de modifier la dose initiale chez le sujet âgé, dans la mesure où les concentrations sériques de lanréotide attendues chez ces patients restent dans la fourchette des concentrations bien tolérées chez le volontaire sain.
5.3. Données de sécurité préclinique
Au cours des tests standard in vitro et in vivo, le lanréotide n’a pas montré de potentiel génotoxique.
La résorption des microsphères est complète en 45 - 60 jours.
Solvant : mannitol ; eau pour préparations injectables.
Après ouverture : le produit doit être utilisé immédiatement.
6.4. Précautions particulières de conservation
A conserver à une température comprise entre + 2°C et + 8° C.
6.5. Nature et contenu de l'emballage extérieur
Poudre en flacon (verre) et 2 ml de solvant en ampoule (verre).
6.6. Précautions particulières d’élimination et de manipulation
La mise en suspension de la poudre dans le solvant spécifique doit être effectuée immédiatement avant l'injection, en agitant le flacon, doucement, 20 à 30 fois, jusqu'à l'obtention d'une suspension homogène ayant un aspect laiteux.
Celle-ci ne doit pas être mélangée à d'autres médicaments.
Tout médicament non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
65 QUAI GEORGES GORSE
92100 BOULOGNE BILLANCOURT
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· 34009 337 354 6 3 : poudre en flacon (verre), + 2 ml de solvant en ampoule (verre) boîte de 2 avec 2 seringues et 4 aiguilles ;
· 34009 337 355 2 4 : poudre en flacon (verre), + 2 ml de solvant en ampoule (verre) boîte de 6 avec 6 seringues et 12 aiguilles.
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
[à compléter ultérieurement par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE
[à compléter ultérieurement par le titulaire]
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Liste I.
Médicament soumis à prescription initiale hospitalière annuelle.
ANSM - Mis à jour le : 24/10/2019
SOMATULINE L.P. 30 mg, poudre et solvant pour suspension injectable (I.M.) à libération prolongée
Lanréotide
· Gardez cette notice. Vous pourriez avoir besoin de la relire.
· Si vous avez d’autres questions, interrogez votre médecin, votre pharmacien ou votre infirmier/ère.
· Ce médicament vous a été personnellement prescrit. Ne le donnez pas à d’autres personnes. Il pourrait leur être nocif, même si les signes de leur maladie sont identiques aux vôtres.
· Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin, votre pharmacien ou votre infirmier/ère. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
1. Qu'est-ce que SOMATULINE L.P. 30 mg, poudre et solvant pour suspension injectable (I.M.) à libération prolongée et dans quels cas est-il utilisé ?
2. Quelles sont les informations à connaître avant d'utiliser SOMATULINE L.P. 30 mg, poudre et solvant pour suspension injectable (I.M.) à libération prolongée ?
3. Comment utiliser SOMATULINE L.P. 30 mg, poudre et solvant pour suspension injectable (I.M.) à libération prolongée ?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver SOMATULINE L.P. 30 mg, poudre et solvant pour suspension injectable (I.M.) à libération prolongée ?
6. Contenu de l’emballage et autres informations.
1. QU’EST-CE QUE SOMATULINE L.P. 30 mg, poudre et solvant pour suspension injectable (I.M.) à libération prolongée ET DANS QUELS CAS EST-IL UTILISE ?
Classe pharmacothérapeutique : antihormones de croissance, Code ATC : H01CB03.
SOMATULINE L.P. 30 mg, poudre et solvant pour suspension injectable (I.M.) à libération prolongée est utilisé :
· Dans le traitement de l’acromégalie lorsque la sécrétion de l’hormone de croissance n’est pas normalisée après d’autres traitements ou lorsque ceux-ci ne peuvent pas être utilisés.
· Dans le traitement des symptômes provoqués par certaines maladies digestives appelées tumeurs carcinoïdes.
· Dans le traitement des adénomes thyréotropes primitifs (tumeur de l’hypophyse provoquant une hyperthyroïdie).
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT D’UTILISER SOMATULINE L.P. 30 mg, poudre et solvant pour suspension injectable (I.M.) à libération prolongée ?
N’utilisez jamais SOMATULINE L.P. 30 mg, poudre et solvant pour suspension injectable (I.M.) à libération prolongée :
· Si vous êtes allergique (hypersensible) au lanréotide, à la somatostatine ou aux médicaments de la même famille (analogues de la somatostatine) ou à l’un des autres composants contenus dans ce médicament (mentionnés dans la rubrique 6).
Avertissements et précautions
· Si vous êtes diabétique. Le lanréotide peut agir sur le taux de sucre dans le sang. Dans ce cas, votre médecin pourra juger nécessaire de vérifier le taux de sucre dans votre sang et éventuellement de modifier votre traitement anti-diabétique pendant le traitement par le lanréotide.
· Si vous avez des calculs biliaires. Le lanréotide peut favoriser la formation de calculs biliaires dans la vésicule biliaire. Une surveillance régulière de la vésicule biliaire peut être nécessaire dans ce cas. Votre médecin pourra décider d’arrêter le traitement par le lanréotide si des complications liées à des calculs biliaires surviennent.
· Si vous avez des problèmes de thyroïde. Le lanréotide peut diminuer légèrement le fonctionnement de votre thyroïde.
· Si vous avez des problèmes cardiaques. Une bradycardie sinusale (ralentissement du rythme du cœur) peut survenir au cours du traitement par le lanréotide. Si vous souffrez de bradycardie, il faudra être particulièrement prudent au début du traitement par le lanréotide.
Si vous êtes dans l’une des situations décrites ci-dessus, prévenez votre médecin ou votre pharmacien avant d’utiliser SOMATULINE L.P 30 mg.
Enfants
L’utilisation de SOMATULINE L.P 30 mg n’est pas recommandée chez l’enfant.
Autres médicaments et SOMATULINE L.P 30 mg poudre et solvant pour suspension injectable (I.M.) à libération prolongée
Informez votre médecin ou pharmacien> si vous utilisez, avez récemment utilisé ou pourriez utiliser tout autre médicament.
Il faut être particulièrement prudent si vous prenez en même temps :
· De la ciclosporine (un médicament qui diminue la réaction immunitaire, utilisé après une transplantation d’organe ou en cas de maladie auto-immune).
· Un traitement antidiabétique (insuline, glitazones, répaglinide ou sulfamides hypoglycémiants).
· Un médicament qui ralentit le rythme du cœur (comme les béta-bloquants).
Dans ce cas, votre médecin pourra décider de modifier la dose de ces médicaments.
SOMATULINE L.P 30 mg poudre et solvant pour suspension injectable (I.M.) à libération prolongée avec des aliments et boissons
Sans objet.
Grossesse
Vous ne devez pas prendre SOMATULINE L.P. durant votre grossesse sauf en cas de stricte nécessité. Si vous êtes enceinte ou si vous pensez l’être, vous devez prévenir immédiatement votre médecin.
Allaitement
En l’absence de données sur l’excrétion de SOMATULINE L.P. dans le lait maternel, SOMATULINE L.P. ne doit pas être utilisé pendant l’allaitement.
Demandez conseil à votre médecin ou à votre pharmacien avant de prendre ce médicament.
Conduite de véhicules et utilisation de machines
Il est peu probable que votre traitement agisse sur votre capacité à conduire ou à utiliser des machines. Toutefois, des effets indésirables comme des sensations vertigineuses peuvent survenir avec SOMATULINE L.P. Si vous présentez ce type d’effets, il faudra être prudent en cas de conduite de véhicule ou d’utilisation de machines.
Informations importantes concernant la teneur en sodium de SOMATULINE L.P 30 mg, poudre et solvant pour suspension injectable (I.M.) à libération prolongée
Ce médicament contient moins de 1 mmol de sodium (23 mg) par flacon (c'est-à-dire essentiellement « sans sodium »).
3. COMMENT UTILISER SOMATULINE L.P. 30 mg, poudre et solvant pour suspension injectable (I.M.) à libération prolongée ?
Posologie
Dans l’acromégalie
Le rythme d’administration de la forme à libération prolongée peut être fixé initialement à 1 injection intramusculaire tous les 14 jours. En cas de réponse insuffisante, jugée sur les taux d’hormone de croissance et d’IGF-1 (mesurés avant l’injection suivante), ce rythme peut être porté à 1 injection tous les 10 jours.
Dans les tumeurs carcinoïdes
Le rythme d’administration de la forme à libération prolongée peut être fixé initialement à 1 injection intramusculaire tous les 14 jours. En cas de réponse insuffisante, jugée sur les symptômes cliniques (flushes, selles diarrhéiques), ce rythme peut être porté à 1 injection tous les 10 jours.
Dans les adénomes thyréotropes primitifs responsables d’une hyperthyroïdie
Le rythme d’administration de la forme à libération prolongée peut être fixé initialement à une injection intramusculaire tous les 14 jours. En cas de réponse insuffisante, jugée sur les taux d’hormones thyroïdiennes et la TSH, ce rythme peut être porté à 1 injection tous les 10 jours.
Votre médecin vous dira pendant combien de temps vous devez utiliser ce médicament. Conformez-vous à ses recommandations.
Mode d’administration
Ce médicament sera préparé et vous sera administré par un professionnel de santé. Il doit être injecté dans le muscle (voie intra-musculaire).
Si vous avez utilisé plus de SOMATULINE L.P 30 mg poudre et solvant pour suspension injectable (I.M.) à libération prolongée que vous n’auriez dû :
Si vous avez reçu plus de SOMATULINE L.P. que vous n’auriez dû, consultez immédiatement votre médecin. En cas de dose trop importante, vous risquez de présenter des effets indésirables plus nombreux ou plus sévères (voir rubrique 4).
Si vous oubliez d’utiliser SOMATULINE L.P 30 mg poudre et solvant pour suspension injectable (I.M.) à libération prolongée :
Ne faites pas d’injection supplémentaire pour compenser l’injection que vous avez oublié de faire.
Si vous arrêtez d’utiliser SOMATULINE L.P 30 mg poudre et solvant pour suspension injectable (I.M.) à libération prolongée :
Une interruption ou un arrêt prématuré de SOMATULINE L.P. 30 mg peut compromettre le succès de votre traitement. Demandez conseil à votre médecin avant d’arrêter votre traitement.
Si vous avez d’autres questions sur l’utilisation de ce médicament, demandez plus d’informations à votre médecin ou à votre pharmacien.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
Prévenez immédiatement votre médecin si vous remarquez l’un des effets indésirables suivants :
· Si vous avez plus soif ou si vous vous sentez plus fatigué que d’habitude et si vous avez la bouche sèche. Ces signes peuvent indiquer que vous avez un taux élevé de sucre dans le sang ou que vous développez un diabète.
· Si vous avez une sensation de faim, des tremblements, une transpiration plus importante que d’habitude, ou si vous vous sentez confus. Ces signes peuvent indiquer que vous avez un taux bas de sucre dans le sang.
Ces effets indésirables sont fréquents ; ils peuvent concerner jusqu’à 1 personne sur 10.
Prévenez immédiatement votre médecin si vous remarquez que :
· Votre visage devient rouge ou gonflé, ou si vous présentez des taches ou une éruption cutanée.
· Vous sentez votre poitrine se serrer, vous êtes gêné pour respirer ou votre respiration est sifflante.
· Vous vous sentez faible, peut-être en relation avec une chute de la pression artérielle.
Ces signes peuvent être la conséquence d’une réaction allergique. La fréquence de cet effet indésirable n’est pas connue car les données disponibles ne permettent pas de l’estimer.
Autres effets indésirables :
Les effets indésirables les plus fréquents sont des troubles gastro-intestinaux, des problèmes au niveau de la vésicule biliaire et des réactions au niveau du point d’injection.
Les effets indésirables qui peuvent survenir avec SOMATULINE L.P. 30 mg sont listés ci-dessous par ordre de fréquence.
Très fréquents (pouvant survenir chez plus de 1 personne sur 10)
· diarrhée, selles molles, douleurs abdominales
· calculs biliaires et autres problèmes de vésicule biliaire. Vous pouvez présenter des symptômes tels que douleur abdominale sévère et soudaine, fièvre élevée, jaunisse (peau et blanc des yeux devenant jaune), frissons, perte d’appétit, démangeaisons.
Fréquents (pouvant survenir jusque chez 1 personne sur 10)
· perte de poids
· manque d’énergie
· battements cardiaques lents
· sensation de fatigue très importante
· diminution de l’appétit
· sensation de faiblesse généralisée
· excès de graisse dans les selles
· sensation de vertiges, maux de tête
· perte des cheveux ou diminution du développement des poils
· douleurs au niveau des muscles des ligaments, des tendons et des os
· réactions au niveau du point d’injection telles que douleur, induration ou démangeaisons
· anomalies des tests hépatiques et pancréatiques ; modification du taux de sucre dans le sang
· nausées, vomissements, constipation, flatulence, ballonnement ou inconfort gastrique, indigestion
· dilatation biliaire (élargissement des voies biliaires entre le foie et la vésicule biliaire et l’intestin). Vous pouvez ressentir des symptômes tels que douleurs de l’estomac, nausées, jaunisse et fièvre.
Peu fréquents (pouvant survenir jusque chez 1 personne sur 100)
· bouffées de chaleur
· difficultés d’endormissement
· changement de couleur des selles
· modification des taux sanguins de phosphatases alcalines et de sodium.
Fréquence inconnue (la fréquence ne peut pas être estimée sur la base des données disponibles)
· Douleur soudaine et intense dans la partie basse de l’estomac. Ceci peut être un signe d’inflammation du pancréas (pancréatite).
· Rougeur, douleur, chaleur et gonflement au site d’injection qui peut sembler rempli de liquide lorsqu’il est pressé, et fièvre. Ceci peut être le signe d’un abcès.
· Douleur intense et soudaine en haut à droite de l’abdomen ou en son centre, pouvant irradier vers l'épaule ou le dos, une sensibilité de l'abdomen, des nausées, des vomissements et une forte fièvre. Ceci peut être le signe de calculs biliaires (cholécystite).
· Douleur dans la partie supérieure droite de votre ventre (abdomen), fièvre, frissons, jaunissement de la peau et des yeux (jaunisse), nausées, vomissements, selles couleur argile, urine foncée, et fatigue. Il peut s’agir des signes d'une inflammation du canal biliaire (cholangite).
Comme le lanréotide peut modifier le taux de sucre dans le sang, votre médecin pourra juger nécessaire de vérifier le taux de sucre dans votre sang, surtout en début du traitement.
De même, comme ce type de médicament peut entraîner des problèmes au niveau de la vésicule biliaire, votre médecin pourra juger nécessaire de surveiller votre vésicule biliaire au début du traitement par SOMATULINE L.P. 30 mg, puis périodiquement lors de la poursuite du traitement.
Si vous remarquez l’un des effets indésirables mentionnés ci-dessus, veuillez en informer votre médecin ou votre pharmacien.
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : www.signalement-sante.gouv.fr.
En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.
5. COMMENT CONSERVER SOMATULINE L.P. 30 mg, poudre et solvant pour suspension injectable (I.M.) à libération prolongée ?
Tenir ce médicament hors de la vue et de la portée des enfants.
N’utilisez pas ce médicament après la date de péremption indiquée sur l’emballage après EXP. La date de péremption fait référence au dernier jour de ce mois
Après ouverture, le produit doit être utilisé immédiatement.
A conserver dans l’emballage d’origine, à une température comprise entre +2° et + 8°.
Ne jetez aucun médicament au tout-à-l’égout ou avec les ordures ménagères. Demandez à votre pharmacien d’éliminer les médicaments que vous n’utilisez plus. Ces mesures contribueront à protéger l’environnement.
6. CONTENU DE L’EMBALLAGE ET AUTRES INFORMATIONS
· La substance active est :
Acétate de lanréotide correspondant à lanréotide............................................................. 0 03 g*
Pour un flacon.
*Compte tenu des caractéristiques de la forme pharmaceutique chaque flacon contient une quantité d'acétate de lanréotide correspondant à 0,04 g de lanréotide.
· Les autres composants sont :
Copolymères (lactide - glycolide et lactique - glycolique), mannitol, carmellose sodique, polysorbate 80.
Solvant : mannitol, eau pour préparations injectables.
Ce médicament se présente sous forme de poudre et solvant pour suspension injectable (IM) à libération prolongée. La poudre est blanchâtre et la présence de bulles d’air à la surface est normale.
Boîte de 1, 2 ou 6 flacon(s) et ampoule(s).
Toutes les présentations peuvent ne pas être commercialisées
Titulaire de l’autorisation de mise sur le marché
65 QUAI GEORGES GORSE
92100 BOULOGNE BILLANCOURT
Exploitant de l’autorisation de mise sur le marché
65 QUAI GEORGES GORSE
92100 BOULOGNE BILLANCOURT
PARC D’ACTIVITES DU PLATEAU DE SIGNES
83870 SIGNES
Noms du médicament dans les Etats membres de l'Espace Economique Européen
Sans objet.
La dernière date à laquelle cette notice a été révisée est :
[à compléter ultérieurement par le titulaire]
Des informations détaillées sur ce médicament sont disponibles sur le site Internet de l’ANSM (France).
Les informations suivantes sont destinées exclusivement aux professionnels de santé :
Instructions pour la reconstitution
SOMATULINE L.P. 30 mg, poudre et solvant pour suspension injectable (I.M.) à libération prolongée
Contenu de la boite
La boite de SOMATULINE L.P.30 mg contient une notice et un kit pour réaliser une injection intramusculaire (voir rubrique 6 de la Notice destinée au patient).
Informations générales
N’utilisez pas ce produit si le kit d’injection est endommagé ou ouvert.
La suspension doit être préparée juste avant l’injection.
La boite de SOMATULINE L.P. 30 mg doit être sortie du réfrigérateur 30 minutes avant utilisation.
Utilisez toujours 2 aiguilles : une pour reconstituer la suspension et remplir la seringue, l’autre pour effectuer l’injection au patient.
1. Préparation du patient
Le patient doit être couché sur le ventre avec la peau de la fesse désinfectée.
2. Préparation de l’injection
Vissez une aiguille sur la seringue (n’enlevez pas le capuchon protecteur de l’aiguille à ce stade).
Cassez l’ampoule de solvant.
Enlevez le capuchon protecteur de l’aiguille et aspirez la totalité du solvant de l’ampoule dans la seringue.
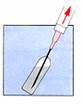
Enlevez la capsule de protection du flacon contenant la poudre. Insérez l’aiguille au travers du bouchon et injectez lentement le solvant de sorte qu’il nettoie toute la partie supérieure du flacon.

Ne retirez pas la seringue du flacon mais remontez l’aiguille au-dessus du niveau du liquide et homogénéisez la suspension en agitant doucement le flacon sans le retourner, jusqu’à obtention d’un mélange laiteux. Attention : Ne pas effectuer le mélange en aspirant le liquide dans la seringue et en le rejetant plusieurs fois de suite.

Aspirez la totalité du mélange dans la seringue.
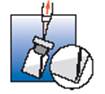
Otez la première aiguille et purgez si nécessaire.

Adaptez la seconde aiguille sur la seringue et procédez immédiatement à l’injection.
Ne mélangez pas ce médicament à d’autres médicaments.
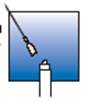
3. Injection
L’injection doit être effectuée par voie intramusculaire dans le muscle glutéal (moyen fessier).

Injectez la totalité du contenu de la seringue immédiatement et rapidement.
Alternez le site d’injection entre le côté droit et le côté gauche lors de chaque injection.
4. Après utilisation
Jetez les aiguilles et le matériel souillé dans un container adapté.
Réservé à usage unique.
Toute suspension restante doit être jetée.