
ANSM - Mis à jour le : 07/03/2025
EQWILATE 1000 UI FVW / 1000 UI FVIII, poudre et solvant pour solution injectable
Facteur von Willebrand humain /facteur VIII de coagulation humain
· Gardez cette notice. Vous pourriez avoir besoin de la relire.
· Si vous avez d’autres questions, interrogez votre médecin ou votre pharmacien.
· Ce médicament vous a été personnellement prescrit. Ne le donnez pas à d’autres personnes. Il pourrait leur être nocif, même si les signes de leur maladie sont identiques aux vôtres.
· Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
1. Qu'est-ce que EQWILATE 1000 UI FVW / 1000 UI FVIII, poudre et solvant pour solution injectable et dans quels cas est-il utilisé ?
2. Quelles sont les informations à connaître avant d'utiliser EQWILATE 1000 UI FVW / 1000 UI FVIII, poudre et solvant pour solution injectable ?
3. Comment utiliser EQWILATE 1000 UI FVW / 1000 UI FVIII, poudre et solvant pour solution injectable ?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver EQWILATE 1000 UI FVW / 1000 UI FVIII, poudre et solvant pour solution injectable ?
6. Contenu de l’emballage et autres informations.

Code ATC : B02BD06.
EQWILATE fait partie de la classe pharmacothérapeutique des médicaments désignés sous le nom de facteurs de coagulation et contient du facteur von Willebrand (FVW) et du facteur VIII de coagulation du sang humain . Ces deux protéines jouent un rôle dans la coagulation du sang.
Maladie de von Willebrand
EQWILATE s’utilise pour le traitement et la prévention des hémorragies chez les patients atteints de maladie de von Willebrand, terme qui désigne en réalité un groupe de maladies apparentées. La maladie de von Willebrand est un trouble de la coagulation sanguine qui se manifeste par des saignements anormalement long. Ce phénomène peut être dû à un manque de FVW dans le sang ou au fait que le FVW n’agit pas comme il le devrait.
Hémophilie A
EQWILATE s’utilise pour le traitement et la prévention des hémorragies chez les patients atteints d’hémophilie A. Ceci est un trouble au cours duquel un saignement peut se poursuivre pendant une durée anormalement longue. Elle est due à un déficit congénital de facteur VIII dans le sang.

N’utilisez jamais EQWILATE 1000 UI FVW / 1000 UI FVIII, poudre et solvant pour solution injectable :
Si vous êtes allergique (hypersensible) au facteur von Willebrand, au facteur VIII de coagulation du sang ou à l’un des autres composants contenus dans ce médicament mentionnés dans la rubrique 6).
Avertissements et précautions
Adressez-vous à votre médecin ou pharmacien avant d’utiliser EQWILATE 1000 UI FVW / 1000 UI FVIII, poudre et solvant pour solution injectable.
EQWILATE, comme pour tout médicament contenant des protéines et injecté dans une veine (administration intraveineuse) des réactions allergiques peuvent apparaître. Soyez attentif à tout signe précoce de réaction allergique (d’hypersensibilité) tel que :
· urticaire
· éruption cutanée
· sensation d’oppression au niveau de la poitrine
· respiration sifflante
· hypotension
· anaphylaxie (lorsqu’une partie ou l’ensemble des symptômes susmentionnés se développent rapidement et intensément)
En cas d’apparition de ce type de symptômes, cessez immédiatement l’injection et contactez un médecin.
Lorsque des médicaments sont préparés à partir de sang ou de plasma humain, des mesures de prévention de la transmission d’agents infectieux sont mises en place. Celles-ci comprennent une sélection clinique soigneuse des donneurs de sang et de plasma de façon à exclure les donneurs risquant d’être porteurs d’infections, et le contrôle sur chaque don et des mélanges de plasma pour la présence de virus/d’infection. Les fabricants de ces médicaments mettent également en œuvre, dans leur procédé de fabrication, des étapes capables d’éliminer ou d’inactiver des virus.
Cependant, lorsque des médicaments préparés à partir de sang ou de plasma humain sont administrés, le risque de transmission de maladies infectieuses ne peut être totalement exclu. Ceci s’applique également à tous les virus inconnus ou émergents ou autres types d’agents infectieux.
Les mesures prises sont considérées comme efficaces contre les virus enveloppés tels que les virus de l’immunodéficience humaine (VIH), de l’hépatite B et de l’hépatite C, ainsi que contre le virus non enveloppé de l’hépatite A. Les mesures prises peuvent être d’efficacité limitée vis-à-vis de virus non enveloppés comme le parvovirus B19.
L’infection par le parvovirus B19 peut être sévère chez la femme enceinte (infection fœtale) et chez les personnes atteintes de déficit immunitaire ou de certains types d’anémie (par exemple anémie falciforme ou dégradation anormale des globules rouges).
Il est fortement recommandé, qu’à chaque administration d’EQWILATE, de prendre note du nom et du numéro de lot du produit afin de maintenir un lien entre le patient et le numéro de lot du médicament.
Une vaccination appropriée (hépatites A et B) des patients recevant des facteurs de coagulation est recommandée.
Maladie de von Willebrand
Voir la section 4. (Maladie de von Willebrand) pour connaître les effets indésirables associés au traitement de la maladie de von Willebrand.
Hémophilie A
L’apparition d’inhibiteurs du facteur VIII est une complication connue pouvant survenir pendant le traitement avec un produit de facteur VIII, peu importe lequel. Ces inhibiteurs, notamment à une forte concentration, empêchent le traitement d’être efficace ; vous ou votre enfant serez donc surveillé étroitement afin de déceler l’apparition de ces inhibiteurs. Si un saignement n’est pas correctement contrôlé avec EQWILATE, informez-en immédiatement votre médecin.
Voir la section 4. (Hémophilie A) pour connaître les effets indésirables associés au traitement de l’hémophilie A.
Enfants et adolescents
Sans objet.
Autres médicaments et EQWILATE 1000 UI FVW / 1000 UI FVIII, poudre et solvant pour solution injectable
Bien que l’on n’ait connaissance d’aucune influence d’autres médicaments sur EQWILATE, informez votre médecin ou pharmacien si vous prenez ou avez pris récemment un autre médicament, y compris un médicament obtenu sans ordonnance.
Ne mélangez pas EQWILATE avec un autre médicament lors de l’injection.
EQWILATE 1000 UI FVW / 1000 UI FVIII, poudre et solvant pour solution injectable avec des aliments et, boissons et de l’alcool
Sans objet.
Grossesse, allaitement et fertilité
Si vous êtes enceinte ou que vous allaitez, si vous pensez être enceinte ou planifiez une grossesse, demandez conseil à votre médecin ou pharmacien avant de prendre ce médicament.
Conduite de véhicules et utilisation de machines
Sans objet.
EQWILATE 1000 UI FVW / 1000 UI FVIII, poudre et solvant pour solution injectable contient du sodium
Ce médicament contient jusqu’à 117,3 mg de sodium (composant principal du sel de cuisine/table) par flacon. Cela équivaut à 5,87% de l’apport alimentaire quotidien maximal recommandé de sodium pour un adulte.

EQWILATE doit être injecté par voie intraveineuse après avoir été reconstitué avec le solvant fourni. Le traitement doit être initié sous contrôle médical.
Posologie
Votre médecin vous indiquera la dose et la fréquence d’administration d’EQWILATE adaptée à votre cas. Respectez toujours la posologie indiquée par votre médecin. En cas d’incertitude, consultez votre médecin ou votre pharmacien.
Si vous avez utilisé plus de EQWILATE 1000 UI FVW / 1000 UI FVIII, poudre et solvant pour solution injectable que vous n’auriez dû
Aucun symptôme de surdosage de FVW ou de facteur VIII humain n’a été décrit. Il convient néanmoins de ne pas dépasser la dose recommandée.
Si vous avez utilisé trop de EQWILATE 1000 UI FVW / 1000 UI FVIII, poudre et solvant pour solution injectable, prenez immédiatement contact avec votre médecin ou votre pharmacien.
Si vous oubliez d’utiliser EQWILATE 1000 UI FVW / 1000 UI FVIII, poudre et solvant pour solution injectable
Ne prenez pas de dose double pour compenser la dose que vous avez oublié de prendre.
Si vous avez d’autres questions sur l’utilisation de ce médicament, demandez plus d’informations à votre médecin ou à votre pharmacien.
Si vous arrêtez d’utiliser EQWILATE 1000 UI FVW / 1000 UI FVIII, poudre et solvant pour solution injectable
Sans objet.

Comme tous les médicaments, ce médicament peut provoquer des effets indésirables, mais ils ne surviennent pas systématiquement chez tout le monde.
Bien que peu fréquentes, une hypersensibilité ou des réactions allergiques ont été observées. Les symptômes sont notamment :
· brûlure et picotement au site de perfusion
· frissons
· bouffées de chaleur
· maux de tête
· urticaire
· diminution de la tension artérielle (hypotension)
· fatigue (léthargie)
· nausées
· nervosité
· accélération de la fréquence cardiaque (tachycardie)
· sensation d’oppression au niveau de la poitrine
· sensation de fourmillements ou de picotements
· vomissements
· respiration sifflante
· gonflement de différentes parties du corps (œdème de Quincke)
Si vous présentez l’un des symptômes susmentionnés, signalez-le à votre médecin.
Vous devez cesser d’utiliser EQWILATE et consulter immédiatement un médecin en cas de symptômes d’œdème de Quincke, par exemple :
· gonflement du visage, de la langue ou de la gorge (pharynx)
· difficultés à avaler
· urticaire et difficultés à respirer
Bien que peu fréquente, de la fièvre a également été observée.
Une douleur abdominale, une douleur dorsale, une douleur thoracique, une toux et un étourdissement peuvent se manifester, mais la fréquence de ces effets indésirables est indéterminée.
Dans de très rares cas, l’hypersensibilité peut engendrer une réaction allergique sévère appelée anaphylaxie (lorsqu’une partie ou l’ensemble des symptômes ci-dessus se développent rapidement et intensément), qui peut se manifester par un choc. En cas de choc anaphylactique, un traitement conforme aux recommandations médicales actuelles lors de choc est indispensable.
Maladie de von Willebrand
Lors d’utilisation d’un produit à base de FVW contenant du facteur VIII pour le traitement de la maladie de von Willebrand, un traitement continu peut engendrer une augmentation excessive du facteur VIII dans le sang. Cela peut se traduire par un risque accru de perturbation de la circulation sanguine (thrombose).
Si vous présentez des facteurs de risque connus, vous devez faire l’objet d’un suivi pour les signes précoces de thrombose. Votre médecin envisagera éventuellement des mesures de prévention (prophylaxie) des événements thrombotiques conformément aux recommandations actuelles.
Les patients atteints de maladie de von Willebrand (particulièrement de type 3) sont susceptibles de développer des inhibiteurs (anticorps neutralisants) dirigées contre le FVW au cours du traitement par du FVW. Dans ces très rares cas, les inhibiteurs peuvent empêcher EQWILATE d’agir efficacement.
En cas de saignements persistants, il convient de rechercher la présence de ces inhibiteurs dans le sang.
Ces inhibiteurs sont susceptibles d’accroître le risque de réactions allergiques sévères (choc anaphylactique). Si vous présentez une réaction allergique, on recherchera la présence d’inhibiteurs.
Si des inhibiteurs sont présents dans votre sang, vous devez contacter un médecin possédant une expérience du traitement des patients atteint de troubles de la coagulation. Chez les patients qui présentent des quantités élevées d’inhibiteurs, un autre type de traitement peut s’avérer utile et doit être envisagé.
Hémophilie A
Chez les enfants n’ayant jamais été traités par un produit de facteur VIII, des inhibiteurs, ou anticorps, (voir rubrique 2) peuvent apparaître effet indésirable très fréquent (pouvant toucher plus d’1 patient sur 10). Cependant, chez les patients ayant déjà reçu un traitement par un produit de facteur VIII pendant plus de 150 jours, ce risque est peu fréquent (peut toucher moins d’1 patient sur 100). En cas d’apparition d’inhibiteurs, le traitement cessera d’être efficace et vous, ou votre enfant, pourriez avoir un saignement persistant. Dans ce cas, consultez immédiatement votre médecin. Ces inhibiteurs sont susceptibles d’accroître le risque de réactions allergiques sévères (choc anaphylactique). Si vous présentez une réaction allergique, on recherchera la présence d’inhibiteurs.
Peu fréquent : peut affecter jusqu’à 1 utilisateur sur 100
Rare : peut affecter jusqu’à 1 utilisateur sur 1.000
Très rare : peut affecter jusqu’à 1 utilisateur sur 10.000
On ne dispose pas de suffisamment de données pour recommander l’utilisation d’EQWILATE chez des patients non préalablement traités.
Effets indésirables supplémentaires chez les enfants
L’expérience du traitement avec EQWILATE chez les enfants de moins de 6 ans est limitée.
Pour des informations sur la sécurité virale, voir section 2. (Avertissements et précautions).
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin, votre pharmacien ou à votre infirmier/ère. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet: https://signalement.social-sante.gouv.fr/.
En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.

Tenir ce médicament hors de la vue et de la portée des enfants.
Conserver la poudre et le flacon de solvant au réfrigérateur (entre +2°C et +8°C).
Ne pas congeler.
Conserver les flacons dans l’emballage extérieur d’origine à l’abri de la lumière.
N’utilisez pas ce médicament après la date de péremption indiquée sur l’étiquette après EXP. La date de péremption fait référence au dernier jour de ce mois.
EQWILATE peut être conservé à température ambiante (max. +25°C) pendant 2 mois. Dans ce cas, la durée de conservation est de 2 mois après que le produit a été retiré pour la première fois du réfrigérateur. Vous devez inscrire la nouvelle date de péremption sur l’emballage extérieur.
La poudre ne doit être dissoute qu’immédiatement avant l’injection. La stabilité de la solution a été démontrée pendant 4 heures à température ambiante. Néanmoins, pour éviter une contamination microbienne, la solution doit être utilisée immédiatement et en une seule fois.
Ne jetez aucun médicament au tout-à-l’égout ou avec les ordures ménagères. Demandez à votre pharmacien d’éliminer les médicaments que vous n’utilisez plus. Ces mesures contribueront à protéger l’environnement.

Ce que contient EQWILATE 1000 UI FVW / 1000 UI FVIII, poudre et solvant pour solution injectable 
Les substances actives sont le facteur von Willebrand humain et le facteur VIII de coagulation humain.
Les autres composants sont du chlorure de sodium, de la glycine, du saccharose, du citrate de sodium et du chlorure de calcium.
Solvant : eau pour préparations injectables avec 0,1% de polysorbate 80
Qu’est-ce que EQWILATE 1000 UI FVW / 1000 UI FVIII, poudre et solvant pour solution injectable et contenu de l’emballage extérieur 
Poudre lyophilisée : poudre blanche ou jaune pâle ou solide friable
Solution reconstituée : doit être lipide ou légèrement opalescente
EQWILATE est fourni sous forme de poudre et de solvant pour solution injectable. Deux conditionnements sont proposés :
· EQWILATE 1000 UI FVW / 1000 UI FVIII, poudre et solvant pour solution injectable, contient respectivement 1000 UI de facteur von Willebrand humain et 1000 UI de facteur VIII de coagulation humain par flacon. Après reconstitution avec 10 ml d’eau pour injection contenant 0,1% de polysorbate 80 (solvant), le produit contient environ 100 UI/ml de facteur von Willebrand humain et 100 UI/ml de facteur VIII de coagulation humain.
Contenu de l’emballage
1 flacon de poudre lyophilisée
1 flacon de solvant
1 boîte de matériel pour injection intraveineuse (1 dispositif de transfert, 1 trousse de perfusion, 1 seringue jetable)
2 compresses imbibées d’alcool
Titulaire de l’autorisation de mise sur le marché 
OCTAPHARMA FRANCE
62 BIS, AVENUE ANDRE MORIZET
92100 BOULOGNE BILLANCOURT
FRANCE
Exploitant de l’autorisation de mise sur le marché 
OCTAPHARMA FRANCE
62 BIS, AVENUE ANDRE MORIZET
92100 BOULOGNE BILLANCOURT
FRANCE
Octapharma Pharmazeutika Produktionsges.m.b.H.
OBERLAAER STR 235
A-1100 VIENNE
AUTRICHE
Noms du médicament dans les Etats membres de l'Espace Economique Européen 
Ce médicament est autorisé dans les Etats membres de l'Espace Economique Européen sous les noms suivants : Conformément à la réglementation en vigueur.
[à compléter ultérieurement par le titulaire]
La dernière date à laquelle cette notice a été révisée est : 
[à compléter ultérieurement par le titulaire]
Des informations détaillées sur ce médicament sont disponibles sur le site Internet de l’ANSM (France).
Instructions pour le traitement à domicile
Veuillez lire toutes les instructions et les respecter soigneusement !
Ne pas utiliser EQWILATE après la date de péremption mentionnée sur l'étiquette.
Pendant la procédure décrite ci-dessous, la stérilité doit être maintenue !
Avant l’administration, le médicament reconstitué doit être inspecté visuellement pour y déceler la présence de particules et de coloration anormale.
La solution doit être limpide ou légèrement opalescente. N'utilisez pas de solutions troubles ou présentant des dépôts.
Utilisez immédiatement la solution préparée afin de prévenir toute contamination microbienne.
N'utilisez que la trousse d'injection fournie. L'utilisation d'un autre matériel d'injection/perfusion peut induire des risques additionnels et un échec du traitement.
Instructions pour la préparation de la solution:
Ne pas utiliser le produit directement après la sortie du réfrigérateur. Amener le solvant et la poudre contenus dans les flacons fermés à température ambiante.
Retirer les capuchons amovibles des deux flacons et nettoyer les bouchons en caoutchouc avec l'une des compresses imbibées d'alcool fournies.
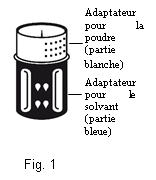
Le dispositif de transfert est représenté à la Fig. 1.
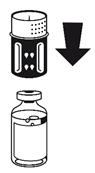
(Fig. 2 + 3) Placer le flacon de solvant sur une surface plane et le tenir fermement. Prendre le dispositif de transfert et le retourner. Placer la partie bleue du dispositif de transfert sur le dessus du flacon de solvant et appuyer fermement jusqu'à ce qu'il s'enclenche.
Ne pas le faire tourner au moment de le fixer.
Fig. 3 Fig. 2![]()
![]()
|
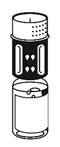
(Fig. 4). Placer le flacon de poudre sur une surface plane et le tenir fermement. Prendre le flacon de solvant avec le dispositif de transfert fixé et le retourner. Placer la partie blanche sur le dessus du flacon de poudre et appuyer fermement jusqu'à ce qu'il s'enclenche Ne pas le faire tourner au moment de le fixer. Le solvant s'écoule automatiquement dans le flacon de poudre. |
Fig. 4 |
||
|
Les deux flacons toujours fixés, agiter doucement le flacon de poudre en le faisant tournoyer jusqu'à ce que le produit soit dissous. La dissolution est terminée en moins de 10 minutes à température ambiante. Il peut se produire une légère formation de mousse pendant la préparation. (Fig. 5). Dévissez le dispositif de transfert en deux parties La mousse va disparaître. Eliminer le flacon de solvant vide avec la partie bleue du dispositif de transfert. |
Fig. 5 |
Instructions pour l'injection:
À titre de précaution, le pouls doit être mesuré avant et pendant l'injection. S'il se produit une forte augmentation de la fréquence cardiaque, réduire la vitesse d'injection ou interrompez l'administration pendant un court moment.
La solution doit être limpide ou légèrement opalescente.
|
(Fig. 6). Fixer la seringue à la partie blanche du dispositif de transfert. Retourner le flacon et prélever la solution dans la seringue
|
Fig. 6 |
|
(Fig. 7). Dès que la solution a été transférée, tenir fermement le piston de la seringue (en la tenant tournée vers le bas) et retirer la seringue du dispositif de transfert
Eliminer le flacon vide, ainsi que la partie blanche du dispositif de transfert.
|
|
Nettoyer le site d'injection choisi avec l'une des compresses imbibées d'alcool fournies.
Fixer la trousse de perfusion fournie à la seringue.
Introduire l'aiguille pour injection dans la veine choisie. Si un garrot a été utilisé pour rendre la veine plus facile à voir, ce garrot doit être relâché avant de commencer à injecter EQWILATE.
Du sang ne doit pas pénétrer dans la seringue, en raison du risque de formation de caillots de fibrine.
Injecter la solution dans la veine lentement, pas plus vite que 2 à 3 ml par minute.
Si plus qu'un flacon d’EQWILATE est utilisé pour un traitement, la même aiguille pour injection et la même seringue peuvent être réutilisées. Le dispositif de transfert est réservé à un usage unique.
Tout produit non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.
Ne pas mélanger EQWILATE à d’autres médicaments ni l’injecter avec d’autres médicaments (en utilisant le même matériel pour injection).
Utiliser uniquement la trousse de perfusion fournie. L’utilisation d’un autre matériel d’injection/de perfusion peut engendrer des risques supplémentaires ou un échec du traitement (adsorption du FVW /facteur VIII sur les surfaces internes de certains équipements de perfusion).
|
| Plan du site | Accessibilité | Contact | Téléchargement | Declaration de confidentialité | Service-Public.fr | Legifrance | Gouvernement.fr |