Dernière mise à jour le 08/01/2026
EFLUELDA TETRA, suspension injectable en seringue préremplie Vaccin grippal quadrivalent (inactivé, à virion fragmenté), 60 microgrammes HA/souche

: Ce médicament fait l'objet d'une surveillance renforcée. Pour plus d'informations, cliquez ici
Ce médicament n'est ou ne sera bientôt plus disponible sur le marché.
Si vous prenez actuellement ce médicament, il vous est recommandé d'en parler avec votre médecin
ou avec votre pharmacien qui pourra vous orienter vers un autre traitement.
Indications thérapeutiques
Classe pharmacothérapeutique : Vaccins contre la grippe, Code ATC : J07BB02.
EFLUELDA TETRA est un vaccin. Ce vaccin aide à protéger les personnes âgées de 60 ans et plus de la grippe. EFLUELDA TETRA doit être utilisé selon les recommandations officielles.
Lorsqu’une personne reçoit EFLUELDA TETRA, le système immunitaire (le système de défense naturelle de l’organisme) développe sa propre protection (anticorps) contre la maladie. Aucun des composants du vaccin ne peut causer la grippe.
La grippe est une maladie respiratoire contagieuse, causée par différentes souches du virus de la grippe, pouvant provoquer une maladie modérée à sévère, et entrainer des complications sévères comme une pneumonie. Ces complications peuvent conduire à une hospitalisation ou même un décès. La grippe est une maladie qui peut se propager rapidement et qui est causée par différentes souches de virus grippal qui peuvent changer tous les ans. En raison du changement potentiel des souches circulant chaque année et de la durée de protection conférée par le vaccin, il est recommandé de se faire vacciner tous les ans. Le plus grand risque de contracter la grippe se situe pendant les mois les plus froids, entre octobre et mars. Si vous n'avez pas été vacciné durant l'automne, il est encore possible de l’être jusqu'au printemps car vous courez le risque de contracter la grippe jusqu'à cette période. Votre médecin pourra vous recommander le meilleur moment pour vous faire vacciner.
EFLUELDA TETRA est destiné à vous protéger contre les quatre souches de virus contenues dans le vaccin, environ 2 à 3 semaines après l’injection. De plus, si vous êtes exposé tout de suite avant ou après la vaccination, vous pouvez encore déclarer la maladie, la période d’incubation de la grippe étant de quelques jours.
Le vaccin ne vous protègera pas des rhumes, même si certains des symptômes ressemblent à ceux de la grippe.
Composition en substances actives
-
Suspension ( Composition pour une dose de 0,7 ml )
- > virus de la grippe inactivé, fragmenté, souche A/Victoria/4897/2022 (H1N1)pdm09 - souche analogue (A/Victoria/4897/2022, IVR-238) 60 microgrammes d'hémagglutinine
- > virus de la grippe inactivé, fragmenté, A/Croatia/10136RV/2023 (H3N2)-souche analogue (A/Croatia/10136RV/2023, X-425A) 60 microgrammes d'hémagglutinine
- > virus de la grippe fragmenté, inactivé, souche B/Austria/1359417/2021 - souche analogue (B/Michigan/01/2021, type sauvage) 60 microgrammes d'hémagglutinine
- > Virus de la grippe fragmenté, inactivé, souche B/Phuket/3073/2013 - souche analogue (B/Phuket/3073/2013, type sauvage) 60 microgrammes d'hémagglutinine
Présentations
> 1 seringue préremplie en verre de 0,7 ml avec aiguille séparée, munie d’un bouchon-piston (Bromobutyle) et d’un capuchon de protection
Code CIP : 34009 302 054 0 2
Déclaration d'arrêt de commercialisation : 04/04/2024
Cette présentation n'est pas agréée aux collectivités
- Prix hors honoraire de dispensation : 30,90 €
- Honoraire de dispensation : 1,02 €
- Prix honoraire compris : 31,92 €
- Taux de remboursement :65 %
Documents de bon usage du médicament
- Stratégie de vaccination contre la Covid-19 : actualisation des recommandations relatives à l’administration concomitante des vaccins contre la Covid-19 et contre la grippe saisonnière
Auteur : Haute autorité de santé
Type : Recommandation vaccinale
Date de mise à jour :Juillet 2023
Service médical rendu (SMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprès de la HAS (plus d'informations dans l'aide). Les avis et synthèses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur du SMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| Important | Avis du 24/06/2020 | Inscription (CT) | Le service médical rendu par EFLUELDA est important dans la prévention de la grippe chez les personnes âgées de 65 ans et plus pour lesquelles la vaccination grippale est recommandée. |
Amélioration du service médical rendu (ASMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprés de la HAS (plus d'informations dans l'aide). Les avis et synthéses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur de l'ASMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| V (Inexistant) | Avis du 24/06/2020 | Inscription (CT) | Prenant en compte : • l’immunogénicité induite par EFLUELDA (vaccin grippal quadrivalent inactivé « haute dose ») non-inférieure à celle du vaccin trivalent « haute dose » commercialisé aux Etats-Unis (FLUZONE trivalent HD, non disponible en France) contre les trois souches communes aux deux vaccins, avec une meilleure réponse immunitaire vis-à-vis de la souche B additionnelle et un profil de tolérance satisfaisant, • l’intérêt possible d’un vaccin quadrivalent à haute dose par rapport à un vaccin quadrivalent à dose standard considérant des résultats des études ayant démontré la supériorité clinique du vaccin haute dose trivalent (commercialisé aux Etats-Unis) par rapport aux vaccins trivalents à dose standard chez les personnes âgées de 65 ans avec une réduction relative modeste de l’incidence des cas de grippe virologiquement confirmés (24,2% [9,7% - 36,5%]) et dans une moindre mesure des hospitalisations pour grippe ou affections respiratoires ou affections cardio-vasculaires (8% à 27%) ou hospitalisations toutes causes (résultats hétérogènes), et sans impact démontré ni sur la mortalité ni sur le déclin fonctionnel, mais en l’absence de donnée d’efficacité clinique comparative d’EFLUELDA par rapport aux vaccins quadrivalents à dose standard commercialisés en France, la Commission considère qu’EFLUELDA (vaccin grippal quadrivalent inactivé à « haute dose ») n’apporte pas d’amélioration du service médical rendu (ASMR V), dans l’immunisation active des personnes âgées de 65 ans et plus en prévention de la grippe, par rapport aux autres vaccins disponibles indiqués dans cette population. |
ANSM - Mis à jour le : 04/07/2025
![]() Ce médicament fait l’objet d’une surveillance supplémentaire qui permettra l’identification rapide de nouvelles informations relatives à la sécurité. Les professionnels de la santé déclarent tout effet indésirable suspecté. Voir rubrique 4.8 pour les modalités de déclaration des effets indésirables.
Ce médicament fait l’objet d’une surveillance supplémentaire qui permettra l’identification rapide de nouvelles informations relatives à la sécurité. Les professionnels de la santé déclarent tout effet indésirable suspecté. Voir rubrique 4.8 pour les modalités de déclaration des effets indésirables.
EFLUELDA TETRA, suspension injectable en seringue préremplie
Vaccin grippal quadrivalent (inactivé, à virion fragmenté), 60 microgrammes HA/souche
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Virus de la grippe (inactivé, fragmenté) des souches suivantes* :
A/Victoria/4897/2022 (H1N1)pdm09-souche analogue (A/Victoria/4897/2022, IVR-238).........................
.................................................................................................................... 60 microgrammes HA**
A/Croatia/10136RV/2023 (H3N2)-souche analogue (A/Croatia/10136RV/2023, X-425A) ........................
.................................................................................................................... 60 microgrammes HA**
B/Austria/1359417/2021-souche analogue (B/Michigan/01/2021, type sauvage)...................................
.................................................................................................................... 60 microgrammes HA**
B/Phuket/3073/2013-souche analogue (B/Phuket/3073/2013, type sauvage) .......................................
.................................................................................................................... 60 microgrammes HA**
Pour une dose de 0,7 mL.
* cultivées sur œufs embryonnés de poules
** hémagglutinine
Ce vaccin est conforme aux recommandations de l'OMS (dans l'Hémisphère Nord) et à la décision de l’UE pour la saison 2025/2026.
EFLUELDA TETRA peut contenir des traces d’œuf, comme l’ovalbumine, et des traces de formaldéhyde, utilisés lors du procédé de fabrication (voir rubrique 4.3).
Pour la liste complète des excipients, voir rubrique 6.1.
Suspension injectable en seringue préremplie.
EFLUELDA TETRA, après avoir été agité doucement, est un liquide opalescent, incolore.
4.1. Indications thérapeutiques
EFLUELDA TETRA est indiqué pour l’immunisation active des personnes âgées de 60 ans et plus en prévention de la grippe.
EFLUELDA TETRA doit être utilisé sur la base des recommandations officielles.
4.2. Posologie et mode d'administration
Chez les personnes âgées de 60 ans et plus : une dose de 0,7 mL.
Population pédiatrique
La tolérance et l’efficacité d’EFLUELDA TETRA chez les enfants âgés de moins de 18 ans n’ont pas été établies.
Mode d’administration
L’administration de ce vaccin se fait de préférence par voie intramusculaire. La voie sous-cutanée peut cependant également être utilisée.
L’injection intramusculaire se fait de préférence dans la région deltoïde. Ce vaccin ne doit pas être injecté dans la fesse, ou dans des zones pouvant être le siège d'un tronc nerveux majeur.
Pour les instructions concernant la préparation du médicament avant administration, voir la rubrique 6.6.
4.4. Mises en garde spéciales et précautions d'emploi
Afin d'améliorer la traçabilité des médicaments biologiques, le nom et le numéro de lot du produit administré doivent être clairement enregistrés.
Comme pour tous les vaccins injectables, il est nécessaire de toujours disposer d’un traitement médical approprié et de surveiller le patient dans l’éventualité d’une réaction anaphylactique suite à l’administration du vaccin.
EFLUELDA TETRA ne doit en aucun cas être administré par voie intravasculaire.
La vaccination doit être différée chez les patients présentant une maladie fébrile aiguë jusqu’à résolution de la fièvre.
Si un syndrome de Guillain-Barré est survenu dans les 6 semaines suivant une vaccination grippale antérieure, la décision d’administrer EFLUELDA TETRA doit se faire sur la base d’une évaluation minutieuse des bénéfices et risques potentiels.
Comme avec les autres vaccins administrés par voie intramusculaire, ce vaccin doit être administré avec précaution chez les patients présentant une thrombocytopénie ou un trouble de la coagulation, car des saignements peuvent survenir suite à une administration intramusculaire chez ces personnes.
Une syncope (évanouissement), en réaction psychogène à l’injection avec une aiguille, peut survenir après, voire avant, toute vaccination. Des mesures doivent être mises en place pour prévenir toute blessure due à l’évanouissement et prendre en charge les réactions syncopales.
La réponse en anticorps chez les patients présentant une immunodépression endogène ou iatrogène peut être insuffisante.
Comme pour tout vaccin, une réponse protectrice peut ne pas être obtenue chez tous les sujets vaccinés.
Ce vaccin contient moins de 1 mmol (23 mg) de sodium par dose, c’est-à-dire qu’il est essentiellement « sans sodium ».
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
Si EFLUELDA TETRA doit être administré en même temps que d’autres vaccins injectables, les injections doivent être pratiquées sur des membres différents.
Il convient de souligner que les effets indésirables peuvent être intensifiés par toute administration concomitante.
La réponse immunitaire peut être réduite si le patient est sous traitement immunosuppresseur.
Après vaccination antigrippale, il a été observé des résultats faussement positifs de tests sérologiques utilisant la méthode ELISA pour détecter les anticorps contre HIV1, hépatite C, et en particulier HTLV1.
La technique Western Blot doit être utilisée pour confirmer ou infirmer les résultats du test ELISA. Les résultats faussement positifs de façon transitoire pourraient être dus à une réponse IgM non spécifique induite par le vaccin.
4.6. Fertilité, grossesse et allaitement
EFLUELDA TETRA est uniquement indiqué chez les personnes âgées de 60 ans et plus.
EFLUELDA TETRA n’a pas été évalué cliniquement chez les femmes enceintes ou allaitantes.
Grossesse
Les vaccins grippaux inactivés à dose standard (15 microgrammes d’hémagglutinine de chaque souche virale par dose) peuvent être utilisés à tous les stades de la grossesse. Les données de sécurité disponibles sont plus importantes pour les deuxième et troisième trimestres de grossesse que pour le premier trimestre. Les données mondiales d’utilisation des vaccins grippaux inactivés à dose standard n’indiquent pas d’issues anormales pour le fœtus et la mère, attribuables au vaccin. Cependant, les données sur l’utilisation chez les femmes enceintes de vaccins grippaux contenant 60 microgrammes d’hémagglutinine de chaque souche virale par dose sont limitées.
EFLUELDA TETRA peut être administré en cas d’allaitement. D'après l'expérience acquise avec les vaccins grippaux à dose standard, aucun effet chez les nourrissons allaités n’est attendu.
Fertilité
Les effets possibles d’EFLUELDA TETRA sur la fertilité humaine n’ont pas été étudiés.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
a. Résumé du profil de tolérance :
Les informations sur les effets indésirables sont basées sur les données provenant de deux essais cliniques réalisés avec EFLUELDA TETRA et sur des données issues d’essais cliniques et de l’expérience après la mise sur le marché du vaccin grippal trivalent (inactivé, à virion fragmenté) Haute Dose (c’est-à-dire contenant 60 microgrammes d’hémagglutinine par souche) (TIV-HD).
La tolérance d’EFLUELDA TETRA a été évaluée dans le cadre d'une analyse poolée de deux essais cliniques (QHD00013 et QHD00011) au cours desquels 2549 sujets âgés de 60 ans et plus (378 âgés entre 60 et 64 ans et 2171 âgés de 65 ans et plus) ont reçu EFLUELDA TETRA.
La réaction indésirable la plus fréquemment rapportée après la vaccination était une douleur au site d'injection, rapportée par 42,6 % des participants, suivie de myalgies (23,8 %), céphalées (17,3 %) et malaise (15,6 %). La majorité de ces réactions sont survenues et se sont résolues dans les trois jours suivant la vaccination. L'intensité de la plupart de ces réactions était légère à modérée.
Dans l'ensemble, les effets indésirables étaient généralement moins fréquents chez les participants âgés de 65 ans et plus que chez les participants âgés de 60 à 64 ans.
La tolérance d’EFLUELDA TETRA (QIV-HD) a été évaluée au cours d’une étude descriptive (QHD00028) au cours de laquelle les sujets ont reçu soit le QIV-HD concomitamment avec une dose de rappel expérimentale de 100 microgrammes de vaccin à ARNm (à nucléoside modifié) contre la COVID-19 (n = 100), soit le QIV-HD uniquement (n = 92), soit une dose de rappel expérimentale de 100 microgrammes du vaccin à ARNm (à nucléoside modifié) contre la COVID-19 uniquement (n = 104). La fréquence et la gravité des effets indésirables locaux et systémiques étaient similaires entre les sujets ayant reçu le vaccin ARNm contre la COVID-19 autorisé concomitamment au QIV-HD et les sujets ayant reçu une dose de rappel du vaccin ARNm contre la COVID-19 autorisé.
b. Liste tabulée des effets indésirables :
Les données ci-dessous résument la fréquence des effets indésirables rapportés après la vaccination par EFLUELDA TETRA et des effets indésirables rapportés au cours du développement clinique et de l’expérience après la mise sur le marché du TIV-HD (marqués par * dans le tableau ci-dessous)
Les effets indésirables sont classés en fonction de leur fréquence selon la convention suivante :
Très fréquent (≥ 1/10) ;
Fréquent (≥ 1/100 à < 1/10) ;
Peu fréquent (≥ 1/1 000 à < 1/100) ;
Rare (≥ 1/10 000 à < 1/1 000) ;
Très rare (< 1/10 000) ;
Fréquence indéterminée (ne peut être estimée sur la base des données disponibles).
|
EFFETS INDÉSIRABLES |
FRÉQUENCE |
|
Troubles généraux et anomalies au site d’administration |
|
|
Douleur au site d’injection, érythème au site d'injection, malaise |
Très fréquent |
|
Gonflement au site d’injection, induration au site d’injection, ecchymose au site d’injection, fièvre (≥ 37,5°C), frissons |
Fréquent |
|
Prurit au site d’injection, fatigue |
Peu fréquent |
|
Asthénie |
Rare |
|
Douleur thoracique |
Fréquence indéterminée* |
|
Affections musculo-squelettiques et systémiques |
|
|
Myalgies |
Très fréquent |
|
Faiblesse musculairea |
Peu fréquent |
|
Arthralgies, douleur aux extrémités |
Rare |
|
Affections du système nerveux |
|
|
Céphalées |
Très fréquent |
|
Léthargiea |
Peu fréquent |
|
Sensation vertigineuse, paresthésie |
Rare |
|
Syndrome de Guillain-Barré (SGB), convulsions, convulsions fébriles, myélite (y compris encéphalomyélite et myélite transverse), paralysie faciale (paralysie de Bell), névrite / neuropathie optique, névrite brachiale, syncope (rapidement après la vaccination) |
Fréquence indéterminée* |
|
Affections hématologiques et du système lymphatique |
|
|
Thrombocytopénie, lymphadénopathie |
Fréquence indéterminée* |
|
Affections respiratoires, thoraciques et médiastinales |
|
|
Toux, douleur oropharyngée |
Peu fréquent |
|
Rhinorrhée |
Rare |
|
Dyspnée, respiration sifflante, oppression dans la gorge |
Fréquence indéterminée* |
|
Affections gastro-intestinales |
|
|
Nausées, vomissements, dyspepsiea, diarrhées |
Peu fréquent |
|
Affections du système immunitaire |
|
|
Prurit, urticaire, sueurs nocturnes, rash |
Rare |
|
Réactions anaphylactiques, autres réactions allergiques / d’hypersensibilité (y compris l’angiœdème) |
Fréquence indéterminée* |
|
Affections vasculaires |
|
|
Rougeur |
Rare |
|
Vascularite, vasodilatation |
Fréquence indéterminée* |
|
Affections de l’oreille et du labyrinthe |
|
|
Vertiges |
Rare |
|
Affections oculaires |
|
|
Hyperémie oculaire |
Rare |
a Dyspepsie, léthargie et faiblesse musculaire ont été observées avec le vaccin grippal trivalent (inactivé, à virion fragmenté) Haute Dose (TIV-HD) au cours de l’essai QHD00013.
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr/.
Des cas d’administration d’une dose plus importante que la dose recommandée (surdosage) ont été rapportés avec le vaccin TIV-HD, lors d’utilisations accidentelles dans la population âgée de moins de 60 ans en raison d’une erreur médicamenteuse. Lorsque des effets indésirables étaient rapportés, ils correspondaient au profil de tolérance connu du vaccin TIV-HD.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Classe pharmacothérapeutique : vaccins contre la grippe, Code ATC : J07BB02.
La vaccination grippale est recommandée de façon annuelle en raison de la durée de l’immunité conférée par le vaccin et parce que les souches circulantes de virus grippal peuvent changer d'une année à l'autre.
Effets pharmacodynamiques
Immunogénicité
Essai QHD00013
Au total, 2 670 personnes âgées de 65 ans et plus ont été randomisées pour recevoir soit une dose d’EFLUELDA TETRA, soit une dose de vaccin TIV-HD (l’une des deux formulations du vaccin comparateur [TIV-HD1 ou TIV-HD2]) ; chaque formulation du vaccin TIV-HD contenait une des deux souches de virus de type B contenues dans le vaccin EFLUELDA TETRA (soit une souche B de la lignée Yamagata, soit une souche B de la lignée Victoria).
Les résultats d’immunogénicité sont résumés dans le Tableau 1.
Tableau 1 : Etude 1a : Analyses de non-infériorité d’EFLUELDA TETRA par rapport au vaccin TIV-HD par la mesure des moyennes géométriques des titres en anticorps (MGTs) par IHA après vaccination, et des taux de séroconversion chez des personnes de 65 ans et plus, dans la population « per-protocole »
|
Souche vaccinale |
|
|
|
|
Conforme aux critères de non-inférioritéf prédéfinis |
||||
|
EFLUELDA TETRA Nc=1 679-1 680 (IC à 95 %) |
Vaccin TIV-HD1d Nc=423 (IC à 95 %) |
Vaccin TIV-HD2e Nc=430 (IC à 95 %) |
EFLUELDA TETRA (IC à 95 %) |
EFLUELDA TETRA Nc=1668-1669 (IC à 95 %) |
Vaccin TIV-HD1d (B1 Victoria) Nc=420-421 (IC à 95 %) |
Vaccin TIV-HD2e (B2 Yamagata) Nc=428 (IC à 95 %) |
EFLUELDA TETRA moins vaccin TIV-HD |
||
|
A (H1N1) g |
312 (292 ; 332) |
374 (341 ; 411) |
0,83 (0,744; 0,932) |
50,4 (48,0 ; 52,8) |
53,7 (50,2 ; 57,1) |
-3,27 (-7,37 ; 0,86) |
Oui |
||
|
A (H3N2) g |
563 (525 ; 603) |
594 (540 ; 653) |
0,95 (0,842 ; 1,066) |
49,8 (47,3 ; 52,2) |
50,5 (47,1 ; 53,9) |
-0,71 (-4,83 ; 3,42) |
Oui |
||
|
B1 (Victoria) |
516 (488 ; 545) |
476 (426 ; 532) |
-- |
1,08 (0,958 ; 1,224) |
36,5 (34,2 ; 38,9) |
39,0 (34,3 ; 43,8) |
-- |
-2,41 (-7,66 ; 2,70) |
Oui |
|
B2 (Yamagata) |
578 (547 ; 612) |
-- |
580 (519 ; 649) |
1,00 (0,881 ; 1,129) |
46,6 (44,2 ; 49,0) |
-- |
48,4 (43,5 ; 53,2) |
-1,75 (-7,04 ; 3,53) |
Oui |
a NCT03282240
b Taux de séroconversion : pour les sujets présentant un titre pré-vaccinal < 10 (1/dil), proportion de sujets présentant un titre post-vaccinal ≥ 40 (1/dil) et pour les sujets présentant un titre prévaccinal ≥ 10 (1/dil), proportion de sujets présentant une multiplication par 4 ou plus du titre pré- à post-vaccinal.
c N est le nombre de participants vaccinés pour lesquels des données sur le critère de jugement immunologique considéré sont disponibles.
d Le vaccin grippal trivalent (inactivé, à virion fragmenté) Haute-Dose 1 (TIV-HD1) contient A/Michigan/45/2015 (H1N1), A/Hong Kong/4801/2014 (H3N2), et B/Brisbane/60/2008 (B1, lignée Victoria).
e Le vaccin grippal trivalent (inactivé, à virion fragmenté) Haute-Dose 2 (TIV-HD2) contient A/Michigan/45/2015 (H1N1), A/Hong Kong/4801/2014 (H3N2), et B/Phuket/3073/2013 (B2, lignée Yamagata).
f Critère prédéfini de non-infériorité pour les taux de séroconversion : la limite inférieure de l’IC à 95 % bilatéral de la différence des taux de séroconversion (EFLUELDA TETRA moins vaccin TIV-HD) est >-10 %. Critère prédéfini de non-infériorité pour le rapport MGT : la limite inférieure de l’IC à 95 % du rapport des MGTs (EFLUELDA TETRA divisé par vaccin TIV-HD) est >0.667.
g Pour la comparaison des souches A, les vaccins TIV-HD1 et TIV-HD2 ont été regroupés dans le groupe vaccin grippal trivalent (inactivé à virion fragmenté) Haute-Dose pour comparaison avec EFLUELDA TETRA.
La démonstration d'une immunogénicité statistiquement comparable entre le vaccin TIV-HD et EFLUELDA TETRA permet de conclure que les résultats des essais d’efficacité clinique et d’efficacité en vie réelle du vaccin TIV-HD s’appliquent à EFLUELDA TETRA.
Essai QHD00011
Un essai clinique de phase 3, randomisé, contrôlé versus un comparateur actif, en double aveugle, a été mené en Europe chez des personnes âgées de 60 ans et plus, pour démontrer la supériorité d’EFLUELDA TETRA par rapport à un vaccin quadrivalent à dose standard (QIV-SD) vis-à-vis de toutes les souches, en comparant la moyenne géométrique des titres en anticorps (MGT) mesurée par inhibition de l’hémagglutination (IHA) au Jour 28 chez les personnes âgées de 60 à 64 ans et chez les personnes âgées de 65 ans et plus.
Au total, 1539 personnes (760 âgées entre 60 et 64 ans et 779 âgées de 65 ans et plus) ont été randomisés pour recevoir soit une dose d’EFLUELDA TETRA, soit une dose de QIV-SD.
Tableau 2 : Etude 2a : Analyses de supériorité d’EFLUELDA TETRA par rapport au vaccin QIV-SD par la mesure des moyennes géométriques des titres en anticorps (MGTs) par IHA après vaccination, chez des personnes âgées de 60 à 64 ans et âgées de 65 ans et plus, Analyse sur toute la population.
|
Souche vaccinale |
Adultes âgés de 60 à 64 ans |
Conforme aux critères de supérioritéc prédéfinis |
Adultes âgés de 65 ans et plus |
Conforme aux critères de supérioritéc prédéfinis |
||||
|
MGT
|
Ratio des MGTs |
MGT
|
Ratio des MGTs |
|||||
|
EFLUELDA TETRA
(IC à 95 %) |
Vaccin QIV-SD Nb=377 (IC à 95 %) |
EFLUELDA TETRA divisé par vaccin |
EFLUELDA TETRA
(IC à 95 %) |
Vaccin QIV-SD Nb=381 (IC à 95 %) |
EFLUELDA TETRA divisé par vaccin |
|||
|
A (H1N1) |
471 (416 ; 533) |
248 (217 ; 283) |
1.90 (1,58 ; 2,28) |
Oui |
286 (250 ; 326) |
162 (139 ; 190) |
1,76 (1,44 ; 2,15)
|
Oui |
|
A (H3N2) |
303 (262 ; 350) |
178 (154 ; 206) |
1,70 (1,38 ; 2,08) |
Oui |
324 (281 ; 374) |
151 (129 ; 176) |
2.15 (1,74 ; 2,65) |
Oui |
|
B1 (Victoria) |
497 (450 ; 548) |
330 (297 ; 367) |
1,51 (1,30 ; 1,74) |
Oui |
405 (366 ; 447) |
262 (236 ; 291) |
1,55 (1,34 ; 1,79)
|
Oui |
|
B2 (Yamagata) |
766 (690 ; 849) |
433 (391 ; 480) |
1,77 (1,53 ; 2,04) |
Oui |
536 (485 ; 592) |
305 (274 ; 340) |
1,76 (1,52 ; 2,03)
|
Oui |
a NCT04024228
b N est le nombre de participants pour lesquels des données sur le critère de jugement considéré sont disponibles.
c La supériorité était démontrée si la limite inférieure de l'IC à 95% bilatéral du rapport des MGTs entre les groupes (EFLUELDA TETRA divisé par vaccin QIV-SD) était > 1 pour chaque souche et dans chaque groupe d'âge
La démonstration d'une immunogénicité statistiquement comparable entre le vaccin TIV-HD et EFLUELDA TETRA chez les personnes âgés de 65 ans et plus (QHD00013) et les réponses immunitaires similaires observées après EFLUELDA TETRA chez les personnes âgés de 60 à 64 ans et chez les personnes âgés de 65 ans et plus (QHD00011) permet de conclure que les résultats des essais d’efficacité clinique et d’efficacité en vie réelle du vaccin TIV-HD s’appliquent à EFLUELDA TETRA à partir de 60 ans.
En outre, EFLUELDA TETRA a induit une réponse immunitaire supérieure aux réponses immunitaires induites par le vaccin QIV-SD pour les 4 souches de virus 28 jours après la vaccination chez les adultes âgés de 60 à 64 ans et chez les adultes âgés de 65 ans et plus.
Efficacité clinique pivot (essai FIM12)
FIM12 est un essai d'efficacité clinique, multicentrique, en double aveugle mené aux États-Unis et au Canada dans lequel des personnes âgées de 65 ans et plus ont été randomisées (1:1) pour recevoir le vaccin TIV-HD ou le vaccin trivalent à dose standard. L'étude a été effectuée pendant deux saisons grippales (2011-2012 et 2012-2013) pour évaluer la survenue d’une grippe confirmée en laboratoire causée par tout type / sous-type du virus de la grippe, associée à un syndrome grippal, comme critère d'évaluation principal.
Les participants ont été suivis pour détecter la survenue d'une maladie respiratoire au travers d’une surveillance active et passive, débutant 2 semaines après la vaccination et pendant une durée d’environ 7 mois. Après un épisode de maladie respiratoire, des échantillons nasopharyngés prélevés par écouvillons ont été analysés ; les taux d'attaque de la grippe et l'efficacité du vaccin ont été mesurés.
Le critère de supériorité statistique prédéfini pour le critère d'évaluation principal (limite inférieure de l'IC à 95 % bilatéral de l'efficacité du vaccin TIV-HD par rapport au vaccin à dose standard > 9,1 %) a été atteint.
|
|
Vaccin trivalent |
Vaccin trivalent |
Efficacité relative |
|
Grippe confirmée en laboratoired causée par : |
|||
|
Tout type / sous-type de virus grippale |
227 (1,43) |
300 (1,89) |
24,2 (9,7 ; 36,5) |
|
Des souches virales similaires à celles contenues dans le vaccin |
73 (0,46) |
113 (0,71) |
35,3 (12,4 ; 52,5) |
a Syndrome grippal : survenue d’au moins un des symptômes respiratoires suivants : gorge irritée, toux, production d’expectorations, respiration sifflante, ou difficulté à respirer ; associé simultanément à au moins l’un des signes ou symptômes généraux suivants : température >37,2°C, frissons, fatigue, céphalées ou myalgie.
b N est le nombre de participants vaccinés soumis à l’analyse per-protocole pour l’évaluation de l’efficacité.
c n est le nombre de participants atteints d’un syndrome grippal défini par le protocole et confirmés en laboratoire.
d Confirmée en laboratoire : par la culture ou par la réaction en chaîne par polymérase
e Critère d’évaluation principal
Etudes d’efficacité en vie réelle :
Un essai clinique contrôlé, randomisé en clusters mené dans des maisons de retraites aux États-Unis a évalué l’efficacité relative du vaccin grippal trivalent (inactivé à virion fragmenté) Haute Dose (TIV-HD), par rapport au vaccin trivalent à dose standard dans la prévention des hospitalisations parmi 53 008 individus pendant la saison grippale 2013-2014.
Pendant la saison 2013-2014, l’incidence des hospitalisations liées à un trouble respiratoire (critère d’évaluation principal) a été réduite de façon significative de 12,7 % (risque relatif ajusté [RRA] = 0,873, IC à 95 % 0,776 ; 0,982, p=0,023) dans les établissements où les résidents ont reçu un vaccin TIV-HD par rapport à ceux qui ont reçu un vaccin grippal à dose standard. De plus, en ce qui concerne les critères d’évaluation secondaires, le vaccin TIV-HD a réduit de 20,9 % les hospitalisations pour pneumonie (RRA 0,791, IC à 95 % : 0,267 ; 0,953, p=0,013), et de 8 % les hospitalisations toutes causes confondues (RRA = 0,915, IC à 95 % : 0,863 ; 0,970, p=0,0028) par rapport à un vaccin grippal à dose standard.
Etudes observationnelles
Plusieurs études rétrospectives, réalisées au cours de 8 saisons de grippe et chez plus de 24 millions d’individus âgés de 65 ans et plus, ont confirmé la supériorité de la protection conférée par le vaccin TIV-HD par rapport au vaccin grippal à dose standard, contre les complications de la grippe telles que les hospitalisations pour grippe ou pneumonie (13,4 % (IC à 95 %: 7,3 % ; 19,2 %, p<0,001)), les hospitalisations pour événements cardiovasculaires ou respiratoires (17,9 % (IC à 95 % : 14,9 % ; 20,9 %, p<0,001)) et les hospitalisations « toutes causes confondues » (8,1 % (IC à 95 % : 5,9 % ; 10,3 %, p<0,001)) ; même si l’impact peut varier selon la saison.
Administration concomitante avec le vaccin à ARNm (à nucléoside modifié) contre la COVID-19
Au cours d’une étude clinique descriptive en ouvert (NCT04969276), des adultes âgés de 65 ans et plus, en bonne santé, ont été répartis en trois groupes : le groupe 1 a reçu EFLUELDA TETRA seul ( N=92), le groupe 2 (N=100) a reçu EFLUELDA TETRA concomitamment à une dose de rappel expérimentale de 100 microgrammes du vaccin à ARNm (à nucléoside modifié) contre la COVID-19 au moins 5 mois après la seconde dose de la primovaccination, le Groupe 3 (N=104) a reçu uniquement la dose de rappel expérimentale de 100 microgrammes du vaccin à ARNm (à nucléoside modifié) contre la COVID-19.
La co-administration n'a provoqué aucune modification des réponses immunitaires au vaccin contre la grippe, mesurées par le test d'inhibition de l'hémagglutination (HAI). La co-administration a entraîné des réponses similaires au vaccin ARNm contre la COVID-19, évaluées par un dosage des IgG anti-spike (voir rubriques 4.5 et 4.8).
5.2. Propriétés pharmacocinétiques
5.3. Données de sécurité préclinique
Le potentiel cancérogène ou mutagène d’EFLUELDA TETRA et ses effets sur les fonctions de reproduction et de développement n’ont pas été évalués.
· Solution de chlorure de sodium isotonique tamponnée au phosphate de sodium
o Chlorure de sodium
o Phosphate de sodium monobasique
o Phosphate de sodium dibasique
o Eau pour préparations injectables
· Octoxinol-9.
12 mois.
6.4. Précautions particulières de conservation
6.5. Nature et contenu de l'emballage extérieur
0,7 mL de suspension en seringue préremplie (verre de type I) munie d’un bouchon-piston (élastomère bromobutyle) et d’un capuchon de protection.
Boîte de 1, 5 ou 10. seringue(s) préremplie(s) sans aiguilles.
Boîte de 1, 5 ou 10. seringue(s) préremplie(s) avec aiguille(s) séparée(s) (acier inoxydable).
Boîte de 1 ou 10. seringue(s) préremplie(s) avec aiguille(s) séparée(s) (acier inoxydable) avec un bouclier de sécurité (polycarbonate).
Toutes les présentations peuvent ne pas être commercialisées.
6.6. Précautions particulières d’élimination et de manipulation
Le vaccin doit être amené à température ambiante avant utilisation.
Agiter avant emploi.
Le vaccin doit être inspecté visuellement pour détecter la présence de particules et / ou un changement de couleur avant administration chaque fois que la solution et le conditionnement le permettent. Le vaccin ne doit pas être utilisé si des particules ou un changement de couleur sont observés.
Préparation pour administration :
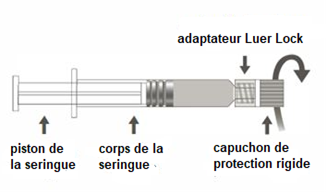
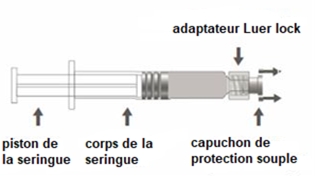
La seringue préremplie peut être fournie avec un Luer Lock et un capuchon de protection rigide (Figure A) ou souple (Figure D). La seringue contenant la suspension injectable doit être inspectée visuellement avant administration. En cas de présence de particules étrangères, de fuite, d'activation prématurée du piston ou d'embout défectueux, jetez la seringue préremplie.
Figure A : seringue Luer Lock avec un capuchon de protection rigide
|
|
|
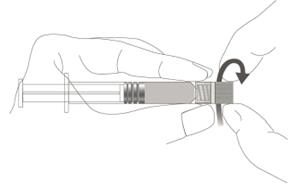
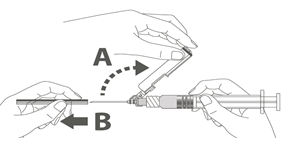
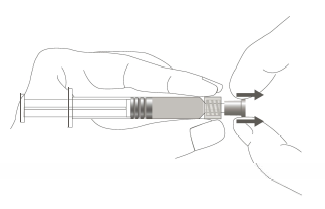
Étape 1 : En tenant l’adaptateur Luer lock d’une main (éviter de tenir le piston ou le corps de la seringue), dévisser le capuchon de protection en le tournant. |
|
|
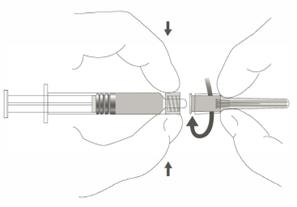
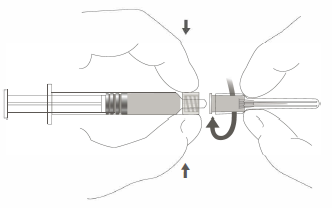
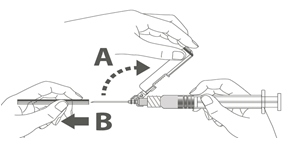
Étape 2 : Pour fixer l’aiguille à la seringue, visser doucement l’aiguille à l’adaptateur Luer lock jusqu’à sentir une légère résistance. |
|
Instructions d’utilisation de l'aiguille sécurisée avec la seringue préremplie Luer Lock :
Suivre les étapes 1 et 2 ci-dessus pour préparer la seringue Luer Lock et la fixation de l’aiguille.
|
Figure B : Aiguille sécurisée (à l’intérieur de la coque) |
Figure C : Composants de l’aiguille sécurisée (préparée pour l’utilisation) |
|
|
|
|
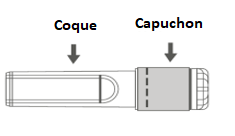
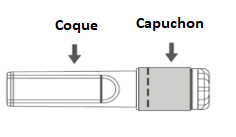
Étape 3 : Retirer la coque de l’aiguille sécurisée en tirant tout droit. L’aiguille est recouverte par le bouclier de sécurité et le protège-aiguille. |
|
|
Étape 4 : A : soulever le bouclier de sécurité en l’écartant de l’aiguille et en le poussant vers le corps de la seringue selon l’angle indiqué. B : Retirez le protège-aiguille en tirant tout droit. |
|
|
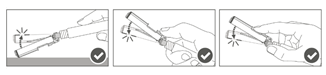
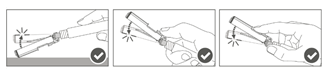
Étape 5 : Une fois l'injection terminée, verrouiller (activer) avec une seule main le bouclier de sécurité à l'aide de l'une des trois (3) techniques illustrées : activation à l’aide d’une surface, du pouce ou de l’index. Remarque : L'activation est vérifiée par un « clic » sonore et/ou tactile. |
|
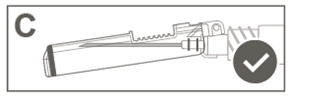
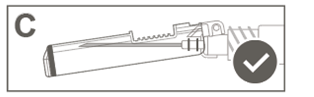
|
Étape 6: Inspecter visuellement l’activation du bouclier de sécurité. Le bouclier de sécurité doit être entièrement verrouillé (activé), comme indiqué sur l’image C. |
|
|
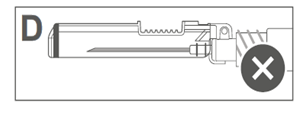
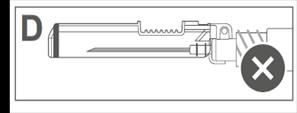
L’image D indique que le bouclier de sécurité n'est PAS complètement verrouillé (non activé). |
|
|
Attention : Ne pas essayer de déverrouiller (désactiver) le dispositif de sécurité en forçant l'aiguille à sortir du bouclier de sécurité. |
Figure D : seringue Luer Lock avec un capuchon de protection souple
|
|
|
Étape 1 : En tenant l’adaptateur Luer lock d'une main (éviter de tenir le piston ou le corps de la seringue), retirer le capuchon de protection souple. |
|
|
Étape 2 : Pour fixer l’aiguille à la seringue, visser doucement l’aiguille à l’adaptateur Luer lock jusqu’à sentir une légère résistance |
|
La seringue est destinée à un usage unique et ne doit pas être réutilisée. Tout médicament non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
82 AVENUE RASPAIL
94250 GENTILLY
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· 34009 302 053 7 2 : 0,7 mL de suspension en seringue préremplie (verre) sans aiguille, munie d’un bouchon-piston (Bromobutyle) et d’un capuchon de protection, Boîte de de 1.
· 34009 302 053 8 9 : 0,7 mL de suspension en seringue préremplie (verre) sans aiguille, munie d’un bouchon-piston (Bromobutyle) et d’un capuchon de protection, Boîte de de 5.
· 34009 302 053 9 6 : 0,7 mL de suspension en seringue préremplie (verre) sans aiguille, munie d’un bouchon-piston (Bromobutyle) et d’un capuchon de protection, Boîte de de 10.
· 34009 302 054 0 2 : 0,7 mL de suspension en seringue préremplie (verre) avec aiguille séparée, munie d’un bouchon-piston (Bromobutyle) et d’un capuchon de protection, Boîte de de 1.
· 34009 302 054 1 9 : 0,7 mL de suspension en seringue préremplie (verre) avec aiguille séparée, munie d’un bouchon-piston (Bromobutyle) et d’un capuchon de protection, Boîte de de 5.
· 34009 302 888 1 8 : 0,7 mL de suspension en seringue préremplie (verre) avec aiguille séparée, munie d’un bouchon-piston (Bromobutyle) et d’un capuchon de protection, avec un bouclier de sécurité. Boîte de de 1.
· 34009 302 888 2 5 : 0,7 mL de suspension en seringue préremplie (verre) avec aiguille séparée, munie d’un bouchon-piston (Bromobutyle) et d’un capuchon de protection, avec un bouclier de sécurité. Boîte de de 10.
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
[à compléter ultérieurement par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE
[à compléter ultérieurement par le titulaire]
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Médicament non soumis à prescription médicale.
ANSM - Mis à jour le : 04/07/2025
EFLUELDA TETRA, suspension injectable en seringue préremplie
Vaccin grippal quadrivalent (inactivé, à virion fragmenté), 60 microgrammes HA/souche
![]() Ce médicament fait l’objet d’une surveillance supplémentaire qui permettra l’identification rapide de nouvelles informations relatives à la sécurité. Vous pouvez y contribuer en signalant tout effet indésirable que vous observez. Voir en fin de rubrique 4 comment déclarer les effets indésirables.
Ce médicament fait l’objet d’une surveillance supplémentaire qui permettra l’identification rapide de nouvelles informations relatives à la sécurité. Vous pouvez y contribuer en signalant tout effet indésirable que vous observez. Voir en fin de rubrique 4 comment déclarer les effets indésirables.
Veuillez lire attentivement cette notice avant de vous faire vacciner car elle contient des informations importantes pour vous.
· Gardez cette notice. Vous pourriez avoir besoin de la relire.
· Si vous avez d’autres questions, interrogez votre médecin, votre pharmacien ou votre infirmier/ère.
· Ce médicament vous a été personnellement prescrit. Ne le donnez pas à d’autres personnes.
· Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin, votre pharmacien ou votre infirmier/ère. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
1. Qu'est-ce que EFLUELDA TETRA, suspension injectable en seringue préremplie et dans quels cas est-il utilisé ?
2. Quelles sont les informations à connaître avant d'utiliser EFLUELDA TETRA, suspension injectable en seringue préremplie ?
3. Comment utiliser EFLUELDA TETRA, suspension injectable en seringue préremplie ?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver EFLUELDA TETRA, suspension injectable en seringue préremplie ?
6. Contenu de l’emballage et autres informations.
1. QU’EST-CE QUE EFLUELDA TETRA, suspension injectable en seringue préremplie ET DANS QUELS CAS EST-IL UTILISE ?
Classe pharmacothérapeutique : Vaccins contre la grippe, Code ATC : J07BB02.
EFLUELDA TETRA est un vaccin. Ce vaccin aide à protéger les personnes âgées de 60 ans et plus de la grippe. EFLUELDA TETRA doit être utilisé selon les recommandations officielles.
Lorsqu’une personne reçoit EFLUELDA TETRA, le système immunitaire (le système de défense naturelle de l’organisme) développe sa propre protection (anticorps) contre la maladie. Aucun des composants du vaccin ne peut causer la grippe.
La grippe est une maladie respiratoire contagieuse, causée par différentes souches du virus de la grippe, pouvant provoquer une maladie modérée à sévère, et entrainer des complications sévères comme une pneumonie. Ces complications peuvent conduire à une hospitalisation ou même un décès. La grippe est une maladie qui peut se propager rapidement et qui est causée par différentes souches de virus grippal qui peuvent changer tous les ans. En raison du changement potentiel des souches circulant chaque année et de la durée de protection conférée par le vaccin, il est recommandé de se faire vacciner tous les ans. Le plus grand risque de contracter la grippe se situe pendant les mois les plus froids, entre octobre et mars. Si vous n'avez pas été vacciné durant l'automne, il est encore possible de l’être jusqu'au printemps car vous courez le risque de contracter la grippe jusqu'à cette période. Votre médecin pourra vous recommander le meilleur moment pour vous faire vacciner.
EFLUELDA TETRA est destiné à vous protéger contre les quatre souches de virus contenues dans le vaccin, environ 2 à 3 semaines après l’injection. De plus, si vous êtes exposé tout de suite avant ou après la vaccination, vous pouvez encore déclarer la maladie, la période d’incubation de la grippe étant de quelques jours.
Le vaccin ne vous protègera pas des rhumes, même si certains des symptômes ressemblent à ceux de la grippe.
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT D’UTILISER EFLUELDA TETRA, suspension injectable en seringue préremplie ?
N’utilisez jamais EFLUELDA TETRA, suspension injectable en seringue préremplie :
Si vous êtes allergique :
· aux substances actives, ou
· à l’un des autres composants de ce vaccin (mentionnés dans la rubrique 6), ou
· à tout constituant pouvant être présent en très petites quantités comme les œufs (ovalbumine, protéines de poulet), le formaldéhyde.
Avertissements et précautions
Adressez-vous à votre médecin, votre pharmacien ou votre infirmier/ère avant d’utiliser EFLUELDA TETRA.
Avant la vaccination, vous devez dire à votre médecin si vous :
· souffrez d’une faible réponse immunitaire (immunodéficience ou prise de médicaments affectant le système immunitaire),
· souffrez de troubles de la coagulation ou êtes facilement sujet aux bleus.
· avez présenté un syndrome de Guillain-Barré (SGB) (faiblesse musculaire intense) après avoir reçu un vaccin grippal,
· avez une maladie avec une température élevée ou modérée ou une maladie aiguë, la vaccination doit être différée après la guérison.
Votre médecin décidera si vous devez être vacciné.
Un évanouissement peut survenir après, voire avant, toute injection avec une aiguille. Aussi, parlez-en à votre médecin ou votre infirmier/ère si vous vous êtes évanoui lors d'une précédente injection.
Comme pour tous les vaccins, EFLUELDA TETRA peut ne pas protéger complètement toutes les personnes vaccinées.
Si, pour quelque raison que ce soit, vous faites une analyse de sang dans les quelques jours qui suivent la vaccination grippale, parlez-en à votre médecin. En effet, des résultats de tests faussement positifs ont été observés chez quelques patients qui avaient été récemment vaccinés.
Enfants
Ce vaccin ne doit pas être utilisé chez les enfants, il est uniquement destiné aux personnes âgées de 60 ans et plus.
Autres médicaments et EFLUELDA TETRA, suspension injectable en seringue préremplie
Informez votre médecin ou votre pharmacien si vous prenez, avez récemment pris ou pourriez prendre tout autre vaccin ou tout autre médicament.
· EFLUELDA TETRA peut être administré en même temps que d’autres vaccins, mais sur des membres différents.
· Les effets indésirables peuvent être intensifiés lors de toute administration concomitante.
· La réponse immunologique peut être diminuée en cas de traitements immunosuppresseurs tels que les corticostéroïdes, les médicaments cytotoxiques ou la radiothérapie.
Sans objet.
Grossesse et allaitement
EFLUELDA TETRA est indiqué uniquement chez les personnes âgées de 60 ans et plus.
Si vous êtes enceinte ou que vous allaitez, si vous pensez être enceinte ou planifiez une grossesse, demandez conseil à votre médecin ou pharmacien avant de prendre ce médicament. Votre médecin/pharmacien sera en mesure de décider si vous devez recevoir EFLUELDA TETRA.
Conduite de véhicules et utilisation de machines
EFLUELDA TETRA n’a aucun effet ou un effet négligeable sur l’aptitude à conduire des véhicules et à utiliser des machines. Toutefois, si vous vous sentez mal ou étourdi, vous ne devez pas conduire.
EFLUELDA TETRA, suspension injectable en seringue préremplie contient du sodium
Ce médicament contient moins de 1 mmol (23 mg) de sodium par dose, c'est-à-dire qu’il est pratiquement « sans sodium ».
3. COMMENT UTILISER EFLUELDA TETRA, suspension injectable en seringue préremplie ?
Les personnes âgées de 60 ans et plus reçoivent une dose de 0,7 mL.
Comment EFLUELDA TETRA est administré
Votre médecin, votre pharmacien ou votre infirmier/ère administrera la dose recommandée de vaccin par une injection dans le muscle ou sous la peau.
Si vous avez utilisé plus de EFLUELDA TETRA, suspension injectable en seringue préremplie que vous n’auriez dû
Sans objet.
Si vous oubliez d’utiliser EFLUELDA TETRA, suspension injectable en seringue préremplie
Si vous arrêtez d’utiliser EFLUELDA TETRA, suspension injectable en seringue préremplie
Sans objet.
Si vous avez d’autres questions sur l’utilisation de ce produit, demandez plus d’informations à votre médecin ou à votre pharmacien.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
Réactions allergiques
Consultez immédiatement un médecin si vous présentez :
· Des réactions allergiques sévères :
o pouvant conduire à une urgence médicale avec une tension basse, essoufflement, respiration sifflante ou difficulté à respirer, un rythme cardiaque rapide et un pouls lent, une peau froide et moite, des vertiges, pouvant entraîner un choc (anaphylaxie, pouvant inclure angiœdème, c'est-à-dire un gonflement situé le plus souvent au niveau de la tête et du cou y compris le visage, les lèvres, la langue, la gorge ou toute autre partie du corps et pouvant entraîner des difficultés à avaler ou à respirer).
Consultez un médecin si vous présentez :
o Des réactions allergiques telles que des réactions cutanées qui peuvent s’étendre sur tout le corps incluant démangeaisons, urticaire, éruption.
Ces effets indésirables sont rares (pouvant affecter jusqu’à une personne sur 1000).
Autres effets indésirables rapportés
Les effets indésirables ci-dessous ont été rapportés chez des personnes âgées de 60 ans et plus.
Très fréquents (pouvant affecter plus d’une personne sur 10) :
· Réactions au site d’injection : douleur, rougeur (érythème).
· Sensation de malaise général, maux de tête, douleurs musculaires (myalgies).
Fréquents (pouvant affecter jusqu’à une personne sur 10) :
· Réactions au site d’injection : gonflement, bleus (ecchymoses), durcissement (induration).
· Fièvre, frissons (tremblements).
Peu fréquents (pouvant affecter jusqu’à une personne sur 100) :
· Réaction au site d’injection : prurit.
· Fatigue, léthargie, nausées, vomissements, diarrhées.
· Toux, faiblesse musculaire, indigestion (dyspepsie), inflammation de la gorge et du nez (douleur oropharyngée).
Rare (pouvant affecter jusqu’à une personne sur 1000) :
· Fatigue et faiblesse inhabituelles (asthénie), rougeur, douleurs articulaires (arthralgies), sensation vertigineuse, sueurs nocturnes, rash, engourdissements ou sensation de fourmillement ou de picotement (paresthésie), inflammation du nez (rhinorrhée), vertiges, excès de sang dans le blanc de l’œil (hyperémie oculaire).
· Douleurs aux extrémités.
Fréquence indéterminée (ne peut être estimée sur la base des données disponibles) :
· Réduction du nombre de certains éléments du sang appelés plaquettes : un faible nombre de celles-ci peut se traduire par des bleus ou saignements excessifs (thrombocytopénie).
· Gonflement des glandes du cou, de l’aisselle ou de l’aine (lymphadénopathie).
· Troubles neurologiques pouvant se traduire par une raideur de la nuque, de la confusion, des engourdissements, des douleurs et une faiblesse des membres, une perte d’équilibre, une perte des réflexes, une paralysie d’une partie ou de tout le corps (encéphalomyélite et myélite transverse, névrite brachiale et syndrome de Guillain-Barré), une paralysie faciale (paralysie de Bell), des troubles visuels dus à une dysfonction des nerfs optiques (névrite/neuropathie optique), une crise (convulsions incluant des convulsions fébriles), un évanouissement (syncope) rapidement après la vaccination.
· Inflammation des vaisseaux sanguins (vascularite) pouvant se traduire par des éruptions cutanées et dans de très rares cas par des problèmes rénaux transitoires, la dilatation des vaisseaux sanguins (vasodilatation).
· Douleur thoracique.
· Respiration sifflante, oppression dans la gorge, difficultés à respirer (dyspnée).
La plupart des effets indésirables sont en général survenus dans les 3 jours suivant la vaccination, et se sont résolus dans les 3 jours. L’intensité de ces effets indésirables était légère à modérée.
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou, votre pharmacien ou à votre infirmier/ère. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr/
En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.
5. COMMENT CONSERVER EFLUELDA TETRA, suspension injectable en seringue préremplie ?
Tenir ce vaccin hors de la vue et de la portée des enfants.
N’utilisez pas ce vaccin après la date de péremption indiquée sur l’étiquette et sur la boîte après EXP. La date de péremption fait référence au dernier jour de ce mois.
A conserver au réfrigérateur (entre 2°C et 8°C). Ne pas congeler. Conserver la seringue dans l’emballage extérieur à l’abri de la lumière.
Ne jetez aucun médicament au tout-à-l’égout ou avec les ordures ménagères. Demandez à votre pharmacien d’éliminer les médicaments que vous n’utilisez plus. Ces mesures contribueront à protéger l’environnement.
6. CONTENU DE L’EMBALLAGE ET AUTRES INFORMATIONS
Ce que contient EFLUELDA TETRA, suspension injectable en seringue préremplie
· Les substances actives sont : Virus de la grippe (inactivé, fragmenté) des souches suivantes* :
A/Victoria/4897/2022 (H1N1)pdm09-souche analogue (A/Victoria/4897/2022, IVR-238)...................
.............................................................................................................. 60 microgrammes HA**
A/Croatia/10136RV/2023 (H3N2)-souche analogue (A/Croatia/10136RV/2023, X-425A) ..................
.............................................................................................................. 60 microgrammes HA**
B/Austria/1359417/2021-souche analogue (B/Michigan/01/2021, type sauvage).............................
.............................................................................................................. 60 microgrammes HA**
B/Phuket/3073/2013-souche analogue (B/Phuket/3073/2013, type sauvage) .................................
.............................................................................................................. 60 microgrammes HA**
Pour une dose de 0,7 mL.
* cultivées sur œufs embryonnés de poules
** hémagglutinine
Ce vaccin est conforme aux recommandations de l'OMS (Organisation Mondiale de la Santé) (dans l'Hémisphère Nord) et à la décision de l’UE pour la saison 2025/2026.
· Les autres composants sont : une solution tampon contenant du chlorure de sodium, du phosphate de sodium monobasique, du phosphate de sodium dibasique, de l'eau pour préparations injectables et de l’octoxinol-9.
Des constituants tels que les œufs (ovalbumine, protéines de poulet) ou le formaldéhyde peuvent être présents en très petites quantités (voir rubrique 2).
Le vaccin, après avoir été agité doucement, est un liquide incolore et opalescent.
EFLUELDA TETRA est une suspension injectable qui se présente sous forme de seringue préremplie de 0,7 mL, sans aiguille ou avec aiguille (en boîte de 1, 5 ou 10), ou avec aiguille sécurisée (en boite de 1 ou 10).
Toutes les présentations peuvent ne pas être commercialisées.
Titulaire de l’autorisation de mise sur le marché
82 AVENUE RASPAIL
94250 GENTILLY
Exploitant de l’autorisation de mise sur le marché
SANOFI WINTHROP INDUSTRIE
82 AVENUE RASPAIL
94250 GENTILLY
VOIE DE L’INSTITUT
PARC INDUSTRIEL D’INCARVILLE
B.P 101
27100 VAL DE REUIL
Noms du médicament dans les Etats membres de l'Espace Economique Européen
Ce médicament est autorisé dans les Etats membres de l'Espace Economique Européen sous les noms suivants : Conformément à la réglementation en vigueur.
[À compléter ultérieurement par le titulaire]
La dernière date à laquelle cette notice a été révisée est :
[à compléter ultérieurement par le titulaire]
< {MM/AAAA}>< {mois AAAA}.>
Des informations détaillées sur ce médicament sont disponibles sur le site Internet de l’ANSM (France).
Les informations suivantes sont destinées exclusivement aux professionnels de santé :
Comme pour tous les vaccins injectables, il est recommandé de toujours disposer d'un traitement médical approprié et de surveiller le sujet dans l'éventualité d'une réaction anaphylactique suite à l'administration du vaccin.
Le vaccin doit être amené à température ambiante avant utilisation.
Agiter avant emploi. Inspecter visuellement avant d’administrer.
Le vaccin ne doit pas être utilisé si des particules étrangères sont présentes dans la suspension.
Il ne doit pas être mélangé avec d’autres médicaments dans la même seringue.
Ce vaccin ne doit pas être injecté directement dans un vaisseau sanguin.
Voir également la rubrique 3. Comment utiliser EFLUELDA TETRA, suspension injectable en seringue préremplie ?
<Préparation et administration :
Instructions d’utilisation de l'aiguille sécurisée avec la seringue préremplie Luer Lock :
|
Figure A : Aiguille sécurisée (à l’intérieur de la coque) |
Figure B : Composants de l’aiguille sécurisée (préparée pour l’utilisation) |
|
|
|
|
|
|
Étape 1 : Pour fixer l’aiguille à la seringue, retirer le capuchon pour exposer l’embase de l'aiguille et visser doucement l’aiguille à l’adaptateur Luer lock jusqu’à sentir une légère résistance. |
||
|
Étape 2 : Retirer la coque de l’aiguille sécurisée en tirant tout droit. L’aiguille est recouverte par le bouclier de sécurité et le protège-aiguille. |
||
|
Étape 3 : A : soulever le bouclier de sécurité en l’écartant de l’aiguille et en le poussant vers le corps de la seringue selon l’angle indiqué. B : Retirez le protège-aiguille en tirant tout droit. |
|
|
|
Étape 4 : Une fois l’injection terminée, verrouiller (activer) avec une seule main le bouclier de sécurité à l'aide de l'une des trois (3) techniques illustrées : activation à l’aide d’une surface, du pouce ou de l’index. Remarque : L'activation est vérifiée par un « clic » sonore et/ou tactile. |
|
|
|
Étape 5: Inspecter visuellement l’activation du bouclier de sécurité. Le bouclier de sécurité doit être entièrement verrouillé (activé), comme indiqué sur l’image C.
L’image D indique que le bouclier de sécurité n'est PAS complètement verrouillé (non activé) |
|
|
|
|
||
|
Attention : Ne pas essayer de déverrouiller (désactiver) le dispositif de sécurité en forçant l'aiguille à sortir du bouclier de sécurité. |
Tout médicament non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.>