Dernière mise à jour le 06/11/2025
DECAPEPTYL L.P. 11,25 mg, poudre et solvant pour suspension injectable (IM ou SC) forme à libération prolongée sur 3 mois
Indications thérapeutiques
Ce médicament contient de la triptoréline. La triptoréline appartient à un groupe de médicaments connus sous le nom d’analogues de l’hormone entraînant la libération de gonadotrophines (GnRH). L’une de ses actions est de diminuer la production d’hormones sexuelles dans le corps.
Ce médicament est un analogue d’une hormone naturelle.
Il est utilisé :
Chez l’homme adulte :
· dans le traitement du cancer de la prostate localement avancé ou métastatique (étendu à d’autres parties du corps).
· dans le traitement du cancer de la prostate localisé à haut risque ou localement avancé, en association à la radiothérapie.
Chez la femme :
· dans le traitement de l’endométriose.
Chez l’enfant :
· dans le traitement de la puberté qui survient prématurément, c’est-à-dire avant 8 ans chez les filles et 10 ans chez les garçons (puberté précoce centrale).
Présentations
> 1 flacon(s) en verre de poudre - 1 ampoule(s) en verre de 2 ml de solvant avec 1 seringue(s) avec 3 aiguille(s)
Code CIP : 341 256-5 ou 34009 341 256 5 2
Déclaration de commercialisation : 19/02/1997
Cette présentation est agréée aux collectivités
- Prix hors honoraire de dispensation : 282,18 €
- Honoraire de dispensation : 1,02 €
- Prix honoraire compris : 283,20 €
- Taux de remboursement :65%
- Cancer de la prostate (dans certains cas seulement)
- Endométriose
- Puberté précoce ; JOURNAL OFFICIEL ; 13/04/16
Service médical rendu (SMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprès de la HAS (plus d'informations dans l'aide). Les avis et synthèses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur du SMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| Important | Avis du 25/07/2018 | Extension d'indication | Le service médical rendu par les spécialités DECAPEPTYL LP 3 mg, 11,25 mg et 22,5 mg est important, en association avec la radiothérapie dans le traitement du cancer de la prostate localisé à haut risque. |
| Important | Avis du 16/03/2016 | Renouvellement d'inscription (CT) | Le service médical rendu par les spécialités DECAPEPTYL reste important dans les indications de leur AMM. |
Amélioration du service médical rendu (ASMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprés de la HAS (plus d'informations dans l'aide). Les avis et synthéses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur de l'ASMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| V (Inexistant) | Avis du 25/07/2018 | Extension d'indication | Les spécialités DECAPEPTYL LP 3 mg, 11,25 mg et 22,5 mg, en association avec la radiothérapie, n’apportent pas d’amélioration du service médical rendu (ASMR V) dans la prise charge du cancer de la prostate localisé à haut risque. Pour rappel, cette prise en charge comprend les autres analogues de la GnRH mentionnés dans la rubrique « 06. Comparateurs cliniquement pertinents » de cet avis. |
| V (Inexistant) | Avis du 21/10/2015 | Extension d'indication | DECAPEPTYL LP 11,25mg n’apporte pas d’amélioration du service médical rendu (ASMR V) par rapport aux autres analogues de la GnRH. |
| V (Inexistant) | Avis du 12/04/2006 | Extension d'indication | DECAPEPTYL LP n’apporte pas d’amélioration du service médical rendu (ASMR de niveau V) par rapport aux autres spécialités à base d’un analogue de la GnRH indiquées dans le traitement du cancer de la prostate à un stade localement avancé. |
ANSM - Mis à jour le : 11/06/2025
DECAPEPTYL L.P. 11,25 mg, poudre et solvant pour suspension injectable (IM ou SC) forme à libération prolongée sur 3 mois
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Triptoréline (sous forme de pamoate de triptoréline).......................................................... 11,25 mg*
Pour une unité de prise
* Compte tenu des caractéristiques de la forme pharmaceutique, chaque flacon contient une quantité de pamoate de triptoréline correspondant à 15 mg de triptoréline.
Pour la liste complète des excipients, voir rubrique 6.1.
Poudre et solvant pour suspension injectable (IM ou SC) à libération prolongée.
4.1. Indications thérapeutiques
Traitement du cancer de la prostate localement avancé ou métastatique.
Traitement du cancer de la prostate localisé à haut risque ou localement avancé, en association à la radiothérapie. Voir rubrique 5.1.
Un effet favorable du médicament est d'autant plus net et plus fréquent que le patient n'a pas reçu auparavant un autre traitement hormonal.
· Endométriose à localisation génitale et extragénitale (du stade I au stade IV)
La durée du traitement est limitée à 6 mois (voir rubrique 4.8). Il n'est pas souhaitable d'entreprendre une seconde cure par la triptoréline ou par un autre analogue de la GnRH.
· Puberté précoce centrale (avant 8 ans chez la fille, avant 10 ans chez le garçon).
4.2. Posologie et mode d'administration
Posologie
Une injection intramusculaire ou sous-cutanée de DECAPEPTYL L.P. 11,25 mg renouvelée toutes les 3 mois.
Durée du traitement :
Dans le traitement du cancer de la prostate hormonodépendant localisé à haut risque ou localement avancé, en traitement concomitant et adjuvant à la radiothérapie, les données cliniques ont montré que la radiothérapie suivie par un traitement de privation androgénique longue était préférable à une radiothérapie suivie par une privation androgénique courte. Voir rubrique 5.1.
La durée du traitement de privation androgénique recommandée par les recommandations cliniques pour les patients avec un cancer de la prostate localisé à haut risque, ou localement avancé, recevant une radiothérapie est de 2 à 3 ans.
Chez les patients atteints d’un cancer de la prostate métastatique résistant à la castration, non castrés chirurgicalement, traités par un agoniste de la GnRH, comme la triptoréline, et éligibles à un traitement par l’acétate d’abiratérone, un inhibiteur de la biosynthèse des androgènes ou l’enzalutamide, un inhibiteur de la voie de signalisation des récepteurs aux androgènes, le traitement par un agoniste de la GnRH doit être poursuivi.
· Endométriose :
Une injection intramusculaire de DECAPEPTYL L.P. 11,25 mg renouvelée tous les 3 mois.
L’administration sous-cutanée n’a pas été étudiée chez la femme.
Le traitement doit être débuté dans les 5 premiers jours du cycle.
Durée du traitement : elle dépend de la gravité initiale de l'endométriose et de l'évolution sous traitement de ses manifestations cliniques (fonctionnelles et anatomiques). La durée du traitement est limitée à 6 mois (voir rubrique 4.8). Il n'est pas souhaitable d'entreprendre une deuxième cure par la triptoréline ou par les autres analogues de la GnRH. Chez les patientes avec une endométriose traitée par les analogues de la GnRH, il a été montré que l’ajout d’une add-back thérapie (ABT – comportant un œstrogène et un progestatif) réduisait la perte de densité minérale osseuse et les symptômes vasomoteurs. Par conséquent, le cas échéant, l’ABT doit être administrée en association à l’analogue de la GnRH en tenant compte des risques et des bénéfices de chaque traitement.
· Puberté précoce centrale :
Le traitement des enfants par la triptoréline doit se faire sous la surveillance générale d'un endocrino-pédiatre, d'un pédiatre ou d’un endocrinologue ayant une expertise dans le traitement de la puberté précoce centrale.
Enfants de plus de 20 kg de poids corporel : une injection intramusculaire de DECAPEPTYL LP 11,25 mg administrée tous les 3 mois.
Le traitement doit être arrêté vers l'âge physiologique de la puberté chez les garçons et les filles et il est recommandé de ne pas poursuivre le traitement chez les filles ayant un âge osseux supérieur à 12-13 ans. Chez les garçons, il existe peu de données disponibles concernant l’âge osseux optimal pour arrêter le traitement. Toutefois, il est recommandé d’arrêter le traitement chez les garçons ayant un âge osseux de 13-14 ans.
DECAPEPTYL L.P. 11,25 mg ne doit pas être injecté par voie intravasculaire. L’administration sous-cutanée n’a pas été étudiée chez l’enfant.
Méthode d’administration
Voir la section « Posologie » ci-dessus.
Pour les instructions concernant la reconstitution du médicament avant administration, voir la rubrique 6.6.
N.B. Il est important que l'injection de la forme à libération prolongée soit pratiquée rigoureusement selon les instructions de la notice. Toute injection défectueuse conduisant à la perte d'une quantité de la suspension supérieure à celle qui reste normalement dans le dispositif utilisé pour l'injection, doit être signalée.
Grossesse et allaitement.
4.4. Mises en garde spéciales et précautions d'emploi
Chez l’adulte, l’utilisation des agonistes de la GnRH peut provoquer une diminution de la densité minérale osseuse augmentant le risque d’ostéoporose. Chez l’homme, des données préliminaires suggèrent que l’utilisation d’un bisphosphonate en association à l’agoniste de la GnRH peut réduire la perte minérale osseuse. Des précautions particulières sont nécessaires chez les patients qui ont des facteurs de risque d’ostéoporose additionnels (par exemple : alcoolisme chronique, tabagisme, traitements à long terme avec des médicaments qui réduisent la densité minérale osseuse, comme par exemple les antiépileptiques ou les corticoïdes, antécédents familiaux d’ostéoporose, malnutrition).
Rarement, le traitement par les analogues de la GnRH peut révéler la présence jusque-là inconnue d’un adénome hypophysaire gonadotrope. Ces patients peuvent présenter une apoplexie pituitaire se caractérisant par l’apparition d’une céphalée soudaine, de vomissements, de troubles visuels et d’une ophtalmoplégie.
Il y a un risque accru de survenue d’une dépression (potentiellement sévère) chez les patients traités par les agonistes de la GnRH, comme la triptoréline. Les patients doivent être informés en conséquence et traités de manière appropriée si des symptômes apparaissent.
Les patients qui souffrent de dépression doivent faire l’objet d’un suivi adapté pendant le traitement.
Des convulsions ont été rapportées avec les analogues de la GnRH, en particulier chez les femmes et les enfants. Certains de ces patients présentaient des facteurs de risque de convulsions (tels que des antécédents d'épilepsie, des tumeurs intracrâniennes ou un traitement concomitant avec des médicaments connus pour présenter un risque de crises convulsives). Des convulsions ont également été rapportées chez des patients ne présentant pas de tels facteurs de risque.
Ce médicament contient moins de 1 mmol (23 mg) de sodium par dose, c.-à-d. qu’il est essentiellement « sans sodium ».
La prudence est requise chez les patients traités par des anticoagulants en raison du risque potentiel d’hématome au site d’injection intramusculaire.
Chez l’homme
Au début du traitement, la triptoréline comme les autres agonistes de la GnRH provoque une augmentation transitoire du taux de testostérone sérique. Cela peut conduire à des cas isolés d’aggravation transitoire des signes et symptômes du cancer de la prostate lors des premières semaines de traitement.
Lors de la phase initiale du traitement, l’administration additionnelle d’un anti-androgène adapté devra être considérée afin de neutraliser l’augmentation initiale du taux sérique de testostérone et l’aggravation des symptômes cliniques.
Chez un nombre réduit de patients peuvent survenir une exacerbation de la tumeur avec une aggravation transitoire des signes et symptômes du cancer de la prostate et une augmentation temporaire des douleurs liées au cancer (douleurs métastatiques), qui peuvent être traitées symptomatiquement.
Comme avec les autres agonistes de la GnRH, des cas isolés de compression médullaire ou d’obstruction de l’urètre ont été observés. En cas de compression médullaire ou d’insuffisance rénale, un traitement standard de ces complications devra être institué et dans les cas extrêmes une orchidectomie d’urgence envisagée (castration chirurgicale). Un suivi attentif est nécessaire lors des premières semaines de traitement, en particulier chez les patients souffrant de métastases vertébrales, à haut risque de compression médullaire, et/ou d’obstruction des voies urinaires. Pour la même raison la mise en route du traitement chez les sujets présentant des signes prémonitoires de compression médullaire doit être soigneusement pesée.
Après castration chirurgicale, la triptoréline ne provoque pas de diminution supplémentaire des taux de testostérone.
L’inhibition prolongée de la sécrétion androgénique qu’elle soit induite par orchidectomie bilatérale ou par administration d’analogue de la GnRH est associée à un risque élevé de perte osseuse et peut conduire à une ostéoporose et à un risque accru de fracture osseuse.
Le traitement par suppression androgénique peut entrainer un allongement de l’intervalle QT. Chez les patients ayant des antécédents ou présentant des facteurs de risque d’allongement de l’intervalle QT et chez les patients traités par un médicament susceptible de prolonger l’intervalle QT (voir rubrique 4.5), le médecin devra évaluer le rapport bénéfice/risque, y compris le risque de torsades de pointe, avant l’initiation d’un traitement par DECAPEPTYL L.P. 11,25 mg.
De plus, des données épidémiologiques ont mis en évidence que ces patients pouvaient être sujets à des changements métaboliques (par exemple une intolérance au glucose, une stéatose hépatique), ou un risque plus élevé de maladie cardiovasculaire pendant le traitement inhibant la sécrétion androgénique. Toutefois, les données prospectives ne confirment pas le lien entre le traitement par analogue de la GnRH et l’augmentation de la mortalité cardiovasculaire. Les patients qui ont un risque élevé de maladies cardiovasculaires ou métaboliques doivent faire l’objet d’une évaluation attentive avant d’instaurer le traitement et d’un suivi adapté pendant le traitement inhibant la sécrétion androgénique.
Du fait de la suppression androgénique, le traitement par les analogues de la GnRH peut augmenter le risque d’anémie. Ce risque doit être évalué chez les patients traités et pris en charge de façon appropriée.
L’administration de triptoréline aux doses thérapeutiques conduit à une suppression du système gonadotrope hypophysaire. Un retour à la normale est généralement obtenu après l’interruption du traitement. Des tests diagnostiques de la fonction gonadotrope hypophysaire conduits durant le traitement et après l’interruption de la thérapie avec un analogue de la GnRH peuvent donc être erronés.
Une élévation transitoire des phosphatases acides en début de traitement peut être observée.
L’efficacité du traitement peut être vérifiée en dosant la testostéronémie et l’antigène prostatique spécifique (PSA).
Chez la femme
Il est indispensable de vérifier l’absence de grossesse avant toute prescription de DECAPEPTYL L.P. 11,25 mg. L’utilisation des agonistes de la GnRH est susceptible de provoquer une diminution de la densité minérale osseuse. Cette réduction est d’environ 1% par mois, au cours d’un traitement de 6 mois. Une réduction de 10% de la densité minérale osseuse est corrélée à une multiplication du risque de fracture par 2 à 3.
Aucune donnée spécifique n’est disponible chez les patientes qui ont déjà une ostéoporose ou qui ont des facteurs de risque d’ostéoporose (par exemple : alcoolisme chronique, tabagisme, traitements à long terme avec des médicaments qui réduisent la densité minérale osseuse, comme par exemple les antiépileptiques ou les corticoïdes, antécédents familiaux d’ostéoporose, malnutrition liée par exemple à une anorexie mentale). Comme la réduction de la densité minérale osseuse est susceptible d'être plus néfaste chez ces patientes, l’instauration d’un traitement par la triptoréline devra être soigneusement évaluée au cas par cas en s’assurant que le bénéfice attendu est supérieur au risque. Des mesures supplémentaires visant à limiter la perte de densité minérale osseuse pourront être envisagées.
· Endométriose
Les agonistes de la GnRH ne sont pas recommandés chez les patientes âgées de moins de 18 ans. Une attention particulière doit être accordée aux adolescentes et aux jeunes femmes (en particulier de moins de 16 ans) qui n'ont peut-être pas atteint leur densité osseuse maximale.
Chez les patientes avec une endométriose traitée par les analogues de la GnRH, il a été montré que l'ajout d’une ABT (comportant un œstrogène et un progestatif) réduisait la perte de densité minérale osseuse et les symptômes vasomoteurs (voir rubrique 4.2).
L’administration de DECAPEPTYL L.P. 11,25 mg entraîne une aménorrhée hypogonadotrophique constante.
La survenue de métrorragies au cours du traitement en dehors du premier mois est anormale, elle doit conduire à la vérification du taux d’œstradiol plasmatique et s’il est inférieur à 50 pg/ml, il faut rechercher d’éventuelles lésions organiques associées.
La patiente devra être informée qu’elle doit consulter son médecin en cas de persistance des règles.
Après l’arrêt du traitement, la fonction ovarienne reprend et l’ovulation survient environ 5 mois après la dernière injection.
Une méthode de contraception non-hormonale devra être utilisée tout au long du traitement et jusqu’à 3 mois après la dernière injection.
· Puberté précoce centrale
Chez les filles, il est indispensable de vérifier l’absence de grossesse avant toute prescription de triptoréline.
Le traitement des enfants avec une tumeur cérébrale évolutive doit faire l’objet d’une évaluation individuelle attentive du rapport bénéfices risques.
Les pseudo-pubertés précoces (hyperplasie ou tumeur des glandes surrénales ou des gonades) et les pubertés précoces indépendantes des gonadotrophines (testotoxicose, hyperplasie familiale des cellules de Leydig) devront être exclues.
Chez les filles, à l’initiation du traitement, la stimulation ovarienne initiale suivie par la diminution des taux d’œstrogènes induite par le traitement, peuvent conduire, au cours du premier mois, à des saignements vaginaux d'intensité légère ou modérée.
A l’arrêt du traitement, le développement pubertaire reprend.
Les données relatives à la fertilité des patientes traitées par les analogues de la GnRH pendant l’enfance sont encore limitées. Chez la plupart des filles, des règles régulières commencent environ 1 an après la fin du traitement.
Le traitement par les agonistes de la GnRH peut entraîner une diminution de la densité minérale osseuse (DMO). Toutefois, après l'arrêt du traitement, le bilan ultérieur de la masse osseuse est préservé et le pic de croissance de la masse osseuse à la fin de la puberté ne semble pas être affecté par le traitement.
Une épiphysiolyse de la hanche peut se produire après l’arrêt du traitement. Il se pourrait que ce soit consécutif à l’affaiblissement du cartilage de conjugaison en raison des faibles concentrations en œstrogène pendant le traitement et à l’augmentation de la vitesse de croissance qui se produit après l’arrêt du traitement et qui faciliterait le déplacement des épiphyses.
Une hypertension intracrânienne idiopathique (pseudotumor cerebri) a été signalée chez des patients pédiatriques recevant de la triptoréline. Les patients doivent être avertis des signes et des symptômes d'hypertension intracrânienne idiopathique, notamment des céphalées sévères ou récurrentes, des troubles de la vision et des acouphènes. En cas d'hypertension intracrânienne idiopathique, l'arrêt de la triptoréline doit être envisagé.
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
Etant donné qu’un traitement par suppression androgénique peut provoquer un allongement de l’intervalle QT, l’utilisation concomitante de triptoréline et de médicaments connus pour allonger l’intervalle QT ou à de médicaments susceptibles de provoquer des torsades de pointe tels les médicaments antiarythmiques de classe Ia (par exemple : quinidine, disopyramide ) ou de classe III (par exemple : amiodarone, sotalol, dofetilide, ibutilide), la méthadone, la moxifloxacine, les antipsychotiques, etc doit être évaluée avec attention (voir rubrique 4.4).
4.6. Fertilité, grossesse et allaitement
Grossesse
Il est indispensable de vérifier l'absence de grossesse avant toute prescription de DECAPEPTYL L.P. 11,25 mg.
La triptoréline ne doit pas être utilisée pendant la grossesse car l’utilisation des agonistes de la GnRH est associée à un risque théorique d’avortement ou d’anomalie fœtale. Avant traitement les patientes en âge de procréer doivent être examinées attentivement pour vérifier l’absence de grossesse. Des méthodes de contraception non hormonale devront être utilisées jusqu’au retour des règles.
La triptoréline ne doit pas être utilisée pendant l’allaitement.
Fertilité
Il n’existe pas de données cliniques suggérant un lien de causalité entre la triptoréline, et toute anomalie ultérieure du développement des ovocytes ou de la grossesse ou de l’issue de la grossesse.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
Cependant, l’aptitude à conduire des véhicules et utiliser des machines peut être altérée en cas de survenue de sensations vertigineuses, d’une somnolence et de troubles de la vision, qui sont des effets indésirables possibles du traitement ou qui peuvent résulter de la pathologie traitée.
Tolérance générale chez l’homme (voir rubrique 4.4)
Etant donné que les patients souffrant de cancer de la prostate hormono-dépendant, localement avancé ou métastatique sont généralement âgés et ont d’autres maladies fréquemment observées dans cette population âgée, des effets indésirables ont été rapportés chez plus de 90% des patients inclus dans les essais cliniques et le lien de causalité est souvent difficile à évaluer.
Comme il a été observé avec d’autres agonistes de la GnRH ou après castration chirurgicale, les effets indésirables les plus communément observés lors du traitement avec la triptoréline étaient dus à ses effets pharmacologiques attendus. Ces effets incluaient des bouffées de chaleur et une diminution de la libido.
A l’exception des réactions immuno-allergiques (rares) et des réactions au site d’injection (<5%), tous les effets indésirables sont connus pour être liés aux changements de la testostéronémie.
Les effets indésirables suivants ont été rapportés et sont considérés comme étant au moins possiblement liés au traitement par la triptoréline. La plupart de ces effets sont connus comme étant liés à une castration biochimique ou chirurgicale.
La fréquence de ces effets indésirables peut être classée comme suit : très fréquent (≥1/10) ; fréquent (≥1/100, < 1/10) ; peu fréquent (≥1/1 000, <1/100), rare (≥1/10 000, <1/1 000). Aucune fréquence ne peut être appliquée aux effets indésirables rapportés après la commercialisation. Ils sont donc rapportés avec la mention « fréquence indéterminée ».
|
Classes de systèmes d’organes |
Très fréquent |
Fréquent |
Peu fréquent |
Rare |
Fréquence indéterminée |
|
Infections et infestations |
|
|
|
Rhinopharyngite |
|
|
Affections hématologiques et du système lymphatique |
|
Anémie |
Thrombocytose |
|
|
|
Affections du système immunitaire |
|
Hypersensibilité |
|
Réaction anaphylactique |
Choc anaphylactique |
|
Troubles du métabolisme et de la nutrition |
|
|
Anorexie Diabète Goutte Hyperlipidémie Appétit augmenté |
|
|
|
Affections psychiatriques |
Diminution de la libido |
Dépression* Perte de la libido Changements d’humeur* |
Insomnie Irritabilité |
État confusionnel Baisse de l’activité Humeur euphorique |
Anxiété |
|
Affections du système nerveux |
Paresthésie du membre inférieur |
Sensation vertigineuse Céphalée |
Paresthésie |
Atteinte de la mémoire |
|
|
Affections oculaires |
|
|
Défauts visuels |
Sensation anormale dans l’œil Perturbation visuelle |
|
|
Affections endocriniennes |
|
|
|
|
Apoplexie hypophysaire** |
|
Affections de l'oreille et du labyrinthe |
|
|
Acouphènes Vertige |
|
|
|
Affections cardiaques |
|
|
Palpitations |
|
Allongement de l’intervalle QT (voir rubriques 4.4 et 4.5) |
|
Affections vasculaires |
Bouffées de chaleur |
Hypertension |
|
Hypotension |
|
|
Affections respiratoires, thoraciques et médiastinales |
|
|
Dyspnée Epistaxis |
Orthopnée |
|
|
Affections gastro-intestinales |
|
Bouche sèche Nausées |
Douleur abdominale Constipation Diarrhée Vomissement |
Distension abdominale Dysgueusie Flatulence |
|
|
Affections de la peau et du tissu sous-cutané |
Hyperhidrose |
|
Acné Alopécie Erythème Prurit Rash Urticaire |
Eruption bulleuse Purpura |
Œdème angioneurotique |
|
Affections musculo-squelettiques et systémiques |
Douleur dorsale |
Douleur musculo-squelettique Extrémités douloureuses |
Arthralgie Douleur osseuse Crampe musculaire Faiblesse musculaire Myalgie |
Raideur articulaire Tuméfaction articulaire Raideur musculo-squelettique Ostéoarthrite |
|
|
Affections du rein et des voies urinaires |
|
|
Nycturie Rétention urinaire |
|
Incontinence urinaire |
|
Affections des organes de reproduction et du sein |
Dysérection (incluant anéjaculation, trouble de l'éjaculation) |
Douleur pelvienne |
Gynécomastie Douleur mammaire Atrophie testiculaire Douleur testiculaire |
|
|
|
Troubles généraux et anomalies au site d'administration |
Asthénie |
Réaction au site d’injection (incluant érythème, inflammation et douleur) Œdème |
Léthargie Œdèmes périphériques Douleur Frissons Somnolence |
Douleur thoracique Dystasie Syndrome pseudo-grippal Fièvre |
Malaise |
|
Investigations |
|
Poids augmenté |
Alanine amino-transférase augmentée Aspartate amino-transférase augmentée Créatininémie augmentée Pression artérielle augmentée Urémie augmentée Gamma-glutamyl-transférase augmentée Poids abaissé |
Phosphatase alcaline augmentée |
|
*Cette fréquence est basée sur la fréquence observée dans la classe pour tous les agonistes de la GnRH.
**Rapporté après l’administration initiale chez des patients avec un adénome hypophysaire.
La triptoréline provoque une augmentation transitoire des taux circulants de testostérone durant la première semaine après la première injection de la formulation à libération prolongée. A la suite de l’augmentation initiale des taux circulants de testostérone, un faible pourcentage de patients (≤ 5%) peut présenter une aggravation temporaire des signes et des symptômes de leur cancer de la prostate (exacerbation de la tumeur), se manifestant généralement par une augmentation des symptômes urinaires (< 2%) et des douleurs métastatiques (5%), qui peuvent être traitées de façon symptomatique. Ces symptômes sont transitoires et disparaissent généralement après 1 à 2 semaines.
Des cas isolés d’exacerbation des symptômes liés à la maladie tels qu’une obstruction de l’urètre ou une compression médullaire par des métastases peuvent survenir. C’est pourquoi les patients avec des lésions métastatiques vertébrales et/ou avec une obstruction de l’appareil urinaire doivent faire l’objet d’une surveillance attentive pendant les premières semaines de traitement (voir rubrique 4.4).
L’utilisation des analogues de la GnRH de synthèse dans le traitement du cancer de la prostate peut être associée à une perte osseuse qui peut conduire à une ostéoporose et augmenter le risque de fracture.
Une augmentation des lymphocytes a été rapportée chez des patients traités par des analogues de la GnRH. Cette lymphocytose secondaire est apparemment liée à la castration induite par la GnRH et semble indiquer que les hormones gonadiques sont impliquées dans l’involution thymique.
Les patients traités au long cours par analogue de la GnRH en association avec la radiothérapie peuvent avoir plus d’effets secondaires en particulier gastro-intestinaux liés à la radiothérapie.
Tolérance générale chez la femme (voir rubrique 4.4)
Les effets indésirables les plus fréquents (≥ 10% des patientes) sont la conséquence de la baisse du taux d’œstrogènes. Il s’agit de céphalées, baisse de la libido, troubles du sommeil, troubles de l’humeur, dyspareunie, dysménorrhée, hémorragie génitale, syndrome d’hyperstimulation ovarienne, hypertrophie ovarienne, douleur pelvienne, douleur abdominale, sécheresse vulvovaginale, hyperhidrose, bouffées de chaleur et asthénie.
Les effets indésirables suivants ont été rapportés et sont considérés comme étant au moins possiblement liés au traitement par la triptoréline. La plupart de ces effets sont connus comme étant liés à une castration biochimique ou chirurgicale.
La fréquence de ces effets indésirables peut être classée comme suit : très fréquent (≥1/10) ; fréquent (≥1/100, < 1/10), peu fréquent (≥1/1 000, <1/100). Aucune fréquence ne peut être appliquée aux effets indésirables rapportés après la commercialisation. Ils sont donc rapportés avec la mention « fréquence indéterminée ».
|
Classes de systèmes d’organes |
Très fréquent |
Fréquent |
Peu fréquent |
Fréquence indéterminée |
|
Affections du système immunitaire |
|
Hypersensibilité |
|
Choc anaphylactique |
|
Troubles du métabolisme et de la nutrition |
|
|
Appétit diminué Rétention liquidienne |
|
|
Affections psychiatriques |
Troubles du sommeil (incluant insomnie) Trouble de l'humeur Diminution de la libido |
Dépression* Nervosité |
Labilité affective Anxiété Dépression** Désorientation |
Etat confusionnel |
|
Affections du système nerveux |
Céphalée |
Sensation vertigineuse |
Dysgueusie Hypo-esthésie Syncope Atteinte de la mémoire Perturbation de l'attention Paresthésie Tremblement |
Convulsions**** |
|
Affections oculaires |
|
|
Sécheresse oculaire Défauts visuels |
Perturbation visuelle |
|
Affections endocriniennes |
|
|
|
Apoplexie hypophysaire*** |
|
Affections de l'oreille et du labyrinthe |
|
|
Vertige |
|
|
Affections cardiaques |
|
|
Palpitations |
|
|
Affections vasculaires |
Bouffées de chaleur |
|
|
Hypertension |
|
Affections respiratoires, thoraciques et médiastinales |
|
|
Dyspnée Epistaxis |
|
|
Affections gastro-intestinales |
|
Nausée Gêne abdominale Douleur abdominale |
Distension abdominale Bouche sèche Flatulence Ulcération buccale Vomissement |
Diarrhée |
|
Affections de la peau et du tissu sous-cutané |
Acné Hyperhidrose Séborrhée |
|
Alopécie Sécheresse cutanée Hirsutisme Onychoclasie Prurit Rash |
Œdème angioneurotique Urticaire |
|
Affections musculo-squelettiques et systémiques |
|
Arthralgie Spasme musculaire Douleur dans les membres |
Dorsalgie Myalgie |
Faiblesse musculaire |
|
Affections des organes de reproduction et du sein |
Affection mammaire Dyspareunie Saignement génital (incluant saignement vaginal, hémorragie de privation) Hypertrophie ovarienne Syndrome d’hyperstimulation ovarienne Douleur pelvienne Sécheresse vulvo-vaginale |
Douleur mammaire |
Saignement pendant les rapports sexuels Cystocèle Trouble menstruel (incluant dysménorrhée, métrorragie et ménorragie) Kyste de l'ovaire Pertes vaginales |
Aménorrhée |
|
Troubles généraux et anomalies au site d'administration |
Asthénie |
Réaction au site d’injection (incluant douleur, gonflement, érythème et inflammation) Œdèmes périphériques |
|
Fièvre Malaise |
|
Investigations |
|
Poids augmenté |
Poids abaissé |
Phosphatase alcaline sanguine augmentée Pression artérielle augmentée |
* traitement de longue durée. Cette fréquence est basée sur la fréquence observée dans la classe pour tous les agonistes de la GnRH.
** traitement de courte durée. Cette fréquence est basée sur la fréquence observée dans la classe pour tous les agonistes de la GnRH.
***Rapporté après l’administration initiale chez des patients avec un adénome hypophysaire.
**** Après la mise sur le marché, des convulsions ont été signalées chez des patients recevant des analogues de la GnRH, dont la triptoréline.
Une exacerbation des symptômes de l’endométriose (douleurs pelviennes, dysménorrhée), peut être observée très fréquemment (≥ 10%) lors de l’augmentation initiale et transitoire du taux plasmatique d’œstradiol et disparaît en une à deux semaines.
La survenue d’hémorragies génitales incluant des métrorragies et des ménorragies peut être observée dans le mois suivant la première injection.
L’utilisation prolongée des analogues de la GnRH peut induire une perte osseuse, facteur de risque d’une éventuelle ostéoporose.
Tolérance générale chez l’enfant (voir rubrique 4.4)
La fréquence de ces effets indésirables peut être classée comme suit : très fréquent (≥ 1/10) ; fréquent (≥ 1/100, < 1/10) ; peu fréquent (≥ 1/1 000, < 1/100). Aucune fréquence ne peut être appliquée aux effets indésirables rapportés après la commercialisation. Ils sont donc rapportés avec la mention « fréquence indéterminée ».
Des saignements vaginaux peuvent survenir dans le mois qui suit la première injection.
|
Classes de systèmes d’organes |
Très fréquent |
Fréquent |
Peu fréquent |
Fréquence indéterminée |
|
Affections du système immunitaire |
|
Hypersensibilité |
|
Choc anaphylactique |
|
Troubles du métabolisme et de la nutrition |
|
|
Obésité |
|
|
Affections psychiatriques |
|
|
Humeur modifiée |
Labilité émotionnelle Dépression Nervosité |
|
Affections du système nerveux |
|
Céphalée |
|
Hypertension intracrânienne idiopathique (pseudotumor cerebri) (voir rubrique 4.4) Convulsions* |
|
Affections oculaires |
|
|
Défauts visuels |
Perturbation visuelle |
|
Affections vasculaires |
|
Bouffées de chaleur |
|
Hypertension |
|
Affections respiratoires, thoraciques et médiastinales |
|
|
Epistaxis |
|
|
Affections gastro-intestinales |
|
Douleur abdominale |
Vomissement Constipation Nausées |
|
|
Affections de la peau et du tissu sous-cutané |
|
Acné |
Prurit Rash Urticaire |
Œdème angioneurotique |
|
Affections musculo-squelettiques et systémiques |
|
|
Cervicalgie |
Myalgie |
|
Affections des organes de reproduction et du sein |
Saignements génitaux (incluant hémorragie vaginale, spotting) Hémorragie de privation Hémorragie utérine Pertes vaginales |
|
Douleur mammaire |
|
|
Troubles généraux et anomalies au site d'administration |
|
Réaction au site d’injection (incluant douleur au site d’injection, érythème au site d’injection, inflammation au site d’injection) |
Malaise |
|
|
Investigations |
|
Poids augmenté |
|
Prolactinémie augmentée Pression artérielle augmentée |
* Après la mise sur le marché, des convulsions ont été signalées chez des patients recevant des analogues de la GnRH, dont la triptoréline.
Tolérance à long terme dans la population pédiatrique :
L'essai clinique à long terme 2-54-52014-159 (NCT00909844) a inclus 35 patients, âgés de 4 à 10,4 ans, qui ont reçu jusqu’à 4 ans de traitement par DECAPEPTYL L.P. 11,25 mg. Plus de la moitié des patients (20 patients : 57,1 %) ont signalé au moins un événement indésirable au cours de l'étude, dont les plus fréquents étaient des douleurs abdominales (17,1 %), des douleurs au site d’injection (11,4 %), des céphalées et des bouffées de chaleur (8,6 % chacun). Dans l'ensemble, le profil de sécurité était similaire à celui observé dans les autres études sur la puberté précoce centrale.
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr
En cas de surdosage, celui-ci devra être traité de façon symptomatique.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Mécanisme d’action
La triptoréline est un décapeptide de synthèse analogue de la GnRH naturelle (hormone de libération des gonadotrophines).
Les études conduites dans l'espèce humaine comme chez l'animal ont montré, qu'après une stimulation initiale, l'administration prolongée de triptoréline entraîne une inhibition de la sécrétion gonadotrope, supprimant par conséquent, les fonctions testiculaire et ovarienne.
L’administration de DECAPEPTYL L.P. 11,25 mg peut entraîner une élévation initiale des taux sanguins de LH et de FSH, ce qui a pour corollaire une augmentation initiale (flare-up) des taux de testostérone chez l’homme et du taux d’œstradiol chez la femme. La poursuite du traitement entraîne une diminution des taux de LH et de FSH conduisant la diminution des taux de testostérone et d’œstradiol qui deviennent équivalents à ceux observés après la castration dans un délai d’environ 20 jours après l’injection et pendant toute la période de libération du principe actif.
Efficacité et sécurité clinique
Cancer de la prostate
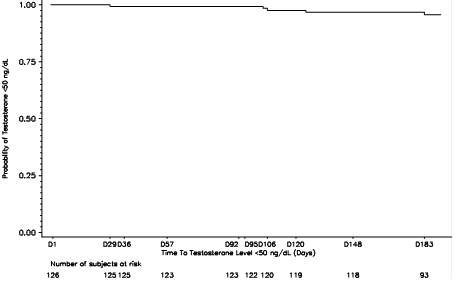
Une étude clinique de phase III, ouverte, non contrôlée, multicentrique, portant sur 126 patients atteints d’un cancer de la prostate avancé a été conduite sur 6 mois, afin d’évaluer l’efficacité de l’administration de DECAPEPTYL L.P. 11,25 mg sous forme d'injection sous-cutanée (une administration tous les 3 mois). Après quatre semaines, 97,6% des patients étaient castrés (taux de testostérone <50 ng/dL) (IC à 95% : [93,2% ; 99,5%]) et la castration a été maintenue jusqu’à M6 chez 96,6% des patients (IC à 95% : [91,6 ; 99,1]) (co-critères principaux). La probabilité pour un patient d’être castré au cours du premier mois de traitement et de rester castré à chaque analyse jusqu'à 6 mois était de 96% (IC 95% [0,92, 0,99]) (critère secondaire) (voir Figure 1).
Figure 1 : Courbe Kaplan-Meier sur la probabilité d’atteindre et de maintenir une testostéronémie <50 ng/dL de J29 à J183 après administration sous-cutanée
|
|
Au cours du traitement par la triptoréline, le taux médian de PSA a diminué de 64,2% à M1 et de 96,0% à M6 (critère secondaire). Les taux médians de PSA sont restés dans la fourchette normale (0 à 4 ng/ml) de M2 à la fin de l'étude.
Chez les patients avec un cancer de la prostate localement avancé, plusieurs études cliniques, randomisées, à long terme, ont démontré le bénéfice d’une privation androgénique associée à la radiothérapie (RT) en comparaison à la RT seule (RTOG 85-31, RTOG 86-10, EORTC 22863, D’Amico et al., JAMA, 2008).
Une étude clinique randomisée de phase III, (EORTC 22961) portant sur 970 patients avec un cancer de la prostate localement avancé (principalement T2c-T4, avec des patients T1c à T2b avec un envahissement ganglionnaire régional) a recherché si une radiothérapie associée à une privation androgénique courte (6 mois, n=483) était non-inférieure à une radiothérapie associée à une privation androgénique longue (3 ans, n=487). L'agoniste de la GnRH était la triptoréline (62,2%) ou d'autres agonistes (37,8%), et l'essai n'était pas stratifié sur le type d'agoniste.
Globalement, la mortalité totale à 5 ans était de 19,0% et 15,2%, respectivement dans les groupes "traitement hormonal court" et "traitement hormonal long", soit un risque relatif de 1,42 (IC unilatéral à 95,71%=1,79 ; IC à 95,71%=[1,09 ; 1,85] ; p=0,65 pour la non infériorité et p=0,0082 pour le test post-hoc de différence entre les groupes de traitement).
La mortalité à 5 ans spécifiquement liée à la prostate était 4,78% et 3,2% respectivement dans les groupes "traitement hormonal court" et "traitement hormonal long", soit un risque relatif de 1,71 (IC 95% [1,14 à 2,57] ; p=0,002). La qualité de vie, évaluée avec l’échelle QLQ-C30, n’était pas significativement différente entre les deux groupes (p=0,37).
L'analyse post hoc dans le sous-groupe triptoréline va dans le même sens de l'avantage du traitement long par rapport au traitement court sur la mortalité globale (risque relatif de 1,28 ; IC à 95,71%=[0,89 ; 1,84] ; p=0,38 et p=0,08 respectivement pour les tests post-hoc de non infériorité et de différence entre les groupes de traitement).
L'indication du cancer de la prostate localisé à haut risque est basée sur des études publiées sur l’association de la radiothérapie et des analogues de la GnRH. Les données cliniques de cinq études publiées ont été analysées (EORTC 22863, RTOG 85-31, RTOG 92-02, RTOG 86-10 et D'Amico et al., JAMA, 2008). Elles ont toutes démontré un avantage de l’association des analogues de la GnRH avec la radiothérapie. Dans les études publiées, il n’était pas possible de clairement différentier les populations respectives des indications du cancer de la prostate localement avancé et du cancer de la prostate localisé à haut risque.
Chez les patients atteints d’un cancer de la prostate métastatique résistant à la castration, les études cliniques ont démontré le bénéfice de l’ajout des inhibiteurs de la biosynthèse des androgènes comme l’acétate d’abiratérone ou des inhibiteurs de la voie de signalisation des récepteurs aux androgènes comme l'enzalutamide, au traitement par un analogue de la GnRH, comme la triptoréline.
Endométriose
Chez la femme, l’administration prolongée de triptoréline entraîne la suppression de la sécrétion d’œstradiol et ainsi une mise au repos du tissu endométriosique.
Population pédiatrique – puberté précoce centrale
L'inhibition de l'hyperactivité gonadotrope hypophysaire se manifeste, dans les deux sexes, par la suppression de la sécrétion d'œstradiol ou de testostérone, par l'abaissement du pic de LH et par une amélioration du rapport âge statural/âge osseux.
La stimulation gonadique initiale peut être responsable de légères hémorragies génitales nécessitant le recours à un traitement par l’acétate de médroxyprogestérone ou de cyprotérone.
Dans l'essai clinique à long terme 2-54-52014-159 (NCT00909844), 34 filles et 1 garçon, atteints de puberté précoce centrale (PPC) ont été traités par 11,25 mg de pamoate de triptoréline tous les 3 mois pendant une période pouvant aller jusqu’à 4 ans. Le traitement prenait fin lorsque l'investigateur décidait que le patient avait terminé son traitement, c’est-à-dire vers 11 ans chez les filles et 13 ans chez les garçons (généralement après 1 à 3 ans de traitement). A cette étape, une stabilisation ou une régression du stade pubertaire mammaire de Tanner étaient maintenues chez 31/34 (91 %) des filles.
5.2. Propriétés pharmacocinétiques
Après injection intramusculaire de DECAPEPTYL L.P. 11,25 mg chez des patients (homme ou femme), on observe un pic plasmatique de triptoréline environ 3 heures après l’injection. Puis après une phase de décroissance qui se poursuit pendant le premier mois, les taux de triptoréline circulants se maintiennent en plateau jusqu’à la fin du troisième mois suivant l’injection.
Chez l’homme, dans l’étude menée avec administrations sous-cutanées, le pic de concentration plasmatique de la triptoréline est rapidement atteint après l’injection (Tmax médian de 4,5 h) et la triptoréline est libérée en continu pendant la période de 91 jours. Trois mois après l'administration sous-cutanée, les concentrations résiduelles de triptoréline (Cmin) étaient de 0,063 ng/ml.
5.3. Données de sécurité préclinique
La résorption de la poudre est complète en 120 jours.
La triptoréline n'est pas mutagène in vitro ou in vivo. Aucun effet oncogène n’a été observé chez la souris à des doses de triptoréline allant jusqu’à 6000 microgrammes/kg après 18 mois de traitement. Une étude de carcinogénicité conduite chez le rat pendant 23 mois, a montré une incidence de près de 100% des tumeurs bénignes hypophysaires à chaque dose, conduisant à une mort prématurée. L’augmentation de l’incidence des tumeurs hypophysaires chez le rat est un effet fréquemment associé au traitement par les agonistes de la GnRH. La pertinence clinique de cet effet n'est pas connue.
Polymère D,L lactide-coglycolide ; mannitol ; carmellose sodique ; polysorbate 80.
Composition du solvant :
Mannitol ; eau pour préparations injectables.
3 ans.
Après reconstitution : à utiliser immédiatement.
6.4. Précautions particulières de conservation
A conserver à une température ne dépassant pas 25°C.
Pour les conditions de conservation du médicament après reconstitution, voir la rubrique 6.3.
6.5. Nature et contenu de l'emballage extérieur
Poudre en flacon (verre type I) de 4 ml muni d’un bouchon (élastomère) de 2 ml de solvant en ampoule (verre) ; boîte de 1 flacon et 1 ampoule avec 1 seringue et 3 aiguilles.
6.6. Précautions particulières d’élimination et de manipulation
La mise en suspension de la poudre dans le solvant spécifique doit être effectuée immédiatement avant l'injection, en agitant le flacon doucement jusqu'à l'obtention d'un mélange laiteux homogène (suivre strictement les instructions d’utilisation figurant ci-après et dans la notice).
Pour usage unique seulement. Toute suspension non utilisée doit être éliminée.
La poudre doit être mise en suspension dans la solution de mannitol de 2 ml fournie.
La totalité du solvant doit être aspirée dans la seringue en utilisant l’aiguille pour la reconstitution (aiguille sans système de sécurité), puis, transférée dans le flacon contenant la poudre. Le flacon doit être agité doucement pour disperser complètement la poudre jusqu’à l’obtention d’une suspension laiteuse homogène. La suspension ainsi obtenue est ensuite aspirée dans la seringue. L’aiguille doit être changée pour permettre l’injection immédiate en utilisant :
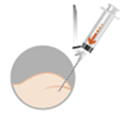
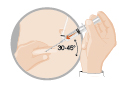
· Une aiguille de 38 mm de long (20 G) avec un système de sécurité pour une injection intramusculaire dans le muscle glutéal (ou muscle fessier) (hommes, femmes et enfants)
· Une aiguille de 25 mm de long (20 G) avec un système de sécurité pour une injection sous-cutanée dans l’abdomen ou la cuisse (uniquement chez l’homme)
La suspension doit être éliminée si elle n’est pas administrée immédiatement après la reconstitution. Voir aussi la rubrique 6.3.
Les aiguilles utilisées pour l’injection doivent être jetées dans un récipient destiné à recevoir des déchets biologiques perforants.
Tout médicament non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
70 RUE BALARD
75015 PARIS
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· 34009 341 256 5 2 : Poudre en flacon (verre) de 4 ml avec bouchon (élastomère) et capsule (aluminium) et 2 ml de solvant en ampoule (verre) ; boîte de 1 flacon et 1 ampoule, 1 seringue et 3 aiguilles.
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
[à compléter ultérieurement par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE
[à compléter ultérieurement par le titulaire]
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Liste I
ANSM - Mis à jour le : 11/06/2025
Triptoréline
· Gardez cette notice. Vous pourriez avoir besoin de la relire.
· Si vous avez d’autres questions, interrogez votre médecin ou votre pharmacien.
· Ce médicament vous a été personnellement prescrit. Ne le donnez pas à d’autres personnes. Il pourrait leur être nocif, même si les signes de leur maladie sont identiques aux vôtres.
· Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou à votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
1. Qu'est-ce que DECAPEPTYL L.P. 11,25 mg, poudre et solvant pour suspension injectable (IM ou SC) forme à libération prolongée sur 3 mois et dans quels cas est-il utilisé ?
2. Quelles sont les informations à connaître avant d'utiliser DECAPEPTYL L.P. 11,25 mg, poudre et solvant pour suspension injectable (IM ou SC) forme à libération prolongée sur 3 mois ?
3. Comment utiliser DECAPEPTYL L.P. 11,25 mg, poudre et solvant pour suspension injectable (IM ou SC) forme à libération prolongée sur 3 mois ?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver DECAPEPTYL L.P. 11,25 mg, poudre et solvant pour suspension injectable (IM ou SC) forme à libération prolongée sur 3 mois ?
6. Contenu de l’emballage et autres informations.
1. QU’EST-CE QUE DECAPEPTYL L.P. 11,25 mg, poudre et solvant pour suspension injectable (IM ou SC) forme à libération prolongée sur 3 mois ET DANS QUELS CAS EST-IL UTILISE ?
Ce médicament contient de la triptoréline. La triptoréline appartient à un groupe de médicaments connus sous le nom d’analogues de l’hormone entraînant la libération de gonadotrophines (GnRH). L’une de ses actions est de diminuer la production d’hormones sexuelles dans le corps.
Ce médicament est un analogue d’une hormone naturelle.
Il est utilisé :
Chez l’homme adulte :
· dans le traitement du cancer de la prostate localement avancé ou métastatique (étendu à d’autres parties du corps).
· dans le traitement du cancer de la prostate localisé à haut risque ou localement avancé, en association à la radiothérapie.
Chez la femme :
· dans le traitement de l’endométriose.
Chez l’enfant :
· dans le traitement de la puberté qui survient prématurément, c’est-à-dire avant 8 ans chez les filles et 10 ans chez les garçons (puberté précoce centrale).
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT D’UTILISER DECAPEPTYL L.P. 11,25 mg, poudre et solvant pour suspension injectable (IM ou SC) forme à libération prolongée sur 3 mois ?
· Si vous êtes allergique (hypersensible) à la triptoréline, à l’hormone entrainant la libération des gonadotrophines (GnRH) aux autres analogues de la GnRH ou à l’un des autres composants contenus dans ce médicament, mentionnés dans la rubrique 6.
· Si vous êtes enceinte ou si vous allaitez.
Avertissements et précautions
Adressez-vous à votre médecin ou pharmacien avant d’utiliser DECAPEPTYL L.P. 11,25 mg.
· Des dépressions parfois graves ont été rapportées chez des patients traités par DECAPEPTYL L.P. 11,25 mg. Si une humeur dépressive apparaît alors que vous êtes traité par DECAPEPTYL L.P. 11,25 mg, informez votre médecin. Votre médecin peut vouloir surveiller votre dépression pendant le traitement.
· Si vous avez, sans que cela n’ait été découvert jusque-là, une augmentation du volume (tumeur bénigne) de la glande hypophysaire, elle pourrait être découverte au cours du traitement par DECAPEPTYL L.P. 11,25 mg qui peut entrainer un saignement au niveau de la tumeur (apoplexie hypophysaire). Les symptômes incluent des maux de tête soudains, des vomissements, des problèmes de vue et une paralysie des yeux.
· Si vous prenez des médicaments pour prévenir la coagulation du sang (anticoagulants) car des hématomes (bleus) pourraient apparaître au site d’injection intramusculaire. Chez l’homme uniquement, le médicament peut être injecté par voie intramusculaire ou sous-cutanée.
· Si une convulsion survient, informez immédiatement votre médecin. Des cas de convulsions ont été signalés chez des patients recevant de la triptoréline ou des médicaments similaires. Ces cas sont survenus chez des patients avec ou sans antécédents médicaux d’épilepsie.
Chez l’homme
· Au début du traitement, il y aura une augmentation de la quantité de testostérone dans votre corps. Ceci peut entraîner une aggravation des symptômes du cancer. Contactez votre médecin si cela se produit. Votre médecin pourra vous prescrire des médicaments (un anti-androgène) pour éviter que vos symptômes ne s’aggravent.
· Si vous souffrez d’une obstruction urinaire ou d’une compression de la moelle épinière (nerfs de votre colonne vertébrale) en raison de la propagation de votre cancer de la prostate, votre médecin vous surveillera étroitement pendant les premières semaines du traitement. Si vous ressentez des difficultés à uriner, des douleurs osseuses, une faiblesse des membres inférieurs ou une sensation de picotements, contactez immédiatement votre médecin, qui évaluera votre état de santé et vous traitera de manière appropriée.
· Après castration chirurgicale, la triptoréline n’induit pas de réduction supplémentaire du taux de testostérone.
· Des tests diagnostiques de la fonction gonadotrope hypophysaire ou des organes sexuels conduits durant le traitement et après l’interruption de la thérapie avec DECAPEPTYL L.P. 11,25 mg peuvent être erronés.
· Chez l’adulte, la triptoréline peut entraîner une perte osseuse (ostéoporose) avec un risque accru de fracture osseuse. Afin de traiter la perte osseuse, votre médecin pourrait vous prescrire un bisphosphonate (médicament utilisé pour traiter la faiblesse osseuse), vous devez donc informer votre médecin si vous présentez l'un des facteurs de risque ci-dessous. Les facteurs de risque peuvent inclure par exemple :
o Si vous ou un membre de votre famille présente une perte osseuse.
o Si vous êtes un grand consommateur d’alcool, et/ou si vous êtes un grand fumeur, ou si vous avez une mauvaise alimentation.
o Si vous suivez un traitement au long cours pouvant provoquer une perte osseuse, comme par exemple des médicaments utilisés pour traiter l’épilepsie ou des stéroïdes (comme l’hydrocortisone ou la prednisolone).
· Vous devez informer votre médecin si vous souffrez de troubles cardiovasculaires, y compris de troubles du rythme cardiaque (arythmie), ou si vous êtes traité par des médicaments pour soigner ces maladies. Le risque de troubles du rythme cardiaque peut être augmenté par l’utilisation de DECAPEPTYL L.P. 11,25 mg.
· Des contrôles biologiques peuvent être nécessaires au cours du traitement pour vérifier son efficacité.
· Le traitement par des analogues de la GnRH, dont DECAPEPTYL L.P. 11,25 mg, pourrait augmenter le risque d'anémie (définie comme une diminution du nombre de globules rouges).
Chez la femme
· Chez l’adulte, la triptoréline peut entraîner une perte osseuse (ostéoporose) avec un risque accru de fracture osseuse. Vous devez donc informer votre médecin si vous présentez l'un des facteurs de risque ci-dessous. Les facteurs de risque peuvent inclure par exemple :
o Si vous ou un membre de votre famille présente une perte osseuse.
o Si vous êtes un grand consommateur d’alcool, et/ou si vous êtes un grand fumeur, ou si vous avez une mauvaise alimentation.
o Si vous suivez un traitement au long cours pouvant provoquer une perte osseuse, comme par exemple des médicaments utilisés pour traiter l’épilepsie ou des stéroïdes (comme l’hydrocortisone ou la prednisolone).
· En raison du manque d’expérience clinique chez les femmes de moins de 18 ans, la triptoréline n’est pas recommandée chez les adolescentes et les jeunes femmes car elle pourrait provoquer une perte osseuse.
· Durant le premier mois de traitement, vous pouvez avoir des saignements vaginaux. Ensuite, vos règles doivent normalement s’arrêter. Si des saignements se produisent après le premier mois de traitement, parlez-en à votre médecin.
· Vos règles devraient revenir environ 5 mois après la dernière injection.
· Vous devez utiliser une méthode de contraception autre que la « pilule » pendant toute la période de traitement et jusqu’au retour des règles.
· Ce traitement doit être administré sous étroite surveillance médicale avec parfois des contrôles biologiques, cliniques et échographiques stricts et réguliers.
Chez l’enfant
· Chez les filles traitées pour une puberté précoce, des saignements vaginaux peuvent apparaître au cours du premier mois de traitement.
· Si vous avez une tumeur du cerveau évolutive, veuillez informer votre médecin. Cela pourra influencer la façon dont votre médecin décidera de vous traiter.
· A l’arrêt du traitement, les signes de la puberté réapparaîtront.
· Chez les filles, les règles débuteront environ un an après l'arrêt du traitement.
· Les autres causes de puberté précoce devront être écartées par votre médecin.
· La densité des os diminue pendant le traitement, mais elle se normalise après l’arrêt du traitement.
· Une pathologie de la hanche peut survenir après l’arrêt du traitement (épiphysiolyse de la hanche). Elle se traduit par une raideur de la hanche, une boiterie et/ou une douleur aiguë à l'aine irradiant vers la cuisse. Si cela se produit vous devez consulter votre médecin.
· Si votre enfant souffre d'un mal de tête intense ou récurrent, de problèmes de vue et de bourdonnements ou sifflements d'oreilles, contactez immédiatement un médecin (voir rubrique 4).
Si vous ou votre enfant êtes concerné par un des signes cités ci-dessus, parlez-en à votre médecin.
Autres médicaments et DECAPEPTYL L.P. 11,25 mg, poudre et solvant pour suspension injectable (IM ou SC) forme à libération prolongée sur 3 mois
Informez votre médecin ou pharmacien si vous prenez, avez récemment pris ou pourriez prendre tout autre médicament.
Chez l’homme
DECAPEPTYL L.P. 11,25 mg peut interagir avec des médicaments utilisés pour traiter les problèmes de rythme cardiaque (par exemple quinidine, procaïnamide, amiodarone et sotalol) ou peut augmenter le risque de troubles du rythme cardiaque quand il est utilisé avec d’autres médicaments, par exemple la méthadone (utilisée pour soulager la douleur et en traitement de substitution des pharmacodépendances), la moxifloxacine (un antibiotique), des antipsychotiques (utilisés pour des troubles mentaux graves).
DECAPEPTYL L.P. 11,25 mg, poudre et solvant pour suspension injectable (IM ou SC) forme à libération prolongée sur 3 mois avec des aliments et boissons
Sans objet.
Ce médicament ne doit pas être utilisé pendant la grossesse ou l’allaitement. N’utilisez pas DECAPEPTYL L.P. 11,25 mg si vous envisagez une grossesse.
Demandez conseil à votre médecin ou votre pharmacien avant de prendre ce médicament.
Conduite de véhicules et utilisation de machines
Vous pouvez ressentir des étourdissements, de la fatigue ou avoir des problèmes de vue tels qu’une vision trouble. Ce sont des effets indésirables possibles du traitement ou de la maladie traitée. Si vous ressentez un de ces effets indésirables, vous ne devez pas conduire ou utiliser des machines.
DECAPEPTYL L.P. 11,25 mg, poudre et solvant pour suspension injectable (IM ou SC) forme à libération prolongée sur 3 mois contient du sodium
Ce médicament contient moins de 1 mmol (23 mg) de sodium par flacon, c.-à-d. qu’il est essentiellement « sans sodium ».
3. COMMENT UTILISER DECAPEPTYL L.P. 11,25 mg, poudre et solvant pour suspension injectable (IM ou SC) forme à libération prolongée sur 3 mois ?
Une injection tous les 3 mois.
Si vous avez l’impression que l’effet de DECAPEPTYL L.P. 11,25 mg est trop fort ou trop faible, consultez votre médecin ou votre pharmacien.
Mode et voie d’administration
Chez l’homme uniquement : voie intramusculaire ou sous-cutanée.
Chez la femme et l’enfant : voie intramusculaire uniquement.
La poudre doit être mise en suspension immédiatement avant l’injection en utilisant exclusivement le solvant fourni dans le conditionnement. La suspension obtenue ne doit pas être mélangée à d’autres médicaments.
N.B : Il est important que la préparation de l’injection soit pratiquée rigoureusement selon les instructions données ci-après. Toute injection défectueuse, conduisant à une perte d’une quantité supérieure à celle qui reste normalement dans le dispositif utilisé pour l’injection doit être signalée.
Durée du traitement
Chez la femme, la durée de traitement est de 6 mois au maximum.
Si vous avez pris plus de DECAPEPTYL L.P. 11,25 mg, poudre et solvant pour suspension injectable (IM ou SC) forme à libération prolongée sur 3 mois que vous n’auriez dû
Consultez immédiatement votre médecin ou votre pharmacien.
Si vous oubliez de prendre DECAPEPTYL L.P. 11,25 mg, poudre et solvant pour suspension injectable (IM ou SC) forme à libération prolongée sur 3 mois
Dans tous les cas, contactez votre médecin.
Ne prenez pas de dose double pour compenser la dose que vous avez oublié de prendre.
Si vous arrêtez de prendre DECAPEPTYL L.P. 11,25 mg, poudre et solvant pour suspension injectable (IM ou SC) forme à libération prolongée sur 3 mois
Chez la femme, reprise de l’activité ovarienne (possibilité d’ovulation, règles).
Si vous avez d’autres questions sur l’utilisation de ce médicament, demandez plus d’informations à votre médecin ou à votre pharmacien.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
Dans de rares cas, une réaction allergique sévère (angiœdème, réaction anaphylactique) peut se produire. Contactez immédiatement un médecin, si vous ressentez des symptômes tels que des difficultés à avaler ou à respirer, des sensations vertigineuses, un gonflement des lèvres, du visage, de la gorge ou de la langue, une éruption cutanée.
Chez l’homme
La plupart des effets indésirables sont attendus, en raison du changement du taux de testostérone dans le corps. Ces effets incluent les bouffées de chaleur, l’impuissance et la baisse de la libido.
Très fréquents (concernent plus de 1 patient sur 10)
· Baisse de la libido
· Fourmillements dans les jambes.
· Bouffées de chaleur.
· Transpiration excessive.
· Douleur dorsale.
· Impuissance
· Sensation de faiblesse.
Fréquents (concernent de 1 à 10 patients sur 100)
· Anémie (diminution du nombre de globules rouges).
· Réaction allergique.
· Dépression, changements d’humeur, perte de la libido.
· Sensations vertigineuses, maux de tête.
· Tension artérielle élevée.
· Bouche sèche, nausées.
· Douleurs osseuses et musculaires, douleurs des extrémités des membres.
· Douleur dans la partie inférieure de l’abdomen.
· Réactions au site d’injection (rougeur, inflammation et douleur), œdème (accumulation de liquide dans les tissus).
· Augmentation du poids.
Peu fréquents (concernent de 1 à 10 patients sur 1 000)
· Augmentation du nombre de plaquettes dans le sang.
· Perte d’appétit, diabète, goutte (douleur intense et gonflement des articulations, généralement du gros orteil), excès de lipides dans le sang, augmentation de l’appétit.
· Insomnie, irritabilité.
· Fourmillements ou engourdissement.
· Troubles de la vision.
· Bourdonnements d’oreilles, vertige.
· Palpitations.
· Difficulté à respirer, saignements de nez.
· Douleur abdominale, constipation, diarrhée, vomissements.
· Acné, chute des cheveux, rougeur de la peau, démangeaisons, éruption cutanée, urticaire.
· Douleur articulaire, douleur osseuse, crampe musculaire, faiblesse musculaire, douleur musculaire.
· Réveil nocturne pour uriner, difficulté d’uriner.
· Gonflement des seins, douleur des seins, réduction de la taille des testicules, douleur des testicules.
· Etat de sommeil profond, gonflement des chevilles, pieds et doigts, douleur, frissons, somnolence.
· Modification de certains examens sanguins (incluant une augmentation des marqueurs du foie), pression artérielle augmentée, perte de poids.
Rares (concernent de 1 à 10 patients sur 10 000)
· Inflammation du nez, de la gorge.
· Etat confusionnel, baisse de l’activité, euphorie.
· Troubles de la mémoire.
· Sensation anormale dans les yeux vision anormale.
· Tension artérielle basse.
· Respiration courte en position couchée.
· Ballonnements, anomalies du goût, flatulence.
· Ampoules cutanées, coloration rouge ou violette de la peau.
· Raideur articulaire, gonflement des articulations, raideur musculo-squelettique, arthrose.
· Douleur thoracique, difficulté à rester debout, symptômes pseudo-grippaux, fièvre.
Fréquence indéterminée (la fréquence ne peut être estimée sur la base des données disponibles)
· Réaction allergique grave pouvant provoquer un gonflement du visage, de la langue et du cou, des sensations de vertiges ou des difficultés à respirer (œdème de Quincke, choc anaphylactique).
· Anxiété.
· En cas de présence d’une tumeur hypophysaire, risque accru de saignement au niveau de la tumeur (apoplexie hypophysaire).
· Modifications de l’électrocardiogramme (allongement de l’intervalle QT).
· Incontinence urinaire.
· Malaise général.
Comme avec les autres analogues de la GnRH, une augmentation du nombre de globules blancs peut être observée avec DECAPEPTYL L.P. 11,25 mg.
Les patients traités au long cours par analogue de la GnRH en association avec la radiothérapie peuvent avoir plus d’effets secondaires en particulier gastro-intestinaux, liés à la radiothérapie.
Chez la femme
La plupart des effets secondaires sont attendus en raison du changement du niveau d'œstrogènes dans l'organisme.
Effets indésirables très fréquents (concernent plus de 1 patient sur 10)
· Difficultés à dormir, changements d’humeur, diminution de la libido.
· Maux de tête.
· Bouffées de chaleur.
· Acné, transpiration excessive, peau grasse.
· Affection des seins.
· Douleur pendant ou après les rapports sexuels, saignements génitaux, syndrome d’hyperstimulation ovarienne (se manifestant par une augmentation de la taille des ovaires et une rétention d’eau), augmentation de la taille des ovaires, douleurs dans le bas ventre, sécheresse vaginale.
· Sensation de faiblesse.
Effets indésirables fréquents (concernent de 1 à 10 patients sur 100)
· Réaction allergique.
· Dépression (en cas de traitement de longue durée), nervosité.
· Sensation vertigineuse.
· Nausées, douleur ou gène abdominales.
· Douleurs articulaires, crampes musculaires, douleur dans les bras et les jambes.
· Douleur des seins.
· Réaction au site d'injection (incluant douleur, gonflement, rougeur et inflammation).
· Œdème des chevilles, pieds et doigts.
· Prise de poids.
Effets indésirables peu fréquents (concernent de 1 à 10 patients sur 1000)
· Appétit diminué.
· Rétention d’eau.
· Variabilité émotionnelle, anxiété, dépression (en cas de traitement de courte durée), altération de la faculté de se repérer dans le temps et dans l'espace.
· Anomalie du goût, diminution de la sensibilité, perte de connaissance temporaire et brutale, perte de mémoire, manque de concentration, fourmillements ou engourdissement, tremblements.
· Sécheresse des yeux, troubles de la vision.
· Vertige.
· Palpitations.
· Difficulté à respirer, saignements de nez.
· Ballonnements, bouche sèche, flatulence, lésion de la bouche, vomissement.
· Chute de cheveux, peau sèche, excès de poils sur le corps, ongles cassants, démangeaisons, éruption cutanée.
· Douleur dorsale, douleur musculaire.
· Saignements pendant les rapports sexuels, descente de la vessie dans le vagin, saignements en dehors des règles, règles douloureuses, règles abondantes, kyste de l’ovaire qui peut provoquer une douleur, pertes vaginales.
· Perte de poids.
Effets indésirables rapportés après la commercialisation (leur fréquence ne peut pas être estimée sur la base des données disponibles)
· Réaction allergique grave pouvant provoquer un gonflement du visage, de la langue, et du cou, des sensations de vertige ou des difficultés à respirer (œdème de Quincke, choc anaphylactique).
· Convulsions.
· État confusionnel.
· Perturbation visuelle.
· En cas de présence d’une tumeur hypophysaire, risque accru de saignement au niveau de la tumeur.
· Tension artérielle élevée.
· Diarrhée
· Urticaire.
· Faiblesse musculaire.
· Absence de règles.
· Fièvre, malaise général.
· Modification de certains examens sanguins (incluant une augmentation des marqueurs du foie).
Dans le cadre du traitement de l’endométriose, il est possible d’observer en début de traitement une accentuation des troubles qui l’ont motivé (douleurs abdominales, dysménorrhée) mais qui doivent disparaître en 1 à 2 semaines. Ces phénomènes peuvent survenir même si l’effet du traitement est favorable. Il faut cependant absolument en avertir immédiatement votre médecin traitant.
Chez l’enfant
Effets indésirables très fréquents (concernent plus de 1 patient sur 10)
· Saignements vaginaux et pertes vaginales chez les filles.
Effets indésirables fréquents (concernent de 1 à 10 patients sur 100)
· Réaction allergique.
· Mal de tête.
· Bouffées de chaleur.
· Douleur abdominale.
· Acné.
· Réaction au site d'injection (rougeur, inflammation et/ou douleur).
· Prise de poids.
Effets indésirables peu fréquents (concernent de 1 à 10 patients sur 1 000)
· Obésité.
· Changement d’humeur.
· Troubles de la vision.
· Saignements de nez.
· Vomissement, constipation, nausées.
· Démangeaisons, éruption cutanée, urticaire.
· Douleur du cou.
· Douleur des seins.
· Malaise général.
Un essai clinique à long terme (jusqu’à 4 ans de traitement) n’a pas mis en évidence de nouveau problème de sécurité significatif.
Effets indésirables rapportés après la commercialisation (leur fréquence ne peut pas être estimée sur la base des données disponibles)
· Réaction allergique grave pouvant provoquer un gonflement du visage, de la langue et du cou, des sensations de vertige ou des difficultés à respirer (œdème de Quincke et choc anaphylactique).
· Convulsions.
· Instabilité émotionnelle, dépression, nervosité.
· Vision anormale.
· Tension artérielle élevée.
· Douleurs musculaires.
· Modification de certains examens sanguins (incluant une augmentation de certaines hormones).
· Hypertension intracrânienne idiopathique (augmentation de la pression intracrânienne autour du cerveau, caractérisée par des maux de tête, une vision double et d'autres symptômes visuels, ainsi que des bourdonnements ou des sifflements d'oreilles).
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr
En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.
5. COMMENT CONSERVER DECAPEPTYL L.P. 11,25 mg, poudre et solvant pour suspension injectable (IM ou SC) forme à libération prolongée sur 3 mois ?
Tenir ce médicament hors de la vue et de la portée des enfants.
N’utilisez pas ce médicament après la date de péremption indiquée sur la boîte après EXP. La date de péremption fait référence au dernier jour de ce mois.
A conserver à une température ne dépassant pas 25 ºC.
Après reconstitution, une utilisation immédiate est recommandée.
N’utilisez pas DECAPEPTYL L.P. 11,25 mg si vous remarquez des signes visibles de détérioration au niveau de l’emballage ou des blisters. Retournez le médicament chez votre pharmacien.
Ne jetez aucun médicament au tout-à-l’égout ou avec les ordures ménagères. Demandez à votre pharmacien d’éliminer les médicaments que vous n’utilisez plus. Ces mesures contribueront à protéger l’environnement.
6. CONTENU DE L’EMBALLAGE ET AUTRES INFORMATIONS
· La substance active est :
Triptoréline (sous forme de pamoate de triptoréline).................................................... 11,25 mg*
Pour une unité de prise
*Compte tenu des caractéristiques de la forme pharmaceutique, chaque flacon contient une quantité de pamoate de triptoréline correspondant à 15 mg de triptoréline.
· Les autres composants sont :
Composition de la poudre : polymère D,L lactide-coglycolide ; mannitol ;carmellose sodique ; polysorbate 80.
Composition du solvant : mannitol ; eau pour préparations injectables.
Ce médicament se présente sous forme de poudre et solvant pour suspension injectable (IM ou SC) à libération prolongée. Boîte de 1 flacon de poudre + 1 ampoule de solvant.
Titulaire de l’autorisation de mise sur le marché
70 RUE BALARD
75015 PARIS
Exploitant de l’autorisation de mise sur le marché
70 RUE BALARD
75015 PARIS
PARC D’ACTIVITES DU PLATEAU DE SIGNES
83870 SIGNES
Noms du médicament dans les Etats membres de l'Espace Economique Européen
Sans objet.
La dernière date à laquelle cette notice a été révisée est :
{MM/AAAA}
Des informations détaillées sur ce médicament sont disponibles sur le site Internet de l’ANSM (France).
Les informations suivantes sont destinées exclusivement aux professionnels de santé (voir rubrique 3) :
INSTRUCTIONS D’UTILISATION
Avant d’injecter lire attentivement la notice.
|
1 – PREPARATION DU PATIENT AVANT LA RECONSTITUTION DU MEDICAMENT |
|||
|
Désinfecter la peau au site d’injection en premier car le médicament doit être administré immédiatement après sa reconstitution. Le site d’injection est : · Pour les femmes et les enfants : le muscle fessier (voie intramusculaire) · Pour les hommes : le muscle fessier (voie intramusculaire) ou l’abdomen ou la cuisse (voie sous-cutanée) |
|||
|
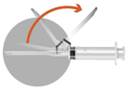
2 – PREPARATION DE L’INJECTION |
|||
|
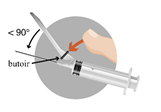
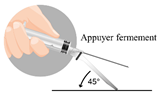
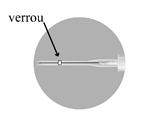
Trois aiguilles sont fournies dans la boîte, utiliser UNIQUEMENT DEUX DE CES AIGUILLES. Aiguille 1 : une aiguille longue (38 mm) sans système de sécurité à utiliser pour la reconstitution dans tous les cas. Aiguille 2 : une aiguille longue (38 mm) avec un système de sécurité à utiliser pour une injection intramusculaire (HOMMES, FEMMES, ENFANTS). Aiguille 3 : une aiguille courte (25 mm) avec un système de sécurité à utiliser pour une injection sous-cutanée (HOMMES UNIQUEMENT). |
|||
|
Aiguille 1 – 38 mm – 20G |
Aiguille 2 – 38 mm – 20G |
Aiguille 3 – 25 mm – 20G |
|
|
|
|
|
|
|
La présence de bulles au-dessus du lyophilisat est un aspect normal du produit. Les étapes suivantes doivent être effectuées les unes après les autres sans interruption. |
|||
|
2a · Sortez l'ampoule contenant le solvant. Si une partie de la solution est bloquée dans le haut de l’ampoule, la tapoter afin de la faire descendre dans le corps de l’ampoule. · Visser l’aiguille 1 (sans système de sécurité) sur la seringue. Ne pas retirer le capuchon de l’aiguille à ce stade. · Casser le haut de l’ampoule en positionnant le point face à soi. · Retirer le capuchon de l’aiguille 1. Insérer l’aiguille dans l’ampoule et prélever la totalité du solvant dans la seringue. Mettre la seringue contenant le solvant de côté. |
|
||
|
2b · Sortir le flacon contenant la poudre. Tapoter pour ramener au fond du flacon la poudre éventuellement accumulée en haut du flacon. · Retirer le capuchon en plastique du flacon. · Reprendre la seringue contenant le solvant et enfoncer verticalement l’aiguille au travers du bouchon en élastomère du flacon. Injecter le solvant lentement, de façon à, si possible, rincer toute la partie supérieure du flacon. |
|
||
|
2c · Remonter l'aiguille 1 au-dessus du niveau du liquide et reconstituer la suspension en agitant horizontalement le flacon. · Agiter le temps nécessaire (au moins 30 secondes) à l’obtention d’une suspension homogène et laiteuse. · Important : Vérifier l’absence d’agglomérats (en cas d’agglomérats poursuivre l’agitation jusqu’à complète homogénéisation). |
|
||
|
2d · Quand la suspension est homogène, descendre l’aiguille et, sans retourner le flacon, aspirer toute la suspension dans la seringue. Une petite quantité de suspension restera dans le flacon et devra être éliminée. Un excès de poudre et de solvant est prévu lors de la fabrication pour autoriser cette perte lors de la préparation de la seringue. · Enlever l’aiguille 1 utilisée pour la reconstitution en la saisissant par l’embout coloré. Visser sur la seringue l’aiguille correspondant au type d’injection : o Pour une injection intramusculaire, l’aiguille 2 (aiguille longue avec un système de sécurité) ou o Pour une injection sous-cutanée, chez l’homme uniquement, l’aiguille 3 (aiguille courte avec un système de sécurité) · Faire basculer le manchon de protection de l'aiguille vers le corps de la seringue. Le manchon de protection reste dans la position que vous définissez. · Enlever le capuchon de l’aiguille. · Amorcer l’aiguille en vidant l’air contenu dans la seringue et injecter immédiatement. |
|
||
|
|
|||
|
3 – INJECTION |
|||
|
Pour éviter la sédimentation, injecter immédiatement dans la zone désinfectée le plus rapidement possible (dans la minute suivant la reconstitution).
· FEMMES, ENFANTS o Injection intramusculaire dans le muscle glutéal (muscle fessier) avec l’aiguille 2 (aiguille longue).
· HOMMES o Injection intramusculaire dans le muscle glutéal (muscle fessier) avec l’aiguille 2 (aiguille longue). o Injection sous-cutanée dans la paroi abdominale ou la face latérale des cuisses avec l’aiguille 3 (aiguille courte). Saisir la peau de l’abdomen ou de la cuisse pour dégager le tissu sous-cutané et insérer l’aiguille avec un angle compris entre 30 et 45 degrés. |
Hommes, femmes, enfants |
||
|
(intramusculaire) |
|||
|
|
|||
|
OU |
|||
|
Hommes uniquement |
|||
|
(sous-cutanée) |
|||
|
|
|||
|
4 – APRES UTILISATION |
|||
|
· Activer le système de sécurité en utilisant la technique à une main o Remarque : garder constamment votre doigt derrière le butoir Il existe deux méthodes pour activer le système de sécurité : § Méthode A : pousser le butoir avec votre doigt Ou
§ Méthode B : pousser la gaine de protection sur une surface plane. o Dans les deux cas, appuyer avec un mouvement ferme rapide jusqu’à l’audition d’un clic. o Vérifier visuellement que l’aiguille est complètement prise dans le manchon de protection. · Les aiguilles utilisées, toute suspension non utilisée ou déchet doivent être éliminés conformément à la réglementation en vigueur. |
Méthode A |
||
|
|
|||
|
OU |
|||
|
Méthode B |
|||
|
|
|||
|
|
|||