Dernière mise à jour le 01/12/2025
LAMISILATE MONODOSE 1 %, solution pour application cutanée
Indications thérapeutiques
Classe pharmacothérapeutique - AUTRES ANTIFONGIQUES TOPIQUES - code ATC : D01AE15
LAMISILATE MONODOSE 1 % tue les champignons microscopiques responsables du pied d'athlète. Après application sur les pieds, la solution laisse un film transparent sur la peau délivrant la substance active dans votre peau.
Comment reconnaître un pied d'athlète (voir rubrique 6 « Conseil d’éducation sanitaire »).
Présentations
> 1 tube(s) polyéthylène aluminium de 4 g
Code CIP : 377 068-4 ou 34009 377 068 4 1
Déclaration de commercialisation : 20/03/2007
Cette présentation n'est pas agréée aux collectivités
Service médical rendu (SMR)
Pas de SMR disponible pour ce médicament ( plus d'informations dans l'aide )
Amélioration du service médical rendu (ASMR)
Pas d'ASMR disponible pour ce médicament (plus d'informations dans l'aide )
ANSM - Mis à jour le : 05/12/2023
LAMISILATE MONODOSE 1%, solution pour application cutanée
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Terbinafine ....................................................................................................................... 10,00 mg
Sous forme de chlorhydrate de terbinafine.......................................................................... 11,25 mg
Pour 1 g de solution.
Excipient à effets notoires : Ethanol à 96% (863,75 mg/g).
Pour la liste complète des excipients, voir rubrique 6.1.
Solution pour application cutanée.
Solution visqueuse, incolore, claire à légèrement opalescente.
4.1. Indications thérapeutiques
Lamisilate Monodose est indiqué dans le traitement des intertrigos interdigito-plantaires ou pied d'athlète chez l’adulte (voir rubrique 4.4).
4.2. Posologie et mode d'administration
Voie cutanée uniquement.
Adultes âgés de 18 ans et plus : Durée et fréquence du traitement :
LAMISILATE MONODOSE 1 % doit être appliqué en une seule fois sur les deux pieds, même si un seul pied semble présenter des lésions. Ainsi, cela permet d'éradiquer les dermatophytes présents sur des lésions non visibles.
Les symptômes cliniques commencent généralement à s’améliorer après quelques jours.
En l’absence d’amélioration des symptômes au bout d’une semaine après l’arrêt du traitement, il est recommandé aux patients de demander conseil auprès d’un pharmacien pour vérifier que le produit a été correctement utilisé ou consulter un médecin pour vérifier le diagnostic.
Il n’existe pas de données sur les traitements répétés avec ce produit, par conséquent, un second traitement ne peut être recommandé dans le cadre d’un épisode particulier de tinea pedis.
Posologie chez les populations particulières
Population pédiatrique
La sécurité de LAMISILATE MONODOSE 1 % chez les enfants n’a pas encore été établie. Son utilisation n’est donc pas recommandée chez les patients de moins de 18 ans.
Mode d’administration
La solution devra être appliquée après avoir soigneusement nettoyé et séché les deux pieds et les mains. Traiter d'abord un pied puis l'autre.
Appliquer une fine couche de solution en commençant par les orteils (espace inter-orteils et zone périphérique), puis appliquer sur l'intégralité de la voûte plantaire ainsi que sur les côtés latéraux du pied jusqu'à hauteur de 1,5 cm.
Recommencer cette opération sur l'autre pied même s'il ne semble pas atteint.
Puis, laisser sécher la solution pendant 1 à 2 minutes jusqu'à formation d'un film.
Se laver ensuite les mains.
Ne pas masser la zone traitée.
Pour un meilleur résultat, la zone traitée ne doit pas être lavée pendant 24 heures après l'application.
C'est pourquoi, il est recommandé d'appliquer LAMISILATE MONODOSE 1 % juste après la toilette (bain ou douche) et d'attendre 24 heures avant de se laver en douceur à nouveau les pieds. Séchez-vous ensuite les pieds en tamponnant délicatement.
Une quantité suffisante de produit devra être utilisée pour traiter les 2 pieds selon les instructions précédentes. La quantité de solution restant dans le tube devra être jetée.
Personnes âgées
Il n’a pas été mis en évidence que les personnes âgées nécessitaient une adaptation de la posologie ou que les effets indésirables étaient différents de ceux présentés chez des patients plus jeunes.
Hypersensibilité connue à la substance active ou à l'un des excipients mentionnés à la rubrique 6.1.
4.4. Mises en garde spéciales et précautions d'emploi
L'utilisation est limitée à l'usage externe.
Ce produit peut être irritant pour les yeux.
En cas de contact accidentel avec les yeux, rincer très soigneusement les yeux avec de l'eau courante.
LAMISILATE MONODOSE 1 % doit être tenue hors de la vue et de la portée des enfants.
LAMISILATE MONODOSE 1 % n’est pas recommandé dans le traitement du pied mocassin (dermatophytie plantaire hyperkératosique chronique).
En cas de réaction allergique, enlever le film à l'aide d'un solvant organique comme de l'alcool dénaturé puis rincer les pieds à l'eau chaude avec du savon.
Informations concernant les excipients
Contient de l’éthanol ; tenir loin des sources de chaleur.
Ce médicament contient 3316,8 mg d’alcool (éthanol) pour chaque dose quotidienne, ce qui correspond à 863,75 mg/g d’éthanol à 96%.
L’éthanol peut causer une sensation de brûlure sur une peau lésée.
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
Aucune donnée d'interaction médicamenteuse n’est connue avec LAMISILATE MONODOSE 1%.
4.6. Fertilité, grossesse et allaitement
Grossesse
Il n’existe pas de données disponibles sur l’utilisation de la terbinafine chez la femme enceinte. Les études effectuées chez l’animal n’ont pas mis en évidence d’effet délétère sur la grossesse ou sur la santé du fœtus (voir rubrique 5.3).
L'utilisation de LAMISILATE MONODOSE 1 % ne doit être envisagée pendant la grossesse que si nécessaire.
La terbinafine est excrétée dans le lait maternel. Après une utilisation topique uniquement, une exposition systémique faible est attendue.
La terbinafine ne doit être utilisé chez les femmes allaitantes seulement si les bénéfices attendus justifient le risque vis-à-vis du nourrisson. De plus, les nourrissons ne doivent en aucun cas être mis en contact avec les zones de la peau traitées et notamment les seins.
Fertilité
Les études chez l’animal n’ont pas mis en évidence d’effet de la terbinafine sur la fertilité (voir rubrique 5.3).
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
Résumé du profil de sécurité
Les effets indésirables correspondent à des réactions au site d'application mineures et réversibles. Dans de très rares cas, des réactions allergiques peuvent apparaître.
Tableau récapitulatif des effets secondaires
Les effets indésirables sont listés ci-dessous par classe de système ou d’organe et par fréquence, selon la convention suivante : Très fréquent (≥ 1/10), fréquent (≥ 1/100 à < 1/10), peu fréquent (≥ 1/ 1 000 à < 1/100), rare (≥ 1/10 000 à < 1/1 000), très rare (< 1/10 000), incluant les cas isolés et fréquence indéterminée (ne peut être estimée à partir des données disponibles).
Au sein de chaque groupe de fréquence, les effets indésirables sont présentés dans l’ordre de gravité décroissante.
Description des effets indésirables
· Troubles cutanés et sous cutanés :
o Très rare (< 1/10 000 incluant des cas isolés) : des réactions allergiques tels que prurit, éruption cutanée, éruption bulleuse et urticairienne.
o Fréquence indéterminée (ne peut être estimée à partir des données disponibles) : exfoliation de la peau, décoloration de la peau, érythème.
· Troubles généraux :
o Peu fréquents (> 1/1 000, < 1/100) : une sécheresse de la peau, une irritation de la peau ou une sensation de brûlure ont été observées au site d’application.
o Fréquence indéterminée (ne peut être estimée à partir des données disponibles) : douleur au site d’application.
· Troubles oculaires :
o Fréquence indéterminée (ne peut être estimée à partir des données disponibles) : irritation des yeux.
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : www.signalement.social-sante.gouv.fr.
En cas d’ingestion accidentelle, prendre en compte la présence d’éthanol (81,05%v/v) de LAMISILATE MONODOSE 1 % solution.
Un surdosage est peu probable puisque cette présentation contient la quantité de médicament nécessaire pour une administration unique par voie cutanée.
Une ingestion accidentelle d'un tube de 4 g contenant 40 mg de terbinafine est largement inférieure à la quantité apportée par la prise d'un comprimé de 250 mg de LAMISIL (dose orale unitaire chez l’adulte).
Si plusieurs tubes de LAMISILATE MONODOSE 1 %, solution étaient ingérés, par inadvertance, des effets similaires à ceux observés avec un surdosage de LAMISIL comprimés pourraient être observés. Cela inclut les céphalées, nausées, douleurs gastriques et vertiges.
Traitement du surdosage
En cas d’ingestion accidentelle, le traitement recommandé du surdosage consiste à éliminer la substance active, par administration de charbon actif essentiellement, et traiter symptomatiquement si nécessaire.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Classe pharmacothérapeutique : ANTIFONGIQUES TOPIQUES, code ATC : D01AE15.
Mécanisme d’action et Effets pharmacodynamiques
La terbinafine appartient à la classe des allylamines et interfère spécifiquement et de façon précoce sur la biosynthèse de l'ergostérol constituant de la membrane cellulaire du champignon. Ceci aboutit à un déficit en ergostérol et à l'accumulation intracellulaire de squalène responsable de son action fongicide.
La terbinafine agit par inhibition de la squalène-époxydase dans la membrane cellulaire du champignon. L'enzyme squalène-époxydase n'est pas liée au système cytochrome P-450. La terbinafine ne modifie pas le métabolisme des hormones et des autres médicaments.
La terbinafine est un antifongique à large spectre actif sur les affections fongiques cutanées dues à des dermatophytes tels que Trichophyton (T. Rubrum, T. Mentagrophytes, T. Verrucosum, T. Violaceum), Microsporum canis et Epidermophyton floccosum.
A faible concentration, la terbinafine est fongicide vis-à-vis des dermatophytes.
Une étude chez des patients atteints de lésions entre les orteils avec extension aux zones périphériques comme la voûte plantaire et les côtés latéraux du pied, a montré l'efficacité clinique dans le pied d'athlète, d'une application unique de LAMISILATE MONODOSE 1 % sur les deux pieds.
La terbinafine a une action longue durée. Moins de 12,5% des patients souffrant de pied d’athlète et traités par la terbinafine 1% solution ont présenté une rechute ou une nouvelle infection dans les 3 mois suivant le traitement.
5.2. Propriétés pharmacocinétiques
Mouiller le film diminue la quantité de terbinafine délivrée au niveau du stratum corneum, c'est pourquoi, il n'est pas recommandé de laver ou mouiller les pieds pendant les 24 heures qui suivent l'application de ce produit, afin de permettre une pénétration optimale de la terbinafine dans le stratum corneum.
Les conditions occlusives probablement rencontrées après application unique de LAMISILATE MONODOSE 1 %, augmenteraient de 2,7 fois, la concentration de la terbinafine dans le stratum corneum.
Bien que cela n'ait pas été étudié, la diffusion de la terbinafine dans le stratum corneum est probablement plus importante chez les patients ayant un pied d'athlète comparativement à celle observée au niveau du dos chez le volontaire sain. Cela s'explique par l'effet occlusif présent au niveau de l'espace interdigital, qui est probablement augmenté avec le port de chaussures, plutôt que du fait de la lésion présente au niveau du stratum corneum du pied.
L'exposition systémique est très faible chez les volontaires sains comme chez les patients atteints d'un pied d'athlète. Une application cutanée de LAMISILATE MONODOSE 1 % dans le dos, sur une surface équivalente à 3 fois celle des 2 pieds, semble correspondre à moins de 0,5 % de la dose administrée avec du LAMISIL 250 mg comprimé.
5.3. Données de sécurité préclinique
Lors d'une étude de cancérogenèse menée pendant deux ans chez la souris, aucune formation néoplasique ou autre production anormale attribuable au traitement n'a été mise en évidence après administration orale de doses allant jusqu'à 130 mg/kg/jour (mâles) et 156 mg/kg/jour (femelles).
Lors d'une étude identique menée chez le rat, les mâles traités à la plus forte dose (soit 69 mg/kg/jour) ont montré une incidence accrue de tumeurs hépatiques. Il a été démontré que cette observation, pouvant être associée à une prolifération des peroxisomes, était spécifique de cette espèce animale car non retrouvée dans l'étude de carcinogénicité chez la souris ou dans les études menées chez la souris, les chiens ou les singes.
Au cours des études à hautes doses orales de terbinafine chez le singe, des irrégularités de réfraction au niveau de la rétine ont été notées aux posologies les plus fortes (dose sans effet toxique 50 mg/kg). Ces irrégularités, non accompagnées de modifications histologiques, étaient associées à la présence d'un métabolite de la terbinafine dans le tissu oculaire et ont disparu après l'arrêt du traitement.
Une batterie standard de tests de génotoxicité réalisés in vitro et in vivo n'a révélé aucun potentiel mutagène ou clastogène du produit.
Par ailleurs, la terbinafine n'a pas altéré la fertilité ni les autres paramètres de reproduction des rats ou des lapins.
Après administrations cutanées répétées chez le rat et le cochon d'Inde de LAMISILATE MONODOSE 1 % solution, la concentration plasmatique mesurée est au moins de 50 à 100 fois plus faible à celle provoquant des effets indésirables lors des études de toxicité chez l'animal. L'apparition d'effets systémiques avec ce médicament peut être exclue.
L'application de LAMISILATE MONODOSE 1 % solution a été bien tolérée lors des nombreuses études de tolérance et n'a pas causé de réaction d'hypersensibilité.
Les données de sécurité de l'acrylate et du copolymère d'octylacrylamide, excipient utilisé pour la première fois dans la formulation d'un médicament pour application cutanée, ont été établies sur la base des études conventionnelles de toxicité en administrations unique et répétées, des études de génotoxicité et de tolérance locale.
3 ans.
6.4. Précautions particulières de conservation
A conserver dans le conditionnement primaire d'origine, à l'abri de la lumière.
A conserver à une température ne dépassant pas 30°C.
6.5. Nature et contenu de l'emballage extérieur
Tube de 4 g en laminé aluminium (PE/Aluminium/PE) muni d'un bouchon en polyéthylène.
6.6. Précautions particulières d’élimination et de manipulation
Pas d’exigences particulières.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
BOX 16184
103 24 STOCKHOLM
SUÈDE
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· 34009 377 068 4 1 : 4 g en tube (PE/Aluminium/PE)
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
[à compléter ultérieurement par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE
[à compléter ultérieurement par le titulaire]
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Médicament non soumis à prescription médicale.
ANSM - Mis à jour le : 05/12/2023
LAMISILATE MONODOSE 1%, solution pour application cutanée
Terbinafine
Vous devez toujours utiliser ce médicament en suivant scrupuleusement les informations fournies dans cette notice ou par votre médecin ou votre pharmacien.
· Gardez cette notice. Vous pourriez avoir besoin de la relire.
· Adressez-vous à votre pharmacien pour tout conseil ou information.
· Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
· Vous devez vous adresser à votre médecin si vous ne ressentez aucune amélioration ou si vous vous sentez moins bien après 7 jours.
1. Qu'est-ce que LAMISILATE MONODOSE 1%, solution pour application cutanée et dans quels cas est-il utilisé ?
2. Quelles sont les informations à connaître avant d'utiliser LAMISILATE MONODOSE 1%, solution pour application cutanée ?
3. Comment utiliser LAMISILATE MONODOSE 1%, solution pour application cutanée ?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver LAMISILATE MONODOSE 1%, solution pour application cutanée ?
6. Contenu de l’emballage et autres informations.
1. QU’EST-CE QUE LAMISILATE MONODOSE 1%, solution pour application cutanée ET DANS QUELS CAS EST-IL UTILISE ?
Classe pharmacothérapeutique - AUTRES ANTIFONGIQUES TOPIQUES - code ATC : D01AE15
LAMISILATE MONODOSE 1 % tue les champignons microscopiques responsables du pied d'athlète. Après application sur les pieds, la solution laisse un film transparent sur la peau délivrant la substance active dans votre peau.
Comment reconnaître un pied d'athlète (voir rubrique 6 « Conseil d’éducation sanitaire »).
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT D’UTILISER LAMISILATE MONODOSE 1%, solution pour application cutanée ?
N’utilisez jamais LAMISILATE MONODOSE 1 %, solution pour application cutanée dans les cas suivants :
· Si vous êtes allergique à la terbinafine ou à l'un des autres composants contenus dans ce médicament mentionnés dans la rubrique 6.
· Parlez-en à votre médecin ou pharmacien si vous êtes concerné et n’utilisez pas LAMISILATE MONODOSE 1%.
Avertissements et précautions
N'utilisez pas ce médicament si vous êtes atteint d'une affection chronique de la voûte plantaire avec épaississement de la peau. Si c’est le cas, consultez votre médecin, il vous prescrira un traitement plus adapté.
LAMISILATE MONODOSE 1% est limité à un usage externe. Ne pas utiliser dans la bouche. Ne pas avaler.
L’utilisation de ce médicament est réservée pour traiter la peau des pieds. Ne pas appliquer sur le visage et les yeux ou sur une peau altérée (après une exposition au soleil ou une desquamation cutanée sévère) car l’alcool contenu dans ce produit pourrait être irritant.
En cas de contact accidentel avec les yeux, laver abondamment avec de l'eau courante. Si une gêne persiste, consultez votre médecin.
Contient de l'éthanol, tenir loin des sources de chaleur.
Enfants et adolescents
Ne pas utiliser ce médicament chez les enfants et adolescents de moins de 18 ans.
Tenir hors de la vue et de la portée des enfants.
Autres médicaments et LAMISILATE MONODOSE 1 %, solution pour application cutanée
Informez votre médecin ou pharmacien si vous utilisez, avez récemment utilisé ou pourriez utiliser tout autre médicament. Ne pas appliquer un autre produit sur la zone traitée par LAMISILATE MONODOSE 1% (qu’il s’agisse d’un traitement obtenu sur ordonnance ou non).
Ce médicament contient un antifongique : la terbinafine. Il est actif contre les champignons de la peau.
VOUS NE DEVEZ PAS PRENDRE EN MEME TEMPS QUE CE MEDICAMENT D’AUTRES MEDICAMENTS ANTIFONGIQUES SANS AVIS MEDICAL
LAMISILATE MONODOSE 1 %, solution pour application cutanée avec des aliments et boissons
Sans objet.
Si vous êtes enceinte, si vous pensez être enceinte ou planifiez une grossesse, demandez conseil à votre médecin ou à votre pharmacien avant d'utiliser ce médicament. L’utilisation de LAMISILATE MONODOSE 1% ne doit être envisagée pendant la grossesse qu’en cas de nécessité.
Ce médicament peut passer dans le lait maternel. Si vous allaitez, demandez conseil à votre médecin ou à votre pharmacien avant d’utiliser ce médicament.
Les nourrissons ne doivent en aucun cas être mis en contact avec la peau traitée, et notamment les seins.
Conduite de véhicules et utilisation de machines
L'utilisation de LAMISILATE MONODOSE 1 % n'a pas d'effet sur l'aptitude à conduire des véhicules et à utiliser des machines.
LAMISILATE MONODOSE 1 %, solution pour application cutanée contient de l’éthanol à 96%.
Ce médicament contient 3316,8 mg d’alcool (éthanol) pour chaque dose quotidienne, ce qui correspond à 863,75 mg/g d’éthanol à 96%.
L’éthanol peut causer une sensation de brûlure sur une peau lésée.
3. COMMENT UTILISER LAMISILATE MONODOSE 1%, solution pour application cutanée ?
Posologie, fréquence d'administration, durée du traitement, mode d'administration
Réservé à l'adulte. Ne pas utiliser chez les moins de 18 ans.
Appliquez en une seule fois. Ne pas appliquer une seconde fois.
Appliquez LAMISILATE MONODOSE 1 % sur les deux pieds, même si les signes sont visibles seulement sur un seul pied. Cela permettra d'éliminer les champignons responsables de cette infection qui peuvent être présents à d'autres endroits du pied, même si cela n'est pas encore visible.
Quand vous appliquez la solution, celle-ci sèche rapidement pour former un film transparent. La quantité de produit disponible dans ce tube a été spécialement conçue pour traiter les deux pieds.
LAMISILATE MONODOSE 1 % délivre dans la peau la substance active qui y reste plusieurs jours afin d'éliminer les champignons à l'origine du pied d'athlète (mycose). Pour obtenir les meilleurs résultats, vous ne devez pas laver ou mouiller vos pieds pendant les 24 heures qui suivent l'application de ce produit.
Quand utiliser LAMISILATE MONODOSE 1 %, solution pour application cutanée :
Appliquez LAMISILATE MONODOSE 1 %, solution après la toilette (bain ou douche).
Comment appliquer LAMISILATE MONODOSE 1 %, solution pour application cutanée :
C'est un traitement pour application unique.
Lavez-vous les deux pieds et séchez-les soigneusement.
Lavez et séchez-vous les mains.
Enlevez le bouchon du tube.
Appliquez sur les deux pieds. Pour cela utilisez environ la moitié du tube sur un pied en quantité suffisante pour recouvrir la zone à traiter. Finissez l'application d'abord sur ce pied, avant de traiter l'autre.
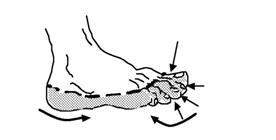
Appliquez avec le doigt la solution sur chaque pied selon le schéma ci-dessous : Etalez uniformément d'abord entre et autour des orteils puis sur l'intégralité de la voûte plantaire et des côtés latéraux du pied.
Ne pas frotter, ni masser.
|
|
|
Traitez le deuxième pied de la même manière, même s'il ne semble pas atteint. Cela permet d'éliminer les champignons responsables de cette infection qui peuvent être présents sur l'autre pied même si cela n'est pas encore visible.
Laissez sécher le produit pendant 1 à 2 minutes sur le pied jusqu'à formation d'un film avant de vous chausser.
Refermez le tube et jetez le produit s’il en reste (voir rubrique 5. de la notice pour savoir comment jeter ce médicament). Ne gardez pas le produit restant et ne le donnez à personne.
Lavez-vous les mains avec de l'eau chaude et au savon après application.
Ne pas laver ou mouiller vos pieds pendant les 24 heures qui suivent l'application de ce produit. Séchez-vous les pieds en les tamponnant doucement après les avoir lavé délicatement.
Ne pas appliquer une seconde fois le produit.
LAMISILATE MONODOSE 1 % agît immédiatement en tuant les champignons microscopiques. Le film formé après application unique permet au principe actif de pénétrer dans votre peau, où il reste actif pendant plusieurs jours. L'état de votre peau devrait s'améliorer en quelques jours. Si vous n'avez pas noté de signes d'amélioration 1 semaine après application de ce produit, demandez conseil à votre pharmacien pour vérifier que le produit a été correctement appliqué ou consultez un médecin pour vérifier le diagnostic.
Ne pas utiliser le produit une seconde fois sur le même épisode de pied d'athlète, si ce traitement n'a pas fonctionné après la première application.
Appliquer LAMISILATE MONODOSE 1% sur les 2 pieds même si les signes ne sont visibles que sur un seul pied. Cela permet d’éliminer les champignons responsables de cette infection qui peuvent être présents sur d’autres parties des pieds même si cela n’est pas encore visible. Après application sur les pieds, la solution sèche et forme un film transparent.
Le tube contient assez de produit pour le traitement des deux pieds.
LAMISILATE MONODOSE 1% diffuse la substance active dans la peau où elle reste plusieurs jours afin de tuer les champignons causant le pied d’athlète. Ne pas laver ou mouillez vos pieds pendant 24 heures après l’application du produit afin d’obtenir le meilleur résultat possible.
Conseils pour améliorer votre traitement :
Gardez la surface traitée propre grâce à une toilette régulière, 24 heures après l'application. Séchez la peau soigneusement sans frotter.
Essayer de ne pas gratter la zone traitée même en cas de démangeaisons car cela pourrait être préjudiciable ou ralentir le processus de guérison ou étendre l'infection.
Parce que cette mycose est très contagieuse, évitez de partager vos affaires (chaussons, chaussettes ) ainsi que vos serviettes de toilette avec d'autres personnes. Pour éviter les recontaminations, lavez régulièrement vos affaires.
Si vous avalez accidentellement ce produit :
Appelez votre médecin qui vous donnera les conseils à suivre. La teneur en alcool doit être prise en considération.
En cas de contact accidentel avec les yeux ou le visage :
Lavez votre visage ou vos yeux abondamment, avec de l'eau courante. Contactez votre médecin si vous êtes toujours gêné.
Si vous avez utilisé plus de LAMISILATE MONODOSE 1 %, solution pour application cutanée que vous n’auriez dû :
Sans objet.
Si vous oubliez d’utiliser LAMISILATE MONODOSE 1 %, solution pour application cutanée
Si vous arrêtez d’utiliser LAMISILATE MONODOSE 1 %, solution pour application cutanée
Sans objet.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
Certaines personnes peuvent être allergiques à LAMISILATE MONODOSE 1%, ce qui peut entraîner des gonflements et des douleurs, des démangeaisons, des ampoules, des éruptions cutanées ou une urticaire. Ces réactions ont été rapportées avec une fréquence très rare (atteint jusqu’à 1 patient sur 10 000).
En cas d’apparition de tels symptômes ou d’autres réactions allergiques suite à l’utilisation du produit, enlevez le film à l’aide d’alcool dénaturé (disponible en pharmacie) et lavez les pieds à l’eau chaude savonneuse puis rincez et séchez. Consultez votre médecin ou votre pharmacien.
Les effets indésirables suivants ont également été rapportés :
Peu fréquents (atteint jusqu’à 1 patient sur 100) : réactions au site d’application incluant sécheresse de la peau, irritation de la peau ou sensation de brûlure au site d'application. Ces effets sont généralement modérés et transitoires.
Fréquence indéterminée (ne peut être estimée à partir des données disponibles) : Changements de couleur de la peau, desquamation de la peau, rougeur, douleur au site d'application, irritation des yeux (en cas d’application accidentelle au niveau des yeux).
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : www.signalement.social-sante.gouv.fr
En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.
5. COMMENT CONSERVER LAMISILATE MONODOSE 1%, solution pour application cutanée ?
Tenir ce médicament hors de la vue et de la portée des enfants.
A conserver dans le conditionnement primaire d'origine, à l'abri de la lumière.
A conserver à une température ne dépassant pas 30°C.
Ne jetez aucun médicament au tout-à-l'égout ou avec les ordures ménagères. Demandez à votre pharmacien d’éliminer les médicaments que vous n’utilisez plus. Ces mesures contribueront à protéger l'environnement.
6. CONTENU DE L’EMBALLAGE ET AUTRES INFORMATIONS
Ce que contient LAMISILATE MONODOSE 1%, solution pour application cutanée
· La substance active est :
Terbinafine................................................................................................................. 10,00 mg
Sous forme de chlorhydrate de terbinafine................................................................... 11,25 mg
Pour 1 g de solution.
· Les autres composants sont :
Copolymère d'acrylates et d'octylacrylamide, hydroxypropylcellulose, triglycérides à chaîne moyenne, éthanol à 96 pour cent.
LAMISILATE MONODOSE 1 % se présente sous la forme d'une solution ressemblant à un gel, claire à légèrement opalescente.
Cette présentation est disponible en tube de 4 g.
Titulaire de l’autorisation de mise sur le marché
BOX 16184
103 24 STOCKHOLM
SUÈDE
Exploitant de l’autorisation de mise sur le marché
ALLOGA France
Zac du Chapotin Sud
69970 Chaponnay
GLAXOSMITHKLINE SANTE GRAND PUBLIC
23 RUE FRANCOIS JACOB
92500 RUEIL-MALMAISON
ou
HALEON GERMANY GMBH
BARTHSTRASSE 4
80339 MÜNCHEN
GERMANY
ou
HALEON DENMARK APS
DELTA PARK 37
2665 VALLENSBÆK STRAND
DENMARK
ou
HALEON BELGIUM N.V./S.A
DA VINCILAAN 5
1930 ZAVENTEM
BELGIUM
ou
DSV SOLUTIONS NV
Eddastraat 21
Gent, 9042
Belgium
ou
DSV Solutions A/S
Kumlehusvej 1A, Ãm
Roskilde, 4000
Denmark
ou
GSK-GEBRO CONSUMER HEALTHCARE GmbH
BAHNHOFBICHL 13
6391 FIEBERBRUNN
AUSTRIA
ou
NOVARTIS (HELLAS) S.A.C.I.
NATIONAL ROAD NO 1 (12TH KM)
METAMORPHOSI 14451 ATHENS
GREECE
ou
GlaxoSmithKline Consumer Healthcare Sp. z o.o.
Gnatowice Stare 30
05-085 Kampinos
Poland
ou
GlaxoSmithKline Consumer Healthcare Sp. z o.o.
ul. Rzymowskiego 53
02-697 Warszawa
Poland
Noms du médicament dans les Etats membres de l'Espace Economique Européen
Ce médicament est autorisé dans les Etats membres de l'Espace Economique Européen sous les noms suivants : Conformément à la réglementation en vigueur.
[à compléter ultérieurement par le titulaire]
La dernière date à laquelle cette notice a été révisée est :
[à compléter ultérieurement par le titulaire]
Des informations détaillées sur ce médicament sont disponibles sur le site Internet de l’ANSM (France).
Conseil d’éducation sanitaire :
a/ Qu’appelle-t-on un pied d’athlète ?
Le pied d’athlète est une affection du pied due à certaines variétés de champignons microscopiques.
b/ Comment reconnaître un pied d’athlète ?
La mycose du pied (pied d’athlète) débute généralement par une atteinte des 3ème et 4ème espaces inter-orteils.
Elle se manifeste par l’apparition entre les orteils de petites peaux avec parfois des fissures ou bien par la présence de cloques remplies de liquide incolore. Elle peut être responsable de démangeaisons très intenses.
A partir de l’atteinte entre les orteils, la mycose peut s’étendre sur le dessus du pied. Il apparaît alors une zone rouge en arc de cercle, bien nette et limitée, qui s’élargit et démange.
Elle ne donne pas d’odeur désagréable au niveau des pieds.
Si l’atteinte siège ou s’étend en dehors de ces zones (entre les orteils et sur le dessus du pied), il est impératif de consulter un médecin car alors il ne s’agit probablement pas d’un pied d’athlète.
Seul le médecin pourra diagnostiquer l’origine de cette atteinte et vous prescrire un traitement adapté.
c/ Quelques conseils généraux :
1) Eviter de gratter les zones infectées même en cas de démangeaison car vous risquez d’étendre l’infection à d’autres zones du corps.
2) Ne partagez pas vos serviettes de toilette, ni vos chaussons, chaussettes etc. afin de ne pas contaminer d’autres personnes.
3) N’utilisez pas de tapis de bain dans la salle de bain familiale.
4) Prenez l’habitude de bien sécher votre peau particulièrement au niveau des pieds et entre les orteils : les mycoses des pieds et des plis sont favorisées par la persistance d’une humidité et l’absence d’aération de la peau.
5) Si vous transpirez, évitez de porter des chaussettes qui facilitent la transpiration comme les tissus synthétiques, préférez le coton.
6) N’utilisez pas de savons particuliers comme les savons acides, utilisez plutôt des savons classiques comme le savon de Marseille ou les savons à pH neutre.
7) Sachez que tous les lieux chauds et humides où de nombreuses personnes marchent pieds nus sont propices à la transmission des mycoses des pieds (douches communes, vestiaires et douches de complexes sportifs, sauna et hammam, salle de bain familiale ...). Dans ces lieux, portez des chaussons de protection comme des « tongs » ou rincez-vous les pieds et séchez-les consciencieusement.
8) Dans le cas où vous vous chaussez sans mettre de chaussettes (notamment l’été), il est préférable de procéder à la désinfection de vos chaussures : demandez conseil à votre pharmacien.