Dernière mise à jour le 01/12/2025
DEXLIQ 4 mg/mL, solution buvable
Indications thérapeutiques
Classe pharmacothérapeutique - code ATC : H02A B02
Stimuler votre organisme avec des corticostéroïdes supplémentaires (comme la dexaméthasone) est un moyen efficace de traiter diverses maladies impliquant une inflammation.
DEXLIQ réduit cette inflammation, qui pourrait entraîner une aggravation de votre état. Vous devez prendre ce médicament régulièrement pour en tirer un bénéfice maximum
Présentations
> 1 flacon jaune (brun) de 30 ml avec fermeture de sécurité enfant avec adaptateur polyéthylène basse densité (PEBD) avec seringue(s) pour administration orale polyéthylène basse densité (PEBD)
Code CIP : 34009 301 334 4 6
Déclaration de commercialisation : 15/05/2023
Cette présentation est agréée aux collectivités
Service médical rendu (SMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprès de la HAS (plus d'informations dans l'aide). Les avis et synthèses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur du SMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| Important | Avis du 09/01/2019 | Inscription (CT) | Le service médical rendu par DEXLIQ 4 mg/ml est important dans toutes les indications de l’AMM. |
Amélioration du service médical rendu (ASMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprés de la HAS (plus d'informations dans l'aide). Les avis et synthéses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur de l'ASMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| V (Inexistant) | Avis du 09/01/2019 | Inscription (CT) | Cette spécialité est un complément de gamme qui n’apporte pas d’amélioration du service médical rendu (ASMR V) par rapport aux autres spécialités à base de dexaméthasone déjà inscrites. |
ANSM - Mis à jour le : 11/02/2025
DEXLIQ 4 mg/mL solution buvable
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Dexaméthasone................................................................................................................. 4,000 mg
Sous forme de phosphate sodique de dexaméthasone
Pour 1 mL de solution.
Excipient(s) à effet notoire : 275 mg de maltitol liquide (E965), 140 mg de sorbitol (E420), 0,2 mg d’éthanol, 90 mg de propylène glycol (E1520).
Pour la liste complète des excipients, voir rubrique 6.1.
Solution incolore à jaunâtre à l’odeur de menthe.
4.1. Indications thérapeutiques
· Infections et infestations : Méningite tuberculeuse, conjointement avec un traitement anti-infectieux exclusivement.
· Tumeurs bénignes, malignes et non précisées (y compris kystes et polypes) :
o Traitement palliatif des pathologies néoplasiques.
o Prophylaxie et traitement des vomissements induits par les cytostatiques, la chimiothérapie émétisante dans le cadre d’un traitement antiémétique.
o Traitement du myélome multiple symptomatique, de la leucémie aiguë lymphoïde/lymphoblastique, de la maladie de Hodgkin et du lymphome non hodgkinien, en association avec d'autres médicaments.
· Affections hématologiques et du système lymphatique : Purpura thrombopénique idiopathique chez l’adulte.
· Affections du système immunitaire : Traitement initial des affections auto-immunes telles que le lupus érythémateux disséminé.
· Affections endocriniennes : essai diagnostique de l’hyperfonction adrénocorticale (test de freinage à la dexaméthasone).
· Affections du système nerveux : Œdème cérébral (uniquement avec symptômes de pression intracrânienne mis en évidence par tomodensitométrie) causé par une tumeur cérébrale, une intervention neurochirurgicale ou un abcès cérébral.
· Affections vasculaires : Phases actives des vascularites systémiques, comme la périartérite noueuse (il convient de limiter la durée du traitement à deux semaines en cas de sérologie positive concomitante pour l'hépatite B).
· Affections respiratoires, thoraciques et médiastinales :
o Exacerbations aiguës de l’asthme lorsque l’emploi d’un corticostéroïde oral est approprié.
o Croup.
· Affections de la peau et du tissu sous-cutané : Traitement initial des maladies cutanées étendues, sévères, aiguës, répondant aux glucocorticoïdes, par exemple l’érythrodermie ou le pemphigus vulgaire.
· Affections musculo-squelettiques et systémiques :
o Phase évolutive sévère d’une polyarthrite rhumatoïde active, par exemple formes destructrices évoluant rapidement et/ou manifestations extra-articulaires.
o Évolution systémique sévère d’une arthrite idiopathique juvénile (maladie de Still).
o Myosite.
· Actes médicaux et chirurgicaux : Prévention et traitement des vomissements postopératoires, dans le cadre d’un traitement antiémétique.
4.2. Posologie et mode d'administration
Adultes
Considérations générales :
Il convient d’adapter la posologie en fonction de la réponse individuelle et de la nature de la maladie. Afin de réduire au maximum les effets indésirables, la dose efficace la plus faible possible doit être utilisée (voir rubrique 4.8 « Effets indésirables »).
La posologie initiale varie entre 0,5 mg et 9 mg par jour, en fonction de la maladie traitée. Dans les maladies plus sévères, des doses supérieures à 9 mg peuvent être nécessaires. Il convient de maintenir la posologie initiale ou de l’adapter jusqu’à ce que la réponse du patient soit satisfaisante. L’administration le soir, qui est utile pour atténuer la raideur matinale, et le fractionnement des doses, sont tous deux associés à une meilleure suppression de l’axe hypothalamo-hypophyso-surrénalien. En l’absence de réponse clinique satisfaisante après une période de temps raisonnable, arrêter le traitement par DEXLIQ et administrer un autre traitement.
Si la réponse initiale est favorable, il convient de déterminer la dose d’entretien en réduisant progressivement la dose jusqu’au niveau le plus bas requis pour maintenir une réponse clinique adéquate. Il est préférable que la posologie chronique ne dépasse pas 1,5 mg de DEXLIQ par jour.
L'apparition de signes indiquant la nécessité d’une adaptation posologique doit être surveillée chez les patients. Il peut s'agir de modifications de l'état clinique résultant de rémissions ou d’exacerbations de la maladie, d’une réactivité individuelle au médicament et de l’effet du stress (par exemple, chirurgie, infection, traumatisme). En cas de stress, il peut être nécessaire d'augmenter la posologie de manière temporaire.
Si le médicament doit être arrêté après plus de quelques jours de traitement, il convient de réduire la dose progressivement.
Les équivalents suivants facilitent le passage à DEXLIQ à partir d'autres glucocorticoïdes :
Milligramme à milligramme, la dexaméthasone est approximativement équivalente à la bêtaméthasone, 4 à 6 fois plus puissante que la méthylprednisolone et la triamcinolone, 6 à 8 fois plus puissante que la prednisone et la prednisolone, 25 à 30 fois plus puissante que l’hydrocortisone et environ 35 fois plus puissante que la cortisone.
Traitement à long terme
Pour le traitement à long terme de plusieurs affections, après le traitement initial, le traitement par glucocorticoïdes doit être modifié, la dexaméthasone étant remplacée par la prednisone/prednisolone afin de réduire la suppression de la fonction du cortex surrénalien.
Affections allergiques autolimitantes aiguës ou exacerbations aiguës de troubles allergiques chroniques :
Le calendrier posologique suivant, combinant un traitement parentéral et oral, est suggéré (les volumes correspondant aux milligrammes de dexaméthasone sont indiqués sur la seringue pour administration orale) :
· Premier jour : Injection de phosphate sodique de dexaméthasone, 4 mg ou 8 mg par voie intramusculaire.
· Deuxième jour : 1 mg de dexaméthasone sous forme de DEXLIQ 4 mg/mL solution buvable deux fois par jour.
· Troisième jour : 1 mg de dexaméthasone sous forme de DEXLIQ 4 mg/mL solution buvable deux fois par jour.
· Quatrième jour : 0,5 mg de dexaméthasone sous forme de DEXLIQ 4 mg/mL solution buvable deux fois par jour.
· Cinquième jour : 0,5 mg de dexaméthasone sous forme de DEXLIQ 4 mg/mL solution buvable deux fois par jour.
· Sixième jour : 0,5 mg de dexaméthasone sous forme de DEXLIQ 4 mg/mL solution buvable.
· Septième jour : 0,5 mg de dexaméthasone sous forme de DEXLIQ 4 mg/mL solution buvable.
· Huitième jour : Réévaluation.
Ce calendrier est conçu pour garantir un traitement adéquat durant les épisodes aigus, tout en réduisant au maximum le risque de surdosage dans les cas chroniques.
Pression intracrânienne élevée :
Le traitement initial est généralement administré par injection. Lorsqu’un traitement d’entretien est requis, DEXLIQ doit être instauré dès que possible. Pour le traitement palliatif des patients présentant des tumeurs cérébrales récidivantes ou inopérables, la posologie d’entretien doit être calculée individuellement. Une posologie de 2 mg deux ou trois fois par jour peut être efficace. Il convient de toujours utiliser la posologie la plus faible nécessaire pour contrôler les symptômes.
Tests de freinage à la dexaméthasone :
· 1. Tests de dépistage du syndrome de Cushing :
2 mg de dexaméthasone sous forme de DEXLIQ 4 mg/mL solution buvable doivent être administrés à 23h00. Des prélèvements sanguins sont ensuite effectués à 8h00 le lendemain matin, afin de doser le cortisol plasmatique.
Si une plus grande exactitude est requise, 0,5 mg de dexaméthasone sous forme de DEXLIQ 4 mg/mL solution buvable doivent être administrés toutes les 6 heures pendant 48 heures. Le sang doit être prélevé à 8h00 pour le dosage du cortisol plasmatique le troisième matin.
L’excrétion des 17-hydroxycorticostéroïdes sera déterminée sur les urines de 24 heures.
· Test visant à distinguer le syndrome de Cushing causé par une sécrétion hypophysaire excessive d’ACTH du syndrome induit par d'autres causes :
2 mg de dexaméthasone sous forme de Dexliq 4 mg/mL solution buvable doivent être administrés toutes les 6 heures pendant 48 heures. Le sang doit être prélevé à 8h00 pour le dosage du cortisol plasmatique le troisième matin.
L’excrétion des 17-hydroxycorticostéroïdes sera déterminée sur les urines de 24 heures.
Population pédiatrique
Il convient de limiter la posologie à une dose un jour sur deux, afin de réduire le retard de croissance et la suppression de l’axe hypothalamo-hypophyso-surrénalien.
Population âgée
Le traitement des patients âgés, en particulier à long terme, doit être planifié en tenant compte des conséquences les plus graves des effets secondaires fréquents des corticostéroïdes dans cette population.
Insuffisance hépatique ou rénale
La dose de dexaméthasone doit être adaptée chez les patients présentant une insuffisance hépatique ou rénale.
Mode d’administration
Voie orale.
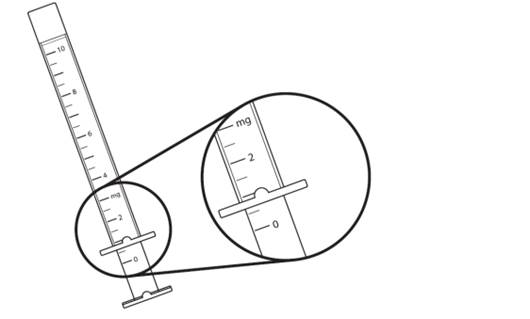
Le médicament est fourni avec une seringue graduée de 3 mL pour administration et un adaptateur à pression pour flacon/seringue. Chaque graduation individuelle correspond à 0,5 mg de dexaméthasone.
Hypersensibilité à la substance active ou à l’un des excipients mentionnés à la rubrique 6.1.
Infection systémique, sauf si un traitement anti-infectieux spécifique est employé.
Infections fongiques systémiques.
Ulcère stomacal ou duodénal.
Infections parasitaires par des vers ronds tropicaux.
4.4. Mises en garde spéciales et précautions d'emploi
Il est possible de réduire au maximum les effets indésirables en utilisant la plus faible dose efficace pendant la période minimale et en administrant la dose quotidienne requise en une seule fois le matin ou, lorsque c’est possible, en une dose matinale un jour sur deux. Un examen fréquent des patients est nécessaire afin de titrer la dose de manière appropriée en fonction de l’activité de la maladie. Lorsqu'une réduction de la posologie est possible, celle-ci doit être progressive (voir rubrique 4.2 « Posologie et mode d'administration »).
Suppression surrénalienne
Une insuffisance adrénocorticale, qui est causée par le traitement par glucocorticoïdes, peut, selon la dose et la durée du traitement, persister pendant de nombreux mois et dans certains cas pendant plus d’un an, après l’arrêt du traitement. L'arrêt des corticostéroïdes après un traitement prolongé doit par conséquent toujours être progressif afin d'éviter une insuffisance surrénalienne aiguë, l'arrêt doit être progressif sur plusieurs semaines ou plusieurs mois en fonction de la dose et de la durée du traitement. Chez les patients ayant reçu des doses supérieures à la dose physiologique de corticostéroïdes systémiques (environ 1 mg de dexaméthasone) pendant plus de 3 semaines, l’arrêt ne doit pas être brutal.
La conduite à tenir pour la réduction posologique dépendra largement de la probabilité de récidive de la maladie due à la réduction de la dose de corticostéroïdes systémiques. Une évaluation clinique de l'activité de la maladie peut être nécessaire durant l’arrêt.
Si la récidive de la maladie est peu probable lors du retrait des corticostéroïdes systémiques, mais en cas d’incertitudes concernant la suppression de l'axe hypothalamo-hypophyso-surrénalien (HHS), la dose de corticostéroïdes systémiques peut être réduite rapidement aux doses physiologiques. Une fois qu’une dose quotidienne de 1 mg de dexaméthasone est atteinte, la réduction posologique doit être plus lente, afin de permettre la récupération de l’axe HHS.
L’arrêt brutal d’un traitement par corticostéroïdes systémiques d’une durée de trois semaines au maximum est approprié si la récidive de la maladie est considérée comme peu probable.
Il est peu probable que l’arrêt brutal de doses allant jusqu’à 6 mg par jour de dexaméthasone pendant 3 semaines conduise à une suppression cliniquement importante de l'axe HHS chez la majorité des patients.
Dans les groupes de patients suivants, l’arrêt progressif du traitement par corticostéroïdes systémiques doit être envisagé même après des cures de 3 semaines ou moins :
Patients ayant reçu des cures répétées de corticostéroïdes systémiques, en particulier de durée supérieure à 3 semaines.
· Une cure de courte durée a été prescrite dans l’année suivant l’arrêt d’un traitement à long terme (plusieurs mois ou plusieurs années).
· Patients ayant d'autres causes d’insuffisance adrénosurrénalienne que le traitement par corticostéroïdes exogènes.
· Patients recevant des doses de corticostéroïdes systémiques supérieures à 6 mg de dexaméthasone par jour.
· Patients prenant des doses le soir de manière répétée.
Situations nécessitant une attention particulière
Le traitement par DEXLIQ ne doit être mis en œuvre que dans indications les plus sérieuses, et, si nécessaire, un traitement anti-infectieux ciblé supplémentaire doit être administré dans les cas suivants :
· Infections virales actives (herpès, zona, varicelle, kératite herpétique)
· Hépatite chronique active Ag HBs-positive
· Période allant d’environ 8 semaines avant à 2 semaines après l'administration de vaccins vivants
· Mycoses et parasitoses systémiques (par exemple, nématodes)
· Poliomyélite
· Lymphadénite après vaccination BCG
· Infections bactériennes aiguës et chroniques
· Antécédents de tuberculose (risque de réactivation). Utiliser uniquement sous protection tuberculostatique
En outre, le traitement par DEXLIQ ne doit être mis en œuvre qu’en cas d’indications sérieuses et, si nécessaires, un traitement spécifique supplémentaire doit être administré dans les cas suivants :
· Ulcères gastro-intestinaux
· Ostéoporose sévère
· Difficultés à réguler une pression artérielle élevée
· Difficultés à réguler un diabète malin
· Affections psychiatriques (y compris antécédents)
· Glaucome à angle fermé et à angle ouvert
· Ulcérations et lésions cornéennes
· Insuffisance cardiaque sévère
Réaction anaphylactique
Des réactions anaphylactiques graves sont possibles.
Tendinite
Le risque de tendinite et de rupture du tendon est augmenté chez les patients traités de manière concomitante par glucocorticoïdes et fluoroquinolones.
Myasthenia gravis
Un myasthenia gravis préexistant peut présenter une détérioration au début du traitement par dexaméthasone.
Œdème cérébral ou pression intracrânienne élevée
Les corticostéroïdes ne doivent pas être utilisés en cas de blessure à la tête car il est probable qu’ils n’auront aucun bénéfice et pourront même être nocifs.
Perforation intestinale
En raison du risque de perforation intestinale, DEXLIQ ne doit être utilisé qu’en cas d’urgence et dans le cadre d’une surveillance appropriée dans les situations suivantes :
· Rectocolite hémorragique sévère avec menace de perforation
· Diverticulite
· Entéro-anastomose (postopératoire immédiat)
Les signes d’irritation péritonéale après une perforation gastro-intestinale peuvent être absents chez les patients recevant des doses élevées de glucocorticoïdes.
Maladie intercurrente et stress
Lors d’un traitement prolongé, toute maladie intercurrente, traumatisme, stress ou intervention chirurgicale nécessiteront une augmentation temporaire de la posologie ; si les corticostéroïdes ont été arrêtés après un traitement prolongé, il peut être nécessaire de les réintroduire temporairement.
Les patients stressés peuvent nécessiter des doses plus élevées de corticostéroïdes avant, pendant et après la période de situation stressante.
Pendant le traitement par DEXLIQ pour des conditions de stress physique spécifique (traumatisme, chirurgie, accouchement, etc.), une augmentation temporaire de la dose peut être nécessaire. Même en cas d’insuffisance adrénocorticale prolongée après l'arrêt du traitement, l’administration de glucocorticoïdes peut être nécessaire dans les situations physiquement stressantes. Une insuffisance adrénocorticale aiguë induite par le traitement peut être minimisée en réduisant lentement la dose jusqu’au moment planifié pour l’arrêt.
Effets anti-inflammatoires/immunosuppresseurs/Infection
Les corticoïdes peuvent exacerber les infections fongiques systémiques et ne doivent être utilisés qu’en cas de besoin pour contrôler des réactions médicamenteuses dues à l'amphotéricine. Dans certains cas, l’utilisation concomitante d'amphotéricine et d'hydrocortisone a été suivie d’une augmentation de volume du cœur et d’une insuffisance cardiaque.
L’administration de vaccins à virus vivant est contre-indiquée chez les personnes recevant des doses immunosuppressives de corticostéroïdes. Si des vaccins viraux ou bactériens inactivés sont administrés à des sujets recevant des doses immunosuppressives de corticostéroïdes, il se peut que la réponse sérique attendue ne soit pas obtenue.
La suppression de la réponse inflammatoire et de la fonction immunitaire augmente la sensibilité aux infections et leur sévérité. Les manifestations cliniques peuvent être atypiques et des infections graves comme la septicémie et la tuberculose peuvent passer inaperçues et atteindre un stade avancé avant d’être diagnostiquées.
Un traitement antimicrobien approprié doit accompagner le traitement par glucocorticoïdes lorsqu’il est nécessaire, par exemple dans la tuberculose et les infections virales et fongiques de l'œil.
Le traitement par DEXLIQ peut masquer les symptômes d’une infection existante ou en développement, rendant le diagnostic plus difficile. Il existe un risque de baisse de la résistance et d'incapacité à localiser l’infection chez les patients sous corticostéroïdes.
La varicelle est particulièrement préoccupante, car cette pathologie normalement mineure peut être fatale chez les patients immunodéprimés. Il est doit être conseillé aux patients (ou aux parents d’enfants) sans antécédents certains de varicelle d'éviter les contacts personnels étroits avec la varicelle ou le zona et, en cas d’exposition, ils doivent consulter un médecin en urgence. Une immunisation passive par immunoglobuline varicelle/zona (VZIG) est nécessaire par les patients non immunisés exposés qui reçoivent des corticostéroïdes systémiques ou les ont utilisés au cours des trois mois précédents ; celle-ci doit être administrée dans les dix jours suivant l’exposition à la varicelle. Si un diagnostic de varicelle est confirmé, la maladie nécessite des soins spécialisés et un traitement en urgence. Les corticostéroïdes ne doivent pas être arrêtés et une augmentation de la dose peut être nécessaire.
La rougeole peut avoir une évolution plus grave et même mortelle chez les patients immunodéprimés. Chez ces patients, enfants ou adultes, une attention particulière est nécessaire afin d'éviter l'exposition à la rougeole. En cas d’exposition, une prophylaxie par un mélange d’immunoglobulines intramusculaires (IG) peut être indiquée. Il doit être conseillé aux patients exposés de consulter un médecin en urgence.
Les corticostéroïdes peuvent activer une amibiase ou une strongyloïdose latentes ou exacerber une maladie active. L'activation d’une maladie latente ou une exacerbation d’infections intercurrentes sont possibles en présence d’agents pathogènes, notamment pour celles causées par Amoeba, Candida, Cryptococcus, Mycobacterium, Nocardia, Pneumocystis ou Toxoplasma. Il est recommandé de les soigner avant de démarrer le traitement par corticostéroïdes, en particulier chez les patients ayant séjourné dans des régions tropicales ou ceux qui présentent une diarrhée inexpliquée.
Un rapport montre que l’utilisation de corticostéroïdes dans le paludisme cérébral est associée à un coma prolongé et une incidence plus élevée des pneumonies et des hémorragies gastro-intestinales, et par conséquent les corticostéroïdes ne doivent pas être utilisés dans le paludisme cérébral.
Réactions psychiatriques
Les patients et/ou soignants doivent être avertis des réactions indésirables psychiatriques potentiellement sévères pouvant survenir avec les stéroïdes systémiques (voir rubrique 4.8). Les symptômes apparaissent généralement dans les jours ou les semaines suivant le début du traitement. Les risques peuvent être supérieurs avec des doses élevées/en cas d’exposition systémique (voir aussi la rubrique 4.5 relatives aux interactions pharmacocinétiques pouvant accroître le risque d’effets secondaires), bien que le niveau de dose ne permette pas de prédire l'apparition, le type, la sévérité ou la durée des réactions. La plupart des réactions s’estompent après une réduction de la dose ou l’arrêt du traitement, bien qu’un traitement spécifique puisse être nécessaire.
Les patients/soignants doivent être encouragés à consulter un médecin en cas de développement de symptômes psychologiques inquiétants, en particulier si une dépression ou des idées suicidaires sont suspectées. Les patients/soignants doivent également être avertis des troubles psychiatriques possibles pouvant survenir pendant ou immédiatement après la réduction de la dose/l’arrêt des stéroïdes systémiques, bien que ces réactions aient rarement été observées.
Une attention particulière est requise en cas d'utilisation de corticostéroïdes systémiques chez des patients présentant des troubles affectifs sévères actuels ou des antécédents de troubles affectifs sévères, chez eux ou leurs proches au premier degré. Cela inclut une dépression ou un trouble maniacodépressif, et une précédente psychose stéroïdienne.
Affections oculaires
L’utilisation prolongée de corticostéroïdes peut entraîner une cataracte sous-capsulaire, un glaucome avec lésions possibles des nerfs optiques, une choriorétinopathie pouvant entraîner une altération de la vision avec perte de vision, et peut accroître l'établissement d’infections oculaires secondaires dues à des champignons ou des virus.
Une attention particulière est requise lors du traitement de patients atteints de glaucome (ou ayant des antécédents familiaux de glaucome), ainsi que de patients présentant un herpès oculaire, en raison d’une perforation cornéenne possible.
Troubles électrolytiques
Des doses moyennes et élevées d’hydrocortisone ou de cortisone peuvent provoquer une élévation de la pression artérielle, une rétention de sel et d’eau et une augmentation de l’excrétion de potassium, mais ces effets sont moins probables avec les dérivés de synthèse, sauf en cas d'utilisation à des doses élevées. Une restriction de l'apport alimentaire en sel et une supplémentation potassique peuvent être nécessaires avec le traitement par corticostéroïdes. Tous les corticostéroïdes augmentent l’excrétion du calcium.
Une attention particulière est requise lors du traitement de patients présentant une insuffisance rénale, une hypertension artérielle et une insuffisance cardiaque congestive.
Autres précautions
Un besoin plus élevé en insuline, ou antidiabétiques oraux, doit être pris en compte lors de l'administration de DEXLIQ à des sujets diabétiques.
Une surveillance régulière de la pression artérielle est nécessaire durant le traitement par DEXLIQ, en particulier pendant l'administration de doses élevées et chez les patients ayant des difficultés à réguler une pression artérielle élevée.
En raison du risque de détérioration, les patients présentant une insuffisance cardiaque sévère doivent faire l’objet d’une surveillance attentive.
Une bradycardie est possible chez les patients traités par des doses élevées de dexaméthasone.
Il convient de faire preuve de prudence lors de l’utilisation de corticostéroïdes chez des patients ayant récemment été victimes d’un infarctus du myocarde, car une rupture myocardique a été signalée.
Les corticostéroïdes doivent être utilisés avec prudence chez les patients migraineux, car les corticostéroïdes peuvent provoquer une rétention hydrique.
Une crise hypertensive liée à un phéochromocytome, pouvant être fatale, a été décrite après l'administration de corticostéroïdes systémiques. Les corticostéroïdes ne doivent être administrés aux patients présentant un phéochromocytome suspecté ou identifié qu'après une évaluation appropriée du rapport risque/bénéfice.
Des examens médicaux réguliers (incluant un contrôle de la vision tous les trois mois) sont conseillés lors du traitement à long terme par DEXLIQ.
Aux doses élevées, il convient de veiller à un apport suffisant en calcium, de limiter l'apport de sodium et de surveiller les taux sériques de potassium. Selon la durée et la posologie du traitement, une influence négative sur le métabolisme calcique peut être attendue et une prophylaxie de l’ostéoporose est donc recommandée. Cela s’applique avant tout aux facteurs de risque coexistants, comme la disposition familiale, l’âge, la ménopause, un apport insuffisant en protéines et en calcium, un tabagisme important, une consommation excessive d'alcool, ainsi qu’un niveau insuffisant d'activité physique. La prévention consiste en un apport suffisant en calcium et en vitamine D et une augmentation de l’activité physique. Un traitement médical supplémentaire doit être envisagé en cas d'ostéoporose préexistante.
Les risques suivants doivent être envisagés en cas d’interruption ou d'arrêt de l’administration de glucocorticoïdes à long terme :
· Exacerbation ou récidive de la maladie sous-jacente, insuffisance surrénalienne aiguë, syndrome de retrait des corticostéroïdes.
· Certaines maladies virales (varicelle, rougeole) chez les patients traités par glucocorticoïdes peuvent être très sévères.
· Les enfants et les personnes immunodéprimées n’ayant pas eu la varicelle ou la rougeole sont exposés à un risque particulier. En cas de contact avec des personnes infectées par le virus de la varicelle ou de la rougeole durant le traitement par DEXLIQ, un traitement préventif doit être instauré si nécessaire.
Symptômes de retrait
L’arrêt des corticostéroïdes après un traitement prolongé peut engendrer des symptômes de retrait, incluant une fièvre, une myalgie, une arthralgie et un malaise. Cela peut se produire même chez des patients ne présentant pas de signes d’insuffisance surrénalienne.
Nouveau-nés prématurés
Les données disponibles tendent à indiquer des événements indésirables sur le neurodéveloppement à long terme après un traitement précoce (moins de 96 heures) de nourrissons prématurés présentant une pneumopathie chronique à des doses de départ de 0,25 mg/kg deux fois par jour.
Population pédiatrique
Les corticostéroïdes provoquent une inhibition dose-dépendante de la croissance chez les nourrissons, les enfants et les adolescents, pouvant être irréversible. Par conséquent, durant le traitement à long terme par DEXLIQ, l’indication doit être très fortement présente chez les enfants et leur croissance doit être contrôlée régulièrement.
Population âgée
Les effets indésirables des corticostéroïdes systémiques peuvent avoir des conséquences graves, en particulier à un âge avancé, incluant notamment l’ostéoporose, l’hypertension artérielle, l’hypokaliémie, le diabète, la sensibilité aux infections et l’atrophie cutanée. Une surveillance clinique étroite est requise afin d'éviter les réactions engageant le pronostic vital.
Influence sur les tests diagnostiques
Les glucocorticoïdes peuvent supprimer les réactions cutanées aux tests d'allergie. Ils peuvent également influer sur le test de réduction du nitro-bleu de tétrazolium utilisé pour la recherche des infections bactériennes et entraîner des résultats faussement négatifs.
Remarque concernant le dopage
L'utilisation de tests de dépistage du dopage lors de la prise de DEXLIQ peut conduire à des résultats positifs.
Avertissements concernant les excipients
Ce médicament contient du maltitol liquide et du sorbitol. Les patients présentant des problèmes héréditaires rares d'intolérance au fructose ne doivent pas prendre ce médicament.
Ce médicament peut contenir de petites quantités d'éthanol, moins de 100 mg pour 10 mg de dexaméthasone.
Ce médicament contient du propylène glycol. L’administration concomitante avec n’importe quel substrat pour l’alcool déshydrogénase comme l’éthanol peut induire des effets indésirables graves chez les nouveau-nés.
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
Effets des autres médicaments sur la dexaméthasone
La dexaméthasone est métabolisée via le cytochrome P450 3A4 (CYP3A4). L’administration concomitante de dexaméthasone avec des inducteurs du CYP3A4, comme la phénytoïne, les barbituriques, l’éphédrine, la rifabutine, la carbamazépine et la rifampicine, peut conduire à une diminution des concentrations plasmatiques de dexaméthasone et une augmentation de la dose peut être nécessaire. L'administration concomitante d'inhibiteurs du CYP3A4 comme le kétoconazole, le ritonavir et l’érythromycine peut conduire à une augmentation des concentrations plasmatiques de dexaméthasone.
Ces interactions peuvent également interférer avec les tests de freinage à la dexaméthasone, qui doivent par conséquent être interprétés avec prudence durant l’administration de substances influant sur le métabolisme de la dexaméthasone.
Le kétoconazole peut accroître les concentrations plasmatiques de dexaméthasone par inhibition du CYP3A4, mais il peut aussi supprimer la synthèse des corticostéroïdes dans les surrénales et provoquer ainsi une insuffisance surrénalienne à l'arrêt du traitement par corticostéroïdes.
L’éphédrine peut accroître la clairance métabolique des corticostéroïdes, entraînant une diminution des taux plasmatiques. Une augmentation de la dose de corticostéroïdes peut être nécessaire.
Des résultats faussement négatifs du test de freinage à la dexaméthasone ont été signalés chez des patients traités par indométacine.
Antibiotiques : Les antibiotiques de type macrolides ont été associés à une baisse significative de la clairance des corticostéroïdes.
Anticholinestérases : L’utilisation concomitante d’agents anticholinestérase et de corticostéroïdes peut produire une faiblesse sévère chez les patients atteints de myasthenia gravis. Si possible, les agents anticholinestérase doivent être arrêtés au moins 24 heures avant le début du traitement par corticostéroïdes.
Colestyramine : La colestyramine peut diminuer l'absorption de la dexaméthasone.
Estrogènes, y compris contraceptifs oraux : Les estrogènes peuvent diminuer le métabolisme hépatique de certains corticostéroïdes, augmentant ainsi leurs effets.
Aminoglutéthimide : Diminution de l’efficacité de la dexaméthasone, en raison de l'augmentation de son métabolisme. Une adaptation de la posologie de la dexaméthasone peut être nécessaire.
Traitements gastro-intestinaux locaux, antiacides, charbon : Une diminution de l'absorption digestive des glucocorticoïdes a été rapportée avec la prednisolone et la dexaméthasone. Par conséquent, les glucocorticoïdes doivent être pris séparément des traitements gastro-intestinaux locaux, des antiacides ou du charbon, avec un intervalle d’au moins deux heures entre les traitements.
Effets de la dexaméthasone sur les autres médicaments
La dexaméthasone est un inducteur modéré du CYP3A4. L’administration concomitante de dexaméthasone avec des substances métabolisées via le CYP3A4 peut conduire à une augmentation de la clairance et une diminution des concentrations plasmatiques de ces substances.
La clairance rénale des salicylates est augmentée par les corticostéroïdes et par conséquent, la posologie des salicylates doit être réduite lors du retrait des stéroïdes.
Les corticostéroïdes ont une action antagoniste sur les effets souhaités des agents hypoglycémiants (y compris l’insuline), des antihypertenseurs et des diurétiques.
Les effets hypokaliémiques de l'acétazolamide, des diurétiques de l'anse, des diurétiques thiazidiques, de l’injection d'amphotéricine B, des agents de déplétion potassique, des (glucominéralo) corticoïdes, du tétracosactide et de la carbonoxolone sont renforcés. L’hypokaliémie prédispose à l'arythmie cardiaque, en particulier aux « torsades de pointes », et augmente la toxicité des glycosides cardiaques. L’hypokaliémie doit être corrigée avant le début du traitement par corticostéroïdes. En outre, l’utilisation concomitante d'amphotéricine B et d'hydrocortisone a dans certains cas été suivie d’une augmentation de volume du cœur et d’une insuffisance cardiaque.
Médicaments contre les ulcères : La carbénoxolone augmente le risque d’hypokaliémie.
Chloroquine, hydroxychloroquine et méfloquine : Risque accru de myopathies et de cardiomyopathies.
L’administration concomitante d'IEC augmente le risque d'affections hématologiques.
Les corticostéroïdes peuvent avoir un impact sur les effets hypotenseurs des médicaments antihypertenseurs. La dose de traitement antihypertenseur peut nécessiter une adaptation durant le traitement par dexaméthasone.
Le risque de tendinite et de rupture du tendon est augmenté chez les patients traités de manière concomitante par glucocorticoïdes et fluoroquinolones.
Atropine et autres anticholinergiques : Des augmentations de la pression intraoculaires peuvent être notées durant l’administration concomitante avec la dexaméthasone.
Myorelaxants non dépolarisants : l’effet myorelaxant peut durer plus longtemps.
Somatotropine : l’effet de l’hormone de croissance peut être réduit.
Protiréline : Une augmentation réduite de la TSH peut être notée durant l'administration de protiréline.
Le sultopride a été lié à des arythmies ventriculaires, en particulier à des torsades de pointes. Cette association n’est pas recommandée.
Les patients prenant des AINS doivent être surveillés en raison d’une augmentation possible de l’incidence et/ou de la sévérité des ulcères gastriques. L’aspirine doit être utilisée avec prudence conjointement avec les corticostéroïdes dans l’hypoprothrombinémie.
Ciclosporine : Une activité accrue de la ciclosporine et des corticostéroïdes est possible lorsque tous deux sont utilisés conjointement. Des convulsions ont été signalées lors d’une utilisation simultanée.
Thalidomide : Le thalidomide doit être coadministré avec prudence, car une nécrolyse épidermique toxique a été décrite lors d’une utilisation concomitante.
Les corticostéroïdes peuvent également influer sur le test de réduction du nitro-bleu de tétrazolium utilisé pour la recherche des infections bactériennes et entraîner des résultats faussement négatifs.
Vaccins vivants atténués : Risque de maladie systémique fatale
Praziquantel : Diminution des concentrations plasmatiques de praziquantel avec un risque d'échec du traitement, en raison de l'augmentation de son métabolisme hépatique par la dexaméthasone.
Anticoagulants oraux : Impact possible du traitement par corticostéroïdes sur le métabolisme des anticoagulants oraux et sur les facteurs de coagulation. Aux doses élevées ou en cas de durée du traitement supérieure à 10 jours, il existe un risque de saignement spécifique au traitement par corticostéroïdes (muqueuse gastro-intestinale, fragilité vasculaire). Les patients prenant des corticostéroïdes associés à des anticoagulants oraux doivent être étroitement surveillés (investigations biologiques au 8e jour, puis toutes les 2 semaines pendant le traitement et après l'arrêt du traitement).
Insuline, sulfonylurées, metformine : Augmentation de la glycémie avec parfois une cétose diabétique, car les corticostéroïdes altèrent la tolérance aux glucides. Par conséquent, l'autosurveillance sanguine et urinaire par le patient doit être renforcée, en particulier au début du traitement.
Isoniazide : Une diminution des taux plasmatiques d’isoniazide a été associée à la prednisolone. Le mécanisme suggéré est une augmentation du métabolisme hépatique de l’isoniazide et une diminution du métabolisme hépatique des glucocorticoïdes. Les patients prenant de l’isoniazide doivent être étroitement surveillés.
4.6. Fertilité, grossesse et allaitement
Grossesse
La dexaméthasone traverse le placenta. L'administration de corticostéroïdes à des animaux en gestation peut entraîner des anomalies du développement fœtal, incluant une fente palatine, un retard de croissance intra-utérine et des effets sur la croissance et le développement du cerveau. Il n’existe pas de données montrant que les corticostéroïdes augmentent l’incidence des anomalies congénitales, comme la fente labiale/palatine dans l’espèce humaine (voir rubrique 5.3). Le traitement par corticostéroïdes à long terme ou répété durant la grossesse augmente le risque de retard de croissance intra-utérine. Chez les nouveau-nés exposés aux corticostéroïdes au cours de la période prénatale, il existe un risque accru d'insuffisance surrénalienne qui, dans des circonstances normales, subit une régression postnatale spontanée et est rarement significative sur le plan clinique. La dexaméthasone ne doit être prescrite pendant la grossesse, et en particulier au cours du premier trimestre, que si les bénéfices l’emportent sur les risques pour la mère et l’enfant.
Les glucocorticoïdes sont excrétés dans le lait maternel. Les informations relatives à l’excrétion de la dexaméthasone dans le lait maternel sont insuffisantes. Un risque pour les nouveau-nés et nourrissons ne peut pas être exclu. Les nourrissons dont les mères prennent de fortes doses de corticostéroïdes systémiques sur des périodes prolongées peuvent présenter une suppression surrénalienne.
Une décision sur la poursuite ou l’interruption de l’allaitement ou sur la poursuite ou l’interruption du traitement par la dexaméthasone doit être prise, en prenant en compte le bénéfice de l’allaitement pour l’enfant et le bénéfice du traitement par la dexaméthasone pour la mère.
Fertilité
Aucune donnée n’est disponible sur l’influence de la dexaméthasone sur la fertilité animale ou humaine.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
L’incidence des effets indésirables anticipés, comme la suppression de l’axe hypothalamo-hypophyso-surrénalien, est corrélée avec l'activité relative de la substance, la dose, l’heure d'administration et la durée du traitement. Durant un traitement à court terme, conformément aux recommandations posologiques et avec une étroite surveillance des patients, le risque d’effets secondaires est faible.
Les effets secondaires habituels du traitement à court terme par dexaméthasone (jours/semaines) incluent une prise de poids, des troubles psychologiques, une intolérance au glucose et une insuffisance adrénocorticale transitoire. Le traitement à long terme par dexaméthasone (mois/années) entraîne généralement une obésité centrale, une fragilité cutanée, une atrophie musculaire, une ostéoporose, un retard de croissance et une insuffisance suprarénale à long terme (voir aussi rubrique 4.4).
|
Infections et infestations |
Sensibilité accrue à ou exacerbation des infections (latentes) avec masquage des symptômes cliniques, infections opportunistes, réactivation d’une tuberculose latente, exacerbation des infections oculaires, candidose |
|
Affections hématologiques et du système lymphatique |
Leucocytose, lymphopénie, éosinopénie, polycythémie, coagulation anormale |
|
Affections du système immunitaire |
Réactions d'hypersensibilité, incluant anaphylaxie, immunosuppression (voir aussi dans « Infections et maladies parasitaires ») |
|
Affections endocriniennes |
Suppression de l'axe hypothalamo-hypophyso-surrénalien et induction du syndrome de Cushing (symptômes typiques : visage lunaire, pléthore, obésité tronculaire), insuffisance surrénale et hypophysaire secondaire (en particulier en cas de stress comme un traumatisme ou une intervention chirurgicale) |
|
Troubles du métabolisme et de la nutrition |
Prise de poids, équilibre protéique et calcique négatif, augmentation de l’appétit, rétention sodée et hydrique, perte potassique (attention : troubles du rythme), alcalose hypokaliémique, manifestation d’un diabète sucré latent, altération de la tolérance aux glucides avec nécessité d'accroître la dose de traitement antidiabétique, hypercholestérolémie, hypertriglycéridémie |
|
Affections psychiatriques |
Dépendance psychologique, dépression, insomnie, schizophrénie aggravée, maladie mentale, de l’euphorie à la psychose manifeste |
|
Affections du système nerveux |
Augmentation de la pression intracrânienne avec œdème papillaire chez les enfants (pseudotumeur cérébrale) généralement après l’arrêt du traitement ; manifestation d’une épilepsie latente, augmentation des crises d'épilepsie manifeste, vertiges, céphalées |
|
Affections oculaires |
Pression intraoculaire élevée, glaucome, œdème papillaire, cataracte, essentiellement avec opacité sous-capsulaire postérieure, atrophie cornéenne et scléreuse, augmentation des infections ophtalmiques virales, fongiques et bactériennes, aggravation des symptômes associés aux ulcères cornéens |
|
Affections cardiaques |
Rupture du muscle cardiaque après des antécédents récents d'infarctus du myocarde, insuffisance cardiaque congestive chez les patients prédisposés, décompensation cardiaque* |
|
Affections vasculaires |
Hypertension artérielle, vascularite, augmentation de l’athérosclérose et risque de thrombose/thromboembolie (l'augmentation de la coagulabilité du sang peut conduire à des complications thromboemboliques) |
|
Affections respiratoires, thoraciques et médiastinales |
Hoquet |
|
Affections gastro-intestinales |
Dyspepsie, distension abdominale*, ulcères gastriques avec perforation et saignement, pancréatite aiguë, œsophagite ulcérante, flatulences, nausées, vomissements |
|
Affections de la peau et du tissu sous-cutané |
Hirsutisme, hypertrichose, atrophie cutanée, télangiectasie, vergetures, érythèmes, acné stéroïdien, pétéchies, ecchymoses, dermite allergique, urticaire, œdème angioneurotique, amincissement des cheveux, troubles pigmentaires, augmentation de la fragilité capillaire, dermatite péribuccale, hyperhidrose |
|
Affections musculo-squelettiques et systémiques |
Inhibition de la croissance chez les nourrissons, enfants et adolescents, fermeture épiphysaire prématurée, ostéoporose, factures de la colonne vertébrale et des os longs, nécrose aseptique des os fémoraux et huméraux, déchirures de tendons, myopathie proximale, faiblesse musculaire, perte de masse musculaire |
|
Affections des organes de reproduction et du sein |
Règles irrégulières, aménorrhée, impuissance |
|
Troubles généraux et anomalies au site d'administration |
Retard de cicatrisation des plaies, inconfort, syndrome de retrait stéroïdien : une réduction trop rapide de la dose de corticostéroïdes après un traitement prolongé peut conduire à une insuffisance surrénalienne aiguë, une hypotension artérielle et au décès. Le syndrome de retrait peut se manifester par une fièvre, une myalgie, une arthralgie, une rhinite, une conjonctivite, des douleurs, des nodules cutanés avec démangeaisons et une perte de poids. |
|
Lésions, intoxications et complications liées aux procédures |
Réponse réduite à la vaccination et aux tests cutanés, tendance aux ecchymoses |
* Voir aussi rubrique 4.4
Description des effets indésirables sélectionnés
Insuffisance adrénocorticale
Une insuffisance adrénocorticale, qui est causée par le traitement par les glucocorticoïdes, peut, selon la dose et la durée du traitement, persister pendant de nombreux mois et dans certains cas pendant plus d’un an, après l’arrêt du traitement (voir rubrique 4.4 « Mises en garde spéciales et précautions d’emploi »).
Modifications psychologiques
Les modifications psychologiques se manifestent sous diverses formes, la plus fréquente étant l’euphorie. Une dépression, des réactions psychotiques et des tendances suicidaires peuvent aussi apparaître. Ces maladies peuvent être graves. Elles apparaissent généralement dans les jours ou les semaines suivant le début du traitement. Leur apparition est plus probable aux doses élevées. La plupart de ces problèmes disparaissent si la dose est réduite ou le médicament est arrêté (voir rubrique 4.4 « Mises en garde spéciales et précautions d’emploi »).
Infections
Le traitement par dexaméthasone peut masquer les symptômes d’une infection existante ou en développement, rendant le diagnostic plus difficile, et peut conduire à un risque accru d'infection (voir rubrique 4.4 « Mises en garde spéciales et précautions d’emploi »).
Perforation intestinale
Les corticostéroïdes peuvent être associés à un risque accru de perforation du colon dans la rectocolite hémorragique sévère avec menace de perforation, diverticulite et entéro-anastomose (postopératoire immédiate).
Les signes d’irritation péritonéale après une perforation gastro-intestinale peuvent être absents chez les patients recevant des doses élevées de glucocorticoïdes (voir rubrique 4.4 « Mises en garde spéciales et précautions d’emploi »).
Affections cardio-vasculaires
Une bradycardie, une détérioration d’une insuffisance cardiaque sévère et des difficultés à réguler une pression artérielle élevée sont possibles. Il convient de faire preuve de prudence lors de l’utilisation de corticostéroïdes chez des patients ayant récemment été victimes d’un infarctus du myocarde, car une rupture myocardique a été signalée (voir rubrique 4.4 « Mises en garde spéciales et précautions d’emploi »).
Population pédiatrique
Les corticostéroïdes causent une inhibition dose-dépendante de la croissance chez le nourrisson, l’enfant et l’adolescent, car les corticostéroïdes peuvent entraîner une fermeture précoce des épiphyses, pouvant être irréversible (voir rubrique 4.4 « Mises en garde spéciales et précautions d’emploi »).
Population âgée
Les effets indésirables des corticostéroïdes systémiques peuvent avoir des conséquences graves, en particulier à un âge avancé, incluant notamment l’ostéoporose, l’hypertension artérielle, l’hypokaliémie, le diabète, la sensibilité aux infections et l’atrophie cutanée (voir rubrique 4.4 Mises en garde spéciales et précautions d’emploi).
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr/.
Les rapports de toxicité aiguë et/ou de décès après un surdosage des glucocorticoïdes sont rares. Aucun antidote n’est disponible. Le traitement n’est probablement pas indiqué en cas de réactions dues à une intoxication chronique, sauf si le patient présente une pathologie qui le rendrait inhabituellement sensible aux effets néfastes des corticostéroïdes. Dans ce cas, il convient de vider l’estomac et d’instaurer un traitement symptomatique selon les besoins. Les réactions anaphylactiques et d'hypersensibilité peuvent être traitées par adrénaline, ventilation artificielle en pression positive et aminophylline. Le patient doit être maintenu au chaud et au calme. La demi-vie biologique de la dexaméthasone dans le plasma est d’environ 190 minutes.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Classe pharmacothérapeutique : glucorticoïdes, code ATC : H02A B02.
La dexaméthasone est un glucorticoïde très puissant d'action prolongée ayant des propriétés négligeables de rétention sodique et donc particulièrement adapté à une utilisation chez les patients présentant une insuffisance cardiaque et une hypertension artérielle. Son activité anti-inflammatoire est 7 fois supérieure à celle de la prednisolone et, comme les autres glucocorticoïdes, la dexaméthasone possède également des propriétés antiallergiques, antipyrétiques et immunosuppressives.
5.2. Propriétés pharmacocinétiques
La dexaméthasone est bien absorbée après administration orale ; ses taux plasmatiques pics sont atteints entre 1 et 2 heures après ingestion et les variations interindividuelles sont importantes. Chez des sujets sains, une demi-vie plasmatique de 3 à 6 heures a été observée, tandis que dans les études de patients, elle peut être réduite à moins de 2 heures. La dexaméthasone est liée (à environ 77 %) aux protéines plasmatiques, essentiellement les albumines. À la différence du cortisol, le pourcentage de liaison protéique de la dexaméthasone reste pratiquement inchangé lors de l’augmentation des concentrations de stéroïdes. Les corticoïdes sont rapidement distribués dans tous les tissus de l’organisme. La dexaméthasone est essentiellement métabolisée dans le foie, mais aussi dans les reins. La dexaméthasone et ses métabolites sont excrétés dans l’urine.
5.3. Données de sécurité préclinique
Maltitol liquide (E965)
Arôme menthe (menthe poivrée, menthe verte, menthol et éthanol)
Sorbitol liquide (non cristallisant) (E420)
Citrate de sodium (E331)
Édétate disodique
Sucralose
Hydroxyde de sodium (pour l’ajustement du pH)
Eau purifiée
18 mois.
Après première ouverture : 3 mois.
6.4. Précautions particulières de conservation
À conserver à une température ne dépassant pas 30°C.
À conserver dans l'emballage d’origine à l'abri de la lumière.
Ne pas mettre au réfrigérateur.
6.5. Nature et contenu de l'emballage extérieur
Flacon en verre ambre (type III) contenant 30 mL ou 50 mL de solution buvable, fermée avec un bouchon à vis à l'épreuve des enfants avec système d’inviolabilité, avec revêtement (joint) en LDPE et adaptateur en LDPE.
Chaque flacon est fourni avec une seringue graduée de 3 mL pour administration orale. Le corps et le piston de la seringue sont constitués de LDPE. La seringue est graduée à intervalles de 0,5 mg et jusqu’à 10 mg.
Taille de conditionnement : 30 mL ou 50 mL.
Toutes les présentations peuvent ne pas être commercialisées.
6.6. Précautions particulières d’élimination et de manipulation
Tout médicament non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
16 RUE MONTROSIER
92200 NEUILLY-SUR-SEINE
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· 34009 301 334 4 6 : Flacon (verre ambré) de 30 mL avec bouchon de sécurité-enfant et seringue pour administration orale. Boîte de 1.
· 34009 301 334 6 0 : Flacon (verre ambré) de 50 mL avec bouchon de sécurité-enfant et seringue pour administration orale. Boîte de 1.
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
[à compléter ultérieurement par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE
[à compléter ultérieurement par le titulaire]
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Liste I.
ANSM - Mis à jour le : 11/02/2025
DEXLIQ 4 mg/mL solution buvable
Dexaméthasone
· Gardez cette notice. Vous pourriez avoir besoin de la relire.
· Si vous avez d’autres questions, interrogez votre médecin ou votre pharmacien.
· Ce médicament vous a été personnellement prescrit. Ne le donnez pas à d’autres personnes. Il pourrait leur être nocif, même si les signes de leur maladie sont identiques aux vôtres.
· Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
1. Qu'est-ce que DEXLIQ 4 mg/mL solution buvable et dans quels cas est-il utilisé ?
2. Quelles sont les informations à connaître avant de prendre DEXLIQ 4 mg/mL solution buvable ?
3. Comment prendre DEXLIQ 4 mg/mL solution buvable ?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver DEXLIQ 4 mg/mL solution buvable ?
6. Contenu de l’emballage et autres informations.
1. QU’EST-CE QUE DEXLIQ 4 mg/mL solution buvable ET DANS QUELS CAS EST-IL UTILISE ?
Classe pharmacothérapeutique - code ATC : H02A B02
Stimuler votre organisme avec des corticostéroïdes supplémentaires (comme la dexaméthasone) est un moyen efficace de traiter diverses maladies impliquant une inflammation.
DEXLIQ réduit cette inflammation, qui pourrait entraîner une aggravation de votre état. Vous devez prendre ce médicament régulièrement pour en tirer un bénéfice maximum
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT DE PRENDRE DEXLIQ 4 mg/mL solution buvable ?
Ne prenez jamais DEXLIQ 4 mg/mL solution buvable :
· si vous êtes allergique à la dexaméthasone ou à l’un des autres composants contenus dans ce médicament, mentionnés dans la rubrique 6 ou si vous avez déjà présenté une réaction inhabituelle à ces substances.
· si vous présentez une infection qui touche le corps entier (sauf si vous recevez un traitement)
· si vous avez une infection fongique qui touche le corps entier
· si vous avez un ulcère stomacal ou duodénal
· si vous avez infection par des vers à la suite d’un voyage dans une région tropicale
Avertissements et précautions
Adressez-vous à votre médecin ou pharmacien avant de prendre DEXLIQ 4 mg/mL solution buvable :
· si vous avez déjà souffert d’une dépression sévère ou d’une dépression maniaque (trouble bipolaire). Cela inclut une dépression ayant eu lieu avant ou pendant la prise de médicaments stéroïdiens comme la dexaméthasone.
· l’un des membres de votre famille proche a eu ces maladies.
Des problèmes de santé mentale sont possibles durant la prise de stéroïdes comme la dexaméthasone.
· Ces maladies peuvent être graves.
· Elles apparaissent généralement dans les jours ou les semaines suivant le début du traitement.
· Leur apparition est plus probable aux doses élevées.
· La plupart de ces problèmes disparaissent si la dose est réduite ou le médicament est arrêté. Toutefois, si des problèmes surviennent, ils peuvent nécessiter un traitement.
Il est important d’en parler à un médecin si vous (ou quelqu’un prenant ce médicament) présentez de quelconques signes de problèmes de santé mentale. Cela est particulièrement important si vous êtes déprimé(e) ou avez des idées suicidaires. Dans un petit nombre de cas, des problèmes de santé mentale sont apparus lors de la réduction de la posologie ou à l'arrêt du traitement.
Adressez-vos à votre médecin avant de prendre ce médicament si :
· vous avez des problèmes rénaux ou hépatiques (cirrhose hépatique ou insuffisance hépatique chronique),
· vous avez une tumeur de la glande surrénale (phéochromocytome),
· vous avez une pression artérielle élevée, une maladie cardiaque ou avez récemment fait une crise cardiaque (une rupture du myocarde a été décrite),
· vous êtes diabétique ou avez des antécédents familiaux de diabète,
· vous souffrez d’ostéoporose (amincissement des os), en particulier si vous êtes une femme ménopausée,
· vous avez présenté une faiblesse musculaire avec ce stéroïde ou d'autres stéroïdes par le passé,
· vous souffrez de glaucome (pression oculaire élevée) ou avez des antécédents familiaux de glaucome, de cataracte (opacification du cristallin entraînant une baisse de la vision),
· vous souffrez de myasthenia gravis (une pathologie responsable d’une faiblesse musculaire),
· vous présentez un trouble intestinal ou un ulcère stomacal (peptique),
· vous avez des problèmes psychiatriques ou avez eu une maladie psychiatrique qui a été aggravée par ce type de médicament,
· vous souffrez d'épilepsie (affection caractérisée par des crises ou convulsions répétées),
· vous êtes migraineux/se,
· vous avez une hypothyroïdie,
· vous avez une infection parasitaire,
· vous avez une tuberculose, une septicémie ou une infection fongique dans l'œil,
· vous souffrez de paludisme cérébral,
· vous avez un herpès (labial, génital ou oculaire, en raison d’une perforation cornéenne possible)
· vous êtes asthmatique,
· vous êtes traité(e) pour une obstruction de vaisseaux sanguins par des caillots sanguins (thromboembolie),
· vous avez des ulcérations et des lésions cornéennes.
Le traitement par corticostéroïdes peut réduire la capacité du corps à combattre les infections. Cela peut parfois conduire à des infections causées par des germes qui sont rarement responsables d’une infection dans des circonstances normales (ce que l’on appelle des infections opportunistes). Si vous présentez une infection de n’importe quel type pendant le traitement par ce médicament, contactez votre médecin immédiatement. Cela est particulièrement important si vous observez des signes de pneumonie : toux, fièvre, essoufflement et douleur thoracique. Vous pouvez également ressentir une confusion, en particulier si vous êtes âgé(e). Vous devez également informer votre médecin si vous avez eu une tuberculose ou si vous avez séjourné dans des régions où les infections par des vers ronds sont fréquentes.
Il est important que pendant le traitement par ce médicament, vous évitiez tout contact avec des personnes souffrant de varicelle, rougeole ou rubéole. Si vous pensez qu’il est possible que vous ayez été exposé(e) à l’une de ces maladies, vous devez consulter votre médecin immédiatement. Vous devez également informer votre médecin si vous avez déjà eu des maladies infectieuses telles que la rougeole ou la varicelle et de toute vaccination.
Le traitement par ce médicament peut provoquer une choriorétinopathie séreuse centrale, une maladie oculaire qui conduit à une vision trouble ou déformée. Cela se produit généralement dans l’un des yeux. Si vous constatez une vision trouble ou déformée durant plusieurs jours, veuillez contacter votre médecin.
Le traitement par ce médicament peut provoquer une inflammation des tendons. Dans des cas extrêmement rares, une rupture de tendon est possible. Ce risque est augmenté par le traitement par certains antibiotiques et par les problèmes rénaux. Contactez votre médecin en cas d'articulations ou de tendons douloureux, raides ou gonflés.
Le traitement par dexaméthasone peut provoquer une affection appelée insuffisance adrénocorticale. Celle-ci peut entraîner une modification de l’efficacité du médicament après un stress et un traumatisme, une chirurgie, un accouchement ou une maladie et il se peut que votre corps ne soit pas capable de répondre de la manière habituelle à un stress sévère comme un accident, une intervention chirurgicale, un accouchement ou une maladie.
Si vous avez un accident, êtes malade, êtes confronté(e) à d'autres conditions de stress physique spécifique ou avez besoin d’une intervention chirurgicale (même chez le dentiste) ou si vous avez besoin d’une vaccination (en particulier par des vaccins à « virus vivant ») pendant la prise de dexaméthasone ou une fois le traitement terminé, vous devez informer la personne chargée de votre traitement du fait que vous prenez ou avez pris des stéroïdes.
En cas de test de retrait (recherchant la quantité d’hormone dans le corps), de test cutané d’allergie ou de test d'infection bactérienne, vous devez informer la personne effectuant le test que vous prenez de la dexaméthasone, car elle peut interférer avec les résultats.
Il se peut également que votre médecin réduise la quantité de sel apportée par votre alimentation et vous donne un complément potassique pendant votre traitement par ce médicament.
Si vous êtes âgé(e), il se peut que certains effets secondaires de ce médicament soient plus graves, en particulier l'amincissement des os (ostéoporose), l’hypertension artérielle, les faibles taux de potassium, le diabète, la sensibilité aux infections et l'amincissement de la peau. Votre médecin vous surveillera plus étroitement.
Enfants
Sans objet.
Autres médicaments et DEXLIQ 4 mg/mL solution buvable
Informez votre médecin ou pharmacien si vous prenez, avez récemment pris ou pourriez prendre tout autre médicament.
Si vous prenez l’un des médicaments suivants, vous devez en parler avec votre médecin avant de prendre la dexaméthasone :
· médicaments anticoagulants, qui liquéfient le sang (par exemple, warfarine, coumarine)
· aspirine ou similaire (médicaments anti-inflammatoires non stéroïdiens), par exemple indométacine
· médicaments utilisés pour traiter le diabète
· médicaments utilisés pour traiter l’hypertension artérielle
· diurétiques
· injection d'amphotéricine B
· phénytoïne, carbamazépine, primidone (médicament contre l’épilepsie)
· rifabutine, rifampicine, isoniazide (antibiotiques utilisés pour traiter la tuberculose)
· antiacides (en particulier ceux contenant du trisilicate de magnésium) ou charbon
· barbituriques (médicaments utilisés pour favoriser le sommeil et atténuer l’anxiété)
· aminoglutéthimide (traitement contre le cancer)
· carbenoxolone (utilisée dans le traitement des ulcères de l’estomac)
· éphédrine (décongestionnant nasal)
· acétazolamide (utilisé pour le glaucome et l’épilepsie)
· hydrocortisone, cortisone et autres corticostéroïdes
· kétoconazole, itraconazole (pour les infections fongiques)
· ritonavir (pour le VIH)
· antibiotiques incluant l’érythromycine, les fluoroquinolones
· médicaments qui favorisent les mouvements musculaires dans le myasthenia gravis (par exemple, néostigmine)
· colestyramine (pour les taux élevés de cholestérol)
· hormones estrogéniques incluant la pilule contraceptive
· tétracosactide (utilisé dans le test de la fonction adrénocorticale)
· sultopride (utilisé pour calmer les émotions)
· ciclosporine (utilisée pour prévenir le rejet après une greffe)
· thalidomide
· praziquantel (administré pour certaines infections par des vers)
· vaccination par des vaccins vivants
· chloroquine, hydroxychloroquine et méfloquine (pour le paludisme)
· somatotropine
· protiréline
Il est possible que vous soyez exposé(e) à un risque accru d’effets secondaires graves si vous prenez la dexaméthasone en association avec les médicaments suivants :
· acide acétylsalicylique ou similaire (médicaments anti-inflammatoires non stéroïdiens), par exemple indométacine
· médicaments utilisés pour traiter le diabète
· médicaments utilisés pour traiter les maladies cardiaques
· diurétiques
· injection d'amphotéricine B
· acétazolamide (utilisé pour le glaucome et l’épilepsie)
· tétracosactide utilisé dans le test de la fonction adrénocorticale
· carbenoxolone (utilisée dans le traitement des ulcères de l’estomac)
· chloroquine, hydroxychloroquine et méfloquine (pour le paludisme)
· médicaments utilisés pour traiter l’hypertension artérielle
· thalidomide utilisée par exemple pour le myélome multiple
· vaccination par des vaccins vivants
· médicaments qui favorisent les mouvements musculaires dans le myasthenia gravis (par exemple, néostigmine)
· antibiotiques incluant les fluoroquinolones
Vous devez lire les notices de tous les médicaments devant être pris en association avec la dexaméthasone pour connaître les informations liées à ces médicaments avant de débuter le traitement par dexaméthasone. En cas d'utilisation de thalidomide, de lénalidomide ou de pomalidomide, une attention particulière doit être portée aux exigences en matière de test et de prévention des grossesses.
DEXLIQ 4 mg/mL solution buvable avec des aliments, boissons et de l’alcool
La dexaméthasone doit être prise avec ou après les aliments, afin de réduire au maximum l’irritation du tractus gastro-intestinal. Les boissons contenant de l'alcool ou de la caféine doivent être évitées. Il est recommandé de consommer de petits repas fréquents et éventuellement de prendre des antiacides, s’ils sont recommandés par votre médecin.
Grossesse, allaitement et fertilité
Si vous êtes enceinte ou que vous allaitez, si vous pensez être enceinte ou planifiez une grossesse, demandez conseil à votre médecin ou pharmacien avant de prendre ce médicament.
DEXLIQ ne doit être prescrit pendant la grossesse, en particulier au cours du premier trimestre, que si les bénéfices l’emportent sur les risques pour la mère et l’enfant. Si vous tombez enceinte pendant l’utilisation du produit, n'arrêtez pas de l’utiliser, mais informez votre médecin immédiatement de votre grossesse.
La dexaméthasone est excrétée dans le lait maternel. Un risque pour les nouveau-nés et nourrissons ne peut pas être exclu. Une décision sur la poursuite ou l’interruption de l’allaitement ou sur la poursuite ou l’interruption du traitement par la dexaméthasone doit être prise, en prenant en compte le bénéfice de l’allaitement pour l’enfant et le bénéfice du traitement par la dexaméthasone pour la mère.
Conduite de véhicules et utilisation de machines
Ne conduisez pas, n’utilisez pas d'outils ou de machines et n’effectuez pas de tâches dangereuses si vous présentez des effets secondaires, comme une confusion, des hallucinations, des vertiges, une fatigue, une somnolence, un évanouissement ou des troubles visuels.
DEXLIQ 4 mg/mL solution buvable contient du maltitol liquide, du sorbitol, de l’éthanol et du propylène glycol
Ce médicament contient du maltitol. Si votre médecin vous a informé(e) d’une intolérance à certains sucres, contactez-le avant de prendre ce médicament.
Ce médicament contient de petites quantités d'éthanol (alcool), moins de 100 mg pour 10 mg de dexaméthasone.
Ce médicament contient 225 mg de propylène glycol pour 10 mg de dexaméthasone.
Si votre bébé a moins de 4 semaines, demandez à votre médecin ou à votre pharmacien avant de lui administrer ce médicament, en particulier si le bébé reçoit d’autres médicaments contenant du propylène glycol ou de l’alcool.
Ce médicament contient 350 mg de sorbitol pour 10 mg de dexaméthasone.
Le sorbitol est une source de fructose. Si votre médecin vous a informé(e) que vous (ou votre enfant) présentiez une intolérance à certains sucres ou si vous avez été diagnostiqué(e) avec une intolérance héréditaire au fructose (IHF), un trouble génétique rare caractérisé par l'incapacité à décomposer le fructose, parlez-en à votre médecin avant que vous (ou votre enfant) ne preniez ou ne receviez ce médicament.
3. COMMENT PRENDRE DEXLIQ 4 mg/mL solution buvable ?
Veillez à toujours prendre ce médicament en suivant exactement les indications de votre médecin. Ces instructions seront inscrites sur la boîte de médicament par votre pharmacien. Vérifiez auprès de votre médecin ou pharmacien en cas de doute.
Utilisation de la seringue
Une seringue graduée de 3 ml et un adaptateur pour flacon/seringue sont fournis avec votre médicament. Utilisez la seringue pour extraire du flacon la quantité de DEXLIQ qui vous a été prescrite par votre médecin.
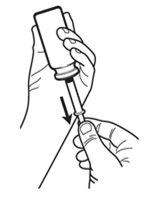
· Insérez l'adaptateur pour flacon fermement dans le col du flacon.
· Poussez la pointe de la seringue dans le trou situé au sommet de l’adaptateur et assurez-vous qu’elle est bien fixée.
· Maintenez la seringue en place et retournez le flacon (voir Figure 1).
· Tout en maintenant la seringue en place, tirez le piston vers le bas jusqu’à la marque appropriée sur la seringue (voir Figure 1 et Figure 2).
· Remettez le flacon à l’endroit.
· Retirez la seringue de l’adaptateur en tournant délicatement la seringue, tout en maintenant le flacon.
· Après utilisation, rebouchez le flacon et lavez la seringue à l’eau chaude. Laissez sécher.
· Ne retirez pas l’adaptateur du flacon.
Figure 1
Chaque graduation sur la seringue correspond à 0,5 mg de dexaméthasone (voir Figure 2).
Figure 2
La dexaméthasone est habituellement fournie à des doses comprises entre 0,5 et 9 mg, en fonction de la maladie traitée. Dans les maladies plus sévères, des doses supérieures à 9 mg peuvent être nécessaires.
La dose que vous devez prendre est déterminée par votre médecin, en fonction de votre poids et de la maladie à traiter. Cette dose est strictement personnelle.
La durée et la fréquence du traitement sont déterminées par votre médecin.
Il est très important de suivre les instructions données par votre médecin et/ou votre pharmacien et de ne pas modifier votre traitement sans en parler à votre médecin. Il est également très important de ne pas interrompre soudainement votre traitement sans en parler d'abord à votre médecin.
Votre médecin peut modifier la dose et la fréquence d'administration en fonction de certains paramètres, notamment vos analyses sanguines, votre état général, les autres médicaments qui vous sont prescrits et votre réponse au traitement.
Important : En cas de doute concernant la quantité de médicament que vous devez prendre, demandez conseil à votre médecin ou pharmacien.
Ne prenez pas plus ou moins que la dose prescrite.
Ne prenez pas votre médicament plus ou moins souvent que ce qui vous a été prescrit.
Utilisation chez les enfants
Si ce médicament est pris par un enfant, il est important que le médecin surveille sa croissance et son développement à intervalles fréquents.
Si vous avez pris plus de DEXLIQ 4 mg/mL solution buvable que vous n’auriez dû
Si vous avez pris trop de médicament, contacter un médecin ou hôpital immédiatement.
Si vous oubliez de prendre DEXLIQ 4 mg/mL solution buvable
Ne prenez pas de dose double pour compenser la dose que vous avez oublié de prendre.
Si vous arrêtez de prendre DEXLIQ 4 mg/mL solution buvable
Si votre traitement doit être arrêté, suivez les conseils de votre médecin. Il se peut qu’il vous dise de réduire la quantité de médicament que vous prenez de manière progressive, jusqu’à ce que vous n’en preniez plus du tout. Il peut être dangereux d'arrêter brutalement de prendre ce médicament. Les symptômes ayant été décrits lors d’un arrêt trop rapide du traitement incluent une faible pression artérielle et, parfois, la récidive de la maladie pour laquelle ce médicament était administré.
Un « syndrome de retrait » est également possible, incluant une fièvre, des douleurs musculaires et articulaires, une inflammation de la muqueuse nasale (rhinite), une perte de poids, des démangeaisons cutanées et une inflammation de l'œil (conjonctivite). Si votre traitement doit être arrêté, suivez les conseils de votre médecin.
Si vous avez d’autres questions sur l’utilisation de ce médicament, demandez plus d’informations à votre médecin ou votre pharmacien.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
Contactez un médecin immédiatement si vous :
· présentez des problèmes graves de santé mentale Ces problèmes peuvent toucher les personnes prenant des médicaments comme la dexaméthasone. Ils incluent :
o se sentir déprimé(e), parfois avec des idées suicidaires
o se sentir euphorique (manie) ou avoir une humeur en dent de scie
o être anxieux, avoir des difficultés à dormir ou à penser, se sentir confus ou perdre la mémoire
o ressentir, voir ou entendre des choses qui n’existent pas. Avoir des pensées étranges et terrifiantes, modifier sa manière d'agir ou avoir le sentiment d’être seul(e)
· présentez une réaction allergique à DEXLIQ. Informez votre médecin ou rendez-vous à l’hôpital immédiatement si vous présentez l’un des effets secondaires suivants :
o peau rouge et boursoufflée
o difficulté à respirer
o gonflement du visage, de la bouche, des lèvres ou des paupières
· ressentez des douleurs abdominales sévères, nausées, vomissements, diarrhée, fatigue et faiblesse musculaire profondes, pression artérielle extrêmement faible, perte de poids et fièvre, car il peut s'agir de signes d’une insuffisance adrénocorticale
· ressentez une douleur abdominale soudaine, sensibilité, nausées, vomissements, fièvre et sang dans les selles, car il peut s’agir de signes d’une déchirure de l’intestin, en particulier si vous avez ou avez eu une maladie intestinale.
D’autres effets secondaires peuvent inclure :
· problèmes de santé mentale : sentiment de dépendance, maux de tête sévères avec troubles visuels (liés à l’arrêt du traitement), aggravation d’une schizophrénie (dans laquelle vous pouvez ressentir, voir ou entendre des choses qui n’existent pas, vous replier sur vous-même ou croire ou suspecter des choses fausses)
· problèmes stomacaux et intestinaux : nausées, vomissements, hoquet, augmentation de l’appétit, maux d’estomac, abdomen gonflé, inflammation et ulcères dans l'œsophage, gêne dans l’estomac, ulcères stomacaux parfois avec saignements, inflammation du pancréas (causant des douleurs dans le dos et l’abdomen), déchirure de l’intestin en particulier si vous avez une maladie inflammatoire de l’intestin, dépôts graisseux inhabituels
· problèmes liés au métabolisme et aux taux de sels : prise de poids, déséquilibre en sels, rétention hydrique, perte de potassium due à de faibles taux de dioxyde de carbone (alcalose hypokaliémique), perte de l'équilibre calcium-protéines, besoin accru en médicaments antidiabétiques, augmentation des taux de cholestérol
· problèmes cardiaques et hématologiques : caillots sanguins, insuffisance cardiaque congestive chez les sujets sensibles, rupture du muscle cardiaque (en particulier en cas de crise cardiaque récente), hypertension artérielle, augmentation ou réduction des taux de globules rouges et de globules blancs, inflammation et épaississement des veines ou des artères
· problèmes musculaires, osseux et cutanés : amincissement des os avec un risque accru de fractures, maladie osseuse, rupture de tendons, perte musculaire, faiblesse, pilosité excessive (en particulier chez les femmes), lenteur de la cicatrisation des plaies, peau fine et délicate, marques inhabituelles sur la peau, bleus, rougeur et inflammation de la peau, vergetures, capillaires gonflés visibles, acné, augmentation de la transpiration, altération de la réaction aux tests cutanés, éruptions cutanées, amincissement des cheveux
· problèmes liés au système immunitaire : muguet, augmentation du risque de contracter des infections, récidive de la tuberculose si vous l'avez déjà eue, affections hématologiques dues à des infections
· problèmes oculaires : cataracte, augmentation de la pression dans l'œil, gonflement oculaire, amincissement des membranes oculaires, aggravation des infections oculaires existantes, protrusion des globes oculaires
· problèmes liés au système reproducteur : irrégularité ou absence des règles, impuissance
· problèmes hormonaux : altération de la régulation hormonale, ralentissement de la croissance chez les enfants et les adolescents, gonflement et prise de poids au niveau du corps et du visage (état cushingoïde)
· problèmes liés au système nerveux : crises et aggravation de l’épilepsie, vertiges, maux de tête
· autre effet général : modification de l’efficacité du médicament après un stress et un traumatisme, une intervention chirurgicale ou une maladie, effets de retrait (fièvre, douleurs musculaires et articulaires, inflammation de l'œil ou du nez, démangeaisons cutanées et perte de poids)
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin, votre pharmacien ou à votre infirmier\ère. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet: https://signalement.social-sante.gouv.fr/.
En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.
5. COMMENT CONSERVER DEXLIQ 4 mg/mL solution buvable ?
Tenir ce médicament hors de la vue et de la portée des enfants.
À conserver à une température ne dépassant pas 30°C. Ne pas mettre au réfrigérateur.
À conserver dans l'emballage d’origine à l'abri de la lumière.
Après la première ouverture, utiliser dans les 3 mois.
N’utilisez pas ce médicament après la date de péremption indiquée sur l’étiquette du flacon et le carton après EXP. La date de péremption fait référence au dernier jour de ce mois.
Ne jetez aucun médicament au tout-à-l’égout ni avec les ordures ménagères. Demandez à votre pharmacien d’éliminer les médicaments que vous n’utilisez plus. Ces mesures contribueront à protéger l’environnement.
6. CONTENU DE L’EMBALLAGE ET AUTRES INFORMATIONS
Ce que contient DEXLIQ 4 mg/mL solution buvable
· La substance active est :
Dexaméthasone........................................................................................................... 4,000 mg
Sous forme de phosphate sodique de dexaméthasone
Pour 1 mL de solution.
· Les autres composants sont :
Propylène glycol (E1520), maltitol liquide (E965), arôme menthe (menthe poivrée, menthe verte, menthol et éthanol), sorbitol liquide (non cristallisant) (E420), citrate de sodium (E331), édétate disodique, sucralose, solution d’hydroxyde de sodium, eau purifiée.
Qu’est-ce que DEXLIQ 4 mg/mL solution buvable et contenu de l’emballage extérieur
DEXLIQ est une solution buvable incolore à jaunâtre à l’odeur de menthe. Elle est fournie dans un flacon en verre ambre contenant 30 ou 50 mL de solution, avec un bouchon à vis à l’épreuve des enfants. Le carton contient également une seringue en plastique de 3 mL pour administration orale et un adaptateur pour flacon/seringue.
Titulaire de l’autorisation de mise sur le marché
16 RUE MONTROSIER
92200 NEUILLY-SUR-SEINE
Exploitant de l’autorisation de mise sur le marché
16 RUE MONTROSIER
92200 NEUILLY-SUR-SEINE
THESI POUSI-XATZI, AGIOU LOUKA STR.
PEANIA, ATTIKI, TK 19002
GRECE
Noms du médicament dans les Etats membres de l'Espace Economique Européen
Ce médicament est autorisé dans les Etats membres de l'Espace Economique Européen sous les noms suivants : Conformément à la réglementation en vigueur.
[À compléter ultérieurement par le titulaire]
La dernière date à laquelle cette notice a été révisée est :
[à compléter ultérieurement par le titulaire]
Des informations détaillées sur ce médicament sont disponibles sur le site Internet de l’ANSM (France).