Dernière mise à jour le 01/12/2025
BRINZOLAMIDE BIOGARAN 10 mg/mL, collyre en suspension
Indications thérapeutiques
Classe pharmacothérapeutique - code ATC : S01EC04.
BRINZOLAMIDE BIOGARAN contient du brinzolamide qui fait partie d’un groupe de médicaments appelé inhibiteurs de l’anhydrase carbonique. Il réduit la pression dans l’œil.
BRINZOLAMIDE BIOGARAN collyre est utilisé pour traiter une pression élevée à l’intérieur de l’œil. Cette pression peut conduire à une maladie appelée glaucome.
Si la pression dans l’œil est trop forte, cela peut endommager votre vue.
Présentations
> 1 flacon(s) compte-gouttes polyéthylène basse densité (PEBD) de 5 ml
Code CIP : 34009 300 431 1 0
Déclaration de commercialisation : 25/11/2016
Cette présentation est agréée aux collectivités
- Prix hors honoraire de dispensation : 4,07 €
- Honoraire de dispensation : 1,02 €
- Prix honoraire compris : 5,09 €
- Taux de remboursement :65%
Service médical rendu (SMR)
Amélioration du service médical rendu (ASMR)
Ce médicament étant un générique, l'ASMR n'a pas été évalué par la commission de la transparence (CT), il est possible de se référer à la /aux spécialité(s) de référence du groupe générique auquel appartient ce médicament (cliquez ici pour aller à la rubrique des groupes génériques)
ANSM - Mis à jour le : 19/09/2022
BRINZOLAMIDE BIOGARAN 10 mg/mL, collyre en suspension
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Chaque mL de suspension contient 10 mg de brinzolamide.
Une goutte contient approximativement 309 microgrammes de brinzolamide.
Excipient à effet notoire :
Chaque mL de suspension contient approximativement 0,1 mg de chlorure de benzalkonium.
Une goutte contient approximativement 3,1 microgrammes de chlorure de benzalkonium.
Pour la liste complète des excipients, voir rubrique 6.1.
Collyre en suspension.
Suspension blanche homogène.
pH : 7.1-7.9
Osmolalité : 270-320 mOsm/Kg
4.1. Indications thérapeutiques
BRINZOLAMIDE BIOGARAN est indiqué pour diminuer la pression intra-oculaire élevée en cas :
· d’hypertension intra-oculaire ;
· de glaucome à angle ouvert ;
en monothérapie chez les patients adultes ne répondant pas aux bêta-bloquants ou chez les patients adultes pour qui les bêta-bloquants sont contre-indiqués, ou bien en association avec les bêta- bloquants ou les analogues des prostaglandines (voir également rubrique 5.1).
4.2. Posologie et mode d'administration
En monothérapie ou en association, la posologie est d’une goutte de BRINZOLAMIDE BIOGARAN dans le cul-de-sac conjonctival de l’œil ou des yeux atteint(s) deux fois par jour. Certains patients peuvent avoir une meilleure réponse avec une goutte trois fois par jour.
Populations particulières
Sujets âgés
Aucun ajustement de la posologie n’est nécessaire chez les patients âgés.
Insuffisance hépatique et rénale
Le brinzolamide n’a pas été étudié chez les patients ayant une insuffisance hépatique et par conséquent n’est pas recommandé chez ces patients.
Le brinzolamide n’a pas été étudié chez les patients ayant une insuffisance rénale sévère (clairance de la créatinine < 30 mL/min) ou chez les patients présentant une acidose hyperchlorémique. Etant donné que le brinzolamide et ses principaux métabolites sont majoritairement excrétés par le rein, BRINZOLAMIDE BIOGARAN est par conséquent contre-indiqué chez ces patients (voir rubrique 4.3).
Population pédiatrique
La sécurité et l’efficacité du brinzolamide chez les nourrissons, les enfants et les adolescents âgés de 0 à 17 ans n’ont pas été établies. Des données actuellement disponibles, sont décrites aux rubriques 4.8 et 5.1.
L’utilisation du brinzolamide n’est pas recommandée chez les nourrissons, les enfants et les adolescents.
Mode d’administration
Voie ophtalmique.
Une occlusion nasolacrymale ou une fermeture douce des paupières après l’instillation est recommandée. Ceci peut réduire l’absorption systémique des médicaments administrés par voie ophtalmique et conduire à une diminution des effets secondaires systémiques.
Demander aux patients de bien agiter le flacon avant usage. Après avoir retiré le capuchon, si la bague de sécurité est trop lâche, la retirer avant utilisation du produit.
Pour éviter la contamination de l’embout compte-gouttes et de la suspension, il faut faire attention à ne pas toucher les paupières, les surfaces voisines ou d’autres surfaces avec l’embout compte- gouttes du flacon. Indiquer aux patients de conserver le flacon bien fermé quand il n’est pas utilisé.
En cas de remplacement d’un autre traitement anti-glaucomateux ophtalmique par BRINZOLAMIDE BIOGARAN, interrompre l’autre médicament et commencer BRINZOLAMIDE BIOGARAN le jour suivant.
En cas d’utilisation de plusieurs médicaments administrés par voie ophtalmique, les instillations doivent être espacées d’au moins 5 minutes. Les pommades ophtalmiques doivent être administrées en dernier.
Si une instillation est oubliée, le traitement doit être poursuivi avec l'instillation suivante comme prévu. La posologie ne doit pas excéder une goutte trois fois par jour dans l’œil (les yeux) atteint(s).
Hypersensibilité à la substance active ou à l’un des excipients mentionnés à la rubrique 6.1 ;
Hypersensibilité connue aux sulfonamides (voir également rubrique 4.4) ;
Insuffisance rénale sévère ;
Acidose hyperchlorémique.
4.4. Mises en garde spéciales et précautions d'emploi
Effets systémiques
Le brinzolamide est un sulfonamide inhibiteur de l’anhydrase carbonique qui même administré localement, est absorbé par voie générale. Les effets indésirables des sulfonamides peuvent aussi être observés avec la voie locale, y compris le syndrome de Stevens-Johnson (SSJ) et la nécrolyse épidermique toxique (NET). Lors de la prescription, les patients doivent être informés des signes et symptômes et les réactions dermiques doivent être surveillés de près. Si des signes de réactions graves ou d’hypersensibilité apparaissent, le brinzolamide doit être immédiatement arrêté.
Des perturbations acido-basiques ont été rapportées suite à l’administration orale d’inhibiteurs de l’anhydrase carbonique. Utiliser avec précaution chez les patients à risque d’insuffisance rénale en raison du risque potentiel d’acidose métabolique (voir rubrique 4.2).
Le brinzolamide n’a été étudié ni chez les prématurés (moins de 36 semaines d’âge gestationnel), ni chez les enfants âgés de moins d’une semaine. En raison du risque possible d’acidose métabolique, les patients présentant une immaturité ou des anomalies tubulaires rénales significatives ne peuvent être traités par le brinzolamide qu’après une évaluation approfondie du rapport bénéfice risque.
Les inhibiteurs de l’anhydrase carbonique par voie orale peuvent diminuer l’aptitude aux tâches nécessitant une vigilance mentale et/ou une coordination physique. Ces effets peuvent aussi se produire après administration topique puisque le BRINZOLAMIDE BIOGARAN présente une absorption systémique.
Traitement concomitant
Chez les patients recevant un inhibiteur de l’anhydrase carbonique par voie orale et du brinzolamide, il y a une possibilité d’addition des effets systémiques inhérents à l’inhibition de l’anhydrase carbonique. L’administration simultanée de brinzolamide et d’inhibiteurs de l’anhydrase carbonique par voie orale n’a pas été étudiée et n’est pas recommandée (voir également rubrique 4.5).
En association, le brinzolamide a été évalué principalement avec le timolol lors du traitement du glaucome. Par ailleurs, l’effet du brinzolamide associé à l’analogue des prostaglandines travoprost sur la réduction de la PIO a été étudié. Il n’existe pas de données à long terme quant à l’association concomitante de brinzolamide et de travoprost (voir également rubrique 5.1).
L’expérience du traitement par brinzolamide chez des patients présentant un glaucome pseudoexfoliatif ou un glaucome pigmentaire est limitée. Il conviendra de faire particulièrement attention lors du traitement de ces patients et une surveillance étroite de la pression intraoculaire (PIO) est recommandée. Le brinzolamide n’a pas été évalué chez les patients présentant un glaucome à angle étroit et son utilisation n’est pas recommandée chez ces patients.
Le rôle éventuel du brinzolamide sur la fonction endothéliale cornéenne n’a pas été étudié chez les patients présentant une cornée fragilisée (notamment chez les patients ayant un faible nombre de cellules endothéliales). En particulier, les patients porteurs de lentilles de contact n’ont pas été étudiés et une surveillance attentive est recommandée chez ces patients sous brinzolamide étant donné que les inhibiteurs de l’anhydrase carbonique peuvent affecter l’hydratation cornéenne et que le port de lentilles de contact peut augmenter le risque pour la cornée. De même, une surveillance attentive est recommandée chez les patients présentant une cornée fragilisée, tels que les patients présentant un diabète sucré ou des dystrophies de la cornée.
Le brinzolamide n’a pas été étudié chez les patients portant des lentilles de contact. BRINZOLAMIDE BIOGARAN contient du chlorure de benzalkonium, qui est connu pour teinter/jaunir les lentilles de contact souples. Le contact avec les lentilles de contact souples doit être évité. Il convient de demander aux patients d’enlever leurs lentilles de contact avant l’instillation de BRINZOLAMIDE BIOGARAN et d’attendre au moins 15 minutes après l’instillation avant de remettre des lentilles de contact.
Le chlorure de benzalkonium est connu pour provoquer une irritation des yeux, des symptômes du syndrome de l’œil sec et peut affecter le film lacrymal et la surface de la cornée. Doit être utilisé avec prudence chez les patients atteints d’œil sec et ceux présentant un risque d’endommagement de la cornée. Les patients doivent être surveillés en cas d’utilisation prolongée.
Les effets rebonds potentiels à l’arrêt du traitement avec le BRINZOLAMIDE BIOGARAN n’ont pas été étudiés ; l’abaissement de la PIO est supposé durer 5 à 7 jours.
Population pédiatrique
La sécurité et l’efficacité de BRINZOLAMIDE BIOGARAN chez les nourrissons, les enfants et les adolescents âgés de 0 à 17 ans n’ont pas été établies et son utilisation n’est pas recommandée chez les nourrissons, les enfants et les adolescents.
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
Aucune étude spécifique des interactions avec d'autres médicaments n’a été effectuée avec le brinzolamide.
Lors des études cliniques, le brinzolamide a été utilisé avec des préparations ophtalmiques d’analogues des prostaglandines et de timolol sans mettre en évidence d’interactions médicamenteuses. L’association de brinzolamide à des myotiques ou des agonistes adrénergiques n’a pas été évaluée au cours de traitements du glaucome.
Le brinzolamide est un inhibiteur de l’anhydrase carbonique qui, bien qu’administré par voie locale, présente une absorption systémique. Des déséquilibres acido-basiques ont été rapportés avec des inhibiteurs de l’anhydrase carbonique par voie orale. La possibilité d’interactions doit être envisagée chez les patients traités avec du brinzolamide.
Les iso-enzymes du cytochrome P-450 responsables du métabolisme du brinzolamide comprennent le CYP3A4 (principal), le CYP2A6, le CYP2C8 et le CYP2C9. Il est supposé que les inhibiteurs du CYP3A4 tels que le kétoconazole, l’itraconazole, le clotrimazole, le ritonavir et la troléandomycine inhiberont le métabolisme du brinzolamide par le CYP3A4. Il est conseillé d’être prudent lorsque les inhibiteurs du CYP3A4 sont donnés simultanément.
Cependant, l’élimination rénale étant la voie principale, l’accumulation de brinzolamide est improbable. Le brinzolamide n’est pas un inhibiteur des iso-enzymes du cytochrome P-450.
4.6. Fertilité, grossesse et allaitement
Grossesse
Il n'existe pas de données ou des données limitées sur l'utilisation ophtalmique du brinzolamide chez la femme enceinte. Des études effectuées chez l'animal ont mis en évidence une toxicité sur la reproduction après une administration systémique (voir également rubrique 5.3).
BRINZOLAMIDE BIOGARAN n’est pas recommandé pendant la grossesse et chez les femmes en âge de procréer n’utilisant pas de contraception.
L’excrétion du brinzolamide et de ses métabolites dans le lait maternel, après administration topique oculaire, n’est pas connue. Des études chez l'animal ont mis en évidence un faible niveau d’excrétion du brinzolamide dans le lait maternel après administration orale.
L’existence d’un risque pour les nouveau-nés/nourrissons ne peut pas être exclu. La décision d’arrêter l’allaitement ou d’arrêter/ suspendre le traitement par le BRINZOLAMIDE BIOGARAN, doit prendre en compte le bénéfice de l’allaitement pour l’enfant ainsi que le bénéfice du traitement pour la femme.
Fertilité
Les études chez l’animal n’ont démontré aucun effet sur la fertilité. Les études n’ont pas permis d’évaluer l’effet d’une administration oculaire topique du brinzolamide sur la fertilité humaine.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
Le brinzolamide a une influence mineure sur la capacité à conduire et utiliser des machines.
Une vision floue provisoire ou d’autres troubles visuels peuvent diminuer l’aptitude à conduire des véhicules ou à utiliser des machines (voir également rubrique 4.8). En cas de vision floue survenant lors de l’instillation, le patient doit attendre que sa vision redevienne normale avant de conduire un véhicule ou d’utiliser une machine.
Les inhibiteurs de l’anhydrase carbonique par voie orale peuvent diminuer l’aptitude à réaliser des tâches nécessitant une vigilance mentale et/ou une coordination physique (voir également rubrique 4.4 et rubrique 4.8).
Résumé du profil de sécurité
Les effets indésirables liés au traitement les plus fréquemment rapportés au cours des études cliniques incluant plus de 2732 patients traités avec du brinzolamide en monothérapie ou en association avec du maléate de timolol 5 mg/mL étaient : dysgueusie (6,0%) (goût amer ou inhabituel, voir description ci-dessous) et trouble de la vision, survenant de façon transitoire lors de l’instillation et dont la durée varie de quelques secondes à quelques minutes (5,4%) (voir également rubrique 4.7).
Tableau résumé des effets indésirables
Les effets indésirables suivants ont été déclarés avec le brinzolamide 10mg/mL collyre en suspension, et sont classés de la façon suivante : très fréquents (≥1/10), fréquents (≥1/100 à < 1/10), peu fréquents (≥1/1000 à <1/100), rares (≥1/10000 à <1/1000), très rares (<1/10000) ou fréquence indéterminée (ne peut être estimée sur la base des données disponibles). Dans chaque groupe de fréquence, les effets indésirables sont présentés dans l’ordre décroissant de gravité. Ces effets indésirables ont été obtenus sur la base des études cliniques ou des rapports spontanés après commercialisation.
|
Classe de systèmes d’organes |
Terme préféré MedDRA (v.15.1) |
|
Infections et infestations |
Peu fréquentes : rhinopharyngite, pharyngite, sinusite Fréquence indéterminée : rhinite |
|
Affections hématologiques et du système lymphatique |
Peu fréquentes : diminution du nombre de globules rouges, augmentation du taux de chlorure dans le sang |
|
Affections du système immunitaire |
Fréquence indéterminée : hypersensibilité |
|
Affections métaboliques et nutritionnelles |
Fréquence indéterminée : diminution de l’appétit |
|
Affections psychiatriques |
Peu fréquentes : apathie, dépression, troubles de l’humeur, diminution de la libido, cauchemars, nervosité Rares : insomnie |
|
Affections du système nerveux |
Peu fréquentes : troubles de l’appareil locomoteur, amnésie, vertiges, paresthésie, maux de tête Rares : troubles de la mémoire, somnolence Fréquence indéterminée : tremblements, hypoesthésie, agueusie |
|
Affections oculaires |
Fréquentes : vision floue, irritation oculaire, douleur oculaire, sensation de corps étranger dans les yeux, hyperhémie oculaire Peu fréquentes : érosion cornéenne, kératite, kératite ponctuée, kératopathie, dépôt oculaire, coloration cornéenne, atteinte de l'épithélium cornéen, blépharites, prurit oculaire, conjonctivite, gonflement oculaire, meibomite, éblouissements, photophobie, œil sec, conjonctivite allergique, ptérygion, pigmentation sclérale, asthénopie, gêne oculaire, sensation anormale dans l’œil, kératoconjonctivite sèche, kyste sous-conjonctival, hyperhémie conjonctivale, prurit des paupières, écoulement de l’œil, formation de croûtes sur le bord de la paupière, augmentation du larmoiement Rares : œdème cornéen, diplopie, baisse de l’acuité visuelle, photopsie, hypoesthésie oculaire, œdème péri orbital, augmentation de la pression intraoculaire, augmentation du rapport « excavation papillaire/disque du nerf optique » Fréquence indéterminée : affection de la cornée, trouble visuel, allergie oculaire, madarose, affection de la paupière, érythème de la paupière |
|
Affections de l’oreille et du labyrinthe |
Rares : acouphènes Fréquence indéterminée : vertiges |
|
Affections cardiaques |
Peu fréquentes : détresse respiratoire, bradycardie, palpitations Rares : angine de poitrine, rythme cardiaque irrégulier Fréquence indéterminée : arythmie, tachycardie, hypertension, augmentation de la pression artérielle, diminution de la tension artérielle, accélération du rythme cardiaque |
|
Affections respiratoires, thoraciques et médiastinales |
Peu fréquentes : dyspnée, épistaxis, douleur oropharyngée, douleur pharyngolaryngée, irritation de la gorge, syndrome de toux des voies aériennes supérieures, rhinorrhée, éternuements Rares : hyperréactivité bronchique, congestion des voies respiratoires supérieures, congestion sinusale, congestion nasale, toux, sécheresse nasale Fréquence indéterminée : asthme |
|
Affections gastro-intestinales |
Fréquentes : dysgueusie Peu fréquentes : œsophagite, diarrhée, nausée, vomissement, dyspepsie, douleur abdominale haute, gêne abdominale, maux d’estomac, flatulences, selles fréquentes, troubles gastro-intestinaux, hypo esthésie orale, paresthésie orale, bouche sèche. |
|
Affections hépatobiliaires |
Fréquence indéterminée : bilan hépatique anormal |
|
Affections de la peau et du tissu sous-cutané |
Peu fréquentes : rash, rash maculopapuleux, tiraillements cutanés Rares : urticaire, alopécie, prurit généralisé Fréquence indéterminée : dermatite, érythème, syndrome de Stevens-Johnson (SSJ) / nécrolyse épidermique toxique (NET) (voir section 4.4) |
|
Affections musculo-squelettiques et systémiques |
Peu fréquentes : maux de dos, spasmes musculaires, myalgie Fréquence indéterminée : arthralgie, douleur des extrémités |
|
Affections du rein et des voies urinaires |
Peu fréquentes : douleurs rénales Fréquence indéterminée : pollakiurie |
|
Affections des organes de reproduction et du sein |
Peu fréquentes : dysfonction érectile |
|
Troubles généraux et anomalies au site d'administration |
Peu fréquentes : douleurs, gêne thoracique, fatigue, sensation de mal-être Rares : douleur thoracique, sensation de nervosité, irritabilité, asthénie Fréquence indéterminée : œdème périphérique, malaise |
|
Lésions, intoxications et complications liées aux procédures |
Peu fréquentes : corps étranger dans l’œil |
Description des effets indésirables sélectionnés
L’effet indésirable systémique le plus fréquemment rapporté au cours des essais cliniques avec le brinzolamide a été la dysgueusie (goût amer ou inhabituel dans la bouche après instillation). Il est probablement dû au passage du collyre dans le nasopharynx par le canal nasolacrymal. L’occlusion nasolacrymale ou la fermeture douce des paupières après l’instillation peut aider à réduire l’incidence de cet effet (voir également rubrique 4.2).
Le brinzolamide est un sulfonamide inhibiteur de l’anhydrase carbonique absorbé par voie systémique. Les effets gastro-intestinaux, affectant le système nerveux, hématologiques, rénaux et métaboliques sont généralement associés aux inhibiteurs de l’anhydrase carbonique systémiques. Les effets indésirables des inhibiteurs de l’anhydrase carbonique par voie orale peuvent être observés avec la voie locale.
Aucun effet indésirable inattendu n’a été observé avec le brinzolamide utilisé en association avec le travoprost. Les effets indésirables observés avec le traitement concomitant ont été ceux rapportés avec chacune des substances actives prise séparément.
Population pédiatrique
Au cours de petites études cliniques à court terme, approximativement 12,5% des patients pédiatriques ont présenté des effets indésirables, la majorité d’entre eux étant des effets oculaires locaux et non graves tels qu’une hyperhémie conjonctivale, une irritation oculaire, un écoulement oculaire et une augmentation du larmoiement (voir également la rubrique 5.1).
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr.
Aucun cas de surdosage n’a été rapporté.
Le traitement devra être symptomatique et général. Un déséquilibre hydro-électrolytique, le développement d’un état d’acidose et d’éventuels effets sur le système nerveux peuvent survenir. L’ionogramme (en particulier le potassium) et le pH sanguin doivent être surveillés.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Mécanisme d’action
L’anhydrase carbonique (AC) est un enzyme retrouvé dans de nombreux tissus de l’organisme y compris dans l’œil. L’anhydrase carbonique catalyse la réaction réversible d’hydratation du dioxyde de carbone et de déshydratation de l’acide carbonique.
L’inhibition de l’anhydrase carbonique dans les procès ciliaires de l’œil diminue la sécrétion d’humeur aqueuse, probablement en ralentissant la formation des ions bicarbonates, ce qui conduit à une réduction du transport de sodium et d’eau. Le résultat est une diminution de la pression intra-oculaire (PIO) qui est un facteur de risque majeur dans la pathogénie des altérations du nerf optique et de la perte du champ visuel d’origine glaucomateuse. Le brinzolamide, un inhibiteur de l’anhydrase carbonique II (AC-II), l’iso-enzyme prédominant de l’œil avec un CI50 in vitro de 3,2 nM et un Ki de 0,13 nM vis-à-vis de l’AC-II.
Efficacité et sécurité clinique
L’effet de brinzolamide associé à l’analogue des prostaglandines travoprost sur la réduction de la PIO a été étudié. Après une période de 4 semaines de traitement par travoprost, les patients qui avaient une PIO ≥ 19 mm Hg ont été randomisés afin de recevoir un traitement additionnel par brinzolamide ou par timolol. Des baisses supplémentaires de la PIO moyenne diurne, allant de 3,2 à 3,4 mm Hg dans le groupe brinzolamide et de 3,2 à 4,2 mm Hg dans le groupe timolol, ont été observées. L’incidence globale des effets indésirables oculaires non graves, représentés essentiellement par des signes d’irritation locale, a été plus élevée dans les groupes brinzolamide/travoprost. Les effets ont été modérés et n’ont pas modifié les taux de sortie d’études (voir également rubrique 4.8).
Une étude clinique a été conduite avec du brinzolamide chez 32 patients pédiatriques âgés de moins de 6 ans, pour lesquels un glaucome ou une hypertension oculaire avait été diagnostiqué. Certains patients n’avaient jamais reçu de médicament antiglaucomateux alors que d’autres en prenaient déjà.
Pour les patients déjà traités, il n’y a pas eu de fenêtre thérapeutique avant l’initiation de la monothérapie avec du brinzolamide. Chez les patients naïfs (10 patients), l’efficacité du brinzolamide était similaire à celle observée préalablement chez les adultes, avec des réductions moyennes de PIO allant jusqu’à 5 mm Hg.
Chez les patients déjà sous médicaments antiglaucomateux (22 patients), la PIO moyenne a légèrement augmenté par rapport à la valeur initiale dans le groupe brinzolamide.
5.2. Propriétés pharmacocinétiques
La liaison aux protéines plasmatiques est peu importante (environ 60%). Le brinzolamide est principalement éliminé par excrétion rénale (environ 60%). Environ 20% de la dose a été retrouvé dans les urines sous forme de métabolite. Le brinzolamide et le N-déséthylbrinzolamide sont les principaux composants retrouvés dans les urines avec des traces (<1%) de métabolites N- desméthoxypropyl et O-desméthyl.
Dans une étude pharmacocinétique par administration orale, des volontaires sains ont reçu des gélules de brinzolamide à 1 mg, deux fois par jour, pendant une durée atteignant 32 semaines et l’activité de l’anhydrase carbonique a été déterminée dans les globules rouges afin d’évaluer le degré d’inhibition systémique de l’anhydrase carbonique.
La saturation par le brinzolamide de l’AC-II érythrocytaire a été obtenue en 4 semaines (concentrations intra-érythrocytaires d’environ 20 µM). Le N-déséthylbrinzolamide s’accumulait dans les globules rouges pour atteindre un état d’équilibre en 20-28 semaines, jusqu’à des concentrations de 6 à 30 µM. A l’état d’équilibre, l’inhibition de l’activité de l’AC érythrocytaire totale était d’environ 70- 75%.
Des sujets atteints d’insuffisance rénale modérée (clairance de la créatinine de 30 à 60 mL/minute) ont reçu 1 mg de brinzolamide par voie orale deux fois par jour pendant une durée atteignant 54 semaines. Les concentrations érythrocytaires de brinzolamide étaient comprises entre 20 et 40 µM à la quatrième semaine de traitement. A l’état d’équilibre, les concentrations érythrocytaires de brinzolamide et de son métabolite étaient respectivement comprises entre 22,0 et 46,1 µM et 17,1 et 88,6 µM.
Les concentrations érythrocytaires en N-déséthylbrinzolamide étaient augmentées et l’activité de l’AC érythrocytaire totale était diminuée lorsque la clairance de la créatinine diminuait mais les concentrations érythrocytaires de brinzolamide et l’activité de l'AC-II restaient inchangées. Chez les sujets présentant l’insuffisance rénale la plus sévère, l’inhibition de l’activité de l’anhydrase carbonique totale était plus importante bien qu’inférieure à 90% à l’état d’équilibre.
Dans une étude utilisant la voie ophtalmique, à l’état d’équilibre, les concentrations érythrocytaires de brinzolamide étaient similaires à celles observées dans l’étude par voie orale, mais les concentrations du N-déséthylbrinzolamide étaient plus faibles. L'activité de l’anhydrase carbonique était environ 40 à 70% de sa valeur avant traitement.
5.3. Données de sécurité préclinique
Les données non cliniques issues des études conventionnelles de pharmacologie de sécurité, de toxicologie en administration répétée, de génotoxicité, de cancérogenèse n’ont pas révélé de risque particulier pour l’homme.
Des études de toxicité chez le lapin recevant des doses de brinzolamide allant jusqu’à 6 mg/kg/jour (125 fois la dose ophtalmique thérapeutique journalière recommandée) n’ont pas révélé d’effet sur le développement fœtal malgré une toxicité maternelle significative. Des études similaires chez le rat ont conduit à de légères réductions de l’ossification du crâne et des barres sternales des fœtus des mères recevant du brinzolamide aux doses de 18 mg/kg/jour (375 fois la dose humaine ophtalmique recommandée) ; ces réductions n’ont pas été observées à 6 mg/kg/jour. Ces résultats sont apparus à des doses entraînant des acidoses métaboliques avec diminution du gain de poids corporel des mères et diminution des poids fœtaux. Chez les petits de mères recevant du brinzolamide par voie orale, des diminutions dose-dépendantes des poids fœtaux ont été observées, allant d’une légère diminution (environ 5-6%) à la dose de 2 mg/kg/jour à près de 14% à la dose de 18 mg/kg/jour. Pendant l'allaitement, la dose sans effet sur la portée était de 5 mg/kg/jour.
4 semaines après la première ouverture.
6.4. Précautions particulières de conservation
Ce médicament ne nécessite pas de précautions particulières de conservation.
6.5. Nature et contenu de l'emballage extérieur
5 mL de suspension blanche homogène en flacon (polyéthylène basse densité) de 10 mL muni d’un compte-goutte (polyéthylène basse densité) et d’un bouchon à vis blanc inviolable en polypropylène ; boîte de 1 flacon ou 3 flacons ou 6 flacons.
Toutes les présentations peuvent ne pas être commercialisées.
6.6. Précautions particulières d’élimination et de manipulation
Pas d’exigences particulières pour l’élimination.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
15 BOULEVARD CHARLES DE GAULLE
92707 COLOMBES CEDEX
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· 34009 300 431 1 0 : 5 mL en flacon (PEBD), boîte de 1.
· 34009 550 157 8 9 : 5 mL en flacon (PEBD), boîte de 3.
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
[à compléter ultérieurement par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE
[à compléter ultérieurement par le titulaire]
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Liste I.
ANSM - Mis à jour le : 19/09/2022
BRINZOLAMIDE BIOGARAN 10 mg/mL, collyre en suspension
Brinzolamide
· Gardez cette notice. Vous pourriez avoir besoin de la relire.
· Si vous avez d’autres questions, interrogez votre médecin, votre pharmacien ou votre infirmier/ère.
· Ce médicament vous a été personnellement prescrit. Ne le donnez pas à d’autres personnes. Il pourrait leur être nocif, même si les signes de leur maladie sont identiques aux vôtres.
· Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin, votre pharmacien ou votre infirmier/ère. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
2. Quelles sont les informations à connaître avant d'utiliser BRINZOLAMIDE BIOGARAN 10 mg/ml, collyre en suspension ?
3. Comment utiliser BRINZOLAMIDE BIOGARAN 10 mg/ml, collyre en suspension ?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver BRINZOLAMIDE BIOGARAN 10 mg/ml, collyre en suspension ?
6. Contenu de l’emballage et autres informations.
1. QU’EST-CE QUE BRINZOLAMIDE BIOGARAN 10 mg/ml, collyre en suspension ET DANS QUELS CAS EST-IL UTILISE ?
Classe pharmacothérapeutique - code ATC : S01EC04.
BRINZOLAMIDE BIOGARAN contient du brinzolamide qui fait partie d’un groupe de médicaments appelé inhibiteurs de l’anhydrase carbonique. Il réduit la pression dans l’œil.
BRINZOLAMIDE BIOGARAN collyre est utilisé pour traiter une pression élevée à l’intérieur de l’œil. Cette pression peut conduire à une maladie appelée glaucome.
Si la pression dans l’œil est trop forte, cela peut endommager votre vue.
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT D’UTILISER BRINZOLAMIDE BIOGARAN 10 mg/ml, collyre en suspension ?
N’utilisez jamais BRINZOLAMIDE BIOGARAN 10 mg/ml, collyre en suspension :
· si vous avez des problèmes rénaux graves ;
· si vous êtes allergique au brinzolamide ou à l’un des autres composants contenus dans ce médicament, mentionnés dans la rubrique 6 ;
· si vous êtes allergique aux médicaments appelés sulfonamides, qui incluent par exemple des médicaments utilisés pour traiter le diabète et les infections, ainsi que des diurétiques, BRINZOLAMIDE BIOGARAN peut entraîner une allergie du même type ;
· si vous avez trop d’acidité dans votre sang (une maladie appelée acidose hyperchlorémique).
Si vous avez d’autres questions, demandez l’avis de votre médecin.
Avertissements et précautions
Adressez-vous à votre médecin, pharmacien ou votre infirmier/ère avant d’utiliser BRINZOLAMIDE BIOGARAN 10 mg/ml, collyre en suspension :
· si vous avez des problèmes rénaux ou hépatiques ;
· si vous avez les yeux secs ou des problèmes de cornée ;
· si vous prenez d’autres sulfonamides ;
· si vous avez une forme spécifique de glaucome pour laquelle la pression dans l’œil augmente à cause de dépôts qui bloquent l’écoulement de fluide vers l’extérieur (glaucome pseudoexfoliatif ou glaucome pigmentaire) ou une forme spécifique de glaucome pour laquelle la pression dans l’œil augmente (parfois rapidement) parce que l’œil devient protubérant et bloque l’écoulement de fluide vers l’extérieur (glaucome à angle fermé) ;
· si vous avez déjà développé une éruption cutanée sévère ou une desquamation de la peau, des cloques et/ou des lésions buccales suite à l’utilisation du brinzolamide ou d’autres médicaments apparentés.
Faites attention lors de l’utilisation du brinzolamide :
· des réactions cutanées graves, y compris le syndrome de Stevens-Johnson et la nécrolyse épidermique toxique, ont été rapportées en association avec le traitement par le brinzolamide. Arrêtez la prise de brinzolamide et consultez immédiatement un médecin si vous remarquez l’un des symptômes liés à ces réactions cutanées graves décrites dans la rubrique 4.
Enfants et adolescents
BRINZOLAMIDE BIOGARAN ne doit pas être utilisé chez les nourrissons, les enfants et les adolescents de moins de 18 ans, sauf recommandation de votre médecin.
Autres médicaments et BRINZOLAMIDE BIOGARAN 10 mg/ml, collyre en suspension
Informez votre médecin ou pharmacien si vous prenez, avez récemment pris ou pourriez prendre tout autre médicament.
Si vous prenez un autre inhibiteur de l’anhydrase carbonique (acétazolamide ou dorzolamide, voir rubrique 1 « Qu’est-ce que BRINZOLAMIDE BIOGARAN 10 mg/ml collyre en suspension et dans quels cas est-il utilisé ? »), parlez-en à votre médecin.
BRINZOLAMIDE BIOGARAN 10 mg/ml, collyre en suspension avec des aliments et boissons
Sans objet.
Grossesse, allaitement et fertilité
Si vous êtes enceinte ou que vous allaitez, que vous pensez être enceinte ou envisagez d’avoir un bébé, demandez conseil à votre médecin ou pharmacien avant d’utiliser ce médicament.
Il est conseillé aux femmes susceptibles d’être enceinte, d’utiliser une méthode contraceptive efficace pendant la durée du traitement par BRINZOLAMIDE BIOGARAN. L’utilisation de BRINZOLAMIDE BIOGARAN n’est pas recommandée pendant la grossesse ou l’allaitement. N’utilisez pas BRINZOLAMIDE BIOGARAN sauf si votre médecin vous l’a clairement indiqué.
Conduite de véhicules et utilisation de machines
Ne conduisez pas de véhicules et n’utilisez pas de machines avant que votre vision ne soit redevenue claire. Vous pouvez trouver que votre vision est trouble juste après avoir utilisé BRINZOLAMIDE BIOGARAN.
BRINZOLAMIDE BIOGARAN peut diminuer l’aptitude à réaliser des tâches nécessitant une vigilance mentale et/ou une coordination motrice. Si vous êtes concerné, faites attention lorsque vous conduisez un véhicule ou utilisez une machine.
BRINZOLAMIDE BIOGARAN 10 mg/ml collyre en suspension contient du chlorure de benzalkonium
Ce médicament contient approximativement 3,1 µg de chlorure de benzalkonium par goutte (= 1 dose), soit 0,1 mg par mL de suspension.
Le chlorure de benzalkonium peut être absorbé par les lentilles de contact souples et changer leur couleur. Retirer les lentilles de contact avant application et attendre au moins 15 minutes avant de les remettre.
Le chlorure de benzalkonium peut également provoquer une irritation des yeux, surtout si vous souffrez du syndrome de l’œil sec ou de troubles de la cornée (couche transparente à l’avant de l’œil). En cas de sensation anormale, de picotements ou de douleur dans les yeux après avoir utilisé ce médicament, contactez votre médecin.
3. COMMENT UTILISER BRINZOLAMIDE BIOGARAN 10 mg/ml, collyre en suspension ?
N’utilisez BRINZOLAMIDE BIOGARAN que dans les yeux. Ne pas l’avaler ou l’injecter.
Posologie
La dose recommandée est
· 1 goutte dans l’œil ou les yeux atteint(s), deux fois par jour, matin et soir.
Utilisez cette posologie à moins que votre médecin ne vous dise de faire différemment. N’utilisez BRINZOLAMIDE BIOGARAN dans les deux yeux que si votre médecin vous a dit de le faire. Prenez-le aussi longtemps que votre médecin vous l’a dit.
Mode d’administration
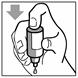

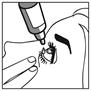
Figure 1 Figure 2 Figure 3
· Prenez le flacon de BRINZOLAMIDE BIOGARAN et un miroir.
· Lavez-vous les mains.
· Agitez le flacon et enlevez le capuchon. Après avoir retiré le capuchon, si la bague de sécurité est trop lâche, la retirer avant utilisation du produit.
· Tenez le flacon, tête en bas, entre le pouce et le majeur.
· Penchez la tête en arrière. Avec un doigt propre, tirez doucement votre paupière vers le bas pour créer un sillon entre la paupière et l’œil. La goutte sera déposée à cet endroit (figure 1).
· Rapprochez l’embout du flacon de votre œil. Utilisez le miroir pour vous aider.
· Ne touchez pas votre œil ou vos paupières, ou les surfaces voisines ou d’autres surfaces avec le compte-gouttes. Cela peut infecter le collyre.
· Appuyez légèrement sur la base du flacon pour libérer une goutte de BRINZOLAMIDE BIOGARAN à chaque fois.
· Ne comprimez pas le flacon : il est conçu pour qu’une légère pression sur la base suffise (figure 2).
· Après avoir utilisé BRINZOLAMIDE BIOGARAN, appuyez avec un doigt sur le coin de votre œil près du nez pendant au moins 1 minute (figure 3). Ceci permet d’empêcher la pénétration de BRINZOLAMIDE BIOGARAN dans le reste du corps.
· Recommencez ces étapes pour l’autre œil, si vous devez traiter les deux yeux.
· Refermez bien le flacon immédiatement après usage.
· Finissez d’utiliser un flacon avant d’en ouvrir un autre.
Si une goutte tombe à côté de votre œil, recommencez.
Si vous utilisez un autre collyre ou une autre pommade ophtalmique, attendez au moins 5 minutes entre chaque médicament. Les pommades ophtalmiques doivent être administrées en dernier.
Si vous avez utilisé plus de BRINZOLAMIDE BIOGARAN 10 mg/ml, collyre en suspension que vous n’auriez dû
Si vous avez mis trop de gouttes dans les yeux, rincez-les avec de l’eau tiède. Ne mettez pas d’autres gouttes sauf quand le moment est venu de prendre la dose suivante.
Si vous oubliez d’utiliser BRINZOLAMIDE BIOGARAN 10 mg/ml, collyre en suspension
Prenez une dose dès que possible, et reprenez ensuite la posologie habituelle. Ne prenez pas de dose double pour compenser la dose oubliée.
Si vous arrêtez d’utiliser BRINZOLAMIDE BIOGARAN 10 mg/ml, collyre en suspension
Si vous arrêtez d’utiliser BRINZOLAMIDE BIOGARAN sans en parler à votre médecin, la tension dans votre œil ne sera plus contrôlée ce qui pourrait entraîner la perte de la vue.
Si vous avez d’autres questions sur l’utilisation de ce médicament, demandez plus d’informations à votre médecin, à votre pharmacien ou à votre infirmier/ère.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
Arrêtez la prise de brinzolamide et adressez-vous immédiatement à votre médecin si vous observez l’un des symptômes suivants :
· plaques rougeâtres non surélevées, en forme de cible ou circulaires sur le tronc, souvent avec des cloques centrales, une desquamation de la peau, des aphtes de la bouche, de la gorge, du nez, des organes génitaux et des yeux. Ces éruptions cutanées graves peuvent être précédées de fièvre et de symptômes pseudo-grippaux (syndrome de Stevens-Johnson, nécrolyse épidermique toxique).
Les effets indésirables suivants ont été observés avec BRINZOLAMIDE BIOGARAN 10 mg/ml collyre en suspension :
Effets indésirables fréquents (pouvant affecter jusqu’à 1 personne sur 10)
· Effets oculaires : vision floue, irritation oculaire, douleur oculaire, écoulement oculaire, démangeaisons oculaires, œil sec, sensation anormale dans l’œil, rougeur oculaire.
· Effets indésirables généraux : mauvais goût dans la bouche.
Effets indésirables peu fréquents (pouvant affecter jusqu’à 1 personne sur 100)
· Effets oculaires : sensibilité à la lumière, inflammation ou infection de la conjonctive, gonflement de l’œil, démangeaisons, rougeurs ou gonflement de la paupière, dépôts dans l’œil, éblouissement, sensation de brûlure, excroissance sur la surface de l’œil, augmentation de la pigmentation de l’œil, fatigue oculaire, croûtes sur la paupière ou augmentation des larmes.
· Effets indésirables généraux : diminution de la fonction cardiaque, battements cardiaques forts qui peuvent être rapides ou irréguliers, diminution du rythme cardiaque, difficulté à respirer, essoufflement, toux, diminution du nombre de globules rouges dans le sang, augmentation du taux de chlorure dans le sang, vertiges, problèmes de mémoire, dépression, nervosité, désintérêt émotionnel, cauchemars, faiblesse généralisée, fatigue, mal-être, douleurs, troubles moteurs, diminution du désir sexuel, problèmes sexuels masculins, symptômes de rhume, encombrement des bronches, sinusite, irritation de la gorge, douleurs de la gorge, sensibilité anormale ou diminuée dans la bouche, inflammation de la paroi de l’œsophage, douleur abdominale, nausée, vomissements, maux d’estomac, selles fréquentes, diarrhée, gaz intestinaux, troubles digestifs, douleur rénale, douleur musculaire, spasmes musculaires, mal de dos, saignements de nez, nez qui coule, nez bouché, éternuements, éruption, sensation cutanée anormale, démangeaisons, peau lisse avec éruption cutanée ou rougeur couverte de protubérances, tiraillement de peau, mal de tête, bouche sèche, débris dans l’œil.
Effets indésirables rares (pouvant concerner jusqu’à 1 personne sur 1000)
· Effets oculaires : gonflement cornéen, vision diminuée ou double, vision anormale, flashs lumineux dans le champ de vision, diminution de la sensation oculaire, gonflement autour de l’œil, augmentation de la pression intra-oculaire, altération du nerf optique.
· Effets indésirables généraux : troubles de la mémoire, somnolence, douleur thoracique, congestion des voies respiratoires supérieures, congestion sinusale, congestion nasale, nez sec, bourdonnements dans les oreilles, perte de cheveux, démangeaison généralisée, sentiment de nervosité, irritabilité, rythme cardiaque irrégulier, faiblesse de l’organisme, difficulté pour dormir, respiration sifflante, démangeaisons liées à une éruption cutanée.
Effets indésirables de fréquence indéterminée (la fréquence ne peut pas être estimée sur la base des données disponibles)
· Effets oculaires : paupière anormale, trouble de la vision, troubles cornéens, allergie oculaire, diminution de la pousse ou du nombre de cils, rougeur de la paupière.
· Effets indésirables généraux : augmentation des symptômes allergiques, sensation diminuée, frisson, diminution ou perte du goût, diminution de la tension artérielle, augmentation de la tension artérielle, augmentation du rythme cardiaque, douleur articulaire, asthme, douleur des extrémités, rougeur de la peau, inflammation, ou démangeaison, examens sanguins hépatiques anormaux, gonflement des extrémités, mictions fréquentes, appétit diminué, sensation de malaise, plaques rougeâtres non surélevées, en forme de cible ou circulaires sur le tronc, souvent avec des cloques centrales, une desquamation de la peau, des aphtes de la bouche, de la gorge, du nez, des organes génitaux et des yeux et pouvant être précédées de fièvre et de symptômes pseudo-grippaux. Ces éruptions cutanées graves peuvent engager le pronostic vital (syndrome de Stevens-Johnson, nécrolyse épidermique toxique).
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin, votre pharmacien ou à votre infirmier/ère. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet: https://signalement.social-sante.gouv.fr
En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.
5. COMMENT CONSERVER BRINZOLAMIDE BIOGARAN 10 mg/ml, collyre en suspension ?
Tenir ce médicament hors de la vue et de la portée des enfants.
N’utilisez pas ce médicament après la date de péremption indiquée sur le flacon et l’emballage après {EXP}. La date de péremption fait référence au dernier jour de ce mois.
Ce médicament ne nécessite pas de précaution particulière de conservation.
Vous devez jeter un flacon quatre semaines après l’avoir ouvert pour la première fois, pour éviter les infections. Inscrivez la date à laquelle vous avez ouvert chaque flacon dans l’espace ci- dessous et dans l’espace prévu à cet effet sur l’étiquette du flacon et la boîte. Pour les étuis contenant un seul flacon, inscrivez seulement la date d’ouverture.
Ouvert le (1) :
Ouvert le (2) :
Ouvert le (3) :
Ouvert le (4) :
Ouvert le (5) :
Ouvert le (6) :
Ne jetez aucun médicament au tout-à-l’égout ou avec les ordures ménagères. Demandez à votre pharmacien d’éliminer les médicaments que vous n’utilisez plus. Ces mesures contribueront à protéger l’environnement.
6. CONTENU DE L’EMBALLAGE ET AUTRES INFORMATIONS
Ce que contient BRINZOLAMIDE BIOGARAN 10 mg/ml, collyre en suspension
· La substance active est :
Brinzolamide.................................................................................................................... 10 mg
Pour 1 mL de suspension
· Les autres composants sont : solution de chlorure de benzalkonium à 50%, mannitol (E421), carbomère 974 P, édétate disodique, chlorure de sodium, poloxamer 407 et eau pour préparations injectables. Des petites quantités d'hydroxyde de sodium sont ajoutées pour conserver des niveaux d'acidité (niveaux de pH) normaux.
BRINZOLAMIDE BIOGARAN est un liquide laiteux (une suspension) fourni dans une boîte contenant un ou trois flacons (récipient compte-goutte) en polyéthylène basse densité de 5 ml avec un bouchon à vis en polypropylène. Les conditionnements suivants sont disponibles : boite de 1x5mL ou 3x5mL ou 6x5mL.
Toutes les présentations peuvent ne pas être commercialisées.
Titulaire de l’autorisation de mise sur le marché
15, BOULEVARD CHARLES DE GAULLE
92707 COLOMBES CEDEX
Exploitant de l’autorisation de mise sur le marché
15, BOULEVARD CHARLES DE GAULLE
92707 COLOMBES CEDEX
DERVENAKION 6
15351 PALLINI - ATTIKI
GRECE
ou
FAMAR S.A.
PLANT A
63 AGIOU DIMITRIOU STREET
17456 ALIMOS
ATHENES
GRECE
ou
BALKANPHARMA-RAZGRAD AD
68 APRILSKO VASTANIE BLVD.
RAZGRAD, 7200
BULGARIE
Noms du médicament dans les Etats membres de l'Espace Economique Européen
Ce médicament est autorisé dans les Etats membres de l'Espace Economique Européen sous les noms suivants : Conformément à la réglementation en vigueur.
[À compléter ultérieurement par le titulaire]
La dernière date à laquelle cette notice a été révisée est :
[à compléter ultérieurement par le titulaire]
Des informations détaillées sur ce médicament sont disponibles sur le site Internet de l’ANSM (France).