Dernière mise à jour le 08/01/2026
FILIOP 40 microgrammes/mL + 5 mg/mL, collyre en solution
Indications thérapeutiques
Classe pharmacothérapeutique - code ATC : S01ED51
FILIOP collyre en solution est une association de deux substances actives (travoprost et timolol). Le travoprost est un analogue des prostaglandines qui agit en augmentant l’évacuation de liquide de l’œil, ce qui abaisse la pression dans l’œil. Le timolol est un bêtabloquant qui agit en réduisant la production de liquide à l'intérieur de l'œil. Les deux substances agissent ensemble pour réduire la pression à l'intérieur de l'œil.
FILIOP collyre est utilisé pour traiter une pression élevée dans l'œil chez les adultes, y compris chez les patients âgés. Cette pression élevée peut provoquer une maladie appelée « glaucome ».
FILIOP collyre en solution est une solution stérile sans conservateur.
Présentations
> 1 flacon(s) multidose(s) en polypropylène de 2,5 ml de collyre muni d'une pompe, d'un cylindre à pression et d'un capuchon
Code CIP : 34009 301 361 6 4
Déclaration de commercialisation : 23/04/2024
Cette présentation est agréée aux collectivités
- Prix hors honoraire de dispensation : 8,96 €
- Honoraire de dispensation : 1,02 €
- Prix honoraire compris : 9,98 €
- Taux de remboursement :65 %
> 3 flacon(s) multidose(s) en polypropylène de 2,5 ml de collyre muni d'une pompe, d'un cylindre à pression et d'un capuchon
Code CIP : 34009 301 857 4 2
Déclaration de commercialisation : 23/04/2024
Cette présentation est agréée aux collectivités
- Prix hors honoraire de dispensation : 25,42 €
- Honoraire de dispensation : 1,02 €
- Prix honoraire compris : 26,44 €
- Taux de remboursement :65 %
Service médical rendu (SMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprès de la HAS (plus d'informations dans l'aide). Les avis et synthèses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur du SMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| Important | Avis du 15/05/2019 | Inscription (CT) | Le service médical rendu par TRAVOPROST/TIMOLOL HORUS PHARMA 40 µg/ml + 5 µg/ml, collyre en solution est important dans l’indication de l’AMM. |
Amélioration du service médical rendu (ASMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprés de la HAS (plus d'informations dans l'aide). Les avis et synthéses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur de l'ASMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| V (Inexistant) | Avis du 15/05/2019 | Inscription (CT) | Les spécialités TRAVOPROST/TIMOLOL HORUS PHARMA 40 µg/ml + 5 µg/ml, collyre en solution n’apportent pas d’amélioration du service médical rendu (ASMR V) par rapport à DUOTRAV 40 µg/ml + 5 mg/ml, collyre en solution. |
ANSM - Mis à jour le : 17/03/2025
FILIOP 40 microgrammes/mL + 5 mg/mL, collyre en solution
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Chaque ml de solution contient 40 microgrammes de travoprost et 5 mg de timolol (sous la forme de maléate de timolol)
Excipient(s) à effet notoire: Chaque ml de solution contient 2 mg d’hydroxystéarate de macrogolglycérol 40 (voir rubrique 4.4).
Chaque ml de solution contient 7,5 mg de propylène glycol.
Pour la liste complète des excipients, voir rubrique 6.1.
Solution aqueuse, limpide et incolore, presque sans particules.
pH : 5,5-7,5
Osmolarité : 290 mOsm/kg ± 10% (261-319 mOsm/kg)
4.1. Indications thérapeutiques
4.2. Posologie et mode d'administration
Utilisation chez les adultes, y compris les patients âgés
La dose est d’une goutte de FILIOP dans le cul-de-sac conjonctival de l'œil/les yeux atteint(s) une fois par jour, à administrer le matin ou le soir. L’administration doit avoir lieu à la même heure chaque jour.
En cas d'oubli d’une dose, poursuivre le traitement en administrant la dose suivante au moment prévu. La dose administrée ne doit pas dépasser une goutte par jour dans l’œil/les yeux atteint(s).
Populations particulières
Insuffisance hépatique et rénale
Aucune étude n’a été réalisée chez les patients atteints d’insuffisance hépatique ou rénale avec le collyre en solution de travoprost/timolol 40 microgrammes/ml + 5 mg/ml ni avec le collyre de timolol 5 mg/ml.
Le travoprost a été étudié chez les patients atteints d’une insuffisance hépatique légère à sévère et chez les patients atteints d’une insuffisance rénale légère à sévère (clairance de la créatinine aussi faible que 14 ml/min). Il n’était pas nécessaire d’ajuster la dose chez ces patients.
Il est peu probable que les patients atteints d’insuffisance hépatique ou rénale nécessitent un ajustement de la dose de FILIOP (voir rubrique 5.2).
Population pédiatrique
La sécurité et l’efficacité du collyre en solution de travoprost/timolol 40 microgrammes/ml + 5 mg/ml chez les enfants et les adolescents âgés de moins de 18 ans n’ont pas été établies.
Aucune donnée n’est disponible.
Mode d’administration
Voie ophtalmique.
FILIOP collyre en solution est une solution stérile sans conservateur.
Donner aux patients l’instruction de se laver les mains avant l’utilisation et d’éviter de laisser l’extrémité du flacon entrer en contact avec l’œil ou les structures avoisinantes car cela pourrait causer des lésions de l’œil.
Informer également les patients que les solutions ophtalmiques qui ne seraient pas correctement manipulées peuvent être contaminées par des bactéries communes connues pour induire des infections oculaires. L’utilisation de solutions contaminées peut causer des lésions graves de l’œil et une perte de vision consécutive.
Afin d’éviter la contamination de l’embout compte-gouttes et de la solution, il faut veiller à ne pas toucher les paupières, les surfaces avoisinantes ou d’autres surfaces avec l’embout compte-gouttes du flacon.
L’occlusion lacrymonasale ou la fermeture des paupières pendant 2 minutes permet de réduire l'absorption systémique, ce qui peut donner lieu à une diminution des effets secondaires systémiques et à une augmentation de l’activité locale du collyre (voir rubrique 4.4).
Si l’on utilise plusieurs médicaments ophtalmiques à usage topique, respecter un intervalle d'au moins 5 minutes entre les administrations (voir rubrique 4.5).
En cas de remplacement d’un autre médicament ophtalmique contre le glaucome par FILIOP, interrompre le traitement par l’autre médicament et débuter l’administration de FILIOP le jour suivant.
Donner aux patients l’instruction d’enlever leurs lentilles de contact souples avant l’application de FILIOP et d’attendre 15 minutes après l’instillation de la dose avant de les remettre en place (voir rubrique 4.4).
· Hypersensibilité aux substances actives ou à l’un des excipients mentionnés à la rubrique 6.1.
· Hypersensibilité à d’autres bêtabloquants.
· Hyperréactivité bronchique, y compris asthme bronchique ou antécédents d’asthme bronchique et bronchopneumopathie chronique obstructive sévère.
· Bradycardie sinusale, maladie du sinus, bloc sino-auriculaire, bloc auriculoventriculaire du second ou troisième degré non maîtrisé par la présence d’un pacemaker. Insuffisance cardiaque manifeste, choc cardiogénique.
· Rhinite allergique sévère et dystrophies cornéennes.
4.4. Mises en garde spéciales et précautions d'emploi
Effets systémiques
Comme c’est le cas pour d’autres médicaments ophtalmiques à usage topique, le travoprost et le timolol sont absorbés au niveau systémique. En raison du composant bêta-adrénergique, le timolol, les mêmes types d’effets indésirables cardiovasculaires, pulmonaires et autres que ceux observés avec les bêtabloquants systémiques, peuvent survenir. L’incidence des effets indésirables systémiques est plus faible après une administration ophtalmique topique qu’en cas d'administration systémique. Pour réduire l'absorption systémique, voir rubrique 4.2.
Affections cardiaques
Les patients ayant des maladies cardiovasculaires (p. ex. cardiopathie ischémique, angor de Prinzmetal et insuffisance cardiaque) et une hypotension, le traitement par bêtabloquants doit faire l’objet d’une évaluation soigneuse et le traitement par d'autres substances actives doit être envisagé. Les patients atteints de maladies cardiovasculaires doivent être surveillés en vue de détecter les signes éventuels d’effets indésirables et d’aggravation de ces maladies.
En raison de leur effet négatif sur le temps de conduction, les bêtabloquants ne doivent être administrés qu’avec prudence aux patients ayant un bloc cardiaque du premier degré.
Affections vasculaires
Les patients atteints de troubles/d’affections sévères de la circulation périphérique (p. ex. formes sévères de la maladie de Raynaud ou du syndrome de Raynaud) doivent être traités avec prudence.
Affections respiratoires
Des réactions respiratoires, y compris des décès secondaires à un bronchospasme chez des patients asthmatiques, ont été signalées après l’administration de certains bêtabloquants ophtalmiques.
FILIOP doit s’utiliser avec prudence chez les patients atteints d’une bronchopneumopathie chronique obstructive (BPCO) légère/modérée et uniquement si les bénéfices potentiels sont supérieurs aux risques potentiels.
Hypoglycémie/diabète
Les bêtabloquants doivent s’administrer avec prudence chez les patients sujets à l’hypoglycémie spontanée et chez les patients ayant un diabète instable car les bêtabloquants peuvent masquer les signes et symptômes d’une hypoglycémie aiguë.
Faiblesse musculaire
On a signalé que les médicaments bêtabloquants renforcent la faiblesse musculaire associée à certains symptômes de myasthénie (p. ex. diplopie, ptosis et faiblesse généralisée).
Maladies de la cornée
Les bêtabloquants ophtalmiques peuvent induire une sécheresse oculaire. Les patients atteints de maladies de la cornée doivent être traités avec prudence.
Décollement de la choroïde
Un décollement de la choroïde a été signalé au cours de l’administration d'un traitement réduisant la sécrétion d'humeur aqueuse (p. ex. timolol, acétazolamide) après une chirurgie de filtration.
Autres bêtabloquants
L'effet sur la pression intraoculaire ou les effets bêtabloquants systémiques connus peuvent être renforcés lorsqu’on administre le timolol à des patients recevant déjà un bêtabloquant systémique. La réponse de ces patients doit être étroitement surveillée. L'utilisation de deux bêtabloquants à usage topique n'est pas recommandée (voir rubrique 4.5).
Anesthésie chirurgicale
Les préparations ophtalmologiques à base de bêtabloquants peuvent bloquer les effets bêta-agonistes systémiques, p. ex. de l'adrénaline. L'anesthésiste doit être informé que le patient reçoit un traitement par timolol.
Hyperthyroïdie
Les bêtabloquants peuvent masquer les signes d’hyperthyroïdie.
Contact cutané
Les prostaglandines et les analogues des prostaglandines sont des substances biologiquement actives pouvant être absorbées par la peau. Les femmes enceintes ou souhaitant tomber enceintes doivent prendre les précautions adéquates pour éviter une exposition directe au contenu du flacon. En cas de contact accidentel avec une grande quantité du contenu du flacon, laver immédiatement et soigneusement la zone exposée.
Réactions anaphylactiques
Pendant le traitement par bêtabloquants, les patients ayant des antécédents d’atopie ou de réaction anaphylactique sévère à divers allergènes peuvent être plus sensibles à des expositions répétées à ces allergènes. Il est également possible que ces patients ne répondent pas à la dose habituelle d’adrénaline utilisée pour traiter les réactions anaphylactiques.
Traitement concomitant
Le timolol peut présenter des interactions avec d’autres médicaments (voir rubrique 4.5).
L'utilisation de deux prostaglandines à usage local n'est pas recommandée.
Effets oculaires
Le travoprost peut modifier progressivement la couleur des yeux en augmentant le nombre de mélanosomes (granules pigmentaires) dans les mélanocytes. Avant d’instaurer le traitement, informer les patients sur la possibilité de modification permanente de la coloration de l’œil. Un traitement unilatéral peut donner lieu à une hétérochromie permanente. À l’heure actuelle, les effets à long terme sur les mélanocytes et leurs conséquences ne sont pas connus. Les modifications de la coloration de l’iris apparaissent lentement et peuvent passer inaperçues pendant des mois, voire des années. La modification de la couleur des yeux a été principalement observée chez des patients ayant des iris de couleur mixte, c.-à-d. bleu-marron, gris-marron, jaune-marron et vert-marron, mais elle a également été observée chez des patients ayant les yeux marrons. De manière typique, au niveau des yeux atteints, la pigmentation brune entourant la pupille s’étend de manière concentrique vers la périphérie mais l’iris peut devenir, en partie ou en totalité, brun plus foncé. Après l’arrêt du traitement, aucune augmentation supplémentaire de la pigmentation brune de l’iris n’a été observée.
Au cours d’études cliniques contrôlées, un assombrissement de la peau périorbitaire et/ou palpébrale a été associé à l’utilisation de travoprost.
Des modifications périorbitaires et palpébrales, notamment un enfoncement du sillon palpébral, ont été observées avec les analogues des prostaglandines.
Le travoprost peut modifier progressivement les cils de l’œil/des yeux traité(s) ; ces modifications ont été observées chez environ la moitié des patients au cours d’études cliniques et sont notamment : augmentation de la longueur, de l’épaisseur, de la pigmentation et/ou du nombre de cils. Le mécanisme des modifications des cils et leurs conséquences à long terme sont actuellement inconnus.
Des études réalisées chez le singe ont révélé que le travoprost induit un léger élargissement de la fente palpébrale. Cependant, cet effet n’a pas été observé pendant les études cliniques et est considéré comme étant spécifique à l’espèce.
Il n’existe aucune expérience sur l’utilisation du collyre en solution de travoprost/timolol 40 microgrammes/ml + 5 mg/ml au cours d’affections oculaires inflammatoires ou au cours des glaucomes néovasculaires, à angle étroit, à angle fermé ou congénitaux. On ne dispose que d’une expérience limitée concernant l’utilisation de ce collyre au cours de maladies oculaires d’origine thyroïdienne, de glaucome à angle ouvert chez les patients pseudophaques et de glaucome pigmentaire ou pseudo-exfoliatif.
Un œdème maculaire a été signalé pendant le traitement par des analogues de la prostaglandine F2α. Il est recommandé d’être prudent lorsqu’on utilise FILIOP chez les patients aphaques, chez les patients pseudophaques présentant une rupture capsulaire postérieure ou portant un implant de chambre antérieure, ou chez les patients présentant des facteurs de risque connus d’œdème maculaire cystoïde.
FILIOP peut s’utiliser avec prudence chez les patients présentant des facteurs de risques connus prédisposant à l’iritis/l’uvétite et chez les patients ayant une inflammation intraoculaire active.
Excipients
FILIOP contient de l’hydroxystéarate de macrogolglycérol 40, qui peut causer des réactions cutanées.
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
Aucune étude d’interaction spécifique n’a été réalisée avec le travoprost ou le timolol.
Il existe un risque d’effets additifs donnant lieu à une hypotension et/ou une bradycardie marquée lorsqu’on administre simultanément une solution ophtalmique de bêtabloquants et un traitement oral par antagonistes du calcium, bêtabloquants, antiarythmiques (notamment l’amiodarone), glycosides digitaliques, parasympathomimétiques, guanéthidine.
La réaction hypertensive résultant de l’arrêt brutal du traitement par clonidine peut être renforcée en cas d'administration de bêtabloquants.
Un renforcement des effets bêtabloquants systémiques (p. ex. réduction de la fréquence cardiaque, dépression) a été rapporté pendant un traitement combiné par timolol et des inhibiteurs du CYP2D6 (p. ex. quinidine, fluoxétine, paroxétine).
Une mydriase résultant de l’utilisation concomitante de bêtabloquants ophtalmiques et d'adrénaline (épinéphrine) a été occasionnellement signalée.
Les bêtabloquants peuvent renforcer l'effet hypoglycémiant des médicaments antidiabétiques.
Les bêtabloquants peuvent masquer les signes et symptômes d'hypoglycémie (voir rubrique 4.4).
4.6. Fertilité, grossesse et allaitement
Femmes en âge de procréer/contraception
FILIOP ne doit pas être utilisé chez les femmes susceptibles de tomber enceintes sauf si une contraception adéquate est mise en place (voir rubrique 5.3).
Grossesse
Le travoprost a des effets pharmacologiques nocifs sur la grossesse et/ou le fœtus/nouveau-né.
Il n’existe pas de données ou il existe des données limitées sur l’utilisation du collyre en solution de travoprost/timolol 40 microgrammes/ml + 5 mg/ml ou sur l’utilisation des composés individuels chez les femmes enceintes. Le timolol ne doit pas être utilisé pendant la grossesse sauf en cas de nécessité absolue.
Des études épidémiologiques n’ont révélé aucun effet malformatif mais ont mis en évidence un risque de retard de la croissance intra-utérine lorsque les bêtabloquants sont administrés par voie orale. De plus, des signes et symptômes d’effets bêtabloquants (p. ex. bradycardie, hypotension, détresse respiratoire et hypoglycémie) ont été observés chez le nouveau-né lorsque les bêtabloquants avaient été administrés jusqu’à l’accouchement. Si l’on administre FILIOP jusqu’à l’accouchement, le nouveau-né doit faire l’objet d’une surveillance attentive pendant les premiers jours de sa vie.
FILIOP ne doit pas être utilisé pendant la grossesse sauf en cas de nécessité absolue. Pour réduire l'absorption systémique, voir rubrique 4.2.
Allaitement
On ne sait pas si le travoprost provenant du collyre est excrété dans le lait maternel humain. Des études réalisées chez l’animal ont révélé une excrétion du travoprost et de ses métabolites dans le lait. Le timolol est excrété dans le lait maternel et a le potentiel d’induire des réactions indésirables graves chez le nourrisson allaité. Cependant, aux doses thérapeutiques du timolol en collyre, il est peu probable que des quantités suffisamment importantes soient présentes dans le lait maternel pour induire des symptômes cliniques de blocage bêta-adrénergique chez le nourrisson. Pour réduire l'absorption systémique, voir rubrique 4.2.
L’utilisation de FILIOP n’est pas recommandée chez les femmes qui allaitent.
Fertilité
Il n’existe aucune donnée sur les effets du collyre en solution de travoprost/timolol 40 microgrammes/ml + 5 mg/ml sur la fertilité de l’être humain. Des études réalisées chez l’animal n’ont mis en évidence aucun effet du travoprost ou du timolol sur la fertilité à des doses plus de 250 fois supérieures à la dose oculaire maximale recommandée chez l’être humain.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
FILIOP n’a aucun effet ou qu’un effet négligeable sur l’aptitude à conduire des véhicules et à utiliser des machines.
Comme c’est le cas avec tout collyre, une vision trouble transitoire ou d’autres troubles visuels peuvent survenir. Si une vision trouble apparaît au cours de l'instillation, le patient doit attendre que sa vision redevienne normale avant de conduire un véhicule ou d'utiliser des machines.
FILIOP peut également provoquer des hallucinations, un étourdissement, une nervosité et/ou une fatigue (voir rubrique 4.8), ce qui peut affecter la capacité à conduire et à utiliser des machines. Les patients doivent être avertis de ne pas conduire de véhicules ni d’utiliser de machines si ces symptômes apparaissent.
Résumé du profil de sécurité
Au cours d’études cliniques réalisées chez 2 170 patients traités par le collyre en solution de travoprost/timolol 40 microgrammes/ml + 5 mg/ml, l’effet indésirable lié au traitement le plus fréquemment signalé était une hyperémie oculaire (12,0 %).
Tableau des effets indésirables
Les effets indésirables suivants mentionnés dans le tableau ci-dessous ont été observés au cours d’études cliniques ou après la commercialisation du médicament. Ils sont classés par classe de systèmes d’organes et par fréquence selon la convention suivante: très fréquent (≥ 1/10), fréquent (≥ 1/100, < 1/10), peu fréquent (≥ 1/1 000, < 1/100), rare (≥ 1/10 000, < 1/1 000), très rare (< 1/10 000) ou fréquence indéterminée (ne peut être estimée sur la base des données disponibles). Au sein de chaque groupe de fréquence, les effets indésirables sont présentés suivant un ordre décroissant de gravité.
|
Classe de systèmes d’organes |
Fréquence |
Effets indésirables |
|
Affections du système immunitaire |
Peu fréquent |
hypersensibilité. |
|
Affections psychiatriques |
Rare |
nervosité. |
|
Fréquence indéterminée |
Hallucinations*, dépression. |
|
|
Affections du système nerveux |
Peu fréquent |
étourdissements, céphalées. |
|
Fréquence indéterminée |
accident vasculaire cérébral, syncope, paresthésies. |
|
|
Affections oculaires |
Très fréquent |
hyperhémie oculaire. |
|
Fréquent |
kératite ponctuée, douleur oculaire, troubles visuels, vision floue, sécheresse oculaire, prurit oculaire, gêne oculaire, irritation oculaire. |
|
|
Peu fréquent |
kératite, iritis, conjonctivite, inflammation de la chambre antérieure, blépharite, photophobie, réduction de l’acuité visuelle, asthénopie, gonflement oculaire, augmentation de la sécrétion lacrymale, érythème des paupières, croissance des cils, allergie oculaire, œdème conjonctival, œdème des paupières. |
|
|
Rare |
érosion cornéenne, meibomite, hémorragie conjonctivale, présence de croûtes sur le bord de la paupière, trichiasis, distichiasis. |
|
|
Fréquence indéterminée |
œdème maculaire, ptosis des paupières, approfondissement du sillon palpébral, hyperpigmentation de l’iris, affection cornéenne. |
|
|
Affections cardiaques |
Peu fréquent |
bradycardie. |
|
Rare |
arythmies, rythme cardiaque irrégulier |
|
|
Fréquence indéterminée |
insuffisance cardiaque, tachycardie, douleur thoracique, palpitations. |
|
|
Affections vasculaires |
Peu fréquent |
hypertension, hypotension. |
|
Fréquence indéterminée |
œdème périphérique |
|
|
Affections respiratoires, thoraciques et médiastinales |
Peu fréquent |
dyspnée, écoulement postnasal. |
|
Rare |
dysphonie, bronchospasme, toux, irritation de la gorge, douleur oropharyngée, inconfort nasal |
|
|
Fréquence indéterminée |
asthme. |
|
|
Affections gastro-intestinales |
Fréquence indéterminée |
dysgueusie. |
|
Affections hépatobiliaires |
Rare |
augmentation des taux d’alanine aminotransférase, augmentation des taux d’aspartate aminotransférase. |
|
Affections de la peau et du tissu sous-cutané |
Peu fréquent |
dermatite de contact, hypertrichose, hyperpigmentation cutanée (péri-oculaire). |
|
Rare |
urticaire, coloration anormale de la peau, alopécie, |
|
|
Fréquence indéterminée |
éruption cutanée. |
|
|
Affections musculo-squelettiques et systémiques |
Rare |
douleur dans les extrémités. |
|
Affections du rein et des voies urinaires |
Rare |
chromaturie. |
|
Troubles généraux et anomalies au site d'administration |
Rare |
soif, fatigue. |
*Effets indésirables observés avec timolol
Effets indésirables supplémentaires ayant été observés avec l’une des substances actives et pouvant potentiellement survenir avec FILIOP:
Travoprost
|
Classe de systèmes d’organes |
Effets indésirables |
|
Affections du système immunitaire |
Allergie saisonnière. |
|
Affections psychiatriques |
Anxiété, insomnie. |
|
Affections oculaires |
uvéite, follicules conjonctivaux, écoulement oculaire, œdème périorbitaire, prurit des paupières, ectropion, cataracte, iridocyclite, herpès simplex ophtalmique, inflammation oculaire, photopsie, eczéma des paupières, halo visuel, hypoesthésie oculaire, pigmentation de la chambre antérieure, mydriase, hyperpigmentation des cils, épaississement des cils, trouble du champ visuel. |
|
Affections de l’oreille et du labyrinthe |
Vertiges, acouphènes. |
|
Affections vasculaires |
Diminution de la pression artérielle diastolique, augmentation de la pression artérielle systolique. |
|
Affections respiratoires, thoraciques et médiastinales |
Asthme aggravé, rhinite allergique, épistaxis, troubles respiratoires, encombrement nasal, sécheresse nasale. |
|
Affections gastro-intestinales |
Ulcère gastro-duodénal réactivé, troubles gastro-intestinaux, diarrhée, constipation, bouche sèche, douleurs abdominales, nausées, vomissements. |
|
Affections de la peau et du tissu sous-cutané |
exfoliation cutanée, texture anormale des cheveux, dermatite allergique, modification de la couleur des cheveux, madarose, prurit, croissance anormale des cheveux, érythème. |
|
Affections musculo-squelettiques et systémiques |
Douleur musculo-squelettique, arthralgie. |
|
Affections du rein et des voies urinaires |
Dysurie, incontinence urinaire. |
|
Troubles généraux et anomalie au site d'administration |
Asthénie. |
|
Investigations |
Augmentation de l’antigène spécifique de la prostate |
Timolol
Comme c'est le cas avec d'autres médicaments ophtalmiques à usage topique, le timolol est absorbé dans la circulation systémique. Cette absorption de timolol peut causer des effets indésirables similaires à ceux observés avec les bêtabloquants systémiques. D’autres effets indésirables sont notamment les réactions observées au sein de la classe des bêtabloquants ophtalmiques. L’incidence des effets indésirables systémiques est plus faible après une administration ophtalmique topique qu’après une administration systémique. Pour réduire l'absorption systémique, voir rubrique 4.2.
|
Classe de systèmes d’organes |
Effets indésirables |
|
Affections du système immunitaire |
Réactions allergiques systémiques, notamment angio-œdème, urticaire, éruption cutanée localisée et généralisée, prurit, anaphylaxie. |
|
Troubles du métabolisme et de la nutrition |
Hypoglycémie. |
|
Affections psychiatriques |
Hallucinations, Insomnie, cauchemars, perte de mémoire. |
|
Affections du système nerveux |
Ischémie cérébrale, augmentation des signes et symptômes de myasthénie grave. |
|
Affections oculaires |
Signes et symptômes d’irritation oculaire (p. ex. brûlure, picotements, démangeaisons, larmoiement, rougeur), décollement de la choroïde après une chirurgie de filtration (voir rubrique 4.4), diminution de la sensibilité cornéenne, diplopie. |
|
Affections cardiaques |
œdème, insuffisance cardiaque congestive, bloc auriculoventriculaire, arrêt cardiaque. |
|
Affections vasculaires |
Phénomène de Raynaud, froideur des mains et des pieds. |
|
|
|
|
Affections gastro-intestinales |
Dysgueusie, nausées, dyspepsie, diarrhée, sécheresse buccale, douleur abdominale, vomissements. |
|
Affections de la peau et du tissu sous-cutané |
Éruption cutanée de type psoriasis ou exacerbation d’un psoriasis. |
|
Affections musculo-squelettiques et systémiques |
Myalgies. |
|
Affections des organes de reproduction et du sein |
Dysfonction sexuelle, diminution de la libido. |
|
Troubles généraux et anomalies au site d'administration |
Asthénie. |
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet :https://signalement.social-sante.gouv.fr.
Un surdosage de FILIOP par voie topique a peu de chance de survenir ou d’être associé à une toxicité.
En cas d’ingestion accidentelle, les symptômes d’un surdosage de bêtabloquants peuvent inclure une bradycardie, une hypotension, un bronchospasme et une insuffisance cardiaque.
En cas de surdosage avec FILIOP, le traitement doit être symptomatique et de soutien. Le timolol ne s’élimine pas facilement par dialyse.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Classe pharmacothérapeutique : Produits ophtalmologiques ; Préparations contre le glaucome et myotiques, code ATC : S01ED51.
Mécanisme d’action
FILIOP contient deux substances actives : le travoprost et le maléate de timolol. Grâce à des mécanismes d’action complémentaires, ces deux composants abaissent la pression intraoculaire (PIO) et leur effet combiné résulte en une réduction de la PIO plus élevée que celle induite par l’un ou l’autre composé administré seul.
Le travoprost, un analogue de la prostaglandine F2α, est un agoniste complet hautement sélectif ayant une affinité élevée pour le récepteur FP des prostaglandines. Il réduit la pression intraoculaire en augmentant l'écoulement de l'humeur aqueuse à travers le réseau trabéculaire et en améliorant l'écoulement uvéoscléral. Chez l’être humain, la réduction de la PIO débute environ 2 heures après l’administration et l’effet maximal est atteint après 12 heures. L’administration d’une dose unique permet d’obtenir un abaissement significatif de la pression intraoculaire pouvant se maintenir pendant une durée supérieure à 24 heures.
Le timolol est un agent non sélectif bloquant les récepteurs adrénergiques qui n’exerce aucune activité sympathomimétique intrinsèque, aucune action dépressive directe sur le myocarde ni aucune activité stabilisatrice des membranes. Des études réalisées par tonographie et fluorophotométrie chez l'être humain indiquent que son action prédominante est liée à une réduction de la formation d’humeur aqueuse et à une légère augmentation de son écoulement.
Pharmacologie secondaire
Chez le lapin, le travoprost a induit une augmentation significative du flux sanguin de la tête du nerf optique après 7 jours d’administration topique oculaire (1,4 microgrammes, une fois par jour).
Effets pharmacodynamiques
Effets cliniques
Au cours d’une étude clinique contrôlée de douze mois réalisée chez des patients ayant un glaucome à angle ouvert ou une hypertension oculaire et présentant une PIO moyenne initiale de 25 à 27 mmHg, l’abaissement de la PIO moyenne obtenu avec le collyre en solution de travoprost/timolol 40 microgrammes/ml + 5 mg/ml, administré une fois par jour le matin, était de 8 à 10 mmHg.
La non‑infériorité du collyre en solution de travoprost/timolol 40 microgrammes/ml + 5 mg/ml par rapport à l’association latanoprost 50 microgrammes/ml + timolol 5 mg/ml en termes d’abaissement de la PIO moyenne, a été démontrée pour tous les points temporels et à toutes les visites.
Au cours d’une étude clinique contrôlée de trois mois réalisée chez des patients ayant un glaucome à angle ouvert ou une hypertension oculaire et présentant une PIO moyenne initiale de 27 à 30 mmHg, l’abaissement de la PIO moyenne obtenu avec le collyre en solution de travoprost/timolol 40 microgrammes/ml + 5 mg/ml, administré une fois par jour le matin, était de 9 à 12 mmHg et était jusqu’à 2 mmHg plus élevé que celui obtenu avec le travoprost 40 microgrammes/ml, administré une fois le soir, et jusqu’à 2 à 3 mmHg plus élevé que celui obtenu avec le timolol 5 mg/ml administré deux fois par jour. La réduction de la PIO moyenne matinale (mesurée à 8 heures du matin, 24 heures après l’administration de la dernière dose du collyre en solution de travoprost/timolol 40 microgrammes/ml + 5 mg/ml) était statistiquement supérieure à celle obtenue avec le travoprost à toutes les visites pendant toute la durée de l’étude.
Au cours de deux études cliniques contrôlées de trois mois réalisées chez des patients ayant un glaucome à angle ouvert ou une hypertension oculaire et présentant une PIO moyenne initiale de 23 à 26 mmHg, l’abaissement de la PIO moyenne obtenu avec le collyre en solution de travoprost/timolol 40 microgrammes/ml + 5 mg/ml, administré une fois par jour le matin, était de 7 à 9 mmHg. Les réductions de la PIO moyenne étaient non inférieures, même si numériquement plus faibles, à celles obtenues en cas de traitement concomitant par travoprost 40 microgrammes/ml, administré une fois par jour le soir, et timolol 5 mg/ml, administré une fois par jour le matin.
Au cours d’une étude clinique contrôlée de 6 semaines réalisée chez des patients ayant un glaucome à angle ouvert ou une hypertension oculaire et présentant une PIO moyenne initiale de 24 à 26 mmHg, l’abaissement de la PIO moyenne obtenu avec le collyre en solution de travoprost/timolol 40 microgrammes/ml + 5 mg/ml (conservé avec du polyquaternium-1), administré une fois par jour le matin, était de 8 mmHg et équivalent à celui obtenu avec le collyre en solution de travoprost/timolol 40 microgrammes/ml + 5 mg/ml (conservé avec du chlorure de benzalkonium).
Les critères d’inclusion étaient communs à toutes les études cliniques, à l’exception du critère de PIO initiale et de la réponse à un traitement antérieur de PIO. Le développement clinique du collyre en solution de travoprost/timolol 40 microgrammes/ml + 5 mg/ml a inclus des patients naïfs de traitement et des patients sous traitement. La réponse insuffisante à une monothérapie ne constituait pas un critère d’inclusion.
Les données existantes indiquent que l’administration le soir pourrait avoir certains avantages sur l’abaissement de la PIO moyenne. Le choix du moment de l’administration (soit le matin ou le soir) doit tenir compte de la préférence du patient et de sa probabilité d’observance du traitement.
5.2. Propriétés pharmacocinétiques
Absorption
Le travoprost et le timolol sont absorbés à travers la cornée. Le travoprost est un promédicament qui subit une hydrolyse rapide par les estérases de la cornée en acide libre actif. Après l’administration uniquotidienne du collyre en solution de travoprost/timolol 40 microgrammes/ml + 5 mg/ml conservé au PQ chez des volontaires sains (N=22) pendant 5 jours, la quantité de l'acide libre travoprost n'était pas mesurable dans les échantillons de plasma chez la majorité des sujets (94,4%) et n'était généralement pas détectable une heure après l'administration. Lorsqu’elles étaient mesurables (≥0,01 ng/ml, la limite de quantification), les concentrations étaient comprises entre 0,01 et 0,03 ng/ml. Après l’administration uniquotidienne du collyre en solution de travoprost/timolol 40 microgrammes/ml + 5 mg/ml, la valeur moyenne de Cmax du timolol à l’état d’équilibre était de 1,34 ng/ml et la valeur de Tmax était d’environ 0,69 heures.
Distribution
Les taux d'acide libre travoprost peuvent être mesurés dans l'humeur aqueuse pendant les premières heures qui suivent l’administration chez l’animal et dans le plasma humain pendant seulement la première heure suivant l’administration ophtalmique du collyre en solution de travoprost/timolol 40 microgrammes/ml + 5 mg/ml. Chez l’être humain, les taux de timolol peuvent être mesurés dans l'humeur aqueuse après l’administration ophtalmique de timolol et dans le plasma pendant maximum les 12 heures suivant l’administration ophtalmique du collyre en solution de travoprost/timolol 40 microgrammes/ml + 5 mg/ml.
Biotransformation
Le métabolisme est la principale voie d’élimination du travoprost et de l’acide libre actif. Les voies métaboliques systémiques sont parallèles à celles de la prostaglandine F2α endogène, et consistent en une réduction de la double liaison 13-14, en une oxydation de la fonction 15-hydroxyle et en un clivage b-oxydatif de la partie supérieure de la chaine.
Le métabolisme du timolol s’effectue par 2 voies. Une voie produit une chaîne latérale éthanolamine sur le cycle thiadiazole et l'autre voie fournit une chaine latérale éthanolique sur l'azote morpholine et une deuxième chaine latérale similaire, avec un groupe carbonyle adjacent à l'azote. La demi‑vie plasmatique (t1/2) du timolol est de 4 heures après l’administration ophtalmique du collyre en solution de travoprost/timolol 40 microgrammes/ml + 5 mg/ml.
Élimination
L'acide libre travoprost et ses métabolites sont principalement excrétés par les reins. Moins de 2% d'une dose de travoprost administrée par voie ophtalmique ont été retrouvés dans l’urine sous forme d'acide libre. Le timolol et ses métabolites sont principalement excrétés par les reins. Environ 20% d'une dose de timolol sont excrétés dans l'urine sous forme inchangée et le reste est excrété dans l'urine sous forme de métabolites.
5.3. Données de sécurité préclinique
Le collyre en solution de travoprost/timolol 40 microgrammes/ml + 5 mg/ml conservé avec le polyquaternium-1, a induit une toxicité minimale au niveau de la surface oculaire, par comparaison à des collyres conservés avec du chlorure de benzalkonium, au cours de l’application sur des cellules cornéennes humaines ou après une administration ophtalmique topique chez le lapin.
Travoprost
Chez le singe, l’administration ophtalmique topique de travoprost à des concentrations allant jusqu'à 0,012 % dans l'œil droit, deux fois par jour pendant un an, n'a induit aucune toxicité systémique.
Des études de toxicité de reproduction réalisées avec le travoprost administré par voie systémique ont été réalisées chez le rat, la souris et le lapin. Les résultats sont liés à l’activité agoniste du récepteur FP de l’utérus, qui se manifeste par une létalité embryonnaire précoce, une perte post-implantation et une toxicité fœtale. Chez la rate gravide, l’administration systémique de travoprost à des doses plus de 200 fois supérieures à la dose thérapeutique pendant la phase d’organogenèse, a induit une augmentation de l’incidence des malformations.
Après l’administration de 3H-travoprost à des rates gravides, de faibles taux de radioactivité ont été mesurés dans le liquide amniotique et les tissus fœtaux. Des études de reproduction et de développement ont démontré l’existence d’un puissant effet abortif, avec l’observation de taux élevés chez le rat et la souris (taux plasmatiques de respectivement 180 pg/ml et 30 pg/ml), à des expositions 1,2 à 6 fois supérieures à l’exposition clinique (jusqu’à 25 pg/ml).
Timolol
Les données non cliniques issues des études conventionnelles de pharmacologie de sécurité, toxicologie en administration répétée, génotoxicité et cancérogénèse, n’ont pas révélé de risque particulier pour l’homme avec le timolol. Des études de toxicité sur les fonctions de reproduction réalisées avec le timolol ont mis en évidence un retard d’ossification fœtale sans effet indésirable sur le développement postnatal chez le rat (7 000 fois la dose thérapeutique) et une augmentation des résorptions fœtales chez le lapin (14 000 fois la dose thérapeutique).
Hydroxystéarate de macrogolglycérol (valeur nominale : 40), chlorure de sodium, propylène glycol (E1520), acide borique, mannitol (E421), hydroxyde de sodium (pour ajustement du pH), eau purifiée.
FILIOP collyre en solution ne doit pas être utilisé pendant plus de 28 jours après la première ouverture du flacon multidose.
6.4. Précautions particulières de conservation
A conserver à une température ne dépassant pas 25°C.
6.5. Nature et contenu de l'emballage extérieur
Flacon multidose blanc (PP) d’une contenance de 5 ml, muni d’une pompe (PP, PEHD, PEBD), d’un cylindre à pression et d’un capuchon (PEHD), contenant 2,5 ml de solution ophtalmique et emballé dans une boîte en carton.
Les présentations suivantes du produit sont disponibles :
Boîtes contenant 1 ou 3 flacons.
Toutes les présentations peuvent ne pas être commercialisées
6.6. Précautions particulières d’élimination et de manipulation
Pas d’exigences particulières
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
INEDI 5
06200 NICE
FRANCE
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· 34009 301 857 4 2 : 2,5 mL de collyre en flacon multidose (PP) de 5 mL, muni d’une pompe, d’un cylindre à pression et d’un capuchon. Boîte de 3.
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
[à compléter ultérieurement par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE
[à compléter ultérieurement par le titulaire]
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Liste I
ANSM - Mis à jour le : 17/03/2025
FILIOP 40 microgrammes/mL + 5 mg/mL, collyre en solution
Travoprost/timolol
· Gardez cette notice. Vous pourriez avoir besoin de la relire.
· Si vous avez d’autres questions, interrogez votre médecin ou votre pharmacien.
· Ce médicament vous a été personnellement prescrit. Ne le donnez pas à d’autres personnes. Il pourrait leur être nocif, même si les signes de leur maladie sont identiques aux vôtres.
· Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin, ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
2. Quelles sont les informations à connaître avant d’utiliser FILIOP 40 microgrammes/mL + 5 mg/mL, collyre en solution ?
3. Comment utiliser FILIOP 40 microgrammes/mL + 5 mg/mL, collyre en solution ?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver FILIOP 40 microgrammes/mL + 5 mg/mL, collyre en solution ?
6. Contenu de l’emballage et autres informations.
1. QU’EST-CE QUE FILIOP 40 microgrammes/mL + 5 mg/mL, collyre en solution ET DANS QUELS CAS EST-IL UTILISE ?
Classe pharmacothérapeutique - code ATC : S01ED51
FILIOP collyre en solution est une association de deux substances actives (travoprost et timolol). Le travoprost est un analogue des prostaglandines qui agit en augmentant l’évacuation de liquide de l’œil, ce qui abaisse la pression dans l’œil. Le timolol est un bêtabloquant qui agit en réduisant la production de liquide à l'intérieur de l'œil. Les deux substances agissent ensemble pour réduire la pression à l'intérieur de l'œil.
FILIOP collyre est utilisé pour traiter une pression élevée dans l'œil chez les adultes, y compris chez les patients âgés. Cette pression élevée peut provoquer une maladie appelée « glaucome ».
FILIOP collyre en solution est une solution stérile sans conservateur.
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT D’UTILISER FILIOP 40 microgrammes/mL + 5 mg/mL, collyre en solution ?
N’utilisez jamais FILIOP 40 microgrammes/mL + 5 mg/mL, collyre en solution :
· si vous êtes allergique au travoprost, au timolol ou à l’un des autres composants contenus dans ce médicament (mentionnés dans la rubrique 6) ;
· si vous êtes allergique aux prostaglandines ou aux bêtabloquants ;
· si vous avez ou avez eu dans le passé des problèmes respiratoires, p. ex. un asthme, une bronchite chronique obstructive sévère (maladie grave des poumons pouvant provoquer une respiration sifflante, des difficultés respiratoires et/ou une toux persistante) ou d’autres types de problèmes respiratoires ;
· si vous avez un rhume de foins sévère ;
· si vous avez une fréquence cardiaque lente, une insuffisance cardiaque ou des troubles du rythme cardiaque (rythme cardiaque irrégulier) ;
· si la surface de votre œil est trouble.
Demandez conseil à votre médecin si l’une de ces situations vous concerne.
Avertissements et précautions
Adressez-vous à votre médecin ou, pharmacien avant d’utiliser FILIOP 40 microgrammes/mL + 5 mg/mL, collyre en solution si vous avez ou avez eu dans le passé :
· une maladie cardiaque coronarienne (les symptômes peuvent inclure une douleur ou une sensation d’oppression dans la poitrine, un essoufflement ou un étouffement), une insuffisance cardiaque ou une tension artérielle faible ;
· des troubles du rythme cardiaque, p. ex. un rythme cardiaque lent ;
· des problèmes respiratoires, un asthme ou une maladie pulmonaire chronique obstructive ;
· une mauvaise circulation sanguine (p. ex. maladie de Raynaud ou syndrome de Raynaud) ;
· un diabète car le timolol peut masquer les signes et symptômes de taux faibles de sucre dans le sang ;
· une hyperactivité de la glande thyroïde car le timolol peut masquer les signes et symptômes d’une maladie de la thyroïde ;
· une myasthénie grave (faiblesse neuromusculaire chronique) ;
· toute réaction allergique sévère (éruption cutanée, rougeur et démangeaisons au niveau de l’œil) survenant pendant l’utilisation de FILIOP, quelle qu'en soit la cause, le traitement par adrénaline peut ne pas être aussi efficace. Ainsi, si vous recevez tout autre traitement, veuillez avertir votre médecin que vous utilisez FILIOP;
· une chirurgie de la cataracte ;
· une inflammation de l’œil (à l’heure actuelle ou dans le passé).
Avant de subir une opération, avertissez votre médecin que vous utilisez FILIOP car le timolol peut modifier les effets de certains médicaments utilisés pendant l’anesthésie.
FILIOP peut modifier la couleur de l’iris (la partie colorée de l’œil). Cette modification peut être permanente.
FILIOP peut provoquer une augmentation de la longueur, de l’épaisseur, de la couleur et/ou du nombre des cils, et peut causer une croissance anormale de poils sur les paupières.
Le travoprost peut être absorbé par la peau et il ne doit donc pas être utilisé chez les femmes enceintes ou qui essaient de tomber enceintes. Si le médicament entre en contact avec la peau, il faut laver immédiatement la zone exposée.
Enfants
FILIOP ne doit pas être utilisé chez les enfants et les adolescents de moins de 18 ans.
Autres médicaments et FILIOP 40 microgrammes/mL + 5 mg/mL, collyre en solution
Informez votre médecin ou pharmacien si vous prenez, avez récemment pris ou pourriez prendre tout autre médicament.
FILIOP peut modifier l’action d’autres médicaments ou d’autres médicaments peuvent modifier l’action de FILIOP, y compris d’autres collyres destinés au traitement du glaucome. Avertissez votre médecin si vous utilisez ou avez l’intention d’utiliser :
· des médicaments pour abaisser la tension artérielle ;
· un médicament pour le cœur, incluant la quinidine (utilisée pour traiter les affections cardiaques et certains types de malaria) ;
· des médicaments pour traiter le diabète ou des antidépresseurs connus sous le nom de « fluoxétine » et « paroxétine ».
FILIOP 40 microgrammes/mL + 5 mg/mL, collyre en solution avec des aliments et, boissons et de l’alcool
Sans objet.
Grossesse, allaitement et fertilité
Si vous êtes enceinte ou que vous allaitez, si vous pensez être enceinte ou planifiez une grossesse, demandez conseil à votre médecin avant d’utiliser ce médicament.
N’utilisez pas FILIOP si vous êtes enceinte sauf si votre médecin l’estime nécessaire. Si vous êtes susceptible de tomber enceinte, vous devez utiliser une contraception adéquate pendant que vous utilisez ce médicament.
N’utilisez pas FILIOP si vous allaitez. Ce médicament peut se retrouver dans votre lait.
Conduite de véhicules et utilisation de machines
Vous pouvez constater que votre vision est floue pendant un certain temps, juste après avoir utilisé FILIOP. FILIOP peut également provoquer des hallucinations, un étourdissement, une nervosité ou une fatigue chez certains patients.
Ne conduisez aucun véhicule et n’utilisez aucune machine jusqu’à la disparition des symptômes.
FILIOP 40 microgrammes/mL + 5 mg/mL, collyre en solution contient de l’hydroxystéarate de macrogolglycérol 40 et du propylène glycol
Ce médicament contient de l’hydroxystéarate de macrogolglycérol 40, qui peut causer des réactions cutanées.
Ce médicament contient 7,5 mg de propylène glycol dans chaque ml de solution.
3. COMMENT UTILISER FILIOP 40 microgrammes/mL + 5 mg/mL, collyre en solution ?
Veillez à toujours utiliser ce médicament en suivant exactement les indications de votre médecin. Vérifiez auprès de votre médecin ou pharmacien en cas de doute.
La dose recommandée est
Une goutte dans l’œil/les yeux atteint(s), une fois par jour le matin ou le soir. Utilisez le médicament à la même heure chaque jour.
N’utilisez FILIOP dans les deux yeux que si votre médecin vous a dit de le faire. Utilisez-le aussi longtemps que votre médecin vous dit de le faire.
N’utilisez FILIOP qu’en gouttes pour les yeux.
Instructions d’utilisation
|
1a
|
Sortez le flacon (image 1a) de l’emballage et écrivez la date d’ouverture sur la boîte en carton et sur le flacon à l’endroit prévu. |
|
|
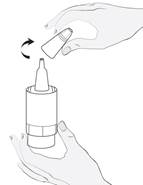
Prenez le flacon de médicament et un miroir. Lavez vos mains. Enlevez le capuchon (image 1b).
|
|
|
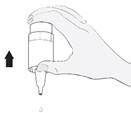
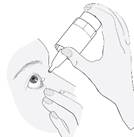
Tenez le flacon vers le bas, en plaçant le pouce sur le rebord du flacon et les autres doigts sur le fond du flacon. Avant la première utilisation, actionnez la pompe du flacon de manière répétitive, environ 10 fois, jusqu’à ce que la première goutte sorte (image 2).
|
|
3 |
Inclinez la tête en arrière. Tirez la paupière vers le bas à l’aide d’un doigt propre, jusqu’à ce qu’il y ait une sorte de « poche » entre la paupière et l’œil. C’est à cet endroit que la goutte doit tomber (image 3). Tenez l’extrémité du flacon près de l’œil. Utilisez le miroir si cela vous aide. |
|
|
Ne touchez pas votre œil ni votre paupière, ni les zones avoisinantes ou d’autres surfaces avec le compte-gouttes. Cela pourrait contaminer le collyre. Appuyez doucement sur le fond du flacon pour libérer une goutte du médicament à la fois (image 4). Si une goutte ne tombe pas dans l’œil, essayez à nouveau. |
|
|
Après l’utilisation du médicament, pressez le coin de l’œil situé du côté du nez pendant 2 minutes avec un doigt (image 5). Cette manœuvre aide à arrêter l’absorption du médicament dans le reste du corps. |
|
|
Si vous utilisez les gouttes dans les deux yeux, répétez ces étapes pour l’autre œil. Fermez bien le capuchon du flacon, juste après l’utilisation. N’utilisez qu’un seul flacon à la fois. N’ouvrez le capuchon qu’au moment où vous avez besoin d’utiliser le flacon. Afin de prévenir les infections, vous devez jeter le flacon 28 jours après sa première ouverture et utiliser un nouveau flacon. |
Si vous avez utilisé plus de FILIOP 40 microgrammes/mL + 5 mg/mL, collyre en solution que vous n’auriez dû
Si vous avez utilisé plus de FILIOP que vous n’auriez dû, rincez votre œil à l’eau chaude. N’appliquez plus aucune goutte jusqu’au moment de la dose habituelle suivante.
Si vous oubliez d’utiliser FILIOP 40 microgrammes/mL + 5 mg/mL, collyre en solution
Si vous oubliez d’utiliser FILIOP, continuez le traitement en appliquant la dose suivante au moment habituel. N’utilisez pas de dose double pour compenser la dose que vous oublié d’utiliser. La dose ne doit pas dépasser une goutte par jour dans l’œil/les yeux atteint(s).
Si vous arrêtez d’utiliser FILIOP 40 microgrammes/mL + 5 mg/mL, collyre en solution
Si vous arrêtez d’utiliser FILIOP sans en parler à votre médecin, la pression dans votre œil ne sera pas contrôlée, ce qui pourrait provoquer une perte de la vision.
Si vous utilisez un autre collyre, attendez au moins 5 minutes entre l’application de FILIOP et celle de l’autre collyre.
Si vous portez des lentilles de contact souples, n’utilisez pas le collyre avec vos lentilles en place. Après avoir utilisé le collyre, attendez 15 minutes avant de remettre vos lentilles.
Si vous avez d’autres questions sur l’utilisation de ce médicament, demandez plus d’informations à votre médecin ou à votre pharmacien.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
Comme tous les médicaments, ce médicament peut provoquer des effets indésirables, mais ils ne surviennent pas systématiquement chez tout le monde.
Vous pouvez généralement poursuivre l’utilisation du collyre sauf si les effets sont graves. Si vous avez la moindre inquiétude, consultez votre médecin ou votre pharmacien. N’arrêtez pas l’utilisation de FILIOP sans en parler d’abord à votre médecin.
Très fréquent (pouvant toucher plus de 1 personne sur 10) :
Effets au niveau de l’œil : rougeur oculaire
Fréquent (pouvant toucher jusqu’à 1 personne sur 10) :
Effets au niveau de l’œil : inflammation de la surface de l’œil avec une atteinte superficielle, douleur oculaire, vision floue, vision anormale, sécheresse de l’œil, démangeaisons au niveau de l’œil, inconfort oculaire, signes et symptômes d’irritation oculaire (p. ex. brûlure, picotements).
Peu fréquent (pouvant toucher jusqu’à 1 personne sur 100) :
Effets au niveau de l’œil : inflammation de la surface de l’œil, inflammation de la paupière, gonflement de la conjonctive, augmentation de la croissance des cils, inflammation de l’iris, inflammation de l’œil, sensibilité à la lumière, altération de la vision, fatigue oculaire, allergie oculaire, gonflement oculaire, augmentation de la production de larmes, rougeur de la paupière, modification de la couleur de la paupière, assombrissement de la peau (autour de l’œil).
Effets indésirables généraux : allergie médicamenteuse, étourdissements, maux de tête, augmentation ou diminution de la tension artérielle, essoufflement, croissance excessive des poils, écoulement dans l’arrière-gorge, inflammation et irritation de la peau, diminution de la fréquence cardiaque.
Effets indésirables rares (pouvant toucher jusqu’à 1 personne sur 1 000) :
Effets au niveau de l’œil : amincissement de la surface de l’œil, inflammation des glandes de la paupière, rupture des vaisseaux sanguins dans l’œil, croûte sur le bord de la paupière, position anormale des cils, croissance anormale des cils.
Effets indésirables généraux : nervosité, rythme cardiaque irrégulier, perte de cheveux, troubles de la voix, difficultés respiratoires, toux, irritation de la gorge, urticaire, anomalies des résultats des tests sanguins évaluant la fonction du foie, coloration anormale de la peau, soif, fatigue, inconfort à l’intérieur du nez, urines colorées, douleur dans les mains et les pieds.
Fréquence indéterminée (ne peut être estimée sur la base des données disponibles) :
Effets au niveau de l’œil : paupière tombante (rendant l’œil à moitié fermé), yeux enfoncés dans les orbites (les yeux apparaissent plus enfoncés), changement de la couleur de l'iris (partie colorée de l'oeil).
Effets indésirables généraux : éruption cutanée, insuffisance cardiaque, douleur dans la poitrine, accident vasculaire cérébral, évanouissement, dépression, asthme, augmentation de la fréquence cardiaque, engourdissement ou picotements, palpitations, gonflement des membres inférieurs, mauvais goût dans la bouche.
De plus :
FILIOP est une association de 2 substances actives. Comme d’autres médicaments s’appliquant dans l’œil, le travoprost et le timolol (un bêtabloquant) sont absorbés dans le sang, ce qui peut provoquer des effets indésirables similaires à ceux observés avec les bêtabloquants administrés par voie intraveineuse et/ou orale. L’incidence des effets indésirables après l’administration ophtalmique topique est plus faible qu’après une administration orale (par la bouche) ou intraveineuse, par exemple. Les effets indésirables mentionnés incluent les réactions observées avec la classe des bêtabloquants lorsqu’ils sont utilisés pour traiter des affections de l’œil :
Effets au niveau de l’œil : inflammation de la paupière, inflammation de la cornée, décollement de la couche située sous la rétine contenant des vaisseaux sanguins suite à une chirurgie de filtration, pouvant causer des troubles de la vision, diminution de la sensibilité cornéenne, érosion cornéenne (atteinte de la couche située à l’avant du globe oculaire), vision double, , écoulement de l’œil, gonflement autour de l’œil, démangeaison de la paupière, renversement externe de la paupière associé à une rougeur, irritation et larmes excessives, vision floue (signe d’opacification du cristallin), gonflement d’une partie de l’œil (uvée), eczéma des paupières, effet de halo, diminution de la vue, pigmentation dans l’œil, dilatation des pupilles, changement de la couleur des cils, changement de la texture des cils, trouble du champ visuel.
Effets indésirables généraux :
· Troubles de l'oreille et du labyrinthe : étourdissement (sensation de tête qui tourne), bourdonnement des oreilles.
· Cœur et circulation : rythme cardiaque lent, palpitations, œdème (accumulation de liquide), modification du rythme ou de la vitesse des battements cardiaques, insuffisance cardiaque congestive (maladie cardiaque s'accompagnant d’un essoufflement et d’un gonflement des pieds et des jambes en raison d’une accumulation de liquide), un type de troubles du rythme cardiaque, crise cardiaque, tension artérielle faible, phénomène de Raynaud, froideur des mains et des pieds, diminution de l’apport de sang au cerveau.
· Système respiratoire : constriction des voies respiratoires dans les poumons (principalement chez les patients ayant une maladie préexistante), difficultés respiratoires, nez bouché, éternuements (causés par une allergie), saignements du nez, sécheresse nasale.
· Système nerveux et troubles généraux : difficultés à dormir (insomnie), cauchemars, perte de mémoire, hallucinations, perte de force et d’énergie, anxiété (détresse émotionnelle).
· Système digestif : troubles du goût, nausées, indigestion, diarrhée, sécheresse de la bouche, douleur abdominale, vomissements et constipation.
· Allergie : réactions allergiques généralisées incluant un gonflement sous la peau pouvant survenir à des endroits tels que le visage et les membres et pouvant causer une obstruction des voies respiratoires et provoquer des difficultés à avaler ou respirer, une urticaire, une éruption localisée et généralisée, des démangeaisons, une réaction allergique grave d’apparition brutale pouvant menacer le pronostic vital.
· Peau : éruption cutanée d’apparence blanc-argenté (éruption psoriasiforme) ou aggravation d’un psoriasis, desquamation de la peau, texture anormale des cheveux, inflammation de la peau avec éruption cutanée et rougeur, modification de la couleur des cheveux, perte des cils, démangeaison, croissance anormale des cheveux, rougeur de la peau.
· Au niveau des muscles : augmentation des signes et symptômes de myasthénie gravis (affection musculaire), sensations inhabituelles telles que des picotements, faiblesse/fatigue musculaire, douleurs musculaires non provoquées par l'exercice, douleurs articulaires.
· Troubles du rein et des voies urinaires : difficulté à uriner et douleur en urinant, fuite urinaire incontrôlée.
· Au niveau de la reproduction : dysfonction sexuelle, diminution de la libido.
· Métabolisme : faibles taux de sucre dans le sang, augmentation de l’antigène de la prostate.
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet: https://signalement.social-sante.gouv.fr
En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.
5. COMMENT CONSERVER FILIOP 40 microgrammes/mL + 5 mg/mL, collyre en solution ?
Tenir ce médicament hors de la vue et de la portée des enfants.
N’utilisez pas ce médicament après la date de péremption indiquée sur la boîte et le flacon après « EXP ». La date de péremption fait référence au dernier jour de ce mois.
N’utilisez pas ce médicament si vous remarquez que le flacon a été brisé ou endommagé avant sa première ouverture.
A conserver à une température ne dépassant pas 25°C.
Afin d’éviter les infections, vous devez jeter le flacon 28 jours après l’avoir ouvert pour la première fois et utiliser un nouveau flacon. Inscrivez la date d’ouverture du flacon à l’endroit prévu sur l’étiquette du flacon et la boîte.
Ne jetez aucun médicament au tout-à-l’égout ni avec les ordures ménagères. Demandez à votre pharmacien d’éliminer les médicaments que vous n’utilisez plus. Ces mesures contribueront à protéger l’environnement.
6. CONTENU DE L’EMBALLAGE ET AUTRES INFORMATIONS
Ce que contient FILIOP 40 microgrammes/mL + 5 mg/mL, collyre en solution
· Les substances actives sont : le travoprost et le timolol.
Chaque ml de solution contient 40 microgrammes de travoprost et 5 mg de timolol (sous la forme de maléate de timolol).
· Les autres composants sont :
Mannitol (E421), acide borique, hydroxyde de sodium (pour ajustement du pH), hydroxystéarate de macrogolglycérol (valeur nominale : 40), propylène glycol (E1520), chlorure de sodium et eau purifiée.
FILIOP collyre en solution se présente sous la forme d’une solution aqueuse, limpide et incolore, presque sans particules (volume de 2,5 ml) contenue dans un flacon multidose blanc de 5 ml (PP) muni d’une pompe (PP, PEHD, PEBD), d’un cylindre à pression et d’un capuchon (PEHD).
Les présentations suivantes du produit sont disponibles :
Boîtes contenant 1 ou 3 flacons.
Toutes les présentations peuvent ne pas être commercialisées
Titulaire de l’autorisation de mise sur le marché
22 Allée Camille Muffat
INEDI 5
06200 NICE
FRANCE
Exploitant de l’autorisation de mise sur le marché
HORUS PHARMA
22 Allée Camille Muffat
INEDI 5
06200 NICE
FRANCE
JADRAN - GALENSKI LABORATORIJ D.D.
SVILNO 20
51000, RIJEKA
CROATIE
ou
PHARMATHEN S.A
DERVENAKION 6
15351, PALLINI
GRECE
Noms du médicament dans les Etats membres de l'Espace Economique Européen
Ce médicament est autorisé dans les Etats membres de l'Espace Economique Européen sous les noms suivants : Conformément à la réglementation en vigueur.
[à compléter ultérieurement par le titulaire]
La dernière date à laquelle cette notice a été révisée est :
[à compléter ultérieurement par le titulaire]
< {MM/AAAA}>< {mois AAAA}.>
Des informations détaillées sur ce médicament sont disponibles sur le site Internet de l’ANSM (France).
 2
2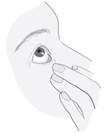
 4
4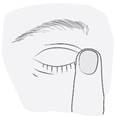 5
5