Dernière mise à jour le 02/02/2026
SARGENOR A LA VITAMINE C, solution buvable en ampoule
Ce médicament n'est ou ne sera bientôt plus disponible sur le marché.
Si vous prenez actuellement ce médicament, il vous est recommandé d'en parler avec votre médecin
ou avec votre pharmacien qui pourra vous orienter vers un autre traitement.
Indications thérapeutiques
Classe pharmacothérapeutique : TONIQUES, code ATC : A13A
Ce médicament contient un acide aminé (l'aspartate d'arginine) et de la vitamine C.
Il est indiqué dans les états de fatigue passagers de l'adulte (à partir de 15 ans).
Service médical rendu (SMR)
Pas de SMR disponible pour ce médicament ( plus d'informations dans l'aide )
Amélioration du service médical rendu (ASMR)
Pas d'ASMR disponible pour ce médicament (plus d'informations dans l'aide )
ANSM - Mis à jour le : 01/09/2024
SARGENOR A LA VITAMINE C, solution buvable en ampoule
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Aspartate d'arginine ................................................................................................................ 1,5 g
Acide ascorbique .................................................................................................................... 0,5 g
Pour une ampoule.
Excipients à effet notoire : Ce médicament contient 4 mg de parahydroxybenzoate de méthyle (E 218), 1 mg de parahydroxybenzoate de propyle (E 216) et 68 mg de sodium.
Pour la liste complète des excipients, voir rubrique 6.1
Solution buvable en ampoule.
4.1. Indications thérapeutiques
Ce médicament est indiqué dans les états de fatigue passagers de l'adulte (à partir de 15 ans).
4.2. Posologie et mode d'administration
RESERVE A L'ADULTE (à partir de 15 ans).
Posologie
· Soit une ampoule le matin et une le midi.
· Soit deux ampoules le matin ou le midi en une seule prise.
· Ne pas dépasser 2 ampoules par jour.
Mode d’administration
· Diluer le contenu de l'ampoule dans un verre d'eau avant de boire.
· Hypersensibilité aux substances actives ou à l’un des excipients mentionnés à la rubrique 6.1.
· Lithiases rénales oxalo-calciques pour des doses de vitamine C supérieures à 1 g par jour.
4.4. Mises en garde spéciales et précautions d'emploi
· En cas de persistance des troubles au-delà de 1 mois de traitement ou d'aggravation des troubles, une recherche étiologique doit être effectuée et la conduite à tenir réévaluée.
· En raison d'un effet légèrement stimulant, il est souhaitable de ne pas prendre ce médicament en fin de journée.
· Chez les patients ayant récemment subi un infarctus du myocarde, ce médicament ne doit être pris que sous surveillance médicale en raison de sa teneur en arginine.
· Lorsqu’il est pris à de fortes doses (plus de 2 g/ jour), l'acide ascorbique peut interférer avec les tests biologiques suivants : dosage de la créatinine et du glucose sanguins et urinaires (contrôle du diabète par tigette à la glucose oxydase).
· Des cas isolés d’hémolyse sévère ont été observés chez des patients présentant un déficit en glucose-6-phosphate déshydrogénase et prenant des doses plus élevées de vitamine C. Il convient donc d'éviter de dépasser la dose recommandée.
· L'acide ascorbique doit être utilisé avec prudence chez les patients présentant une surcharge en fer, par exemple en cas d'hémochromatose.
· Des doses élevées d'acide ascorbique peuvent entraîner une augmentation du taux d'oxalate dans l'urine. Cela augmente le risque de formation de calculs d'oxalate de calcium, en particulier chez les patients prédisposés à la formation de calculs rénaux.
· En raison de la présence de parahydroxybenzoate de méthyle et de parahydroxybenzoate de propyle, ce médicament peut provoquer des réactions allergiques (éventuellement retardées).
· Ce médicament contient 68 mg de sodium par ampoule, ce qui équivaut à 3,4 % de l’apport alimentaire quotidien maximal recommandé par l’OMS de 2 g de sodium par adulte.
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
Liée à la présence de vitamine C
Précaution d'emploi
+ DÉFÉRIPRONE
Par extrapolation à partir de l’interaction avec la déféroxamine : avec l’acide ascorbique à fortes doses et par voie IV, risque d’anomalies de la fonction cardiaque, voire insuffisance cardiaque aiguë (en général réversible à l’arrêt de la vitamine C).
+ DÉFÉROXAMINE
Avec l'acide ascorbique à fortes doses et par voie IV : anomalies de la fonction cardiaque, voire insuffisance cardiaque aiguë (en général réversible à l'arrêt de la vitamine C).
En cas d'hémochromatose, ne donner de la vitamine C qu'après avoir commencé le traitement par la déféroxamine. Surveiller la fonction cardiaque en cas d'association.
A prendre en compte
+ CICLOSPORINE
Risque de diminution des concentrations sanguines de la ciclosporine, notamment en cas d’association avec la vitamine E.
4.6. Fertilité, grossesse et allaitement
Grossesse
Il n'y a pas ou peu de données sur l'utilisation de SARGENOR A LA VITAMINE C, solution buvable en ampoule chez les femmes enceintes. Par mesure de précaution, il est préférable d'éviter l'utilisation de SARGENOR A LA VITAMINE C, solution buvable en ampoule pendant la grossesse.
L’excrétion de l'aspartate d’arginine dans le lait maternel n’est pas connue. L’acide ascorbique est excrété dans le lait maternel. Un risque pour les nouveau-nés et les nourrissons ne peut être exclu. Par conséquent, l'utilisation de SARGENOR A LA VITAMINE C, solution buvable en ampoule est à éviter pendant l'allaitement.
Fertilité
Il n’existe pas de données animales ou cliniques sur l’effet de SARGENOR A LA VITAMINE C, solution buvable en ampoule sur la fertilité.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
Les effets indésirables mentionnés ci-dessous, pouvant survenir avec SARGENOR A LA VITAMINE C, solution buvable en ampoule sont listés par classe de systèmes d’organes et par fréquence selon la convention suivante : très fréquent (≥ 1/10) ; fréquent (≥1/100, <1/10) ; peu fréquent (≥ 1/1000, <1/100) ; rare (≥ 1/10 000, <1/1000) ; très rare (<1/10 000) ; et fréquence indéterminée (ne peut être estimée sur la base des données disponibles).
|
Système de classes d’organes (SOC) |
Fréquence |
Terme préférentiel MedDRA (PT) |
|
Affection du système immunitaire |
Fréquence indéterminée |
Hypersensibilité |
|
Affections gastro-intestinales |
Fréquence indéterminée |
Troubles gastro-intestinaux, diarrhée, nausée, vomissements (à forte dose) |
|
Affections de la peau et du tissu sous-cutané |
Fréquence indéterminée |
Dermatite allergique (réactions cutanées notamment dues à la présence des parahydroxybenzoates) |
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr.
· A doses supérieures à 1 g/ jour en vitamine C, possibilité de :
o troubles digestifs (brûlures gastriques, diarrhée)
o troubles urinaires (lithiases oxaliques, cystiniques et/ou uriques)
o Hémolyse chez les sujets déficients en G6PD
· A doses supérieures à 2 g/ jour en vitamine C, l'acide ascorbique peut interférer avec les tests biologiques suivants : dosage de la créatinine et du glucose sanguins et urinaires (contrôle du diabète par tigette à la glucose oxydase).
· L’aspartate d’arginine peut être à l’origine de troubles gastro-intestinaux tels que diarrhée, nausée, douleurs abdominales, ballonnements et vomissements à fortes doses ou lors d’un traitement prolongé.
· Si un surdosage est suspecté, SARGENOR à la Vitamine C doit être arrêté et une prise en charge médicale envisagée si besoin.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Classe pharmacothérapeutique : TONIQUES, code ATC : A13A
5.2. Propriétés pharmacocinétiques
Absorption
L'acide ascorbique est bien absorbé dans sa presque totalité au niveau de l'intestin grêle.
Élimination
L'aspartate d'arginine et l'acide aspartique sont éliminés par voie rénale.
La vitamine C est éliminée dans les urines sous forme inchangée ou sous forme d'acide hydro-ascorbique, d'acide 2-3 dicétogulonique et d'acide oxalique.
5.3. Données de sécurité préclinique
Sans objet.
2 ans.
6.4. Précautions particulières de conservation
A conserver à une température ne dépassant pas 30°C.
6.5. Nature et contenu de l'emballage extérieur
5 ml en ampoule (verre brun de type II) ; boîte de 10, 20 ou 40.
Toutes les présentations peuvent ne pas être commercialisées.
6.6. Précautions particulières d’élimination et de manipulation
Pas d'exigences particulières.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
MEDA PHARMA
1 BIS PLACE DE LA DEFENSE – TOUR TRINITY
92400 COURBEVOIE
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· 34009 354 561 6 8 : 5 ml en ampoule (verre brun) ; boîte de 10.
· 34009 354 562 2 9 : 5 ml en ampoule (verre brun) ; boîte de 20.
· 34009 354 563 9 7 : 5 ml en ampoule (verre brun) ; boîte de 40.
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
[à compléter ultérieurement par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE
[à compléter ultérieurement par le titulaire]
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Médicament non soumis à prescription médicale.
ANSM - Mis à jour le : 01/09/2024
SARGENOR A LA VITAMINE C, solution buvable en ampoule
Aspartate d’arginine, acide ascorbique
Vous devez toujours prendre ce médicament en suivant scrupuleusement les informations fournies dans cette notice ou par votre médecin ou votre pharmacien.
· Gardez cette notice. Vous pourriez avoir besoin de la relire.
· Adressez-vous à votre pharmacien pour tout conseil ou information.
· Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
· Vous devez vous adresser à votre médecin si vous ne ressentez aucune amélioration ou si vous vous sentez moins bien après un mois.
1. Qu'est-ce que SARGENOR A LA VITAMINE C, solution buvable en ampoule et dans quels cas est-il utilisé ?
2. Quelles sont les informations à connaître avant de prendre SARGENOR A LA VITAMINE C, solution buvable en ampoule ?
3. Comment prendre SARGENOR A LA VITAMINE C, solution buvable en ampoule ?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver SARGENOR A LA VITAMINE C, solution buvable en ampoule ?
6. Contenu de l’emballage et autres informations.
1. QU’EST-CE QUE SARGENOR A LA VITAMINE C, solution buvable en ampoule ET DANS QUELS CAS EST-IL UTILISE ?
Classe pharmacothérapeutique : TONIQUES, code ATC : A13A
Ce médicament contient un acide aminé (l'aspartate d'arginine) et de la vitamine C.
Il est indiqué dans les états de fatigue passagers de l'adulte (à partir de 15 ans).
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT DE PRENDRE SARGENOR A LA VITAMINE C, solution buvable en ampoule ?
Ne prenez jamais SARGENOR A LA VITAMINE C, solution buvable en ampoule :
· si vous êtes allergique aux substances actives ou à l’un des autres composants contenus dans ce médicament, mentionnés dans la rubrique 6,
· en cas de calcul rénal (oxalo-calcique).
Avertissements et précautions
Adressez-vous à votre médecin ou pharmacien avant de prendre SARGENOR A LA VITAMINE C, solution buvable en ampoule.
· En raison d'un effet légèrement stimulant, il est souhaitable de ne pas prendre ce médicament en fin de journée.
· Si votre fatigue s'accroît ou persiste après 1 mois de traitement ou si elle s'accompagne de manifestations inhabituelles (voir Conseils d'éducation sanitaire), prenez l'avis de votre médecin ou de votre pharmacien.
· Si vous avez récemment subi un infarctus du myocarde, ce médicament ne doit être pris que sous surveillance médicale en raison de sa teneur en arginine.
· Si vous devez effectuer les examens biologiques suivants, parlez-en à votre médecin : créatinine, dosage du glucose dans le sang et dans les urines (test de la glucose oxydase pour le diabète). Des doses élevées (plus de 2 g/jour) de vitamine C peuvent interférer avec ces examens.
· Si vous avez un déficit enzymatique appelé déficit en glucose-6- phosphate déshydrogénase (un trouble héréditaire du métabolisme des globules rouges), informez-en votre médecin. L'hémolyse (destruction des globules rouges) peut être provoquée par des doses élevées de vitamine C chez les patients présentant un déficit en glucose-6-phosphate déshydrogénase.
· Si vous souffrez d'une surcharge en fer, par exemple d'hémochromatose, informez-en votre médecin.
· Des doses élevées de vitamine C peuvent augmenter le taux d'oxalate de calcium dans l'urine et entraîner la formation de calculs rénaux. Consultez votre médecin avant de prendre SARGENOR A LA VITAMINE C, solution buvable en ampoule, en particulier si vous êtes prédisposé à la formation de calculs rénaux.
Enfants
Sans objet.
Autres médicaments et SARGENOR A LA VITAMINE C, solution buvable en ampoule
|
Ce médicament contient de l'aspartate d'arginine et de la vitamine C. D'autres médicaments en contiennent. Ne les associez pas, afin de ne pas dépasser les doses maximales conseillées (voir rubrique 3). |
Informez votre médecin ou pharmacien si vous prenez, avez récemment pris ou pourriez prendre tout autre médicament.
En particulier informez votre médecin ou pharmacien dans les situations suivantes :
· Si vous souffrez de surcharge en fer pouvant nécessiter un traitement par déféroxamine ou défériprone (médicaments utilisés pour capter le fer ou l’aluminium lors d’intoxications ou de surcharges de l’organisme). Votre fonction cardiaque devra être surveillée en cas d’association.
· Si vous prenez de la ciclosporine (médicament utilisé pour diminuer les réactions immunitaires de l’organisme, par exemple après une greffe d’organe) car la vitamine C risque de diminuer les concentrations de la ciclosporine dans votre sang, notamment en cas d’association avec la vitamine E.
SARGENOR A LA VITAMINE C, solution buvable en ampoule avec des aliments et boissons
Sans objet.
Grossesse et allaitement
Si vous allaitez, vous devez éviter de prendre ce médicament car il peut se retrouver dans le lait maternel.
Conduite de véhicules et utilisation de machines
Sans objet.
SARGENOR A LA VITAMINE C, solution buvable en ampoule contient du parahydroxybenzoate de méthyle, du parahydroxybenzoate de propyle et du sodium.
Ce médicament peut provoquer des réactions allergiques (éventuellement retardées).
Ce médicament contient 68 mg de sodium (composant principal du sel de cuisine/table) par ampoule. Cela équivaut à 3,4 % de l’apport alimentaire quotidien maximal recommandé de sodium pour un adulte.
3. COMMENT PRENDRE SARGENOR A LA VITAMINE C, solution buvable en ampoule?
Veillez à toujours prendre ce médicament en suivant exactement les instructions de cette notice ou les indications de votre médecin ou pharmacien. Vérifiez auprès de votre médecin ou pharmacien en cas de doute.
Posologie
RESERVE A L'ADULTE (à partir de 15 ans).
· Soit une ampoule le matin et une le midi.
· Soit deux ampoules le matin ou le midi en une seule prise.
· Ne pas dépasser 2 ampoules par jour.
· Diluer le contenu de l'ampoule dans un verre d'eau avant de boire.
Durée de traitement
|
La durée d'utilisation est limitée à 1 mois |
Mode d’emploi
Les ampoules sont munies de traits circulaires, un ou plusieurs, aux deux extrémités, où se trouve un point de rupture prédéterminé.

Les extrémités de l’ampoule doivent être cassées au niveau de ces points prédéterminés. La solution ne s'écoule que lorsque les deux extrémités sont cassées.
Les ampoules peuvent être ouvertes manuellement, en suivant les étapes ci-dessous :
1. Tenez l'ampoule en position oblique À CÔTÉ du verre à boire que vous allez utiliser (et non pas au-dessus du verre).
2. Cassez l'extrémité supérieure en la pliant avec une légère pression entre le pouce et l’index. Utilisez un tissu en papier propre pour protéger vos doigts et exercer une pression plus forte.
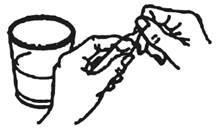
3. Retourner l'ampoule (la solution ne s'écoule pas encore).
4. Tenez l'ampoule en position oblique à côté du verre. Seule l'extrémité cassée est au-dessus du verre.
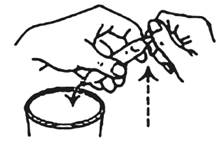
5. Cassez l'autre extrémité. La solution s'écoule maintenant.
6. Assurez-vous que la solution dans le verre ne contient pas de débris de verre.
Si vous avez pris plus de SARGENOR A LA VITAMINE C, solution buvable en ampoule que vous n'auriez dû
En cas de surdosage, arrêtez le traitement et consultez immédiatement votre médecin ou votre pharmacien.
· A doses supérieures à 1 g/jour en vitamine C possibilité de :
o troubles digestifs (brûlures d'estomac, diarrhée),
o troubles urinaires (formation de calculs rénaux),
o Hémolyse (destruction des globules rouges) chez les sujets déficients en glucose-6-phosphate déshydrogénase (enzyme spécifique des globules rouges).
· A doses supérieures à 2 g/jour en vitamine C, la vitamine C peut interférer avec les tests biologiques suivants : dosage de la créatinine et du glucose sanguin et urinaire (contrôle du diabète par tigette à la glucose-oxydase).
· L'ingestion de fortes doses d'arginine ou un traitement prolongé peuvent provoquer des troubles gastro-intestinaux tels que diarrhées, nausées, douleurs abdominales, ballonnements et vomissements.
Si vous oubliez de prendre SARGENOR A LA VITAMINE C, solution buvable en ampoule
Si vous arrêtez de prendre SARGENOR A LA VITAMINE C, solution buvable en ampoule
Sans objet.
Si vous avez d’autres questions sur l’utilisation de ce médicament, demandez plus d’informations à votre médecin ou à votre pharmacien.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
Comme tous les médicaments, ce médicament peut provoquer des effets indésirables, mais ils ne surviennent pas systématiquement chez tout le monde.
Fréquence indéterminée (ne peut être estimée sur la base des données disponibles)
· Réactions allergiques (hypersensibilité)
· Troubles gastro-intestinaux tels que diarrhée, nausée, vomissements (à forte dose)
· Réactions cutanées notamment dues à la présence des parahydroxybenzoates
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr.
En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.
5. COMMENT CONSERVER SARGENOR A LA VITAMINE C, solution buvable en ampoule ?
Tenir ce médicament hors de la vue et de la portée des enfants.
N’utilisez pas ce médicament après la date de péremption mentionnée sur la boîte ou l’ampoule. La date de péremption fait référence au dernier jour de ce mois.
A conserver à une température ne dépassant pas 30°C.
Ne jetez aucun médicament au tout-à-l’égout ou avec les ordures ménagères. Demandez à votre pharmacien d’éliminer les médicaments que vous n’utilisez plus. Ces mesures contribueront à protéger l’environnement.
6. CONTENU DE L’EMBALLAGE ET AUTRES INFORMATIONS
Ce que contient SARGENOR A LA VITAMINE C, solution buvable en ampoule
· Les substances actives sont :
Aspartate d'arginine........................................................................................................... 1,5 g
Acide ascorbique............................................................................................................... 0,5 g
Pour une ampoule.
· Les autres composants sont : parahydroxybenzoate de méthyle (E 218), parahydroxybenzoate de propyle (E 216), saccharine sodique, arôme fruits rouges/caramel, solution d'hydroxyde de sodium à 40 %, eau purifiée.
Ce médicament se présente sous forme de solution buvable en ampoule. Boîte de 10, 20 ou 40 ampoules de 5 ml.
Titulaire de l’autorisation de mise sur le marché
1 BIS PLACE DE LA DEFENSE – TOUR TRINITY
92400 COURBEVOIE
Exploitant de l’autorisation de mise sur le marché
COOPERATION PHARMACEUTIQUE FRANCAISE
PLACE LUCIEN AUVERT
77020 MELUN CEDEX
MEDA MANUFACTURING
AVENUE J.F. KENNEDY
33700 MERIGNAC
Noms du médicament dans les Etats membres de l'Espace Economique Européen
Sans objet.
La dernière date à laquelle cette notice a été révisée est :
[à compléter ultérieurement par le titulaire]
{MM/AAAA}>< {mois AAAA}.
Des informations détaillées sur ce médicament sont disponibles sur le site Internet de l’ANSM (France).
CONSEILS D'EDUCATION SANITAIRE
Ce médicament a pour but d'atténuer un état de fatigue passager.
Il convient de distinguer la fatigue physique normale survenant à la suite d'un effort important par exemple et l'asthénie qui est une fatigue en dehors de tout effort.
· La fatigue survenant à la suite d'un effort physique est normale : le repos suffit à la faire disparaître.
· La fatigue qui ne cède pas au repos ou asthénie est la sensation de ne pas pouvoir fournir un effort avant même de l'avoir commencé. Cette fatigue peut être la conséquence d'un surmenage, d'une maladie.
Certains médicaments peuvent aussi entraîner une fatigue inhabituelle : relisez la notice des médicaments que vous prenez et demandez l'avis de votre pharmacien ou de votre médecin.
Mais, dans de nombreux cas, aucune cause précise n'est retrouvée.
La fatigue peut se manifester par des symptômes très variables.
Cela peut être une impression générale de faiblesse.
Mais parfois, des symptômes peuvent s'y associer comme des troubles du sommeil (insomnie, sommeil agité...), intellectuels (difficultés de concentration, de la mémoire et de l'attention...), sexuels (diminution du désir...), du caractère (irritabilité, pessimisme, tristesse, démotivation...).
Vous pouvez diminuer votre fatigue en respectant autant que possible les conseils suivants :
· Reposez-vous, relaxez-vous, cherchez les raisons de votre fatigue.
· Pratiquez une activité physique régulière et adaptée.
· Ayez une alimentation équilibrée (notamment évitez la prise d'alcool, de tabac, d'excitants).
· Retrouvez votre rythme de sommeil (heure du coucher régulière et durée suffisante de sommeil).
Demandez l'avis de votre pharmacien ou de votre médecin dans les cas suivants :
· Absence d'amélioration après 1 mois de traitement.
· Augmentation de la sensation de fatigue en cours de traitement.
· Survenue de nouveaux symptômes ou de symptômes inhabituels.