Dernière mise à jour le 01/12/2025
CHOLECALCIFEROL BIOGARAN 100 000 UI, solution buvable en ampoule
Indications thérapeutiques
Classe pharmacothérapeutique : vitamine D et analogues - code ATC : A11CC05.
Ce médicament est indiqué dans le traitement et/ou la prophylaxie de la carence en vitamine D.
Présentations
> 1 ampoule(s) en verre brun de 2 ml
Code CIP : 34009 300 045 6 2
Déclaration de commercialisation : 06/08/2015
Cette présentation est agréée aux collectivités
- Prix hors honoraire de dispensation : 1,11 €
- Honoraire de dispensation : 1,02 €
- Prix honoraire compris : 2,13 €
- Taux de remboursement :65%
Service médical rendu (SMR)
Amélioration du service médical rendu (ASMR)
Ce médicament étant un générique, l'ASMR n'a pas été évalué par la commission de la transparence (CT), il est possible de se référer à la /aux spécialité(s) de référence du groupe générique auquel appartient ce médicament (cliquez ici pour aller à la rubrique des groupes génériques)
ANSM - Mis à jour le : 10/03/2025
CHOLECALCIFEROL BIOGARAN 100 000 UI, solution buvable en ampoule
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Cholécalciférol (ou vitamine D3).............................................................................................. 2,5 mg
Quantité correspondant à................................................................................................. 100 000 UI
Pour une ampoule de 2 ml.
Pour la liste complète des excipients, voir rubrique 6.1.
Solution buvable claire, jaunâtre en ampoule, avec une odeur de citron.
4.1. Indications thérapeutiques
Traitement et/ou prophylaxie de la carence en vitamine D.
4.2. Posologie et mode d'administration
Enfant de plus de 2 ans et adolescent
Prophylaxie :
Il est préférable d’administrer des doses quotidiennes en gouttes.
En cas de non-observance à la supplémentation quotidienne :
· 1 ampoule deux fois par an (en automne et en hiver) chez les enfants en bonne santé.
· 1 ampoule tous les trimestres en cas de disponibilité réduite de la vitamine D (obésité, peau pigmentée, absence d'exposition au soleil) ou d’un apport réduit (régime végétalien).
Adulte et sujet âgé
Prophylaxie : 1 ampoule tous les 3 mois.
Traitement : 1 à 2 ampoules par mois selon l'intensité de la carence jusqu'au retour à la normale de la calcémie et de la phosphorémie, en surveillant la calciurie pour éviter un surdosage, puis traitement prophylactique selon le schéma ci-dessus, sans dépasser 600 000 UI par an.
Mode d’administration
Voie orale.
Le contenu de l'ampoule peut être administré pur dans une petite cuillère ou dilué dans un peu d'eau (un léger trouble peut apparaître).
· Hypersensibilité à la substance active ou à l’un des excipients mentionnés à la rubrique 6.1 ;
· Hypercalcémie, hypercalciurie, lithiase calcique ;
· Hypervitaminose D ;
· Néphrocalcinose ;
· Pathologies et/ou conditions entrainant une hypercalcémie et/ou une hypercalciurie.
4.4. Mises en garde spéciales et précautions d'emploi
Dans des indications nécessitant des doses fortes et répétées, surveiller la calciurie et la calcémie et arrêter les apports de vitamine D si la calcémie dépasse 106 mg/ml (2,65 mmol/l) ou si la calciurie dépasse 300 mg/l chez l'adulte ou 4 à 6 mg/kg/j chez l'enfant.
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
Associations à prendre en compte
+ Orlistat
Diminution de l'absorption de la vitamine D.
4.6. Fertilité, grossesse et allaitement
Grossesse
Les données sont limitées sur l’utilisation du cholécalciférol chez la femme enceinte.
Les études sur l'animal ont mis en évidence des effets tératogènes à des doses très élevées.
Un surdosage en cholécalciférol doit être évité pendant la grossesse, en raison du risque d’hypercalcémie prolongée pouvant entraîner un retard de développement physique et mental, une sténose aortique supravalvulaire et une rétinopathie chez l'enfant.
Le cholécalciférol n’est pas recommandé dans la prophylaxie de la carence chez les femmes enceintes. En cas de carence, CHOLECALCIFEROL BIOGARAN n’est pas recommandé chez les femmes enceintes en raison de son fort dosage.
Le cholécalciférol et ses métabolites sont excrétés dans le lait maternel. Aucun surdosage induit par une mère allaitante n'a été observé chez le nouveau-né ; cependant, lors de prescription d'un supplément de cholécalciférol à un nouveau-né allaité, le médecin doit tenir compte de toute dose supplémentaire de cholécalciférol prise par la mère. CHOLECALCIFEROL BIOGARAN n’est pas recommandé chez les femmes allaitantes en raison de son fort dosage.
Fertilité
Il n’y a pas de donnée concernant l’effet de la vitamine D sur la fertilité.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
Les effets sur l’aptitude à conduire des véhicules et à utiliser des machines n’ont pas été étudiés.
Très rarement et notamment en cas de surdosage (voir rubrique 4.9) :
· réaction d'hypersensibilité au cholécalciférol ;
· hypercalcémie, hypercalciurie, lithiase calcique.
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance ‑ Site internet : https://signalement.social-sante.gouv.fr/
· céphalées, asthénie, anorexie, amaigrissement, arrêt de croissance ;
· nausées, vomissements ;
· polyurie, polydipsie, déshydratation ;
· hypertension artérielle ;
· lithiase calcique, calcifications tissulaires, en particulier rénales et vasculaires ;
· insuffisance rénale.
Signes biologiques :
· hypercalcémie, hypercalciurie, hyperphosphatémie, hyperphosphaturie.
Conduite à tenir :
Cesser l'administration de vitamine D, réduire les apports calciques, augmenter la diurèse, boissons abondantes.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Classe pharmacothérapeutique : vitamine D et analogues, code ATC : A11CC05.
Le rôle essentiel de la vitamine D s'exerce sur l'intestin, dont elle augmente la capacité à absorber le calcium et les phosphates, et sur le squelette, dont elle favorise la minéralisation (grâce à ses actions directes sur l'os en formation et à ses actions indirectes impliquant l'intestin, les parathyroïdes et l'os déjà minéralisé).
5.2. Propriétés pharmacocinétiques
Après absorption, elle se lie à une protéine porteuse spécifique et est transportée jusqu'au foie pour y être convertie en 25‑hydroxyvitamine D. Cette dernière se lie à son tour à la même protéine porteuse et est transportée jusqu'aux reins où elle est transformée en sa forme active, la 1,25‑dihydroxyvitamine D.
Ses sites de stockage essentiels sont le tissu adipeux, les muscles, mais aussi le sang. La 25‑hydroxyvitamine D liée à sa protéine porteuse est la forme majeure de réserve circulante de la vitamine D. Sa demi‑vie dans le sang est de 15 à 40 jours.
L'élimination de la vitamine D et de ses métabolites se fait par voie fécale, sous forme non transformée ou sous forme hydrosoluble (acide calcitroïque, dérivés glycuroconjugués).
5.3. Données de sécurité préclinique
Non renseigné.
6.4. Précautions particulières de conservation
Conserver l'ampoule dans l'emballage extérieur.
Ne pas mettre au réfrigérateur et ne pas congeler.
6.5. Nature et contenu de l'emballage extérieur
Boîte de 1.
6.6. Précautions particulières d’élimination et de manipulation
Pas d’exigences particulières.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
15, BOULEVARD CHARLES DE GAULLE
92700 COLOMBES
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· 34009 300 045 6 2 : 2 ml en ampoule (verre brun). Boîte de 1.
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
[à compléter ultérieurement par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE
[à compléter ultérieurement par le titulaire]
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Liste II.
ANSM - Mis à jour le : 10/03/2025
CHOLECALCIFEROL BIOGARAN 100 000 UI, solution buvable en ampoule
Cholécalciférol
Veuillez lire attentivement cette notice avant de prendre ce médicament car elle contient des informations importantes pour vous.
· Gardez cette notice. Vous pourriez avoir besoin de la relire.
· Si vous avez d’autres questions, interrogez votre médecin, votre pharmacien ou votre infirmier/ère.
· Ce médicament vous a été personnellement prescrit. Ne le donnez pas à d’autres personnes. Il pourrait leur être nocif, même si les signes de leur maladie sont identiques aux vôtres.
· Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin, votre pharmacien ou votre infirmier/ère. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
1. Qu'est-ce que CHOLECALCIFEROL BIOGARAN 100 000 UI, solution buvable en ampoule et dans quels cas est‑il utilisé ?
2. Quelles sont les informations à connaître avant de prendre CHOLECALCIFEROL BIOGARAN 100 000 UI, solution buvable en ampoule ?
3. Comment prendre CHOLECALCIFEROL BIOGARAN 100 000 UI, solution buvable en ampoule ?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver CHOLECALCIFEROL BIOGARAN 100 000 UI, solution buvable en ampoule ?
6. Contenu de l’emballage et autres informations.
1. QU’EST-CE QUE CHOLECALCIFEROL BIOGARAN 100 000 UI, solution buvable en ampoule ET DANS QUELS CAS EST-IL UTILISE ?
Classe pharmacothérapeutique : vitamine D et analogues - code ATC : A11CC05.
Ce médicament est indiqué dans le traitement et/ou la prophylaxie de la carence en vitamine D.
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT DE PRENDRE CHOLECALCIFEROL BIOGARAN 100 000 UI, solution buvable en ampoule ?
Ne prenez jamais CHOLECALCIFEROL BIOGARAN 100 000 UI, solution buvable en ampoule
· Si vous êtes allergique (hypersensible) au cholécalciférol (vitamine D3) ou à l’un des autres composants contenus dans ce médicament, mentionnés dans la rubrique 6 ;
· si vous présentez un excès de calcium dans le sang (hypercalcémie), un excès de calcium dans les urines (hypercalciurie), des calculs rénaux (lithiase calcique), des dépôts de calcium dans les reins (néphrocalcinose) ;
· si vous présentez une hypervitaminose D (intoxication par la vitamine D) ;
· si vous avez une maladie et/ou des troubles pouvant entraîner une hypercalcémie (un excès de calcium dans le sang) et/ou une hypercalciurie (un excès de calcium dans les urines).
Avertissements et précautions
Adressez‑vous à votre médecin, pharmacien ou votre infirmier/ère avant de prendre CHOLECALCIFEROL BIOGARAN.
Afin d'éviter tout surdosage, tenez compte des doses totales de vitamine D en cas d'association avec un traitement contenant déjà cette vitamine ou en cas d'utilisation de lait supplémenté en vitamine D.
En cas d'administration de doses fortes et répétées de vitamine D, il est nécessaire de surveiller le taux de calcium dans le sang et les urines.
Enfants et adolescents
Sans objet.
Autres médicaments et CHOLECALCIFEROL BIOGARAN 100 000 UI, solution buvable en ampoule
Informez votre médecin ou pharmacien si vous prenez, avez récemment pris ou pourriez prendre tout autre médicament.
CHOLECALCIFEROL BIOGARAN 100 000 UI, solution buvable en ampoule avec des aliments et boissons
Sans objet.
Si vous êtes enceinte ou que vous allaitez, si vous pensez être enceinte ou planifiez une grossesse, demandez conseil à votre médecin ou pharmacien avant de prendre ce médicament.
Grossesse
Les données sont limitées sur l’utilisation du cholécalciférol chez la femme enceinte.
Il faut éviter tout surdosage de vitamine D pendant la grossesse, car une hypercalcémie (concentration accrue de calcium dans le sang) prolongée peut provoquer un retard physique et mental, ainsi que des effets néfastes au niveau du cœur et des yeux chez l’enfant à naître.
CHOLECALCIFEROL BIOGARAN n’est pas recommandé chez les femmes enceintes en cas de prévention ou de traitement de la carence en raison de son fort dosage.
Allaitement
La vitamine D passe dans le lait maternel. CHOLECALCIFEROL BIOGARAN n’est pas recommandé chez la femme allaitante en cas de prévention ou de traitement de la carence en raison de son fort dosage.
Demandez conseil à votre médecin ou à votre pharmacien avant de prendre tout médicament.
Conduite de véhicules et utilisation de machines
Les effets sur l’aptitude à conduire des véhicules et à utiliser des machines n’ont pas été étudiés.
CHOLECALCIFEROL BIOGARAN 100 000 UI, solution buvable en ampoule contient
Sans objet.
3. COMMENT PRENDRE CHOLECALCIFEROL BIOGARAN 100 000 UI, solution buvable en ampoule ?
Posologie
Enfant de plus de 2 ans et adolescent
· Prévention de la carence en vitamine D :
Il est préférable d’administrer des doses quotidiennes en gouttes.
Dans le cas où la supplémentation quotidienne n’est pas respectée :
o 1 ampoule deux fois par an (en automne et en hiver) chez les enfants en bonne santé ;
o 1 ampoule tous les trimestres en cas de disponibilité réduite de la vitamine D (obésité, peau pigmentée, absence d’exposition au soleil) ou d’un apport réduit (régime végétalien).
En cas de prescription de CHOLECALCIFEROL BIOGARAN, respectez la posologie indiquée par votre médecin.
Adulte et sujet âgé
· Prévention de la carence en vitamine D :
o 1 ampoule tous les 3 mois.
· Traitement de la carence en vitamine D :
o 1 à 2 ampoules par mois, sans dépasser 600 000 UI par an, soit 6 ampoules par an.
Mode et voie d’administration
Voie orale.
Le contenu de l'ampoule peut être administré pur dans une petite cuillère ou dilué dans un peu d'eau (un léger trouble peut apparaître).
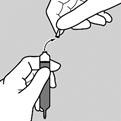
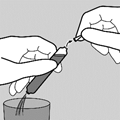
L’ouverture des deux pointes de l’ampoule peut générer des débris de verre. Il est important de ne pas casser les pointes au-dessus du verre contenant le liquide. Suivre les instructions suivantes :
1. Tenir l’ampoule verticalement et casser la pointe supérieure puis s’assurer de l’absence de débris de verre.
2. Retourner ensuite l’ampoule au-dessus d’un verre en la tenant obliquement afin que la deuxième pointe ne soit pas au-dessus du verre. Cassez la deuxième pointe pour permettre au liquide de s’écouler.
Si vous avez pris plus de CHOLECALCIFEROL BIOGARAN 100 000 UI, solution buvable en ampoule que vous n’auriez dû
Les signes cliniques d'un surdosage sont :
· maux de tête, fatigue, perte de l'appétit, amaigrissement, arrêt de la croissance ;
· nausées, vomissements ;
· urines abondantes, soif intense, déshydratation ;
· calcul rénal, calcification des tissus, en particulier du rein et des vaisseaux ;
· insuffisance rénale (défaillance des fonctions du rein).
Les signes biologiques d'un surdosage sont :
· augmentation du taux de calcium dans le sang et les urines et augmentation du taux de phosphore dans le sang et les urines.
En cas de surdosage, il faut arrêter le traitement, boire abondamment, limiter les apports en calcium (laitage) et consulter un médecin.
Si vous oubliez de prendre CHOLECALCIFEROL BIOGARAN 100 000 UI, solution buvable en ampoule
Si vous arrêtez de prendre CHOLECALCIFEROL BIOGARAN 100 000 UI, solution buvable en ampoule
Sans objet.
Si vous avez d’autres questions sur l’utilisation de ce médicament, demandez plus d’informations à votre médecin, à votre pharmacien ou à votre infirmier/ère.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
Les effets indésirables suivants sont rapportés très rarement et notamment en cas de surdosage (voir rubrique 3 « Si vous avez pris plus de CHOLECALCIFEROL BIOGARAN 100 000 Ul, solution buvable en ampoule que vous n'auriez dû ») :
· réaction d'hypersensibilité, hypercalcémie, hypercalciurie, lithiase calcique.
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin, votre pharmacien ou à votre infirmier/ère. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence Nationale de Sécurité du Médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance ‑ Site internet : https://signalement.social-sante.gouv.fr/
En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.
5. COMMENT CONSERVER CHOLECALCIFEROL BIOGARAN 100 000 UI, solution buvable en ampoule ?
Tenir ce médicament hors de la vue et de la portée des enfants.
N'utilisez pas ce médicament après la date de péremption indiquée sur l’emballage. La date de péremption fait référence au dernier jour de ce mois.
Conserver l'ampoule dans l'emballage extérieur.
Ne pas mettre au réfrigérateur et ne pas congeler.
Ne jetez aucun médicament au tout‑à‑l'égout ou avec les ordures ménagères. Demandez à votre pharmacien d'éliminer les médicaments que vous n'utilisez plus. Ces mesures contribueront à protéger l'environnement.
6. CONTENU DE L’EMBALLAGE ET AUTRES INFORMATIONS
Ce que contient CHOLECALCIFEROL BIOGARAN 100 000 UI, solution buvable en ampoule
· La substance active est :
Cholécalciférol (ou vitamine D3)........................................................................................ 2,5 mg
Quantité correspondant à........................................................................................... 100 000 UI
Pour une ampoule de 2 ml.
· Les autres composants sont :
Butylhydroxytoluène, saccharine, acide sorbique, arôme naturel de citron, macrogolglycérides oléiques.
Ce médicament se présente sous forme d’une solution buvable claire, jaunâtre, en ampoule, avec une odeur de citron.
Boîte de 1 ampoule.
Titulaire de l’autorisation de mise sur le marché
15, BOULEVARD CHARLES DE GAULLE
92700 COLOMBES
Exploitant de l’autorisation de mise sur le marché
15, BOULEVARD CHARLES DE GAULLE
92700 COLOMBES
Z.A. EST N°1
60190 ESTREES‑SAINT‑DENIS
Noms du médicament dans les Etats membres de l'Espace Economique Européen
Sans objet.
La dernière date à laquelle cette notice a été révisée est :
[à compléter ultérieurement par le titulaire]
Des informations détaillées sur ce médicament sont disponibles sur le site Internet de l’ANSM (France).