Dernière mise à jour le 30/06/2025
EPINITRIL 15 mg/24 heures, dispositif transdermique
Indications thérapeutiques
EPINITRIL contient un principe actif, la trinitrine qui appartient à un groupe de médicaments nommés les dérivés nitrés. C’est un vasodilatateur utilisé dans les maladies cardiaques.
Les dispositifs transdermiques sont appliqués sur la peau, puis la substance active va constamment passer au travers de la peau, jusque dans votre corps.
EPINITRIL est indiqué comme traitement préventif de la crise d’angor, utilisable seul ou en association avec d’autres traitements anti-angineux.
L’angine de poitrine se caractérise généralement par une douleur ou un resserrement dans la poitrine, bien qu’elle puisse être ressentie dans le cou ou le bras. La douleur survient lorsque le cœur n'est pas suffisamment oxygéné. EPINITRIL n'est pas indiqué pour le traitement des crises aiguës. Pour le traitement des crises aiguës, vous devez utiliser votre comprimé sublingual habituel ou votre spray.
Les dispositifs transdermiques d’EPINITRIL sont pour un usage externe seulement.
Vous devez vous adresser à votre médecin si vous ne ressentez aucune amélioration ou si vous vous sentez moins bien.
Présentations
> 30 sachet(s) papier polyéthylène aluminium P-A-M-éthylène (SURLYN) de 1 dispositif(s)
Code CIP : 358 992-1 ou 34009 358 992 1 7
Déclaration de commercialisation : 16/04/2003
Cette présentation est agréée aux collectivités
- Prix hors honoraire de dispensation : 14,01 €
- Honoraire de dispensation : 1,02 €
- Prix honoraire compris : 15,03 €
- Taux de remboursement :65%
Service médical rendu (SMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprès de la HAS (plus d'informations dans l'aide). Les avis et synthèses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur du SMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| Important | Avis du 27/06/2018 | Renouvellement d'inscription (CT) | Le service médical rendu par EPINITRIL [5 mg/24 h, 10 mg/24 h, 15 mg/24 h], dispositifs transdermiques reste important dans l’indication de l’AMM. |
Amélioration du service médical rendu (ASMR)
Pas d'ASMR disponible pour ce médicament (plus d'informations dans l'aide )
ANSM - Mis à jour le : 22/05/2025
EPINITRIL 15 mg/24 heures, dispositif transdermique
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Un dispositif transdermique contient 47,04 mg/19,12 cm² de trinitrine et délivre 15 mg de trinitrine par 24 heures (0,6 mg/h).
Pour la liste complète des excipients, voir rubrique 6.1.
Dispositif rond, jaune clair et transparent, sur lequel est imprimé le code d’identification (NR15) et recouvert d’un feuillet de protection carré aluminisé et siliconé sur ses deux faces.
4.1. Indications thérapeutiques
4.2. Posologie et mode d'administration
Différents dosages d’EPINITRIL sont disponibles.
Le traitement est initié habituellement avec un dispositif EPINITRIL 5 mg/24 heures appliqué sur la peau, une fois par jour. EPINITRIL 5 mg/24 heures délivre 0,2 mg/heure de trinitrine.
La dose doit être adaptée individuellement au cours du traitement pour obtenir un effet thérapeutique optimal.
La dose quotidienne maximale ne doit pas dépasser 15 mg de trinitrine.
EPINITRIL s’administre de façon discontinue, avec un intervalle libre quotidien sans trinitrine afin d’éviter le développement d’une tolérance aux dérivés nitrés. Cet intervalle libre doit correspondre à une période pendant laquelle le patient ne présente pas de crise. L’horaire de prise du traitement anti-angineux associé (bêta-bloquant et/ou inhibiteur calcique) doit être choisi pour assurer une couverture thérapeutique pendant cet intervalle libre.
L’intervalle libre sans trinitrine doit être observé pendant 8 à 12 heures.
Dans le traitement préventif de la crise d’angor, le développement d’une tolérance aux dérivés nitrés est un phénomène bien établi. Une prescription adaptée respectant un intervalle libre assure l’efficacité thérapeutique des dérivés nitrés.
Les patients souffrant d’angor nocturne tireront profit d’un traitement la nuit, suivi d’un intervalle libre le jour. Chez ces patients, un traitement anti-angineux associé pourra être nécessaire pendant la journée.
Les patients souffrant d’angor sévère peuvent également requérir un traitement anti-angineux associé pendant l’intervalle libre.
Chez le sujet âgé
Aucun ajustement posologique n’est recommandé chez le sujet âgé, dans la mesure où aucune étude n’a été effectuée dans cette population.
Chez l’insuffisant rénal et/ou hépatique
Dans la mesure où aucune étude n’a été effectuée chez les patients présentant une altération de la fonction rénale et/ou hépatique, aucune recommandation posologique ne peut être formulée.
Population pédiatrique
EPINITRIL n’est pas recommandé chez l’enfant et l’adolescent âgé de moins de 18 ans.
Mode d’administration
Chaque dispositif transdermique EPINITRIL est contenu dans un sachet fermé. La face qui colle est recouverte d'un film protecteur qu'il faut retirer avant d'appliquer le dispositif transdermique. Le dispositif transdermique adhère facilement sur la peau et reste bien collé pendant un bain ou l'exercice physique.
Il est recommandé d’appliquer le dispositif transdermique EPINITRIL sur la peau du thorax ou sur la partie supérieure du bras côté externe, en un endroit dépourvu de rougeur ou d’irritation, et d’alterner les zones d’application. Les dispositifs transdermiques successifs ne doivent pas être appliqués sur la même zone de peau, jusqu’à ce que plusieurs jours se soient écoulés.
Si nécessaire, le rasage de la zone d’application pourra être réalisé. Les zones d’application formant des plis ou susceptibles de frottements lors des mouvements doivent être évités.
· Insuffisance circulatoire aiguë associée à une hypotension importante (choc),
· Situations d’hypertension intracrânienne, y compris traumatisme crânien,
· Insuffisance cardiaque obstructive (par exemple, en présence d’une sténose mitrale ou aortique ou d’une péricardite constrictive).
· L’association avec les inhibiteurs de la Phosphodiestérase 5 (PDE5), tel que le sildénafil, est contre-indiquée car les inhibiteurs de la PDE5 augmentent l’action vasodilatatrice d’EPINITRIL, provoquant une hypotension sévère,
· Traitement concomitant par le riociguat, un activateur de la guanylate cyclase soluble,
· Hypotension sévère (pression artérielle systolique inférieure à 90 mmHg),
· Hypovolémie sévère,
· Anémie sévère,
· Œdème pulmonaire toxique.
4.4. Mises en garde spéciales et précautions d'emploi
Comme pour tous les dérivés nitrés, lors du passage d’un traitement au long cours par EPINITRIL à un autre médicament, l’arrêt de la trinitrine doit être fait progressivement et un traitement de remplacement doit être introduit pendant la période d’arrêt de la trinitrine.
Le dispositif transdermique d’EPINITRIL doit être retiré avant l’application de tout champ magnétique ou électrique sur le corps pendant des procédures telles qu’une IRM (Imagerie par Résonance Magnétique), une cardioversion ou une défibrillation par courant continu, ou un traitement diathermique.
En cas d’infarctus du myocarde ou d’insuffisance cardiaque aiguë récents, le traitement par EPINITRIL doit être débuté avec prudence, sous contrôle médical strict et/ou surveillance hémodynamique.
Le retrait du dispositif transdermique doit être considéré comme une partie intégrante de la prise en charge des patients présentant une hypotension importante.
EPINITRIL n’est pas le traitement des crises d’angor aiguës nécessitant un soulagement rapide, de l’angor instable ni de l’infarctus du myocarde.
Le dispositif transdermique doit être retiré en cas de collapsus ou d’état de choc.
Il est conseillé d’augmenter progressivement la dose jusqu’à l’atteinte de l’effet optimal : si la dose initiale utilisée est trop élevée, des maux de tête sévères ou une hypotension peuvent apparaître chez certains patients. La survenue de ces effets indésirables est plus rare lors du passage des dérivés nitrés de la forme injectable à la forme transdermique.
Une tolérance croisée avec d’autres dérivés nitrés est possible.
L'utilisation de produits pour usage topique, en particulier en cas de traitement prolongé, peut conduire à un phénomène de sensibilisation ; dans ce cas, le traitement doit être suspendu et un traitement plus adapté sera mis en place.
Une bradycardie paradoxale et une augmentation de la fréquence de l’angor peuvent survenir chez les patients présentant une hypotension induite par la trinitrine.
EPINITRIL doit être utilisé avec la plus grande prudence chez les patients présentant un risque de glaucome à angle fermé.
Précautions d’emploi
Hypoxémie
Il convient d’être prudent chez les patients présentant une hypoxémie artérielle secondaire à une anémie sévère (y compris dans les formes induites par un déficit en G6PD) car la biotransformation de la trinitrine est réduite chez ces patients.
De même, il faut être prudent chez les patients présentant une hypoxémie et un déséquilibre du rapport ventilation/perfusion dus à une maladie pulmonaire ou à une insuffisance cardiaque ischémique. Chez les patients ayant une hypoventilation alvéolaire, une vasoconstriction intra-pulmonaire se produit afin de dévier la perfusion des zones d’hypoxie alvéolaire vers des régions mieux ventilées du poumon (mécanisme d’Euler– Liljestrand).
Les patients souffrant d’angine de poitrine, d’infarctus du myocarde, ou d’ischémie cérébrale présentent souvent des anomalies des petites voies aériennes (en particulier d’hypoxie alvéolaire). Dans ce cas, une vasoconstriction intra-pulmonaire se produit afin de dévier la perfusion des zones d’hypoxie alvéolaire vers des régions mieux ventilées du poumon. La trinitrine étant un vasodilatateur puissant, elle pourrait inverser cette vasoconstriction protectrice et, par conséquent, se traduire par une perfusion accrue de zones mal ventilées, aggravant le déséquilibre ventilation/perfusion et entraînant une diminution supplémentaire de la pression artérielle partielle en oxygène.
Cardiomyopathie hypertrophique
Un traitement par dérivés nitrés peut aggraver l’angor causé par une cardiomyopathie hypertrophique.
Majoration de l’angor
La fréquence des crises d’angor au cours des périodes de retrait du dispositif transdermique peut augmenter. Dans ces cas, le recours à un traitement anti-angineux supplémentaire est souhaitable.
Tolérance à la trinitrine sublinguale
Lorsqu’une tolérance aux dispositifs transdermiques de trinitrine survient, l’effet de la trinitrine sublinguale sur la tolérance à l’effort peut être partiellement diminué.
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
L'administration simultanée d'EPINITRIL et d'autres vasodilatateurs (ex inhibiteurs de la PDE-5 comme le sildénafil) potentialise l'effet hypotenseur d'EPINITRIL.
L’utilisation d’EPINITRIL avec le riociguat, un activateur de la guanylate cyclase soluble, est contre-indiquée (voir rubrique 4.3), l’utilisation concomitante pouvant provoquer une hypotension.
Associations à prendre en compte
L'administration simultanée d'EPINITRIL et d'inhibiteurs calciques, inhibiteurs de l’enzyme de conversion, bêta-bloquants, diurétiques, anti-hypertenseurs, antidépresseurs tricycliques, neuroleptiques et des principaux psychotropes peut potentialiser l'effet hypotenseur d'EPINITRIL. Il en est de même pour l'alcool.
L'administration simultanée d'EPINITRIL et de dihydroergotamine peut augmenter la biodisponibilité de la dihydroergotamine. Une attention particulière est requise chez les patients présentant une coronaropathie, car la dihydroergotamine s’oppose à l’effet de la trinitrine et peut induire une vasoconstriction coronaire.
Les anti-inflammatoires non stéroïdiens (sauf l’acide acétylsalicylique) peuvent diminuer la réponse thérapeutique à EPINITRIL.
L'administration simultanée d'EPINITRIL et d'amifostine ou d’acide acétylsalicylique peut potentialiser l'effet hypotenseur d'EPINITRIL.
4.6. Fertilité, grossesse et allaitement
Grossesse
Comme tout médicament, EPINITRIL ne doit pas être prescrit pendant la grossesse, en particulier pendant le premier trimestre, sauf s'il y a des raisons impératives de l'utiliser. Le bénéfice pour la mère doit être évalué compte tenu du risque pour l'enfant.
Il y a peu d’informations sur le passage de la substance active dans le lait maternel chez la femme, comme chez l'animal. Lors de l’allaitement, les risques pour l’enfant ne peuvent pas être exclus.
La décision de continuer ou non l’allaitement ou de continuer ou non le traitement par EPINITRIL doit prendre en compte le bénéfice de l’allaitement pour l’enfant et le bénéfice du traitement pour la mère.
Fertilité
Il n’y a pas de donnée sur l’effet d’EPINITRIL sur la fertilité.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
Les effets indésirables du médicament sont listés selon les classes de systèmes d’organes (SOC) du MedDRA. Pour chaque classe, les effets indésirables du médicament sont classés en fonction de leur fréquence, les plus fréquents apparaissant en premier. De plus, au sein de chaque groupe de fréquence, les effets indésirables du médicament sont classés par ordre de gravité décroissante. Enfin, la fréquence des effets indésirables est également donnée selon la classification CIOMS III : très fréquent (≥ 1/10) ; fréquent (≥ 1/100, < 1/10) ; peu fréquent (≥ 1/1 000, < 1/100) ; rare (≥ 1/10 000, < 1/1 000) ; très rare (< 1/10 000), y compris les notifications isolées.
|
Système organe classe |
Très fréquent (≥ 1/10) |
Fréquent (³ 1/100 à < 1/10) |
Peu fréquent (³ 1/1 000 à < 1/100) |
Rare (³ 1/10 000 à < 1/1 000) |
Très rare (< 1/10 000) |
|
Affections du système nerveux central |
|
Céphalées1
|
|
|
Sensations vertigineuses Syncope |
|
Affections cardiaques |
|
|
|
Tachycardie2 |
|
|
Affections vasculaires |
|
|
|
Hypotension orthostatique Bouffées vasomotrices2 |
|
|
Affections gastro-intestinales |
Nausées Vomissements |
|
|
|
|
|
Affections de la peau et du tissu sous-cutané |
|
|
Dermite de contact |
|
|
|
Troubles généraux et anomalies au site d’administration |
|
|
Érythème au site d’application Prurit Brûlure Irritation3 |
|
|
|
Investigations |
|
|
|
Augmentation de la fréquence cardiaque |
|
1 Comme tous les autres dérivés nitrés, EPINITRIL provoque fréquemment des céphalées dépendantes de la dose, dues à la vasodilatation cérébrale. Ces céphalées régressent souvent après quelques jours malgré le maintien du traitement. Si les céphalées persistent pendant le traitement intermittent, il convient de les traiter avec des antalgiques légers. En cas de céphalées ne répondant pas au traitement antalgique, il convient de réduire la posologie de la trinitrine ou d’arrêter le traitement.
2 Une légère augmentation réflexe de la fréquence cardiaque peut être contrôlée, si nécessaire, en associant un bêta-bloquant.
3 Lors du retrait du dispositif transdermique, les légères rougeurs de la peau disparaissent habituellement en quelques heures. Le site d’application doit être changé régulièrement afin d’éviter toute irritation locale.
Les effets indésirables suivants ont été rapportés au cours de l’expérience post-AMM et proviennent de déclarations spontanées et de cas publiés. Ces effets ayant été rapportés volontairement par une population dont la taille n’est pas précisément définie, leur fréquence ne peut être estimée de manière fiable, d’où leur classement dans la catégorie « Fréquence indéterminée ».
· Affections cardiaques : palpitations.
· Affections de la peau et du tissu sous-cutané : rash généralisé.
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr.
Signes
Des doses élevées de trinitrine peuvent entraîner une hypotension sévère et une tachycardie réflexe ou un collapsus et une syncope. Une méthémoglobinémie a également été signalée après un surdosage accidentel.
Prise en charge
L’effet nitré d’EPINITRIL peut être rapidement stoppé en retirant simplement le dispositif transdermique.
L’hypotension ou le collapsus peuvent être maitrisés par l’élévation des jambes du patient ou, si nécessaire, leur bandage compressif.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Mécanisme d’action
La trinitrine, comme les autres dérivés nitrés organiques, est un puissant dilatateur des muscles lisses des vaisseaux.
L’effet sur le système veineux prédomine sur l’effet sur le système artériel, entraînant une diminution de la précharge ventriculaire. La résistance vasculaire générale est relativement peu affectée, la fréquence cardiaque inchangée ou légèrement augmentée et la résistance vasculaire pulmonaire systématiquement diminuée.
5.2. Propriétés pharmacocinétiques
La trinitrine est rapidement hydrolysée par les enzymes hépatiques, qui jouent un rôle important dans sa biodisponibilité. Le pic plasmatique de trinitrine après administration sublinguale est observé dans les 4 minutes et la demi-vie est de 1 à 3 minutes.
Les systèmes transdermiques permettent d’éviter l’effet de premier passage hépatique, d’assurer une absorption progressive de la trinitrine et d’obtenir ainsi un effet prophylactique.
La biodisponibilité systémique de la trinitrine est de l’ordre de 75% à 90% après application du dispositif transdermique. Le principe actif et ses deux métabolites le 1,2-GDN (1,2-glycéryl dinitrate) et le 1,3-GDN (1,3-glycéryl dinitrate) sont détectés dans le plasma 30 à 60 minutes après application du dispositif ; les concentrations plasmatiques à l’état d’équilibre sont constantes entre la 2ème et la 24ème heure ; aucune substance n’est détectable dans le plasma 1 heure après le retrait du dispositif. Après application d’un dispositif transdermique EPINITRIL 15 mg/24 h, les concentrations plasmatiques moyennes de trinitrine, de 1,2-GDN et de 1,3-GDN sont respectivement d’environ 361, 2406 et 430 pg/ml pour EPINITRIL 15 mg/24 heures.
5.3. Données de sécurité préclinique
Chez l’animal, les tests réalisés sur les excipients formant la matrice adhésive ont montré leur bonne tolérance cutanée.
Copolymère acrylate-vinylacétate (Durotak 387-2516), hydroabietyl phtalate (Cellolyn 21 E), polymère de butyltitanate.
Support de l’adhésif
Polypropylène laqué.
3 ans.
6.4. Précautions particulières de conservation
A conserver à une température ne dépassant pas +25°C.
A conserver dans l’emballage extérieur.
6.5. Nature et contenu de l'emballage extérieur
Conditionnement primaire
La face adhésive du dispositif transdermique est recouverte par un feuillet de protection carré aluminisé et siliconé sur ses deux faces, qui est enlevé avant application ; chaque dispositif est contenu dans un sachet hermétique en Surlyn (matériau thermoscellable Aluminium/Polyéthylène/Papier).
Conditionnement secondaire
Etui en carton contenant 15 ou 30 dispositifs transdermiques.
Toutes les tailles de conditionnement peuvent ne pas être commercialisées.
Toutes les présentations peuvent ne pas être commercialisées.
6.6. Précautions particulières d’élimination et de manipulation
Déchirer le sachet au niveau du bord prédécoupé (ne pas utiliser de ciseaux, afin de ne pas endommager le dispositif) et en extraire le dispositif. Le dispositif doit être utilisé immédiatement après ouverture du sachet.
Tenir le dispositif, au niveau de la languette prédétachable. Retirer l’autre partie du feuillet protecteur et la jeter.
Ne pas toucher la partie adhésive du dispositif. Appliquer le dispositif en tenant la partie encore couverte par le feuillet de protection. Retirer la partie restante du feuillet de protection et appuyer fermement sur toute la surface du dispositif pendant environ 10 secondes. Passer le doigt sur les bords afin d’assurer une adhésivité optimale.
Se laver les mains avant et après l’application d’EPINITRIL.
Après utilisation, le dispositif transdermique devra être replié côté adhésif à l’intérieur et jeté.
Tout médicament non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
TOUR HEKLA
52 AVENUE DU GENERAL DE GAULLE
92800 PUTEAUX
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· 34009 358 991 5 6 : dispositif transdermique en sachet (Papier/PE/Aluminium/SURLYN) ; boîte de 15.
· 34009 358 992 1 7 : dispositif transdermique en sachet (Papier/PE/Aluminium/SURLYN) ; boîte de 30.
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
[à compléter ultérieurement par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE
[à compléter ultérieurement par le titulaire]
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Liste II.
ANSM - Mis à jour le : 22/05/2025
EPINITRIL 15 mg/24 heures, dispositif transdermique
Trinitrine
· Gardez cette notice. Vous pourriez avoir besoin de la relire.
· Si vous avez d’autres questions, interrogez votre médecin ou votre pharmacien.
· Ce médicament vous a été personnellement prescrit. Ne le donnez pas à d’autres personnes. Il pourrait leur être nocif, même si les signes de leur maladie sont identiques aux vôtres.
· Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
1. Qu'est-ce que EPINITRIL 15 mg/24 heures, dispositif transdermique et dans quels cas est-il utilisé ?
2. Quelles sont les informations à connaître avant d'utiliser EPINITRIL 15 mg/24 heures, dispositif transdermique ?
3. Comment utiliser EPINITRIL 15 mg/24 heures, dispositif transdermique ?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver EPINITRIL 15 mg/24 heures, dispositif transdermique ?
6. Contenu de l’emballage et autres informations.
1. QU’EST-CE QUE EPINITRIL 15 mg/24 heures, dispositif transdermique ET DANS QUELS CAS EST-IL UTILISE ?
EPINITRIL contient un principe actif, la trinitrine qui appartient à un groupe de médicaments nommés les dérivés nitrés. C’est un vasodilatateur utilisé dans les maladies cardiaques.
Les dispositifs transdermiques sont appliqués sur la peau, puis la substance active va constamment passer au travers de la peau, jusque dans votre corps.
EPINITRIL est indiqué comme traitement préventif de la crise d’angor, utilisable seul ou en association avec d’autres traitements anti-angineux.
L’angine de poitrine se caractérise généralement par une douleur ou un resserrement dans la poitrine, bien qu’elle puisse être ressentie dans le cou ou le bras. La douleur survient lorsque le cœur n'est pas suffisamment oxygéné. EPINITRIL n'est pas indiqué pour le traitement des crises aiguës. Pour le traitement des crises aiguës, vous devez utiliser votre comprimé sublingual habituel ou votre spray.
Les dispositifs transdermiques d’EPINITRIL sont pour un usage externe seulement.
Vous devez vous adresser à votre médecin si vous ne ressentez aucune amélioration ou si vous vous sentez moins bien.
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT D’UTILISER EPINITRIL 15 mg/24 heures, dispositif transdermique ?
N’utilisez jamais EPINITRIL 15 mg/24 heures, dispositif transdermique :
· si vous êtes allergique à la substance active ou une substance dérivée des nitrates ou à l’un des autres composants contenus dans ce médicament, mentionnés dans la rubrique 6.
· si vous présentez ou avez récemment présenté un état de choc avec une pression très basse,
· si vous avez des maux de tête, si vous vomissez ou faites des crises d’épilepsie associées à une augmentation de la pression intracrânienne, y compris celles causées par un traumatisme crânien,
· si vous souffrez d’insuffisance cardiaque due à une obstruction, par exemple en présence d’un rétrécissement de l’orifice aortique ou de l’orifice auriculo-ventriculaire du cœur (respectivement sténose aortique ou sténose mitrale), ou d’un épaississement fibreux de la fine membrane entourant le cœur comme un sac (péricardite constrictive),
· si vous prenez des médicaments destinés au traitement du dysfonctionnement érectile (par exemple, le sildénafil ou un autre inhibiteur de la PDE-5). Les dérivés nitrés ne doivent pas être administrés chez les patients traités par le sildénafil ou d’autres médicaments utilisés pour traiter le dysfonctionnement érectile. Les patients actuellement traités par les dérivés nitrés ne doivent pas prendre de sildénafil ou d’autres médicaments destinés au traitement du dysfonctionnement érectile. L’association d’un dérivé nitré avec le sildénafil ou un autre inhibiteur de la PDE-5 peut entraîner une diminution brutale et très importante de la pression artérielle, qui peut entraîner une syncope, une perte de conscience ou même une crise cardiaque (voir également la rubrique « Utilisation d’autres médicaments »),
· si vous prenez un médicament contenant du riociguat, un activateur de la guanylate cyclase soluble,
· si vous avez une pression artérielle très basse (pression artérielle systolique inférieure à 90 mmHg),
· si vous présentez une baisse importante du volume sanguin dans votre corps, due à une perte de sang ou une perte de liquides organiques (hypovolémie sévère),
· si vous présentez une anémie sévère,
· si vous présentez une rétention liquidienne d’origine toxique dans les poumons (œdème pulmonaire toxique).
Avertissements et précautions
Adressez-vous à votre médecin ou pharmacien avant d’utiliser EPINITRIL 15 mg/24 heures, dispositif transdermique.
· si vous arrêtez le traitement. L’arrêt du traitement par EPINITRIL doit être progressif et celui-ci doit être remplacé par des doses décroissantes de dérivés nitrés oraux à libération prolongée ;
· si vous devez avoir un examen par imagerie résonance magnétique (IRM), si vous devez subir une stimulation électrique de votre cœur pour le rétablissement du rythme cardiaque normal (défibrillation ou cardioversion) ou avant un traitement cardiaque (diathermie). Vous devez retirer EPINITRIL avant de subir ces traitements ;
· si vous êtes ou avez récemment été victime d’une crise cardiaque (infarctus du myocarde) ou si vous ressentez les signes d’une insuffisance cardiaque aiguë tels que souffle coupé, sensation d’extrême fatigue, gonflement des jambes. Votre médecin vous prescrira des analyses pour contrôler vos fonctions cardiovasculaires ;
· si vous présentez une baisse importante de pression artérielle pendant le traitement par EPINITRIL, le dispositif doit être retiré ; de même, si vous êtes en état de choc (collapsus), le dispositif doit être retiré,
· si vous souffrez de douleurs dans la poitrine (crises d’angine de poitrine) ou si votre cœur ne reçoit pas un flux sanguin suffisamment important, ni une quantité d’oxygène suffisante (angor instable) ou si vous faites une crise cardiaque, EPINITRIL n’est pas le traitement adapté de ces pathologies ;
· si vous présentez des maux de tête sévères ou une pression artérielle anormalement basse (hypotension). Cette situation peut survenir si la dose initiale est trop élevée. Il est recommandé d’augmenter la dose progressivement jusqu’à obtenir l’effet optimal ;
· si vous prenez d’autres dérivés nitrés, car votre organisme pourrait développer une résistance aux effets de ces médicaments après une exposition répétée ;
· si vous avez ou avez eu une baisse de pression artérielle importante induite par les dérivés nitrés. Dans ce cas, vous pourriez avoir une diminution du rythme cardiaque (bradycardie paroxystique) et une aggravation de l’angine de poitrine ;
· si vous souffrez d’une maladie du nerf optique (glaucome par fermeture de l’angle) ;
· si l’oxygénation de votre sang est insuffisante (hypoxémie) à cause d’une anémie sévère, d’une maladie pulmonaire ou d’une réduction de l’irrigation du cœur (insuffisance cardiaque ischémique) ;
Ces patients souffrant de ces pathologies montrent aussi souvent une modification du rapport ventilation/perfusion qui est un signe de la fonction respiratoire. Chez ces patients, la trinitrine peut diminuer le rapport ventilation/perfusion et provoquer une diminution de l’oxygénation sanguine ;
· si l’angor est provoqué par un épaississement de votre cœur (cardiomyopathie hypertrophique). Les dérivés nitrés peuvent aggraver ce type d’angine de poitrine ;
· si vous présentez une augmentation de la fréquence des crises d’angor pendant les périodes au cours desquelles vous ne portez pas de dispositif transdermique. Votre médecin pourra réévaluer votre maladie coronarienne et envisager un ajustement du traitement.
· si vous avez un phénomène de sensibilisation de la peau (démangeaison, brûlure, inflammation), le traitement doit être arrêté et il faut consulter votre médecin.
Enfants et adolescents
Sans objet.
Autres médicaments et EPINITRIL 15 mg/24 heures, dispositif transdermique
Informez votre médecin ou pharmacien si vous utilisez, avez récemment utilisé ou pourriez utiliser tout autre médicament.
L’administration simultanée de médicaments destinés au traitement du dysfonctionnement érectile (c’est-à-dire sildénafil et autres inhibiteurs de la PDE-5) accentue la diminution de la pression artérielle induite par les dérivés nitrés, et doit par conséquent être évitée (voir « N’utilisez jamais EPINITRIL »).
La prise simultanée d’EPINITRIL avec le riociguat, un activateur de la guanylate cyclase soluble, est contre-indiquée, l’utilisation concomitante pouvant provoquer une hypotension (voir « N’utilisez jamais EPINITRIL »).
L’administration simultanée :
· avec des médicaments utilisés pour baisser la pression artérielle comme les antagonistes calciques, les inhibiteurs de l’enzyme de conversion (utilisés aussi pour le traitement de l'insuffisance cardiaque), les bêta-bloquants (utilisés dans les arythmies cardiaques), les diurétiques (augmentation de l'élimination de l’eau), les autres antihypertenseurs,
· avec les antidépresseurs tricycliques (médicaments utilisés dans la dépression),
· avec des neuroleptiques (utilisés dans le traitement des psychoses),
· avec la majorité des tranquillisants (sédatifs),
· ainsi qu'avec l'alcool, et avec de l'amifostine (médicament utilisé en chimio et radiothérapie) et
· avec l'acide acétylsalicylique (un AINS),
peuvent potentialiser la diminution de la pression artérielle induite par EPINITRIL.
Le traitement concomitant avec de la dihydroergotamine peut diminuer l’effet d’EPINITRIL.
Les médicaments de la famille des anti-inflammatoires non stéroïdiens (sauf l’acide acétylsalicylique) peuvent diminuer l’effet thérapeutique d’EPINITRIL.
EPINITRIL 15 mg/24 heures, dispositif transdermique avec des aliments, boissons et de l’alcool
Sans objet.
Grossesse, allaitement et fertilité
EPINITRIL ne doit pas être utilisé pendant la grossesse, en particulier dans les 3 premiers mois, sauf si votre médecin vous l'a prescrit.
Les informations connues étant limitées sur le passage de la trinitrine dans le lait maternel, un risque pendant l’allaitement ne peut pas être exclu. Votre médecin évaluera s’il est préférable d’arrêter l’allaitement ou plutôt d’arrêter le traitement par EPINITRIL.
Aucune donnée n’est disponible sur l’effet d’EPINITRIL pour la fertilité humaine.
Si vous êtes enceinte ou que vous allaitez, si vous pensez être enceinte ou planifiez une grossesse, demandez conseil à votre médecin ou pharmacien avant d’utiliser ce médicament.
Conduite de véhicules et utilisation de machines
EPINITRIL peut modifier votre capacité à conduire ou utiliser des machines, particulièrement en début de traitement ou lors des ajustements de doses : il peut diminuer vos réactions ou peut diminuer votre pression sanguine en position debout ou provoquer un malaise voire même dans des cas exceptionnels, un évanouissement après un surdosage.
Si vous remarquez ces effets, vous ne devez pas conduire ou utiliser des machines.
EPINITRIL 15 mg/24 heures, dispositif transdermique contient
Sans objet.
3. COMMENT UTILISER EPINITRIL 15 mg/24 heures, dispositif transdermique ?
Posologie
La dose recommandée est d’un dispositif transdermique EPINITRIL 5 mg/24 heures par jour, appliqué soigneusement sur la peau et conservez-le pendant 12 à 16 heures. Ensuite retirez le dispositif transdermique et laissez un intervalle sans dispositif transdermique de 8 à 12 heures.
Votre médecin peut vous prescrire une dose quotidienne maximale de 15 mg de trinitrine, c’est-à-dire un dispositif transdermique EPINITRIL 15 mg/24 heures une fois par jour.
Fréquence d’administration
Vous devez changer votre dispositif transdermique EPINITRIL conformément aux instructions de votre médecin. Votre médecin vous indiquera combien de temps vous devez garder le dispositif transdermique et la durée de l’intervalle sans dispositif transdermique.
Utilisation chez les enfants et les adolescents
EPINITRIL ne doit pas être utilisé chez l’enfant et chez l’adolescent âgé de moins de 18 ans.
Durée de traitement
Le traitement par EPINITRIL peut être poursuivi pendant plusieurs années, cependant votre médecin devra vous examiner régulièrement afin de décider s’il faut continuer le traitement ou changer votre schéma thérapeutique.
Mode d’administration
Comment mettre en place votre dispositif transdermique
|
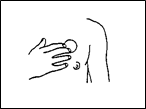
Vous devez appliquer le dispositif transdermique sur une zone de peau sèche et propre, ne présentant aucune lésion, et exempte de toute trace de crème, de produits hydratants ou de talc. Il est recommandé d’appliquer EPINITRIL sur la peau du thorax (voir Figure 1), ou sur la partie supérieure du bras du côté externe, indemne de rougeur ou d’irritation, et d’alterner les sites d’application. Si nécessaire, le rasage du site d’application pourra être réalisé. Les sites d’application formant des plis ou susceptibles de frottements lors des mouvements doivent être évités
Figure 1
|
|||
|
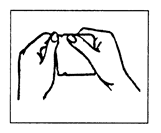
Ne pas appliquer les dispositifs transdermiques consécutivement au même endroit. EPINITRIL doit être appliqué sur la peau dès qu’il a été retiré de son sachet de la façon suivante : 1) Déchirer le sachet au niveau de l’encoche. Ne pas utiliser de ciseaux (voir Figure 2).
Figure 2
|
|||
|
|
|||
|
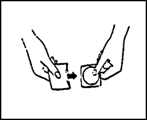
2) Maintenir le dispositif transdermique entre le pouce et l’index au niveau de la languette prédétachable (voir Figure 3).
Figure 3
|
|||
|
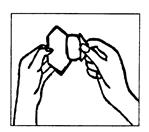
3) Peler le feuillet protecteur avec l’autre main (voir Figure 4). Ne pas toucher la partie adhésive du dispositif transdermique car il perdrait de sa capacité adhésive.
Figure 4
|
|||
|
4) Appliquer la partie ouverte du dispositif transdermique sur la peau, et retirer la partie restante du feuillet protecteur. Appuyer fermement pendant environ 10 secondes sur toute la surface du dispositif transdermique. Passer le doigt sur les bords afin d’assurer une adhésivité optimale. Se laver les mains avant et après l’application d’EPINITRIL. |
Pour retirer un dispositif transdermique, soulever simplement le bord et tirer doucement le dispositif transdermique jusqu’à ce qu’il soit détaché. Après utilisation, plier le dispositif transdermique en deux, côté adhésif à l’intérieur, puis le jeter dans une poubelle hors de portée des enfants.
Si le dispositif transdermique se décolle
Si EPINITRIL est appliqué correctement, il est très peu probable qu’il se décolle. Cependant, si le dispositif transdermique se décolle, remplacez-le par un nouveau dispositif, puis changez à nouveau le dispositif en suivant le rythme normal de votre traitement.
Si vous avez utilisé plus de EPINITRIL 15 mg/24 heures, dispositif transdermique que vous n’auriez dû
Si vous prenez de fortes doses de trinitrine, vous pouvez ressentir une baisse très importante de la pression sanguine, une augmentation du rythme cardiaque ou un état de choc et une perte de connaissance, de même qu’une altération de l’hémoglobine (méthémoglobinémie).
Si vous ou quelqu’un d’autre appliquez trop de dispositifs transdermiques en une seule fois, retirez-les avec précaution et lavez la peau abondamment pour réduire l’absorption. Si vous ressentez une baisse de la pression sanguine ou un état de choc, surélevez les jambes, voire éventuellement faites un bandage compressif des jambes.
Si vous oubliez d’utiliser EPINITRIL 15 mg/24 heures, dispositif transdermique
Si vous arrêtez d’utiliser EPINITRIL 15 mg/24 heures, dispositif transdermique
Lors de l’interruption du traitement par EPINITRIL, vous pourrez présenter une récidive des crises d’angor.
Si vous avez d’autres questions sur l’utilisation de ce médicament, demandez plus d’informations à votre médecin ou à votre pharmacien.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
Les effets indésirables suivants ont été observés :
Effets indésirables très fréquents (survenant chez plus d’un patient sur 10) :
· Nausées,
· Vomissements.
Effets indésirables fréquents (survenant chez plus d’un patient sur 100 et moins de 10 patients sur 100) :
· Maux de tête.
Effets indésirables peu fréquents (survenant chez plus d’un patient sur 1 000 mais moins de 10 patients sur 1 000) :
· Inflammation de la peau (dermatite de contact),
· Rougeur et irritation de la peau au niveau du site d’application,
· Démangeaisons,
· Sensation de brûlure.
Effets indésirables rares (survenant chez plus d’un patient mais moins de 10 patients sur 10 000) :
· Augmentation de la fréquence cardiaque (tachycardie),
· Diminution de la pression sanguine en position debout (hypotension orthostatique), qui peut être décrite comme des épisodes transitoires d'étourdissements,
· Rougeurs,
· Augmentation du rythme cardiaque.
Effets indésirables très rares (survenant chez moins d’un patient sur 10 000) :
· Malaise,
· Perte de conscience (syncope).
Effets indésirables dont la fréquence est indéterminée :
· Battements cardiaques anormaux (palpitations),
· Eruption cutanée généralisée (rash généralisé).
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr.
En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.
5. COMMENT CONSERVER EPINITRIL 15 mg/24 heures, dispositif transdermique ?
Tenir ce médicament hors de la vue et de la portée des enfants.
N’utilisez pas ce médicament après la date de péremption indiquée sur la boite. La date de péremption fait référence au dernier jour de ce mois.
Conditions de conservation
À conserver à une température ne dépassant pas +25°C.
N’utilisez pas ce médicament si vous remarquez des signes visibles de détérioration.
Ne jetez aucun médicament au tout-à-l’égout ou avec les ordures ménagères. Demandez à votre pharmacien d’éliminer les médicaments que vous n’utilisez plus. Ces mesures contribueront à protéger l’environnement.
6. CONTENU DE L’EMBALLAGE ET AUTRES INFORMATIONS
Ce que contient EPINITRIL 15 mg/24 heures, dispositif transdermique
EPINITRIL contient un principe actif la trinitrine et est disponible en 3 dosages.
EPINITRIL 15 mg/24 h contient 47,04 mg de trinitrine et délivre environ 15 mg de trinitrine par jour (0,6 mg par heure) ; la surface de libération du dispositif transdermique est de 19,12 cm².
Le code d’identification imprimée sur la feuille de protection est NR15.
Les autres composants sont : une substance adhésive (copolymère acrylate-vinylacétate), un agent collant (hydroabiétyl phtalate) et un agent réticulé (polymère de butyltitanate). Ils sont appliqués, avec la substance active, sur un support (film de polypropylène laqué). La face adhésive est recouverte par un feuillet de protection aluminisé et siliconé sur les 2 côtés, il est ensuite enlevé avant application.
EPINITRIL 15 mg/24 h est un dispositif transdermique recouvert d’adhésif. Chaque dispositif transdermique est scellé individuellement dans un sachet protecteur.
Boîte de 15 et 30 dispositifs transdermiques.
Titulaire de l’autorisation de mise sur le marché
TOUR HEKLA
52 AVENUE DU GENERAL DE GAULLE
92800 PUTEAUX
Exploitant de l’autorisation de mise sur le marché
LABORATOIRES BOUCHARA-RECORDATI
TOUR HEKLA
52 AVENUE DU GENERAL DE GAULLE
92800 PUTEAUX
DAMASTOWN INDUSTRIAL PARK
MULHUDDART
DUBLIN 15
IRLANDE
OU
LTS LOHMANN THERAPIE SYSTEME AG
LOHMANNSTRASSE 2
56626 ANDERNACH
ALLEMAGNE
Noms du médicament dans les Etats membres de l'Espace Economique Européen
Ce médicament est autorisé dans les Etats membres de l'Espace Economique Européen sous les noms suivants : Conformément à la réglementation en vigueur.
[À compléter ultérieurement par le titulaire]
La dernière date à laquelle cette notice a été révisée est :
[À compléter ultérieurement par le titulaire]
Des informations détaillées sur ce médicament sont disponibles sur le site Internet de l’ANSM (France).