Dernière mise à jour le 01/12/2025
MICROLAX BEBE SORBITOL CITRATE ET LAURILSULFOACETATE DE SODIUM, solution rectale en récipient unidose
Indications thérapeutiques
Classe pharmacothérapeutique : LAVEMENT, code ATC : A06AG11.
Ce médicament est préconisé comme traitement symptomatique de certaines formes de constipation et comme préparation à certains examens (rectoscopie).
Présentations
> 4 récipient(s) unidose(s) polyéthylène de 3,87 g avec canule(s)
Code CIP : 354 454-5 ou 34009 354 454 5 2
Déclaration de commercialisation : 10/09/2002
Cette présentation est agréée aux collectivités
Service médical rendu (SMR)
Pas de SMR disponible pour ce médicament ( plus d'informations dans l'aide )
Amélioration du service médical rendu (ASMR)
Pas d'ASMR disponible pour ce médicament (plus d'informations dans l'aide )
ANSM - Mis à jour le : 06/10/2025
MICROLAX BEBE SORBITOL CITRATE ET LAURILSULFOACETATE DE SODIUM, solution rectale en récipient unidose
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Sorbitol à 70 % cristallisable.............................................................................................. 2,6790 g
Citrate de sodium.............................................................................................................. 0,2700 g
Laurilsulfoacétate de sodium à 70 %................................................................................... 0,0387 g
Pour un récipient unidose.
3,87 g = 3 ml de solution rectale
Excipient(s) à effet notoire : Acide sorbique
Pour la liste complète des excipients, voir rubrique 6.1.
Solution rectale en récipient unidose.
4.1. Indications thérapeutiques
Traitement symptomatique de la constipation basse, notamment par dyschésie rectale.
Préparation aux examens endoscopiques du rectum.
4.2. Posologie et mode d'administration
Traitement symptomatique de la constipation: 1 récipient unidose par jour.
La dose doit être administrée 5 à 20 minutes avant l’effet attendu.
Préparation aux examens endoscopiques du rectum: 1 récipient unidose administré 5 à 20 minutes avant l'heure choisie pour la selle.
L’assistance d’un adulte ou d’un professionnel de santé est nécessaire à l’administration du médicament.
Mode d’administration
Voie rectale.
Casser l'embout.
Introduire toute la longueur de la canule dans le rectum et vider par pression tout le contenu du tube, retirer la canule sans relâcher la pression sur le tube.
· Hypersensibilité aux substances actives ou à l'un des excipients mentionnés à la rubrique 6.1.
· Obstruction intestinale et douleurs abdominales d'étiologie inconnue.
· Traitement concomitant avec de la catiorésine sulfo sodique (voir rubrique 4.5).
· Traitement concomitant avec de la catiorésine sulfo calcique (voir rubrique 4.5).
4.4. Mises en garde spéciales et précautions d'emploi
Une utilisation prolongée est déconseillée. Si les symptômes persistent plus de quelques jours ou s’aggravent, un avis médical est nécessaire.
Le traitement médicamenteux de la constipation n'est qu'un adjuvant au traitement hygiéno-diététique:
· enrichissement de l'alimentation en fibres végétales et en boissons;
· conseils d'activité physique et de rééducation de l'exonération.
Chez l'enfant, la prescription de laxatif doit être exceptionnelle (risque d'entraver le fonctionnement normal du réflexe d'exonération).
Précautions d'emploi
Il est recommandé d'éviter l'emploi de ce médicament dans le cas de poussées hémorroïdaires, de fissures anales ou de recto-colite hémorragique.
Il est recommandé de faire preuve d’une extrême prudence chez des patients atteints de maladies inflammatoires ou ulcéreuses qui affectent le colon ou chez des patients souffrant d’affections gastro-intestinales aiguës.
Ce médicament contient de l’acide sorbique qui peut provoquer des réactions cutanées locales (par exemple dermatite de contact).
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
+ Catiorésine sulfo sodique (voie orale et rectale du sorbitol ou de la résine)
Risque de nécrose colique, éventuellement fatale.
+ Catiorésine sulfo calcique (voie orale et rectale du sorbitol ou de la résine)
Risque de nécrose colique, éventuellement fatale.
Tout autre médicament administré par voie rectale doit être utilisé à distance de MICROLAX BEBE car il peut être éliminé par le tractus gastro-intestinal sans avoir été absorbé.
4.6. Fertilité, grossesse et allaitement
MICROLAX BEBE n'est pas destiné à l'adulte.
Cependant, en cas d'utilisation dans des circonstances exceptionnelles chez les femmes en âge de procréer, il faut rappeler les points suivants :
· Il n’existe pas de données appropriées sur les femmes enceintes et aucune étude clinique bien contrôlée n’a été réalisée chez ces patientes.
· Dans les conditions normales d’utilisation, aucun effet sur la grossesse n’est attendu car l’exposition systémique au produit est probablement limitée.
· Il n’existe aucune donnée permettant de savoir si le sorbitol, le citrate de sodium et le laurilsulfoacétate de sodium sont excrétés dans le lait maternel.
· Dans les conditions normales d’utilisation, aucun effet sur les nouveau-nés/nourrissons allaités n’est attendu car l’exposition systémique au produit est probablement limitée.
· Les études réalisées chez le rat et le lapin (seulement avec le sorbitol) n’ont montré aucun effet sur la fertilité (voir rubrique 5.3).
· En conséquence, l'utilisation de ce médicament ne doit être envisagée au cours de la grossesse et en cas d’allaitement que si nécessaire.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
Le tableau suivant décrit les effets indésirables qui ont été rapportés lors de l’utilisation post-marketing avec le sorbitol, le citrate de sodium et le laurilsulfoacétate de sodium. La fréquence des effets indésirables est définie en utilisant la convention suivante :
· Très fréquent (≥ 1/10)
· Fréquent (≥1/100, < 1/10)
· Peu fréquent (≥ 1/1000, < 1/100)
· Rare (≥ 1/10000, < 1/1000)
· Très rare (< 1/10000)
· Fréquence indéterminée (ne peut être estimée sur la base des données disponibles).
|
Système organe |
Effets indésirables |
|
Fréquence |
|
|
Affections du système immunitaire |
|
|
Fréquence indéterminée |
Réactions d'hypersensibilité (telles que urticaires) |
|
Affections gastro-intestinales |
|
|
Fréquence indéterminée |
Douleurs abdominalesa |
|
|
Inconfort anorectal |
|
|
Selles liquides |
- a : inclut les gênes abdominales, les douleurs abdominales et les douleurs abdominales hautes.
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : www.signalement-sante.gouv.fr.
Aucun cas de surdosage n'a été rapporté lors de l’utilisation post-marketing ou dans la littérature scientifique. Cependant, un usage prolongé peut donner lieu à des sensations de brûlures anales, et exceptionnellement des rectites congestives.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Classe pharmacothérapeutique : LAVEMENT, code ATC : A06AG11 (A: appareil digestif et métabolisme).
Mécanisme d’action
Le citrate de sodium a un effet émollient sur les matières fécales dures lié à sa pénétration dans le bol fécal et au relargage d’eau. Le laurilsulfoacétate de sodium améliore les capacités de mouillage et de pénétration de la solution, et le sorbitol augmente l’effet de relargage d’eau du citrate de sodium.
5.2. Propriétés pharmacocinétiques
Délai d’action : 5 à 20 minutes.
Les substances actives ont probablement une absorption systémique limitée et sont éliminées dans les selles.
Absorption
Citrate de sodium
Il n’existe pas d’étude décrivant l’absorption du citrate de sodium en cas d’administration par voie rectale chez l’homme.
Laurilsulfoacétate de sodium
Il n’existe pas d’étude décrivant l’absorption du laurilsulfoacétate de sodium en cas d’administration par voie rectale chez l’homme.
Sorbitol
Le sorbitol est faiblement absorbé par le tractus gastrointestinal en cas d’administration par voie rectale.
Distribution
Il n’existe pas d’étude décrivant la distribution du citrate de sodium, du laurilsulfoacétate de sodium et du sorbitol en cas d’administration par voie rectale chez l’homme.
Biotransformation
Il n’existe pas d’étude décrivant la biotransformation du citrate de sodium, du laurilsulfoacétate de sodium et du sorbitol en cas d’administration par voie rectale chez l’homme.
Élimination
Le citrate de sodium, le laurilsulfoacétate de sodium et le sorbitol sont principalement éliminés dans les fèces.
5.3. Données de sécurité préclinique
Les données disponibles dans la littérature ont montré que les substances actives présentaient généralement une faible toxicité dans les études par administration répétée par voie orale.
Aucun effet indésirable n’a été signalé pour le citrate de sodium au cours des études de toxicité par administration répétée de doses allant jusqu’à 1 500 mg/kg/jour. L’étude de toxicité par administration répétée de laurilsulfoacétate de sodium chez le rat n’a révélé aucun signe de toxicité systémique pour des doses allant jusqu’à 75 mg/kg/jour. Des études de toxicité par administration répétée réalisées chez le rat ont démontré que le sorbitol était bien toléré.
Le citrate de sodium et le sorbitol n’ont présenté aucun effet génotoxique lors des essais in vitro et in vivo. Le laurilsulfoacétate de sodium n’a présenté aucun effet génotoxique lors des essais in vitro.
Le citrate de sodium et le laurilsulfoacétate de sodium n’ont eu aucun effet cancérogène chez le rat. Selon des études alimentaires à long terme menées chez le rat, le sorbitol n’a eu aucun effet cancérogène.
Le citrate de sodium n’a pas entrainé d’effet tératogène chez le rat. Aucun effet tératogène n’a été signalé suite à l’administration orale de 1 000 mg/kg/jour de laurilsulfoacétate de sodium chez le rat. Le sorbitol n’a pas entrainé d’effet tératogène chez le lapin et chez le rat après incorporation dans la nourriture (jusqu’à 20% de sorbitol).
Le traitement par du citrate de sodium par voie orale n’a présenté aucun effet reprotoxique chez le rat. Lors d’une étude de toxicité pour la reproduction et pour le développement réalisée chez le rat, aucun effet sur la croissance, la fertilité et la capacité de reproduction n’a été observé après administration orale de doses de laurilsulfoacétate de sodium allant jusqu’à 1 000 mg/kg/jour. Au cours d’études non-cliniques menées chez le rat soumis à une exposition alimentaire au sorbitol, aucun effet lié au traitement n’a été signalé en termes de capacité d’accouplement, de grossesse, de capacité de reproduction, de nouveau-nés ou d’histopathologie.
Acide sorbique, glycérol, eau purifiée.
3 ans.
6.4. Précautions particulières de conservation
A conserver à une température ne dépassant pas 25°C.
6.5. Nature et contenu de l'emballage extérieur
3,87 g en récipient unidose (PE) avec canule (PE). Boîte de 4, 6, 50 ou 200.
Toutes les présentations peuvent ne pas être commercialisées.
6.6. Précautions particulières d’élimination et de manipulation
Tout médicament non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
41 rue Camille Desmoulins
92130 ISSY-LES-MOULINEAUX
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· 34009 354 454 5 2 : 3,87 g de solution rectale en récipient unidose (PE) avec canule (PE). Boîte de 4.
· 34009 321 174 3 7 : 3,87 g de solution rectale en récipient unidose (PE) avec canule (PE). Boîte de 6.
· 34009 562 071 8 3 : 3,87 g de solution rectale en récipient unidose (PE) avec canule (PE). Boîte de 50.
· 34009 560 185 6 7 : 3,87 g de solution rectale en récipient unidose (PE) avec canule (PE). Boîte de 200.
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
[à compléter ultérieurement par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE
[à compléter ultérieurement par le titulaire]
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Médicament non soumis à prescription médicale.
ANSM - Mis à jour le : 06/10/2025
Sorbitol à 70% cristallisable, citrate de sodium, laurilsulfoacétate de sodium à 70%
Vous devez toujours utiliser ce médicament en suivant scrupuleusement les informations fournies dans cette notice ou par votre médecin ou votre pharmacien.
· Gardez cette notice. Vous pourriez avoir besoin de la relire.
· Adressez-vous à votre pharmacien pour tout conseil ou information.
· Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
· Vous devez vous adresser à votre médecin si vous ne ressentez aucune amélioration ou si vous vous sentez moins bien après quelques jours.
1. Qu'est-ce que MICROLAX BEBE SORBITOL CITRATE ET LAURILSULFOACETATE DE SODIUM, solution rectale en récipient unidose et dans quels cas est-il utilisé ?
2. Quelles sont les informations à connaître avant d'utiliser MICROLAX BEBE SORBITOL CITRATE ET LAURILSULFOACETATE DE SODIUM, solution rectale en récipient unidose ?
3. Comment utiliser MICROLAX BEBE SORBITOL CITRATE ET LAURILSULFOACETATE DE SODIUM, solution rectale en récipient unidose ?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver MICROLAX BEBE SORBITOL CITRATE ET LAURILSULFOACETATE DE SODIUM, solution rectale en récipient unidose ?
6. Contenu de l’emballage et autres informations.
1. QU’EST-CE QUE MICROLAX BEBE SORBITOL CITRATE ET LAURILSULFOACETATE DE SODIUM, solution rectale en récipient unidose ET DANS QUELS CAS EST-IL UTILISE ?
Classe pharmacothérapeutique : LAVEMENT, code ATC : A06AG11.
Ce médicament est préconisé comme traitement symptomatique de certaines formes de constipation et comme préparation à certains examens (rectoscopie).
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT D’UTILISER MICROLAX BEBE SORBITOL CITRATE ET LAURILSULFOACETATE DE SODIUM, solution rectale en récipient unidose ?
· si votre enfant est allergique à l’une des substances actives (le sorbitol, le citrate de sodium ou le laurilsulfoacétate de sodium) ou à l’un des autres composants contenus dans ce médicament, mentionnés dans la rubrique 6.
· si votre enfant souffre de douleurs abdominales dont la cause est inconnue.
· si votre enfant prend de la catiorésine sulfo sodique ou de la catiorésine sulfo calcique (administrée par voie orale ou rectale), médicaments pour traiter l’hyperkaliémie (fort taux de potassium dans le sang).
Avertissements et précautions
Adressez-vous à votre médecin ou pharmacien avant d’utiliser MICROLAX BEBE SORBITOL CITRATE ET LAURILSULFOACETATE DE SODIUM, solution rectale en récipient unidose.
Mises en garde spéciales
PAS D'UTILISATION PROLONGEE SANS AVIS MEDICAL
Constipation occasionnelle
Elle peut être liée à une modification récente du mode de vie (voyage). Le médicament peut être une aide en traitement court. Toute constipation récente inexpliquée par le changement de mode de vie, toute constipation accompagnée de douleurs, de fièvre, de gonflement du ventre doit faire demander l'avis du médecin.
Constipation chronique (constipation de longue durée)
Elle peut être liée à deux causes :
· soit une maladie de l'intestin qui nécessite une prise en charge par le médecin,
· soit à un déséquilibre de la fonction intestinale dû aux habitudes alimentaires et au mode de vie.
Le traitement comporte entre autres :
· une augmentation des apports alimentaires en produits d'origine végétale (légumes verts, crudités, pain complet, fruits...) ;
· une augmentation de la consommation d'eau et de jus de fruits ;
· une augmentation des activités physiques (sport, marche...) ;
· une rééducation du réflexe de défécation ;
· parfois, l'adjonction de son à l'alimentation.
Il est utile de prendre conseil auprès de votre médecin ou de votre pharmacien.
Précautions d'emploi
Vous ne devez pas utiliser ce médicament sans demander l'avis de votre médecin si votre enfant est dans un des cas suivants :
· crise hémorroïdaire,
· fissure anale (lésion située au niveau de l'anus plus ou moins douloureuse pendant le passage des selles et persistant pendant plusieurs heures),
· maladie de Crohn ou rectocolite hémorragique (maladies avec une inflammation du rectum et du gros intestin se manifestant par des douleurs au ventre, des diarrhées avec des glaires, du sang et souvent de la fatigue).
Autres médicaments et MICROLAX BEBE SORBITOL CITRATE ET LAURILSULFOACETATE DE SODIUM, solution rectale en récipient unidose
MICROLAX BEBE est contre-indiqué en association avec la catiorésine sulfo sodique ou de la catiorésine sulfo calcique (voie orale et rectale).
Vous devez utiliser tout autre médicament administré par voie rectale à distance de MICROLAX BEBE car il peut être éliminé par le tractus gastro-intestinal sans avoir été absorbé.
Informez votre médecin ou pharmacien si vous utilisez, avez récemment utilisé ou pourriez utiliser tout autre médicament.
MICROLAX BEBE SORBITOL CITRATE ET LAURILSULFOACETATE DE SODIUM, solution rectale en récipient unidose avec des aliments et des boissons
Sans objet.
MICROLAX BEBE n’est pas destiné à l’adulte.
Cependant, en cas d’utilisation dans des circonstances exceptionnelles chez les femmes en âge de procréer, il faut rappeler les points suivants :
Si vous êtes enceinte ou que vous allaitez, si vous pensez être enceinte ou planifiez une grossesse, demandez conseil à votre médecin ou pharmacien avant de prendre ce médicament.
Conduite de véhicules et utilisation de machines
Ce médicament n’a aucun effet ou un effet négligeable sur l’aptitude à conduire des véhicules et à utiliser des machines.
MICROLAX BEBE SORBITOL CITRATE ET LAURILSULFOACETATE DE SODIUM, solution rectale contient de l’acide sorbique qui peut provoquer des réactions cutanées locales (par exemple dermatite de contact).
3. COMMENT UTILISER MICROLAX BEBE SORBITOL CITRATE ET LAURILSULFOACETATE DE SODIUM, solution rectale en récipient unidose ?
Posologie
Traitement de la constipation : 1 récipient unidose par jour.
Préparation aux examens endoscopiques du rectum: 1 récipient unidose administré 5 à 20 minutes avant l'heure choisie pour la selle.
Mode d'administration
Ce médicament s'administre par voie rectale. Il n'est pas nécessaire d'être allongé pour administrer le produit ni pour attendre qu'il produise son effet.
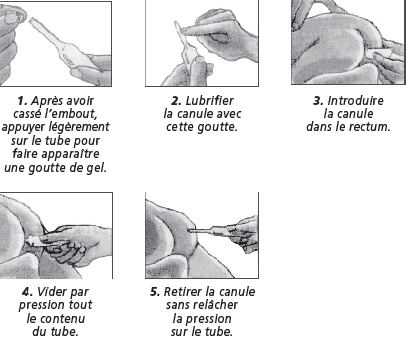
Ce médicament agit le plus souvent en 5 à 20 minutes.
Un délai plus important (supérieur à 1 heure) peut s'observer chez les sujets restant allongés durant une longue période.
Durée du traitement
Ne pas utiliser ce médicament plus de quelques jours sans avoir demandé l'avis de votre médecin.
Si vous avez utilisé plus de MICROLAX BEBE SORBITOL CITRATE ET LAURILSULFOACETATE DE SODIUM, solution rectale en récipient unidose que vous n’auriez dû
Un usage prolongé peut donner lieu à des sensations de brûlures anales, et exceptionnellement des rectites congestives.
Si vous oubliez d’utiliser MICROLAX BEBE SORBITOL CITRATE ET LAURILSULFOACETATE DE SODIUM, solution rectale en récipient unidose
Ne prenez pas de dose double pour compenser la dose que vous avez oubliée de prendre.
Si vous arrêtez d’utiliser MICROLAX BEBE SORBITOL CITRATE ET LAURILSULFOACETATE DE SODIUM, solution rectale en récipient unidose
Sans objet.
Si vous avez d’autres questions sur l’utilisation de ce médicament, demandez plus d’informations à votre médecin ou à votre pharmacien.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
Les effets indésirables suivants ont été rapportés avec une fréquence inconnue :
· Douleurs abdominales
· Gêne au niveau de l’anus et/ou du rectum
· Selles liquides
· Réactions allergiques (urticaires)
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet: www.signalement-sante.gouv.fr
En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.
5. COMMENT CONSERVER MICROLAX BEBE SORBITOL CITRATE ET LAURILSULFOACETATE DE SODIUM, solution rectale en récipient unidose ?
Tenir ce médicament hors de la vue et de la portée des enfants.
A conserver à une température ne dépassant pas 25°C.
Ne jetez aucun médicament au tout-à-l’égout ou avec les ordures ménagères. Demandez à votre pharmacien d’éliminer les médicaments que vous n’utilisez plus. Ces mesures contribueront à protéger l’environnement.
6. CONTENU DE L’EMBALLAGE ET AUTRES INFORMATIONS
· Les substances actives sont :
Sorbitol à 70 % cristallisable........................................................................................ 2,6790 g
Citrate de sodium........................................................................................................ 0,2700 g
Laurilsulfoacétate de sodium à 70 %............................................................................. 0,0387 g
Pour un récipient unidose.
· Les autres composants sont : acide sorbique, glycérol, eau purifiée.
Ce médicament se présente sous forme de solution rectale en récipient unidose (PE).
La solution rectale est une solution visqueuse et incolore, comportant des petites bulles d’air en récipient unidose.
Boîte de 4, 6, 50 ou 200 récipients unidoses.
Toutes les présentations peuvent ne pas être commercialisées.
Titulaire de l’autorisation de mise sur le marché
41 rue Camille Desmoulins
92130 ISSY-LES-MOULINEAUX
Exploitant de l’autorisation de mise sur le marché
41 RUE CAMILLE DESMOULINS
91230 ISSY-LES-MOULINEAUX
5, AVENUE DE CONCYR
45071 ORLEANS CEDEX 2
Noms du médicament dans les Etats membres de l'Espace Economique Européen
Sans objet.
La dernière date à laquelle cette notice a été révisée est :
[à compléter ultérieurement par le titulaire]
Des informations détaillées sur ce médicament sont disponibles sur le site Internet de l’ANSM (France).