Dernière mise à jour le 02/02/2026
ENSTILAR 50 microgrammes/0,5 mg/g, mousse cutanée
Indications thérapeutiques
ENSTILAR est à utiliser sur la peau pour traiter le psoriasis vulgaire chez l’adulte. Le psoriasis est dû à une production trop rapide des cellules de votre peau. Ceci entraîne rougeur, desquamation et épaississement de la peau.
ENSTILAR contient du calcipotriol et de la bétaméthasone. Le calcipotriol aide à ramener la vitesse de croissance des cellules de la peau à la normale et la bétaméthasone aide à réduire l'inflammation.
Présentations
> 1 flacon(s) pressurisé(s) aluminium de 60 g
Code CIP : 34009 300 749 8 5
Déclaration de commercialisation : 17/03/2018
Cette présentation est agréée aux collectivités
- Prix hors honoraire de dispensation : 33,91 €
- Honoraire de dispensation : 1,02 €
- Prix honoraire compris : 34,93 €
- Taux de remboursement :65%
> 2 flacon(s) pressurisé(s) aluminium de 60 g
Code CIP : 34009 300 749 9 2
Déclaration de commercialisation : 24/07/2021
Cette présentation est agréée aux collectivités
- Prix hors honoraire de dispensation : 67,41 €
- Honoraire de dispensation : 1,02 €
- Prix honoraire compris : 68,43 €
- Taux de remboursement :65 %
Service médical rendu (SMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprès de la HAS (plus d'informations dans l'aide). Les avis et synthèses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur du SMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| Important | Avis du 07/04/2021 | Inscription (CT) | Le service médical rendu par ENSTILAR (calcipotriol, bétaméthasone) 50 µg/0,5 mg/g, mousse cutanée est important dans l’indication de l’AMM. |
| Important | Avis du 25/10/2017 | Inscription (CT) | Le service médical rendu par ENSTILAR est important dans l’indication de l’AMM. |
Amélioration du service médical rendu (ASMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprés de la HAS (plus d'informations dans l'aide). Les avis et synthéses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur de l'ASMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| V (Inexistant) | Avis du 07/04/2021 | Inscription (CT) | Cette spécialité est un complément de gamme qui n’apporte pas d’amélioration du service médical rendu (ASMR V) par rapport à la présentation déjà inscrite. |
| IV (Mineur) | Avis du 25/10/2017 | Inscription (CT) | Compte-tenu : • des données disponibles qui démontrent la supériorité de l’association calcipotriol/bétaméthasone sous forme mousse versus cette même association sous les formes pommades et gel, sur un critère de jugement clinique • et au regard de la quantité d’effet supplémentaire modeste sur le pourcentage de succès selon le score IGA, de l’ordre de 10 à 15 % selon la forme, ENSTILAR apporte une amélioration du service médical rendu mineure (ASMR IV) par rapport à la stratégie thérapeutique qui comprend les comparateurs cliniquement pertinents (à savoir DAIVOBET gel, DAIVOBET pommade et XAMIOL gel). |
ANSM - Mis à jour le : 07/05/2024
ENSTILAR 50 microgrammes/0,5 mg/g, mousse cutanée
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Sous forme de calcipotriol monohydrate
Bétaméthasone..................................................................................................................... 0,5 mg
Sous forme de dipropionate de bétaméthasone
Pour 1 g de mousse cutanée.
Excipient à effet notoire : 1 g de mousse cutanée contient 50 microgrammes de butylhydroxytoluène (E321).
Pour la liste complète des excipients, voir rubrique 6.1.
Après pulvérisation, une mousse blanche à blanchâtre se forme.
La mousse a l’apparence d’une mousse non expansible qui se rétracte progressivement après pulvérisation.
4.1. Indications thérapeutiques
Traitement topique du psoriasis vulgaire chez les adultes.
4.2. Posologie et mode d'administration
Traitement des poussées
ENSTILAR doit être appliqué une fois par jour sur les lésions. La durée de traitement recommandée est de 4 semaines. Après cette période, s’il est nécessaire de continuer ou de reprendre le traitement, celui‑ci doit être poursuivi après avis médical et sous surveillance régulière.
Traitement d’entretien à long terme
Un traitement d’entretien à long terme peut être envisagé chez les patients ayant répondu à un traitement de 4 semaines par ENSTILAR une fois par jour. ENSTILAR doit être appliqué deux fois par semaine sur deux jours non consécutifs sur les zones précédemment affectées par le psoriasis vulgaire. Les applications doivent être espacées de 2 à 3 jours sans traitement par ENSTILAR.
En présence de signes de rechute, le traitement des poussées tel que décrit ci-dessus doit être réinstauré.
Dose maximale
La dose maximale journalière d’ENSTILAR ne doit pas dépasser 15 g. Cela signifie qu’un flacon de 60 g doit durer pendant au moins 4 jours de traitement. 15 g correspondent à la quantité délivrée par le flacon si on appuie en continu sur le bec diffuseur pendant environ 1 minute.
Une application de deux secondes délivre approximativement 0,5 g. Pour information, 0,5 g de mousse doit couvrir une surface de peau correspondant à peu près à la main d’un adulte.
En cas d’utilisation d’autres produits topiques contenant du calcipotriol en plus d’ENSTILAR, la dose totale de produits contenant du calcipotriol ne doit pas dépasser 15 g par jour.
La surface corporelle totale traitée ne doit pas dépasser 30 %.
Populations particulières
Insuffisance rénale et hépatique
La sécurité et l’efficacité d’ENSTILAR chez des patients atteints d’une insuffisance rénale sévère ou de troubles hépatiques sévères n'ont pas été évaluées.
Population pédiatrique
La sécurité et l’efficacité d’ENSTILAR chez les enfants âgés de moins de 18 ans n’ont pas été établies.
Les données actuellement disponibles chez les enfants âgés de 12 à 17 ans sont décrites aux rubriques 4.8 et 5.1 mais aucune recommandation sur la posologie ne peut être faite.
Mode d’administration
Voie cutanée.
Le flacon doit être agité pendant quelques secondes avant utilisation. ENSTILAR doit être appliqué par pulvérisation en maintenant le flacon à au moins 3 cm de la peau. La mousse peut être pulvérisée en maintenant le flacon dans n’importe quelle orientation sauf horizontalement.
ENSTILAR doit être pulvérisé directement sur les lésions de psoriasis puis massé délicatement.
Si utilisé sur le cuir chevelu, ENSTILAR doit être pulvérisé dans la paume de la main, puis appliqué sur les lésions du cuir chevelu avec le bout des doigts. Les instructions de lavage des cheveux sont fournies dans la notice.
Les mains doivent être lavées après avoir utilisé ENSTILAR (sauf si ENSTILAR est utilisé pour traiter les mains) pour éviter tout transfert accidentel sur d’autres parties du corps ainsi qu’une absorption non souhaitée du médicament au niveau des mains. L’application sous pansement occlusif doit être évitée car elle augmente l'absorption systémique des corticoïdes. Il est recommandé de ne pas prendre de douche ni de bain immédiatement après l’application d’ENSTILAR. Laissez la mousse en contact avec le cuir chevelu et/ou la peau pendant la nuit ou la journée.
Hypersensibilité aux substances actives ou à l’un des excipients mentionnés à la rubrique 6.1.
ENSTILAR est contre-indiqué en cas de psoriasis érythrodermique et pustuleux.
En raison de la présence de calcipotriol, ENSTILAR est contre-indiqué chez les patients ayant des antécédents de troubles du métabolisme calcique (voir rubrique 4.4).
En raison de la présence de corticoïde, ENSTILAR est contre-indiqué dans les cas suivants s’ils affectent la zone de traitement : lésions de la peau d’origine virale (par exemple herpès ou varicelle), infections cutanées d’origine fongique ou bactérienne, infections parasitaires, atteinte cutanée en relation avec une tuberculose, dermatite péri-orale, atrophie de la peau, vergetures, fragilité du réseau veineux, ichtyose, acné vulgaire, acné rosacée, rosacée, ulcères et plaies (voir rubrique 4.4).
4.4. Mises en garde spéciales et précautions d'emploi
Effets sur le système endocrinien
Des effets indésirables observés avec un traitement systémique par corticoïde, comme le freinage de l’axe hypothalamo-hypophysaire ou une détérioration de l’équilibre d’un diabète sucré, peuvent également se produire lors d’un traitement topique par corticoïde en raison de son absorption systémique. L’application sous pansement occlusif doit être évitée car elle augmente l'absorption systémique des corticoïdes.
L’application sur de larges surfaces de peau lésée, sur les muqueuses ou dans les plis doit être évitée car elle augmente l’absorption systémique des corticoïdes (voir rubrique 4.8).
Troubles visuels
Des troubles visuels peuvent apparaitre lors d'une corticothérapie par voie systémique ou locale. En cas de vision floue ou d'apparition de tout autre symptôme visuel apparaissant au cours d'une corticothérapie, un examen ophtalmologique est requis à la recherche notamment d'une cataracte, d'un glaucome, ou d'une lésion plus rare telle qu'une choriorétinopathie séreuse centrale, décrits avec l'administration de corticostéroïdes par voie systémique ou locale.
Effets sur le métabolisme calcique
En raison de la présence du calcipotriol dans ENSTILAR, une hypercalcémie peut survenir. La calcémie se normalise à l’arrêt du traitement. Le risque d’hypercalcémie est minime quand la dose journalière maximale d’ENSTILAR (15 g) n’est pas dépassée (voir rubrique 4.2).
Effets indésirables locaux
ENSTILAR contient un corticoïde du groupe fort de classe III et l’utilisation simultanée d'autres corticoïdes sur la même zone de traitement doit être évitée.
La peau du visage et de la région génitale est très sensible aux corticoïdes. Le produit ne doit pas être utilisé sur ces zones.
Le patient doit être formé à l'utilisation correcte du produit afin d’éviter l’application et le transfert accidentel sur le visage, la bouche et les yeux. Les mains doivent être lavées après chaque application afin d’éviter tout transfert accidentel sur ces zones ainsi qu’une absorption non souhaitée du médicament au niveau des mains.
Infections cutanées concomitantes
Si les lésions se surinfectent, elles doivent être traitées par un traitement antimicrobien.
Cependant, si l’infection s’aggrave, le traitement par corticoïdes doit être arrêté (voir rubrique 4.3).
Arrêt du traitement
Le traitement du psoriasis par corticoïdes topiques présente un risque d’effet rebond à l’arrêt du traitement. La surveillance médicale doit donc être poursuivie après l’arrêt du traitement.
Traitement au long cours
L’utilisation de corticoïdes au long cours peut augmenter le risque de survenue d'effets indésirables locaux et systémiques. Le traitement doit être arrêté en cas d’effets indésirables liés à l'utilisation de corticoïdes au long cours (voir rubrique 4.8).
Utilisation non évaluée
Il n’existe pas de données concernant l’utilisation d’ENSTILAR dans le psoriasis en gouttes.
Effets indésirables liés aux excipients
ENSTILAR contient du butylhydroxytoluène (E321) qui peut provoquer des réactions cutanées locales (par exemple : dermatite de contact), ou une irritation des yeux et des muqueuses.
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
Aucune étude d’interaction n’a été réalisée avec ENSTILAR.
4.6. Fertilité, grossesse et allaitement
Grossesse
Il n'existe pas de données suffisamment pertinentes concernant l'utilisation d’ENSTILAR chez la femme enceinte. Les études chez l’animal après administration orale de calcipotriol n’ont pas mis en évidence d’effets tératogènes, bien qu’une toxicité sur la reproduction ait été mise en évidence (voir rubrique 5.3). Les études menées chez l’animal avec des glucocorticoïdes ont mis en évidence une toxicité sur la reproduction (voir rubrique 5.3), mais un certain nombre d'études épidémiologiques (moins de 300 grossesses) n'a pas montré d’anomalies congénitales chez les enfants nés de mères traitées par corticoïdes pendant la grossesse. Le risque potentiel pour l’Homme n’est pas connu de façon sure. En conséquence, ENSTILAR ne doit être utilisé au cours de la grossesse que lorsque le bénéfice potentiel justifie le risque potentiel.
Allaitement
La bétaméthasone passe dans le lait maternel, mais le risque d'observer un effet indésirable chez le nourrisson est très faible aux doses thérapeutiques. Il n’existe pas de données sur l'excrétion du calcipotriol dans le lait maternel. La prudence s’impose en cas de prescription d’ENSTILAR chez la femme qui allaite. La patiente devra être informée de ne pas utiliser ENSTILAR sur les seins pendant l’allaitement.
Fertilité
Les études chez le rat après administration orale de calcipotriol ou de dipropionate de bétaméthasone n'ont démontré aucune altération de fertilité chez le mâle et la femelle (voir rubrique 5.3). Il n’existe pas de données sur la fertilité humaine.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
L’estimation de la fréquence des effets indésirables repose sur l’analyse cumulée des données issues des études cliniques.
Les effets indésirables les plus fréquemment rapportés au cours du traitement sont les réactions au site d’application.
Les effets indésirables sont présentés par classe de système-organe MedDRA (SOC), et les effets indésirables individuels sont présentés au sein de chaque SOC par ordre décroissant de fréquence. Dans chaque catégorie de fréquence, les effets indésirables sont présentés par ordre décroissant de gravité.
Très fréquent (≥ 1/10)
Fréquent (≥ 1/100 et < 1/10)
Peu fréquent (≥1/1 000 et < 1/100)
Rare (≥ 1/10 000 et < 1/1 000)
Très rare (< 1/10 000)
Fréquence indéterminée (ne peut être estimée sur la base des données disponibles)
|
Infections et infestations |
|
|
Peu fréquent (≥ 1/1 000 et < 1/100) |
Folliculite |
|
Affections du système immunitaire |
|
|
Peu fréquent (≥ 1/1 000 et < 1/100) |
Hypersensibilité |
|
Trouble du métabolisme et de la nutrition |
|
|
Peu fréquent (≥ 1/1 000 et < 1/100) |
Hypercalcémie* |
|
Affections oculaires |
|
|
Fréquence indéterminée |
Vision floue** |
|
Affections de la peau et du tissu sous-cutané |
|
|
Peu fréquent (≥ 1/1 000 et < 1/100) |
Hypopigmentation de la peau |
|
Fréquence indéterminée |
Modification de la couleur des cheveux*** |
|
Troubles généraux et anomalies au site d’administration |
|
|
Peu fréquent (≥ 1/1 000 et < 1/100) |
Effet rebond |
|
Prurit au site d’application |
|
|
Irritation au site d’application |
|
|
Douleur au site d’application**** |
|
|
Fréquence indéterminée |
Erythème au site d’application***** |
* Une hypercalcémie modérée a été observée.
** Voir rubrique 4.4.
*** Une coloration transitoire jaunâtre des cheveux blancs ou gris au niveau du site d’application du cuir chevelu a été rapportée avec les produits associant calcipotriol et bétaméthasone.
**** Les brûlures au site d’application sont incluses dans les douleurs au site d’application.
***** Déclaré depuis la mise sur le marché du produit.
Population pédiatrique
Aucune différence cliniquement significative sur le profil de tolérance n’a été observée entre les adultes et les adolescents. Un total de 106 adolescents a été traité au cours d’un essai clinique en ouvert. Voir la rubrique 5.1 pour plus de détails concernant cet essai.
Les effets indésirables suivants, considérés comme liés à la classe pharmacologique du calcipotriol et de la bétaméthasone, sont respectivement :
Calcipotriol
Les effets indésirables incluent réactions au site d'application, prurit, irritation cutanée, sensation de brûlure et de picotement, sècheresse de la peau, érythème, éruption cutanée, dermatite, aggravation du psoriasis, photosensibilité et réactions d'hypersensibilité incluant de très rares cas d'angio-œdème et d'œdème de la face.
Des effets systémiques après utilisation topique peuvent se produire très rarement et provoquer une hypercalcémie ou une hypercalciurie (voir rubrique 4.4).
Bétaméthasone (sous forme dipropionate)
Des réactions locales peuvent se produire après utilisation topique, surtout en cas d’utilisation au long cours, notamment atrophie de la peau, télangiectasies, vergetures, folliculite, hypertrichose, dermatite péri-orale, eczéma de contact, dépigmentation et colloïd milium.
Lors du traitement du psoriasis avec des corticoïdes topiques, il peut exister un risque de développer un psoriasis pustuleux généralisé.
Des effets systémiques après utilisation topique de corticoïdes sont rares chez l’adulte mais peuvent être sévères. Un freinage de l’axe hypothalamo-hypophysaire, une cataracte, des infections, une détérioration de l’équilibre d’un diabète sucré et une augmentation de la pression intra-oculaire peuvent survenir, notamment après un traitement au long cours.
Les effets systémiques se produisent plus fréquemment lors de l’application sous occlusion (plastique, plis cutanés), lors de l’application sur de larges surfaces de peau et lors d’un traitement au long cours (voir rubrique 4.4).
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr/.
L'utilisation excessive et prolongée de corticoïdes topiques peut entraîner un freinage de l’axe hypothalamo-hypophysaire habituellement réversible. Dans ce cas, un traitement symptomatique est indiqué.
En cas de toxicité chronique, le traitement par corticoïde doit être arrêté progressivement.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Mécanisme d’action
ENSTILAR associe les effets pharmacologiques du calcipotriol monohydrate qui est un analogue synthétique de la vitamine D3 et du dipropionate de bétaméthasone, un corticoïde d’origine synthétique.
Dans le psoriasis, la vitamine D et ses analogues agissent principalement en inhibant la prolifération des kératinocytes et en induisant leur différenciation. Le mécanisme antiprolifératif sous-jacent de la vitamine D dans les kératinocytes implique une induction du facteur inhibiteur de la croissance, le facteur de croissance transformant bêta (TGF-β) et des inhibiteurs de kinase cycline-dépendante, ce qui entraîne un arrêt du cycle cellulaire en phase G1 ainsi qu’une régulation négative de deux facteurs de prolifération Early Growth Response-1 et Polo-Like Kinase-2.
De plus, la vitamine D a un effet immunomodulateur, en supprimant l’activation et la différenciation des cellules Th17/Th1 et en induisant en même temps une réponse des Th2/Treg.
Dans le psoriasis, les corticoïdes ont une action immunosuppressive, en particulier sur les cytokines pro-inflammatoires et les chimiokines, ce qui inhibe l’activation des cellules T. Au niveau moléculaire, les corticoïdes agissent grâce au récepteur glucocorticoïde intracellulaire et l’activité anti‑inflammatoire qui est due à l’inhibition de l’action des facteurs de transcription pro-inflammatoires tels que le facteur nucléaire ĸB, la protéine activatrice 1, et le facteur-3 régulateur de l’interféron.
En association, le calcipotriol monohydrate et le dipropionate de bétaméthasone favorisent des effets anti-inflammatoire et antiprolifératif plus importants que les composants seuls.
Effets pharmacodynamiques
Données à court terme
Dans la limite des conditions maximales d’utilisation, chez des patients atteints d’un psoriasis étendu du corps et du cuir chevelu traités jusqu’à 4 semaines, la réponse surrénalienne à l’ACTH a été déterminée par mesure des taux de cortisol sérique. Aucun des 35 patients n’a présenté une cortisolémie nulle à 30 ou 60 minutes après stimulation à l’ACTH. Il apparaît donc que pour ENSTILAR, le risque de freinage de l’axe hypothalamo‑hypophysaire est faible quand il est utilisé dans le traitement d’un psoriasis étendu pendant 4 semaines. De même, il n’y a pas de signe de troubles du métabolisme calcique à la suite de l’utilisation d’ENSTILAR dans le traitement d’un psoriasis étendu pendant 4 semaines.
Données à long terme
La réponse surrénalienne au test de provocation à l’ACTH a été évaluée chez des patients adultes atteints de psoriasis vulgaire modéré à sévère affectant au moins 10 % de la surface corporelle. Les patients ont été randomisés pour recevoir ENSTILAR ou le véhicule de la mousse deux fois par semaine jusqu’à 52 semaines (traitement d’entretien à long terme). Les patients ayant fait une rechute ont été traités par ENSTILAR une fois par jour pendant 4 semaines, puis ont poursuivi le traitement randomisé.
Les résultats de l’étude étaient concordants avec un faible risque de freinage de l’axe hypothalamo‑hypophysaire chez les patients atteints d’un psoriasis étendu (BSA : 10-30 %) utilisant ENSTILAR deux fois par semaine jusqu’à 52 semaines comme décrit ci-dessus. Cette étude n’a pas mis en évidence d’effet cliniquement significatif sur le métabolisme calcique.
Efficacité et sécurité clinique
Données à court terme
L'efficacité d’ENSTILAR utilisé une fois par jour a été évaluée dans trois études cliniques de 4 semaines randomisées, en double aveugle ou à l’insu de l’investigateur, incluant plus de 1 100 patients atteints d’un psoriasis du corps (et également du cuir chevelu dans l’Etude 2) d’une sévérité au moins légère selon le score PGA (Physician’s Global Assessment), touchant au minimum 2% de la surface corporelle (BSA), et avec un score PASI (Psoriasis Area Severity Index) modifié (m-PASI) au moins égal à 2. Le PGA est calculé en utilisant une échelle à 5 points (blanchi, presque blanchi, léger, modéré et sévère) basée sur la sévérité moyenne des lésions.
Le critère primaire était le pourcentage de patients répondant au traitement (patients blanchis ou quasi-blanchis pour ceux atteints d’un psoriasis au moins modéré à J0, patients blanchis pour ceux atteints d’un psoriasis léger à J0) selon le PGA à la semaine 4.
Caractéristiques de la maladie à J0
|
|
Etude 1 (N=426) |
Etude 2 (N=302) |
Etude 3 (N=376) |
|
Sévérité de la maladie à J0 (PGA) |
|
|
|
|
Léger |
65 (15,3 %) |
41 (13,6 %) |
63 (16,8 %) |
|
Modéré |
319 (74,9 %) |
230 (76,2 %) |
292 (77,7 %) |
|
Sévère |
42 (9,9 %) |
31 (10,3 %) |
21 (5,6 %) |
|
Surface corporelle moyenne (intervalle) |
7,5 % (2-30 %) |
7,1% (2-28 %) |
7,5 % (2-30 %) |
|
m-PASI moyen (intervalle) |
7,5 (2,0-47,0) |
7,6 (2,0-28,0) |
6,8 (2,0-22,6) |
Pourcentage de patients répondant au traitement selon le PGA du corps à la semaine 4
|
|
ENSTILAR |
Véhicule de la mousse |
Bétaméthasone dans le véhicule de la mousse |
Calcipotriol dans le véhicule de la mousse |
Daivobet pommade |
Véhicule de la pommade |
|
Etude 1 |
(N=323) 53,3% |
(N=103) 4,8% |
|
|
|
|
|
Etude 2 |
(N=100) 45,0% |
|
(N=101) 30,7% |
(N=101) 14,9% |
|
|
|
Etude 3 |
(N=141) 54,6% |
(N=49) 6,1% |
|
|
(N=135) 43,0% |
(N=51) 7,8% |
Les résultats pour le critère primaire « pourcentage de patients répondant au traitement » (selon le PGA du corps) à la semaine 4 ont montré qu’ENSTILAR était significativement plus efficace que tous les comparateurs inclus et que les réponses ont été observées dans tous les niveaux de sévérité de la maladie évalués à J0.
Dans l’Etude 2, l’effet d’ENSTILAR sur le cuir chevelu a été évalué par le pourcentage de patients répondant au traitement selon le PGA du cuir chevelu à la semaine 4.
Pourcentage de patients répondant au traitement selon le PGA du cuir chevelu à la semaine 4
|
|
ENSTILAR |
Bétaméthasone dans le véhicule de la mousse |
Calcipotriol dans le véhicule de la mousse |
|
Etude 2 |
(N=100) 53,0% |
(N=101) 47,5% |
(N=101) 35,6% |
ENSTILAR était significativement plus efficace que le calcipotriol et était également associé à un taux plus élevé de réponse au traitement qu’avec la bétaméthasone mais cette comparaison n’était pas significative.
L’effet d’ENSTILAR sur les démangeaisons et la perte de sommeil due aux démangeaisons a été étudié dans l’Etude 1 en utilisant une échelle visuelle analogique (EVA) allant de 0 mm (pas de démangeaison/pas de perte de sommeil due aux démangeaisons) à 100 mm (les pires démangeaisons que vous puissiez imaginer/pire perte de sommeil imaginable). Un nombre de patients significativement plus important a atteint une réduction de leurs démangeaisons et de leur perte de sommeil due aux démangeaisons de 70% dans le groupe ENSTILAR comparé au groupe véhicule à partir de J3 et tout au long du traitement.
L’effet d’ENSTILAR sur la qualité de vie a été étudié dans l’Etude 1 grâce au questionnaire générique EQ-5D-5L et au questionnaire spécifique à la dermatologie DLQI. Il a été démontré une amélioration de la qualité de vie significativement plus importante en faveur d’ENSTILAR avec le questionnaire DLQI à partir de la semaine 1 et tout au long du traitement et avec le questionnaire EQ-5D-5L à la semaine 4.
Données à long terme
L’efficacité et la sécurité d’emploi du traitement par ENSTILAR ont été évaluées dans une étude randomisée, en double aveugle, contrôlée par le véhicule (Etude 4). Les patients ont reçu ENSTILAR en ouvert une fois par jour pendant 4 semaines et les répondeurs ont ensuite été randomisés pour recevoir ENSTILAR (traitement d’entretien à long terme) ou le véhicule de la mousse deux fois par semaine jusqu’à 52 semaines. Les patients des deux bras de traitement ayant fait une rechute ont été traités une fois par jour par ENSTILAR pendant 4 semaines et les répondeurs ont ensuite poursuivi le traitement randomisé.
Caractéristiques de la maladie à J0 (tous les patients randomisés)
|
|
Etude 4 (N=545) |
|
Sévérité de la maladie à J0 (PGA) |
|
|
Léger |
58 (10,6 %) |
|
Modéré |
447 (82,0 %) |
|
Sévère |
40 (7,3 %) |
|
Surface corporelle moyenne (intervalle) |
8,3 (1,0 - 38,0) |
|
m-PASI moyen (intervalle) |
7,8 (2,0 - 28,0) |
Chez les patients qui ont reçu le traitement d’entretien à long terme par ENSTILAR, le délai avant la première rechute a été plus long, la proportion de jours en rémission pendant l’étude a été plus élevée, et il y a eu moins de rechutes que chez les patients qui ont reçu le véhicule de la mousse. Le tableau ci-dessous montre l’effet sur les rechutes dans cette étude.
Résumé de l’efficacité jusqu’à 52 semaines du traitement d’entretien à long terme (Etude 4)
|
Critère d’évaluation |
Données observées dans l’étude |
Résultats de l’analyse statistique (N=521)* |
||
|
Traitement d’entretien à long terme + traitement des rechutes (N=256) |
Traitement par le véhicule + traitement des rechutes (N=265) |
Estimations [IC à 95 %] |
Valeur p |
|
|
Principal : Délai avant la première rechute |
Délai médian avant la première rechute = 56 jours |
Délai médian avant la première rechute = 30 jours |
HR = 0,57 [0,47‑0,69] (Réduction de 43 % [31 %‑53 %]) |
p < 0,001 |
|
Secondaire : Proportion de jours en rémission |
Proportion médiane de jours = 69,3% |
Proportion médiane de jours = 56,6% |
DP = 11 % [8 %‑14 %] (Augmentation de 41 [29-53] jours) |
p < 0,001 |
|
Secondaire : Nombre de rechutes |
Nombre médian de rechutes = 2,0 |
Nombre médian de rechutes = 3,0 |
RR = 0,54 [0,46‑0,63] (Réduction de 46 % [37 %‑54 %]) |
p < 0,001 |
* L’analyse statistique a comparé le traitement d’entretien à long terme + traitement des rechutes au traitement par le véhicule + traitement des rechutes.
DP : Différence de la proportion de jours par an ; HR : Hazard Ratio ; IC : Intervalle de Confiance ; N : nombre de patients randomisés ayant reçu le traitement au moins 1 fois ; RR : Risque relatif.
Population pédiatrique
Les effets sur le métabolisme calcique ont été étudiés dans un essai clinique en ouvert, non contrôlé de 4 semaines chez 106 adolescents âgés de 12 à 17 ans atteints de psoriasis du cuir chevelu et du corps. Les patients ont utilisé jusqu’à 105 g par semaine d’ENSTILAR. Aucun cas d’hypercalcémie et aucune modification cliniquement pertinente de la calciurie n’ont été rapportés.
La réponse surrénalienne à l’administration d’ACTH a été mesurée dans un sous-groupe de 33 patients atteints d’un psoriasis en plaques étendu touchant au moins 20% de la surface du cuir chevelu et 10% de la surface corporelle. Après 4 semaines de traitement par ENSTILAR, 2 patients ont eu une cortisolémie ≤18 µg/dl 30 minutes après l’administration d’ACTH mais la réponse s’est normalisée à 60 minutes. A l’état basal, un troisième patient avait une réponse minimale du cortisol à l’administration d’ACTH, ce qui n’a pas permis d’interpréter les résultats après le traitement. Aucune manifestation clinique n’a été observée dans chacun de ces cas.
5.2. Propriétés pharmacocinétiques
L’excrétion du calcipotriol se fait principalement via les selles (rats et cochons nains) et pour le dipropionate de bétaméthasone via les urines (rats et souris). Chez les rats, les études de distribution tissulaire du calcipotriol et du dipropionate de bétaméthasone radiomarqués ont montré que le rein et le foie avaient le taux le plus élevé de radioactivité.
Le niveau d’absorption percutanée des deux substances actives après application topique d’ENSTILAR a été déterminé dans l’étude de l’axe hypothalamo-hypophysaire chez des patients atteints d’un psoriasis vulgaire étendu (voir rubrique 5.1). Le calcipotriol et le dipropionate de bétaméthasone étaient en dessous de la limite inférieure de quantification dans plusieurs échantillons prélevés chez les 35 patients traités 1 fois par jour pendant 4 semaines pour un psoriasis étendu incluant le corps et le cuir chevelu. Le calcipotriol était quantifiable à différents temps chez un patient, tandis que le dipropionate de bétaméthasone l’a été chez 5 patients. Les métabolites du calcipotriol et du dipropionate de bétaméthasone étaient respectivement détectables chez 3 et 27 patients.
5.3. Données de sécurité préclinique
Une toxicité maternelle et fœtale chez le rat et le lapin a été observée après l’administration orale d’une dose de calcipotriol de 54 μg/kg/j et de 12 μg/kg/j, respectivement. Les anomalies fœtales observées de manière concomitante avec une toxicité maternelle ont inclus des signes révélateurs d’une immaturité du squelette (ossification incomplète des os du pubis et des phalanges des pattes avant, et des fontanelles hypertrophiées) et une incidence de côtes surnuméraires augmentée.
Les données non cliniques issues des études conventionnelles de pharmacologie de sécurité, toxicologie en administration répétée, génotoxicité, n’ont pas révélé de risque particulier pour l’Homme.
Des études de cancérogénèse par voie cutanée chez la souris et des études de cancérogénèse par voie orale chez le rat, avec le calcipotriol et le dipropionate de bétaméthasone n'ont pas révélé de risque particulier pour l’Homme.
Dans une étude de tolérance locale chez le cochon nain, ENSTILAR a causé une irritation légère à modérée de la peau.
Après première ouverture : 6 mois.
6.4. Précautions particulières de conservation
A conserver à une température ne dépassant pas 30°C.
Attention :
Aérosol extrêmement inflammable.
Flacon pressurisé : peut éclater sous l’effet de la chaleur. A protéger de la lumière du soleil.
Ne pas exposer à des températures supérieures à 50ºC.
Ne pas perforer, ni brûler, même après usage.
Ne pas pulvériser sur une flamme nue ou une autre source de chaleur.
Tenir à l’écart des étincelles, des flammes nues ou d’autres sources de chaleur.
Ne pas fumer.
6.5. Nature et contenu de l'emballage extérieur
Flacon en aluminium revêtu d’une couche de vernis polyamide-imide, et équipé d’une valve continue et d’un bec diffuseur.
Le flacon contient 60 g de mousse, ceci n’inclut pas la quantité de gaz propulseurs.
Boîtes de : 60 g et 2x60 g.
Toutes les présentations peuvent ne pas être commercialisées.
6.6. Précautions particulières d’élimination et de manipulation
Tout médicament non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
INDUSTRIPARKEN 55
2750 BALLERUP
DANEMARK
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· 34009 300 749 8 5 : 60 g de mousse en flacon pressurisé (Aluminium). Boîte de 1.
· 34009 300 749 9 2 : 60 g de mousse en flacon pressurisé (Aluminium). Boîte de 2.
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
[à compléter ultérieurement par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE
[à compléter ultérieurement par le titulaire]
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Liste I.
ANSM - Mis à jour le : 07/05/2024
ENSTILAR 50 microgrammes/0,5 mg/g, mousse cutanée
Calcipotriol/bétaméthasone
· Gardez cette notice. Vous pourriez avoir besoin de la relire.
· Si vous avez d’autres questions, interrogez votre médecin, votre pharmacien ou votre infirmier/ère.
· Ce médicament vous a été personnellement prescrit. Ne le donnez pas à d’autres personnes. Il pourrait leur être nocif, même si les signes de leur maladie sont identiques aux vôtres.
· Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
1. Qu'est-ce que ENSTILAR 50 microgrammes/0,5 mg/g, mousse cutanée et dans quels cas est-il utilisé ?
2. Quelles sont les informations à connaître avant d'utiliser ENSTILAR 50 microgrammes/0,5 mg/g, mousse cutanée ?
3. Comment utiliser ENSTILAR 50 microgrammes/0,5 mg/g, mousse cutanée ?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver ENSTILAR 50 microgrammes/0,5 mg/g, mousse cutanée ?
6. Contenu de l’emballage et autres informations.
1. QU’EST-CE QUE ENSTILAR 50 microgrammes/0,5 mg/g, mousse cutanée ET DANS QUELS CAS EST-IL UTILISE ?
ENSTILAR est à utiliser sur la peau pour traiter le psoriasis vulgaire chez l’adulte. Le psoriasis est dû à une production trop rapide des cellules de votre peau. Ceci entraîne rougeur, desquamation et épaississement de la peau.
ENSTILAR contient du calcipotriol et de la bétaméthasone. Le calcipotriol aide à ramener la vitesse de croissance des cellules de la peau à la normale et la bétaméthasone aide à réduire l'inflammation.
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT D’UTILISER ENSTILAR 50 microgrammes/0,5 mg/g, mousse cutanée ?
N’utilisez jamais ENSTILAR 50 microgrammes/0,5 mg/g, mousse cutanée :
· si vous êtes allergique au calcipotriol, à la bétaméthasone ou à l’un des autres composants contenus dans ce médicament, mentionnés dans la rubrique 6,
· si vous avez des problèmes liés au taux de calcium dans l’organisme (demandez à votre médecin),
· si vous avez un psoriasis d’un certain type : comme le psoriasis érythrodermique ou le psoriasis pustuleux (demandez à votre médecin si vous n’êtes pas sûr).
Comme ENSTILAR contient un corticoïde fort, ne l’utilisez PAS dans les situations suivantes :
· infections de la peau dues à un virus (ex : un bouton de fièvre ou la varicelle),
· infections de la peau dues à un champignon (ex : pied d’athlète ou teigne),
· infections de la peau dues à une bactérie,
· infections de la peau dues à un parasite (ex : la gale),
· tuberculose,
· dermatite périorale (rougeur autour de la bouche),
· amincissement de la peau, veines s’abîmant facilement, vergetures,
· ichtyose (peau sèche avec des sortes d’écailles),
· acné (boutons),
· rosacée (rougeur sévère soudaine ou rougeur de la peau du visage),
· ulcères ou plaies de la peau.
Avertissements et précautions
Adressez-vous à votre médecin, pharmacien ou votre infirmier/ère avant d’utiliser ENSTILAR 50 microgrammes/0,5 mg/g, mousse cutanée :
· si vous êtes diabétique (diabète sucré) car le taux de sucre dans votre sang peut être modifié par les corticoïdes,
· si vous prenez d’autres médicaments qui contiennent des corticoïdes car vous pourriez avoir des effets indésirables,
· si vous avez un psoriasis d’un certain type appelé le psoriasis en gouttes.
Adressez-vous à votre médecin, pharmacien ou votre infirmier/ère pendant le traitement :
· si vous avez pris ce médicament pendant une longue période et prévoyez d’arrêter le traitement (car il y a un risque que votre psoriasis s’aggrave ou « flambe » si les corticoïdes sont arrêtés brutalement),
· si votre peau s’infecte, car vous pourriez avoir besoin d’arrêter le traitement,
· si le taux de calcium dans votre sang change (voir la rubrique 4 pour plus d’informations),
· en cas de vision floue ou d’autres troubles visuels.
Précautions particulières :
· Evitez de couvrir la zone traitée avec des bandages ou des pansements car cela augmente l’absorption des corticoïdes.
· Evitez d’utiliser plus de 15 grammes par jour. Cela signifie qu’un flacon de 60 g d’ENSTILAR doit durer au moins 4 jours. 15 g est délivré si vous appuyez en continu sur le bec diffuseur pendant environ 1 minute. Pulvériser pendant 2 secondes permet de délivrer une dose d’environ 0,5 g d’ENSTILAR. Pour information, 0,5 g de mousse doit couvrir une surface de peau correspondant à peu près à la main d’un adulte.
· Evitez l’utilisation sur plus de 30% de votre corps.
· Evitez l’utilisation sur de larges surfaces de peau lésée, sur les muqueuses ou dans les plis de la peau (dans l’aine, sous les bras, sous les seins) car cela augmente l’absorption des corticoïdes.
· Evitez l’utilisation sur le visage ou les organes génitaux (sexuels) car ceux-ci sont très sensibles aux corticoïdes.
Enfants et adolescents
ENSTILAR n’est pas recommandé chez les enfants âgés de moins de 18 ans.
Autres médicaments et ENSTILAR 50 microgrammes/0,5 mg/g, mousse cutanée
Informez votre médecin, pharmacien ou infirmier/ère si vous utilisez, avez récemment utilisé ou pourriez utiliser tout autre médicament.
ENSTILAR 50 microgrammes/0,5 mg/g, mousse cutanée avec des aliments, boissons et de l’alcool
Sans objet.
Grossesse et allaitement
Si vous êtes enceinte ou que vous allaitez, si vous pensez être enceinte ou planifiez une grossesse, demandez conseil à votre médecin avant de prendre ce médicament.
Si votre médecin est d'accord pour que vous allaitiez, faites attention et n’appliquez pas ENSTILAR sur vos seins. Voir « Instructions pour une utilisation appropriée ».
Conduite de véhicules et utilisation de machines
Ce médicament ne devrait avoir aucun effet sur votre capacité à conduire ou utiliser des machines.
ENSTILAR 50 microgrammes/0,5 mg/g, mousse cutanée contient du butylhydroxytoluène (E321).
Ce médicament contient du butylhydroxytoluène (E321) qui peut provoquer des réactions cutanées locales (par exemple : dermatite de contact), ou une irritation des yeux et des muqueuses. Voir « Instructions pour une utilisation appropriée ».
3. COMMENT UTILISER ENSTILAR 50 microgrammes/0,5 mg/g, mousse cutanée ?
ENSTILAR est utilisé par voie cutanée (sur la peau).
Avant utilisation, veuillez lire la notice même si vous avez déjà utilisé ENSTILAR auparavant.
ENSTILAR est conçu pour être appliqué directement (aérosol) sur votre peau atteinte de psoriasis vulgaire.
Instructions pour une utilisation appropriée
Pour une utilisation sur le corps :
|
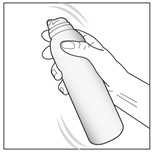
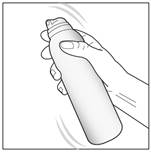
1- Agitez le flacon pendant quelques secondes avant utilisation. |
|
|
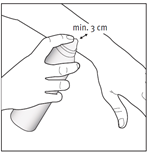
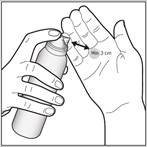
2- Appliquez la mousse en maintenant le flacon à une distance d’au moins 3 cm de la peau et pulvérisez directement sur la zone atteinte. |
|
|
3- La mousse peut être pulvérisée en maintenant le flacon dans n’importe quelle orientation sauf horizontalement. |
|
|
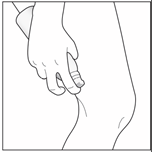
4- Faites pénétrer la mousse en massant délicatement chaque zone de peau atteinte. |
|
|
5- Après avoir appliqué la mousse, remettez le bouchon sur le flacon pour empêcher une pulvérisation accidentelle quand il n’est pas utilisé. |
|
|
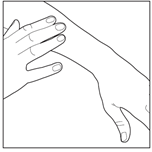
6- Lavez-vous soigneusement les mains après avoir utilisé ENSTILAR (sauf si vous utilisez la mousse pour traiter vos mains). Cela évitera tout transfert accidentel de la mousse sur d’autres parties du corps (surtout sur le visage, la bouche et les yeux). Laissez la mousse en contact avec la peau pendant la nuit ou la journée. |
|
Pour une utilisation sur le cuir chevelu :
|
1- Peignez vos cheveux pour éliminer les pellicules. |
|
|
2- Agitez le flacon pendant quelques secondes avant utilisation. |
|
|
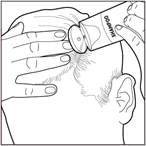
3- Tenir le flacon à une distance d’au moins 3 cm de la peau. Pulvérisez directement dans la paume de la main. La mousse peut être pulvérisée en maintenant le flacon dans n’importe quelle orientation sauf horizontalement. |
|
|
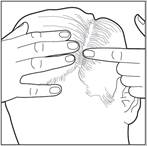
4- Placez la mousse sur votre doigt et appliquez-la directement sur les zones touchées. Minimisez l'application dans les cheveux pour faciliter le lavage. Frottez doucement la mousse sur le cuir chevelu. Après application de la mousse, remettez le bouchon sur le flacon pour empêcher une pulvérisation accidentelle quand il n’est pas utilisé. |
|
|
5- Lavez-vous soigneusement les mains après avoir utilisé ENSTILAR. Cela évitera tout transfert accidentel de la mousse sur d’autres parties du corps (surtout sur le visage, la bouche et les yeux). Laissez la mousse en contact avec le cuir chevelu pendant la nuit ou la journée. |
|
Lorsque vous vous lavez les cheveux, les instructions suivantes pourront vous être utiles :
|
1- Appliquez un shampooing doux non traitant sur cheveux secs en particulier sur les zones où la mousse a été appliquée. Il est plus facile d'éliminer ENSTILAR lorsque le shampooing est appliqué sur des cheveux secs, car l'eau dilue l'effet nettoyant du shampooing. |
|
|
2- Masser le shampooing sur les cheveux secs / le cuir chevelu. Laissez le shampooing sur le cuir chevelu pendant quelques minutes avant de rincer. |
|
|
3- Rincez abondamment avec de l’eau. |
|
|
4- Répéter un shampooing normal si nécessaire. |
Informations complémentaires pour une utilisation appropriée :
· Appliquez le produit uniquement sur votre psoriasis et pas sur la peau qui ne présente pas de psoriasis.
· Nettoyez ou rincez soigneusement si, par accident, vous avez appliqué de la mousse sur vos yeux, votre bouche, vos organes génitaux ou vos seins si vous allaitez.
· Ne vous inquiétez pas si vous appliquez sans le faire exprès de la mousse sur de la peau saine autour des lésions de psoriasis, mais essuyez-la si elle se répand trop largement.
· Ne couvrez pas la zone traitée ni avec un bandage ni avec un pansement serré.
· Pour un effet optimal, il est recommandé de ne pas prendre de douche ni de bain immédiatement après l’application de la mousse.
· Après l’application de la mousse, évitez le contact avec des tissus qui sont facilement tachés par la graisse (ex : la soie).
Durée du traitement
· Appliquez la mousse une fois par jour. Il peut être plus pratique d’appliquer la mousse le soir.
· La durée normale de traitement est de 4 semaines mais votre médecin peut décider de vous prescrire une durée de traitement différente.
Votre médecin peut vous demander d’utiliser ENSTILAR deux fois par semaine une fois que votre psoriasis a disparu ou quasiment disparu. ENSTILAR doit être appliqué deux fois par semaine sur deux jours non consécutifs (par exemple le mercredi et le samedi) sur les zones précédemment affectées par le psoriasis. Les applications doivent être espacées de 2 à 3 jours sans traitement par ENSTILAR.
Si les symptômes réapparaissent, vous devez utiliser ENSTILAR une fois par jour comme décrit ci‑dessus et contacter votre médecin pour revoir votre traitement.
Si vous avez utilisé plus d’ENSTILAR 50 microgrammes/0,5 mg/g, mousse cutanée que vous n’auriez dû
Important : un flacon de 60 g d’ENSTILAR doit durer au moins 4 jours (voir rubrique 2 « Précautions particulières »). Si vous utilisez d’autres produits contenant du calcipotriol, la quantité totale de calcipotriol, dont ENSTILAR, ne doit pas excéder 15 grammes par jour.
Contactez votre médecin si vous avez utilisé plus que la dose recommandée.
Une utilisation excessive d’ENSTILAR peut provoquer des troubles du calcium sanguin qui revient généralement à la normale à l’arrêt du traitement.
Une utilisation excessive au long cours peut également entraîner un fonctionnement anormal de vos glandes surrénales (elles se situent près des reins et produisent des hormones).
Voir la rubrique 4 pour plus d’informations.
Si vous oubliez d’utiliser ENSTILAR 50 microgrammes/0,5 mg/g, mousse cutanée
N’appliquez pas de dose double pour compenser la dose que vous avez oublié d’appliquer.
Si vous arrêtez d’utiliser ENSTILAR 50 microgrammes/0,5 mg/g, mousse cutanée
Le traitement par ENSTILAR doit être arrêté en suivant les instructions de votre médecin. Il peut être nécessaire d’arrêter le traitement progressivement, surtout si vous l’avez utilisé pendant longtemps.
Si vous avez d’autres questions sur l’utilisation de ce médicament, demandez plus d’informations à votre médecin, votre pharmacien ou à votre infirmier/ère.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
Effets indésirables observés pour ENSTILAR :
Effets indésirables peu fréquents (peuvent affecter jusqu’à 1 personne sur 100) :
· Réaction allergique. Les symptômes peuvent être une éruption et un gonflement de la peau, du visage ou de la bouche.
· Aggravation ou « flambée » de votre psoriasis après arrêt du traitement.
· Augmentation du taux de calcium dans le sang.
· Irritation de la peau sous forme de démangeaisons, douleur, brûlures, picotements et/ou rougeur de la peau.
· Rougeur, douleur ou gonflement à la racine des poils (folliculite).
· Eclaircissement de la peau (dépigmentation).
Effet indésirable avec une fréquence indéterminée (la fréquence ne peut pas être estimée sur la base des données disponibles) :
· Vision floue.
· Rougeur de la peau au site d’application du produit.
ENSTILAR contient de la bétaméthasone (un corticoïde fort) et du calcipotriol. Vous pourrez présenter les effets indésirables suivants. Ces effets indésirables surviennent le plus souvent après une utilisation d’ENSTILAR au long cours, sous occlusion ou dans les plis de la peau (ex : dans l’aine, sous les bras, sous les seins), ou sur de larges surfaces de peau :
· Réactions allergiques avec gonflement du visage ou d’autres parties du corps telles que les mains ou les pieds. Un gonflement des lèvres/gorge et des difficultés à respirer peuvent survenir.
· Le taux de calcium dans votre sang ou vos urines peut augmenter de façon à provoquer des symptômes : une envie fréquente d’uriner, constipation, faiblesse musculaire, et confusion. Le taux de calcium redevient normal à l’arrêt du traitement.
· Vos glandes surrénales peuvent cesser de fonctionner correctement. Les signes sont la fatigue, la dépression et l’anxiété.
· Vision trouble, difficultés à voir la nuit, sensibilité à la lumière (ceci peut être le signe d’une cataracte).
· Douleur de l’œil, yeux rouges, baisse de la vision ou vision trouble (ceci peut être le signe d’une augmentation de la pression dans l’œil).
· Infections (car votre système immunitaire est affaibli).
· Psoriasis pustuleux (une zone rouge avec des pustules jaunâtres (boutons)).
· Vous pouvez avoir des fluctuations de la concentration de sucre dans votre sang.
Si vous ressentez l’un des effets indésirables ci-dessus, contactez immédiatement votre médecin.
Les effets indésirables moins graves provoqués par le calcipotriol ou la bétaméthasone sont les suivants :
· Amincissement de la peau.
· Vergetures.
· Les vaisseaux sanguins sous votre peau peuvent devenir plus visibles.
· Changement de la pousse des poils.
· Rougeur autour de la bouche (dermatite périorale).
· Aggravation de votre psoriasis.
· Sensibilité de la peau à la lumière entraînant une éruption cutanée.
· Eruption cutanée avec démangeaisons (eczéma).
· Coloration transitoire jaunâtre des cheveux blancs ou gris au niveau du site d’application du cuir chevelu.
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin, votre pharmacien ou à votre infirmier/ère. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr/
En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.
5. COMMENT CONSERVER ENSTILAR 50 microgrammes/0,5 mg/g, mousse cutanée ?
|
Attention : aérosol extrêmement inflammable. Flacon pressurisé : peut éclater sous l’effet de la chaleur. A protéger de la lumière du soleil. Ne pas exposer à des températures supérieures à 50ºC. Ne pas perforer ni brûler, même après usage. Ne pas pulvériser sur une flamme nue ou une autre source de chaleur. Tenir à l’écart des étincelles, des flammes nues ou d’autres sources de chaleur. Ne pas fumer près du flacon. |
Tenir ce médicament hors de la vue et de la portée des enfants.
N’utilisez pas ce médicament après la date de péremption indiquée sur le flacon et l’emballage après EXP. La date de péremption fait référence au dernier jour de ce mois.
A conserver à une température ne dépassant pas 30°C.
Le flacon doit être jeté 6 mois après la première ouverture.
Ne jetez aucun médicament au tout-à-l’égout ou avec les ordures ménagères. Demandez à votre pharmacien d’éliminer les médicaments que vous n’utilisez plus. Ces mesures contribueront à protéger l’environnement.
6. CONTENU DE L’EMBALLAGE ET AUTRES INFORMATIONS
Ce que contient ENSTILAR 50 microgrammes/0,5 mg/g, mousse cutanée
· Les substances actives sont :
Calcipotriol..................................................................................................... 50 microgrammes
Sous forme de calcipotriol monohydrate
Bétaméthasone............................................................................................................... 0,5 mg
Sous forme de dipropionate de bétaméthasone
Pour 1 g de mousse cutanée.
· Les autres composants sont :
Paraffine liquide, éther stéarylique de polyoxypropylène, tout-rac-alpha-tocophérol, vaseline blanche, butylhydroxytoluène (E321), butane, éther diméthylique.
Qu’est-ce que ENSTILAR 50 microgrammes/0,5 mg/g, mousse cutanée et contenu de l’emballage extérieur
ENSTILAR est une mousse cutanée.
Après pulvérisation, une mousse blanche à blanchâtre se forme. Celle-ci a l’apparence d’une mousse non expansible qui se rétracte progressivement après pulvérisation.
|
|
Flacon en aluminium revêtu d’une couche de vernis polyamide-imide, et équipé d’une valve continue et d’un bec diffuseur.
Le flacon contient 60 g de mousse, ceci n’inclut pas la quantité de gaz propulseurs.
Boîtes de : 60 g et 2x60 g.
Toutes les présentations peuvent ne pas être commercialisées.
Titulaire de l’autorisation de mise sur le marché
INDUSTRIPARKEN 55
2750 BALLERUP
DANEMARK
Exploitant de l’autorisation de mise sur le marché
Immeuble Ampère E - La Défense
34-40 RUE HENRI REGNAULT
92400 COURBEVOIE
FRANCE
285 CASHEL ROAD, CRUMLIN
DUBLIN 12
IRLANDE
OU
LEO PHARMA A/S
INDUSTRIPARKEN 55
2750 BALLERUP
DANEMARK
Noms du médicament dans les Etats membres de l'Espace Economique Européen
Ce médicament est autorisé dans les Etats membres de l'Espace Economique Européen et au Royaume-Uni (Irlande du Nord) sous les noms suivants : Conformément à la réglementation en vigueur.
[À compléter ultérieurement par le titulaire]
La dernière date à laquelle cette notice a été révisée est :
[à compléter ultérieurement par le titulaire]
Des informations détaillées sur ce médicament sont disponibles sur le site Internet de l’ANSM (France).