Dernière mise à jour le 02/02/2026
EPREX 40 000 UI/mL, solution injectable en seringue préremplie
Indications thérapeutiques
Classe pharmacothérapeutique : autres ANTI-ANEMIQUES/ERYTHROPOIETINE - code ATC : B03XA01.
· EPREX est utilisé dans le traitement des anémies symptomatiques dues à des maladies du rein :
o chez les enfants en hémodialyse,
o chez les adultes en hémodialyse ou dialyse péritonéale,
o chez les adultes non encore dialysés ayant une anémie sévère.
Si vous souffrez d’une maladie rénale, vous pouvez présenter un manque de globules rouges si votre rein ne produit pas suffisamment d’érythropoïétine (qui est nécessaire à la production des globules rouges). EPREX vous est prescrit pour stimuler votre moelle osseuse afin de produire plus de globules rouges.
· EPREX est utilisé dans le traitement de l’anémie chez les adultes recevant une chimiothérapie pour des tumeurs solides, un lymphome malin ou un myélome multiple (cancer de la moelle osseuse) et pouvant avoir besoin d’une transfusion de sang. EPREX peut réduire le besoin de transfusion sanguine chez ces patients.
· EPREX est utilisé chez les adultes modérément anémiques qui donnent leur sang avant une intervention chirurgicale, afin que celui-ci puisse leur être réinjecté pendant ou après l’intervention. EPREX stimulant la production de globules rouges, les médecins peuvent prélever plus de sang chez ces patients.
· EPREX est utilisé chez les adultes modérément anémiques devant avoir une intervention chirurgicale orthopédique majeure (par exemple en cas de chirurgie pour prothèse de hanche ou de genou), afin de diminuer le besoin éventuel de transfusions sanguines.
· EPREX est utilisé pour traiter l’anémie chez les adultes atteints d’un trouble de la moelle osseuse provoquant des perturbations sévères de la création des cellules sanguines (syndromes myélodysplasiques). EPREX peut réduire le besoin de réaliser des transfusions sanguines.
Présentations
> 1 seringue(s) préremplie(s) en verre de 0,5 ml avec aiguille(s)
Code CIP : 369 919-9 ou 34009 369 919 9 6
Déclaration de commercialisation : 28/06/2006
Cette présentation est agréée aux collectivités
- Prix hors honoraire de dispensation : 88,99 €
- Honoraire de dispensation : 1,02 €
- Prix honoraire compris : 90,01 €
- Taux de remboursement :65%
> 1 seringue(s) préremplie(s) en verre de 1 ml avec aiguille(s)
Code CIP : 369 923-6 ou 34009 369 923 6 8
Déclaration de commercialisation : 28/06/2006
Cette présentation est agréée aux collectivités
- Prix hors honoraire de dispensation : 176,91 €
- Honoraire de dispensation : 1,02 €
- Prix honoraire compris : 177,93 €
- Taux de remboursement :65%
> 1 seringue(s) préremplie(s) en verre de 0,75 ml avec aiguille(s)
Code CIP : 383 276-4 ou 34009 383 276 4 9
Déclaration de commercialisation : 19/05/2008
Cette présentation est agréée aux collectivités
- Prix hors honoraire de dispensation : 132,96 €
- Honoraire de dispensation : 1,02 €
- Prix honoraire compris : 133,98 €
- Taux de remboursement :65%
Documents de bon usage du médicament
- Anémie chez l’insuffisant rénal : comment utiliser les agents stimulant l’érythropoïèse
Auteur : Haute autorité de santé
Type : Fiche Bon Usage du Médicament
Date de mise à jour :Septembre 2013
Service médical rendu (SMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprès de la HAS (plus d'informations dans l'aide). Les avis et synthèses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur du SMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| Important | Avis du 07/02/2018 | Extension d'indication | Le service médical rendu par EPREX est important dans l’extension d’indication. |
| Important | Avis du 20/04/2016 | Renouvellement d'inscription (CT) | Le service médical rendu par les spécialités EPREX reste important : • dans le traitement de l’anémie associée à l’insuffisance rénale chronique : • chez les adultes et les enfants âgés de 1 à 18 ans hémodialysés et chez les patients adultes en dialyse péritonéale, • chez les adultes insuffisants rénaux non encore dialysés pour le traitement de l'anémie sévère d'origine rénale accompagnée de symptômes cliniques chez les patients. • chez les adultes participant à un programme de transfusions autologues différées pour augmenter les dons de sang autologue : le traitement doit être uniquement administré aux patients présentant une anémie modérée (concentration d’hémoglobine comprise entre 10 et 13 g/dl [soit 6,2 - 8,1 mmol/l], sans carence martiale) s’il n’existe pas ou peu de méthodes d’épargne du sang lorsqu’une intervention chirurgicale majeure programmée nécessite de grandes quantités de sang (4 unités de sang ou plus chez les femmes et 5 unités de sang ou plus chez les hommes) . • chez les adultes, sans carence martiale, devant avoir une intervention chirurgicale orthopédique majeure programmée, ayant un risque présumé important de complications transfusionnelles pour réduire l'exposition aux transfusions de sang homologue : l'utilisation devra être réservée aux patients ayant une anémie modérée (par exemple, concentration d’hémoglobine comprise entre 10 et 13 g/dl) qui n'ont pas accès à un programme de transfusions autologues différées et chez lesquels on s’attend à des pertes de sang modérées (900 à 1800 ml). |
| Modéré | Avis du 20/04/2016 | Renouvellement d'inscription (CT) | Le service médical rendu par les spécialités EPREX reste modéré chez les adultes traités par chimiothérapie pour des tumeurs solides, un lymphome malin ou un myélome multiple, et à risque de transfusion en raison de leur état général (par exemple, état cardiovasculaire, anémie pré existante au début de la chimiothérapie) pour le traitement de l'anémie et la réduction des besoins transfusionnels. |
Amélioration du service médical rendu (ASMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprés de la HAS (plus d'informations dans l'aide). Les avis et synthéses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur de l'ASMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| V (Inexistant) | Avis du 07/02/2018 | Extension d'indication | Prenant en compte : • la démonstration de la supériorité de EPREX (époétine alfa) uniquement en termes de réponse érythroïde par rapport au placebo dans une population sélectionnée ne requérant que peu ou pas de transfusions, • de l’absence de démonstration de la supériorité de EPREX (époétine alfa) par rapport au placebo sur des critères cliniques pertinents tels que la normalisation de l’anémie et/ou de réduction du besoin transfusionnel, • l’absence de démonstration d’un gain sur l’amélioration de la qualité de vie, • le profil de tolérance des EPO exposant les patients à des effets indésirables rares mais graves (thrombose artérielle, toxicité cutanée sévère et érythroblastopénie notamment), la Commission considère que EPREX n’apporte pas d’amélioration du service médical rendu (ASMR V) dans la prise en charge des adultes atteints de syndromes myélodysplasiques (SMD) primitifs de risque faible ou intermédiaire 1, ayant une anémie symptomatique (concentration d'hémoglobine = 10 g/dL) et un taux sérique d'érythropoïétine faible (< 200 mU/mL). |
| V (Inexistant) | Avis du 06/04/2016 | Extension d'indication | EPREX 40 000 UI/ml, solution injectable en seringue pré-remplie, n’apporte pas d’amélioration du service médical rendu (ASMR V) par rapport aux autres ASE. |
| V (Inexistant) | Avis du 20/02/2008 | Inscription (CT) | Cette spécialité est un complément de gamme qui n’apporte pas d’amélioration du service médical rendu. |
Autres informations
- Titulaire de l'autorisation : JANSSEN CILAG
- Conditions de prescription et de délivrance :
- liste I
- prescription initiale hospitalière annuelle
- prescription initiale par un médecin exerçant dans un service de dialyse à domicile
- Statut de l'autorisation : Valide
- Type de procédure : Procédure de reconnaissance mutuelle
- Code CIS : 6 722 854 1
ANSM - Mis à jour le : 06/11/2025
EPREX 40000 UI/mL, solution injectable en seringue préremplie
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Epoétine alfa.................................................................. 40 000 UI/mL (336,0 microgrammes par mL)
produite sur cellules ovariennes de hamster chinois (CHO) par la technique de l’ADN recombinant.
Une seringue préremplie de 0,5 mL contient 20 000 UI (168,0 microgrammes) d’époétine alfa.
Une seringue préremplie de 0,75 mL contient 30 000 UI (252,0 microgrammes) d’époétine alfa.
Une seringue préremplie de 1,0 mL contient 40 000 UI (336,0 microgrammes) d’époétine alfa.
Pour la liste complète des excipients, voir rubrique 6.1.
Solution injectable en seringue préremplie.
Solution transparente, incolore.
4.1. Indications thérapeutiques
· chez les adultes et les enfants âgés de 1 à 18 ans hémodialysés et chez les patients adultes en dialyse péritonéale,
· chez les adultes insuffisants rénaux non encore dialysés pour le traitement de l'anémie sévère d'origine rénale accompagnée de symptômes cliniques chez les patients.
EPREX est indiqué chez les adultes traités par chimiothérapie pour des tumeurs solides, un lymphome malin ou un myélome multiple, et à risque de transfusion en raison de leur état général (par exemple, état cardiovasculaire, anémie pré‑existante au début de la chimiothérapie) pour le traitement de l'anémie et la réduction des besoins transfusionnels.
EPREX est indiqué chez les adultes participant à un programme de transfusions autologues différées pour augmenter les dons de sang autologue. Le traitement doit être uniquement administré aux patients présentant une anémie modérée (concentration d’hémoglobine comprise entre 10 et 13 g/dL [soit 6,2 - 8,1 mmol/L], sans carence martiale) s’il n’existe pas ou peu de méthodes d’épargne du sang lorsqu’une intervention chirurgicale majeure programmée nécessite de grandes quantités de sang (4 unités de sang ou plus chez les femmes et 5 unités de sang ou plus chez les hommes).
EPREX est indiqué chez les adultes, sans carence martiale, devant avoir une intervention chirurgicale orthopédique majeure programmée, ayant un risque présumé important de complications transfusionnelles pour réduire l'exposition aux transfusions de sang homologue. L'utilisation devra être réservée aux patients ayant une anémie modérée (par exemple, concentration d’hémoglobine comprise entre 10 et 13 g/dL) qui n'ont pas accès à un programme de transfusions autologues différées et chez lesquels on s’attend à des pertes de sang modérées (900 à 1800 mL).
EPREX est indiqué pour le traitement de l’anémie symptomatique (concentration d’hémoglobine ≤ 10 g/dL) chez les adultes atteints de syndromes myélodysplasiques (SMD) primitifs de risque faible ou intermédiaire 1, présentant un taux sérique d’érythropoïétine faible (< 200 mU/mL).
4.2. Posologie et mode d'administration
Toutes les autres causes d’anémie (carences en fer, folates ou vitamine B12, intoxication à l’aluminium, infection ou inflammation, pertes sanguines, hémolyse et fibrose médullaire quelle qu’en soit l’origine) doivent être évaluées et traitées avant d’instaurer un traitement par époétine alfa, et de décider d’augmenter la posologie. Pour garantir une réponse optimale à l’époétine alfa, des réserves en fer suffisantes doivent être assurées et une supplémentation en fer doit être administrée si besoin (voir rubrique 4.4).
Traitement de l’anémie symptomatique chez les patients adultes en insuffisance rénale chronique :
Les symptômes et conséquences de l’anémie peuvent varier avec l’âge, le sexe et les comorbidités ; une évaluation par le médecin de l’état de santé et de l’évolution clinique du patient est nécessaire.
L’intervalle recommandé pour la concentration d’hémoglobine désirée est compris entre 10 g/dL et 12 g/dL (6,2 à 7,5 mmol/L). EPREX doit être administré afin d’augmenter l’hémoglobine à un taux ne dépassant pas 12 g/dL (7,5 mmol/L). Une augmentation du taux d’hémoglobine supérieure à 2 g/dL (1,25 mmol/L) sur une période de quatre semaines doit être évitée. Si cela se produit, une adaptation appropriée de la dose doit être réalisée comme indiqué.
En raison de la variabilité intra-patient, des valeurs individuelles et occasionnelles du taux d’hémoglobine au-dessus et au-dessous de l’intervalle de concentrations d’hémoglobine désiré peuvent être observées chez un même patient. La variabilité du taux d’hémoglobine doit être prise en compte par l’adaptation de la posologie en tenant compte de l’intervalle de la concentration d’hémoglobine allant de 10 g/dL (6,2 mmol/L) à 12 g/dL (7,5 mmol/L).
Un taux d’hémoglobine prolongé supérieur à 12 g/dL (7,5 mmol/L) doit être évité. Si le taux d’hémoglobine augmente de plus de 2 g/dL (1,25 mmol/L) par mois, ou si le taux d’hémoglobine prolongé dépasse 12 g/dL (7,5 mmol/L), réduire la dose d’EPREX de 25 %. Si le taux d’hémoglobine dépasse 13 g/dL (8,1 mmol/L), interrompre le traitement jusqu’à ce que le taux s’abaisse en dessous de 12 g/dL (7,5 mmol/L) et reprendre le traitement par EPREX à une dose de 25 % inférieure à la dose précédente.
Les patients doivent être étroitement surveillés afin de s’assurer que la dose d’EPREX efficace la plus faible soit utilisée pour obtenir un contrôle adéquat de l’anémie et des symptômes de l’anémie tout en maintenant une concentration d’hémoglobine inférieure ou égale à 12 g/dL (7,5 mmol/L).
La prudence s’impose en cas d’augmentation de dose de l’ASE (Agent Stimulant l’Erythropoïèse) chez les patients ayant une insuffisance rénale chronique. Chez les patients ayant une réponse faible aux ASE, d’autres facteurs expliquant la faible réponse devront être considérés (voir rubriques 4.4 et 5.1).
Le traitement par EPREX est divisé en deux phases : une phase correctrice et une phase d’entretien.
Patients adultes en hémodialyse
Chez les patients en hémodialyse, lorsque la voie intraveineuse est déjà disponible, l’administration par la voie intraveineuse est préférable.
· Phase correctrice
La posologie initiale est de 50 UI/kg 3 fois par semaine.
Si nécessaire, augmenter ou diminuer la dose de 25 UI/kg (3 fois par semaine) jusqu’à atteindre l’intervalle de concentrations d’hémoglobine désiré, compris entre 10 g/dL et 12 g/dL (6,2 mmol/L à 7,5 mmol/L) (ceci doit être réalisé par palier d'au moins 4 semaines).
· Phase d'entretien
La dose totale recommandée par semaine est comprise entre 75 UI/kg et 300 UI/kg.
Une adaptation appropriée de la dose devra être réalisée pour maintenir les valeurs de l’hémoglobine dans l’intervalle de concentrations désiré, compris entre 10 g/dL et 12 g/dL (6,2 à 7,5 mmol/L).
Les patients avec un taux d'hémoglobine à l’instauration très bas (< 6 g/dL ou < 3,75 mmol/L) peuvent avoir besoin de doses d'entretien plus élevées que les patients dont l'anémie à l’instauration est moins sévère (> 8 g/dL ou > 5 mmol/L).
Patients adultes insuffisants rénaux non encore dialysés
Lorsque la voie intraveineuse n’est pas encore disponible, EPREX peut être administré par voie sous-cutanée.
· Phase correctrice
La posologie initiale est de 50 UI/kg 3 fois par semaine, suivie si nécessaire d'une augmentation de dose de 25 UI/kg (3 fois par semaine) jusqu'à atteindre le but désiré (ceci doit être réalisé par palier d'au moins 4 semaines).
· Phase d'entretien
Lors de la phase d’entretien, EPREX peut être administré 3 fois par semaine ou, dans le cas d’une administration par voie sous-cutanée, une fois par semaine ou une fois toutes les deux semaines.
Une adaptation appropriée de la dose et de l’intervalle d’administration devra être réalisée pour maintenir les valeurs de l'hémoglobine au taux désiré : hémoglobine entre 10 g/dL et 12 g/dL (6,2 à 7,5 mmol/L). Une prolongation de l’intervalle d’administration peut nécessiter une augmentation de la dose.
La posologie maximale ne doit pas excéder 150 UI/kg 3 fois par semaine, 240 UI/kg (jusqu’à un maximum de 20 000 UI) une fois par semaine, ou 480 UI/kg (jusqu’à un maximum de 40 000 UI) une fois toutes les deux semaines.
Patients adultes en dialyse péritonéale
Lorsque la voie intraveineuse n’est pas encore disponible, EPREX peut être administré par voie sous-cutanée.
· Phase correctrice
La posologie initiale est de 50 UI/kg 2 fois par semaine.
· Phase d'entretien
La dose d’entretien recommandée est comprise entre 25 UI/kg et 50 UI/kg, 2 fois par semaine en 2 injections identiques.
Une adaptation appropriée de la dose devra être réalisée pour maintenir les valeurs de l'hémoglobine au taux désiré, entre 10 g/dL et 12 g/dL (6,2 à 7,5 mmol/L).
Traitement des patients adultes ayant une anémie induite par la chimiothérapie
Les symptômes et conséquences de l’anémie peuvent varier avec l’âge, le sexe et l’impact global de la maladie ; une évaluation par le médecin de l’état de santé et de l’évolution clinique du patient est nécessaire.
EPREX doit être administré aux patients ayant une anémie (par exemple, une concentration d’hémoglobine ≤ 10 g/dL (6,2 mmol/L)).
La dose initiale est de 150 UI/kg administrée par voie sous-cutanée 3 fois par semaine.
Alternativement, EPREX peut être administré par voie sous-cutanée à la dose initiale de 450 UI/kg une fois par semaine.
Une adaptation appropriée de la dose devra être réalisée pour maintenir les valeurs de l'hémoglobine dans l’intervalle de concentrations désiré, compris entre 10 g/dL et 12 g/dL (6,2 à 7,5 mmol/L).
En raison de la variabilité intra-patient, des concentrations individuelles et occasionnelles du taux d’hémoglobine au-dessus et au-dessous de l’intervalle de concentrations d’hémoglobine désiré peuvent être observées chez un même patient. La variabilité du taux d’hémoglobine doit être prise en compte par l’adaptation de la posologie en tenant compte de l’intervalle de concentrations d’hémoglobine désiré, compris entre 10 g/dL (6,2 mmol/L) et 12 g/dL (7,5 mmol/L). Une concentration d’hémoglobine prolongée supérieure à 12 g/dL (7,5 mmol/L) doit être évitée ; des recommandations sur l’adaptation posologique appropriée lorsque les concentrations d’hémoglobine dépassent 12 g/dL (7,5 mmol/L) sont décrites ci-dessous.
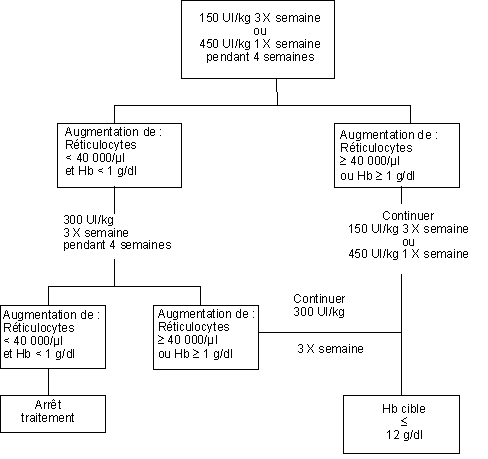
Si la concentration d'hémoglobine a augmenté d'au moins 1 g/dL (0,62 mmol/L), ou si le nombre de réticulocytes a augmenté d’au moins 40 000 cellules/µl par rapport aux valeurs initiales après 4 semaines de traitement, la dose doit être maintenue à 150 UI/kg 3 fois par semaine ou 450 UI/kg 1 fois par semaine.
Si l'augmentation de la concentration d'hémoglobine est inférieure à 1 g/dL (inférieure à 0,62 mmol/L) et si le nombre de réticulocytes a augmenté de moins de 40 000 cellules/µl par rapport aux valeurs initiales, augmenter la dose à 300 UI/kg 3 fois par semaine. Si après 4 semaines supplémentaires de traitement à 300 UI/kg 3 fois par semaine, la concentration d'hémoglobine a augmenté d’au moins 1 g/dL (au moins 0,62 mmol/L) ou le nombre de réticulocytes a augmenté d’au moins 40 000 cellules/µl, la dose de 300 UI/kg 3 fois par semaine doit être maintenue.
Si la concentration d'hémoglobine a augmenté de moins de 1 g/dL (moins de 0,62 mmol/L) et le nombre de réticulocytes a augmenté de moins de 40 000 cellules/µl par rapport aux valeurs initiales, la réponse est improbable et le traitement doit être arrêté.
Adaptation de la posologie pour maintenir les concentrations d’hémoglobine entre 10 g/dL et 12 g/dL
Si la concentration d’hémoglobine augmente de plus de 2 g/dL (1,25 mmol/L) par mois, ou si la concentration d’hémoglobine dépasse 12 g/dL (7,5 mmol/L), réduire la dose d’EPREX d’environ 25 % à 50 %.
Si la concentration d’hémoglobine dépasse 13 g/dL (8,1 mmol/L), interrompre le traitement jusqu’à ce que la concentration baisse en dessous de 12 g/dL (7,5 mmol/L) et reprendre le traitement par EPREX à une dose de 25 % inférieure à la dose précédente.
![]()
![]()
![]() Le schéma posologique recommandé est décrit ci-après :
Le schéma posologique recommandé est décrit ci-après :
 |
Les patients doivent être étroitement surveillés afin de s’assurer que la dose d’Agent Stimulant l’Erythropoïèse (ASE) la plus faible soit utilisée pour obtenir un contrôle adéquat des symptômes de l’anémie.
Le traitement par EPREX doit être poursuivi jusqu’à un mois après l’arrêt de la chimiothérapie.
Traitement des patients adultes en chirurgie participant à un programme de transfusions autologues différées
La posologie d'EPREX chez les patients ayant une anémie modérée (hématocrite entre 33 et 39 %) qui doivent donner au moins 4 unités de sang, est de 600 UI/kg par voie intraveineuse 2 fois par semaine pendant 3 semaines avant l'intervention. EPREX doit être administré après la fin de procédure du don de sang.
Traitement des patients adultes devant avoir une chirurgie orthopédique majeure programmée
La dose recommandée d’EPREX est de 600 UI/kg administrée par voie sous-cutanée une fois par semaine pendant les 3 semaines (jour -21, -14, -7) précédant l'intervention chirurgicale et le jour de l'intervention.
Si pour des raisons médicales la période avant l'intervention doit être réduite à moins de 3 semaines, EPREX doit être administré par voie sous-cutanée à la dose de 300 UI/kg tous les jours, pendant 10 jours consécutifs avant l'intervention, le jour de l'intervention et pendant les 4 jours suivant l'intervention.
Si la concentration d'hémoglobine atteint 15 g/dL ou plus pendant la période pré-opératoire, l'administration d'EPREX doit être arrêtée et les doses ultérieures initialement prévues ne doivent pas être administrées.
Traitement des patients adultes atteint d’un SMD de risque faible ou intermédiaire 1
EPREX doit être administré aux patients présentant une anémie symptomatique (i.e. concentration d’hémoglobine ≤10 g/dL (6.2 mmol/L)).
La dose initiale recommandée d’EPREX est de 450 UI/kg (la dose totale maximale est de 40 000 UI) administrée par voie sous-cutanée 1 fois chaque semaine, avec un espacement des doses d’au moins 5 jours.
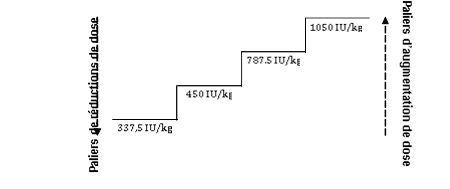
Des ajustements appropriés de doses doivent être appliqués afin de maintenir des concentrations d’hémoglobine comprises dans l’intervalle cible de 10 g/dL à 12 g/dL (6.2 à 7.5 mmol/L). Il est recommandé d’évaluer la réponse érythroïde 8 à 12 semaines suivant l’initiation du traitement. Les augmentations et diminutions de dose doivent être faites par paliers de dose successifs (voir diagramme ci-dessous). Une concentration en hémoglobine supérieure à 12 g/dL (7.5 mmol/L) doit être évitée.
Augmentation de dose : la dose ne doit pas être augmentée au-delà de 1050 UI/kg (dose totale de 80 000 UI) par semaine. Si le patient perd la réponse ou que la concentration en hémoglobine chute de ≥ 1 g/dL après la réduction de dose, celle-ci doit être augmentée d’un palier de dose. Un délai minimum de 4 semaines doit être respecté entre les augmentations de dose.
Suspension et diminution de dose : l'époétine alfa doit être suspendue lorsque la concentration d'hémoglobine dépasse 12 g/dL (7,5 mmol/L). Une fois que le taux d'hémoglobine est < 11 g/dL, la dose peut être redémarrée sur le même palier de dose ou sur un palier inférieur selon l’évaluation du médecin. Une diminution de dose en une seule étape peut être envisagée s'il y a une augmentation rapide du taux d'hémoglobine (> 2 g/dL sur 4 semaines).
Les symptômes et les séquelles de l'anémie peuvent varier en fonction de l'âge, du sexe et des comorbidités. Une évaluation individuelle de l'état du patient et du traitement par le médecin est nécessaire.
Population pédiatrique
Traitement de l’anémie symptomatique chez les patients insuffisants rénaux chroniques hémodialysés
Les symptômes et conséquences de l’anémie peuvent varier avec l’âge, le sexe et les co-morbidités ; une évaluation par le médecin de l’état de santé et de l’évolution clinique du patient est nécessaire.
Chez les enfants, l’intervalle de concentrations d’hémoglobine recommandé est compris entre 9,5 g/dL et 11 g/dL (5,9 et 6,8 mmol/L). EPREX doit être administré afin d’augmenter l’hémoglobine à un taux ne dépassant pas 11 g/dL (6,8 mmol/L). Une augmentation du taux d’hémoglobine supérieure à 2 g/dL (1,25 mmol/L) sur une période de quatre semaines doit être évitée. Si cela se produit, une adaptation appropriée de la dose doit être réalisée comme indiqué.
Les patients doivent être étroitement surveillés afin de s’assurer que la dose d’EPREX la plus faible soit utilisée pour obtenir un contrôle adéquat de l’anémie et des symptômes de l’anémie.
Le traitement par EPREX est divisé en deux phases : une phase correctrice et une phase d’entretien.
Chez les enfants hémodialysés, lorsque la voie intraveineuse est déjà disponible, l’administration par la voie intraveineuse est préférable.
· Phase correctrice
La posologie initiale est de 50 UI/kg 3 fois par semaine par voie intraveineuse.
Si nécessaire, augmenter ou diminuer la dose de 25 UI/kg (3 fois par semaine) jusqu'à atteindre l’intervalle de concentrations d’hémoglobine désiré, compris entre 9,5 g/dL et 11 g/dL (5,9 à 6,8 mmol/L) (ceci doit être réalisé par palier d’au moins 4 semaines).
· Phase d'entretien
Une adaptation appropriée de la dose devra être réalisée afin de maintenir un taux d’hémoglobine dans l’intervalle de concentrations désiré, compris entre 9,5 g/dL et 11 g/dL (5,9 et 6,8 mmol/L).
Généralement les enfants de moins de 30 kg nécessitent des doses d’entretien plus importantes que ceux de plus de 30 kg et que les adultes.
Les enfants avec un taux d'hémoglobine à l’instauration très bas (< 6,8 g/dL ou < 4,25 mmol/L) peuvent avoir besoin de doses d'entretien plus importantes que ceux dont le taux d'hémoglobine à l’instauration est plus élevé (> 6,8 g/dL ou > 4,25 mmol/L).
Anémie chez les patients insuffisants rénaux chroniques avant l’instauration de la dialyse ou en dialyse péritonéale
La sécurité et l’efficacité d’EPREX chez les patients insuffisants rénaux chroniques et anémiés, avant l’instauration de la dialyse ou étant en dialyse péritonéale, n’ont pas encore été établies. Les données actuellement disponibles concernant l’utilisation d’EPREX par voie sous-cutanée dans ces populations sont décrites dans la rubrique 5.1 mais aucune recommandation posologique ne peut être donnée.
Traitement des enfants ayant une anémie induite par la chimiothérapie
La sécurité et l’efficacité d’EPREX chez les enfants recevant une chimiothérapie n’ont pas encore été établies (voir rubrique 5.1).
Traitement des enfants en chirurgie participant à un programme de transfusions autologues différées
La sécurité et l’efficacité d’EPREX chez les enfants n’ont pas encore été établies. Aucune donnée n’est disponible.
Traitement des enfants devant avoir une chirurgie orthopédique majeure programmée
La sécurité et l’efficacité d’EPREX chez les enfants n’ont pas encore été établies. Aucune donnée n’est disponible.
Mode d’administration
Précautions à prendre avant la manipulation et l’administration du médicament :
Avant utilisation, laisser reposer la seringue d’EPREX jusqu’à ce qu’elle atteigne la température ambiante. Ceci prend habituellement 15 à 30 minutes.
Traitement de l’anémie symptomatique chez les patients adultes insuffisants rénaux chroniques
Chez les patients en insuffisance rénale chronique dont l’accès à la voie intraveineuse est déjà disponible (patients hémodialysés), l’administration d’EPREX par voie intraveineuse est préférable.
Lorsque l’accès à la voie intraveineuse n’est pas encore disponible (patients non encore dialysés et patients en dialyse péritonéale), EPREX peut être administré par injection sous-cutanée.
Traitement des patients adultes ayant une anémie induite par la chimiothérapie
EPREX doit être administré par injection sous-cutanée.
Traitement des patients adultes en chirurgie participant à un programme de transfusions autologues différées
EPREX doit être administré par voie intraveineuse.
Traitement des patients adultes devant avoir une chirurgie orthopédique majeure programmée
EPREX doit être administré par injection sous-cutanée.
Traitement des patients adultes atteints de SMD de risque faible ou intermédiaire 1
EPREX doit être administré par injection sous-cutanée.
Traitement de l’anémie symptomatique chez les enfants insuffisants rénaux chroniques hémodialysés
Chez les enfants en insuffisance rénale chronique dont l’accès à la voie intraveineuse est déjà disponible (patients hémodialysés), l’administration d’EPREX par voie intraveineuse est préférable.
Administration intraveineuse
Administrer en une à cinq minutes au moins, selon la dose totale. Chez les patients en hémodialyse, une injection en bolus peut être réalisée pendant la séance de dialyse dans le site d'injection approprié situé au niveau du retour veineux de la ligne de dialyse. Autrement, l’injection peut être faite à la fin de la séance de dialyse dans l'aiguille à fistule, en la faisant suivre d'un rinçage par 10 mL de solution saline isotonique afin d'assurer le bon passage du produit dans la circulation.
Une administration plus lente est préférable chez les patients qui auraient présenté des symptômes pseudo‑grippaux (voir rubrique 4.8).
Ne pas administrer EPREX en perfusion intraveineuse, ni en mélange avec d'autres solutions de médicaments.
Administration sous-cutanée
Un volume maximal de 1 mL par site d'injection ne doit généralement pas être dépassé. En cas de volume plus important, utiliser plus d'un site pour l'injection.
Les injections se font au niveau des membres ou de la paroi abdominale antérieure.
Dans le cas où le médecin décide que le patient ou le personnel soignant peut administrer EPREX par voie sous-cutanée de manière sûre et efficace, des instructions pour un bon dosage et une bonne administration doivent être fournies.
Comme avec les autres médicaments injectables, assurez-vous de l’absence de particules dans la solution ou d’un changement de couleur.
Marques de graduation
L'étiquette de la seringue contient des marques de graduation numérotées afin de permettre l'administration d'une partie de la dose (voir rubrique 6.6). Cependant, le produit est à usage unique seulement. Une seule dose d'EPREX doit être utilisée pour chaque seringue.
· Hypersensibilité à la substance active ou à l'un des excipients mentionnés à la rubrique 6.1.
· Les patients ayant développé une érythroblastopénie à la suite d'un traitement par une érythropoiétine ne doivent pas être traités par EPREX ou par toute autre érythropoiétine (voir rubrique 4.4 - Erythroblastopénie).
· Hypertension non contrôlée.
· Toutes les contre-indications associées à un programme de transfusions autologues différées doivent être respectées chez les patients qui reçoivent EPREX au cours d'un tel programme.
· L'utilisation d'EPREX, chez les patients devant avoir une intervention chirurgicale orthopédique majeure programmée et ne participant pas à un programme de transfusions autologues différées, est contre‑indiquée chez les patients présentant une pathologie vasculaire sévère coronarienne, des artères périphériques, carotidienne, ou cérébrales, y compris chez les patients présentant des antécédents récents d'infarctus du myocarde ou d'accident vasculaire cérébral.
· Les patients en chirurgie qui, quelle qu'en soit la raison, ne peuvent pas recevoir une prophylaxie antithrombotique appropriée.
4.4. Mises en garde spéciales et précautions d'emploi
Afin d'améliorer la traçabilité des médicaments biologiques, le nom et le numéro de lot du produit administré doivent être clairement enregistrés.
Généralités
Chez tous les patients traités par époétine alfa, la pression artérielle doit être suivie étroitement et contrôlée de façon appropriée. Epoétine alfa doit être utilisée avec précaution en présence d'une hypertension non ou insuffisamment traitée ou difficilement contrôlable. Il peut être nécessaire d’instaurer ou d'augmenter le traitement anti‑hypertenseur. Si la pression artérielle ne peut être contrôlée, le traitement par époétine alfa doit être interrompu.
Des crises hypertensives avec encéphalopathie et convulsions, nécessitant l'attention immédiate d'un médecin et la prise en charge en soins intensifs, sont également survenues pendant le traitement par époétine alfa chez des patients dont la pression artérielle était précédemment normale ou basse. Une attention particulière devra être accordée aux céphalées violentes pseudo-migraineuses d’apparition brutale, comme un possible signal d'alarme (voir rubrique 4.8).
L’époétine alfa doit être utilisée avec précaution chez les patients épileptiques, ayant des antécédents de convulsions, ou ayant des pathologies associées à une prédisposition aux convulsions, comme les infections du SNC et les métastases cérébrales.
L’époétine alfa doit être utilisée avec précaution chez les patients ayant une insuffisance hépatique chronique. La sécurité de l’époétine alfa n’a pas été établie chez les patients ayant un dysfonctionnement hépatique.
Une augmentation de l’incidence des événements vasculaires thrombotiques (EVT) a été observée chez les patients recevant des ASE (voir rubrique 4.8). Ces événements incluent les thromboses veineuses ou artérielles et les embolies (dont certaines avec une issue fatale), tels que thrombose veineuse profonde, embolie pulmonaire, thrombose rétinienne et infarctus du myocarde. En outre, des accidents vasculaires cérébraux (incluant infarctus cérébral, hémorragie cérébrale et accidents ischémiques transitoires) ont été rapportés.
Le risque rapporté d’EVT doit être soigneusement évalué au regard du bénéfice du traitement par époétine alfa, en particulier chez les patients ayant des facteurs de risque préexistants d’EVT, incluant obésité et antécédents d’EVT (par exemple, thrombose veineuse profonde, embolie pulmonaire, et accident vasculaire cérébral).
Chez tous les patients, les taux d’hémoglobine doivent être étroitement surveillés en raison du risque potentiel augmenté d’évènements thrombo-emboliques et d’évolutions fatales lorsque les patients sont traités à des taux d’hémoglobine supérieurs à l’intervalle de concentration correspondant à l’indication utilisée.
Lors d'un traitement par époétine alfa, une augmentation modérée et dose-dépendante de la numération plaquettaire, dans les limites de la normale, peut être observée. Celle-ci régresse avec la poursuite du traitement. De plus, des cas de thrombocytémie supérieurs au taux normal ont été rapportés. Il est conseillé de surveiller la numération plaquettaire à intervalles réguliers pendant les 8 premières semaines de traitement.
Toutes les autres causes d'anémie (carences en fer, folates ou vitamine B12, intoxication à l’aluminium, infection ou inflammation, pertes sanguines, hémolyse et fibrose médullaire quelle qu’en soit l’origine) doivent être évaluées et traitées avant d'instaurer le traitement par époétine alfa et de décider d’augmenter la posologie. Dans la plupart des cas, les taux de ferritine sérique chutent parallèlement à l'augmentation de l'hématocrite. Pour garantir une réponse optimale à l’époétine alfa, des réserves en fer suffisantes doivent être assurées et une supplémentation en fer doit être administrée si besoin (voir rubrique 4.2). Pour la sélection de la meilleure option de traitement en fonction des besoins du patient, il convient de suivre les recommandations actuelles concernant la supplémentation en fer, ainsi que les instructions posologiques approuvées et mentionnées dans le Résumé des Caractéristiques du Produit (RCP) du médicament à base de fer :
· Pour les patients ayant une insuffisance rénale chronique, une supplémentation en fer est recommandée si les taux de ferritine sérique sont inférieurs à 100 ng/mL.
· Pour les patients atteints d’un cancer, une supplémentation en fer est recommandée si le coefficient de saturation de transferrine est inférieur à 20 %.
· Pour les patients participant à un programme de transfusions autologues différées, une supplémentation en fer doit être administrée plusieurs semaines en amont de l’instauration du prélèvement autologue afin de constituer des réserves en fer élevées avant d’instaurer le traitement par époétine alfa, et pendant toute la durée du traitement par époétine alfa.
· Pour les patients devant avoir une intervention chirurgicale orthopédique majeure programmée, une supplémentation en fer devra être administrée pendant toute la durée du traitement par époétine alfa. Si possible, la supplémentation en fer doit être instaurée avant de commencer le traitement par époétine alfa pour constituer des réserves en fer suffisantes.
L’apparition ou l’aggravation d’une porphyrie a été très rarement observée chez les patients traités par époétine alfa. L’époétine alfa doit être utilisée avec précaution chez les patients atteints de porphyrie.
Des réactions indésirables cutanées sévères (SCAR), dont le syndrome de Stevens-Johnson (SSJ) et le syndrome de Lyell, pouvant engager le pronostic vital ou être fatales ont été signalées dans le cadre de traitements à base d’époétine. Des cas plus graves ont été observés lors de l’utilisation d’époétines à longue durée d’action.
Au moment de la prescription, les patients doivent être informés des signes et symptômes et faire l’objet d’une surveillance étroite des réactions cutanées. Si des signes ou symptômes évoquant l’une de ces réactions apparaissent, EPREX doit être arrêté immédiatement et un traitement de substitution doit être envisagé.
Si le patient a développé une réaction cutanée sévère telle que le SSJ ou le syndrome de Lyell en raison de l’utilisation d’EPREX, il ne faut jamais réintroduire un traitement à base d’EPREX chez ce patient.
Le capuchon d’aiguille de la seringue préremplie contient du caoutchouc naturel sec (un dérivé du latex), qui peut provoquer de graves réactions allergiques chez les personnes sensibles au latex. Les patients ne peuvent voir leur traitement modifié d’un ASE à un autre que sous une surveillance adaptée.
Erythroblastopénies
Des érythroblastopénies avec anticorps ont été rapportées après plusieurs mois ou années de traitement par époétine alfa.
Des cas ont également été rapportés chez des patients atteints d’hépatite C et traités par interféron et ribavirine lors de l’utilisation concomitante d’ASE. L’époétine alfa n’est pas approuvée dans la prise en charge de l’anémie associée à une hépatite C.
Chez les patients présentant une perte soudaine d’efficacité définie par une baisse de l’hémoglobine (de 1 à 2 g/dL par mois) avec une augmentation des besoins transfusionnels, une numération des réticulocytes doit être réalisée et les causes habituelles de non réponse (carences en fer, folates ou vitamine B12, intoxication à l’aluminium, infection ou inflammation, pertes sanguines, hémolyse et fibrose médullaire quelle qu’en soit l’origine) doivent être recherchées.
Une diminution paradoxale du taux d’hémoglobine et le développement d’une anémie sévère associée à un faible taux de réticulocytes imposent l’arrêt immédiat du traitement par l’époétine alfa et une recherche des anticorps anti-érythropoïétine. Une ponction médullaire doit aussi être envisagée pour confirmer le diagnostic d’érythroblastopénie.
Aucun traitement par un autre ASE ne devra être débuté en raison du risque de réaction croisée.
Traitement de l’anémie symptomatique chez l’adulte et l’enfant en insuffisance rénale chronique :
Chez les patients en insuffisance rénale chronique traités par époétine alfa, les taux d'hémoglobine doivent être régulièrement mesurés jusqu'à ce qu'un taux stable soit atteint, puis périodiquement ensuite.
Chez les patients insuffisants rénaux chroniques, le taux d'hémoglobine doit augmenter d'environ 1 g/dL (0,62 mmol/L) par mois et ne pas dépasser 2 g/dL/mois (1,25 mmol/L) afin de minimiser les risques d'hypertension.
Chez les patients en insuffisance rénale chronique, la concentration d’hémoglobine d’entretien ne doit pas dépasser la limite supérieure de l’intervalle des concentrations d’hémoglobine telle que recommandée dans la rubrique 4.2. Dans les études cliniques, un risque augmenté de décès et d’évènements cardiovasculaires graves a été observé lorsque les ASE étaient administrés afin d’obtenir un taux d’hémoglobine supérieur à 12 g/dL (7,5 mmol/L).
Les études cliniques contrôlées n’ont pas montré de bénéfices significatifs attribuables à l’administration d’époétines lorsque la concentration d’hémoglobine est augmentée au-delà du taux nécessaire pour contrôler les symptômes de l’anémie et pour éviter une transfusion sanguine.
La prudence s’impose en cas d’augmentation de dose d’EPREX chez les patients ayant une insuffisance rénale chronique car des doses cumulatives d’époétine élevées peuvent être associées à un risque accru de mortalité et d’évènements graves cardiovasculaires et cérébrovasculaires. Chez les patients ayant une réponse faible aux époétines, d’autres facteurs expliquant la faible réponse devront être considérées (voir rubriques 4.2 et 5.1).
Les patients en insuffisance rénale chronique traités par époétine alfa par voie sous-cutanée devront être suivis régulièrement afin de rechercher une perte d’efficacité, définie par l’absence de réponse ou une diminution de la réponse au traitement par époétine alfa chez des patients antérieurement répondeurs à ce traitement. Cette perte d’efficacité est caractérisée par une diminution constante de l’hémoglobine malgré l’augmentation des doses d’époétine alfa (voir rubrique 4.8).
Certains patients ayant un intervalle d’administration d’époétine alfa plus long (supérieur à une semaine) peuvent ne pas maintenir un taux d’hémoglobine approprié (voir rubrique 5.1) et peuvent nécessiter une augmentation de la dose d’époétine alfa. Les taux d’hémoglobine doivent être surveillés régulièrement.
Des thromboses de la fistule artério-veineuse sont survenues chez les patients hémodialysés, particulièrement chez ceux ayant une tendance à l'hypotension ou présentant des complications au niveau de leur fistule (par exemple sténoses, anévrysmes, etc.). Une révision précoce de la fistule artério-veineuse et une prophylaxie anti-thrombotique par administration d’acide acétylsalicylique, par exemple, sont recommandées chez ces patients.
Une hyperkaliémie a été observée dans des cas isolés, bien que le lien de causalité n’ait pas été établi. L'ionogramme sanguin doit être surveillé chez les patients insuffisants rénaux chroniques. En cas d'hyperkaliémie ou d'augmentation de la kaliémie, l'arrêt d'époétine alfa jusqu'à correction du taux sérique de potassium peut être envisagé en plus du traitement approprié de l’hyperkaliémie.
Lors d'un traitement par époétine alfa, l'augmentation de l'hématocrite rend souvent nécessaire d'augmenter les doses d'héparine pendant l'hémodialyse. L’obstruction du système de dialyse peut survenir si l'héparinisation n'est pas optimale.
D'après les données disponibles à ce jour, la correction de l'anémie par époétine alfa chez les patients adultes insuffisants rénaux non encore dialysés n'accélère pas l'évolution de l'insuffisance rénale.
Traitement des patients ayant une anémie induite par la chimiothérapie :
Chez les patients atteints d’un cancer traités par époétine alfa, les taux d'hémoglobine doivent être régulièrement mesurés jusqu'à ce qu'un taux stable soit atteint, puis périodiquement ensuite.
Les époétines sont des facteurs de croissance qui stimulent essentiellement la production de globules rouges. Des récepteurs à l’érythropoïétine peuvent être présents à la surface de diverses cellules malignes. Comme pour tout facteur de croissance, la possibilité que les époïétines puissent stimuler la croissance des tumeurs ne peut pas être exclue.
Le rôle des ASE sur la progression tumorale ou la réduction de la survie sans progression ne peut être exclu. Dans des études cliniques contrôlées, l’utilisation d’époétine alfa et d’autres ASE a été associée à une diminution du contrôle loco-régional ou à une diminution de la survie globale :
· une diminution du contrôle loco-régional chez des patients atteints d’un cancer de la tête et du cou avancé recevant une radiothérapie lorsque l’administration visait un taux d’hémoglobine supérieur à 14 g/dL (8,7 mmol/L),
· un raccourcissement de la survie globale et une augmentation du nombre de décès attribués à la progression de la maladie à 4 mois chez des patients atteints d’un cancer du sein métastatique recevant une chimiothérapie lorsque l’administration visait un taux d’hémoglobine de 12 à 14 g/dL (7,5 à 8,7 mmol/L),
· une augmentation du risque de décès lorsque l’administration visait un taux d’hémoglobine de 12 g/dL (7,5 mmol/L) chez des patients ayant une maladie maligne active ne recevant ni chimiothérapie ni radiothérapie. Les ASE ne sont pas indiqués pour une utilisation dans cette population de patients,
· une augmentation observée de 9 % du risque de progression de la maladie ou de décès dans le bras associant époétine alfa à des traitements standards d’après les résultats d’une analyse primaire et une augmentation du risque de 15 % ne pouvant être statistiquement exclu chez les patients recevant une chimiothérapie pour un cancer du sein métastatique, lorsque l’administration visait un taux d’hémoglobine compris entre 10 et 12 g/dL (6,2 à 7,5 mmol/L).
Au vu des informations ci-dessus, dans certaines situations cliniques, la transfusion sanguine devrait être le traitement privilégié de l’anémie des patients atteints de cancer. La décision d’administrer une érythropoïétine recombinante doit être déterminée sur une évaluation du bénéfice/risque prenant en compte l’avis du patient dans son contexte clinique spécifique. Les facteurs à considérer dans cette évaluation doivent inclure le type de tumeur et son stade, le degré de l’anémie, l’espérance de vie, l’environnement dans lequel le patient est traité et la préférence du patient (voir rubrique 5.1).
Lorsque l'on évalue le caractère approprié d'un traitement par époétine alfa chez les patients atteints d’un cancer recevant une chimiothérapie (patient à risque d'être transfusé), il faut tenir compte du fait que l'apparition des globules rouges suit l'administration de l’ASE avec un délai de 2 à 3 semaines.
Patients adultes en chirurgie participant à un programme de transfusions autologues différées
Toutes les mises en garde et précautions particulières d'emploi associées à un programme de transfusions autologues différées doivent être respectées, en particulier le remplacement en routine du volume prélevé.
Patients devant avoir une chirurgie orthopédique majeure programmée
Les bonnes pratiques de gestion du sang doivent toujours être appliquées dans le cadre péri-opératoire. Les patients devant bénéficier d'une chirurgie orthopédique majeure programmée, doivent recevoir une prophylaxie antithrombotique appropriée, dans la mesure où des événements thrombotiques et vasculaires peuvent survenir chez ces patients, particulièrement chez ceux ayant une pathologie cardio-vasculaire sous-jacente. De plus, des précautions particulières doivent être prises chez les patients à risque de développer des thromboses veineuses profondes. Enfin, chez les patients ayant un taux initial d'hémoglobine supérieur à 13 g/dL, la possibilité que le traitement par époétine alfa soit associé à un risque accru d'événements thrombotiques/vasculaires post-opératoires, ne peut être exclue. En conséquence, l'époétine alfa ne doit pas être utilisée chez les patients qui ont un taux d'hémoglobine initial supérieur à 13 g/dL.
Excipients
Sodium
Ce médicament contient moins de 1 mmol de sodium (23 mg) par dose, c’est-à-dire qu’il est essentiellement « sans sodium ».
Polysorbate 80
Ce médicament contient un maximum de 0,30 mg de polysorbate 80 (E 433) par seringue, équivalent à une concentration de 0,30 mg/mL. Les polysorbates peuvent provoquer des réactions allergiques.
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
Il n'existe aucune donnée qui indique une éventuelle interaction d’époétine alfa avec le métabolisme d'autres médicaments. Les médicaments diminuant l’érythropoïèse peuvent diminuer la réponse à l’époétine alfa.
Etant donné que la ciclosporine se lie aux érythrocytes, une interaction demeure possible. Si l'époétine alfa est administrée en association avec la ciclosporine, les taux sanguins de ciclosporine doivent être surveillés et la dose de ciclosporine ajustée en fonction de l'augmentation de l'hématocrite.
Il n'existe pas de données indiquant une interaction entre l’époétine alfa et le G-CSF ou le GM-CSF en ce qui concerne la différenciation ou la prolifération hématologique des échantillons de biopsies tumorales in vitro.
Chez les patientes adultes ayant un cancer du sein métastatique, la co-administration par voie sous-cutanée de 40 000 UImL/mLd’époétine alfa et de 6 mg/kg de trastuzumab n’a pas eu d’effet sur la pharmacocinétique du trastuzumab.
4.6. Fertilité, grossesse et allaitement
Grossesse
Il n'existe aucune étude spécifique et contrôlée chez la femme enceinte. Les études effectuées chez l'animal ont mis en évidence une toxicité sur la reproduction (voir rubrique 5.3).
En conséquence, l'époétine alfa ne doit être utilisée en cas de grossesse que si le bénéfice escompté justifie le risque potentiel pour le fœtus.
L'utilisation d'époétine alfa n'est pas recommandée chez les patientes enceintes participant à un programme de transfusions autologues différées avant une chirurgie.
Il n’a pas été établi si l’époétine alfa exogène est excrétée dans le lait humain. L’époétine alfa doit être utilisée avec précaution chez la femme qui allaite. La décision de continuer/interrompre l’allaitement ou de continuer/interrompre le traitement par époétine alfa doit être prise en prenant en compte le bénéfice de l’allaitement pour l’enfant au regard du bénéfice du traitement par époétine alfa pour la mère.
L'utilisation d'époétine alfa n'est pas recommandée chez les patientes allaitant participant à un programme de transfusions autologues différées avant une chirurgie.
Fertilité
Il n’existe aucune étude évaluant l’effet potentiel de l’époétine alfa sur la fertilité masculine ou féminine.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
Résumé du profil de tolérance
L'effet indésirable le plus fréquent lors du traitement par époétine alfa est une augmentation dose‑dépendante de la pression artérielle ou une aggravation d'une hypertension pré‑existante. Une surveillance de la pression artérielle doit être réalisée, en particulier en début de traitement (voir rubrique 4.4).
Les effets indésirables survenant le plus fréquemment lors des études cliniques conduites avec l’époétine alfa sont diarrhées, nausées, vomissements, pyrexie et céphalée. Un syndrome grippal peut survenir, en particulier en début de traitement.
Une congestion des voies respiratoires, incluant des évènements de congestion des voies respiratoires supérieures, des congestions nasales et des rhinopharyngites, ont été rapportés lors d’études chez des patients adultes insuffisants rénaux non encore dialysés traités avec un intervalle d’administration prolongé.
Une augmentation de l’incidence des événements vasculaires thrombotiques (EVT) a été observée chez les patients recevant des ASE (voir rubrique 4.4).
Liste tabulée des effets indésirables
Sur un total de 3417 sujets ayant participé à 25 études randomisées, en double aveugle, contrôlées versus placebo ou un traitement de référence, le profil global de sécurité d’emploi d’EPREX a été évalué chez 2094 sujets anémiques. Etaient inclus 228 sujets atteints d’IRC traités par époétine alfa dans 4 études conduites dans l’insuffisance rénale chronique (2 études en prédialyse [N = 131 sujets IRC exposés] et 2 études en dialyse [N = 97 sujets IRC exposés]) ; 1 404 sujets atteints d’un cancer exposés dans 16 études conduites dans l’anémie chimio-induite, 147 sujets exposés dans 2 études relatives au programme de transfusions autologues différées, 213 sujets exposés dans 1 étude en période péri-opératoire et 102 sujets exposés dans 2 études dans les SMD. Les effets indésirables rapportés chez ≥ 1 % des sujets traités par époétine alfa dans ces études sont présentés dans le tableau ci-dessous.
Les fréquences sont définies de la manière suivante : très fréquent (≥ 1/10) ; fréquent (≥ 1/100, < 1/10) ; peu fréquent (≥ 1/1 000, < 1/100) ; rare (≥ 1/10 000, < 1/1 000) ; très rare (< 1/10 000) ; fréquence indéterminée (ne peut être estimée sur la base des données disponibles).
|
Classes de systèmes d’organes |
Effet indésirable |
Fréquence |
|
Affections hématologiques et du système lymphatique |
Erythroblastopénie3 Thrombocytémie |
Rare |
|
Troubles du métabolisme et de la nutrition |
Hyperkaliémie1 |
Peu fréquent |
|
Affection du système immunitaire |
Hypersensibilité3 |
Peu fréquent |
|
Réaction anaphylactique3 |
Rare |
|
|
Affection du système nerveux |
Céphalées |
Fréquent |
|
Convulsions |
Peu fréquent |
|
|
Affections vasculaires |
Hypertension, Thromboses veineuses et artérielles 2 |
Fréquent |
|
Crise aiguë d’hypertension3 |
Fréquence indéterminée |
|
|
Affections respiratoires, thoraciques et médiastinales |
Toux |
Fréquent |
|
Congestion des voies respiratoires |
Peu fréquent |
|
|
Affections gastro-intestinales |
Diarrhées, Nausées, Vomissements |
Très fréquent |
|
Affections de la peau et du tissu sous-cutané |
Rash |
Fréquent |
|
Urticaire3 |
Peu fréquent |
|
|
Œdème angioneurotique3 |
Fréquence indéterminée |
|
|
Affections musculo-squelettiques et du tissu conjonctif |
Arthralgie, Douleur osseuse, Myalgie, Extrémités douloureuses |
Fréquent |
|
Affections congénitales, familiales et génétiques |
Porphyrie aiguë3 |
Rare |
|
Troubles généraux et anomalies au site d'administration |
Fièvre |
Très fréquent |
|
Frissons, Syndrome grippal, Réaction au site d’injection, Œdèmes périphériques |
Fréquent |
|
|
Inefficacité médicamenteuse3 |
Fréquence indéterminée |
|
|
Investigations |
Présence d’anticorps anti-érythropoïétine |
Rare |
|
1 Fréquent en dialyse. 2 Inclut les événements artériels et veineux, d’issue fatale et non fatale, tels que thrombose veineuse profonde, embolie pulmonaire, thrombose rétinienne, thrombose artérielle (y compris infarctus du myocarde), accidents vasculaires cérébraux (y compris infarctus cérébral et hémorragie cérébrale), accidents ischémiques transitoires, et thrombose d'une dérivation artério-veineuse (y compris la fistule de dialyse) et thrombose au niveau d’anévrismes de dérivations artérioveineuses. 3 Présenté dans la sous-rubrique ci-dessous et/ou dans la rubrique 4.4. |
||
Descriptions d’effets indésirables particuliers
Des réactions d'hypersensibilité, incluant des cas de rash (y compris urticaire), de réactions anaphylactiques et d’œdème angioneurotique ont été rapportées.
Des réactions indésirables cutanées sévères (SCAR), dont le syndrome de Stevens-Johnson (SSJ) et le syndrome de Lyell, pouvant engager le pronostic vital ou être fatales ont été rapportées dans le cadre de traitements à base d’époétine (voir rubrique 4.4).
Des crises hypertensives avec encéphalopathie et convulsions, nécessitant l'attention immédiate d'un médecin et la prise en charge en soins intensifs, sont également survenues pendant le traitement par époétine alfa chez des patients dont la pression artérielle était préalablement normale ou basse. Une attention particulière devra être accordée aux céphalées violentes pseudo-migraineuses d’apparition brutale comme un possible signal d'alarme (voir rubrique 4.4).
Des cas d’érythroblastopénies avec anticorps ont été rapportés très rarement chez moins d’un cas pour 10 000 patients-années après des mois ou années de traitement par EPREX (voir rubrique 4.4). Les cas signalés étaient plus nombreux après administration sous-cutanée (SC) qu’après administration intraveineuse (IV).
Patients adultes atteints de SMD de risque faible ou intermédiaire 1
Dans l'étude multicentrique randomisée, en double aveugle, contrôlée versus placebo, 4 (4,7 %) sujets ont présenté des EVT (mort subite, accident vasculaire cérébral ischémique, embolie et phlébite). Tous les EVT se sont produits dans le groupe de l'époétine alfa et dans les 24 premières semaines de l'étude. Trois ont été confirmés en tant qu’EVT et pour le cas restant (mort subite), l'événement thromboembolique n'a pas été confirmé. Deux sujets présentaient des facteurs de risque significatifs (fibrillation auriculaire, insuffisance cardiaque et thrombophlébite).
Population pédiatrique en insuffisance rénale chronique et hémodialysée
L’exposition chez les enfants insuffisants rénaux chroniques hémodialysés, dans les essais cliniques et après la commercialisation, est limitée. Aucun effet indésirable spécifique de la population pédiatrique non mentionné dans le tableau ci-dessus, ou non cohérent avec la pathologie sous-jacente n’a été rapporté dans cette population.
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr/.
La marge thérapeutique d'époétine alfa est très large. Un surdosage d'époétine alfa peut entraîner une exacerbation des effets pharmacologiques de l'hormone. Une saignée peut être pratiquée si un taux excessif d'hémoglobine est atteint. Tout autre traitement médical nécessaire doit être mis en place.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Classe pharmacothérapeutique : Antianémique. Code ATC : B03XA01.
Mécanisme d’action
L’érythropoïétine (EPO) est une hormone glycoprotéique produite principalement par le rein en réponse à une hypoxie et constitue le facteur clé de la régulation de la production d’érythrocytes. L’EPO est impliquée dans toutes les phases de l’érythropoïèse, et exerce son principal effet au niveau des précurseurs érythroïdes. Après s’être fixée sur ses récepteurs à la surface des cellules, l’EPO active les voies de transduction du signal qui interfèrent avec l’apoptose et stimule la prolifération des cellules érythroïdes. L’EPO recombinante humaine (époétine alfa), synthétisée par des cellules ovariennes de hamster chinois, a une séquence de 165 acides aminés identique à celle de l’EPO urinaire humaine ; les analyses fonctionnelles ne permettent pas de distinction entre les deux. Le poids moléculaire apparent de l’érythropoïétine est de 32 000 à 40 000 daltons.
L’érythropoïétine est un facteur de croissance qui stimule principalement la production de globules rouges. Les récepteurs de l’érythropoïétine peuvent être exprimés à la surface de diverses cellules malignes.
Effets pharmacodynamiques
Volontaires sains
Après l’administration de doses uniques (doses de 20 000 à 160 000 UI par voie sous-cutanée) d’époétine alfa, une réponse dose-dépendante a été observée sur les marqueurs pharmacodynamiques étudiés, incluant les réticulocytes, les érythrocytes et l’hémoglobine. Un profil défini de concentrations en fonction du temps, avec un pic et un retour aux valeurs initiales, a été observé pour les modifications des réticulocytes exprimées en pourcentage. Un profil moins défini a été observé pour les érythrocytes et l’hémoglobine. De façon générale, tous les marqueurs pharmacodynamiques ont augmenté de manière linéaire avec la dose, la réponse maximale étant obtenue aux doses les plus élevées.
D’autres études pharmacodynamiques ont comparé la posologie de 40 000 UI une fois par semaine versus 150 UI/kg 3 fois par semaine. Malgré des différences dans les profils de concentrations en fonction du temps, la réponse pharmacodynamique (mesurée par les modifications en pourcentage des réticulocytes, de l’hémoglobine et du nombre total d’érythrocytes) a été similaire entre ces schémas de traitement. D’autres études ont comparé la posologie de 40 000 UI d’époétine alfa une fois par semaine à des doses comprises entre 80 000 et 120 000 UI une fois toutes les deux semaines par voie sous-cutanée. Globalement, d’après les résultats de ces études pharmacodynamiques conduites chez des sujets sains, le schéma posologique à 40 000 UI une fois par semaine semble plus efficace sur la production d’érythrocytes que le schéma à une fois toutes les deux semaines, malgré une similitude observée entre ces deux schémas sur la production de réticulocytes.
Insuffisance rénale chronique
L’époétine alfa a montré stimuler l’érythropoïèse chez les patients IRC anémiques, incluant les patients en pré-dialyse et les patients dialysés. Le premier signe de réponse à l’époétine alfa est une augmentation de la numération des réticulocytes dans les 10 jours, suivie d’une augmentation de la numération érythrocytaire, de l’hémoglobine et de l’hématocrite, généralement dans les 2 à 6 semaines. La réponse de l’hémoglobine varie selon les patients et peut être influencée par les réserves en fer et la présence de pathologies médicales concomitantes.
Anémie induite par la chimiothérapie
L’époétine alfa administrée 3 fois par semaine ou une fois par semaine a montré augmenter l’hémoglobine et diminuer les besoins transfusionnels après le premier mois de traitement chez les patients anémiques atteints d’un cancer et recevant une chimiothérapie.
Dans une étude comparant le schéma posologique de 150 UI/kg, 3 fois par semaine à celui de 40 000 UI une fois par semaine chez des sujets sains et des sujets anémiques atteints d’un cancer, les profils temporels des modifications en pourcentage des réticulocytes, de l’hémoglobine et du nombre total d’érythrocytes ont été similaires entre les deux schémas posologiques, aussi bien chez les sujets sains que chez les sujets anémiques atteints d’un cancer. Les ASC (Aire sous la courbe) des différents paramètres pharmacodynamiques étaient similaires entre le schéma posologique de 150 UI/kg, 3 fois par semaine et celui de 40 000 UI, une fois par semaine chez les sujets sains ainsi que chez les sujets anémiques atteints d’un cancer.
Patients adultes en chirurgie participant à un programme de transfusions autologues différées
L’époétine alfa a montré stimuler la production d’érythrocytes pour augmenter les dons de sang autologue, et limiter la diminution de l’hémoglobine chez les patients adultes devant avoir une intervention chirurgicale majeure programmée pour lesquels il n’est pas attendu que les prélèvements autologues couvrent complètement leurs besoins transfusionnels péri-opératoires. Les effets les plus importants sont observés chez les patients ayant un taux d’hémoglobine bas (≤ 13 g/dL).
Traitement des patients adultes devant avoir une chirurgie orthopédique majeure programmée
Chez les patients devant avoir une chirurgie orthopédique majeure programmée et ayant un taux d'hémoglobine avant traitement > 10 et ≤ 13 g/dL, l’époétine alfa a montré diminuer le risque de transfusions homologues et accélérer la récupération érythroïde (augmentation des taux d’hémoglobine, d’hématocrite et du nombre de réticulocytes).
Efficacité et sécurité clinique
Insuffisance rénale chronique
L’époétine alfa a été étudiée dans des essais cliniques chez des patients adultes IRC anémiques, incluant des patients hémodialysés et des patients en pré-dialyse, pour traiter l’anémie et maintenir l’hématocrite dans l’intervalle de concentration cible allant de 30 à 36 %.
Dans les essais cliniques conduits avec des doses initiales allant de 50 à 150 UI/kg, trois fois par semaine, environ 95 % de l’ensemble des patients ont répondu par une augmentation cliniquement significative de l’hématocrite. Après environ deux mois de traitement, quasiment tous les patients étaient indépendants des transfusions. Une fois le taux cible d’hématocrite atteint, la dose d’entretien a été individualisée pour chaque patient.
Dans les trois plus grands essais cliniques conduits chez les patients adultes dialysés, la dose d’entretien médiane nécessaire pour maintenir le taux d’hématocrite entre 30 et 36 % était d’environ 75 UI/kg administrée 3 fois par semaine.
Dans une étude multicentrique, contrôlée versus placebo, en double aveugle, évaluant la qualité de vie de patients IRC hémodialysés, une amélioration cliniquement et statistiquement significative de l’état de fatigue, des symptômes physiques, des relations sociales et de la dépression (Kidney Disease Questionnaire) a été mise en évidence après 6 mois de traitement chez les patients traités par époétine alfa comparée aux patients sous placebo. Les patients du bras traité par époétine alfa ont également été recrutés dans une étude d’extension en ouvert qui a montré un maintien de l’amélioration de leur qualité de vie pendant 12 mois supplémentaires.
Patients adultes insuffisants rénaux non encore dialysés
Dans les essais cliniques conduits chez des patients IRC non dialysés traités par époétine alfa, la durée moyenne du traitement était presque de cinq mois. Ces patients ont répondu au traitement par époétine alfa d’une manière similaire à celle observée chez les patients dialysés. Les patients IRC non dialysés ont présenté une augmentation dose-dépendante et prolongée de l’hématocrite lorsque l’époétine alfa était administrée soit par voie intraveineuse soit par voie sous-cutanée. Des taux similaires d’augmentation de l’hématocrite ont été observés quelle que soit la voie d’administration de l’époétine alfa. En outre, l’administration de doses d’époétine alfa comprises entre 75 et 150 UI/kg par semaine ont montré maintenir le taux d’hématocrite entre 36 et 38 % pendant une période allant jusqu’à six mois.
Dans deux études au cours desquelles EPREX était administré avec un intervalle prolongé (3 fois par semaine, une fois par semaine, une fois toutes les deux semaines et une fois toutes les 4 semaines), certains patients traités avec des intervalles d’administration prolongés n’ont pas maintenu un taux d’hémoglobine approprié et ont atteint le taux limite d’hémoglobine défini dans le protocole comme critère de sortie d’étude (0 % dans le groupe une fois par semaine, 3,7 % dans le groupe une fois toutes les 2 semaines et 3,3 % dans le groupe une fois toutes les 4 semaines).
Une étude prospective randomisée (CHOIR) a été conduite chez 1 432 patients anémiques en insuffisance rénale chronique qui n’étaient pas dialysés. Les patients ont été randomisés pour recevoir un traitement par époétine alfa ciblant un taux d’hémoglobine d’entretien de 13,5 g/dL (supérieur à la concentration d’hémoglobine recommandée) ou de 11,3 g/dL. Un événement cardiovasculaire majeur (décès, infarctus du myocarde, accident vasculaire cérébral ou hospitalisation pour insuffisance cardiaque congestive) est survenu chez 125 (18 %) des 715 patients du bras correspondant à l’hémoglobine élevée, comparativement à 97 (14 %) des 717 patients du bras à l’hémoglobine faible (hazard ratio [HR] 1,3, IC à 95 % : 1,0, 1,7 ; p = 0,03).
Des analyses post-hoc poolées des études cliniques conduites avec les ASE ont été réalisées chez les patients atteints d’insuffisance rénale chronique (patients dialysés, non dialysés, diabétiques, non diabétiques). Une tendance vers une augmentation du risque estimé de mortalité de toute cause confondue, d’évènements cardiovasculaires et vasculaires cérébraux, associée à des doses cumulatives élevées d’ASE a été observée, indépendamment du fait que le patient soit ou non dialysé ou diabétique (voir rubriques 4.2 et 4.4).
Traitement des patients ayant une anémie induite par la chimiothérapie
L’époétine alfa a été étudiée dans des essais cliniques chez des patients adultes, anémiques, atteints d’un cancer avec des tumeurs lymphoïdes et solides, et des patients sous divers traitements chimiothérapeutiques, avec ou sans platine. Dans ces études, il a été montré que l’époétine alfa administrée 3 fois par semaine et une fois par semaine augmente l’hémoglobine et diminue les besoins transfusionnels après le premier mois de traitement chez les patients anémiques traités pour un cancer. Dans certaines études, la phase en double aveugle a été suivie d’une phase en ouvert pendant laquelle tous les patients ont reçu de l’époétine alfa et un maintien de l’effet a été observé.
Les données disponibles suggèrent que les patients ayant des cancers hématologiques et des tumeurs solides répondent de manière équivalente au traitement par époétine alfa, et que les patients avec ou sans une infiltration tumorale de la moelle osseuse répondent de manière équivalente au traitement par époétine alfa. Dans les études conduites avec une chimiothérapie, une intensité comparable de la chimiothérapie dans les bras sous époétine alfa et sous placebo a été démontrée par une aire sous la courbe des neutrophiles en fonction du temps similaire chez les patients traités par époétine alfa et chez les patients traités par placebo, ainsi que par une proportion similaire de patients dont le nombre absolu de neutrophiles a baissé en dessous de 1 000 et 500 cellules/µl dans les bras traités par époétine alfa et placebo.
Dans une étude prospective, randomisée, en double aveugle, contrôlée versus placebo, conduite chez 375 patients anémiques recevant une chimiothérapie sans platine pour diverses hémopathies malignes de type non myéloïdes, il a été observé une diminution significative des conséquences de l'anémie (par exemple : fatigue, baisse d'énergie et réduction de l'activité) mesurées par les instruments et échelles suivantes : Echelle générale d'évaluation fonctionnelle du traitement de l'anémie du cancer FACT-an, échelle de fatigue FACT-an, et échelle analogue linéaire du cancer (CLAS). Deux autres études, randomisées, contrôlées versus placebo, d'effectif plus réduit n'ont pas permis de montrer une amélioration significative des paramètres de qualité de vie sur les échelles EORTC-QLQ-C30 et CLAS respectivement.
La survie et la progression tumorale ont été étudiées dans cinq larges études contrôlées incluant un total de 2833 patients dont quatre étaient des études contrôlées contre placebo en double aveugle et une était une étude ouverte. Les études ont soit recruté des patients qui étaient traités par chimiothérapie (deux études) soit utilisé des populations de patients chez lesquelles les ASE n’étaient pas indiqués : anémie chez des patients atteint d’un cancer ne recevant pas de chimiothérapie, et patients avec des cancers de la tête et du cou recevant une radiothérapie. La concentration d’hémoglobine cible désirée dans deux études était >13 g/dL ; dans les trois autres études elle était comprise entre 12 et 14 g/dL. Dans l’étude ouverte il n’y a pas eu de différence de la survie globale entre les patients traités par l’érythropoïétine recombinante humaine et les groupes contrôles. Dans les quatre études contrôlées contre placebo les rapports de risques pour la survie globale ont été compris entre 1,25 et 2,47 en faveur des groupes contrôles. Ces études ont montré de façon cohérente un excès de mortalité inexpliqué, statistiquement significatif, chez les patients qui avaient une anémie associée à différents types de cancers fréquents qui recevaient une érythropoïétine recombinante humaine par comparaison aux groupes contrôles. Les résultats de survie globale dans les études ne pouvaient pas être expliqués de façon satisfaisante par les différences d’incidence de thromboses et complications associées entre ceux recevant une érythropoïétine recombinante humaine et ceux du groupe contrôle.
Une analyse des données individuelles a également été réalisée sur plus de 13 900 patients atteints d’un cancer (traités par chimio, radio, radio et chimiothérapie ou non traités) participant à 53 études contrôlées conduites avec plusieurs époétines. La méta-analyse des données de survie globale a montré un risque relatif estimé à 1,06 en faveur du groupe contrôle (IC 95 % : 1,00, 1,12 ; 53 études et 13 933 patients) et pour les patients atteints d’un cancer traité par chimiothérapie, le risque relatif pour la survie globale a été de 1,04 (IC 95 % : 0,97, 1,11 ; 38 études et 10 441 patients). Les méta-analyses ont également montré une augmentation significative constante du risque relatif d’évènements thromboemboliques chez les patients atteints d’un cancer recevant une érythropoïétine recombinante humaine (voir rubrique 4.4).
Une étude en ouvert, multicentrique et randomisée a été conduite chez 2098 femmes anémiques atteintes d’un cancer du sein métastatique, en première ou seconde ligne de traitement par une chimiothérapie. Il s’agissait d’une étude de non-infériorité conçue afin d’exclure une augmentation du risque de 15 % de progression tumorale ou de décès chez les patients traités par de l’époétine alfa et des traitements standards en comparaison aux patients recevant des traitements standards seuls. À la date de « cut-off » des données cliniques, la survie sans progression médiane selon l’évaluation de la progression de la maladie par l’investigateur, était de 7,4 mois dans chaque bras (HR 1,09, IC à 95 % : 0,99-1,20) indiquant que l’objectif de l’étude n’était pas atteint. Le nombre de patients ayant reçu des transfusions de culots de globules rouges était significativement moins élevé dans le bras traité par de l’époétine alfa et des traitements standards (5,8 % versus 11,4 %) ; cependant, le nombre de patients ayant présenté des évènements thrombotiques vasculaires était significativement plus élevé dans le bras traité par de l’époétine alpha et des traitements standards (2,8 % versus 1,4 %). Lors de l’analyse finale, 1 653 décès ont été rapportés. La survie globale médiane dans le bras associant époétine alfa à des traitements standards était de 17,8 mois contre 18,0 mois dans le bras recevant des traitements standards seuls (HR 1,07, IC à 95 % : 0,97-1,18). Le délai jusqu’à progression (time to progression, TTP) médian, en fonction de la progression de la maladie (PM) telle que déterminée par l’investigateur, était de 7,5 mois dans le bras traité par de l’époétine alfa et des traitements standards et de 7,5 mois dans le bras recevant des traitements standards (HR 1,099, IC à 95 % : 0,998-1,210). Le TTP médian, en fonction de la PM telle que déterminée par le comité d’examen indépendant (Independent Review Committee, IRC), était de 8,0 mois dans le bras associant époétine alfa à des traitements standards et de 8,3 mois dans le bras recevant des traitements standards (HR 1,033, IC à 95 % : 0,924-1,156).
Programme de transfusions autologues différées
L’effet de l’époétine alfa pour faciliter les dons de sang autologues chez les patients ayant un taux d’hématocrite faible (≤ 39 % en l’absence d’une anémie sous-jacente due à une carence martiale) et devant avoir une intervention chirurgicale orthopédique majeure a été évalué dans une étude en double aveugle, contrôlée versus placebo chez 204 patients et une étude en simple aveugle, contrôlée versus placebo chez 55 patients.
Dans l’étude en double aveugle, les patients étaient traités par voie intraveineuse par de l’époétine alfa à la dose de 600 UI/kg ou par un placebo une fois par jour tous les 3 à 4 jours pendant 3 semaines (total de 6 doses). En moyenne, les patients traités par époétine alfa ont été en mesure d’effectuer significativement plus de dons de sang (4,5 unités) comparativement aux patients sous placebo (3,0 unités).
Dans l’étude en simple aveugle, les patients ont été traités par voie intraveineuse par de l’époétine alfa à la dose de 300 UI/kg ou 600 UI/kg ou par un placebo une fois par jour tous les 3 à 4 jours pendant 3 semaines (total de 6 doses). Les patients traités par de l’époétine alfa ont également été en mesure d’effectuer significativement plus de dons de sang (époétine alfa 300 UI/kg = 4,4 unités ; époétine alfa 600 UI/kg = 4,7 unités) comparativement aux patients sous placebo (2,9 unités).
Le traitement par époétine alfa a diminué de 50 % le risque d’exposition à des transfusions de sang homologue comparativement aux patients ne recevant pas d’époétine alfa.
Intervention chirurgicale orthopédique majeure programmée
L’effet de l’époétine alfa (300 UI/kg ou 100 UI/kg) sur l’exposition aux transfusions de sang homologue a été évalué dans un essai clinique en double aveugle, contrôlé versus placebo chez des patients adultes non carencés en fer devant avoir une intervention chirurgicale orthopédique majeure programmée de la hanche ou du genou. L’époétine alfa a été administrée par voie sous-cutanée pendant 10 jours avant l’intervention chirurgicale, le jour de la chirurgie et pendant quatre jours après l’intervention chirurgicale. Les patients ont été stratifiés en fonction de leur taux initial d’hémoglobine (≤ 10 g/dL, > 10 à ≤ 13 g/dL et > 13 g/dL).
L’époétine alfa à la dose de 300 UI/kg a significativement réduit le risque de transfusions de sang homologue chez les patients ayant un taux d’hémoglobine avant traitement compris entre > 10 et ≤ 13g/dL. 16% des patients sous époétine alfa à la dose de 300 UI/kg, 23 % des patients sous époétine alfa à la dose de 100 UI/kg et 45 % des patients sous placebo ont eu besoin d’une transfusion.
Un essai en ouvert, à groupes parallèles, conduit chez des sujets adultes non carencés en fer ayant un taux d’hémoglobine avant traitement compris entre ≥ 10 et ≤ 13 g/dL et devant avoir une intervention chirurgicale orthopédique majeure programmée de la hanche ou du genou, a comparé le traitement par époétine alfa à la dose de 300 UI/kg administrée par voie sous-cutanée quotidiennement pendant 10 jours avant l’intervention chirurgicale, le jour de la chirurgie et pendant quatre jours après l’intervention, au traitement par époétine alfa à la dose de 600 UI/kg administrée par voie sous-cutanée une fois par semaine pendant 3 semaines avant l’intervention chirurgicale et le jour de la chirurgie.
De la période avant le traitement à la période avant la chirurgie, l’augmentation moyenne du taux d’hémoglobine dans le bras recevant l’époétine alfa à la dose de 600 UI/kg par semaine (1,44 g/dL) était deux fois plus élevée que celle observée dans le bras à la dose de 300 UI/kg par jour (0,73 g/dL). Les taux moyens d’hémoglobine étaient similaires pour les deux bras de traitement pendant toute la période post-opératoire.
La réponse érythropoïétique observée dans les deux bras de traitement a abouti à des taux similaires de transfusion (16 % dans le bras sous 600 UI/kg par semaine et 20 % dans le bras sous 300 UI/kg par jour).
Traitement des patients adultes atteints de SMD à risque faible ou intermédiaire 1
Une étude multicentrique randomisée, en double aveugle, contrôlée versus placebo a évalué l'efficacité et la sécurité de l'époétine alfa chez les sujets adultes anémiques atteint d’un SMD de risque faible ou intermédiaire 1.
Les sujets ont été classés en fonction du taux d'érythropoïétine (EPO) sérique et du statut transfusionnel avant l’inclusion. Les principales caractéristiques de référence pour le palier < 200 mU/mL sont présentées dans le tableau ci-dessous.
|
Caractérstiques initiales des sujets avec un taux d’EPO sérique < 200mU/mL à l’inclusion |
||
|
|
|
|
|
|
Randomisé |
|
|
|
Epoétine alfa |
Placebo |
|
Total (N)b |
85a |
45 |
|
Taux d’EPO sérique < 200 mU/mL (N) |
71 |
39 |
|
|
|
|
|
Hémoglobine (g/L) |
|
|
|
N |
71 |
39 |
|
Moyenne |
92,1 (8,57) |
92,1 (8,51) |
|
Médiane |
94,0 |
96,0 |
|
Intervalle |
(71, 109) |
(69, 105) |
|
Moyenne (IC à 95 %) |
(90,1 ; 94.1) |
(89,3 ; 94.9) |
|
|
|
|
|
Transfusions antérieures |
|
|
|
N |
71 |
39 |
|
Oui |
31 (43,7 %) |
17 (43,6 %) |
|
≤ 2 unités CGR |
16 (51,6 %) |
9 (52,9 %) |
|
> 2 et ≤ 4 unités CGR |
14 (45,2 %) |
8 (47,1 %) |
|
> 4 unités CGR |
1 ( 3,2 %) |
0 |
|
Non |
40 (56,3 %) |
22 (56,4 %) |
|
|
|
|
|
a Le taux d’EPO sérique n’était pas disponible pour 1 sujet. b Dans le palier ≥ 200 mU/mL il y avait respectivement 13 sujets dans le groupe époétine alfa et 6 sujets dans le groupe placebo. |
||
La réponse érythroïde a été définie selon les critères de l’International Working Group (IWG) de 2006 comme une augmentation de l'hémoglobine ≥ 1,5 g/dL par rapport à l’état initial ou une réduction des unités CGR transfusées, en nombre absolu, d'au moins 4 unités toutes les 8 semaines par rapport aux 8 semaines précédant l’état initial, et une durée de réponse d'au moins 8 semaines.
Une réponse érythroïde au cours des 24 premières semaines de l'étude a été démontrée pour 27/85 (31,8 %) sujets du groupe recevant l'époétine alfa comparativement à 2/45 (4,4 %) sujets du groupe placebo (p < 0,001). Tous les sujets qui ont répondu étaient dans le groupe présentant un taux d’EPO sérique < 200 mU/mL au moment de l’inclusion. Dans ce groupe, 20/40 (50 %) sujets sans transfusions préalables ont montré une réponse érythroïde au cours des 24 premières semaines, comparativement à 7/31 (22,6 %) sujets ayant reçu des transfusions antérieures (deux sujets ayant reçu une transfusion antérieure ont atteint l’objectif principal basé sur la réduction du nombre d’unités CGR transfusées, en nombre absolu, d'au moins 4 unités toutes les 8 semaines par rapport aux 8 semaines précédant l’état initial).
Le délai médian entre l’état initial et la première transfusion était statistiquement plus long dans le groupe époétine alfa comparé au groupe placebo (49 vs 37 jours, p = 0,046). Après 4 semaines de traitement, le délai avant première transfusion était encore plus augmenté dans le groupe de l'époétine alfa (142 vs 50 jours, p = 0,007). Le pourcentage de sujets transfusés dans le groupe recevant l'epoetin alfa est passé de 51,8 % dans les 8 semaines précédant l’état initial à 24,7 % entre les semaines 16 et 24, comparativement au groupe placebo qui a connu une augmentation du taux de transfusion de 48,9 % à 54,1 % sur les mêmes périodes.
Population pédiatrique
Insuffisance rénale chronique
L’époétine alfa a été évaluée dans une étude clinique de recherche de doses en ouvert, non randomisée, d’une durée de 52 semaines, chez des patients pédiatriques IRC en hémodialyse. L’âge médian des patients recrutés dans l’étude était de 11,6 ans (intervalle de 0,5 à 20,1 ans).
L’époétine alfa a été administrée à une dose de 75 UI/kg/semaine par voie intraveineuse fractionnées en 2 ou 3 doses, après la dialyse, avec une augmentation de 75 UI/kg/semaine à intervalles de 4 semaines (jusqu’à un maximum de 300 UI/kg/semaine), pour atteindre une augmentation de l’hémoglobine d’1 g/dL/mois. L’intervalle de concentrations d’hémoglobine désiré était de 9,6 à 11,2 g/dL. 81 % des patients ont atteint la concentration cible d’hémoglobine. Le délai médian pour atteindre cette cible était de 11 semaines et la dose médiane au taux cible était de 150 UI/kg/semaine. Parmi les patients ayant atteint le taux cible, 90 % recevaient le traitement 3 fois par semaine.
Après 52 semaines, 57 % des patients restaient dans l’étude et recevaient une dose médiane de 200 UI/kg/semaine.
Les données cliniques concernant l’administration chez les enfants par voie sous-cutanée sont limitées. Dans 5 études non contrôlées, en ouvert, de faible effectif (nombre de patients allant de 9 à 22, total N = 72), l’époétine alfa a été administrée par voie sous-cutanée chez des enfants à des posologies initiales comprises entre 100 UI/kg/semaine et 150 UI/kg/semaine, avec la possibilité d’augmenter la posologie jusqu’à 300 UI/kg/semaine. Dans ces études, la plupart des patients étaient en prédialyse (N = 44), 27 patients étaient en dialyse péritonéale et 2 patients étaient en hémodialyse. L’âge des patients allait de 4 mois à 17 ans. De façon générale, ces études ont des limites méthodologiques mais le traitement a été associé à une tendance positive au regard des taux d’hémoglobine plus élevés. Aucun effet indésirable inattendu n’a été signalé (voir rubrique 4.2).
Anémie induite par la chimiothérapie
L’époétine alfa à la dose de 600 UI/kg (administrée par voie intraveineuse ou sous-cutanée, une fois par semaine) a été évaluée chez des enfants anémiés recevant une chimiothérapie myélosuppressive pour le traitement de diverses tumeurs non-myéloïdes infantiles dans une étude randomisée, en double-aveugle, contre placebo de 16 semaines et dans une étude randomisée, contrôlée, en ouvert, de 20 semaines.
Dans l’étude de 16 semaines (n = 222), aucun effet statistiquement significatif n’a été observé concernant les scores du PedsQL Inventory (« Paediatric Quality of Life Inventory ») ou du PedsQL Cancer Module, déclarés par le patient ou par le parent, chez les patients traités par époétine alfa en comparaison au groupe ayant reçu le placebo (critère d’efficacité principal). De plus, aucune différence statistique n’a été observée pour la proportion de patients ayant nécessité des transfusions de concentrés de globules rouges entre le groupe époétine alfa et le groupe placebo.
Dans l’étude de 20 semaines (n = 225), aucune différence significative n’a été observée pour le critère d’efficacité principal, c’est-à-dire, pour la proportion de patients qui ont nécessité une transfusion de globules rouges après le jour 28 (62 % des patients traités par époétine alfa versus 69 % des patients traités par le traitement standard).
5.2. Propriétés pharmacocinétiques
Après injection sous‑cutanée, les taux sériques d'époétine alfa atteignent un pic entre 12 et 18 heures suivant l’administration. Il n'y a pas eu d'accumulation après l’administration par voie sous-cutanée de doses multiples de 600 UI/kg par semaine.
La biodisponibilité absolue de l’époétine alfa injectée par voie sous‑cutanée est d’approximativement 20 % chez les sujets sains.
Distribution
Le volume moyen de distribution était de 49,3 mL/kg après l’administration par voie intraveineuse de doses de 50 et 100 UI/kg chez des sujets sains. Après l’administration intraveineuse d’époétine alfa chez des sujets en insuffisance rénale chronique, le volume de distribution était compris respectivement entre 57 et 107 mL/kg après une dose unique (12 UI/kg) et entre 42 et 64 mL/kg après des doses multiples (48 à 192 UI/kg). Par conséquent, le volume de distribution est légèrement supérieur à l’espace plasmatique.
Élimination
La demi-vie de l’époétine alfa après l’administration par voie intraveineuse de doses multiples est d’environ 4 heures chez les sujets sains. La demi-vie pour la voie sous-cutanée est estimée à environ 24 heures chez les sujets sains.
Le Cl/F moyen pour les schémas posologiques à 150 UI/kg 3 fois par semaine et 40 000 UI une fois par semaine chez des sujets sains a été de 31,2 et 12,6 mL/h/kg respectivement. Le Cl/F moyen pour les schémas posologiques à 150 UI/kg 3 fois par semaine et 40 000 UI une fois par semaine chez des sujets anémiques atteints d’un cancer a été de 45,8 et 11,3 mL/h/kg respectivement. Chez la plupart des sujets anémiques atteints d’un cancer recevant une chimiothérapie cyclique, le Cl/F était inférieur après l’administration par voie sous-cutanée de doses de 40 000 UI une fois par semaine et de 150 UI/kg, 3 fois par semaine comparativement aux valeurs recueillies chez les sujets sains.
Linéarité/Non-linéarité
Chez les sujets sains, une augmentation dose-proportionnelle des concentrations sériques d’époétine alfa a été observée après l’administration par voie intraveineuse de 150 et 300 UI/kg, 3 fois par semaine. L’administration de doses uniques de 300 à 2 400 UI/kg d’époétine alfa par voie sous-cutanée a abouti à une relation linéaire entre la Cmax moyenne et la dose, et entre l’ASC moyenne et la dose. Une relation inverse entre la clairance apparente et la dose a été observée chez les sujets sains.
Dans les études étudiant l’allongement de l’intervalle d’administration (40 000 UI une fois par semaine et 80 000, 100 000 et 120 000 UI une fois toutes les deux semaines), une relation linéaire mais non proportionnelle à la dose a été observée à l’état d’équilibre entre la Cmax moyenne et la dose, et entre l’ASC moyenne et la dose.
Relations pharmacocinétique/pharmacodynamique
L’époétine alfa montre un effet lié à la dose sur les paramètres hématologiques, indépendamment de la voie d’administration.
Population pédiatrique
Une demi-vie d’environ 6,2 à 8,7 heures a été rapportée chez les sujets pédiatriques en insuffisance rénale chronique après l’administration par voie intraveineuse de doses multiples d’époétine alfa. Le profil pharmacocinétique de l’époétine alfa chez les enfants et les adolescents semble similaire à celui des adultes.
Les données pharmacocinétiques chez les nouveau-nés sont limitées.
Une étude au cours de laquelle l’érythropoïétine a été administrée par voie intraveineuse chez 7 nouveau-nés prématurés de très faible poids à la naissance et 10 adultes en bonne santé a suggéré que le volume de distribution était environ 1,5 à 2 fois plus élevé chez les nouveau-nés prématurés comparé aux adultes en bonne santé, et que la clairance était environ 3 fois plus élevée chez les nouveau-nés prématurés comparé aux adultes en bonne santé.
Insuffisance rénale
Chez les patients en insuffisance rénale chronique, la demi-vie de l’époétine alfa administrée par voie intraveineuse, d’environ 5 heures, est légèrement plus longue, que celle des sujets sains.
5.3. Données de sécurité préclinique
L’époétine alfa n’induit pas de mutations génétiques chez les bactéries (test d’Ames), ni d’aberrations chromosomiques dans les cellules de mammifères, ni de micronoyaux chez la souris ou de mutation génétique au locus HGPRT.
Des études de carcinogénicité à long terme n'ont pas été réalisées. Des rapports contradictoires dans la littérature, basés sur des conclusions in vitro d'échantillons de tumeur humaine, suggèrent que les érythropoïétines puissent jouer un rôle de proliférateurs de tumeur. Ces résultats sont d'une signification incertaine en clinique.
Dans des cultures de cellules humaines de moelle osseuse, l’époétine alfa stimule spécifiquement l’érythropoïèse et n’affecte pas la leucopoïèse. Aucune action cytotoxique de l’époétine alfa sur les cellules de moelle osseuse n’a pu être détectée.
Dans les études chez l'animal, l'époétine alfa a montré diminuer le poids fœtal, retarder l'ossification et augmenter la mortalité fœtale à une dose hebdomadaire d’environ 20 fois celle recommandée chez l’Homme. Ces modifications sont considérées comme secondaires à la diminution de la prise de poids chez la mère, et la signification chez l’Homme est inconnue compte-tenu des doses thérapeutiques.
Glycine.
Eau pour préparations injectables.
Phosphate monosodique dihydraté.
Phosphate disodique dihydraté.
Chlorure de sodium.
18 mois.
6.4. Précautions particulières de conservation
Pour l’usage ambulatoire, le médicament peut être sorti du réfrigérateur, sans y être replacé, pour une période de 3 jours maximum à une température ne dépassant pas 25°C. Si le médicament n’a pas été utilisé à la fin de cette période, il doit être jeté.
6.5. Nature et contenu de l'emballage extérieur
0,5 mL (20 000 UI) de solution injectable en seringue préremplie (verre type I) avec un piston (recouvert de teflon), une aiguille avec un capuchon d’aiguille (le revêtement contient du caoutchouc naturel sec [un dérivé du latex] recouvert d’un capuchon en polypropylène) et un dispositif de protection d’aiguille PROTECS (polycarbonate) attaché à la seringue – boîtes de 1, 4 et 6.
0,75 mL (30 000 UI) de solution injectable en seringue préremplie (verre type I) avec un piston (recouvert de teflon), une aiguille avec un capuchon d’aiguille (le revêtement contient du caoutchouc naturel sec [un dérivé du latex] recouvert d’un capuchon en polypropylène) et un dispositif de protection d’aiguille PROTECS (polycarbonate) attaché à la seringue – boîtes de 1, 4 et 6.
1,0 mL (40 000 UI) de solution injectable en seringue préremplie (verre type I) avec un piston (recouvert de teflon), une aiguille avec un capuchon d’aiguille (le revêtement contient du caoutchouc naturel sec [un dérivé du latex] recouvert d’un capuchon en polypropylène) et un dispositif de protection d’aiguille PROTECS (polycarbonate) attaché à la seringue – boîtes de 1, 4 et 6.
6.6. Précautions particulières d’élimination et de manipulation
Le produit ne doit pas être utilisé, et doit être éliminé :
· si le scellage est endommagé,
· si le liquide est coloré ou si vous pouvez voir des particules en suspension,
· si vous savez ou pensez que le produit a été accidentellement congelé, ou
· s'il y a eu une panne du réfrigérateur.
Ce produit est à usage unique seulement. Utiliser une seule dose d’EPREX de chaque seringue. Dans le cas où seule une partie de la dose contenue dans la seringue est nécessaire, le capuchon d’aiguille doit être enlevé avant que le piston ne soit poussé jusqu’à la graduation numérotée désirée afin d’éliminer la quantité de solution non désirée avant l’injection. Voir la rubrique 3. Comment utiliser EPREX (instructions pour l’auto-injection d’EPREX) de la notice.
Les seringues préremplies sont équipées d’un dispositif de protection d’aiguille PROTECS afin d’éviter les piqûres accidentelles après l’injection. La notice contient les instructions complètes pour l’utilisation et la manipulation des seringues préremplies équipées d’un dispositif de protection d’aiguille PROTECS.
Tout médicament non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
167 QUAI DE LA BATAILLE DE STALINGRAD
92130 ISSY-LES-MOULINEAUX
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· 34009 369 919 9 6 : 0,5 mL (20 000 UI), solution injectable en seringue préremplie (verre type I) avec un piston (recouvert de teflon), une aiguille avec un capuchon d’aiguille (le revêtement contient du caoutchouc naturel sec [un dérivé du latex] recouvert d’un capuchon en polypropylène) et un dispositif de protection d’aiguille (polycarbonate) attaché à la seringue – boîte de 1.
· 34009 369 920 7 8 : 0,5 mL (20 000 UI), solution injectable en seringue préremplie (verre type I) avec un piston (recouvert de teflon), une aiguille avec un capuchon d’aiguille (le revêtement contient du caoutchouc naturel sec [un dérivé du latex] recouvert d’un capuchon en polypropylène) et un dispositif de protection d’aiguille (polycarbonate) attaché à la seringue – boîte de 4.
· 34009 369 921 3 9 : 0,5 mL (20 000 UI), solution injectable en seringue préremplie (verre type I) avec un piston (recouvert de teflon), une aiguille avec un capuchon d’aiguille (le revêtement contient du caoutchouc naturel sec [un dérivé du latex] recouvert d’un capuchon en polypropylène) et un dispositif de protection d’aiguille (polycarbonate) attaché à la seringue – boîte de 6.
· 34009 383 276 4 9 : 0,75 mL (30 000 UI), solution injectable en seringue préremplie (verre type I) avec un piston (recouvert de teflon), une aiguille avec un capuchon d’aiguille (le revêtement contient du caoutchouc naturel sec [un dérivé du latex] recouvert d’un capuchon en polypropylène) et un dispositif de protection d’aiguille (polycarbonate) attaché à la seringue – boîte de 1.
· 34009 383 277 0 0 : 0,75 mL (30 000 UI), solution injectable en seringue préremplie (verre type I) avec un piston (recouvert de teflon), une aiguille avec un capuchon d’aiguille (le revêtement contient du caoutchouc naturel sec [un dérivé du latex] recouvert d’un capuchon en polypropylène) et un dispositif de protection d’aiguille (polycarbonate) attaché à la seringue – boîte de 4.
· 34009 383 278 7 8 : 0,75 mL (30 000 UI), solution injectable en seringue préremplie (verre type I) avec un piston (recouvert de teflon), une aiguille avec un capuchon d’aiguille (le revêtement contient du caoutchouc naturel sec [un dérivé du latex] recouvert d’un capuchon en polypropylène) et un dispositif de protection d’aiguille (polycarbonate) attaché à la seringue – boîte de 6.
· 34009 369 923 6 8 : 1 mL (40 000 UI), solution injectable en seringue préremplie (verre type I) avec un piston (recouvert de teflon), une aiguille avec un capuchon d’aiguille (le revêtement contient du caoutchouc naturel sec [un dérivé du latex] recouvert d’un capuchon en polypropylène) et un dispositif de protection d’aiguille (polycarbonate) attaché à la seringue – boîte de 1.
· 34009 369 924 2 9 : 1 mL (40 000 UI), solution injectable en seringue préremplie (verre type I) avec un piston (recouvert de teflon), une aiguille avec un capuchon d’aiguille (le revêtement contient du caoutchouc naturel sec [un dérivé du latex] recouvert d’un capuchon en polypropylène) et un dispositif de protection d’aiguille (polycarbonate) attaché à la seringue – boîte de 4.
· 34009 369 925 9 7 : 1 mL (40 000 UI), solution injectable en seringue préremplie (verre type I) avec un piston (recouvert de teflon), une aiguille avec un capuchon d’aiguille (le revêtement contient du caoutchouc naturel sec [un dérivé du latex] recouvert d’un capuchon en polypropylène) et un dispositif de protection d’aiguille (polycarbonate) attaché à la seringue – boîte de 6.
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
[à compléter ultérieurement par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE
[à compléter ultérieurement par le titulaire]
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Liste I.
Prescription initiale hospitalière d’une durée de un an.
La prescription initiale par un médecin exerçant dans un service de dialyse à domicile est également autorisée.
ANSM - Mis à jour le : 06/11/2025
EPREX 40000 UI/mL, solution injectable en seringue préremplie
Epoétine alfa
· Gardez cette notice. Vous pourriez avoir besoin de la relire.
· Si vous avez d’autres questions, interrogez votre médecin, votre pharmacien ou votre infirmier/ère.
· Ce médicament vous a été personnellement prescrit. Ne le donnez pas à d’autres personnes. Il pourrait leur être nocif, même si les signes de leur maladie sont identiques aux vôtres.
· Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin, votre pharmacien ou votre infirmier/ère. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
2. Quelles sont les informations à connaître avant d'utiliser EPREX 40000 UI/mL, solution injectable en seringue préremplie ?
3. Comment utiliser EPREX 40000 UI/mL, solution injectable en seringue préremplie ?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver EPREX 40000 UI/mL, solution injectable en seringue préremplie ?
6. Contenu de l’emballage et autres informations.
1. QU’EST-CE QUE EPREX 40000 UI/mL, solution injectable en seringue préremplie ET DANS QUELS CAS EST-IL UTILISE ?
Classe pharmacothérapeutique : autres ANTI-ANEMIQUES/ERYTHROPOIETINE - code ATC : B03XA01.
· EPREX est utilisé dans le traitement des anémies symptomatiques dues à des maladies du rein :
o chez les enfants en hémodialyse,
o chez les adultes en hémodialyse ou dialyse péritonéale,
o chez les adultes non encore dialysés ayant une anémie sévère.
Si vous souffrez d’une maladie rénale, vous pouvez présenter un manque de globules rouges si votre rein ne produit pas suffisamment d’érythropoïétine (qui est nécessaire à la production des globules rouges). EPREX vous est prescrit pour stimuler votre moelle osseuse afin de produire plus de globules rouges.
· EPREX est utilisé dans le traitement de l’anémie chez les adultes recevant une chimiothérapie pour des tumeurs solides, un lymphome malin ou un myélome multiple (cancer de la moelle osseuse) et pouvant avoir besoin d’une transfusion de sang. EPREX peut réduire le besoin de transfusion sanguine chez ces patients.
· EPREX est utilisé chez les adultes modérément anémiques qui donnent leur sang avant une intervention chirurgicale, afin que celui-ci puisse leur être réinjecté pendant ou après l’intervention. EPREX stimulant la production de globules rouges, les médecins peuvent prélever plus de sang chez ces patients.
· EPREX est utilisé chez les adultes modérément anémiques devant avoir une intervention chirurgicale orthopédique majeure (par exemple en cas de chirurgie pour prothèse de hanche ou de genou), afin de diminuer le besoin éventuel de transfusions sanguines.
· EPREX est utilisé pour traiter l’anémie chez les adultes atteints d’un trouble de la moelle osseuse provoquant des perturbations sévères de la création des cellules sanguines (syndromes myélodysplasiques). EPREX peut réduire le besoin de réaliser des transfusions sanguines.
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT D’UTILISER EPREX 40000 UI/mL, solution injectable en seringue préremplie ?
N’utilisez jamais EPREX 40000 UI/mL, solution injectable en seringue préremplie :
· Si vous êtes allergique à l’époétine alfa ou à l’un des autres composants contenus dans ce médicament (mentionnés dans la rubrique 6).
· Si l’on vous a diagnostiqué une érythroblastopénie (la moelle osseuse ne parvient pas à produire suffisamment de globules rouges) après un traitement par un produit qui stimule la production de globules rouges (y compris EPREX). Voir rubrique 4, Quels sont les effets indésirables éventuels ?
· Si vous avez une hypertension non correctement contrôlée par les médicaments.
· Pour stimuler la production de vos globules rouges (afin que les médecins puissent vous prélever plus de sang) si vous ne pouvez pas avoir de transfusions avec votre propre sang pendant ou après une chirurgie.
· Si vous allez avoir une intervention chirurgicale orthopédique majeure (telle qu’une intervention du genou ou de la hanche), et que :
o vous souffrez d’une maladie cardiaque grave,
o vous présentez des troubles sévères des veines ou des artères,
o vous avez récemment eu un infarctus du myocarde ou un accident vasculaire cérébral,
o vous ne pouvez pas prendre de médicament pour fluidifier le sang.
· EPREX peut ne pas vous convenir. Veuillez en parler avec votre médecin. Certains patients, lorsqu’ils reçoivent un traitement par EPREX, ont besoin de médicaments afin de diminuer le risque de caillots sanguins. Si vous ne pouvez pas prendre de médicament qui empêche la formation de caillots sanguins, vous ne devez pas recevoir EPREX.
Avertissements et précautions
EPREX et d’autres produits qui stimulent la production de globules rouges peuvent augmenter le risque de formation de caillots sanguins chez tous les patients. Ce risque peut être plus élevé si vous avez d’autres facteurs de risque de formation de caillots sanguins (par exemple, si vous avez déjà eu un caillot sanguin dans le passé ou que vous êtes en surpoids, vous êtes diabétique, vous avez une maladie cardiaque, ou vous êtes alité depuis une longue durée en raison d’une intervention chirurgicale ou d’une maladie). Adressez-vous à votre médecin si vous avez l’un de ces facteurs de risques. Votre médecin vous aidera à décider si EPREX vous convient.
Il est important d’avertir votre médecin si l’un des cas suivants s’applique à vous. Il vous sera peut-être toujours possible d’utiliser EPREX, mais il vous faudra en parler d’abord avec votre médecin.
· Si vous savez que vous souffrez, ou que vous avez souffert :
o d’hypertension,
o de convulsions ou crises d’épilepsie,
o d’une maladie du foie,
o d’une anémie due à d’autres causes,
o d’une porphyrie (maladie rare du sang),
o une allergie au latex. Le capuchon d’aiguille de ce médicament contient du caoutchouc de latex qui peut provoquer des réactions allergiques graves chez les personnes sensibles au latex. Voir la rubrique 4 pour les signes d'une réaction allergique.
· Si vous êtes atteint d’insuffisance rénale chronique, et en particulier si vous ne répondez pas de manière satisfaisante à EPREX, votre médecin vérifiera votre dose d’EPREX car une augmentation répétée de la dose d’EPREX alors que vous ne répondez pas à ce traitement peut augmenter le risque d’avoir un problème au niveau du cœur ou des vaisseaux sanguins et pourrait augmenter le risque d’infarctus du myocarde, d’accident vasculaire cérébral et de décès.
· Si vous souffrez d’un cancer, sachez que les produits qui stimulent la production de globules rouges (comme EPREX), peuvent agir en tant que facteur de croissance et qu’ils sont susceptibles par conséquent, en théorie, d’affecter la progression de votre cancer. En fonction de votre situation individuelle, une transfusion sanguine peut être préférable. Parlez-en avec votre médecin.
· Si vous souffrez d’un cancer, sachez que l’utilisation d’EPREX peut être associée à un raccourcissement de la survie et à un taux plus élevé de décès chez les patients atteints d’un cancer de la tête et du cou, ou recevant une chimiothérapie pour un cancer du sein métastasique.
· Des réactions cutanées graves, dont le syndrome de Stevens-Johnson (SSJ) et le syndrome de Lyell, ont été rapportées dans le cadre de traitements à base d’époétine.
Le SSJ/le syndrome de Lyell peuvent se manifester initialement au niveau du tronc, sous forme de taches en forme de « cocardes » ou de plaques circulaires rougeâtres avec souvent des bulles centrales. Des ulcères de la bouche, de la gorge, du nez, des parties génitales et des yeux (yeux rouges et gonflés) peuvent également apparaître. Ces éruptions cutanées graves sont souvent précédées de fièvre et/ou de symptômes de type grippal. Elles peuvent évoluer en un décollement cutané généralisé et en complications engageant le pronostic vital.
Si vous développez une éruption cutanée grave ou un autre de ces symptômes, arrêtez de prendre EPREX et contactez votre médecin ou demandez immédiatement un avis médical.
Faîtes attention avec les autres produits qui stimulent la production de globules rouges :
EPREX est un médicament du groupe des produits qui stimulent la production des globules rouges, comme le fait l’érythropoïétine humaine. Votre médecin traitant devra toujours mentionner le médicament exact que vous utilisez. S’il vous est donné un produit de ce groupe autre qu’EPREX pendant votre traitement, parlez-en à votre médecin ou votre pharmacien avant de l’utiliser.
Enfants et adolescents
Sans objet.
Autres médicaments et EPREX 40000 UI/mL, solution injectable en seringue préremplie
Informez votre médecin si vous prenez, avez récemment pris ou pourriez prendre tout autre médicament.
Si vous êtes traité par un produit appelé ciclosporine (utilisé par exemple après les greffes de rein), votre médecin peut vous prescrire des analyses de sang afin de vérifier votre taux de ciclosporine pendant le traitement par EPREX.
Les suppléments en fer et autres stimulants du sang peuvent accroître l’efficacité d’EPREX. Votre médecin décidera de la nécessité de vous les prescrire.
En cas de consultation à l’hôpital, en clinique ou chez votre médecin de famille, indiquez que vous suivez un traitement par EPREX. Ce dernier est susceptible d’affecter d’autres traitements ou des résultats d’analyses.
Sans objet.
Grossesse, allaitement et fertilité
Il est important d’avertir votre médecin si l’un des cas suivants s’applique à vous. Il vous sera peut-être toujours possible d’utiliser EPREX, mais il vous faudra en parler d’abord avec votre médecin.
· Si vous êtes enceinte ou pensez que vous pouvez l’être.
· Si vous allaitez.
Conduite de véhicules et utilisation de machines
Sans objet.
EPREX 40000 UI/mL, solution injectable en seringue préremplie contient du sodium
Ce médicament contient moins de 1 mmol de sodium (23 mg) par dose, c’est-à-dire qu’il est essentiellement « sans sodium ».
EPREX 40000 UI/mL, solution injectable en seringue préremplie contient du polysorbate 80
Ce médicament contient un maximum de 0,30 mg de polysorbate 80 par seringue, équivalent à une concentration de 0,30 mg/mL. Les polysorbates peuvent provoquer des réactions allergiques. Informez votre médecin si vous ou votre enfant avez déjà présenté une allergie.
3. COMMENT UTILISER EPREX 40000 UI/mL, solution injectable en seringue préremplie ?
Veillez à toujours utiliser ce médicament en suivant exactement les indications de votre médecin. Vérifiez auprès de votre médecin en cas de doute.
Votre médecin a demandé des analyses sanguines et a décidé que vous deviez être traité par EPREX.
EPREX peut être administré sous forme d’injection :
· soit dans une veine ou dans un tube relié à une veine (voie intraveineuse),
· soit sous la peau (voie sous-cutanée).
Votre médecin décidera du mode d’injection d’EPREX. Généralement, les injections sont réalisées par un médecin, un/e infirmier/ère ou tout autre professionnel de santé. Dans certains cas, selon le motif du traitement par EPREX, des patients peuvent apprendre à s’auto-injecter le produit sous la peau : voir le paragraphe Instructions pour l’auto-injection d’EPREX.
EPREX ne doit pas être utilisé :
· après la date de péremption figurant sur l’étiquette et l’emballage externe,
· si vous savez ou vous pensez qu’il peut avoir été congelé accidentellement, ou
· s’il y a eu une panne du réfrigérateur.
La dose d’EPREX que vous recevez dépend de votre poids en kilogrammes. La cause de votre anémie est également un facteur permettant à votre médecin de décider de la posologie correcte.
Votre médecin surveillera régulièrement votre pression artérielle pendant la durée de votre traitement par EPREX.
Patients souffrant de maladies du rein
· Votre médecin maintiendra votre taux d’hémoglobine entre 10 et 12 g/dL car un taux d’hémoglobine élevé peut augmenter le risque de caillots sanguins et de décès. Chez les enfants, le taux d’hémoglobine doit être maintenu entre 9,5 et 11 g/dL.
· La posologie habituelle de départ pour les adultes et les enfants est de 50 Unités Internationales (UI) d’EPREX par kilogramme (/kg) de poids corporel, trois fois par semaine.
· Pour les patients en dialyse péritonéale, EPREX peut être administré deux fois par semaine.
· Pour les adultes et les enfants, EPREX est administré par injection dans une veine ou dans un tube relié à une veine. Lorsque cet accès (dans une veine ou dans un tube relié à une veine) n’est pas déjà disponible, votre médecin pourra décider qu’EPREX soit injecté sous la peau (voie sous-cutanée). Ceci s’applique aux patients en dialyse et aux patients non encore dialysés.
· Votre médecin vous prescrira des analyses de sang régulières, généralement pas plus fréquemment que toutes les quatre semaines, afin de surveiller la façon dont votre anémie répond au traitement et de pouvoir adapter la posologie. Une augmentation de l’hémoglobine de plus de 2 g/dL sur une période de quatre semaines doit être évitée.
· Une fois l’anémie corrigée, votre médecin continuera de vérifier votre sang régulièrement. Votre dose et votre fréquence d’administration d’EPREX pourront être adaptées afin de maintenir votre réponse au traitement. Votre médecin utilisera la dose efficace la plus faible pour contrôler les symptômes de votre anémie.
· Si vous ne répondez pas suffisamment au traitement par EPREX, votre médecin vérifiera votre dose et vous informera si vous avez besoin de changer les doses d’EPREX.
· Si vous avez un intervalle d’administration plus long (supérieur à une semaine) d’EPREX, vous pouvez ne pas maintenir un taux d’hémoglobine approprié et vous pourriez avoir besoin d’une augmentation de la dose ou de la fréquence d’administration d’EPREX.
· Vous pourrez recevoir des suppléments en fer avant et pendant le traitement par EPREX, ce qui permet d’améliorer son efficacité.
· Si vous êtes sous dialyse lorsque vous débutez votre traitement par EPREX, il est possible que votre médecin décide d’adapter votre régime de dialyse. La décision sera prise par votre médecin.
Adultes recevant une chimiothérapie
· Votre médecin peut initier le traitement avec EPREX si votre taux d’hémoglobine est de 10 g/dL ou moins.
· Votre médecin maintiendra votre taux d’hémoglobine entre 10 et 12 g/dL car un taux d’hémoglobine élevé peut augmenter le risque de caillots sanguins et de décès.
· La posologie de départ est soit 150 UI par kilogramme de poids corporel trois fois par semaine, soit 450 UI par kilogramme de poids corporel une fois par semaine.
· EPREX est administré par injection sous la peau.
· Votre médecin vous prescrira des analyses de sang et pourra ajuster la posologie, selon l’évolution de votre anémie sous EPREX.
· Vous pourrez recevoir des suppléments en fer avant et pendant le traitement par EPREX, ce qui permet d’améliorer son efficacité.
· Le traitement par EPREX se poursuit généralement pendant un mois après la fin de la chimiothérapie.
Adultes donnant leur propre sang
· La posologie habituelle est de 600 UI par kilogramme de poids corporel deux fois par semaine.
· EPREX est administré par voie intraveineuse, immédiatement après que vous ayez donné votre sang, pendant trois semaines avant l’intervention chirurgicale.
· Vous pourrez recevoir des suppléments en fer avant et pendant le traitement par EPREX, ce qui permet d’améliorer son efficacité.
Adultes devant avoir une intervention chirurgicale orthopédique majeure
· La posologie recommandée est de 600 UI par kilogramme de poids corporel une fois par semaine.
· EPREX est administré par une injection sous la peau chaque semaine pendant trois semaines avant l’intervention, ainsi que le jour de l’intervention.
· Si, pour des raisons médicales, la date de votre intervention doit être avancée, la dose quotidienne recommandée est de 300 UI/kg jusqu’à dix jours avant l’intervention, le jour de l’intervention et pendant les quatre premiers jours suivant l’intervention.
· Si des analyses de sang révèlent un taux d’hémoglobine trop élevé avant l’intervention, le traitement sera interrompu.
· Vous pourrez recevoir des suppléments en fer avant et pendant le traitement par EPREX, ce qui permet d’améliorer son efficacité.
Adultes atteints de syndrome myélodysplasique
· Votre médecin peut initier un traitement avec EPREX si vous avez un taux d’hémoglobine de 10 g/dL ou moins. Le but du traitement est de maintenir votre niveau d’hémoglobine entre 10 et 12 g/dL, un niveau supérieur d’hémoglobine pourrait augmenter le risque de caillots sanguins et de décès.
· EPREX vous sera administré par injection sous la peau.
· La dose de départ est de 450 UI par kilogramme de masse corporelle, une fois par semaine.
· Votre médecin vous prescrira des tests sanguins et pourra ajuster la dose en fonction de la réponse de votre anémie au traitement par EPREX.
Instructions pour l’auto-injection d’EPREX 40000 UI/mL, solution injectable en seringue préremplie
Au début du traitement, EPREX est habituellement injecté par le personnel médical ou infirmier. Il est possible que, plus tard, votre médecin vous enseigne la façon dont vous ou la personne qui vous soigne pouvez vous injecter EPREX sous la peau (voie sous-cutanée).
· N’essayez pas de vous auto-injecter le produit si vous n’avez pas été formé par votre médecin ou votre infirmier/ère.
· Utilisez toujours EPREX exactement selon les instructions fournies par votre médecin ou votre infirmier/ère.
· Utilisez EPREX seulement si le produit a été correctement conservé – Voir rubrique 5.
· Avant utilisation, laissez reposer la seringue d’EPREX jusqu’à ce que le produit atteigne la température ambiante. Ceci prend habituellement entre 15 et 30 minutes.
N’utilisez qu’une dose d’EPREX 40000 UI/mL, solution injectable en seringue préremplie par seringue.
Si EPREX est injecté sous la peau (par voie sous-cutanée), la quantité injectée n’est habituellement pas supérieure à un millilitre (1 mL) pour une seule injection.
EPREX est administré seul et n’est pas mélangé à d’autres liquides à injecter.
N’agitez pas les seringues d’EPREX 40000 UI/mL, solution injectable en seringue préremplie. Une agitation vigoureuse et prolongée peut détériorer le produit. Si le produit a été vigoureusement agité, ne l’utilisez pas.
Comment vous auto-injecter le produit par voie sous-cutanée en utilisant une seringue préremplie :
Les seringues préremplies sont équipées d’un dispositif de protection d’aiguille PROTECS afin d’éviter les piqûres accidentelles après l’injection. Cette information est indiquée sur la boîte.
· Sortez une seringue du réfrigérateur. Le liquide doit revenir à température ambiante. Ne retirez pas le capuchon d’aiguille de la seringue lorsque le produit revient à température ambiante.
· Vérifiez la seringue, afin de vous assurer que la dose est la bonne, que la date de péremption n’est pas dépassée, que la seringue n’est pas abîmée et que le liquide est clair et non congelé.
· Retirez la partie détachable de l'étiquette de la seringue. Si vous ne pouvez pas voir les graduations numérotées à travers la fenêtre de visualisation, tenez le corps de la seringue et tournez doucement la seringue par le couvercle de l'aiguille pour aligner les graduations numérotées sur la fenêtre de visualisation.
· Choisissez un site d’injection. Les bons sites d’injection se situent en haut de la cuisse et sur l’abdomen, mais loin du nombril. Changez de site d’un jour à l’autre.
· Lavez-vous les mains. Désinfectez le site d’injection avec un tampon antiseptique.
· Tenez la seringue préremplie par le corps de la seringue en positionnant l’aiguille recouverte du capuchon vers le haut.
· Ne tenez pas la seringue par la tête du piston, le piston lui-même, les ailettes du dispositif de protection d’aiguille, ou le capuchon d’aiguille.
· Ne tirez à aucun moment sur le piston.
· N’enlevez pas le capuchon d’aiguille de la seringue préremplie avant que vous ne soyez prêt à vous injecter EPREX.
· Enlevez soigneusement le capuchon d’aiguille de la seringue en tenant la seringue par le corps et en tirant le capuchon d’aiguille sans le tordre. Ne touchez pas l’aiguille et ne secouez pas la seringue.
· Retirez la bulle d'air en tenant la seringue avec l'aiguille dirigée vers le haut et en appuyant doucement sur le piston jusqu'à ce qu'une goutte de liquide sorte de l'extrémité de l'aiguille.
· Si votre médecin vous a indiqué que vous avez seulement besoin d’une dose partielle, poussez le piston jusqu’à la graduation numérotée désirée afin d’éliminer la quantité de liquide non désirée avant l’injection.
· Ne touchez pas les ailes de protection de l’aiguille afin d’éviter que l’aiguille soit prématurément recouverte par le dispositif de protection de l’aiguille.
· Pincez un pli de peau entre votre pouce et votre index. Ne le pressez pas.
· Enfoncez l’aiguille complètement. Votre médecin ou votre infirmier/ière vous a peut-être montré comment procéder.
· Poussez le piston avec votre pouce aussi loin que possible afin d’injecter la totalité du liquide. Poussez-le lentement et régulièrement, en conservant le pli de peau entre le pouce et l’index. Le dispositif de protection d’aiguille PROTECS ne sera pas activé tant que la dose entière ne sera pas délivrée. Vous pourrez entendre un déclic lorsque le dispositif de protection d’aiguille PROTECS a été activé.
· Lorsque le piston a été poussé aussi loin que possible, retirez l’aiguille et arrêtez de pincer la peau.
· Relâchez doucement le piston pour permettre à la seringue de remonter jusqu’à ce que l’aiguille soit entièrement recouverte par le dispositif de protection d’aiguille PROTECS.
· Lorsque l’aiguille est retirée de votre peau, il se peut qu’il y ait un petit saignement au point d’injection. Ceci est normal. Vous pouvez appuyer sur le point d’injection avec un tampon antiseptique pendant quelques secondes après l’injection.
· Jetez votre seringue usagée dans un conteneur conçu à cet effet – voir rubrique 5.
Si vous avez utilisé plus d’EPREX 40000 UI/mL, solution injectable en seringue préremplie que vous n’auriez dû :
Prévenez immédiatement votre médecin ou votre infirmier/ère si vous pensez qu’une quantité excessive d’EPREX a été injectée. Les effets indésirables liés à un surdosage d’EPREX sont peu probables.
Si vous oubliez d’utiliser EPREX 40000 UI/mL, solution injectable en seringue préremplie :
Faites la prochaine injection dès que vous y pensez. Si la prochaine injection est dans moins d’un jour, n’effectuez pas l’injection oubliée et poursuivez normalement votre traitement. Ne doublez pas les injections pour compenser une dose oubliée.
Si vous arrêtez d’utiliser EPREX 40000 UI/mL, solution injectable en seringue préremplie :
Sans objet.
Si vous êtes atteint d’une hépatite C et que vous êtes traités par de l’interféron et de la ribavirine :
Vous devez en parler avec votre médecin car l’association d’époétine alfa avec l’interféron et la ribavirine a conduit, dans de rares cas, à une perte de l’effet et au développement d’une affection appelée érythroblastopénie, une forme sévère d’anémie. EPREX n’est pas approuvé dans la prise en charge de l’anémie associée à une hépatite C.
Si vous avez d’autres questions sur l’utilisation de ce médicament, demandez plus d’informations à votre médecin, à votre pharmacien ou à votre infirmier/ière.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
Informez immédiatement votre médecin ou votre infirmier/ière si vous ressentez un des effets mentionnés dans la liste.
Effets indésirables très fréquents
Ils peuvent survenir chez plus de 1 personne sur 10 traitées par EPREX.
· Diarrhées.
· Malaise gastrique.
· Vomissements.
· Fièvre.
· Congestion des voies respiratoires, tel que nez bouché ou mal de gorge, a été rapportée chez des patients souffrant d’une maladie rénale et non encore dialysés.
Effets indésirables fréquents
Ils peuvent survenir jusqu’à 1 personne sur 10 traitées par EPREX.
· Augmentation de la pression artérielle. Maux de tête notamment s’ils sont d’apparition brutale, en coup de poignard de type migraineux, sensation de confusion ou crises convulsives peuvent être des signes d'une augmentation brutale de la pression artérielle. Cela nécessite un traitement urgent. Une augmentation de la pression artérielle peut nécessiter un traitement médicamenteux (ou une adaptation de votre traitement anti-hypertenseur actuel).
· Caillots sanguins (incluant thrombose veineuse profonde et embolie) pouvant nécessiter un traitement urgent. Vous pourrez avoir comme symptômes une douleur thoracique, un essoufflement et un gonflement douloureux et une rougeur généralement au niveau des jambes.
· Toux.
· Eruption cutanée, pouvant être le résultat d'une réaction allergique.
· Douleur osseuse ou musculaire.
· Symptômes pseudo-grippaux, tels que maux de tête, gêne et douleur dans les articulations, sensation de faiblesse, frissons, fatigue et sensation de vertige. Ils peuvent être plus fréquents en début de traitement. Si vous avez ces symptômes lors d'une injection intraveineuse, une administration plus lente du produit pourra contribuer à les éviter par la suite.
· Rougeur, brûlure et douleur au point d’injection.
· Gonflement des chevilles, des pieds ou des doigts.
· Douleur des bras ou des jambes.
Effets indésirables peu fréquents
Ils peuvent survenir jusqu’à 1 personne sur 100 traitées par EPREX.
· Taux élevé de potassium dans le sang pouvant entrainer un rythme cardiaque anormal (il s’agit d’un effet indésirable très fréquent chez les patients dialysés).
· Crises convulsives.
· Congestion du nez ou des voies respiratoires.
· Réaction allergique.
· Urticaire.
Effets indésirables très rares
Ils peuvent survenir chez jusqu’à 1 personne sur 10 000 traitées par EPREX
· Symptômes d’érythroblastopénie.
L’érythroblastopénie signifie que la moelle osseuse se trouve dans l’impossibilité de produire suffisamment de globules rouges.
Une érythroblastopénie entraîne une anémie sévère et soudaine. Les symptômes sont :
o Fatigue inhabituelle,
o Sensation de vertige,
o Essoufflements.
Des cas d’érythroblastopénie ont très rarement été rapportés, principalement chez les patients ayant une maladie rénale, après plusieurs mois ou années de traitement par EPREX ou par d’autres produits qui stimulent la production de globules rouges.
· Une augmentation des petites cellules sanguines (appelées plaquettes), qui sont habituellement impliquées dans la formation du caillot sanguin, peut survenir en particulier en début de traitement. Votre médecin pourra vérifier cela.
· Réactions allergiques sévères pouvant inclure :
o Un gonflement du visage, des lèvres, de la bouche, de la langue ou de la gorge,
o Difficultés pour avaler ou respirer,
o Eruption prurigineuse (urticaire).
· Problème au niveau du sang qui peut causer de la douleur, des urines de couleur foncée ou une sensibilité accrue de la peau à la lumière du soleil (porphyrie).
Si vous êtes hémodialysé :
· Des caillots sanguins (thrombose) peuvent se former dans votre fistule de dialyse. Cela est plus fréquent si vous avez une pression artérielle basse ou si votre fistule présente des complications.
· Des caillots sanguins peuvent également se former dans votre circuit d’hémodialyse. Votre médecin pourra décider d’augmenter votre dose d’héparine durant la dialyse.
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin, votre pharmacien ou à votre infirmier/ère. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr/.
En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.
5. COMMENT CONSERVER EPREX 40000 UI/mL, solution injectable en seringue préremplie ?
Tenir ce médicament hors de la vue et de la portée des enfants.
N’utilisez pas ce médicament après la date de péremption indiquée sur l’étiquette et la boite après EXP. La date de péremption fait référence au dernier jour de ce mois.
A conserver au réfrigérateur (entre 2 et 8° C). Vous pouvez sortir EPREX du réfrigérateur et le maintenir à température ambiante (sans dépasser 25°C) pendant un maximum de 3 jours. Une fois que la seringue a été sortie du réfrigérateur et a atteint la température ambiante (jusqu’à 25°C), elle doit être utilisée dans les 3 jours ou être jetée.
Ne pas congeler ou agiter.
A conserver dans l’emballage d’origine à l’abri de la lumière.
N’utilisez pas ce médicament si vous remarquez que le scellage a été endommagé ou si le liquide est coloré ou si vous voyez des particules en suspension. Dans ces cas-là, jetez le médicament.
Ne jetez aucun médicament au tout-à-l’égout ni avec les ordures ménagères. Demandez à votre pharmacien d’éliminer les médicaments que vous n’utilisez plus. Ces mesures contribueront à protéger l’environnement.
6. CONTENU DE L’EMBALLAGE ET AUTRES INFORMATIONS
Ce que contient EPREX 40000 UI/mL, solution injectable en seringue préremplie
· La substance active est : l’époétine alfa (pour les quantités voir le tableau ci-dessous).
· Les autres composants sont :
Polysorbate 80 (E 433), chlorure de sodium, phosphate monosodique dihydraté, phosphate disodique dihydraté, glycine et eau pour préparations injectables.
EPREX est une solution injectable présentée en seringue préremplie (voir tableau ci-dessous). Les seringues préremplies sont équipées d’un dispositif de protection d’aiguille PROTECS. EPREX est une solution claire et incolore.
|
Présentation* |
Correspondance par présentation en Quantité/Volume pour chaque dosage |
Quantité d’époétine alfa |
|
Boite de 6 seringues préremplies avec dispositif de protection d’aiguille PROTECS |
2000 UI/mL: 1000 UI/0,5 mL |
8,4 microgrammes |
|
|
4000 UI/mL : 2000 UI/0,5 mL |
16,8 microgrammes |
|
|
10 000 UI/mL : 3000 UI/0,3 mL 4000 UI/0,4 mL 5000 UI/0,5 mL 6000 UI/0,6 mL 8000 UI/0,8 mL 10 000 UI/1 mL |
25,2 microgrammes 33,6 microgrammes 42,0 microgrammes 50,4 microgrammes 67,2 microgrammes 84,0 microgrammes |
|
Boite de 1 seringue préremplie avec dispositif de protection d’aiguille PROTECS |
40 000 UI/mL : 20 000 UI/0,5 mL 30 000 UI/0,75 mL 40 000 UI/1 mL |
168 microgrammes 252 microgrammes 336 microgrammes |
|
Boite de 4 seringues préremplies avec dispositif de protection d’aiguille PROTECS |
40 000 UI/mL : 20 000 UI/0,5 mL 30 000 UI/0,75 mL 40 000 UI/1 mL |
168 microgrammes 252 microgrammes 336 microgrammes |
|
Boite de 6 seringues préremplies avec dispositif de protection d’aiguille PROTECS |
40 000 UI/mL : 20 000 UI/0,5 mL 30 000 UI/0,75 mL 40 000 UI/1 mL |
168 microgrammes 252 microgrammes 336 microgrammes |
*Toutes les présentations peuvent ne pas être commercialisées.
Titulaire de l’autorisation de mise sur le marché
167 QUAI DE LA BATAILLE DE STALINGRAD
92130 ISSY-LES-MOULINEAUX
Exploitant de l’autorisation de mise sur le marché
JANSSEN-CILAG
167 QUAI DE LA BATAILLE DE STALINGRAD
92130 ISSY-LES-MOULINEAUX
EINSTEINWEG 101
2333 CB
LEIDEN
PAYS-BAS
Noms du médicament dans les Etats membres de l'Espace Economique Européen
Ce médicament est autorisé dans les Etats membres de l'Espace Economique Européen et au Royaume-Uni (Irlande du Nord) sous les noms suivants : Conformément à la réglementation en vigueur.
[À compléter ultérieurement par le titulaire]
La dernière date à laquelle cette notice a été révisée est :
[à compléter ultérieurement par le titulaire]
< {MM/AAAA}>< {mois AAAA}.>
Des informations détaillées sur ce médicament sont disponibles sur le site Internet de l’ANSM (France).