Dernière mise à jour le 08/01/2026
DICLOFENAC URGO 140 mg, emplâtre médicamenteux
Indications thérapeutiques
Classe pharmacothérapeutique : Anti-inflammatoire non stéroïdien à usage topique, code ATC : M02AA15.
DICLOFENAC URGO 140 mg, emplâtre médicamenteux appartient à une classe de médicaments appelés les anti-inflammatoires non stéroïdiens (AINS). Les AINS réduisent la douleur et l’inflammation.
DICLOFENAC URGO 140 mg, emplâtre médicamenteux est utilisé pour soulager la douleur et l’inflammation d’origine rhumatismale ou traumatique affectant les articulations, les muscles, les tendons ou les ligaments.
Présentations
> 5 enveloppe(s) papier polyéthylène aluminium copolymère d'éthylène et d'acide méthacrylique de 1 emplâtre(s)
Code CIP : 34009 301 760 3 0
Déclaration de commercialisation : 08/09/2020
Cette présentation n'est pas agréée aux collectivités
> 10 enveloppe(s) papier polyéthylène aluminium copolymère d'éthylène et d'acide méthacrylique de 1 emplâtre(s)
Code CIP : 34009 301 760 5 4
Déclaration de commercialisation : 05/04/2022
Cette présentation n'est pas agréée aux collectivités
Service médical rendu (SMR)
Amélioration du service médical rendu (ASMR)
Ce médicament étant un générique, l'ASMR n'a pas été évalué par la commission de la transparence (CT), il est possible de se référer à la /aux spécialité(s) de référence du groupe générique auquel appartient ce médicament (cliquez ici pour aller à la rubrique des groupes génériques)
ANSM - Mis à jour le : 15/07/2025
DICLOFENAC URGO 140 mg, emplâtre médicamenteux
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Chaque emplâtre médicamenteux de 10 cm x 14 cm contient 180 mg d’épolamine de diclofénac correspondant à 140 mg de diclofénac sodique.
Excipient(s) à effet notoire :
Parahydroxybenzoate de méthyle (E218) : 14 mg
Parahydroxybenzoate de propyle (E216) : 7 mg
Propylène glycol (E1520) : 420 mg
Polysorbate 80 (E433) : 28 mg
Quantité rapportée à un emplâtre.
Pour la liste complète des excipients, voir rubrique 6.1.
Emplâtre médicamenteux de 10 cm x 14 cm.
Gel blanc à jaune pâle étalé uniformément sur un support non tissé.
4.1. Indications thérapeutiques
4.2. Posologie et mode d'administration
Posologie
Un (1) emplâtre sur la région la plus douloureuse une ou deux fois par jour.
Durée d’administration
L’utilisation de DICLOFENAC URGO 140 mg, emplâtre médicamenteux doit être la plus courte possible. La durée maximale de traitement est de 14 jours consécutifs.
Sujet âgé
Ce médicament doit être utilisé avec précaution chez les personnes âgées qui sont davantage sujettes aux effets indésirables (voir également rubrique 4.4).
Enfants et adolescents de moins de 16 ans
Ce médicament ne doit pas être utilisé chez l'enfant de moins de 16 ans compte tenu du manque de données concernant la sécurité d'emploi et l'efficacité. Voir également rubrique 4.3.
Chez les enfants âgés de 16 ans ou plus, si le produit est utilisé pendant plus de 7 jours pour soulager la douleur, ou si les symptômes persistent, il est conseillé au patient/parent de l’adolescent de consulter un médecin.
Insuffisance hépatique ou rénale
Pour l'utilisation de DICLOFENAC URGO 140 mg, emplâtre médicamenteux chez les patients avec une insuffisance hépatique ou rénale se référer à la rubrique 4.4.
Mode d’administration
Couper l’enveloppe contenant les emplâtres médicamenteux à l'endroit indiqué. Retirer un emplâtre médicamenteux, enlever le film plastique qui protège la surface adhésive et l'appliquer sur la région ou l'articulation douloureuse. Si nécessaire, il peut être maintenu en place par un filet élastique. Refermer soigneusement l’enveloppe au moyen de la glissière.
L'emplâtre doit être utilisé intact.
Ce médicament est contre-indiqué dans les cas suivants:
· Hypersensibilité au diclofénac, à l'acide acétylsalicylique ou aux autres anti-inflammatoires non stéroïdiens (AINS) ou à l'un des excipients de ce produit listés à la rubrique 6.1.
· Patients chez lesquels les crises d'asthme, d'urticaire ou de rhinite aiguë sont provoquées par l'acide acétylsalicylique ou d'autres médicaments anti-inflammatoires non stéroïdiens (AINS).
· Peau lésée, quelle que soit la lésion: dermatoses suintantes, eczéma, lésion infectée, brûlure ou plaie.
· A partir du début du 6ème mois de la grossesse (voir rubrique 4.6 Grossesse et allaitement).
· Patients souffrant d'un ulcère peptique évolutif.
· Chez l'enfant et l'adolescent âgé de moins de 16 ans.
4.4. Mises en garde spéciales et précautions d'emploi
· L’emplâtre médicamenteux ne doit pas être mis en contact ni appliqué sur les muqueuses ou sur les yeux.
· Ne pas utiliser sous pansement occlusif.
· L'apparition d'une éruption cutanée après application de DICLOFENAC URGO 140 mg, emplâtre médicamenteux impose l'arrêt immédiat du traitement.
· L'administration concomitante de médicaments contenant du diclofénac ou d'autres AINS, que ce soit par voie locale ou par voie générale, est à proscrire.
· La survenue d'effets indésirables d'ordre systémique après l’application de diclofénac en topique ne peut être exclue en cas d’utilisation prolongée (voir les informations produit sur les formes systémiques de Diclofenac). Bien que les effets systémiques soient peu fréquents, l’emplâtre médicamenteux doit être utilisé avec précaution chez les patients présentant une altération de la fonction rénale, cardiaque, ou hépatique, chez les patients présentant des antécédents d'ulcère digestif, de maladie intestinale inflammatoire ou de saignements digestifs. Les anti-inflammatoires non stéroïdiens doivent être utilisés avec précaution chez les personnes âgées qui sont davantage sujettes aux effets indésirables.
· Ce médicament contient du parahydroxybenzoate de méthyle et du parahydroxybenzoate de propyle. Il peut causer des réactions allergiques (possibilité d'allergie retardée).
· Ce médicament contient 420 mg de propylène glycol dans chaque emplâtre médicamenteux.
· Ce médicament contient du polysorbate 80 qui peut provoquer des réactions allergiques.
· Afin de réduire tout risque de photosensibilisation, les patients doivent être informés d'éviter toute exposition aux rayonnements solaires (soleil ou cabine UV).
· Les bronchospasmes peuvent être provoqués chez les patients présentant un asthme bronchique, une maladie allergique ou une allergie à l'acide acétylsalicylique ou à un autre AINS ou ayant des antécédents de ces pathologies. L’emplâtre médicamenteux doit être utilisé avec précaution chez les patients présentant ou non un asthme chronique, chez lesquels les crises d'asthme, d'urticaire ou de rhinites aiguës sont provoquées par l'acide acétylsalicylique ou d'autres anti-inflammatoires non stéroïdiens (voir rubrique 4.3 Contre-indications). Afin de minimiser la survenue d'effets indésirables, il est recommandé d'utiliser la dose minimale efficace pour contrôler les symptômes pendant la période la plus courte possible, sans dépasser le maximum autorisé de 14 jours (Voir rubriques 4.2 et 4.8).
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
4.6. Fertilité, grossesse et allaitement
Il n’existe aucune donnée clinique concernant l’utilisation de DICLOFENAC URGO 140 mg, emplâtre médicamenteux pendant la grossesse. Même si l’exposition systémique à DICLOFENAC URGO 140 mg, emplâtre médicamenteux atteinte après une administration topique est plus faible par rapport à celle observée à la suite d’une administration par voie orale, le risque d’effets délétères éventuels chez l’embryon ou le fœtus n’est pas connu.
La concentration systémique de diclofénac est plus faible après une administration topique, par rapport aux formulations orales.
En référence au traitement par les AINS par voie systémique, il est recommandé de :
L'inhibition de la synthèse des prostaglandines peut affecter le déroulement de la grossesse et/ou le développement de l'embryon ou du fœtus. Les données des études épidémiologiques suggèrent une augmentation du risque de fausse-couche, de malformations cardiaques et de gastroschisis, après traitement par un inhibiteur de la synthèse des prostaglandines en début de grossesse. Le risque absolu de malformation cardiovasculaire passe de moins de 1 %, à approximativement 1,5 %. Le risque paraît augmenter en fonction de la dose et de la durée du traitement. Chez l'animal, il a été montré que l'administration d'un inhibiteur de la synthèse des prostaglandines provoquait une perte pré et post-implantatoire accrue et une augmentation de la létalité embryo-fœtale. De plus, une incidence supérieure de certaines malformations, y compris cardiovasculaires, a été rapportée chez des animaux ayant reçu un inhibiteur de la synthèse des prostaglandines au cours de la phase d'organogénèse de la gestation.
Sauf nécessité absolue, le diclofénac ne doit donc pas être donné au cours du premier et du second trimestre de la grossesse. Si le diclofénac est administré chez une femme souhaitant être enceinte ou durant le premier ou le second trimestre de la grossesse, la dose devra être la plus faible possible et la durée du traitement la plus courte possible.
Pendant le troisième trimestre de la grossesse, l'utilisation des inhibiteurs de la synthèse des prostaglandines peut exposer le fœtus à:
· une toxicité cardio-pulmonaire (fermeture prématurée du canal artériel et hypertension artérielle pulmonaire),
· un dysfonctionnement rénal, pouvant évoluer vers une insuffisance rénale associée à un oligohydroamniosis.
· la mère et le nouveau-né, en fin de grossesse, à:
· un risque d'allongement du temps de saignement, un effet antiagrégant qui peut se produire même à de très faibles doses,
· une inhibition des contractions utérines, entraînant un retard de terme ou un accouchement prolongé.
Par conséquent, le diclofénac est contre-indiqué au cours du troisième trimestre de la grossesse.
Allaitement
Le diclofénac, comme tous les AINS, passe dans le lait maternel en petites quantités. Cependant, aux doses thérapeutiques de l’emplâtre médicamenteux au diclofénac, aucun effet sur l’enfant allaité n’est attendu.
En raison d'un manque d'études contrôlées chez les femmes qui allaitent, le produit ne doit être utilisé pendant l'allaitement que sur les conseils d'un professionnel de la santé. Ainsi, DICLOFENAC URGO 140 mg, emplâtre médicamenteux ne doit pas être appliqué sur les seins des mères allaitantes ni sur d’autres zones sur de grandes surfaces cutanées ou pendant une période prolongée (voir rubrique 4.4).
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
DICLOFENAC URGO 140 mg, emplâtre médicamenteux n’a aucun effet sur l’aptitude à conduire des véhicules et à utiliser des machines.
Les effets indésirables (Tableau 1) sont classés par fréquence, le plus fréquent en premier, de la manière suivante: très fréquent: (> 1/10); fréquent (≥ 1/100, < 1/10) ; peu fréquent (≥ 1/1 000, < 1/100) ; rare (≥ 1/10 000, < 1/1 000) ; très rare (< 1/10,000) ; Fréquence indéterminée : ne peut être estimée sur la base des données disponibles.
|
Infections et infestations |
|
|
Très rare |
Eruption pustuleuse |
|
Trouble du système immunitaire |
|
|
Très rare |
Hypersensibilité (y compris urticaire), œdème angioneurotique, réaction de type anaphylactique |
|
Troubles respiratoires, thoraciques et médiastinaux |
|
|
Très rare |
Asthme |
|
Réactions cutanées et des tissus sous-cutanés |
|
|
Fréquent
Peu fréquent Rare Très rare |
Eruption cutanée, eczéma, érythème, dermatite (y compris dermatite allergique et de contact), prurit Pétéchie Dermatite bulleuse (ex : érythème bulleux), peau sèche Réaction de photosensibilité |
|
Troubles généraux et incidents liés au site d’administration |
|
|
Fréquent Peu fréquent |
Réaction au site d’application Sensation de chaleur |
L'absorption systémique du diclofénac est très faible comparée aux taux plasmatiques observés après l'utilisation de formes orales de diclofénac et la probabilité de survenue d'effets indésirables d'ordre systémique (tels que des troubles gastriques, hépatiques et rénaux) est très faible comparée à la fréquence de tels effets associés au diclofénac par voie orale. Cependant, lorsque DICLOFENAC URGO 140 mg, emplâtre médicamenteux est appliqué sur une surface de peau relativement étendue et pendant une période prolongée, la possibilité de survenue d'effets indésirables systémiques ne peut être exclue.
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr/.
Il n’existe pas de cas documentés de surdosage liés à l’utilisation d’un emplâtre médicamenteux au diclofénac. Dans l’éventualité de l’apparition d’effets indésirables systémiques liés à une utilisation incorrecte ou à un surdosage accidentel (par exemple chez l’enfant) de ce produit, les mesures générales de prise en charge d’une intoxication par des anti-inflammatoires non stéroïdiens doivent être appliquées.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Classe pharmacothérapeutique : Anti-inflammatoire non stéroïdien à usage topique, code ATC : M02AA15.
L'hydroxyéthylpyrrolidine de diclofénac ou épolamine de diclofénac est un sel de diclofénac soluble dans l'eau.
Le diclofénac est un anti-inflammatoire non stéroïdien dérivé de l'acide phénylacétique appartenant au groupe des acides aryl carboxyliques.
Sous forme d'emplâtre médicamenteux, il possède une activité locale anti-inflammatoire et antalgique.
5.2. Propriétés pharmacocinétiques
Dans une étude clinique, la cinétique d’absorption résultant de l’application consécutive de deux emplâtres a montré que la diffusion prolongée de la substance active atteignait un taux plasmatique maximal de diclofénac (Cmax) compris entre 1,0 et 3,4 ng/mL, après environ 8 heures (Tmax 8,6 ± 3,3 heures). L’exposition systémique (AUC) au diclofénac résultant de l’application consécutive de deux emplâtres est inférieure (< 1 %) à celle d’une dose journalière orale de diclofénac sodique.
Le diclofénac est largement lié aux protéines plasmatiques (environ 99 %). L’excrétion urinaire de la substance au 8ème jour, sur un intervalle de 0-48h, représente 0,013 % de la dose appliquée avec l’emplâtre.
5.3. Données de sécurité préclinique
Support : support non tissé polyester.
Couche adhésive (gel actif) : gélatine, povidone (K90), sorbitol liquide (non cristallisable), kaolin lourd, dioxyde de titane (E171), propylène glycol (E1520), parahydroxybenzoate de méthyle (E218), parahydroxybenzoate de propyle (E216), édétate disodique, acide tartrique, glycinate d’aluminium, carmellose sodique, polyacrylate de sodium, 1,3-butylène glycol, polysorbate 80 (E433), eau purifiée.
Film protecteur : film polypropylène.
3 ans.
Après première ouverture de l’enveloppe scellée : 4 mois.
6.4. Précautions particulières de conservation
6.5. Nature et contenu de l'emballage extérieur
Enveloppes scellées composées de Papier/Polyéthylène/Aluminium/Copolymère d'éthylène et d'acide méthacrylique, contenant 5 emplâtres médicamenteux.
Taille du conditionnement: 5 ou 10 emplâtres médicamenteux par boîte.
Toutes les présentations peuvent ne pas être commercialisées.
6.6. Précautions particulières d’élimination et de manipulation
La substance active résiduelle de l'emplâtre médicamenteux peut poser un risque pour l'environnement aquatique. Ne pas jeter les emplâtres médicamenteux usagés dans les toilettes. Les emplâtres médicamenteux doivent être éliminés conformément à la réglementation en vigueur.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
42 RUE DE LONGVIC
21300 CHENOVE
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· 34009 301 760 3 0 : Emplâtre médicamenteux sous enveloppe scellée (papier/PE/Aluminium/copolymère d’éthylène et d’acide méthacrylique) ; boîte de 5.
· 34009 301 760 5 4 : Emplâtre médicamenteux sous enveloppe scellée (papier/PE/Aluminium/copolymère d’éthylène et d’acide méthacrylique) ; boîte de 10.
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
[à compléter ultérieurement par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE
[à compléter ultérieurement par le titulaire]
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Médicament non soumis à prescription médicale.
ANSM - Mis à jour le : 15/07/2025
DICLOFENAC URGO 140 mg, emplâtre médicamenteux
Diclofénac sodique (sous forme d’épolamine de diclofénac)
Veuillez lire attentivement cette notice avant d’utiliser ce médicament car elle contient des informations importantes pour vous.
Vous devez toujours utiliser ce médicament en suivant scrupuleusement les informations fournies dans cette notice ou par votre médecin ou votre pharmacien.
· Gardez cette notice. Vous pourriez avoir besoin de la relire.
· Adressez-vous à votre pharmacien pour tout conseil ou information.
· Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
· Vous devez vous adresser à votre médecin si vous ne ressentez aucune amélioration ou si vous vous sentez moins bien après une courte période d’utilisation.
1. Qu'est-ce que DICLOFENAC URGO 140 mg, emplâtre médicamenteux et dans quels cas est-il utilisé ?
2. Quelles sont les informations à connaître avant d'utiliser DICLOFENAC URGO 140 mg, emplâtre médicamenteux ?
3. Comment utiliser DICLOFENAC URGO 140 mg, emplâtre médicamenteux ?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver DICLOFENAC URGO 140 mg, emplâtre médicamenteux ?
6. Contenu de l’emballage et autres informations.
1. QU’EST-CE QUE DICLOFENAC URGO 140 mg, emplâtre médicamenteux ET DANS QUELS CAS EST-IL UTILISE ?
Classe pharmacothérapeutique : Anti-inflammatoire non stéroïdien à usage topique, code ATC : M02AA15.
DICLOFENAC URGO 140 mg, emplâtre médicamenteux appartient à une classe de médicaments appelés les anti-inflammatoires non stéroïdiens (AINS). Les AINS réduisent la douleur et l’inflammation.
DICLOFENAC URGO 140 mg, emplâtre médicamenteux est utilisé pour soulager la douleur et l’inflammation d’origine rhumatismale ou traumatique affectant les articulations, les muscles, les tendons ou les ligaments.
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT D’UTILISER DICLOFENAC URGO 140 mg, emplâtre médicamenteux ?
N’utilisez jamais DICLOFENAC URGO 140 mg, emplâtre médicamenteux :
· si vous êtes allergique au diclofénac, à l'acide acétylsalicylique (aspirine) ou aux autres AINS
· si vous êtes allergique à l'un des autres composants de DICLOFENAC URGO 140 mg, emplâtre médicamenteux (voir rubrique 6)
· si vous avez de l'asthme, des problèmes respiratoires, une éruption cutanée ou un nez qui coule après avoir pris de l'acide acétylsalicylique (aspirine) ou un autre AINS
· si vous débutez ou que vous êtes déjà au-delà de votre 6ème mois de grossesse
· si vous avez actuellement un ulcère d'estomac (ulcère peptique)
· si vous avez des lésions cutanées, y compris des zones de suintement ou infectées, de l'eczéma, des brûlures ou des plaies
· si vous êtes un enfant ou un adolescent âgé de moins de 16 ans
Si vous vous trouvez dans l’un de ces cas, vous devez en parler avec votre médecin ou votre pharmacien.
Avertissements et précautions
Adressez-vous à votre médecin ou pharmacien avant d’utiliser DICLOFENAC URGO 140 mg, emplâtre médicamenteux si :
· vous avez une maladie du cœur
· vous avez une maladie du rein
· vous avez une maladie du foie
· vous avez des antécédents d’ulcère de l’estomac
· vous avez une maladie inflammatoire intestinale telle que maladie de Crohn ou colites ulcératives ou vous êtes susceptible d’avoir des saignements d’origine intestinale
· vous avez de l’asthme
· vous avez des problèmes respiratoires, des démangeaisons cutanées ou le nez qui coule après avoir pris de l’acide acétylsalycilique (aspirine) ou tout autre AINS
· vous prenez déjà du diclofénac ou un autre AINS, que ce soit par voie orale ou par voie topique
· vous utilisez régulièrement une cabine UV ou vous vous exposez au soleil
· vous faites partie des personnes âgées, car vous êtes plus sujet aux effets indésirables
Autres informations importantes
Utilisez toujours DICLOFENAC URGO 140 mg, emplâtre médicamenteux à la plus petite dose efficace sur la plus petite période nécessaire au traitement de vos symptômes.
Les patients âgés doivent utiliser DICLOFENAC URGO 140 mg, emplâtre médicamenteux avec prudence, car ils sont particulièrement exposés aux effets indésirables.
Afin de minimiser la fréquence des effets indésirables, il est recommandé d’utiliser la plus petite dose possible sur une durée la plus courte possible.
Enfants et adolescents
Ne pas utiliser chez les enfants et les adolescents de moins de 16 ans.
Autres médicaments et DICLOFENAC URGO 140 mg, emplâtre médicamenteux
Si DICLOFENAC URGO 140 mg, emplâtre médicamenteux est utilisé correctement, le risque d'interaction avec d'autres médicaments est très faible.
Cependant, informez votre médecin ou pharmacien si vous prenez, avez récemment pris ou pourriez prendre tout autre médicament.
DICLOFENAC URGO 140 mg, emplâtre médicamenteux avec des aliments, boissons et de l’alcool
Sans objet.
Si vous êtes enceinte ou que vous allaitez, si vous pensez être enceinte ou planifiez une grossesse, demandez conseil à votre médecin ou pharmacien avant de prendre ce médicament.
N’utilisez pas DICLOFENAC URGO 140 mg, emplâtre médicamenteux si vous commencez ou que vous êtes au-delà du 6ème mois de grossesse, car cela pourrait nuire à votre enfant à naître ou causer des problèmes lors de l'accouchement. DICLOFENAC URGO 140 mg, emplâtre médicamenteux ne doit être utilisé que sur avis médical avant le 6ème mois de grossesse et à la dose la plus faible possible sur une durée de traitement la plus courte possible.
DICLOFENAC URGO 140 mg, emplâtre médicamenteux ne doit être utilisé pendant l’allaitement que sur avis médical car le diclofénac passe dans le lait maternel en petites quantités. Cependant, DICLOFENAC URGO 140 mg, emplâtre médicamenteux ne doit pas être appliqué sur les seins des mères allaitantes ni sur d’autres zones sur de grandes surfaces cutanées ou pendant une période prolongée.
Les formes orales (p. ex. comprimés) de diclofénac peuvent entraîner des effets indésirables chez votre enfant à naître. Avec DICLOFENAC URGO 140 mg, emplâtre médicamenteux lorsqu’il est utilisé sur la peau, ce risque n’est pas connu.
Consultez votre médecin ou pharmacien pour toute information si vous êtes enceinte ou que vous allaitez.
Conduite de véhicules et utilisation de machines
DICLOFENAC URGO 140 mg, emplâtre médicamenteux n’a aucun effet sur l’aptitude à conduire des véhicules et à utiliser des machines.
DICLOFENAC URGO 140 mg, emplâtre médicamenteux contient :
· des conservateurs appelés parahydroxybenzoates pouvant provoquer des réactions allergiques (éventuellement différées),
· 420 mg de propylène glycol dans chaque emplâtre médicamenteux,
· du polysorbate 80 qui peut provoquer des réactions allergiques.
3. COMMENT UTILISER DICLOFENAC URGO 140 mg, emplâtre médicamenteux ?
Adultes et adolescents de 16 ans et plus
Combien d’emplâtres utiliser ?
La dose recommandée de DICLOFENAC URGO 140 mg, emplâtre médicamenteux est d'un (1) emplâtre dans la zone la plus douloureuse une ou deux fois par jour (une application toutes les 12 ou 24 heures) pendant 14 jours consécutifs au maximum. Si vous ne ressentez aucune amélioration au cours de la période de traitement recommandée ou si vos symptômes s'aggravent, parlez-en à votre médecin.
Utilisation chez les enfants et les adolescents (de moins de 16 ans)
Ce médicament ne doit pas être utilisé chez l'enfant de moins de 16 ans compte tenu de manque de données concernant la sécurité et l'efficacité (voir N’utilisez jamais DICLOFENAC URGO 140 mg, emplâtre médicamenteux).
Chez les enfants âgés de 16 ans ou plus, si les symptômes persistent, il est conseillé au patient/parent de l’adolescent de consulter un médecin.
Comment appliquer DICLOFENAC URGO 140 mg, emplâtre médicamenteux ?
Couper le haut de l’enveloppe refermable et extraire l’emplâtre.
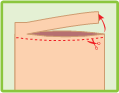
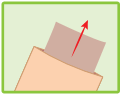
Refermer soigneusement l’enveloppe.
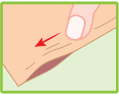
Enlever le film plastique protégeant la face adhésive de l’emplâtre.
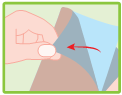
Appliquer l’emplâtre sur la zone douloureuse ou enflée.
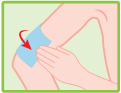
· Si nécessaire, il peut être maintenu en place par une compresse de gaze à maillage large ou de fines bandes adhésives. Vous pouvez vous les procurer auprès de votre pharmacien.
· Ne pas couvrir l'emplâtre avec tout autre type de pansement.
· L’emplâtre médicamenteux ne doit être appliqué que sur une peau saine, non lésée, et non pas sur des plaies cutanées ou des blessures ouvertes, et ne doit pas être porté lors des bains ou des douches.
· Ne pas appliquer l'emplâtre sur les yeux, le nez, la bouche, les zones génitales et anales. En cas de contact, rincer à l'eau.
· L'emplâtre ne doit pas être découpé.
Changer l’emplâtre.
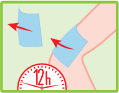
· Enlevez l’emplâtre toutes les 12 ou 24 heures et appliquez-en un nouveau.
Si vous avez utilisé plus de DICLOFENAC URGO 140 mg, emplâtre médicamenteux que vous n’auriez dû
Sans objet.
Si vous oubliez d’utiliser DICLOFENAC URGO 140 mg, emplâtre médicamenteux
N'appliquez pas d’emplâtre supplémentaire pour compenser la dose oubliée. Appliquez simplement votre prochain emplâtre comme prévu.
Si vous avez d'autres questions sur l'utilisation de ce médicament, demandez plus d'informations à votre médecin ou à votre pharmacien.
Si vous arrêtez d’utiliser DICLOFENAC URGO 140 mg, emplâtre médicamenteux
Sans objet.
Si vous avez d’autres questions sur l’utilisation de ce médicament, demandez plus d’informations à votre médecin ou à votre pharmacien.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
Certains effets indésirables peu fréquents et certains effets indésirables très rares peuvent être graves
Si vous ressentez un des signes suivants d'allergie, ARRETEZ d'utiliser DICLOFENAC URGO 140 mg, emplâtre médicamenteux et prévenez votre médecin ou pharmacien immédiatement :
· Gonflement des lèvres, des yeux ou de la bouche, crise d'asthme ou asthmatiforme qui sont des signes d'une réaction allergique grave (concerne moins d'un utilisateur sur 10 000),
· Eruption, picotements ou sensation de brûlure sur le site d'application (concerne 1 à 10 utilisateurs sur 1000).
D'autres effets indésirables peuvent survenir, généralement légers et passagers (si cela vous arrive, consultez votre médecin ou pharmacien).
Effets indésirables fréquents (concernent 1 à 10 utilisateurs sur 100)
· Démangeaisons cutanées
Effets indésirables peu fréquents (concernent de 1 à 10 utilisateurs sur 1000)
· Eruption cutanée
· Rougeurs de la peau
· Petits boutons rouge ou violet sous la peau
Effets indésirables rares (concernent de 1 à 10 utilisateurs sur 10000)
· Peau sèche et squameuse
· Gonflement au site d’application de l’emplâtre
Effets indésirables très rares (concernent moins d'un utilisateur sur 10000)
· Eruptions cutanées aggravées par la lumière du soleil
DICLOFENAC URGO 140 mg, emplâtre médicamenteux étant appliqué sur la peau sur la zone lésée, le risque d'effets indésirables, comme des problèmes gastriques tels que douleur, indigestion, ou tout signe de saignement de l'estomac ou de l'intestin est moindre que dans le cas où le diclofénac est pris par voie orale. Cependant, si DICLOFENAC URGO 140 mg, emplâtre médicamenteux n'est pas utilisé correctement, ces effets indésirables peuvent survenir.
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet: https://signalement.social-sante.gouv.fr/
En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.
5. COMMENT CONSERVER DICLOFENAC URGO 140 mg, emplâtre médicamenteux ?
Tenir ce médicament hors de la vue et de la portée des enfants.
N’utilisez pas ce médicament après la date de péremption indiquée sur le sachet et l’emballage. La date de péremption fait référence au dernier jour de ce mois.
Ce médicament ne nécessite pas de précautions particulières de conservation concernant la température.
Ne pas utiliser 4 mois après première ouverture du sachet. Après avoir retiré chaque emplâtre, s'assurer que le sachet est bien refermé.
Ne jetez aucun médicament au tout-à-l’égout ou avec les ordures ménagères. Demandez à votre pharmacien d’éliminer les médicaments que vous n’utilisez plus. Ces mesures contribueront à protéger l’environnement.
6. CONTENU DE L’EMBALLAGE ET AUTRES INFORMATIONS
Ce que contient DICLOFENAC URGO 140 mg, emplâtre médicamenteux
· La substance active est l’épolamine de diclofénac.
Chaque emplâtre médicamenteux contient un total de 180 mg d’épolamine de diclofénac, correspondant à 140 mg de diclofénac sodique.
· Les autres composants sont : gélatine, povidone (K90), sorbitol liquide (non cristallisable), kaolin lourd, dioxyde de titane (E171), propylene glycol (E1520), parahydroxybenzoate de méthyle (E218), parahydroxybenzoate de propyle (E216), édétate disodique (E385), acide tartrique, glycinate d’aluminium, carmellose sodique, polyacrylate de sodium, 1,3-butylène glycol, polysorbate 80 (E433), eau purifiée.
La couche de support non tissée est en polyester.
Le film protecteur amovible est en polypropylene.
Qu’est-ce que DICLOFENAC URGO 140 mg, emplâtre médicamenteux et contenu de l’emballage extérieur
Les enveloppes refermables contiennent 5 emplâtres.
Chaque boîte de DICLOFENAC URGO 140 mg, emplâtre médicamenteux contient 5 ou 10 emplâtres.
Toutes les présentations peuvent ne pas être commercialisées.
Titulaire de l’autorisation de mise sur le marché
42 RUE DE LONGVIC
21300 CHENOVE
Exploitant de l’autorisation de mise sur le marché
42 RUE DE LONGVIC
21300 CHENOVE
PIAZZA PASOLINI, 2
20159 MILANO
ITALIE
Noms du médicament dans les Etats membres de l'Espace Economique Européen
Ce médicament est autorisé dans les Etats membres de l'Espace Economique Européen sous les noms suivants : Conformément à la réglementation en vigueur.
[À compléter ultérieurement par le titulaire]
La dernière date à laquelle cette notice a été révisée est :
[à compléter ultérieurement par le titulaire]
< {MM/AAAA}>< {mois AAAA}.>
Des informations détaillées sur ce médicament sont disponibles sur le site Internet de l’ANSM (France).