 Participez à la création d’un site d'informations accessibles sur les médicaments pensé pour le grand public !
Participez à la création d’un site d'informations accessibles sur les médicaments pensé pour le grand public !Inscrivez-vous ici pour le tester en avant-première, partager vos impressions, et nous aider à l’améliorer !
 Participez à la création d’un site d'informations accessibles sur les médicaments pensé pour le grand public !
Participez à la création d’un site d'informations accessibles sur les médicaments pensé pour le grand public !PALIPERIDONE TEVA 100 mg, suspension injectable à libération prolongée - Résumé des caractéristiques du produit |
 |
|
ANSM - Mis à jour le : 24/05/2024
PALIPERIDONE TEVA 100 mg, suspension injectable à libération prolongée
2. COMPOSITION QUALITATIVE ET QUANTITATIVE 
Chaque seringue préremplie contient 156 mg de palmitate de palipéridone dans 1 mL équivalent à 100 mg de palipéridone.
Pour la liste complète des excipients, voir rubrique 6.1.
Suspension injectable à libération prolongée (injection à libération prolongée).
La suspension est de couleur blanche à blanc cassé. La suspension est de pH neutre (environ 7,0).
4.1. Indications thérapeutiques 
Chez les patients adultes sélectionnés atteints de schizophrénie et ayant précédemment répondu à la palipéridone ou à la rispéridone orale, la palipéridone peut être utilisée sans stabilisation préalable par un traitement oral si les symptômes psychotiques sont légers à modérés et si un traitement injectable à action prolongée est nécessaire.
4.2. Posologie et mode d'administration 
Posologie
Les doses initiales de PALIPERIDONE TEVA recommandées sont de 150 mg au jour 1 du traitement et de 100 mg une semaine plus tard (jour 8), les deux doses étant administrées dans le muscle deltoïde afin d’atteindre rapidement des concentrations thérapeutiques (voir rubrique 5.2). La troisième dose doit être administrée un mois après la seconde dose d’instauration. La dose d’entretien mensuelle recommandée est de 75 mg ; certains patients peuvent bénéficier de doses plus faibles ou plus élevées dans l’intervalle recommandé allant de 25 à 150 mg en fonction de la tolérance individuelle du patient et/ou de l’efficacité. Les patients en surpoids ou obèses peuvent avoir besoin de doses comprises dans l’intervalle supérieur (voir rubrique 5.2). Après la seconde dose d’instauration, les doses d’entretien mensuelles peuvent être administrées soit dans le muscle deltoïde soit dans le muscle fessier.
Un ajustement de la dose d’entretien peut être effectué mensuellement. Lors des ajustements de dose, les propriétés de libération prolongée de PALIPERIDONE TEVA doivent être prises en compte (voir rubrique 5.2), car l’effet complet des doses d’entretien peut ne pas être observé avant plusieurs mois.
Substitution de la palipéridone orale à libération prolongée ou de la rispéridone orale par PALIPERIDONE TEVA
PALIPERIDONE TEVA doit être instauré comme décrit au début de la rubrique 4.2 ci-dessus. Durant le traitement par dose d’entretien mensuelle de PALIPERIDONE TEVA, les patients précédemment stabilisés sous différentes doses de palipéridone orale sous forme de comprimés à libération prolongée peuvent atteindre une exposition similaire en palipéridone à l’état d’équilibre avec les injections. Les doses d’entretien de PALIPERIDONE TEVA nécessaires pour atteindre une exposition similaire à l’état d’équilibre sont indiquées dans le tableau suivant :
|
Doses de palipéridone sous forme de comprimés à libération prolongée et de PALIPERIDONE TEVA requises pour atteindre une exposition à la palipéridone similaire à l’état d’équilibre lors d’un traitement d’entretien |
|
|
Dose précédente de palipéridone sous forme de comprimés à libération prolongée |
Injection de PALIPERIDONE TEVA |
|
3 mg par jour |
25-50 mg tous les mois |
|
6 mg par jour |
75 mg tous les mois |
|
9 mg par jour |
100 mg tous les mois |
|
12 mg par jour |
150 mg tous les mois |
La palipéridone orale ou la rispéridone orale précédemment administrée peut être arrêtée au moment de l’instauration du traitement par PALIPERIDONE TEVA. Certains patients peuvent bénéficier d’un arrêt progressif. Certains patients passant d’une dose orale de palipéridone plus élevée (par exemple, 9–12 mg par jour) à des injections dans le muscle fessier avec PALIPERIDONE TEVA peuvent avoir une exposition plasmatique plus faible au cours des 6 premiers mois après le changement. Par conséquent, de façon alternative, il pourrait être envisagé de faire des injections dans le muscle deltoïde pendant les 6 premiers mois.
Substitution de l’injection de rispéridone à action prolongée par PALIPERIDONE TEVA
Lors de la substitution de l’injection de rispéridone à action prolongée, instaurer le traitement par PALIPERIDONE TEVA à la place de l’injection suivante programmée. PALIPERIDONE TEVA doit ensuite être poursuivi à intervalles mensuels. Le schéma posologique d’instauration de la première semaine incluant les injections intramusculaires (jour 1 et 8, respectivement) décrit en rubrique 4.2 ci-dessus n’est pas nécessaire. Les patients précédemment stabilisés par différentes doses de rispéridone injectable à action prolongée peuvent atteindre une exposition à la palipéridone similaire à l’état d’équilibre lors d’un traitement d’entretien par des doses mensuelles de PALIPERIDONE TEVA comme suit :
|
Doses de rispéridone injectable à action prolongée et de PALIPERIDONE TEVA requises pour atteindre une exposition à la palipéridone similaire à l’état d’équilibre |
|
|
Dose précédente de rispéridone injectable à action prolongée |
Injection de PALIPERIDONE TEVA |
|
25 mg toutes les 2 semaines |
50 mg tous les mois |
|
37,5 mg toutes les 2 semaines |
75 mg tous les mois |
|
50 mg toutes les 2 semaines |
100 mg tous les mois |
L’arrêt des médicaments antipsychotiques doit être effectué conformément aux informations de prescription appropriées. Si PALIPERIDONE TEVA est interrompu, ses propriétés de libération prolongée doivent être prises en compte. Il est recommandé de réévaluer périodiquement la nécessité de poursuivre un traitement contre les symptômes extrapyramidaux (SE).
Oubli de doses
Eviter l’oubli de doses
Il est recommandé que la seconde dose d’instauration de PALIPERIDONE TEVA soit administrée une semaine après la première dose. Afin d’éviter un oubli de dose, les patients peuvent recevoir la seconde dose 4 jours avant ou après l’échéance de la première semaine (jour 8). De même, il est recommandé que la troisième injection et les injections suivantes après le schéma d’instauration soient administrées mensuellement. Pour pallier un oubli d’une dose mensuelle, les patients peuvent recevoir l’injection jusqu’à 7 jours avant ou après l’échéance mensuelle.
Si la date cible de la seconde injection de PALIPERIDONE TEVA (jour 8 ± 4 jours) est oubliée, la recommandation d’instaurer à nouveau le traitement dépend de la durée qui s’est écoulée depuis la première injection reçue par le patient.
Oubli de la seconde dose d’instauration (< 4 semaines après la première injection)
Si moins de 4 semaines se sont écoulées depuis la première injection, alors le patient devra recevoir la seconde injection de 100 mg dans le muscle deltoïde dès que possible. Une troisième injection de 75 mg de PALIPERIDONE TEVA dans le muscle deltoïde ou le muscle fessier devra être administrée 5 semaines après la première injection (quelle que soit la date de la seconde injection). Par la suite, le cycle mensuel normal des injections dans le muscle deltoïde ou le muscle fessier de doses allant de 25 à 150 mg, en fonction de la tolérance individuelle du patient et/ou de l’efficacité, sera poursuivi.
Oubli de la seconde dose d’instauration (4 à 7 semaines après la première injection)
Si 4 à 7 semaines se sont écoulées depuis la première injection de PALIPERIDONE TEVA, reprendre le traitement par deux injections de 100 mg comme suit :
1. une injection dans le muscle deltoïde dès que possible,
2. une autre injection dans le muscle deltoïde une semaine plus tard,
3. reprise du cycle normal mensuel des injections dans le muscle deltoïde ou le muscle fessier de doses allant de 25 à 150 mg, en fonction de la tolérance individuelle du patient et/ou de l’efficacité.
Oubli de la seconde dose d’instauration (> 7 semaines après la première injection)
Si plus de 7 semaines se sont écoulées depuis la première injection de PALIPERIDONE TEVA, la posologie doit être instaurée comme décrit pour l’instauration initiale recommandée de PALIPERIDONE TEVA ci-dessus.
Oubli d’une dose d’entretien mensuelle (1 mois à 6 semaines)
Après l’instauration, le cycle d’injection de PALIPERIDONE TEVA recommandé est mensuel. Si moins de 6 semaines se sont écoulées depuis la dernière injection, alors la dose précédemment stabilisée doit être administrée dès que possible, suivie par des injections à intervalles mensuels.
Oubli d’une dose d’entretien mensuelle (> 6 semaines à 6 mois)
Si plus de 6 semaines se sont écoulées depuis la dernière injection de PALIPERIDONE TEVA, la recommandation est la suivante :
Pour les patients stabilisés par des doses allant de 25 à 100 mg
1. une injection dans le muscle deltoïde dès que possible de la même dose que celle par laquelle le patient était précédemment stabilisé,
2. une autre injection dans le muscle deltoïde (même dose) une semaine plus tard (jour 8),
3. reprise du cycle mensuel normal des injections dans le muscle deltoïde ou dans le muscle fessier de doses allant de 25 à 150 mg, en fonction de la tolérance individuelle du patient et/ou de l’efficacité.
Pour les patients stabilisés par 150 mg
1. une injection d’une dose de 100 mg dans le muscle deltoïde dès que possible,
2. une autre injection d’une dose de 100 mg dans le muscle deltoïde une semaine plus tard (jour 8),
3. reprise du cycle normal mensuel des injections dans le muscle deltoïde ou dans le muscle fessier de doses allant de 25 à 150 mg, en fonction de la tolérance individuelle du patient et/ou de l’efficacité.
Oubli d’une dose d’entretien mensuelle (> 6 mois)
Si plus de 6 mois se sont écoulés depuis la dernière injection de PALIPERIDONE TEVA, la posologie doit être instaurée comme décrit pour l’instauration initiale recommandée de PALIPERIDONE TEVA ci-dessus.
Populations particulières
Personnes âgées
L’efficacité et la sécurité chez les personnes âgées de plus de 65 ans n’ont pas été établies.
En général, la posologie de PALIPERIDONE TEVA recommandée pour les patients âgés présentant une fonction rénale normale est la même que celle des patients adultes plus jeunes dont la fonction rénale est normale. Toutefois, certains patients âgés pouvant avoir une fonction rénale diminuée, un ajustement posologique peut être nécessaire (voir Insuffisance rénale ci-dessous pour les recommandations posologiques chez les patients présentant une insuffisance rénale).
Insuffisance rénale
La palipéridone n’a pas été étudiée de manière systématique chez les patients présentant une insuffisance rénale (voir rubrique 5.2). Chez les patients présentant une insuffisance rénale légère (clairance de la créatinine ≥ 50 à < 80 mL/min), les doses initiales de PALIPERIDONE TEVA recommandées sont de 100 mg au jour 1 du traitement et de 75 mg une semaine plus tard, les deux doses étant administrées dans le muscle deltoïde. La dose d’entretien mensuelle recommandée est de 50 mg dans un intervalle allant de 25 à 100 mg en fonction de la tolérance individuelle du patient et/ou l’efficacité.
PALIPERIDONE TEVA n’est pas recommandé chez les patients présentant une insuffisance rénale modérée ou sévère (clairance de la créatinine < 50 mL/min) (voir rubrique 4.4).
Insuffisance hépatique
D’après l’expérience acquise avec la palipéridone orale, aucun ajustement posologique n’est nécessaire chez les patients présentant une insuffisance hépatique légère ou modérée. La palipéridone n’ayant pas été étudiée chez les patients présentant une insuffisance hépatique sévère, la prudence est recommandée chez ces patients (voir rubrique 5.2).
Population pédiatrique
La sécurité et l’efficacité de la palipéridone chez les enfants et les adolescents âgés de < 18 ans n’ont pas été établies. Aucune donnée n’est disponible.
Mode d’administration
PALIPERIDONE TEVA est destiné à l’administration intramusculaire uniquement. Il ne doit pas être administré par une autre voie. Il doit être injecté lentement, en profondeur dans le muscle deltoïde ou fessier. Chaque injection doit être administrée par un professionnel de santé. L’administration doit être effectuée par une injection unique. La dose ne doit pas être administrée par des injections séparées.
Les doses d’instauration du jour 1 et du jour 8 doivent chacune être administrées dans le muscle deltoïde afin d’atteindre rapidement des concentrations thérapeutiques (voir rubrique 5.2). Après la seconde dose d’instauration, les doses d’entretien mensuelles peuvent être administrées soit dans le muscle deltoïde soit dans le muscle fessier. Un changement du muscle fessier au muscle deltoïde (et vice versa) doit être envisagé en cas de douleur au site d’injection et si la gêne associée n’est pas bien tolérée (voir rubrique 4.8). Il est également recommandé d’alterner entre les côtés gauche et droit (voir ci-dessous).
Pour les instructions relatives à l’utilisation et la manipulation de PALIPERIDONE TEVA, voir la notice (informations destinées aux professionnels de santé).
Administration dans le muscle deltoïde
La taille d’aiguille recommandée pour les administrations initiales et d’entretien de PALIPERIDONE TEVA dans le muscle deltoïde est déterminée par le poids du patient. Pour les patients dont le poids est ≥ 90 kg, l’aiguille de 11/2 pouce 22 Gauge (38,1 mm × 0,72 mm) est recommandée. Pour ceux dont le poids est < 90 kg, l’aiguille de 1 pouce 23 Gauge (25,4 mm × 0,64 mm) est recommandée. Les injections dans le muscle deltoïde doivent être alternées entre les deux muscles deltoïdes.
Administration dans le muscle fessier
La taille d’aiguille recommandée pour l’administration d’entretien de PALIPERIDONE TEVA dans le muscle fessier est l’aiguille de 11/2 pouce 22 Gauge (38,1 mm × 0,72 mm). L’administration doit être faite dans le quadrant supéro-externe de la fesse. Les injections dans le muscle fessier doivent être alternées entre les deux muscles fessiers.
4.4. Mises en garde spéciales et précautions d'emploi 
Utilisation chez les patients dans un état d’agitation aiguë ou dans un état psychotique grave
PALIPERIDONE TEVA ne doit pas être utilisé dans la prise en charge des états psychotiques sévères ou d’agitation aiguë lorsqu’un contrôle immédiat des symptômes est recherché.
Intervalle QT
La prudence est recommandée lorsque la palipéridone est prescrite à des patients présentant une maladie cardiovasculaire connue ou des antécédents familiaux d’allongement de l’intervalle QT, et en cas d’utilisation concomitante de médicaments suspectés d’allonger l’intervalle QT.
Syndrome malin des neuroleptiques
Le syndrome malin des neuroleptiques (SMN), caractérisé par une hyperthermie, une rigidité musculaire, une instabilité du système nerveux autonome, une altération de la conscience et une augmentation des taux sériques de créatine phosphokinase, a été rapporté avec la palipéridone. Des signes cliniques supplémentaires peuvent inclure une myoglobinurie (rhabdomyolyse) et une insuffisance rénale aiguë. Si un patient développe des signes ou des symptômes évocateurs d’un SMN, la palipéridone doit être interrompue.
Dyskinésie tardive/symptômes extrapyramidaux
Les médicaments qui possèdent des propriétés antagonistes des récepteurs de la dopamine ont été associés à l’induction de dyskinésie tardive caractérisée par des mouvements anormaux involontaires, prédominant au niveau de la langue et/ou du visage. Si les signes et symptômes d’une dyskinésie tardive apparaissent, l’arrêt de tous les antipsychotiques, dont la palipéridone, doit être envisagé.
La prudence s’impose chez les patients recevant, de façon concomitante, des psychostimulants (par exemple, méthylphénidate) et la palipéridone, car des symptômes extrapyramidaux peuvent apparaître lors de l’ajustement de l’un ou des deux médicaments. L’arrêt progressif du traitement stimulant est recommandé (voir rubrique 4.5).
Leucopénie, neutropénie et agranulocytose
Des cas de leucopénie, neutropénie et agranulocytose ont été rapportés avec la palipéridone.
Une agranulocytose a été très rarement rapportée (< 1/10 000 patients) lors de la surveillance après commercialisation. Les patients présentant des antécédents cliniquement significatifs de faible numération des globules blancs (NGB) ou de leucopénie/neutropénie d’origine médicamenteuse doivent être surveillés pendant les tout premiers mois de traitement et l’arrêt de PALIPERIDONE TEVA doit être envisagé au premier signe d’une baisse cliniquement significative de la NGB en l’absence d’autres facteurs causaux. Les patients présentant une neutropénie cliniquement significative doivent être attentivement surveillés en vue de détecter une fièvre ou d’autres symptômes ou signes d’infection et doivent être traités rapidement si de tels symptômes ou signes apparaissent. Les patients présentant une neutropénie sévère (numération absolue de neutrophiles < 1 × 109/L) doivent arrêter PALIPERIDONE TEVA et leur NGB doit être suivie jusqu’au rétablissement.
Réactions d’hypersensibilité
Des réactions anaphylactiques chez des patients ayant précédemment toléré la rispéridone orale ou la palipéridone orale ont été rarement rapportées depuis le début de la commercialisation (voir rubriques 4.1 et 4.8).
Si des réactions d’hypersensibilité surviennent : arrêter PALIPERIDONE TEVA, instaurer des mesures de soutien générales de façon cliniquement appropriée et surveiller le patient jusqu’à ce que les signes et les symptômes disparaissent (voir rubriques 4.3 et 4.8).
Hyperglycémie et diabète
Hyperglycémie, diabète et exacerbation d’un diabète préexistant, dont coma diabétique et acidocétose, ont été rapportés au cours du traitement par palipéridone. Une surveillance clinique adéquate est recommandée conformément aux recommandations relatives aux antipsychotiques. Les symptômes d’hyperglycémie (tels que polydipsie, polyurie, polyphagie et faiblesse) doivent être recherchés chez les patients traités par palipéridone. Une surveillance régulière doit être effectuée chez les patients diabétiques afin de détecter une aggravation de la glycémie.
Prise de poids
Une prise de poids significative a été rapportée avec l’utilisation de la palipéridone. Le poids doit être contrôlé régulièrement.
Utilisation chez des patients présentant des tumeurs prolactine-dépendantes
Des études sur des cultures de tissus suggèrent que la croissance cellulaire des tumeurs du sein chez l’Homme peut être stimulée par la prolactine. Bien qu’aucune association claire avec l’administration d’antipsychotiques n’ait été démontrée jusqu’à présent dans les études cliniques et épidémiologiques, la prudence est recommandée chez les patients présentant des antécédents médicaux significatifs. La palipéridone doit être utilisée avec prudence chez les patients présentant une tumeur préexistante potentiellement prolactine-dépendante.
Hypotension orthostatique
La palipéridone peut induire une hypotension orthostatique chez certains patients par son activité alpha-bloquante. Sur la base des données combinées de trois essais contrôlés versus placebo, de 6 semaines, à doses fixes réalisés avec la palipéridone orale sous forme de comprimés à libération prolongée (3, 6, 9 et 12 mg), une hypotension orthostatique a été rapportée chez 2,5 % des sujets traités par la palipéridone orale par rapport à 0,8 % des patients sous placebo. La palipéridone doit être utilisée avec prudence chez les patients présentant une maladie cardiovasculaire connue (par exemple, insuffisance cardiaque, infarctus du myocarde ou ischémie, anomalies de la conduction), une maladie cérébrovasculaire ou des situations cliniques prédisposant le patient à l’hypotension (par exemple, déshydratation et hypovolémie).
Convulsions
La palipéridone doit être utilisée avec prudence chez les patients présentant des antécédents de convulsions ou d’autres situations cliniques pouvant potentiellement abaisser le seuil épileptogène.
Insuffisance rénale
Les concentrations plasmatiques de palipéridone sont augmentées chez les patients présentant une insuffisance rénale et de ce fait, un ajustement posologique est recommandé chez les patients présentant une insuffisance rénale légère. La palipéridone n’est pas recommandée chez les patients présentant une insuffisance rénale modérée ou sévère (clairance de la créatinine < 50 mL/min) (voir rubriques 4.2 et 5.2).
Insuffisance hépatique
Aucune donnée n’est disponible chez les patients présentant une insuffisance hépatique sévère (classe C de Child-Pugh). La prudence est recommandée si la palipéridone est utilisée chez ces patients.
Patients âgés déments
La palipéridone n’a pas été étudiée chez les patients âgés déments. La palipéridone doit être utilisée avec prudence chez les patients âgés déments présentant des facteurs de risque d’accident vasculaire cérébral.
L’expérience acquise avec la rispéridone, citée ci-dessous, est considérée comme également valable pour la palipéridone.
Mortalité globale
Dans une méta-analyse portant sur 17 essais cliniques contrôlés, des patients âgés déments traités par d’autres antipsychotiques atypiques, incluant la rispéridone, l’aripiprazole, l’olanzapine et la quétiapine ont présenté une augmentation du risque de mortalité par rapport au placebo. Parmi ceux traités par la rispéridone, le taux de mortalité était de 4 % par rapport à 3,1 % pour le placebo.
Effets indésirables cérébrovasculaires
Une augmentation du risque d’effets indésirables cérébrovasculaires d’un facteur 3 environ a été observée dans des essais cliniques randomisés contrôlés versus placebo réalisés chez des patients déments avec certains antipsychotiques atypiques, incluant la rispéridone, l’aripiprazole et l’olanzapine. Le mécanisme de cette augmentation du risque n’est pas connu.
Maladie de Parkinson et démence à corps de Lewy
Les prescripteurs doivent évaluer les risques versus les bénéfices de la prescription de palipéridone chez les patients présentant une maladie de Parkinson ou une démence à corps de Lewy (DCL), ces deux groupes pouvant présenter une augmentation du risque de survenue de syndrome malin des neuroleptiques ainsi qu’une augmentation de la sensibilité aux antipsychotiques.
Les manifestations de l’augmentation de sensibilité peuvent inclure une confusion, un trouble de la conscience avec ralentissement de la pensée, une instabilité posturale avec des chutes fréquentes, en plus des symptômes extrapyramidaux.
Priapisme
La survenue d’un priapisme a été rapportée avec les médicaments antipsychotiques (dont la rispéridone) ayant des propriétés alpha-bloquantes adrénergiques. Au cours de la surveillance post-commercialisation, des cas de priapisme ont également été rapportés avec la palipéridone orale, qui est le métabolite actif de la rispéridone. Les patients doivent être informés de consulter en urgence un médecin si le priapisme n’a pas disparu au bout de 4 heures.
Régulation de la température corporelle
Une altération de la capacité corporelle à diminuer la température corporelle centrale a été rapportée avec les médicaments antipsychotiques. La prudence est recommandée lors de la prescription de la palipéridone chez des patients qui seront exposés à certaines situations pouvant contribuer à une augmentation de la température corporelle centrale ; par exemple, exercice physique intense, exposition à une chaleur extrême, traitement concomitant par des médicaments ayant une activité anticholinergique ou existence d’une déshydratation.
Thromboembolie veineuse
Des cas de thromboembolie veineuse (TEV) ont été rapportés avec les médicaments antipsychotiques. Les patients traités par antipsychotiques présentant souvent des facteurs de risque acquis de TEV, tout facteur de risque potentiel de TEV doit être identifié avant et pendant le traitement par palipéridone et des mesures préventives doivent être mises en œuvre.
Effet antiémétique
Un effet antiémétique a été observé au cours des études précliniques réalisées avec la palipéridone. Cet effet, lorsqu’il survient chez l’Homme, peut masquer les signes et les symptômes de surdosage de certains médicaments ou certaines situations cliniques telles qu’une occlusion intestinale, un syndrome de Reye et une tumeur cérébrale.
Administration
La prudence est recommandée afin d’éviter toute injection accidentelle de PALIPERIDONE TEVA dans un vaisseau sanguin.
Syndrome de l’iris hypotonique peropératoire
Un syndrome de l’iris hypotonique peropératoire (SIHP) a été observé au cours d’interventions chirurgicales de la cataracte chez des patients traités par des médicaments antagonistes des récepteurs alpha 1a-adrénergiques, tels que la palipéridone (voir rubrique 4.8).
Le SIHP peut augmenter le risque de complications oculaires pendant et après l’opération. L’utilisation actuelle ou antérieure de médicaments ayant un effet antagoniste des récepteurs alpha 1a-adrénergiques doit être portée à la connaissance du chirurgien ophtalmologiste avant l’intervention chirurgicale. Le bénéfice potentiel de l’arrêt du traitement par alpha 1-bloquant avant l’intervention chirurgicale de la cataracte n’a pas été établi et doit être mis en balance avec le risque d’arrêt du traitement antipsychotique.
Excipients
Ce médicament contient moins de 1 mmol (23 mg) de sodium par dose, c.-à-d. qu’il est essentiellement « sans sodium ».
4.5. Interactions avec d'autres médicaments et autres formes d'interactions 
La prudence est conseillée lorsque la palipéridone est prescrite avec des médicaments connus pour allonger l’intervalle QT, par exemple, les antiarythmiques de classe IA (par exemple, quinidine, disopyramide) et les antiarythmiques de classe III (par exemple, amiodarone, sotalol), certains antihistaminiques, certains autres antipsychotiques et certains antipaludéens (par exemple, méfloquine). Cette liste est indicative et non exhaustive.
Effets potentiels de PALIPERIDONE TEVA sur d’autres médicaments
La palipéridone ne devrait pas entraîner d’interactions pharmacocinétiques cliniquement importantes avec les médicaments métabolisés par les isoenzymes du cytochrome P-450.
Compte tenu des effets primaires de la palipéridone sur le système nerveux central (SNC) (voir rubrique 4.8), la palipéridone doit être utilisée avec prudence en association avec d’autres médicaments agissant au niveau central ; par exemple, les anxiolytiques, la majorité des antipsychotiques, les hypnotiques, les opiacés, etc., ou avec l’alcool.
La palipéridone peut antagoniser l’effet de la lévodopa et d’autres agonistes dopaminergiques. Lorsque cette association s’avère nécessaire, en particulier au stade terminal de la maladie de Parkinson, la dose efficace la plus faible de chaque traitement doit être prescrite.
Du fait de son potentiel d’induction d’une hypotension orthostatique (voir rubrique 4.4), un effet additif peut être observé lorsque la palipéridone est administrée avec d’autres médicaments présentant ce potentiel, par exemple d’autres antipsychotiques, antidépresseurs tricycliques.
La prudence est conseillée lorsque la palipéridone est associée à d’autres médicaments connus pour diminuer le seuil épileptogène (c’est-à-dire, phénothiazines ou butyrophénones, antidépresseurs tricycliques ou ISRS, tramadol, méfloquine, etc.).
La co-administration de palipéridone orale sous forme de comprimés à libération prolongée à l’état d’équilibre (12 mg une fois par jour) avec du divalproex de sodium sous forme de comprimés à libération prolongée (500 à 2 000 mg une fois par jour) n’a pas affecté la pharmacocinétique du valproate à l’état d’équilibre.
Aucune étude d’interaction entre la palipéridone et le lithium n’a été effectuée. Toutefois, une interaction pharmacocinétique est peu probable.
Effets potentiels d’autres médicaments sur PALIPERIDONE TEVA
Les études in vitro indiquent que le CYP2D6 et le CYP3A4 peuvent interférer de façon minime avec le métabolisme de la palipéridone, mais qu’il n’existe pas in vitro ni in vivo de données indiquant que ces isoenzymes jouent un rôle significatif dans le métabolisme de la palipéridone. L’administration concomitante de palipéridone orale avec la paroxétine, un puissant inhibiteur du CYP2D6, n’a pas montré d’effet cliniquement significatif sur la pharmacocinétique de la palipéridone.
La co-administration de la palipéridone orale à libération prolongée une fois par jour avec de la carbamazépine 200 mg administrée deux fois par jour a entraîné une diminution d’environ 37 % de la Cmax et de l’ASC moyennes de la palipéridone à l’état d’équilibre. Cette diminution est due, pour une large part, à une augmentation de 35 % de la clairance rénale de la palipéridone résultant probablement de l’induction de la P-gp rénale par la carbamazépine. Une diminution mineure de la quantité de substance active excrétée sous forme inchangée dans les urines suggère qu’il y a peu d’effet sur le métabolisme via le CYP ou sur la biodisponibilité de la palipéridone au cours de la co-administration avec la carbamazépine. Des diminutions plus importantes des concentrations plasmatiques de palipéridone peuvent survenir avec des doses plus élevées de carbamazépine. Lors de l’instauration de la carbamazépine, la dose de PALIPERIDONE TEVA doit être réévaluée et augmentée si nécessaire. A l’inverse, lors de l’arrêt de la carbamazépine, la dose de PALIPERIDONE TEVA doit être réévaluée et diminuée si nécessaire.
La co-administration d’une dose unique de 12 mg de palipéridone orale sous forme de comprimé à libération prolongée avec le divalproex de sodium sous forme de comprimés à libération prolongée (deux comprimés de 500 mg une fois par jour) a entraîné une augmentation d’environ 50 % de la Cmax et de l’ASC de la palipéridone, résultant probablement d’une augmentation de l’absorption orale. Aucun effet sur la clairance systémique n’ayant été observé, une interaction cliniquement significative n’est pas attendue entre le divalproex de sodium sous forme de comprimés à libération prolongée et l’injection intramusculaire de palipéridone. Cette interaction n’a pas été étudiée avec PALIPERIDONE TEVA.
Utilisation concomitante de PALIPERIDONE TEVA avec la rispéridone ou la palipéridone orale
La palipéridone étant le principal métabolite actif de la rispéridone, la prudence est de mise lorsque la palipéridone est co-administrée avec la rispéridone ou la palipéridone orale pendant des périodes prolongées. Les données de sécurité concernant l’utilisation concomitante de la palipéridone avec d’autres antipsychotiques sont limitées.
Utilisation concomitante de PALIPERIDONE TEVA avec des psychostimulants
L’utilisation concomitante de psychostimulants (par exemple, méthylphénidate) avec la palipéridone peut entraîner des symptômes extrapyramidaux lors de l’ajustement de l’un ou des deux traitements (voir rubrique 4.4).
4.6. Fertilité, grossesse et allaitement 
Grossesse
Il n’existe pas de données adéquates sur l’utilisation de la palipéridone pendant la grossesse. Le palmitate de palipéridone injecté par voie intramusculaire et la palipéridone administrée par voie orale n’ont pas montré d’effets tératogènes au cours des études chez l’animal, mais d’autres types de toxicité sur la reproduction ont été observés (voir rubrique 5.3). Les nouveau-nés exposés à la palipéridone pendant le troisième trimestre de la grossesse présentent un risque d’effets indésirables incluant des symptômes extrapyramidaux et/ou des symptômes de sevrage, pouvant varier en termes de sévérité et de durée après l’accouchement. Les effets suivants ont été rapportés : agitation, hypertonie, hypotonie, tremblements, somnolence, détresse respiratoire, ou trouble de l’alimentation. Par conséquent, les nouveau-nés doivent être étroitement surveillés. PALIPERIDONE TEVA ne doit pas être utilisé au cours de la grossesse, sauf en cas de nécessité absolue.
La palipéridone est excrétée dans le lait maternel en quantités suffisantes pour que des effets sur le nourrisson allaité soient possibles lorsque des doses thérapeutiques sont administrées à la femme allaitante. PALIPERIDONE TEVA ne doit pas être utilisé au cours de l’allaitement.
Fertilité
Aucun effet pertinent n’a été observé dans les études non cliniques.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines 
La palipéridone peut avoir une influence mineure ou modérée sur l’aptitude à conduire et à utiliser des machines due à des effets potentiels sur le système nerveux et la vision, tels que sédation, somnolence, syncope, vision trouble (voir rubrique 4.8). Par conséquent, les patients doivent être informés de ne pas conduire ou utiliser de machines jusqu’à ce que leur sensibilité individuelle à PALIPERIDONE TEVA soit connue.
Résumé du profil de sécurité
Les effets indésirables les plus fréquemment rapportés au cours des essais cliniques ont été insomnie, céphalées, anxiété, infection des voies respiratoires supérieures, réaction au site d’injection, parkinsonisme, prise de poids, akathisie, agitation, sédation/somnolence, nausées, constipation, sensations vertigineuses, douleurs musculo-squelettiques, tachycardie, tremblements, douleur abdominale, vomissements, diarrhée, fatigue et dystonie. Parmi ces effets indésirables, l’akathisie et la sédation/somnolence sont apparues dose-dépendantes.
Liste des effets indésirables sous forme de tableau
Les effets suivants sont tous les effets indésirables rapportés avec la palipéridone par catégorie de fréquence estimée à partir des essais cliniques menés avec le palmitate de palipéridone. Les termes et fréquences suivants sont utilisés : très fréquent (≥ 1/10) ; fréquent (≥ 1/100, < 1/10) ; peu fréquent (≥ 1/1 000, < 1/100) ; rare (≥ 1/10 000, < 1/1 000) ; très rare (< 1/10 000) et fréquence indéterminée (ne peut être estimée sur la base des données disponibles).
|
Classe de systèmes d’organes |
Effet indésirable |
||||
|
Fréquence |
|||||
|
Très fréquent |
Fréquent |
Peu fréquent |
Rare |
Fréquence indéterminéea |
|
|
Infections et infestations |
|
infection des voies respiratoires supérieures, infection des voies urinaires, grippe |
pneumonie, bronchite, infection des voies respiratoires, sinusite, cystite, infection auriculaire, angine, onychomycose, cellulite, abcès sous-cutané |
infection oculaire, acarodermatite |
|
|
Affections hématologiques et du système lymphatique |
|
|
diminution de la numération de globules blancs, anémie |
neutropénie, thrombopénie, augmentation de la numération des éosinophiles |
agranulocytose |
|
Affections du système immunitaire |
|
|
hypersensibilité |
|
réaction anaphylactique |
|
Affections endocriniennes |
|
hyperprolactinémieb |
|
sécrétion inappropriée d’hormone antidiurétique, présence de glucose urinaire |
|
|
Troubles du métabolisme et de la nutrition |
|
hyperglycémie, prise de poids, perte de poids, diminution de l’appétit |
diabèted, hyperinsulinémie, augmentation de l’appétit, anorexie, augmentation des triglycérides sanguins, augmentation du cholestérol sanguin |
acidocétose diabétique, hypoglycémie, polydipsie |
intoxication par l’eau |
|
Affections psychiatriques |
insomniee |
agitation, dépression, anxiété |
trouble du sommeil, manie, diminution de la libido, nervosité, cauchemar |
catatonie, état de confusion, somnambulisme, émoussement affectif, anorgasmie |
trouble des conduites alimentaires lié au sommeil |
|
Affections du système nerveux |
|
parkinsomismec, akathisiec, sédation/somnolence, dystoniec, sensations vertigineuses, dyskinésiec, tremblements, céphalées |
dyskinésie tardive, syncope, hyperactivité psychomotrice, sensations vertigineuses posturales, perturbation de l’attention, dysarthrie, dysgueusie, hypoesthésie, paresthésie |
syndrome malin des neuroleptiques, ischémie cérébrale, non réponse aux stimuli, perte de la conscience, diminution du niveau de la conscience, convulsione, trouble de l’équilibre, coordination anormale, titubation de la tête |
coma diabétique |
|
Affections oculaires |
|
|
vision trouble, conjonctivite, sécheresse oculaire |
glaucome, trouble du mouvement oculaire, révulsion oculaire, photophobie, augmentation du larmoiement, hyperémie oculaire |
syndrome de l’iris hypotonique (péropératoire) |
|
Affections de l’oreille et du labyrinthe |
|
|
vertige, acouphènes, douleur auriculaire |
|
|
|
Affections cardiaques |
|
tachycardie |
bloc auriculo-ventriculaire, trouble de la conduction, allongement de l’intervalle QT à l’électrocardiogramme, syndrome de tachycardie orthostatique posturale, bradycardie, électrocardiogramme anormal, palpitations |
fibrillation auriculaire, arythmie sinusale |
|
|
Affections vasculaires |
|
hypertension |
hypotension, hypotension orthostatique |
embolie pulmonaire, thrombose veineuse, bouffées de chaleur |
ischémie |
|
Affections respiratoires, thoraciques et médiastinales |
|
toux, congestion nasale |
dyspnée, douleur pharyngolaryngée, épistaxis |
syndrome d’apnée du sommeil, congestion pulmonaire, encombrement des voies respiratoires, râles, sifflements |
hyperventilation, pneumonie d’aspiration, dysphonie |
|
Affections gastro-intestinales |
|
douleur abdominale, vomissements, nausées, constipation, diarrhée, dyspepsie, douleur dentaire |
gêne abdominale, gastro-entérite, dysphagie, sécheresse buccale, flatulence |
pancréatite, occlusion intestinale, gonflement de la langue, incontinence fécale, fécalome, chéilite |
iléus |
|
Affections hépatobiliaires |
|
augmentation des transaminases |
augmentation des gamma-glutamyltransférases, augmentation des enzymes hépatiques |
|
jaunisse |
|
Affections de la peau et du tissu sous-cutané |
|
|
urticaire, prurit, rash, alopécie, eczéma, sécheresse cutanée, érythème, acné |
toxidermie, hyperkératose, dermatite séborrhéique, pellicules |
syndrome de StevensJohnson/nécrolyse épidermique toxique, angiœdème, décoloration de la peau |
|
Affections musculo-squelettiques et systémiques |
|
douleur musculo-squelettique, douleur dorsale, arthralgie |
augmentation de la créatine phosphokinase sanguine, spasmes musculaires, raideur articulaire, faiblesse musculaire |
rhabdomyolyse, tuméfaction articulaire |
posture anormale |
|
Affections du rein et des voies urinaires |
|
|
incontinence urinaire, pollakiurie, dysurie |
rétention urinaire |
|
|
Affections gravidiques, puerpérales et périnatales |
|
|
|
|
syndrome de sevrage médicamenteux néonatal (voir rubrique 4.6) |
|
Affections des organes de reproduction et du sein |
|
aménorrhée |
dysfonctionnement érectile, trouble de l’éjaculation, trouble menstruele, gynécomastie, galactorrhée, dysfonctionnement sexuel, douleur mammaire |
priapisme, gêne mammaire, engorgement mammaire, accroissement mammaire, écoulement vaginal |
|
|
Troubles généraux et anomalies au site d’administration |
|
fièvre, asthénie, fatigue, réaction au site d’injection |
œdème de la face, œdèmee, augmentation de la température corporelle, démarche anormale, douleur thoracique, gêne thoracique, malaise, induration |
hypothermie, frissons, soif, syndrome de sevrage médicamenteux, abcès au site d’injection, cellulite au site d’injection, kyste au site d’injection, hématome au site d’injection |
diminution de la température corporelle, nécrose au site d’injection, ulcère au site d’injection |
|
Lésions, intoxications et complications liées aux procédures |
|
|
chute |
|
|
a. La fréquence de ces effets indésirables est qualifiée comme « indéterminée » car ils n’ont pas été observés lors d’essais cliniques portant sur le palmitate de palipéridone. Ils proviennent soit de rapports spontanés post-commercialisation et la fréquence ne peut être déterminée, soit de données issues d’essais cliniques et/ou de rapports post-commercialisation portant sur la rispéridone (quelle que soit la formulation) ou la palipéridone orale.
b. Se référer à « Hyperprolactinémie » ci-dessous.
c. Se référer à « Symptômes extrapyramidaux » ci-dessous.
d. Dans les essais contrôlés versus placebo, un diabète a été rapporté chez 0,32 % des sujets traités par palipéridone par rapport à un taux de 0,39 % dans le groupe placebo. L’incidence globale de tous les essais cliniques était de 0,65 % chez tous les sujets traités par palmitate de palipéridone.
e. L’insomnie inclut : insomnie initiale, insomnie du milieu de la nuit ; la convulsion inclut : crise de grand mal ; l’œdème inclut : œdème généralisé, œdème périphérique, œdème prenant le godet ; les troubles menstruels incluent : menstruation retardée, menstruation irrégulière, oligoménorrhée.
Effets indésirables observés avec les formulations à base de rispéridone
La palipéridone est le métabolite actif de la rispéridone. Par conséquent, les profils des effets indésirables de ces composés (incluant les deux formulations orale et injectable) s’appliquent l’un à l’autre.
Description des effets indésirables sélectionnés
Réaction anaphylactique
Rarement, des cas de réaction anaphylactique après l’injection de palipéridone ont été rapportés pendant la période post-commercialisation chez les patients ayant précédemment toléré la rispéridone orale ou la palipéridone orale (voir rubrique 4.4).
Réactions au site d’injection
L’effet indésirable lié au site d’injection le plus fréquemment rapporté a été la douleur. La majorité de ces réactions a été rapportée comme étant de sévérité légère à modérée. L’évaluation par les sujets de la douleur au site d’injection, réalisée à l’aide d’une échelle visuelle analogique, tendait à diminuer en fréquence et en intensité durant toute la période des études de phases II et III avec la palipéridone. Les injections dans le muscle deltoïde ont été perçues comme légèrement plus douloureuses que les injections dans le muscle fessier. Les autres réactions au site d’injection ont été principalement d’intensité faible et ont inclus induration (fréquent), prurit (peu fréquent) et nodules (rare).
Symptômes extrapyramidaux (SEP)
Les SEP incluaient une analyse combinée des termes suivants : parkinsonisme (incluant hypersécrétion salivaire, raideur musculo-squelettique, parkinsonisme, salivation, phénomène de la roue dentée, bradykinésie, hypokinésie, faciès figé, tension musculaire, akinésie, rigidité de la nuque, rigidité musculaire, démarche parkinsonienne, réflexe glabellaire anormal et tremblement de repos parkinsonien), akathisie (incluant akathisie, impatiences, hyperkinésie et syndrome des jambes sans repos), dyskinésie (dyskinésie, contractions musculaires, choréoathétose, athétose et myoclonie), dystonie (incluant dystonie, hypertonie, torticolis, contractions musculaires involontaires, contracture musculaire, blépharospasme, crise oculogyre, paralysie de la langue, spasme facial, laryngospasme, myotonie, opisthotonos, spasme oropharyngé, pleurothotonos, spasme de la langue et trismus) et tremblements. Il est à noter qu’un spectre plus large de symptômes est inclus, qui n’ont pas nécessairement une origine extrapyramidale.
Prise de poids
Dans l’étude de 13 semaines comprenant la dose d’instauration de 150 mg, la proportion de sujets présentant une prise de poids anormale ≥ 7 % a montré une tendance dose-dépendante, avec un taux d’incidence de 5 % dans le groupe placebo par rapport à des taux de 6 %, 8 % et 13 % dans les groupes palipéridone 25 mg, 100 mg et 150 mg, respectivement.
Pendant la période de transition/entretien de 33 semaines en ouvert de l’essai de prévention des récidives à long terme, 12 % des sujets traités par palipéridone répondaient à ce critère (prise de poids ≥ 7 % depuis la phase en double aveugle jusqu’à la fin de l’étude) ; le changement de poids moyen (ET) à partir du début de l’étude en ouvert était +0,7 (4,79) kg.
Hyperprolactinémie
Dans les essais cliniques, des augmentations médianes de la prolactine sérique ont été observées chez les sujets des deux sexes qui ont reçu la palipéridone. Des effets indésirables pouvant suggérer une augmentation des taux de prolactine (par exemple, aménorrhée, galactorrhée, troubles menstruels, gynécomastie) ont été rapportés au total chez < 1 % des sujets.
Effets de classe
Un allongement de l’intervalle QT, des arythmies ventriculaires (fibrillation ventriculaire, tachycardie ventriculaire), une mort subite inexpliquée, un arrêt cardiaque et des torsades de pointes peuvent survenir avec les antipsychotiques.
Des cas de thromboembolie veineuse, incluant des cas d’embolie pulmonaire et de thrombose veineuse profonde, ont été rapportés avec les médicaments antipsychotiques (fréquence indéterminée).
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr
Symptômes
En général, les signes et symptômes attendus sont ceux résultant d’une exacerbation des effets pharmacologiques connus de la palipéridone, à savoir endormissement et sédation, tachycardie et hypotension, allongement de l’intervalle QT et symptômes extrapyramidaux. Des torsades de pointes et une fibrillation ventriculaire ont été rapportées chez un patient dans le contexte d’un surdosage en palipéridone orale. En cas de surdosage aigu, l’implication possible de plusieurs médicaments doit être prise en compte.
Prise en charge
La forme à libération prolongée du médicament et la longue demi-vie d’élimination de la palipéridone doivent être prises en compte dans l’évaluation des besoins en traitement et du rétablissement. Il n’existe pas d’antidote spécifique à la palipéridone. Des mesures de soutien générales doivent être mises en place. Etablir et maintenir l’accès aux voies aériennes et assurer une oxygénation et une ventilation adéquates.
Une surveillance cardiovasculaire doit débuter immédiatement et doit inclure un suivi électrocardiographique en continu pour détecter d’éventuelles arythmies. Une hypotension et un collapsus circulatoire doivent être traités par des mesures appropriées telles que la perfusion intraveineuse de fluides et/ou d’agents sympathomimétiques. En cas de symptômes extrapyramidaux sévères, des agents anticholinergiques doivent être administrés. Une supervision et un suivi rapprochés doivent être poursuivis jusqu’au rétablissement du patient.
5. PROPRIETES PHARMACOLOGIQUES 
5.1. Propriétés pharmacodynamiques 
Classe pharmacothérapeutique : psycholeptiques, autres antipsychotiques, code ATC : N05AX13.
PALIPERIDONE TEVA contient un mélange racémique de palipéridone (+) et (-).
Mécanisme d’action
La palipéridone est un agent sélectif bloquant les effets des monoamines, dont les propriétés pharmacologiques sont différentes de celles des neuroleptiques conventionnels. La palipéridone se lie fortement aux récepteurs sérotoninergiques 5-HT2 et dopaminergiques D2. La palipéridone bloque également les récepteurs alpha 1-adrénergiques et, à un moindre degré, les récepteurs histaminergiques H1 et alpha 2-adrénergiques. L’activité pharmacologique des énantiomères (+) et (-) de la palipéridone est qualitativement et quantitativement comparable.
La palipéridone ne se lie pas aux récepteurs cholinergiques. Bien que la palipéridone soit un puissant antagoniste D2, qui est considéré comme responsable de l’effet bénéfique sur les symptômes positifs de la schizophrénie, elle entraîne moins de catalepsie et diminue moins la motricité que les neuroleptiques conventionnels. L’antagonisme sérotoninergique central dominant peut diminuer la capacité de la palipéridone à induire des effets indésirables extrapyramidaux.
Efficacité clinique
Traitement de la phase aiguë de la schizophrénie
L’efficacité de la palipéridone dans le traitement de la phase aiguë de la schizophrénie a été établie au cours de quatre études à court terme (une étude de 9 semaines et trois études de 13 semaines) en double aveugle, randomisées, contrôlées versus placebo, à doses fixes chez des patients adultes en rechute hospitalisés en phase aiguë et répondant aux critères DSM-IV de la schizophrénie. Les doses fixes de palipéridone dans ces études ont été administrées aux jours 1, 8 et 36 dans l’étude de 9 semaines ainsi qu’au jour 64 dans les études de 13 semaines. Aucune couverture additionnelle avec un antipsychotique oral n’a été requise pendant le traitement de la phase aiguë de la schizophrénie par palipéridone. Le critère d’efficacité principal a été défini comme la diminution des scores totaux à l’échelle PANSS (Positive and Negative Syndrome Scale) comme indiqué dans le tableau ci-dessous. L’échelle PANSS est un inventaire validé de plusieurs items portant sur cinq facteurs afin d’évaluer les symptômes positifs, les symptômes négatifs, les pensées désorganisées, l’hostilité/l’excitation incontrôlées et l’anxiété/la dépression. Le fonctionnement a été évalué en utilisant l’échelle PSP (Personal and Social Performance).
L’échelle PSP est une échelle validée notée par les cliniciens qui mesure le fonctionnement personnel et social dans quatre domaines : les activités utiles à la société (travail et études), les relations personnelles et sociales, l’autonomie et les comportements perturbateurs et agressifs.
Dans une étude de 13 semaines (n = 636) comparant trois doses fixes de palipéridone (injection initiale de 150 mg dans le muscle deltoïde suivie de 3 doses dans le muscle fessier ou deltoïde de 25 mg/4 semaines, 100 mg/4 semaines ou 150 mg mg/4 semaines) au placebo, les trois doses de palipéridone ont été supérieures au placebo dans l’amélioration du score total à l’échelle PANSS. Dans cette étude, les groupes de traitement de 100 mg/4 semaines et 150 mg/4 semaines ont montré une supériorité statistique par rapport au placebo sur l’échelle PSP, mais pas celui de 25 mg/4 semaines. Ces résultats soutiennent l’efficacité sur la durée totale du traitement et l’amélioration sur l’échelle PANSS qui a été observée dès le jour 4 avec une différence significative par rapport au placebo dans les groupes palipéridone 25 mg et 150 mg à partir du jour 8.
Les résultats des autres études ont fourni des résultats statistiquement significatifs en faveur de la palipéridone, excepté pour la dose de 50 mg dans une étude (voir tableau ci-dessous).
|
Score total à l’échelle Positive and Negative Syndrome Scale (PANSS) pour la schizophrénie — Variations entre l’état initial et la dernière évaluation — Données en LOCF dans les études R092670-SCH-201, R092670-PSY-3003, R092670-PSY-3004 et R092670-PSY-3007 : analyse de l’efficacité primaire |
||||||
|
|
Placebo |
25 mg |
50 mg |
100 mg |
150 mg |
|
|
R092670-PSY-3007* Moyenne à l’inclusion (ET) Variation moyenne (ET) Valeur de p (vs. placebo) |
n = 160 86,8 (10,31)
-2,9 (19,26)
-- |
n = 155 86,9 (11,99)
-8,0 (19,90)
0,034 |
-- |
n = 161 86,2 (10,77)
-11,6 (17,63)
< 0,001 |
n = 160 88,4 (11,70)
-13,2 (18,48)
< 0,001 |
|
|
R092670-PSY-3003 Moyenne à l’inclusion (ET) Variation moyenne (ET) Valeur de p (vs. placebo) |
n = 132 92,4 (12,55)
-4,1 (21,01)
-- |
-- |
n = 93 89,9 (10,78)
-7,9 (18,71)
0,193 |
n = 94 90,1 (11,66)
-11,0 (19,06)
0,019 |
n = 30 92,2 (11,72)
-5,5 (19,78)
|
|
|
R092670-PSY-3004 Moyenne à l’inclusion (ET) Variation moyenne (ET) Valeur de p (vs. placebo) |
n = 125 90,7 (12,22)
-7,0 (20,07)
-- |
n = 129 90,7 (12,25)
-13,6 (21,45)
0,015 |
n = 128 91,2 (12,02)
-13,2 (20,14)
0,017 |
n = 131 90,8 (11,70)
-16,1 (20,36)
< 0,001 |
-- |
|
|
R092670-SCH-201 Moyenne à l’inclusion (ET) Variation moyenne (ET) Valeur de p (vs. placebo) |
n = 66 87,8 (13,90)
6,2 (18,25)
-- |
-- |
n = 63 88,0 (12,39)
-5,2 (21,52)
0,001 |
n = 68 85,2 (11,09)
-7,8 (19,40)
< 0,0001 |
-- |
|
* Dans l’étude R092670-PSY-3007, une dose d’instauration de 150 mg a été administrée à tous les sujets des groupes de traitement par palipéridone au jour 1 suivie par la dose assignée par la suite.
Remarque : une variation négative du score indique une amélioration.
Maintien du contrôle des symptômes et prévention des rechutes de la schizophrénie
L’efficacité de la palipéridone dans le maintien du contrôle des symptômes et la prévention des rechutes de la schizophrénie a été établie dans une étude à long terme en double aveugle, contrôlée versus placebo, à doses flexibles impliquant 849 sujets adultes non âgés répondant aux critères DSM-IV de la schizophrénie. Cette étude incluait une phase de traitement de la phase aigüe et de stabilisation de 33 semaines en ouvert, une phase randomisée, en double aveugle et contrôlée versus placebo pour observer les rechutes et une période d’extension en ouvert de 52 semaines. Dans cette étude, la palipéridone a été administrée mensuellement à des doses de 25, 50, 75 et 100 mg ; la dose de 75 mg a été autorisée uniquement dans l’extension en ouvert de 52 semaines. Les sujets ont reçu initialement des doses flexibles (25–100 mg) de palipéridone pendant une période de transition de 9 semaines, suivie d’une période d’entretien de 24 semaines, au cours de laquelle les sujets devaient avoir un score PANSS ≤ 75. Des ajustements posologiques ont été autorisés uniquement pendant les 12 premières semaines de la période d’entretien. Au total, 410 patients stabilisés ont été randomisés sous palipéridone (durée médiane de 171 jours [allant de 1 à 407 jours]) ou sous placebo (durée médiane de 105 jours [allant de 8 à 441 jours]) jusqu’à ce qu’ils présentent une recrudescence des symptômes schizophréniques dans la phase en double aveugle de durée variable. L’essai a été arrêté très tôt pour des raisons d’efficacité car un délai avant rechute significativement plus long (p < 0,0001, figure 1) a été observé chez les patients traités par palipéridone comparativement au placebo (rapport de risque = 4,32 ; IC à 95 % : 2,4 à 7,7).
Jours depuis la randomisation Test du log-rank, valeur de p < 0,0001 Placebo N = 156 Injection de palipéridone N = 156![]()
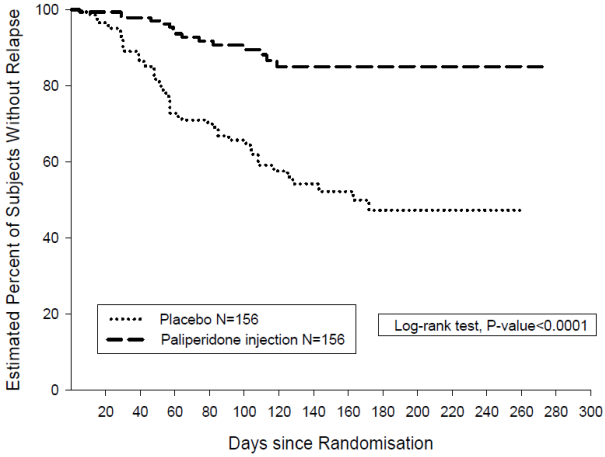
Figure 1 : Courbe de Kaplan-Meier du délai avant rechute — Analyse intermédiaire (analyse intermédiaire en intention de traiter)
Population pédiatrique
L’Agence européenne des médicaments a accordé une dérogation à l’obligation de soumettre les résultats d’études avec le médicament de référence contenant de la palipéridone dans tous les sous-groupes de la population pédiatrique de schizophrénie. Voir rubrique 4.2 pour des informations concernant l’usage pédiatrique.
5.2. Propriétés pharmacocinétiques 
Le palmitate de palipéridone est un ester de palmitate, prodrogue de la palipéridone. En raison de sa solubilité extrêmement faible dans l’eau, le palmitate de palipéridone se dissout lentement après une injection intramusculaire avant d’être hydrolysé en palipéridone et absorbé dans la circulation sanguine. Après administration d’une dose unique par voie intramusculaire, les concentrations plasmatiques de palipéridone augmentent graduellement pour atteindre des concentrations plasmatiques maximum à un Tmax médian de 13 jours. La libération de la substance active démarre dès le jour 1 et dure au moins 4 mois.
Après l’injection intramusculaire de doses uniques (25–150 mg) dans le muscle deltoïde, une Cmax, en moyenne 28 % supérieure a été observée par rapport à l’injection dans le muscle fessier. Les deux injections intramusculaires initiales dans le muscle deltoïde de 150 mg le jour 1 et de 100 mg le jour 8 permettent d’atteindre rapidement les concentrations thérapeutiques. Le profil de libération et le schéma posologique de palipéridone aboutissent au maintien prolongé des concentrations thérapeutiques. L’exposition totale à la palipéridone après administration de palipéridone en suspension injectable à libération prolongée a été dose-proportionnelle dans un intervalle de doses allant de 25 à 150 mg et la Cmax a été inférieure à la dose proportionnalité pour les doses dépassant 50 mg. Le ratio moyen pic/vallée à l’état d’équilibre pour une dose de 100 mg de palipéridone était de 1,8 après l’administration dans le muscle fessier et de 2,2 après l’administration dans le muscle deltoïde. La demi-vie apparente médiane de la palipéridone après l’administration de palipéridone en suspension injectable à libération prolongée dans l’intervalle de doses 25-150 mg allait de 25 à 49 jours.
La biodisponibilité absolue du palmitate de palipéridone après l’administration de palipéridone en suspension injectable à libération prolongée est de 100 %.
Après l’administration du palmitate de palipéridone, les énantiomères (+) et (-) de la palipéridone s’interconvertissent, atteignant un ratio d’ASC (+) sur (-) d’environ 1,6–1,8.
La liaison aux protéines plasmatiques de la palipéridone racémique est de 74 %.
Biotransformation et élimination
Une semaine après l’administration d’une dose orale unique de 1 mg de 14C-palipéridone à libération immédiate, 59 % de la dose a été excrétée sous forme inchangée dans les urines, indiquant que la palipéridone n’est pas extensivement métabolisée au niveau hépatique. Environ 80 % de la radioactivité administrée a été retrouvée dans les urines et 11 % dans les fèces. Quatre voies métaboliques ont été identifiées in vivo, aucune d’entre elles ne concerne plus de 6,5 % de la dose : déalkylation, hydroxylation, déshydrogénation et coupure du noyau benzisoxazole. Bien que les études in vitro suggèrent un rôle du CYP2D6 et du CYP3A4 dans le métabolisme de la palipéridone, il n’existe pas de preuve in vivo que ces isoenzymes jouent un rôle significatif dans le métabolisme de la palipéridone. Les analyses de pharmacocinétique de population n’ont indiqué aucune différence notoire sur la clairance apparente de la palipéridone après l’administration de palipéridone orale entre les métaboliseurs rapides et les métaboliseurs lents des substrats du CYP2D6. Les études in vitro sur des microsomes hépatiques humains ont montré que la palipéridone n’inhibe pas de façon substantielle le métabolisme des médicaments métabolisés par les isoenzymes du cytochrome P450, incluant CYP1A2, CYP2A6, CYP2C8/9/10, CYP2D6, CYP2E1, CYP3A4 et CYP3A5.
Des études in vitro ont montré que la palipéridone était un substrat de la P-gp et un inhibiteur faible de la P-gp à des concentrations élevées. Aucune donnée in vivo n’est disponible et la signification clinique n’est pas connue.
Injection de palmitate de palipéridone à action prolongée versus palipéridone orale à libération prolongée
PALIPERIDONE TEVA est conçu pour délivrer la palipéridone sur une période mensuelle alors que la palipéridone orale à libération prolongée est administrée quotidiennement. Le schéma initial de PALIPERIDONE TEVA (150 mg/100 mg dans le muscle deltoïde aux jour 1/jour 8) a été établi afin d’atteindre rapidement des concentrations de palipéridone à l’état d’équilibre lors de l’instauration du traitement sans utiliser de couverture orale supplémentaire.
En général, les concentrations plasmatiques initiales totales de palipéridone étaient comprises dans l’intervalle d’exposition observé avec des doses de palipéridone orale à libération prolongée allant de 6 à 12 mg. L’utilisation du schéma initial de palipéridone a permis aux patients de rester dans la fenêtre d’exposition obtenue avec des doses de 6 à 12 mg de palipéridone orale à libération prolongée même les jours précédant l’administration de la dose (jour 8 et jour 36) où l’exposition est plus faible. En raison de la différence de profils pharmacocinétiques médians entre les deux médicaments, la prudence est recommandée lors d’une comparaison directe de leurs propriétés pharmacocinétiques.
Insuffisance hépatique
La palipéridone n’est pas fortement métabolisée au niveau hépatique. Bien que la palipéridone n’ait pas été étudiée chez les patients présentant une insuffisance hépatique, aucun ajustement posologique n’est requis chez les patients présentant une insuffisance hépatique légère ou modérée. Dans une étude sur la palipéridone orale chez des sujets présentant une insuffisance hépatique modérée (classe B de Child-Pugh), les concentrations plasmatiques de la palipéridone libre étaient comparables à celles des sujets sains. La palipéridone n’a pas été étudiée chez les patients présentant une insuffisance hépatique sévère.
Insuffisance rénale
L’élimination d’une dose orale unique de 3 mg de palipéridone sous forme de comprimé à libération prolongée a été étudiée chez des sujets présentant différents degrés de fonction rénale. L’élimination de la palipéridone décroît avec la diminution de la clairance estimée de la créatinine. Chez les sujets présentant une fonction rénale altérée, la clairance totale de la palipéridone était réduite de 32 % en moyenne lors d’une insuffisance rénale légère (ClCr = 50 à < 80 mL/min), de 64 % lors d’une insuffisance rénale modérée (ClCr = 30 à < 50 mL/min) et de 71 % lors d’une insuffisance rénale sévère (ClCr = 10 à < 30 mL/min), ce qui correspondait à une augmentation moyenne de l’exposition (ASCinf) de 1,5, 2,6 et 4,8 fois, respectivement, par rapport à des sujets sains. Sur la base d’un nombre limité d’observations avec la palipéridone chez les sujets présentant une insuffisance rénale légère et de simulations pharmacocinétiques, une réduction de dose est recommandée (voir rubrique 4.2).
Personnes âgées
L’analyse pharmacocinétique de population n’a pas mis en évidence de différences pharmacocinétiques liées à l’âge.
Indice de masse corporelle (IMC)/poids corporel
Des études pharmacocinétiques sur le palmitate de palipéridone ont montré des concentrations plasmatiques de palipéridone légèrement plus faibles (10 à 20 %) chez les patients en surpoids ou obèses par rapport aux patients dont le poids était normal (voir rubrique 4.2).
Origine ethnique
Une analyse de pharmacocinétique de population sur les données d’études menées avec la palipéridone orale n’a pas mis en évidence de différences liées à l’origine ethnique sur la pharmacocinétique de la palipéridone après administration de palipéridone.
Sexe
Aucune différence cliniquement significative n’a été observée entre les hommes et les femmes.
Tabagisme
D’après des études in vitro utilisant des enzymes hépatiques humaines, la palipéridone n’est pas un substrat du CYP1A2 ; le tabagisme ne devrait donc pas avoir d’effet sur la pharmacocinétique de la palipéridone. L’effet du tabagisme sur la pharmacocinétique de la palipéridone n’a pas été étudié avec la palipéridone en suspension injectable à libération prolongée. Une analyse de pharmacocinétique de population basée sur des données de la palipéridone orale sous forme de comprimés à libération prolongée a montré une exposition à la palipéridone légèrement plus faible chez les fumeurs que chez les non-fumeurs. Il est peu probable que la différence soit cliniquement significative.
5.3. Données de sécurité préclinique 
Chez les animaux traités avec le palmitate de palipéridone, une réaction inflammatoire a été observée au niveau du site d’injection intramusculaire. La formation d’abcès est survenue occasionnellement.
Au cours des études de reproduction chez le rat avec la rispéridone orale, qui est largement convertie en palipéridone chez le rat et l’Homme, des effets indésirables ont été observés sur le poids de naissance et la survie des progénitures. Aucune embryotoxicité ou malformation n’a été observée après l’administration intramusculaire du palmitate de palipéridone à des rates gravides jusqu’à la dose la plus élevée (160 mg/kg/jour), correspondant à 4,1 fois l’exposition chez l’Homme à la dose maximale recommandée de 150 mg. D’autres antagonistes dopaminergiques, lorsqu’ils ont été administrés à des animaux gravides, ont entraîné des effets délétères sur les capacités d’apprentissage et le développement moteur des progénitures.
Le palmitate de palipéridone et la palipéridone n’ont pas été génotoxiques. Au cours d’études de cancérogénèse orale réalisées avec la rispéridone chez le rat et la souris, des augmentations de l’incidence des adénomes hypophysaires (souris), des adénomes du pancréas endocrine (rat), et de la glande mammaire (chez les deux espèces) ont été observées. Le potentiel cancérogène du palmitate de palipéridone injecté par voie intramusculaire a été évalué chez le rat. Une augmentation statistiquement significative des adénocarcinomes des glandes mammaires chez les rats femelles à 10, 30 et 60 mg/kg/mois a été observée. Les rats mâles ont montré une augmentation statistiquement significative des adénomes et des carcinomes des glandes mammaires à 30 et 60 mg/kg/mois, ce qui correspond à 1,2 et 2,2 fois l’exposition chez l’Homme à la dose maximale recommandée de 150 mg. Ces tumeurs peuvent être liées à un antagonisme D2 dopaminergique prolongé et à une hyperprolactinémie. La signification de ces données tumorales chez les rongeurs en termes de risque pour l’espèce humaine est inconnue.
Ce médicament ne doit pas être mélangé avec d’autres médicaments.
2 ans
6.4. Précautions particulières de conservation 
Ce médicament ne nécessite pas de précautions particulières de conservation.
6.5. Nature et contenu de l'emballage extérieur 
1 mL de suspension en seringue préremplie (copolymère d’oléfine cyclique) munie d’un bouchon-piston, d’une valve antiretour et d’un capuchon (caoutchouc bromobutyle) avec une aiguille de sécurité de 11/2 pouce 22 G (38,1 mm × 0,72 mm) et une aiguille de sécurité de 1 pouce 23 G (25,4 mm × 0,64 mm).
Chaque boîte contient 1 seringue préremplie et 2 aiguilles.
6.6. Précautions particulières d’élimination et de manipulation 
Tout médicament non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE 
SWENSWEG 5
2031 GA, HAARLEM
PAYS-BAS
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE 
· 34009 302 327 9 8 : Boite de 1 seringue pré-remplie et 2 aiguilles.
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION 
[à compléter ultérieurement par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE 
[à compléter ultérieurement par le titulaire]
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES 
Liste I
Prescription initiale réservée aux spécialistes en psychiatrie.
Renouvellement non restreint
|
| Plan du site | Accessibilité | Contact | Téléchargement | Declaration de confidentialité | Service-Public.fr | Legifrance | Gouvernement.fr |