Dernière mise à jour le 02/02/2026
OXYCODONE EG LP 20 mg, comprimé pelliculé à libération prolongée
Indications thérapeutiques
Classe pharmacothérapeutique - code ATC : N02A A05
OXYCODONE EG LP (chlorhydrate d'oxycodone) est un traitement de la douleur puissant à action centrale, du groupe des opioïdes.
OXYCODONE EG LP est utilisé pour traiter les douleurs sévères qui ne peuvent être correctement soulagées que par des analgésiques opioïdes
OXYCODONE EG LP est indiqué chez les adultes et les adolescents de 12 ans et plus.
Présentations
> 28 plaquette(s) PVC PVDC aluminium avec fermeture de sécurité enfant de 1 comprimé(s)
Code CIP : 277 550-9 ou 34009 277 550 9 5
Déclaration de commercialisation : 07/09/2015
Cette présentation est agréée aux collectivités
- Prix hors honoraire de dispensation : 9,15 €
- Honoraire de dispensation : 1,02 €
- Prix honoraire compris : 10,17 €
- Taux de remboursement :65%
Documents de bon usage du médicament
- Prévenir le risque de surdose d’opioïdes
Auteur : Haute autorité de santé
Type : Fiche Bon Usage du Médicament
Date de mise à jour :Avril 2023
- Prise en charge médicamenteuse de la douleur chez l'enfant : alternatives à la codéine
Auteur : Haute autorité de santé
Type : Fiche mémo
Date de mise à jour :Février 2016
- Les médicaments des accès douloureux paroxystiques du cancer
Auteur : Haute autorité de santé
Type : Fiche Bon Usage du Médicament
Date de mise à jour :Juin 2014
Service médical rendu (SMR)
Amélioration du service médical rendu (ASMR)
Ce médicament étant un générique, l'ASMR n'a pas été évalué par la commission de la transparence (CT), il est possible de se référer à la /aux spécialité(s) de référence du groupe générique auquel appartient ce médicament (cliquez ici pour aller à la rubrique des groupes génériques)
Autres informations
- Titulaire de l'autorisation : EG LABO - Laboratoires EuroGenerics
- Conditions de prescription et de délivrance :
- prescription en toutes lettres sur ordonnance sécurisée
- prescription limitée à 4 semaines
- stupéfiants
- Statut de l'autorisation : Valide
- Type de procédure : Procédure décentralisée
- Code CIS : 6 705 537 0
ANSM - Mis à jour le : 19/03/2025
OXYCODONE EG LP 20 mg, comprimé pelliculé à libération prolongée
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Chlorhydrate d’oxycodone ..................................................................................................... 20 mg
Equivalent à 17,9 mg d’oxycodone.
Pour un comprimé pelliculé à libération prolongée.
Excipients à effet notoire : chaque comprimé pelliculé à libération prolongée contient 46 mg de lactose (sous forme monohydratée).
Pour la liste complète des excipients, voir rubrique 6.1
Comprimé pelliculé à libération prolongée.
Comprimé pelliculé à libération prolongée rond, biconvexe, rose clair, d’un diamètre de 6,9 à 7,3 mm et d’une épaisseur de 3,2 à 3,9 mm.
4.1. Indications thérapeutiques
Douleurs sévères qui ne peuvent être correctement traitées que par des analgésiques opioïdes.
OXYCODONE EG LP est indiqué chez les adultes et les adolescents âgés de 12 ans et plus.
4.2. Posologie et mode d'administration
La posologie dépend de l'intensité de la douleur et de la susceptibilité individuelle du patient au traitement. Les recommandations posologiques générales sont les suivantes :
Adultes et adolescents de 12 ans et plus
Titration et ajustement posologique
En général, la posologie initiale chez les patients naïfs d’opioïdes est de 10 mg de chlorhydrate d'oxycodone administrés à 12 heures d'intervalle. Certains patients peuvent bénéficier d’une posologie initiale de 5 mg de chlorhydrate d'oxycodone afin de minimiser l’incidence des effets indésirables.
Les patients recevant déjà un traitement par opioïdes peuvent débuter le traitement à des posologies plus élevées compte tenu de leur expérience préalable des traitements par opioïdes.
Pour les posologies non réalisables/praticables avec ce dosage, d'autres dosages de ce médicament sont disponibles.
D'après des études cliniques contrôlées, 10 à 13 mg de chlorhydrate d'oxycodone correspondent approximativement à 20 mg de sulfate de morphine, chacun dans la formulation à libération prolongée.
En raison des différences individuelles de sensibilité aux divers opioïdes, il est recommandé de commencer le traitement des patients par OXYCODONE EG LP de façon conventionnelle après conversion à partir d'autres opioïdes, avec 50 à 75 % de la dose calculée d'oxycodone.
Certains patients prenant OXYCODONE EG LP suivant un protocole établi ont besoin d'analgésiques à libération rapide comme médicament de secours pour le traitement des accès douloureux paroxystiques. OXYCODONE EG LP n'est pas indiqué dans le traitement de douleurs aiguës et/ou des accès douloureux paroxystiques.
La posologie du médicament de secours doit être équivalente à 1/6 de la posologie équianalgésique quotidienne d’OXYCODONE EG LP. L'utilisation d'un médicament de secours plus de deux fois par jour indique que la posologie d’OXYCODONE EG LP doit être augmentée. La posologie ne sera modifiée qu’une fois par jour/une fois tous les 2 jours jusqu'à ce l’on soit parvenu à une administration biquotidienne stable.
Après une augmentation posologique de 10 à 20 mg administrés toutes les 12 heures, les ajustements posologiques doivent être effectués par paliers d'environ un tiers de la posologie journalière. L'objectif est de déterminer une posologie spécifique au patient permettant de maintenir une analgésie adéquate en deux prises quotidiennes avec des effets indésirables supportables et en utilisant le moins possible le médicament de secours aussi longtemps que le traitement antalgique est nécessaire.
Bien qu'une administration symétrique (la même posologie administrée le matin et le soir) à heures régulières (toutes les 12 heures) soit appropriée chez la majorité des patients, certains patients peuvent tirer un meilleur bénéfice thérapeutique d'une administration asymétrique. En général, la plus faible posologie antalgique efficace doit être privilégiée. Pour le traitement de douleurs d'origine non maligne, une posologie journalière de 40 mg est généralement suffisante ; mais des posologies plus élevées peuvent s'avérer nécessaires. Les patients souffrant de douleurs cancéreuses peuvent avoir besoin de posologies comprises entre 80 et 120 mg, et même jusqu'à 400 mg dans certains cas. Si des posologies encore plus élevées sont nécessaires, la posologie doit être déterminée individuellement en évaluant le rapport entre l'efficacité et la tolérance et le risque d'effets indésirables.
Une adaptation de la posologie n'est habituellement pas nécessaire chez les patients âgés ne présentant pas de manifestation clinique d’altération de la fonction hépatique et/ou rénale.
Les patients à risque, par exemple les patients ayant un faible poids corporel ou présentant un métabolisme lent des médicaments, doivent recevoir la moitié de la posologie initiale recommandée chez l’adulte s’ils sont naïfs aux opioïdes. Par conséquent, la posologie minimale recommandée, soit 10 mg, peut ne pas être appropriée comme posologie initiale.
La titration doit être réalisée conformément à la situation clinique individuelle.
Insuffisants rénaux ou hépatiques
L’initiation du traitement doit suivre une approche conservatrice chez ces patients. La posologie initiale recommandée chez l'adulte doit être réduite de 50 % (par exemple une posologie journalière totale de 10 mg par voie orale chez les patients naïfs aux opioïdes), et chaque patient doit faire l'objet d’une titration permettant un contrôle analgésique adéquat conformément à sa situation clinique.
Population pédiatrique
Enfants de moins 12 ans
L'oxycodone n'a pas été étudié chez l'enfant de moins de 12 ans. La sécurité d’emploi et l'efficacité d’OXYCODONE EG LP n'ont pas été démontrées et son utilisation chez l'enfant de moins de 12 ans n'est par conséquent pas recommandée.
Mode d’administration
Voie orale.
OXYCODONE EG LP doit être pris deux fois par jour selon un protocole établi et à une posologie déterminée.
Les comprimés pelliculés à libération prolongée peuvent être pris pendant ou en dehors des repas avec une quantité suffisante de liquide. OXYCODONE EG LP doit être avalé entier sans être mâché, divisé ou écrasé. Prendre des comprimés mâchés, divisés ou écrasés d’OXYCODONE EG LP peut entraîner la libération et l'absorption rapides d'une quantité potentiellement mortelle d'oxycodone.
OXYCODONE EG LP ne doit pas être pris avec des boissons alcoolisées.
Objectifs et arrêt du traitement
Avant d’instaurer un traitement par OXYCODONE EG LP, une stratégie thérapeutique comprenant la durée et les objectifs du traitement, ainsi qu’un plan d’arrêt du traitement, doivent être convenus avec le patient, conformément aux directives de prise en charge de la douleur. Au cours du traitement, le médecin et le patient doivent s’entretenir régulièrement afin d’évaluer la nécessité de poursuivre le traitement, d’envisager son interruption et d’adapter les doses si nécessaire. Lorsqu’un patient n’a plus besoin d’un traitement à l’oxycodone, il peut être conseillé de diminuer progressivement la dose pour prévenir les symptômes de sevrage. En l’absence d’un contrôle adéquat de la douleur, il convient de réfléchir à la survenue possible d’une hyperalgésie, d’une tolérance et d’une progression de la maladie sous-jacente (voir rubrique 4.4)
Durée du traitement
OXYCODONE EG LP ne doit pas être pris plus longtemps que nécessaire.
· Hypersensibilité à la substance active ou à l’un des excipients mentionnés à la rubrique 6.1 ;
· Dépression respiratoire sévère avec hypoxie et/ou élévation du taux de dioxyde de carbone dans le sang (hypercapnie) ;
· Bronchopneumopathie obstructive chronique sévère ;
· Cœur pulmonaire ;
· Asthme bronchique sévère ;
· Iléus paralytique ;
· Abdomen aigu, retard de la vidange gastrique.
4.4. Mises en garde spéciales et précautions d'emploi
Dépression cardiaque et respiratoire
La dépression respiratoire constitue le risque induit par les opioïdes le plus important et le plus susceptible de se produire chez les patients âgés ou affaiblis. L'effet dépresseur respiratoire de l'oxycodone peut conduire à une augmentation des concentrations de dioxyde de carbone dans le sang et donc dans le liquide céphalo-rachidien. Chez les patients prédisposés, les opioïdes peuvent entraîner une baisse importante de la pression artérielle.
Tolérance et dépendance
L'utilisation prolongée d’OXYCODONE EG LP peut développer une accoutumance au médicament se manifestant par la nécessité d'augmenter les posologies pour maintenir l'effet analgésique souhaité. Il existe une accoutumance croisée aux autres opioïdes. L'utilisation chronique d’OXYCODONE EG LP peut entraîner une dépendance physique. Des symptômes de sevrage peuvent survenir en cas d’interruption brutale du traitement.
Si le traitement par oxycodone n'est plus nécessaire, il est recommandé de réduire progressivement la posologie journalière afin d'éviter l'apparition d'un syndrome de sevrage.
Les symptômes de sevrage peuvent comprendre bâillements, mydriase, larmoiement, rhinorrhée, tremblements, hyperhidrose, anxiété, agitation, convulsions et insomnie.
Une hyperalgésie ne répondant pas à une augmentation supplémentaire de la posologie d'oxycodone peut survenir dans de très rares cas, particulièrement à des posologies élevées. Une réduction de la posologie d'oxycodone ou le passage à un opioïde alternatif peut s'avérer nécessaire.
Trouble d’utilisation d’opioïde (abus et dépendance)
Une accoutumance (tolérance) et une dépendance physique et/ou psychologique peuvent apparaître lors de l’administration répétée d’opioïdes comme l’oxycodone.
L’utilisation répétée d’OXYCODONE EG LP peut conduire à un trouble d’utilisation d’opioïde (TUO). Une dose plus élevée et une durée plus longue du traitement par opioïdes peuvent augmenter le risque de développer un TUO. L’abus ou le mésusage intentionnel d’OXYCODONE EG LP peut entraîner un surdosage et/ou le décès. Le risque de développement d’un TUO est accru chez les patients ayant des antécédents personnels ou familiaux (parents ou fratrie) de troubles d’utilisation d’opioïde (y compris de troubles liés à l’utilisation d’alcool), en cas de tabagisme actif ou chez les patients ayant des antécédents personnels d’autres troubles de la santé mentale (par exemple, dépression majeure, anxiété et troubles de la personnalité).
Les patients devront être surveillés afin de détecter tout signe de comportements de recherche compulsive du produit (par exemple, demande de renouvellement trop précoce de la prescription). Dans ce cadre, les opioïdes et les médicaments psychoactifs (tels que les benzodiazépines) utilisés en concomitance devront être passés en revue. Pour les patients présentant des signes et symptômes de TUO, une consultation auprès d’un addictologue devra être envisagée.
OXYCODONE EG LP a un potentiel de dépendance.
Abus
En cas d'injection parentérale abusive, les excipients du comprimé (notamment le talc) peuvent provoquer une nécrose tissulaire autour du point d’injection, des granulomes pulmonaires ainsi que d'autres événements graves, d’issue potentiellement fatale.
Afin de conserver les propriétés de libération contrôlée des comprimés, les comprimés pelliculés à libération prolongée doivent être avalés entiers, sans être mâchés, divisés ou écrasés. La prise de comprimés pelliculés à libération prolongée mâchés, divisés ou écrasés peut entraîner la libération et l'absorption rapides d'une quantité potentiellement mortelle d'oxycodone (voir rubrique 4.9).
Alcool
La prise concomitante d'alcool et d’OXYCODONE EG LP risque d’accroître les effets indésirables d’OXYCODONE EG LP; leur utilisation concomitante doit donc être évitée.
Risques provenant de l’usage concomitant de médicaments sédatifs tels que les benzodiazépines ou médicaments apparentés.
L’usage concomitant d’oxycodone et de médicaments sédatifs tels que les benzodiazépines ou médicaments apparentés peut résulter en une sédation, une dépression respiratoire, un coma ou la mort. A cause de ces risques, la prescription concomitante de ces médicaments sédatifs doit être réservée à des patients pour lesquels il n’existe pas d’alternative thérapeutique. S’il est décidé de prescrire l’oxycodone concomitamment avec des médicaments sédatifs, la plus faible dose efficace devra être utilisée, et la durée de traitement devra être la plus courte possible.
Les patients devront être suivis pour l’apparition de symptômes de détresse respiratoire et de sédation. A cette fin, il est fortement recommandé d’informer les patients et leurs soignants d’être attentifs à ces symptômes (voir rubrique 4.5)
Groupes de patients particuliers
Il est nécessaire d'agir avec prudence chez les patients âgés ou affaiblis, les patients présentant une insuffisance sévère de la fonction pulmonaire, hépatique ou rénale, un myxœdème, une hypothyroïdie, les patients atteints de la maladie d'Addison (insuffisance surrénalienne), de psychose par intoxication (par ex. alcool), d'hypertrophie prostatique, d'insuffisance adrénocorticale, d'alcoolisme, de dépendance connue aux opioïdes, de delirium tremens, de pancréatite, de maladie des voies biliaires, de colique biliaire ou urétérale, de maladies intestinales inflammatoires, de pathologies impliquant une élévation de la pression intracrânienne, de troubles de la régulation de la circulation sanguine, d'épilepsie ou d'une tendance aux crises convulsives et chez les patients ayant pris des IMAO au cours des deux dernières semaines. Les patients présentant une insuffisance hépatique sévère doivent être surveillés attentivement.
Affections hépatobiliaires
L’oxycodone peut provoquer un dysfonctionnement et des spasmes du sphincter d’Oddi, ce qui accroît le risque de symptômes des voies biliaires et de pancréatite. L’oxycodone doit donc être administrée avec précaution chez les patients atteints de pancréatite et de maladies des voies biliaires.
Procédures chirurgicales
Des précautions particulières sont nécessaires lors de l'administration d'oxycodone à des patients subissant une chirurgie intestinale. Les opioïdes ne doivent être administrés qu'en postopératoire une fois la fonction intestinale rétablie.
La sécurité d’emploi d’OXYCODONE EG LP utilisé en préopératoire n'a pas été établie.
L'utilisation d’OXYCODONE EG LP n'est ni recommandée en préopératoire ni dans les 12 à 24 heures suivant l'intervention.
Population pédiatrique
La sécurité d’emploi et l'efficacité d’OXYCODONE EG LP chez les enfants âgés de moins de 12 ans n'ont pas été établies. L’utilisation d’OXYCODONE EG LP n’est pas recommandée chez les enfants de moins de 12 ans en raison des doutes concernant sa sécurité d’emploi et son efficacité.
Sportifs
L'attention des sportifs est attirée sur le fait que ce médicament peut induire une réaction positive des tests pratiqués lors des contrôles antidopage..
L’utilisation d’OXYCODONE EG LP en tant que produit dopant peut s’avérer dangereuse pour la santé.
Troubles respiratoires liés au sommeil
Les opioïdes peuvent provoquer des troubles respiratoires liés au sommeil, tels que l’apnée du sommeil centrale (ASC) et l’hypoxémie liée au sommeil. L’utilisation d’opioïdes augmente de façon dose-dépendante le risque d’ASC. Chez les patients présentant une ASC, une diminution de la dose totale d’opioïdes doit être envisagée.
Excipient
Ce médicament contient du lactose. Son utilisation est déconseillée chez les patients présentant une intolérance au galactose, un déficit total en lactase ou un syndrome de malabsorption du glucose ou du galactose (maladies héréditaires rares).
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
Les dépresseurs du système nerveux central (par ex. sédatifs, hypnotiques, phénothiazines, neuroleptiques, anesthésiques, antidépresseurs, myorelaxants) et les autres opioïdes ou l'alcool peuvent accentuer les effets indésirables de l'oxycodone, en particulier la dépression respiratoire.
Médicaments sédatifs tels que les benzodiazépines et médicaments apparentés :
L’usage concomitant d’opioïdes et de médicaments sédatifs tels les benzodiazépines ou médicaments apparentés augmente le risque de sédation, dépression respiratoire, coma et mort à cause d’un effet additif de dépression du SNC. La dose et la durée d’utilisation concomitante devra être limitée (voir rubrique 4.4). Médicaments dépresseurs du SNC incluent, mais ne sont pas limités à, autres opioïdes, gabapentinoïdes tels que pregabaline, anxiolytiques, hypnotiques et sédatifs (incluant les benzodiazépines), antipsychotiques, antidépresseurs, phénothiazines et alcool.
Les IMAO sont connus pour interagir avec les analgésiques de type narcotique, produisant une excitation ou une dépression du SNC accompagnée d'une crise hyper- ou hypotensive (voir rubrique 4.4). OXYCODONE EG LP doit être utilisé avec précaution chez les patients recevant des IMAOs ou ayant reçu des IMAO au cours des deux dernières semaines (voir rubrique 4.4).
L'oxycodone est métabolisé principalement par le cytochrome P450 3A4, et minoritairement par le CYP2D6. Ces voies métaboliques peuvent être inhibées ou induites par divers médicaments ou éléments alimentaires susceptibles d’être administrés de façon concomitante. Les médicaments inhibant l'activité de CYP2D6, tels que la paroxétine et la quinidine, peuvent provoquer une baisse de la clairance de l'oxycodone susceptible d’entraîner une augmentation des taux plasmatiques d'oxycodone.
Les inhibiteurs du CYP3A4, tels que les antibiotiques macrolides (par ex. clarithromycine, érythromycine et télithromycine), les antifongiques azolés (par ex. kétoconazole, voriconazole, itraconazole et posaconazole), les inhibiteurs de protéase (par ex. bocéprévir, ritonavir, indinavir, nelfinavir et saquinavir), la cimétidine et le jus de pamplemousse peuvent provoquer une baisse de la clairance de l'oxycodone susceptible d’entraîner une augmentation des taux plasmatiques d'oxycodone. Il peut donc être utile d'ajuster la posologie d'oxycodone en conséquence. Quelques exemples spécifiques sont fournis ci-dessous :
· L'itraconazole, un inhibiteur puissant du CYP3A4, administré à raison de 200 mg par voie orale pendant cinq jours, a augmenté l'ASC de l'oxycodone administré par voie orale. En moyenne, l'ASC était environ 2,4 fois plus élevée (intervalle de 1,5 à 3,4) ;
· Le voriconazole, un inhibiteur du CYP3A4, administré à raison de 200 mg deux fois par jour pendant quatre jours (400 mg donnés pour les deux premières prises), a augmenté l'ASC de l'oxycodone administré par voie orale. En moyenne, l'ASC était environ 3,6 fois plus élevée (intervalle de 2,7 à 5,6) ;
· La télithromycine, un inhibiteur du CYP3A4, administrée à raison de 800 mg par voie orale pendant quatre jours, a augmenté l'ASC de l'oxycodone administré par voie orale. En moyenne, l'ASC était environ 1,8 fois plus élevée (intervalle de 1,3 à 2,3) ;
· Le jus de pamplemousse, un inhibiteur du CYP3A4, administré à raison de 200 ml trois fois par jour pendant cinq jours, a augmenté l'ASC de l'oxycodone administré par voie orale. En moyenne, l'ASC était environ 1,7 fois plus élevée (intervalle de 1,1 à 2,1).
Les inducteurs du CYP3A4, tels que la rifampicine, la carbamazépine, la phénytoïne et le millepertuis peuvent induire le métabolisme de l'oxycodone et provoquer une augmentation de sa clairance entraînant une réduction des taux plasmatiques d'oxycodone. Il peut être utile d'ajuster la posologie d'oxycodone en conséquence. Quelques exemples spécifiques sont fournis ci-dessous :
· Le millepertuis, un inducteur du CYP3A4, administré à raison de 300 mg trois fois par jour pendant quinze jours, a réduit l'ASC de l'oxycodone administré par voie orale. En moyenne, l'ASC était réduite d’environ 50 % (intervalle de 37 à 57 %) ;
· La rifampicine, un inducteur du CYP3A4, administré à raison de 600 mg une fois par jour pendant sept jours, a réduit l'ASC de l'oxycodone administré par voie orale. En moyenne, l'ASC était réduite d'environ 86 %.
L'effet d'autres inhibiteurs d'isoenzymes pertinents sur le métabolisme de l'oxycodone n'est pas connu. Les interactions éventuelles doivent être prises en compte.
Des modifications cliniquement pertinentes du rapport international normalisé (INR) ont été observées dans les deux sens chez des individus ayant reçu de façon concomitante des anticoagulants coumariniques et de l'oxycodone.
Il n'existe pas d'études explorant l'effet de l'oxycodone sur le métabolisme d'autres médicaments catalysés par le CYP.
L'alcool peut accentuer les effets pharmacodynamiques d’OXYCODONE EG LP; son utilisation concomitante doit être évitée.
4.6. Fertilité, grossesse et allaitement
L'utilisation de ce médicament doit être évitée dans la mesure du possible chez les patientes enceintes ou qui allaitent.
Grossesse
Les données sur l'utilisation de l'oxycodone chez la femme enceinte sont limitées. Les nourrissons nés de mères ayant reçu des opioïdes au cours des 3 à 4 dernières semaines avant l'accouchement doivent être surveillés en raison d’une éventuelle dépression respiratoire. Des symptômes de sevrage peuvent être observés chez les nouveau-nés de mères sous traitement par oxycodone.
Allaitement
L'oxycodone peut être excrété dans le lait maternel et peut entraîner une dépression respiratoire chez le nouveau-né. Par conséquent, l'oxycodone ne doit pas être utilisé pendant l’allaitement.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
Lorsque le traitement est stable, une interdiction totale de conduire des véhicules n'est pas nécessaire. Dans ces circonstances, le chlorhydrate d'oxycodone a une influence mineure sur l'aptitude à conduire des véhicules et à utiliser des machines.
Le médecin traitant doit évaluer la situation individuelle.
Résumé du profil de sécurité
L'oxycodone peut provoquer une dépression respiratoire, un myosis, des spasmes bronchiques et des spasmes des muscles lisses et peut supprimer le réflexe de toux.
Les effets indésirables considérés comme étant au moins potentiellement liés au traitement sont énumérés par classe de systèmes d'organes et par fréquence absolue. Les fréquences sont définies comme suit :
Très fréquent (≥ 1/10)
Fréquent (≥ 1/100 à < 1/10)
Peu fréquent (≥ 1/1000 à < 1/100)
Rare (≥ 1/10 000 à < 1/1000)
Très rare (< 1/10 000)
Fréquence indéterminée (ne peut être estimée à partir des données disponibles).
|
|
Très fréquent |
Fréquent |
Peu fréquent |
Rare |
Très rare |
Fréquence indéterminée |
|
Troubles hématologiques et du système lymphatique |
|
|
|
Lympha-dénopathie |
|
|
|
Troubles du système immunitaire |
|
|
Hypersensibilité |
|
|
Réactions anaphylactiques |
|
Troubles endocriniens |
|
|
Syndrome de sécrétion inappropriée d'hormone antidiurétique |
|
|
|
|
Troubles du métabolisme et de la nutrition |
|
Anorexie ; baisse de l'appétit |
Déshydratation |
|
|
|
|
Troubles psychiatriques |
|
Divers effets indésirables psychologiques notamment des changements d'humeur (par ex. anxiété, dépression) ; modifications de l'activité (principalement une suppression parfois associée à une léthargie, occasionnellement une augmentation accompagnée de nervosité et d'insomnie) et des modifications des performances cognitives (pensée anormale, confusion, cas isolés de troubles du langage) |
Modifications de la perception telle que dépersonnalisation ; hallucinations ; labilité altérée ; hyperacousie ; humeur euphorique ; agitation ; baisse de la libido ; dépendance médicamenteuse (voir rubrique 4.4) |
|
|
Agressivité |
|
Troubles du système nerveux |
Somnolence ; vertiges ; céphalées |
Asthénie ; tremblements |
Tonus musculaire plus élevé ou plus faible ; amnésie ; convulsions ; hypertonie ; contractions musculaires involontaires ; hypoesthésie ; troubles du langage ; syncope ; paresthésie ; dysgueusie ; troubles de la coordination |
Crises d'épilepsie, notamment chez les patients épileptiques ou les patients ayant une tendance aux convulsions ; spasmes musculaires |
|
Hyperalgésie |
|
Troubles oculaires |
|
|
Trouble du larmoiement ; altération de la vision ; myosis |
|
|
|
|
Troubles de l'oreille et du labyrinthe |
|
|
Vertiges, acouphènes |
|
|
|
|
Troubles cardiaques |
|
|
Tachycardie supraventriculaire, palpitations (dans un contexte de syndrome de sevrage) |
|
|
|
|
Troubles vasculaires |
|
|
Vasodilatation |
Hypotension ; hypotension orthostatique. |
|
|
|
Troubles respiratoires, thoraciques et médiastinaux |
|
Dyspnée, bronchospasme |
Dépression respiratoire ; augmentation de la toux ; pharyngite ; rhinite ; modifications de la voix |
|
|
Syndrome d’apnée du sommeil centrale |
|
Troubles gastro-intestinaux |
Constipation ; nausées ; vomissements |
Sécheresse buccale, accompagnée dans de rares cas de soif et d’une difficulté à avaler ; affections gastro-intestinales telles que douleurs abdominales ; diarrhée ; dyspepsie |
Ulcères de la bouche ; gingivite ; stomatite ; flatulence ; éructation ; dysphagie ; iléus |
Saignement des gencives ; augmentation de l'appétit ; selles noires ; tâches et atteintes dentaires |
|
Caries dentaires |
|
Troubles hépatobiliaires |
|
|
Augmentation des enzymes hépatiques |
|
|
Cholestase ; colique biliaire ; dysfonctionnement du sphincter d'Oddi |
|
Affections de la peau et du tissu sous-cutané |
Prurit |
Éruptions cutanées notamment rougeurs ; hyperhidrose ; dans de rares cas, augmentation de la photosensibilité ; cas isolés d'urticaire ou de dermatite exfoliante |
Sécheresse cutanée |
Herpès, urticaire |
|
|
|
Troubles du rein et des voies urinaires |
|
Troubles de la miction (augmentation de l'envie d'uriner) |
Rétention urinaire |
|
|
|
|
Troubles des organes de reproduction et du sein |
|
|
Dysfonction érectile, impuissance |
|
|
Aménorrhée |
|
Troubles généraux et anomalies au site d'administration |
|
Asthénie |
Blessures accidentelles ; douleurs (par ex. douleurs dans la poitrine) ; malaise ; œdème ; œdème périphérique ; migraine ; dépendance physique avec symptômes de sevrage ; accoutumance au médicament ; réactions allergiques ; frissons ; soif. |
Variations du poids (augmentation ou baisse) ; cellulite |
|
|
Description d’effets indésirables sélectionnés
Pharmacodépendance
L’utilisation répétée d’OXYCODONE EG LP peut entraîner une pharmacodépendance, même à des doses thérapeutiques. Le risque de pharmacodépendance peut varier en fonction des facteurs de risque individuels du patient, de la posologie et de la durée du traitement opioïde (voir rubrique 4.4).
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr/.
Symptômes et intoxication :
Les signes d'un surdosage en oxycodone sont : un myosis, une dépression respiratoire, une somnolence, une réduction du tonus des muscles squelettiques et une hypotension. Dans des cas graves, un collapsus circulatoire, une stupeur, un coma, une bradycardie et un œdème pulmonaire non cardiogénique peuvent survenir ; l'abus de posologies élevées d'opioïdes puissants tels que l'oxycodone peut s'avérer mortel. Une leucoencéphalopathie toxique a été observée en cas de surdosage d’oxycodone.
Traitement des intoxications :
L'attention principale doit porter sur la mise en place d'une voie respiratoire dégagée et l'instauration d'une ventilation assistée ou contrôlée.
En cas de surdosage, l'administration intraveineuse d'un antagoniste des opioïdes (par ex. 0,4 à 2 mg de naloxone par voie intraveineuse) peut être recommandée. L'administration de doses uniques doit être répétée à intervalles de 2 à 3 minutes selon la situation clinique. La perfusion intraveineuse de 2 mg de naloxone dans 500 ml de solution physiologique ou de solution de dextrose à 5 % (correspondant à 0,004 mg/ml de naloxone) est possible. La vitesse de perfusion doit être adaptée en fonction des précédentes injections en bolus et de la réponse du patient.
La naloxone ne doit pas être administrée en l'absence de dépression respiratoire ou circulatoire cliniquement significative secondaire à un surdosage en oxycodone. La naloxone doit être administrée avec précaution aux patients connus ou suspectés d'être physiquement dépendants de l'oxycodone. Dans ce cas, une réversion brutale ou totale des effets opioïdes peut provoquer des douleurs et un syndrome de sevrage aigu.
Un lavage gastrique peut alors être envisagé. Administrer le charbon activé (50 g chez l'adulte, 10 à 15 g chez l'enfant) si une quantité importante a été ingérée en 1 heure, à condition que les voies respiratoires soient protégées. On peut supposer que l'administration tardive de charbon activé est bénéfique pour les préparations à libération prolongée ; cependant, ceci n'est étayé par aucune preuve.
Afin d'accélérer le transit, un laxatif approprié (par ex. une solution à base de PEG) peut s'avérer utile.
Si nécessaire, des mesures complémentaires (respiration artificielle, apport d'oxygène, administration de vasopresseurs et traitement par perfusion) doivent être mises en place dans le traitement du choc circulatoire associé. En cas d'arrêt ou d'arythmie cardiaque, un massage ou une défibrillation cardiaque peuvent être indiqués. Une ventilation assistée ainsi que le maintien de l'équilibre hydroélectrolytique peuvent être nécessaires.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Mécanisme d’action
L'oxycodone présente une affinité pour les récepteurs opioïdes kappa, mu et delta dans le cerveau et le rachis. Il agit au niveau de ces récepteurs en qualité d'agoniste opioïde sans effet antagoniste. L'effet thérapeutique est principalement analgésique et sédatif. Par rapport à l'oxycodone à libération rapide, les comprimés à libération prolongée, administrés seuls ou en association avec d'autres substances, offrent un soulagement de la douleur d’une durée sensiblement plus longue, sans augmenter l'apparition d'effets indésirables.
Autres effets pharmacologiques
Les études in vitro et chez l'animal indiquent divers effets des opioïdes naturels tels que la morphine, sur les composants du système immunitaire ; la signification clinique de ces données n'est pas connue.
On ne sait pas si l'oxycodone, un opioïde semi-synthétique, a des effets immunologiques similaires à ceux de la morphine.
5.2. Propriétés pharmacocinétiques
La biodisponibilité relative de l’oxycodone à libération prolongée est comparable à celle de l'oxycodone à libération rapide avec une concentration plasmatique maximale obtenue environ 3 heures après la prise des comprimés à libération prolongée par rapport à 1 à 1,5 heures. Les pics de taux plasmatiques et les variations de concentrations d'oxycodone des formulations à libération prolongée et à libération rapide sont comparables lorsqu'elles sont administrées à la même posologie journalière à des intervalles respectivement de 12 et 6 heures.
Les comprimés ne doivent pas être mâchés, divisés ou écrasés car cela peut entraîner la libération et l'absorption rapides d'une quantité potentiellement mortelle d'oxycodone en raison de la destruction des propriétés de libération prolongée.
Distribution
La biodisponibilité absolue de l'oxycodone est environ égale aux deux-tiers de celle observée par administration parentérale. A l'état d'équilibre, le volume de distribution de l’oxycodone est de 2,6 l/kg ; la liaison aux protéines plasmatiques est de 38 à 45 % ; la demi-vie d'élimination varie de 4 à 6 heures et la clairance plasmatique est de 0,8 l/min. La demi-vie d'élimination de l'oxycodone contenu dans les comprimés à libération prolongée varie de 4 à 5 heures et l'état d'équilibre est obtenu en moyenne au bout d'un jour.
Biotransformation
L'oxycodone est métabolisé dans l'intestin et dans le foie, via le système enzymatique du cytochrome P450, en noroxycodone et oxymorphone ainsi qu'en plusieurs conjugués glucuronides. Les études in vitro suggèrent que les doses thérapeutiques de cimétidine n'ont probablement aucun effet significatif sur la formation de noroxycodone. Chez l'homme, la quinidine réduit la production d'oxymorphone bien que les propriétés pharmacodynamiques de l'oxycodone n’en soient pas affectées. La contribution des métabolites à l'effet pharmacodynamique global n'est pas significative.
Élimination
L'oxycodone et ses métabolites sont excrétés via l'urine et les fèces. L'oxycodone traverse le placenta et peut être détecté dans le lait maternel.
Linéarité/non-linéarité
Pour l’intervalle des doses des comprimés d'oxycodone à libération prolongée compris entre 5 et 80 mg, la linéarité des concentrations plasmatiques a été démontrée en termes de rapidité et de degré d'absorption.
5.3. Données de sécurité préclinique
Aucune étude de cancérogenèse à long terme n'a été réalisée.
Les tests in vitro montrent que l'oxycodone est potentiellement clastogène. Cependant, aucun effet similaire n'a été observé dans des conditions in vivo, même à des doses toxiques. Les résultats indiquent que le risque mutagène de l'oxycodone aux concentrations thérapeutiques utilisées chez l'homme peut être exclu avec une certaine assurance.
Lactose monohydraté, copolymère d’ammonio méthacrylate (type B), povidone (K29/32), talc, triacétine, alcool stéarylique, stéarate de magnésium.
Pelliculage :
Hypromellose, talc, macrogol 400, dioxyde de titane (E171), oxyde de fer rouge (E172).
3 ans.
6.4. Précautions particulières de conservation
Ce médicament ne nécessite pas de précautions particulières de conservation.
6.5. Nature et contenu de l'emballage extérieur
Boîtes de 10*1, 14*1, 20*1, 25*1, 28*1, 30*1, 40*1, 50*1, 56*1, 60*1, 98*1 et 100*1 comprimés pelliculés à libération prolongée sous plaquettes prédécoupées unitaires (PVC/PVDC/Aluminium) avec sécurité enfant.
Toutes les présentations peuvent ne pas être commercialisées.
6.6. Précautions particulières d’élimination et de manipulation
Pas d’exigences particulières.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
EG LABO – Laboratoires EuroGenerics
central park
9-15 rue Maurice mallet
92130 issy-les-moulineaux
FRANCE
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· 34009 277 546 1 6 : 10*1 comprimés pelliculés à libération prolongée sous plaquettes prédécoupées unitaires (PVC/PVDC/Aluminium).
· 34009 277 547 8 4 : 14*1 comprimés pelliculés à libération prolongée sous plaquettes prédécoupées unitaires (PVC/PVDC/Aluminium).
· 34009 277 548 4 5 : 20*1 comprimés pelliculés à libération prolongée sous plaquettes prédécoupées unitaires (PVC/PVDC/Aluminium).
· 34009 277 549 0 6 : 25*1 comprimés pelliculés à libération prolongée sous plaquettes prédécoupées unitaires (PVC/PVDC/Aluminium).
· 34009 277 550 9 5 : 28*1 comprimés pelliculés à libération prolongée sous plaquettes prédécoupées unitaires (PVC/PVDC/Aluminium).
· 34009 277 551 5 6 : 30*1 comprimés pelliculés à libération prolongée sous plaquettes prédécoupées unitaires (PVC/PVDC/Aluminium).
· 34009 277 552 1 7 : 40*1 comprimés pelliculés à libération prolongée sous plaquettes prédécoupées unitaires (PVC/PVDC/Aluminium).
· 34009 277 553 8 5 : 50*1 comprimés pelliculés à libération prolongée sous plaquettes prédécoupées unitaires (PVC/PVDC/Aluminium).
· 34009 277 554 4 6 : 56*1 comprimés pelliculés à libération prolongée sous plaquettes prédécoupées unitaires (PVC/PVDC/Aluminium).
· 34009 277 555 0 7 : 60*1 comprimés pelliculés à libération prolongée sous plaquettes prédécoupées unitaires (PVC/PVDC/Aluminium).
· 34009 277 556 7 5 : 98*1 comprimés pelliculés à libération prolongée sous plaquettes prédécoupées unitaires (PVC/PVDC/Aluminium).
· 34009 277 557 3 6 : 100*1 comprimés pelliculés à libération prolongée sous plaquettes prédécoupées unitaires (PVC/PVDC/Aluminium).
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
[à compléter ultérieurement par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE
[à compléter ultérieurement par le titulaire]
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Stupéfiant: prescription limitée à 28 jours.
Prescription sur ordonnance répondant aux spécifications fixées par l'arrêté du 31 mars 1999.
ANSM - Mis à jour le : 19/03/2025
OXYCODONE EG LP 20 mg, comprimé pelliculé à libération prolongée
Chlorhydrate d'oxycodone
· Gardez cette notice. Vous pourriez avoir besoin de la relire.
· Si vous avez d’autres questions, interrogez votre médecin ou votre pharmacien.
· Ce médicament vous a été personnellement prescrit. Ne le donnez pas à d’autres personnes. Il pourrait leur être nocif, même si les signes de leur maladie sont identiques aux vôtres.
· Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
1. Qu'est-ce que OXYCODONE EG LP 20 mg, comprimé pelliculé à libération prolongée et dans quels cas est-il utilisé ?
2. Quelles sont les informations à connaître avant de prendre OXYCODONE EG LP 20 mg, comprimé pelliculé à libération prolongée ?
3. Comment prendre OXYCODONE EG LP 20 mg, comprimé pelliculé à libération prolongée ?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver OXYCODONE EG LP 20 mg, comprimé pelliculé à libération prolongée ?
6. Contenu de l’emballage et autres informations.
1. QU’EST-CE QUE OXYCODONE EG LP 20 mg, comprimé pelliculé à libération prolongée ET DANS QUELS CAS EST-IL UTILISE ?
Classe pharmacothérapeutique - code ATC : N02A A05
OXYCODONE EG LP (chlorhydrate d'oxycodone) est un traitement de la douleur puissant à action centrale, du groupe des opioïdes.
OXYCODONE EG LP est utilisé pour traiter les douleurs sévères qui ne peuvent être correctement soulagées que par des analgésiques opioïdes
OXYCODONE EG LP est indiqué chez les adultes et les adolescents de 12 ans et plus.
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT DE PRENDRE OXYCODONE EG LP 20 mg, comprimé pelliculé à libération prolongée ?
Ne prenez jamais OXYCODONE EG LP 20 mg, comprimé pelliculé à libération prolongée
· si vous êtes allergique au chlorhydrate d'oxycodone ou à l’un des autres composants contenus dans ce médicament (mentionnés dans la rubrique 6) ;
· si vous souffrez d’une insuffisance respiratoire sévère (dépression respiratoire) avec trop peu d’oxygène dans votre sang (hypoxie) et/ou trop de dioxyde de carbone dans votre sang (hypercapnie) ;
· si vous souffrez d’une insuffisance pulmonaire chronique sévère, de cœur pulmonaire (modifications cardiaques dues à une surcharge chronique de la circulation pulmonaire) ou d'asthme bronchique aigu et sévère ;
· si vous présentez des dysfonctionnements intestinaux avec occlusion intestinale (iléus paralytique) ;
· si vous présentez un abdomen aigu ou souffrez d’une vidange gastrique ralentie.
Avertissements et précautions
Adressez-vous à votre médecin ou pharmacien avant de prendre OXYCODONE EG LP
· si vous êtes âgé(e) ou fragilisé(e) ;
· si vous souffrez d'une insuffisance pulmonaire, hépatique ou rénale ;
· si vous souffrez de myxœdème (certaines maladies de la glande thyroïde) ou d'une altération de la fonction thyroïdienne ;
· si vous souffrez d'insuffisance des glandes surrénales (maladie d'Addison) ;
· si vous souffrez d'une augmentation du volume de la prostate (hypertrophie de la prostate) ;
· si vous souffrez d'affections intestinales inflammatoires ;
· si vous souffrez d'une inflammation du pancréas (pancréatite) ;
· si vous présentez une affection associée à une augmentation de la pression cérébrale ;
· si vous souffrez de troubles de la régulation de la circulation ;
· si vous souffrez de colique biliaire et néphrétique ;
· si vous souffrez d'épilepsie ou d'une tendance aux crises d'épilepsie ;
· si vous prenez des inhibiteurs de la monoamine oxydase ou IMAO (pour le traitement de la dépression).
Adressez-vous à votre médecin si l'une ou l'autre de ces affections vous concerne ou vous a concerné par le passé.
Contactez votre médecin si vous ressentez de fortes douleurs abdominales supérieures pouvant irradier vers le dos, des nausées, des vomissements ou de la fièvre, car il pourrait s’agir de symptômes liés à l’inflammation du pancréas (pancréatite) et des voies biliaires.L’utilisation de ce médicament est déconseillée chez les patients présentant une intolérance au galactose, un déficit en lactase de Lapp ou un syndrome de malabsorption du glucose ou du galactose (maladies héréditaires rares).
Tolérance, dépendance et addiction
Ce médicament contient de l’oxycodone qui est un médicament opioïde. Il peut entraîner une dépendance et/ou une addiction.
OXYCODONE EG LP peut induire une dépendance primaire. Lorsqu'il est utilisé pendant longtemps, une tolérance aux effets peut s'installer et des posologies progressivement plus élevées peuvent être nécessaires pour continuer à soulager la douleur.
L'utilisation chronique d’OXYCODONE EG LP peut entraîner une dépendance physique et un syndrome de sevrage peut apparaître si l'arrêt du traitement est soudain. Lorsqu'un patient n'a plus besoin de traitement par chlorhydrate d'oxycodone, il est conseillé de réduire progressivement la posologie afin d'éviter les symptômes de sevrage.
Ce médicament contient de l’oxycodone qui est un médicament opioïde. L’utilisation répétée d’analgésiques opioïdes peut entraîner une diminution de l’efficacité du médicament (vous vous y habituez, ce que l’on appelle la tolérance). L’utilisation répétée d’OXYCODONE EG LP peut entraîner une dépendance, un abus et une addiction, ce qui peut conduire à un surdosage potentiellement mortel.
Le risque de devenir dépendant(e) ou addict(e) varie d’une personne à l’autre. Vous risquez davantage de devenir dépendant(e) ou addict(e) à OXYCODONE EG LP si :
· si vous ou une personne de votre famille avez déjà consommé de façon abusive ou été dépendant(e) à l’alcool, à des médicaments sur ordonnance ou à des substances illicites (« addiction ») ;
· si vous fumez ;
· si vous avez déjà présenté des troubles de l’humeur (dépression, anxiété ou trouble de la personnalité) ou si vous avez été suivi(e) par un psychiatre pour d’autres troubles de la santé mentale ;
Si vous remarquez l’un des signes suivants pendant que vous prenez OXYCODONE EG LP, cela peut être le signe que vous êtes devenu(e) dépendant(e) ou addict(e).
· Vous avez besoin de prendre le médicament pendant une durée plus longue que celle indiquée par votre médecin.
· Vous avez besoin de prendre plus que la dose recommandée.
· Vous utilisez le médicament pour des raisons autres que celles prescrites, par exemple pour rester calme ou pour vous aider à dormir.
· Vous avez tenté à plusieurs reprises, sans succès, d’arrêter d’utiliser le médicament ou d’en contrôler son utilisation.
· Lorsque vous arrêtez de prendre le médicament, vous vous sentez mal, et vous vous sentez mieux lorsque vous reprenez le médicament (« effets de sevrage »).
Si vous remarquez l’un de ces signes, parlez-en à votre médecin pour discuter de la meilleure approche de traitement pour vous, y compris le moment approprié pour arrêter et la façon d’arrêter en toute sécurité (voir rubrique 3, Si vous arrêtez de prendre OXYCODONE EG LP).
OXYCODONE EG LP est à prendre par voie orale uniquement. En cas d'injection abusive (injection dans une veine), les excipients des comprimés (notamment le talc) peuvent entraîner la destruction (nécrose) du tissu local, des modifications du tissu pulmonaire (granulomes pulmonaires) ou d'autres événements graves potentiellement mortels.
Sportifs
L’attention des sportifs est attirée sur le fait que ce médicament peut induire une réaction positive des tests pratiqués lors des contrôles antidopage.
L'utilisation d’OXYCODONE EG LP comme agent de dopage peut s’avérer dangereuse pour la santé.
Troubles respiratoires liés au sommeil
OXYCODONE EG LP peut provoquer des troubles respiratoires liés au sommeil, tels que l’apnée du sommeil (pauses respiratoires pendant le sommeil) et l’hypoxémie liée au sommeil (faible taux d’oxygène dans le sang). Les symptômes associés peuvent inclure des pauses respiratoires pendant le sommeil, des réveils nocturnes dus à un essoufflement, des difficultés à rester endormi(e) ou une somnolence excessive pendant la journée. Si vous ou une personne de votre entourage remarquez ces symptômes, contactez votre médecin. Une réduction de la dose pourra être envisagée par votre médecin.
Enfants et adolescents
OXYCODONE EG LP n'a pas été étudié chez l'enfant de moins de 12 ans. Sa sécurité d’emploi et son efficacité n'ont pas été établies si bien que son utilisation chez l'enfant de moins de 12 ans n'est pas recommandée.
Autres médicaments et OXYCODONE EG LP 20 mg, comprimé pelliculé à libération prolongée
Informez votre médecin ou pharmacien si vous prenez, avez récemment pris ou pourriez prendre tout autre médicament. Si vous prenez ces comprimés avec d'autres médicaments, l'effet de ces comprimés ou de l'autre médicament peut être modifié.
Les comprimés ne doivent pas être utilisés de manière concomitante avec un inhibiteur de la monoamine oxydase, ou si vous avez pris ce type de médicament au cours des deux dernières semaines (voir rubrique 2 « Ne prenez jamais OXYCODONE EG LP 20 mg, comprimé pelliculé à libération prolongée »).
Informez votre médecin ou pharmacien si vous prenez :
· des médicaments pour vous aider à dormir ou à rester calme (par exemple, des tranquillisants, des hypnotiques ou des sédatifs) ;
· des médicaments pour traiter la dépression (par exemple la paroxétine) ;
· des médicaments pour traiter des troubles psychiatriques ou mentaux (tels que les phénothiazines ou les neuroleptiques) ;
· des médicaments pour traiter l’épilepsie, la douleur et l’anxiété tels que gabapentine et pregabaline ;
· d'autres analgésiques puissants (médicaments « antidouleur ») ;
· des relaxants musculaires ;
· de la quinidine (un médicament utilisé en cas de rythme cardiaque trop rapide) ;
· de la cimétidine (un médicament pour les ulcères de l'estomac, l’indigestion ou les brûlures d'estomac) ;
· des médicaments pour traiter les infections fongiques (tels que le kétoconazole, le voriconazole, l'itraconazole ou le posaconazole) ;
· des médicaments utilisés pour traiter les infections (tels que la clarithromycine, l'érythromycine ou la télithromycine) ;
· une famille particulière de médicaments appelés inhibiteurs de protéases utilisés pour traiter le VIH (tels que le bocéprévir, le ritonavir, l'indinavir, le nelfinavir ou le saquinavir) ;
· de la rifampicine pour le traitement de la tuberculose ;
· de la carbamazépine (un médicament utilisé dans le traitement des crises d'épilepsie, d'attaques ou de convulsions et certaines affections douloureuses) ;
· de la phénytoïne (un médicament utilisé dans le traitement des crises d'épilepsie, d'attaques ou de convulsions) ;
· un médicament à base de plantes, appelé millepertuis (également connu sous le nom d'Hypericum perforatum).
Informez également votre médecin si vous avez récemment reçu un anesthésique.
L’usage concomitant d’OXYCODONE EG et de médicaments sédatifs tels que les benzodiazépines ou médicaments apparentés augmente les risques de somnolence, de difficultés à respirer (dépression respiratoire), de coma et de mort. A cause de ces risques, l’utilisation concomitante de ces médicaments devrait être considérée uniquement lorsqu’il n’y a pas d’autre possibilité de traitement.
Si votre médecin prescrit OXYCODONE EG avec des médicaments sédatifs la dose et la durée du traitement concomitant devra être limitée par votre médecin.
Informez votre médecin de tout médicament sédatif que vous prenez, et suivez rigoureusement ses recommandations de dosage. Il est recommandé d’informer des amis ou des proches d’être vigilants à l’apparition des symptômes décrits ci-dessus. Contactez votre médecin si vous présentez de tels symptômes.
OXYCODONE EG LP 20 mg, comprimé pelliculé à libération prolongée avec des aliments, boissons et de l’alcool
La consommation d'alcool pendant le traitement par OXYCODONE EG LP peut augmenter l'envie de dormir ou le risque d'effets secondaires graves tels qu'une respiration superficielle avec un risque d'arrêt respiratoire et de perte de conscience. Il est recommandé de ne pas boire d'alcool pendant le traitement par OXYCODONE EG LP.
Vous devez éviter de boire du jus de pamplemousse pendant le traitement par OXYCODONE EG LP.
Si vous êtes enceinte ou que vous allaitez, si vous pensez être enceinte ou planifiez une grossesse, demandez conseil à votre médecin ou pharmacien avant de prendre ce médicament.
Grossesse
OXYCODONE EG LP ne doit pas être utilisé pendant la grossesse à moins que cela ne soit nécessaire. Les données sur l'utilisation de l'oxycodone chez la femme enceinte sont limitées.
L'oxycodone traverse le placenta et passe dans la circulation sanguine de l'enfant.
L'utilisation prolongée d'oxycodone pendant la grossesse peut entraîner des symptômes de sevrage chez le nouveau-né. L'utilisation d'oxycodone durant l'accouchement peut provoquer une dépression respiratoire chez le nouveau-né.
Allaitement
Vous ne devez pas prendre OXYCODONE EG LP lorsque vous allaitez car l'oxycodone passe dans le lait maternel.
Conduite de véhicules et utilisation de machines
Le chlorhydrate d’oxycodone altère la vigilance et la réactivité de telle manière que l'aptitude à conduire des véhicules et à utiliser des machines en serait affectée voire complètement défaillante.
Pour consulter les effets indésirables éventuels affectant les compétences motrices et la concentration, voir la rubrique 4.
Lorsque le traitement est stable, une interdiction totale de conduire des véhicules n'est pas nécessaire. Le médecin traitant doit évaluer la situation individuelle.
Veuillez voir avec votre médecin si, ou dans quelles conditions, vous pouvez conduire un véhicule.
OXYCODONE EG LP 20 mg, comprimé pelliculé à libération prolongée contient du lactose
Si votre médecin vous a informé(e) d’une intolérance à certains sucres, contactez-le avant de prendre ce médicament.
3. COMMENT PRENDRE OXYCODONE EG LP 20 mg, comprimé pelliculé à libération prolongée ?
La posologie recommandée est de :
Adultes et adolescents (de 12 ans et plus)
La posologie initiale recommandée est de 10 mg de chlorhydrate d'oxycodone administrés à 12 heures d'intervalle. Cependant, votre médecin vous prescrira la posologie nécessaire pour traiter la douleur.
Les patients ayant déjà pris des opioïdes peuvent commencer le traitement avec des posologies plus élevées compte tenu de leur expérience préalable des traitements par opioïdes.
Pour le traitement de douleurs d'origine non maligne, une posologie journalière de 40 mg de chlorhydrate d'oxycodone est généralement suffisante, mais des posologies plus importantes peuvent s'avérer nécessaires.
Les patients souffrant de douleurs cancéreuses ont généralement besoin de posologies allant de 80 à 120 mg de chlorhydrate d'oxycodone, et même jusqu'à 400 mg dans certains cas.
Pour les posologies non réalisables/praticables avec ce dosage, d'autres dosages de ce médicament sont disponibles.
Patients à risque
Si vous souffrez d'une insuffisance de la fonction rénale et/ou hépatique ou si votre poids corporel est faible, votre médecin peut vous prescrire une posologie initiale plus faible.
Utilisation chez les enfants et les adolescents
OXYCODONE EG LP n'est pas recommandé chez les enfants de moins de 12 ans.
Mode d’administration
Avaler le comprimé pelliculé à libération prolongée entier avec une quantité de liquide suffisante (½ verre d'eau), pendant ou en dehors des repas, matin et soir à horaires fixes (par ex. 8h00 et 20h00).
Les comprimés pelliculés à libération prolongée doivent être avalés entiers, sans être mâchés, divisés ou écrasés, ce qui entraînerait la libération rapide de l'oxycodone en raison de l'altération des propriétés de libération prolongée des comprimés. La prise de comprimés pelliculés à libération prolongée mâchés, divisés ou écrasés entraîne la libération et l'absorption rapides d'une quantité potentiellement mortelle d'oxycodone. (Voir la rubrique « Si vous avez pris plus de OXYCODONE EG LP 20 mg, comprimé pelliculé à libération prolongée que vous n'auriez dû »).
Les comprimés pelliculés à libération prolongée peuvent être pris pendant ou en dehors des repas avec une quantité suffisante de liquide.
OXYCODONE EG LP ne doit pas être pris avec des boissons alcoolisées.
Instructions d'ouverture :
Ce médicament est fourni dans un emballage muni d'une sécurité pour enfants. Les comprimés pelliculés à libération prolongée ne peuvent pas être sortis de la plaquette par pression. Veuillez respecter les instructions suivantes pour ouvrir la plaquette.
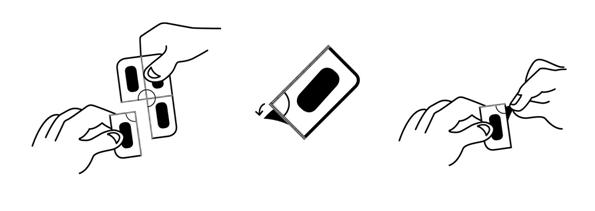
1. Détacher une seule dose en déchirant le long de la ligne perforée de la plaquette.
2. Une zone non scellée est alors exposée/atteignable ; cette zone se situe à l'endroit où les lignes perforées se rencontrent.
3. A l'endroit où le rabat n'est pas scellé, peler la couverture d'aluminium pour la retirer de la feuille d'aluminium sous-jacente.
La détermination de la posologie journalière, la répartition de la posologie par prise et tout ajustement de la posologie au cours de la poursuite du traitement sont décidés par le médecin traitant et dépendent de la posologie précédente.
Certains patients recevant OXYCODONE EG LP suivant un protocole établi ont besoin d'analgésiques à action rapide comme médicament de secours pour contrôler une douleur paroxystique. OXYCODONE EG LP n'est pas destiné au traitement de douleurs paroxystiques.
Le traitement doit être contrôlé régulièrement quant au soulagement de la douleur et d’autres effets afin d'obtenir une analgésie adéquate avec des effets secondaires supportables aussi longtemps que le traitement antalgique est nécessaire.
Si vous avez pris plus d’OXYCODONE EG LP 20 mg, comprimé pelliculé à libération prolongée que vous n’auriez dû :
Si vous avez pris plus d’OXYCODONE EG LP que ce qui vous a été prescrit, vous devez en informer votre médecin ou votre centre local antipoison immédiatement. Les symptômes suivants pourraient survenir : pupilles contractées (myosis), dépression respiratoire, somnolence, réduction du tonus des muscles squelettiques et hypotension. Dans des cas graves, un collapsus circulatoire, une inactivité mentale et motrice (stupeur), un état inconscient (coma), une baisse de la fréquence cardiaque et une accumulation d'eau dans les poumons (œdème pulmonaire non cardiogénique) peuvent survenir ; l'abus de posologies élevées d'opioïdes puissants tels que l'oxycodone peut s'avérer mortel. Vous ne devez en aucun cas vous exposer à des situations exigeant un haut degré de concentration, comme par exemple conduire une voiture.
Si vous oubliez de prendre OXYCODONE EG LP 20 mg, comprimé pelliculé à libération prolongée :
Si vous utilisez une dose plus faible d’OXYCODONE EG LP que ce qui vous a été prescrit ou si vous omettez de prendre une dose, le soulagement de la douleur sera insuffisant ou cessera complètement.
Vous pouvez compenser la dose oubliée si l'intervalle jusqu'à la prise suivante est supérieur à 8 heures. Vous pouvez alors continuer à prendre le médicament comme indiqué.
Vous devez aussi prendre ce médicament si l'intervalle jusqu'à la prise suivante est plus court à condition de retarder la prise suivante de 8 heures. En principe, vous ne devez pas prendre OXYCODONE EG LP plus d'une fois toutes les 8 heures
Ne prenez pas de dose double pour compenser la dose que vous avez oublié de prendre.
Si vous arrêtez de prendre OXYCODONE EG LP 20 mg, comprimé pelliculé à libération prolongée :
N'arrêtez pas votre traitement sans en informer votre médecin.
Lorsqu'un patient n'a plus besoin du traitement par OXYCODONE EG LP, il est conseillé de réduire progressivement la posologie afin d'éviter les symptômes de sevrage.
Si vous avez d’autres questions sur l'utilisation de ce médicament, demandez plus d'informations à votre médecin ou à votre pharmacien.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
Effets indésirables ou signes significatifs à prendre en compte et mesures à prendre lorsque ces effets indésirables ou ces signes apparaissent :
Si vous ressentez l’un des effets indésirables suivants, arrêtez de prendre OXYCODONE EG LP et contactez votre médecin immédiatement.
La dépression respiratoire est le risque induit par les opioïdes le plus important et le plus susceptible de survenir chez les patients âgés ou affaiblis. Par conséquent, chez les patients prédisposés, les opioïdes peuvent entraîner une baisse importante de la pression artérielle.
Par ailleurs, l'oxycodone peut provoquer une contraction des pupilles, des spasmes bronchiques et des spasmes des muscles lisses ainsi que supprimer le réflexe de toux.
Autres effets indésirables éventuels :
Très fréquent (peut affecter plus d'une personne sur 10) :
Sédation (fatigue allant jusqu'à la somnolence) ; vertiges ; céphalées ; constipation ; nausées ; vomissements ; démangeaisons.
Fréquent (peut affecter jusqu'à 1 personne sur 10) :
Plusieurs effets secondaires psychologiques tels que des changements d'humeur (par ex. anxiété, dépression) ; des modifications de l'activité (principalement sédation, parfois associée à une léthargie ; occasionnellement une augmentation de l'activité accompagnée de nervosité et d'insomnie) et des modifications des performances cognitives (troubles de la pensée, confusion, cas isolés de troubles du langage), sensation de faiblesse (asthénie) ; tremblements ; dépression respiratoire, difficulté à respirer ou respiration sifflante (dyspnée, bronchospasme), sécheresse buccale, dans de rares cas accompagnée de soif et d’une difficulté à avaler ; troubles gastro-intestinaux tel que douleurs au ventre ; diarrhée ; maux d'estomac (dyspepsie) ; diminution de l’appétit, affections cutanées telles que éruptions cutanées, rarement augmentation de la sensibilité à la lumière (photosensibilité), éruptions cutanées avec démangeaisons (urticaire) ou squames (dermatite exfoliante) dans des cas isolés, troubles urinaires (élimination d'urine fréquente), augmentation de la sudation (hyperhidrose), manque de force (asthénie).
Peu fréquent (peut affecter jusqu'à 1 personne sur 100) :
Affection qui entraîne la production anormale d'une hormone réduisant l'élimination d'urine (syndrome de sécrétion inappropriée d'hormone antidiurétique), modifications de la perception telles que dépersonnalisation, hallucinations (perception de choses qui n’existent pas), instabilité émotionnelle, dépendance au médicament (voir rubrique « Mises en garde spéciales »), modification du goût, troubles visuels, sens anormalement aigu de l'ouïe (hyperacousie) ; euphorie ; agitation, augmentation ou baisse du tonus musculaire , contractions musculaires involontaires, troubles de la mémoire (amnésie) ; attaques, troubles du langage ; réduction du sens du toucher (hypoesthésie) ; troubles de la coordination ; malaise ; évanouissement ; fourmillements (paresthésie) ; sentiment que tout tourne (vertiges), accélération du pouls ; battements du cœur rapides ou irréguliers (tachycardie supraventriculaire), palpitations (dans un contexte de syndrome de sevrage), élargissement des vaisseaux sanguins (vasodilatation), augmentation de la toux ; inflammation de la gorge (pharyngite) ; écoulement nasal ; modifications de la voix, ulcères de la bouche ; inflammation des gencives, inflammation de la bouche (stomatite) ; altération de la capacité à avaler (dysphagie), flatulence, production de rots ; obstruction de l'intestin (iléus), difficulté respiratoire (dépression respiratoire), troubles du goût, augmentation des valeurs hépatiques, sécheresse cutanée, rétention d'urine, troubles de la fonction sexuelle (réduction du désir sexuel, troubles de l’érection et impuissance), blessures accidentelles ; douleurs (par ex. douleurs dans la poitrine) ; excès de liquide dans les tissus (œdème) ; migraine ; dépendance physique avec symptômes de sevrage ; réactions allergiques, manque d'eau dans le corps (déshydratation), hypersensibilité (réactions allergiques), soif, larmoiement oculaire, constriction pupillaire (miosis), frissons, tintement ou bourdonnement dans les oreilles (acouphène), accoutumance au médicament (si bien qu'une augmentation de la dose devient nécessaire pour obtenir l'effet requis).
Rare (peut affecter jusqu'à 1 personne sur 1000) :
Maladie ganglionnaire (lymphadénopathie), crises convulsives, notamment chez les patients souffrant d'épilepsie ou ayant tendance à avoir des crises, spasmes musculaires (contraction involontaire des muscles), baisse de la pression artérielle, accompagnée dans de rares cas de symptômes tels que martèlement ou accélération des battements du cœur, étourdissements au passage à la position debout (hypotension orthostatique), saignement des gencives ; augmentation de l'appétit ; selles noires ; tâches et atteintes dentaires, herpès (affection de la peau et des muqueuses), urticaire, variations du poids corporel (perte ou prise) ; cellulite.
Fréquence indéterminée (ne peut être estimée sur la base des données disponibles)
Réaction anaphylactique, agressivité, sensibilité accrue à la douleur (hyperalgésie), caries dentaires, stase biliaire, colique biliaire, absence de saignements menstruels (aménorrhée), l’utilisation au long cours de OXYCODONE EG LP pendant la grossesse peut entrainer des syndromes de sevrage mettant en jeu le pronostic vital chez le nouveau-né. Les symptômes à surveiller chez le nouveau-né incluent irritabilité, hyperactivité, rythmes anormaux du sommeil, cris aigus, tremblements, être malade, diarrhée et absence de prise de poids, apnée du sommeil (pauses respiratoires pendant le sommeil), un problème affectant une valve des intestins qui peut provoquer une douleur abdominale haute sévère (dysfonctionnement du sphincter d’Oddi).
Syndrome de sevrage aux opioïdes
Étant donné que le chlorhydrate d'oxycodone est susceptible de provoquer une dépendance médicamenteuse, il est possible de développer un syndrome d'abstinence ou de sevrage aux opioïdes caractérisé par plusieurs ou l'ensemble des symptômes suivants : agitation, yeux humides (larmoiement), rhinorrhée, bâillements, sudation, frissons, douleurs musculaires, dilatation des pupilles et battements de cœur irréguliers (palpitations). D'autres symptômes peuvent également se manifester, notamment : irritabilité, anxiété, mal de dos, douleurs articulaires, faiblesse, crampes abdominales, insomnie, nausées, anorexie, vomissements, diarrhée, ou augmentation de la pression artérielle, de la fréquence respiratoire ou de la fréquence cardiaque.
Contre-mesures
Si vous présentez l'un des effets indésirables listés ci-dessus, votre médecin prendra généralement des mesures appropriées.
La constipation peut être évitée par une alimentation riche en fibres et une augmentation de la consommation de liquides.
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet: : https://signalement.social-sante.gouv.fr/
En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.
5. COMMENT CONSERVER OXYCODONE EG LP 20 mg, comprimé pelliculé à libération prolongée ?
Tenir ce médicament hors de la vue et de la portée des enfants. Conserver ce médicament dans un lieu de conservation fermé à clé, sûr et sécurisé, où d’autres personnes ne peuvent pas y accéder. Il peut nuire gravement, voire être fatal aux personnes auxquelles il n’a pas été prescrit.
N’utilisez pas ce médicament après la date de péremption indiquée sur la plaquette et l’emballage après « EXP ». La date de péremption fait référence au dernier jour de ce mois.
Ce médicament ne nécessite pas de précautions particulières de conservation.
Ne jetez aucun médicament au tout-à-l’égout ou avec les ordures ménagères. Demandez à votre pharmacien d’éliminer les médicaments que vous n’utilisez plus. Ces mesures contribueront à protéger l’environnement.
6. CONTENU DE L’EMBALLAGE ET AUTRES INFORMATIONS
Ce que contient OXYCODONE EG LP 20 mg, comprimé pelliculé à libération prolongée
· La substance active est :
Chlorhydrate d’oxycodone .............................................................................................. 20 mg
Équivalent à 17,9 mg d’oxycodone.
Pour un comprimé pelliculé à libération prolongée.
· Les autres composants composants sont :
Noyau :
Lactose monohydraté, copolymère d’ammonio méthacrylate (type B), povidone (K29/32), talc, triacétine, alcool stéarylique, stéarate de magnésium.
Pelliculage :
Hypromellose, talc, macrogol 400, dioxyde de titane (E171), oxyde de fer rouge (E172).
Ce médicament se présente sous forme de comprimé pelliculé à libération prolongée rond, biconvexe, rose clair, d’un diamètre de 6,9 à 7,3 mm et d’une épaisseur de 3,2 à 3,9 mm.
Boîtes de 10*1, 14*1, 20*1, 25*1, 28*1, 30*1, 40*1, 50*1, 56*1, 60*1, 98*1 et 100*1 comprimés pelliculés à libération prolongée sous plaquettes prédécoupées unitaires (PVC/PVDC/Aluminium) avec sécurité enfant.
Toutes les présentations peuvent ne pas être commercialisées.
Titulaire de l’autorisation de mise sur le marché
EG LABO - Laboratoires EuroGenerics
central park
9-15 rue Maurice mallet
92130 issy-les-moulineaux
FRANCE
Exploitant de l’autorisation de mise sur le marché
EG LABO - Laboratoires EuroGenerics
central park
9-15 rue Maurice mallet
92130 issy-les-moulineaux
FRANCE
STADASTRASSE 2-18
61118 BAD VILBEL
Allemagne
ou
CENTRAFARM SERVICES B.V.
VAN DE REIJTSTRAAT 31-E
4814 NE BREDA
PAYS BAS
Noms du médicament dans les Etats membres de l'Espace Economique Européen
Ce médicament est autorisé dans les Etats membres de l'Espace Economique Européen sous les noms suivants : Conformément à la réglementation en vigueur.
[à compléter ultérieurement par le titulaire]
La dernière date à laquelle cette notice a été révisée est :
[à compléter ultérieurement par le titulaire]
Des informations détaillées sur ce médicament sont disponibles sur le site Internet de l’ANSM (France).