Dernière mise à jour le 02/02/2026
ZOLADEX 3,6 mg, implant en seringue préremplie pour voie sous-cutanée
Indications thérapeutiques
Classe pharmacothérapeutique - code ATC : L02AE03
Analogue de l’hormone entraînant la libération de gonadotrophine.
Ce médicament est un analogue d'une hormone naturelle.
Il est préconisé dans le traitement de :
· certaines maladies de la prostate et des os,
· certaines maladies du sein de la femme pré-ménopausée.
Présentations
> 1 seringue(s) préremplie(s) polystyrène polyéthylène de 3,6 mg
Code CIP : 329 326-7 ou 34009 329 326 7 2
Déclaration de commercialisation : 19/11/1988
Cette présentation est agréée aux collectivités
- Prix hors honoraire de dispensation : 86,03 €
- Honoraire de dispensation : 1,02 €
- Prix honoraire compris : 87,05 €
- Taux de remboursement :100%
Service médical rendu (SMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprès de la HAS (plus d'informations dans l'aide). Les avis et synthèses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur du SMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| Important | Avis du 07/09/2016 | Renouvellement d'inscription (CT) | Le service médical rendu par ZOLADEX 3,6 mg et ZOLADEX 10,8 mg reste important dans les indications de l’AMM. |
Amélioration du service médical rendu (ASMR)
Pas d'ASMR disponible pour ce médicament (plus d'informations dans l'aide )
ANSM - Mis à jour le : 25/01/2024
ZOLADEX 3,6 mg, implant en seringue préremplie pour voie sous-cutanée
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Goséréline base ................................................................................................................... 3,6 mg
(Sous forme d'acétate de goséréline)
Pour un implant.
Pour la liste complète des excipients, voir rubrique 6.1.
Implant en seringue préremplie.
4.1. Indications thérapeutiques
Zoladex est indiqué chez les adultes dans le :
· Traitement du cancer de la prostate métastasé.
· Un effet favorable du médicament est d'autant plus net et plus fréquent que le patient n'a pas reçu antérieurement de traitement hormonal.
· Traitement adjuvant à la radiothérapie externe dans le cancer de la prostate localement avancé (stade T3 -T4 de la classification TNM ou stade C de la classification AUA).
· Traitement du cancer du sein métastatique hormono-dépendant de la femme préménopausée quand une suppression de la fonction ovarienne est nécessaire.
Remarque : Ce médicament n'est en aucune façon le traitement adjuvant du cancer du sein non métastasé.
4.2. Posologie et mode d'administration
Une prudence particulière doit être observée lors de l’administration de Zoladex 3,6 mg chez les patients ayant un IMC bas et/ou recevant un traitement anticoagulant (voir rubrique 4.4).
Pour une administration correcte, se reporter au schéma du mode d'administration inséré dans la boite.
Posologie
Cancer du sein et de la prostate :
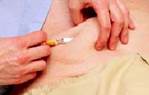
Un implant d'acétate de goséréline, dosé à 3,6 mg, sera injecté par voie sous-cutanée dans la paroi abdominale antérieure, tous les 28 jours.
Dans l'indication : « traitement adjuvant à la radiothérapie externe dans le cancer de la prostate localement avancé », la durée de l'hormonothérapie est fixée à 3 ans.
Mode d’administration
Avant l'injection, il convient de s'assurer qu'une partie de l'implant est visible dans la fenêtre de la seringue.
Précautions à prendre avant la manipulation ou l’administration du médicament :
Le piston ne doit pas être enlevé lorsque l'aiguille est en place et il est indispensable de le pousser à fond pour injecter l'implant dans le tissu sous-cutané.
Grossesse et allaitement (voir rubrique 4.6).
4.4. Mises en garde spéciales et précautions d'emploi
Il existe un risque accru de survenue de dépression incidente (qui peut être sévère) chez les patients traités par agonistes de la GnRH, tels que la goséréline. Les patients doivent être informés en conséquence et traités de façon appropriée si des symptômes apparaissent.
Des lésions au site d’injection ont été rapportées avec Zoladex 3,6 mg incluant des douleurs, des hématomes, des hémorragies, et des lésions vasculaires. Une surveillance des patients présentant des signes ou symptômes d’hémorragie abdominale doit être réalisée. Dans de très rares cas, des erreurs d’administration ont provoqué une lésion vasculaire et un choc hémorragique nécessitant des transfusions sanguines et une intervention chirurgicale. Une prudence particulière doit être observée lors de l’administration de Zoladex 3,6 mg chez les patients ayant un IMC bas et/ou recevant un traitement anticoagulant (voir rubrique 4.2).
Le traitement par suppression androgénique peut allonger l’intervalle QT.
Pour les patients ayant des antécédents ou des facteurs de risques d’allongement de l’intervalle QT, et pour les patients recevant des médicaments pouvant allonger l’intervalle QT (voir rubrique 4.5), les médecins doivent évaluer le rapport bénéfice risque en prenant en compte le risque de torsade de pointes avant d’initier Zoladex.
Le traitement par Zoladex peut donner des réactions positives aux tests anti-dopage.
Chez l’homme :
L’utilisation de Zoladex 3,6 mg chez les hommes présentant un risque particulier d’obstruction de l’uretère ou de compression de la moelle épinière doit être envisagée avec prudence et ces patients doivent être étroitement surveillés pendant le premier mois de traitement.
L’utilisation initiale d’un anti-androgène (par ex. acétate de cyprotérone 300 mg par jour pendant trois jours avant et trois semaines après le début du traitement par Zoladex) doit être envisagée à l’instauration d’un traitement par analogue de la LHRH, car il a été rapporté qu’il prévient les séquelles éventuelles de l’augmentation initiale de la testostérone sérique. En présence d’une compression de la moelle épinière ou d’une insuffisance rénale due à une obstruction de l’uretère, un traitement standard spécifique de ces complications doit être instauré.
L’utilisation d’agonistes de la LHRH peut entraîner une diminution de la densité minérale osseuse. Les données préliminaires obtenues chez l’homme indiquent que l’utilisation d’un bisphosphonate en association avec un agoniste de la LHRH pourrait réduire la perte de densité minérale osseuse.
Une prudence particulière est nécessaire chez les patients présentant des facteurs supplémentaires de risque d’ostéoporose (par ex. consommation excessive chronique d'alcool, tabagisme, traitement au long court par des anticonvulsivants ou des corticoïdes, antécédent familial d'ostéoporose).
Des troubles de l’humeur, y compris dépression, ont été rapportés. Les patients dépressifs et les patients hypertendus doivent être soigneusement surveillés.
Une diminution de la tolérance au glucose a été observée chez les hommes recevant des agonistes de la LHRH. Elle peut se manifester sous la forme d’un diabète ou, chez les patients ayant déjà un diabète sucré, par une perte de la maîtrise de la glycémie. On doit donc envisager de surveiller la glycémie.
Une augmentation des cas d’insuffisance cardiaque et d’infarctus du myocarde a été observée lors d’une étude épidémiologique chez les patients traités par agonistes de la LHRH dans le traitement du cancer de la prostate. Le risque apparaît augmenté lors de l’association d’agonistes de la LHRH et d’anti-androgènes.
Des mesures de surveillance ciblées sur les facteurs de risques cardiovasculaires sont nécessaires. Chez les patients présentant ces facteurs de risque et/ou une pathologie cardiovasculaire préexistante, une prise en charge et un traitement des facteurs de risques est nécessaire. Voir Rubrique 4.8.
Chez la femme :
Cancer du sein
Diminution de la densité minérale osseuse.
L’utilisation d’agonistes de la LHRH peut entraîner une diminution de la densité minérale osseuse. Après deux ans de traitement pour un cancer du sein précoce, la perte moyenne de densité minérale osseuse a été de 6,2 % et 11,5 % au niveau du col du fémur et de la colonne lombaire respectivement. Il a été montré que cette perte est en partie réversible, au cours du suivi après un an sans traitement, avec une récupération de 3,4 % et 6,4 % comparativement à l’inclusion au niveau du col du fémur et de la colonne lombaire respectivement, bien que cette récupération soit fondée sur des données très limitées.
Pour la majorité des femmes, les données actuellement disponibles suggèrent qu’une récupération de la perte osseuse survient après l’arrêt du traitement.
Des données préliminaires suggèrent que l’utilisation de Zoladex en association avec le tamoxifène chez les patientes atteintes d’un cancer du sein pourrait réduire la déminéralisation osseuse.
Hémorragie de privation
Au début du traitement par Zoladex, certaines femmes peuvent présenter une hémorragie vaginale de durée et d’intensité variables. Ces hémorragies vaginales surviennent généralement au cours du premier mois suivant le début du traitement. Une telle hémorragie correspond probablement à une hémorragie de privation d’estrogène et devrait s’arrêter spontanément. Si elle persiste, il faudra en rechercher la cause.
L’utilisation de Zoladex pourrait entraîner une augmentation de la résistance cervicale ; il convient donc d’être prudent lors de la dilatation du col de l’utérus.
Les femmes en âge de procréer doivent utiliser des méthodes de contraception non hormonales pendant le traitement par Zoladex et jusqu’au rétablissement des règles après l’arrêt du traitement par Zoladex.
Des troubles de l’humeur, y compris dépression, ont été rapportés. Les patientes dépressives et les patientes hypertendues doivent être soigneusement surveillées.
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
Associations faisant l'objet de précautions d’emploi
Etant donné que le traitement par suppression androgénique peut entraîner un allongement de l’intervalle QT, l’utilisation concomitante de Zoladex avec des médicaments connus pour allonger l’intervalle QT ou des médicaments pouvant induire des torsades de pointes tels que les médicaments antiarythmiques de classe Ia (par exemple quinidine, disopyramide) ou de classe III (par exemple amiodarone, sotalol, dofétilide, ibutilide), la méthadone, la moxifloxacine, les antipsychotiques, etc doit être évaluée avec précaution (voir rubrique 4.4)
4.6. Fertilité, grossesse et allaitement
Grossesse
Zoladex ne doit pas être utilisé pendant la grossesse car l’utilisation intercurrente d’agonistes de la LHRH est associée à un risque théorique d’avortement ou d’anomalie fœtale.
Fertilité
Avant le traitement, les femmes potentiellement fertiles doivent être soigneusement examinées afin d’exclure toute grossesse. Des méthodes de contraception non hormonales doivent être utilisées pendant le traitement jusqu’au rétablissement des règles.
Allaitement
Zoladex ne doit pas être utilisé pendant l’allaitement.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
Zoladex 3,6 mg n’a aucun effet ou un effet négligeable sur l’aptitude à conduire des véhicules et à utiliser des machines.
Les catégories de fréquences suivantes sont basées sur tous les effets indésirables provenant des études cliniques, des études post-commercialisation et des rapports spontanés.
Dans cette rubrique, les effets indésirables sont définis comme suit : très fréquent (≥ 1/10), fréquent (≥ 1/100 à < 1/10), peu fréquent (≥ 1/1 000 à < 1/100), rare (≥ 1/10 000 à < 1/1 000), et très rare (< 1/10 000), fréquence indéterminée (ne peut être estimée sur la base des données disponibles).
Tableau : Réactions indésirables médicamenteuses à Zoladex 3,6 mg présentées par classe de système d’organe MedDRA
|
Classe de système d’organe |
Fréquence |
Hommes |
Femmes |
|
Tumeurs bénignes, malignes et non précisées (incluant kystes et polypes) |
Très rare |
Tumeur de l’hypophyse
|
Tumeur de l’hypophyse |
|
|
Fréquence indéterminée |
NA |
Dégénérescence des fibromes utérins |
|
Affections du système immunitaire |
Peu fréquent |
Hypersensibilité au médicament
|
Hypersensibilité au médicament
|
|
|
Rare |
Réaction anaphylactique |
Réaction anaphylactique |
|
Affections endocriniennes |
Très rare |
Hémorragie hypophysaire |
Hémorragie hypophysaire
|
|
Troubles du métabolisme et de la nutrition |
Fréquent |
Diminution de la tolérance au glucosea |
NA |
|
|
Peu fréquent |
|
Hypercalcémie |
|
Affections psychiatriques |
Très fréquent |
Diminution de la libidob |
Diminution de la libidob |
|
Peu fréquent |
Altération de l’humeur, dépression (prise à court terme) |
Altération de l’humeur, dépression (prise à court terme) |
|
|
Fréquent |
Altération de l’humeur, dépression (prise à long terme) |
Altération de l’humeur, dépression (prise à long terme) |
|
|
Très rare |
Trouble psychotique |
Trouble psychotique |
|
|
Affections du système nerveux |
Fréquent |
Paresthésies |
Paresthésies |
|
|
|
Compression de la moelle épinière |
NA |
|
|
|
NA |
Céphalées |
|
Affections vasculaires |
Très fréquent |
Bouffées, Vasomotricesb
|
Bouffées, Vasomotricesb
|
|
|
Fréquent |
Variation de la pression artériellec
|
Variation de la pression artériellec
|
|
Affections cardiaques |
Fréquent |
Insuffisance cardiaque f Infarctus du myocardef |
|
|
Fréquence indéterminée |
Allongement de l’intervalle QT (voir rubriques 4.4 et 4.5) |
Allongement de l’intervalle QT (voir rubriques 4.4 et 4.5) |
|
|
Affections de la peau et du tissu sous cutané |
Très fréquent |
Hyperhydroseb |
Acnéi Hyperhydroseb |
|
Fréquent |
Rashd |
Rashd Alopécieg |
|
|
Fréquence indéterminée |
Alopécieh |
|
|
|
Affections musculo-squelettiques, systémiques et osseuses |
Fréquent |
Douleurs osseusese |
NA |
|
|
|
|
Arthralgie |
|
|
Peu fréquent |
Arthralgie |
|
|
Affections du rein et des voies urinaires |
Peu fréquent |
Obstruction de l’uretère |
NA |
|
Affections des organes de reproduction et du sein |
Très fréquent |
Impuissance |
NA |
|
|
|
NA |
Sécheresse vulvovaginale |
|
|
|
NA |
Augmentation du volume mammaire
|
|
|
Fréquent |
Gynécomastie |
NA |
|
|
Peu fréquent |
Sensibilité mammaire |
NA |
|
|
Rare |
NA |
Kyste ovarien |
|
|
Fréquence indéterminée |
NA |
Hémorragie de privation (voir rubrique 4.4) |
|
Troubles généraux et anomalies au site d’administration |
Très fréquent |
|
Réactions au site d’injection |
|
|
Fréquent |
Réactions au site d’injection
|
Augmentation du volume tumoral, tumeur douloureuse |
|
Investigations |
Fréquent |
Perte de densité minérale osseuse (voir rubrique 4.4), augmentation du poids |
Perte de densité minérale osseuse (voir rubrique 4.4), augmentation du poids
|
a Une diminution de la tolérance au glucose a été observée chez les hommes recevant des agonistes de la LHRH. Elle peut se manifester sous la forme d’un diabète ou, chez les patients ayant déjà un diabète sucré, par une perte de la maîtrise de la glycémie.
b Effets pharmacologiques qui ne nécessitent que rarement l’arrêt du traitement. Les bouffées de chaleur et sueurs peuvent continuer après l’arrêt du traitement par Zoladex.
c Peuvent se manifester sous forme d’une hypotension ou d’une hypertension et sont parfois observées chez les patients ayant reçu de la goséréline. Ces modifications sont habituellement transitoires, disparaissant pendant le traitement ou après l’arrêt du traitement par la goséréline. Dans de rares cas, ces modifications ont été suffisamment importantes pour nécessiter une intervention médicale, notamment l’arrêt du traitement par goséréline.
d Généralement léger, régressant souvent sans nécessiter l’arrêt du traitement.
e Initialement, les patients atteints de cancer de la prostate pourront ressentir une augmentation temporaire des douleurs osseuses pouvant être prise en charge par un traitement symptomatique.
f Une augmentation des cas d’insuffisance cardiaque et d’infarctus du myocarde a été observée lors d’une étude épidémiologique chez les patients traités par agonistes de la LHRH dans le traitement du cancer de la prostate. Le risque apparaît augmenté lors de l’association d’agonistes de la LHRH et d’anti-androgènes.
g Une perte des cheveux a été rapportée chez les femmes. Elle est habituellement légère mais peut être sévère dans certains cas.
h Particulièrement perte des poils au niveau du corps, ce qui est un effet attendu de la baisse des taux d’androgènes.
i L’apparition d’acné a généralement été observée le mois suivant le début de traitement par goséréline.
Expérience post-commercialisation
Un petit nombre de cas de modification de la numération formule sanguine, de dysfonction hépatique, d’embolie pulmonaire et de pneumonie interstitielle a été rapporté lors de l’utilisation de Zoladex.
En début de traitement, les patientes atteintes de cancer du sein pourraient ressentir une intensification temporaire des signes et des symptômes pouvant être prise en charge par un traitement symptomatique.
Rarement, des patientes atteintes de cancer du sein métastasé ont développé une hypercalcémie lors de l’instauration du traitement. Il convient d’exclure l’hypercalcémie en présence de signes évocateurs (par ex. soif, etc.).
Rarement, certaines femmes entrent en ménopause pendant le traitement par les analogues de la LHRH et leurs règles ne reviennent pas à l’arrêt du traitement. Il n’est pas déterminé s’il s’agit d’un effet du traitement par Zoladex ou d’une conséquence de leurs états gynécologiques.
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr/.
L’expérience en matière de surdosage est limitée chez l’Homme. Dans des cas où Zoladex a été administré avant la date prévue, ou lorsqu’une dose de goséréline plus importante que la dose prévue a été administrée, aucun effet indésirable cliniquement significatif n’a été observé. Les tests réalisés chez l’animal suggèrent que, à des doses plus élevées de goséréline, aucun autre effet que les effets thérapeutiques voulus sur les concentrations d’hormones sexuelles et l’appareil reproducteur ne sera visible. En cas de surdosage, le traitement doit être symptomatique.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
La goséréline est un décapeptide de synthèse analogue agoniste de la LH-RH naturelle.
L'administration chronique d'acétate de goséréline entraîne, après environ trois semaines, une forte réduction des taux de LH hypophysaire et des taux de testostérone plasmatique au niveau habituellement observé chez les hommes ayant subi une castration chirurgicale.
Celle-ci est maintenue pendant toute la durée du traitement.
Chez l'homme, à l'instauration du traitement par l'acétate de goséréline, la stimulation initiale de la sécrétion de LH entraîne une élévation transitoire de la testostérone plasmatique.
Cependant, en une semaine, la concentration plasmatique de testostérone retombe à son niveau initial.
Chez la femme, une stimulation initiale de la sécrétion de LH, FSH et d'estradiol est également observée.
Les concentrations plasmatiques de l'estradiol chutent 21 jours environ après la première injection et restent à un niveau comparable à celui observé chez les femmes ménopausées lorsque le traitement est administré toutes les 4 semaines.
5.2. Propriétés pharmacocinétiques
La demi-vie de la goséréline augmente chez les sujets présentant une insuffisance rénale jusqu'à 12 heures environ.
Chez l'insuffisant hépatique, les concentrations maximales et les aires sous courbes sont significativement plus élevées par rapport au sujet sain.
La formulation implant de l'acétate de goséréline libère le principe actif de façon continue, le pic de concentration sérique survenant 2 semaines environ après l'administration.
Il n'est pas observé d'accumulation lorsque l'implant est administré toutes les 4 semaines
5.3. Données de sécurité préclinique
Chez la souris, l'administration à long terme de doses supérieures à la dose thérapeutique chez l'homme a entraîné une hyperplasie des cellules des îlots de Langerhans et une prolifération bénigne pylorique, phénomène spontané dans cette espèce.
L'éventuelle implication clinique est inconnue.
3 ans
6.4. Précautions particulières de conservation
A conserver à température ne dépassant pas + 25°C.
6.5. Nature et contenu de l'emballage extérieur
Implant en seringue préremplie (Polystyrène- Polyéthylène) avec système de sécurité (SafesystemTM) ; boîte de 1.
6.6. Précautions particulières d’élimination et de manipulation
Pour une administration correcte, se reporter au schéma du mode d'administration inséré dans la boite.
Vérifier l'intégrité de la pochette avant usage.
L'implant de goséréline s'utilise dès l'ouverture de la pochette. Une prudence particulière doit être observée lors de l’administration de Zoladex 3,6 mg chez les patients ayant un IMC bas et/ou recevant un traitement anticoagulant (voir rubrique 4.4).
La présence du système de sécurité (SafesystemTM) est destinée à protéger le personnel soignant contre le risque de piqûre accidentelle.
Tout médicament non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
TOUR CARPE DIEM
31 PLACE DES COROLLES
92400 COURBEVOIE
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· 34009 329 326 7 2 : implant en seringue préremplie (Polystyrène- PE) avec système de sécurité (SafesystemTM) ; boîte de 1.
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
[à compléter ultérieurement par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE
[à compléter ultérieurement par le titulaire]
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Liste I.
ANSM - Mis à jour le : 25/01/2024
ZOLADEX 3,6 mg, implant en seringue préremplie pour voie sous-cutanée
Acétate de goséréline
· Gardez cette notice. Vous pourriez avoir besoin de la relire.
· Si vous avez d’autres questions, interrogez votre médecin, ou votre pharmacien ou votre infirmier/ère.
· Ce médicament vous a été personnellement prescrit. Ne le donnez pas à d’autres personnes. Il pourrait leur être nocif, même si les signes de leur maladie sont identiques aux vôtres.
· Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin, ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
1. Qu'est-ce que Zoladex 3,6 mg, implant en seringue préremplie pour voie sous-cutanée et dans quels cas est-il utilisé ?
2. Quelles sont les informations à connaître avant d’utiliser Zoladex 3,6 mg, implant en seringue préremplie pour voie sous-cutanée ?
3. Comment utiliser Zoladex 3,6 mg, implant en seringue préremplie pour voie sous-cutanée ?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver Zoladex 3,6 mg, implant en seringue préremplie pour voie sous-cutanée ?
6. Contenu de l’emballage et autres informations.
1. QU’EST-CE QUE ZOLADEX 3,6 mg, implant en seringue préremplie pour voie sous-cutanée ET DANS QUELS CAS EST-IL UTILISE ?
Classe pharmacothérapeutique - code ATC : L02AE03
Analogue de l’hormone entraînant la libération de gonadotrophine.
Ce médicament est un analogue d'une hormone naturelle.
Il est préconisé dans le traitement de :
· certaines maladies de la prostate et des os,
· certaines maladies du sein de la femme pré-ménopausée.
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT D’UTILISER ZOLADEX 3,6 mg, implant en seringue préremplie pour voie sous-cutanée ?
N'utilisez jamais Zoladex 3,6 mg, implant en seringue préremplie pour voie sous-cutanée :
· Si vous êtes allergique à la substance active ou à l’un des autres composants contenus dans ce médicament, mentionnés dans la rubrique 6
· Si vous allaitez ou si vous êtes enceinte (voir rubrique 2 « Grossesse et allaitement »)
Avertissements et précautions
Adressez-vous à votre médecin, pharmacien ou votre infirmier/ère avant que l’injection de Zoladex 3,6 mg, implant en seringue préremplie pour voie sous-cutanée ne soit pratiquée, dans les cas suivants :
· Zoladex peut entraîner une réduction du calcium osseux (fragilisation de l’os). Si vous souffrez d’une maladie en relation avec la solidité de vos os, assurez-vous que votre médecin en a été informé.
· Des cas de dépression, parfois sévères, ont été rapportés chez les patients prenant Zoladex. Si vous prenez Zoladex et si vous présentez une humeur dépressive, informez votre médecin.
Mises en garde
Comme avec les autres médicaments de la même classe, des cas d'aggravation, le plus souvent transitoires, des symptômes ont été rapportés lors de la mise en route du traitement chez l'homme et chez la femme (voir rubrique 4 « Quels sont les effets indésirables éventuels ? »).
En cas de tumeur de l'hypophyse, parfois méconnue, Zoladex peut provoquer des céphalées importantes, des malaises, des troubles visuels et des pertes de connaissance. Il faut en informer immédiatement votre médecin.
Précautions d'emploi
Zoladex peut entraîner une réduction du calcium osseux (fragilisation de l’os). Une récupération partielle de cette perte peut intervenir à l’arrêt du traitement.
Signalez à votre médecin si vous souffrez d’hypertension ou de dépression.
Veuillez prévenir votre médecin si vous souffrez de troubles cardiaques ou circulatoires, y compris de troubles du rythme cardiaque (arythmie), ou si vous êtes traité par des médicaments pour soigner ces maladies. Les problèmes de rythme cardiaque peuvent être augmentés avec l’utilisation de Zoladex.
Chez l'homme
Une surveillance particulièrement attentive doit être effectuée durant les premières semaines du traitement, notamment chez les patients ayant une obstruction des voies urinaires ou une compression de la moelle.
Chez la femme
Il est impératif de vérifier avant la mise en œuvre du traitement l'absence de grossesse.
L'administration régulière de ce médicament tous les 28 jours entraîne une suppression des règles. La survenue de saignements au cours du traitement est anormale, en dehors du premier mois. Elle doit conduire à des examens médicaux particuliers.
Enfants
Ce médicament n'est pas indiqué chez l'enfant.
Autres médicaments et Zoladex
Zoladex peut interagir avec certains médicaments utilisés pour traiter les problèmes de rythme cardiaque (par exemple quinidine, procainamide, amiodarone et sotalol) ou peut augmenter le risque de troubles du rythme cardiaque quand il est utilisé avec d’autres médicaments (par exemple la méthadone (utilisée pour soulager la douleur et en traitement de substitution des pharmacodépendances), la moxifloxacine (un antibiotique), des antipsychotiques (utilisés pour des troubles mentaux sévères)).
Informez votre médecin ou pharmacien si vous utilisez, avez récemment utilisé, ou pourriez utiliser tout autre médicament.
Interactions avec les aliments et les boissons
Grossesse et allaitement
Grossesse
Ce médicament ne doit pas être utilisé pendant la grossesse. En cas de découverte fortuite d'une grossesse alors que vous prenez ce médicament, avertissez tout de suite votre médecin, qui interrompra alors le traitement.
Si vous êtes enceinte ou que vous allaitez, si vous pensez être enceinte ou planifiez une grossesse, demandez conseil à votre médecin ou pharmacien avant de prendre ce médicament.
Allaitement
ZOLADEX ne doit pas être utilisé en cas d'allaitement.
Demandez conseil à votre médecin ou à votre pharmacien avant de prendre tout médicament.
Sportifs
Le traitement par Zoladex peut donner des réactions positives aux tests anti-dopage.
Conduite de véhicules et utilisation de machines
Zoladex 3,6 mg n’a aucun effet ou un effet négligeable sur l’aptitude à conduire des véhicules et à utiliser des machines.
ZOLADEX contient l’excipient :
Copolymère lactoglycolique.
3. COMMENT UTILISER ZOLADEX 3,6 mg, implant en seringue préremplie pour voie sous-cutanée ?
Veillez à toujours utiliser ce médicament en suivant exactement les instructions de cette notice ou les indications de votre médecin, pharmacien ou infirmier/ère.
Vérifiez auprès de votre médecin, pharmacien ou infirmier/ère en cas de doute
Posologie
Un implant d'acétate de goséréline, dosé à 3,6 mg, sera injecté par voie sous-cutanée dans la paroi abdominale antérieure, tous les 28 jours.
Avant l'injection, il convient de s'assurer que l'implant (petit cylindre plein de couleur blanc cassé) est visible dans la fenêtre de la seringue. Le piston ne doit pas être enlevé lorsque l'aiguille est en place et il est indispensable de le pousser à fond pour injecter l'implant dans le tissu sous-cutané.
Pour une administration correcte, se reporter au schéma du mode d'administration inséré dans la boîte.
Durée du traitement
La durée du traitement est adaptée selon les cas.
Dans tous les cas, se conformer strictement à l'ordonnance de votre médecin.
Si vous oubliez d'utiliser ZOLADEX 3,6 mg, implant en seringue préremplie pour voie sous-cutanée :
Prévenez immédiatement votre médecin.
Si vous avez d’autres questions sur l’utilisation de ce médicament, demandez plus d’informations à votre médecin, à votre pharmacien ou à votre infirmier/ère.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
Chez l'homme
Il est possible d'observer en début de traitement, une accentuation des troubles qui l'ont motivé : troubles urinaires, douleurs. Ces phénomènes peuvent survenir même si l'effet du traitement est favorable.
Il faut cependant en avertir immédiatement votre médecin traitant.
Ont aussi été rapportés :
Impuissance, gonflement ou sensibilité mammaire
Diminution de la fonction cardiaque, crise cardiaque
Augmentation du taux de sucre dans le sang
Chez la femme
Au cours du traitement, il est possible que surviennent, même si le traitement est favorable :
Des maux de tête, une augmentation du volume des seins et une sécheresse vulvovaginale.
Chez les patientes souffrant d'une maladie du sein, il est également possible d'observer en début de traitement une accentuation des symptômes, même si l'effet du traitement est favorable.
Possibilité d'augmentation de la quantité de calcium dans le sang en début de traitement.
Dégénérescence des fibromes utérins chez les femmes ayant des fibromes utérins.
De l’acné a été rapporté très fréquemment (souvent au cours du premier mois de traitement).
Kyste ovarien, saignements anormaux.
Chez l'homme et la femme
Au cours du traitement, il est possible que surviennent, même si l'effet du traitement est favorable, des bouffées de chaleur et sueurs. Occasionnellement, ces effets indésirables peuvent persister pendant un certain temps (potentiellement plusieurs mois) après l’arrêt du traitement par Zoladex. Une baisse de la libido a également été observée.
Ont aussi été rapportés : douleurs articulaires, sensation de faiblesse musculaire, fourmillements au niveau des extrémités, éruption cutanée, réactions locales avec douleur au site d'injection, réactions allergiques, anaphylaxie, augmentation ou diminution de la tension artérielle, troubles psychotiques, troubles de l’humeur y compris dépression, affection de l’hypophyse y compris tumeurs, chute des cheveux, augmentation du poids, perte de densité minérale osseuse.
Des lésions au site d’injection (incluant des atteintes des vaisseaux sanguins de l’abdomen) ont été rapportées suite à l’injection de Zoladex 3,6 mg. Dans de très rares cas, cela a provoqué un saignement important. Contactez votre médecin immédiatement si vous présentez l’un des symptômes suivants : douleur abdominale, distension abdominale, essoufflement, vertige, tension artérielle basse et/ou toute altération de la conscience.
Fréquence indéterminée : Modifications de l’électrocardiogramme (allongement de l’intervalle QT).
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet: https://signalement.social-sante.gouv.fr/
En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.
5. COMMENT CONSERVER ZOLADEX 3,6 mg, implant en seringue préremplie pour voie sous-cutanée ?
Tenir ce médicament hors de la vue et de la portée des enfants.
N’utilisez pas ce médicament après la date de péremption indiquée sur l’emballage.
La date de péremption fait référence au dernier jour de ce mois.
Conserver Zoladex 3,6 mg, implant en seringue préremplie pour voie sous-cutanée à une température ne dépassant pas +25°C.
A n'utiliser que si la pochette est intacte.
Doit être utilisé dès l'ouverture de la pochette.
N’utilisez pas ce médicament si vous remarquez des signes visibles de détérioration. Retournez le médicament chez votre pharmacien.
Ne jetez aucun médicament au tout-à-l’égout ni avec les ordures ménagères. Demandez à votre pharmacien d’éliminer les médicaments que vous n’utilisez plus. Ces mesures contribueront à protéger l’environnement.
6. CONTENU DE L’EMBALLAGE ET AUTRES INFORMATIONS
Ce que contient ZOLADEX 3,6 mg, implant en seringue préremplie pour voie sous-cutanée
· La substance active est :
Goséréline base.............................................................................................................. 3,6 mg
(Sous forme d'acétate de goséréline)
Pour un implant.
· Les autres composants sont :
Copolymère lactoglycolique.
Ce médicament se présente sous forme de seringue préremplie pour voie sous-cutanée. Boîte de 1.
Titulaire de l’autorisation de mise sur le marché
ASTRAZENECA
TOUR CARPE DIEM
31 PLACE DES COROLLES
92400 COURBEVOIE
Exploitant de l’autorisation de mise sur le marché
ASTRAZENECA
TOUR CARPE DIEM
31 PLACE DES COROLLES
92400 COURBEVOIE
GÄRTUNAVÄGEN
152 57 SÖDERTÄLJE
SUEDE
Noms du médicament dans les Etats membres de l'Espace Economique Européen
Sans objet.
La dernière date à laquelle cette notice a été révisée est :
[à compléter ultérieurement par le titulaire]
Des informations détaillées sur ce médicament sont disponibles sur le site Internet de l’ANSM (France).
Les informations suivantes sont destinées exclusivement aux professionnels de santé :
|
Schéma du mode d'administration |
|||
|
|
|
|
|
|
|
Logo* |
|
|
|
|
SafesystemTM |
|
|
|
Goséréline |
|||
|
1 - Installer le patient confortablement, la partie supérieure du corps légèrement surélevée.
REMARQUE : Des précautions doivent être prises lors de l’injection de Zoladex dans la paroi abdominale antérieure du fait de la proximité de l’artère épigastrique inférieure sous-jacente et de ses branches. Les patients très minces peuvent avoir un risque plus important de lésion vasculaire.
|
|
||
|
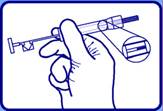
2 - Retirer la seringue de la pochette stérile et placer la seringue à la lumière afin de vérifier qu'au moins une partie de l'implant Zoladex de couleur blanc cassé est visible. |
|
||
|
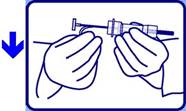
3 - Saisir la barrette rouge de sécurité en plastique et la retirer de la seringue selon la direction de la flèche. |
|
||
|
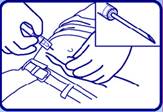
4 - Tenir le corps de la seringue, orienter le biseau de l'aiguille vers le haut.
REMARQUE : La seringue de Zoladex ne peut pas être utilisée pour l’aspiration. Si l’aiguille hypodermique pénètre un gros vaisseau, du sang sera instantanément visible dans la chambre de la seringue. Si un vaisseau est atteint, retirez l’aiguille et contrôlez immédiatement tout saignement, en surveillant les signes ou symptômes d’hémorragie abdominale. Après s’être assuré que le patient soit hémodynamiquement stable, un autre implant de Zoladex peut être injecté avec une nouvelle seringue au niveau d’un autre site d’injection. Une prudence particulière doit être observée lors de l’administration de Zoladex chez les patients ayant un IMC bas et/ou recevant un traitement anticoagulant.
|
|
||
|
5 - Ne pas piquer dans le muscle ou le péritoine |
|
||
|
6 - Pousser le piston à fond pour libérer l'implant et pour déclencher le système de sécurité.
REMARQUE : L’aiguille ne se rétracte pas
|
|
||
|
7 - Tenir la seringue comme sur la figure 6, retirer l'aiguille pour permettre au manchon protecteur de glisser et de recouvrir l'aiguille.
REMARQUE : Dans le cas, peu probable, où il serait nécessaire de retirer chirurgicalement un implant de Zoladex, il peut être localisé par échographie.
|
|
||
|
8 - Voici l'aspect de la seringue après injection. |
|
||
N.B. : pour assurer une meilleure conservation une capsule de gel de silice se trouve dans la pochette.
NE PAS L'AVALER, NI L'INJECTER