
ANSM - Mis à jour le : 19/03/2025
MISOLFA 2 mg/0,03 mg, comprimé pelliculé
2. COMPOSITION QUALITATIVE ET QUANTITATIVE 
Diénogest................................................................................................................................ 2 mg
Ethinylestradiol.................................................................................................................... 0,03 mg
Pour un comprimé pelliculé
Excipient à effet notoire : 57,170 mg de lactose monohydraté
Pour la liste complète des excipients, voir rubrique 6.1.
Comprimé pelliculé blanc, rond.
4.1. Indications thérapeutiques 
· Traitement de l’acné modérée après échec de traitements topiques ou d’un traitement antibiotique oral adaptés chez les femmes optant pour un contraceptif oral.
La décision de prescrire MISOLFA doit être prise en tenant compte des facteurs de risque de la patiente, notamment ses facteurs de risque thromboembolique veineux (TEV), ainsi que du risque TEV associé à MISOLFA en comparaison aux autres contraceptifs hormonaux combinés (CHC) (voir rubriques 4.3 et 4.4).
4.2. Posologie et mode d'administration 
Posologie et mode d’administration
Un comprimé pelliculé de MISOLFA par jour pendant 21 jours consécutifs.
Le comprimé doit être pris chaque jour environ à la même heure. Il doit être avalé entier, avec un peu de liquide si nécessaire.
Extraire le premier comprimé de l’alvéole individuelle de la plaquette qui porte le nom du jour de la semaine auquel débute la prise de comprimés (par ex. « Lun » pour lundi).
Continuer à prendre les comprimés en suivant la direction des flèches, jusqu’à ce que la plaquette soit vide.
Durant l’intervalle de 7 jours sans prise de comprimés après les 21 jours de prise de comprimés, une hémorragie de privation apparaît habituellement 2 à 4 jours après la prise du dernier comprimé.
Après cette interruption de 7 jours, poursuivre la prise de comprimés avec la plaquette suivante, que l’hémorragie soit déjà terminée ou soit toujours en cours.
La protection contraceptive est maintenue durant la période de 7 jours sans comprimés.
Comment commencer à prendre MISOLFA ?
· Si aucune contraception hormonale n’a été utilisée au cours du mois précédent :
La prise des comprimés débute le jour 1 du cycle de la femme (c.-à-d. le premier jour de ses menstruations). S’il est pris correctement, MISOLFA assure une protection contraceptive à partir du premier jour de la prise des comprimés.
Si la prise des comprimés débute entre le jour 2 et le jour 5, il faut utiliser une méthode contraceptive non hormonale supplémentaire (méthode barrière) pendant les 7 premiers jours de la prise des comprimés.
· Passage d’un autre contraceptif hormonal combiné (contraceptif oral combiné, anneau vaginal, dispositif transdermique) à MISOLFA :
Selon le type de contraceptif oral combiné utilisé précédemment, la femme doit commencer à prendre MISOLFA soit le jour suivant la période habituelle sans comprimé (qui suit la prise du dernier comprimé actif), soit le jour suivant la prise du dernier comprimé inactif du contraceptif oral combiné précédent. En cas d’utilisation précédente d’un anneau vaginal ou d’un dispositif transdermique, la patiente commencera à prendre MISOLFA le jour suivant la période habituelle sans anneau vaginal ou dispositif transdermique.
· Passage d’un contraceptif à progestatif seul (pilule progestative (POP), implant, préparation injectable) ou d’un dispositif intra-utérin à MISOLFA :
Les femmes qui utilisaient précédemment une pilule progestative (POP) peuvent passer à MISOLFA n’importe quel jour de la semaine, selon leur choix. Les femmes qui utilisaient un implant ou un dispositif intra-utérin (DIU) doivent commencer à prendre MISOLFA le jour même du retrait de l’implant ou du DIU. Les femmes qui recevaient une préparation injectable doivent commencer à prendre MISOLFA le jour où l’injection suivante était programmée. Dans tous ces cas, l’utilisation complémentaire d’une méthode contraceptive non hormonale (méthode barrière) est requise durant les 7 premiers jours de la prise de MISOLFA.
· Après un avortement au cours du premier trimestre :
La femme peut commencer à prendre MISOLFA immédiatement. Aucune précaution contraceptive supplémentaire n’est nécessaire dans ce cas.
· Après une naissance ou une fausse-couche durant le deuxième trimestre (voir rubrique 4.6 pour l’utilisation durant l’allaitement) :
Le risque d’événements thromboemboliques étant accru durant la période qui suit immédiatement l’accouchement, la prise d’un contraceptif oral se fera au plus tôt 21 à 28 jours après la naissance chez les femmes qui n’allaitent pas ou qui ont subi une fausse-couche au deuxième trimestre. Il convient d’utiliser une méthode contraceptive non hormonale supplémentaire (méthode barrière) pendant les 7 premiers jours de la prise des comprimés. Toutefois, s’il y a déjà eu rapport sexuel, l’existence d’une grossesse doit être exclue avant que la patiente ne commence à prendre MISOLFA, ou bien la patiente doit attendre ses premières menstruations.
Durée de l’administration
MISOLFA peut être pris tant que l’utilisation d’une méthode de contraception hormonale est souhaitable, et pour autant qu’il n’existe aucune contre-indication en termes de santé (voir rubrique 4.4 concernant les examens réguliers à effectuer).
Une amélioration visible de l’acné nécessite habituellement au moins trois mois de traitement, des cas d’amélioration supplémentaire ayant été rapportés après six mois de traitement. Une évaluation doit être effectuée 3 à 6 mois après la mise en route du traitement, puis à intervalles réguliers, afin d’examiner la nécessité de poursuivre le traitement.
Conduite en cas d’oubli de comprimés
L’efficacité contraceptive peut être réduite lorsque MISOLFA n’est pas pris de façon régulière.
Si la patiente a oublié de prendre un comprimé mais que moins de 12 heures se sont écoulées depuis le moment de prise habituel, la protection contraceptive ne sera pas réduite. La femme doit recommencer à prendre tous les comprimés suivants au moment habituel.
Si plus de 12 heures se sont écoulées depuis le moment de prise habituel, la protection contraceptive n’est plus entièrement garantie. Plus le moment d’oubli d’un comprimé est proche de la période sans comprimés, plus le risque de tomber enceinte est élevé.
Lorsque l’hémorragie de privation habituelle ne survient pas après l’oubli d’un comprimé, il faut exclure toute grossesse avant d’entamer une nouvelle plaquette.
|
Les deux règles de base suivantes s’appliquent en cas d’oubli de comprimés : 1. La prise des comprimés ne doit pas être interrompue pendant plus de 7 jours. 2. Les comprimés doivent être pris régulièrement pendant au moins 7 jours pour obtenir une inhibition efficace de l’axe hypothalamo-hypophyso-ovarien. |
Dès lors, la marche à suivre en cas d’oubli de comprimés est la suivante :
Prendre le dernier comprimé oublié le plus rapidement possible, même si cela signifie que la patiente doit prendre 2 comprimés le même jour. Poursuivre ensuite la prise des comprimés à l’heure habituelle. Utiliser une méthode de contraception supplémentaire non hormonale au cours des 7 jours suivants.
Si vous avez oublié un seul comprimé durant la semaine 2, il n’est pas nécessaire de prendre de précaution contraceptive supplémentaire.
Si vous avez oublié plus d’un comprimé, vous devez utiliser une méthode contraceptive non hormonale supplémentaire jusqu’à l’apparition de votre hémorragie de privation suivante.
1. S’il reste moins de 7 jours entre le comprimé oublié et le dernier comprimé de votre plaquette en cours, entamez la plaquette suivante le lendemain du jour où vous avez pris le dernier comprimé de votre plaquette en cours (donc, pas de période sans comprimés). Vous n’aurez probablement pas votre hémorragie de privation habituelle avant d’avoir pris tous les comprimés de cette seconde plaquette. Toutefois, il est fréquent que des hémorragies intermenstruelles et du spotting surviennent.
2. Vous pouvez aussi procéder différemment : vous pouvez arrêter de prendre les comprimés dans votre plaquette en cours et avancer la période sans comprimés. Après une période sans comprimés de maximum 7 jours, incluant les jours d’oubli de comprimé(s), entamez la plaquette suivante.
Que faire en cas de vomissements ou de diarrhée ?
En cas de vomissements ou de diarrhée sévère survenant dans les 4 heures suivant la prise de MISOLFA, il est possible que les substances actives ne soient pas totalement absorbées et des précautions contraceptives supplémentaires doivent être prises. Il y a lieu de suivre les recommandations ci-dessus décrivant la procédure à suivre en cas d’oubli de comprimés (voir également rubrique 4.2). Le comprimé supplémentaire doit être pris dans une plaquette différente si le schéma habituel de prise des comprimés doit être maintenu. En cas de symptômes gastro-intestinaux persistants ou récurrents, il faut utiliser des méthodes contraceptives non hormonales supplémentaires et consulter un médecin.
Retarder l’hémorragie de privation
Pour retarder l’hémorragie de privation, l’utilisatrice doit continuer à prendre des comprimés en entamant immédiatement la plaquette suivante de MISOLFA, sans respecter de période sans comprimés. L’hémorragie de privation peut être retardée aussi longtemps que l’utilisatrice le souhaite, mais pas au-delà de la fin de la seconde plaquette. Des hémorragies intermenstruelles et du spotting sont fréquents durant cette période. Après la période habituelle de 7 jours sans comprimés qui suit, la patiente peut continuer à prendre MISOLFA comme d’habitude.
· présence ou antécédents de pancréatite, si elle est associée à une hypertriglycéridémie sévère
· présence ou antécédents de pathologie hépatique, tant que la fonction hépatique ne s’est pas normalisée (incluant le syndrome de Dubin-Johnson et le syndrome de Rotor)
· présence ou antécédents de tumeurs hépatiques
· présence avérée ou suspicion de tumeur maligne hormono-dépendante (par ex. tumeur du sein ou de l’endomètre)
· saignement vaginal inexpliqué
· aménorrhée inexpliquée
· hypersensibilité aux substances actives ou à l’un des excipients mentionnés à la rubrique 6.1.
· Présence ou risque de thromboembolie veineuse (TEV)
o Thromboembolie veineuse - présence de TEV (en cas de traitement par anticoagulants) ou antécédents de TEV (par ex. thrombose veineuse profonde [TVP] ou embolie pulmonaire [EP]).
o Prédisposition connue, héréditaire ou acquise, à la thromboembolie veineuse, telle qu’une résistance à la protéine C activée (PCa) (facteur V de Leiden), un déficit en antithrombine III, un déficit en protéine C, un déficit en protéine S
o Chirurgie majeure avec immobilisation prolongée (voir rubrique 4.4)
o Risque élevé de thromboembolie veineuse dû à la présence de facteurs de risque multiples (voir rubrique 4.4)
· Présence ou risque de thromboembolie artérielle (TEA)
o Thromboembolie artérielle - présence ou antécédents de thromboembolie artérielle (par ex. infarctus du myocarde [IM]) ou de prodromes (par ex. angine de poitrine)
o Affection cérébrovasculaire - présence ou antécédents d’accident vasculaire cérébral (AVC) ou de prodromes (par ex. accident ischémique transitoire [AIT])
o Prédisposition connue, héréditaire ou acquise, à la thromboembolie artérielle, telle qu'une hyperhomocystéinémie et une présence d’anticorps anti-phospholipides (anticorps anticardiolipine, anticoagulant lupique)
o Antécédents de migraine avec symptômes neurologiques focaux
o Risque élevé de thromboembolie artérielle dû à la présence de facteurs de risque multiples (voir rubrique 4.4) ou à la présence d’un facteur de risque sévère tel que :
§ diabète sucré s’accompagnant de symptômes vasculaires
§ hypertension sévère
§ dyslipoprotéinémie sévère
L’utilisation concomitante de MISOLFA et d’autres médicaments contenant de l’ombitasvir/ paritaprévir/ritonavir et du dasabuvir, des médicaments contenant du glécaprévir/pibrentasvir ou sofosbuvir/velpatasvir/voxilaprévir est contre-indiquée (voir rubrique 4.5).
4.4. Mises en garde spéciales et précautions d'emploi 
· l’utilisatrice est enceinte ou pense être enceinte,
· premiers signes de phlébite ou signes d’une thrombose potentielle (dont thrombose rétinienne), d’une embolie ou d’un infarctus du myocarde (voir rubriques «Symptômes de TEV» et «Symptômes de TEA»),
· élévation constante de la tension artérielle au-delà de 140/90 mmHg. Dès que les valeurs de la tension artérielle sont revenues à la normale sous traitement antihypertenseur, la possibilité de reprendre un contraceptif oral combiné peut être envisagée.
· première apparition d’une migraine ou détérioration d’une migraine existante,
· douleur épigastrique sévère, hépatomégalie ou signes d’une hémorragie intra-abdominale (présence éventuelle d’une tumeur hépatique, voir rubrique 4.4),
· apparition d’un ictère, d’une hépatite, d’un prurit généralisé, d’une cholestase, ainsi que de paramètres hépatiques anormaux. Le métabolisme des hormones stéroïdiennes est diminué chez les personnes qui présentent une altération de la fonction hépatique.
· insuffisance aiguë dans la prise en charge du diabète sucré,
· nouvelle apparition ou réapparition d’une porphyrie.
Affections/Facteurs de risque nécessitant une surveillance médicale particulière :
· affections cardiaques et rénales, car la substance active éthinylestradiol est susceptible d’induire une rétention hydrique,
· troubles du métabolisme des lipides. Chez les utilisatrices qui présentent des troubles du métabolisme des lipides, l’éthinylestradiol (le composant œstrogénique de MISOLFA) peut induire une forte augmentation des triglycérides plasmatiques et, ultérieurement, une pancréatite ainsi que d’autres complications (voir également rubrique 4.3).
· antécédents d’affection hépatique,
· pathologies de la vésicule biliaire,
· dépression. Il convient d’établir si la dépression est liée à l’utilisation de MISOLFA. Si nécessaire, d’autres méthodes de contraception non hormonales doivent être utilisées.
· diminution de la tolérance au glucose/diabète sucré. Comme les contraceptifs oraux combinés peuvent influencer la résistance à l’insuline et la tolérance au glucose, la dose requise d’insuline ou d’autres antidiabétiques sera éventuellement modifiée.
· épilepsie. Si la fréquence des crises épileptiques augmente sous MISOLFA, l’utilisation d’autres méthodes contraceptives doit être envisagée.
· chorée de Sydenham,
· utérus myomateux,
· otosclérose.
Effets indésirables graves des contraceptifs oraux combinés
La prise de contraceptifs oraux combinés est associée à un risque accru de plusieurs affections graves dont l’infarctus du myocarde, la thromboembolie, l’accident vasculaire cérébral et la tumeur hépatique. Le risque de morbidité et de mortalité est encore augmenté en présence d’autres facteurs de risque, comme une hypertension, une hyperlipidémie, un excès pondéral et un diabète.
En présence de l’une des affections ou de l’un des facteurs de risque mentionnés ci-dessous, il convient de discuter avec la patiente de la pertinence de l’utilisation de MISOLFA.
En cas d’aggravation ou de première apparition de l’une de ces affections ou de l’un de ces facteurs de risque, la patiente doit être invitée à contacter son médecin afin de vérifier s’il y a lieu d’interrompre l’utilisation de MISOLFA.
Troubles circulatoires
Risque de thromboembolie veineuse (TEV)
L’utilisation d’un contraceptif hormonal combiné (CHC) augmente le risque de thromboembolie veineuse (TEV) par rapport à la non-utilisation. Les produits qui contiennent du lévonorgestrel, du norgestimate ou de la noréthistérone sont associés au risque le plus faible de TEV. Les autres produits comme Misolfa peuvent avoir un risque plus élevé de 1.6 fois. La décision d’utiliser tout autre produit que ceux associés au risque de TEV le plus faible doit être prise uniquement après concertation avec la patiente afin de s’assurer qu’elle comprenne le risque de TEV associé aux CHC, l’impact de ses facteurs de risque actuels sur ce risque et le fait que le risque de TEV est maximal au cours de la première année d’utilisation. Certaines données probantes indiquent également une augmentation du risque lors de la reprise d’un CHC après une interruption de 4 semaines ou plus.
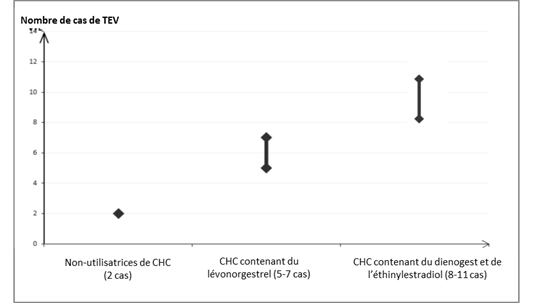
Parmi les femmes qui n’utilisent pas de CHC et qui ne sont pas enceintes, environ 2 sur 10 000 développeront une TEV sur une période d’un an. Cependant, chez une femme donnée, le risque peut être considérablement plus élevé, selon les facteurs de risque qu’elle présente (voir ci-dessous).
Selon les résultats des études épidémiologiques menées auprès de femmes utilisant des contraceptifs oraux combinés faiblement dosés (< 50 microgrammes d’éthinylestradiol), environ 6 à 12 femmes sur 10 000 développeront une TEV sur une période d’un an.
On estime que sur 10 000 femmes qui utilisent une faible dose de CHC contenant du lévonorgestrel, environ 6[1] développeront une TEV sur une période d’un an.
On estime que sur 10 000 femmes qui utilisent un CHC contenant du diénogest et de l’éthinylestradiol entre 8 et 11[2] développeront une TEV sur une période d’un an (voir tableau 1).
Ce nombre de TEV par année est inférieur à celui attendu pendant la grossesse ou en période post-partum.
La TEV peut être fatale dans 1 à 2 % des cas.
Tableau 1 : Nombre de cas de TEV pour 10 000 femmes sur une période d’un an
On a rapporté des cas extrêmement rares de thrombose dans d’autres vaisseaux sanguins, par ex. au niveau des veines et artères hépatiques, mésentériques, rénales ou rétiniennes chez les utilisatrices de CHC.
Facteurs de risque de TEV
Le risque de complications thromboemboliques veineuses chez les utilisatrices de CHC peut être considérablement accru si d’autres facteurs de risque sont présents, en particulier en présence de facteurs de risque multiples (voir le tableau 2 ci-dessous).
MISOLFA est contre-indiqué chez les femmes présentant de multiples facteurs de risque qui les exposent à un risque élevé de thrombose veineuse (voir rubrique 4.3). Lorsqu’une femme présente plus d’un facteur de risque, l’augmentation du risque peut être supérieure à la somme des risques associés à chaque facteur pris individuellement – dans ce cas, le risque global de TEV doit être pris en compte (voir tableau 2). Si le rapport bénéfice/risque est jugé défavorable, le CHC ne doit pas être prescrit (voir rubrique 4.3).
Tableau 2 : Facteurs de risque de TEV
|
Facteur de risque |
Remarque |
|
Obésité (indice de masse corporelle supérieur à 30 kg/m2). |
Le risque augmente considérablement avec l’IMC. Cette donnée est particulièrement importante à prendre en compte si d’autres facteurs de risque sont également présents. |
|
Immobilisation prolongée (y compris trajets aériens > 4 heures), chirurgie majeure, toute intervention chirurgicale au niveau des jambes ou du bassin, neurochirurgie ou traumatisme majeur)
Remarque : l’immobilisation temporaire, y compris les trajets aériens > 4 heures, peut également constituer un facteur de risque de TEV, en particulier chez les femmes présentant d’autres facteurs de risque. |
Dans ces situations, il est conseillé d’interrompre la prise du dispositif transdermique/de la pilule/de l’anneau (au moins quatre semaines à l’avance en cas de chirurgie programmée) et de la reprendre au plus tôt deux semaines après remobilisation complète. Une autre méthode de contraception doit être utilisée afin d’éviter une grossesse non désirée. Si la prise de MISOLFA n’a pas été interrompue à l’avance, la mise en place d’un traitement antithrombotique doit être envisagée. |
|
Existence d’antécédents familiaux positifs (c.-à-d. thromboembolie veineuse dans la fratrie ou chez un parent, en particulier à un âge relativement jeune, par ex. avant 50 ans) |
Si l’on suspecte une prédisposition héréditaire, la femme devra être adressée à un spécialiste pour avis avant de prendre toute décision concernant l’utilisation d’un CHC. |
|
Autres affections médicales associées à la TEV. |
Cancer, lupus érythémateux disséminé, syndrome hémolytique et urémique, maladies inflammatoires chroniques de l’intestin (maladie de Crohn ou rectocolite hémorragique) et drépanocytose. |
|
Âge. |
En particulier au-delà de 35 ans. |
Il n’existe aucun consensus concernant le rôle éventuel des varices et d’une thrombophlébite superficielle dans l’apparition ou la progression d’une thrombose veineuse.
Il convient d’envisager le risque accru de thromboembolie durant la grossesse, et en particulier au cours des 6 semaines suivant le post-partum (pour des informations relatives à « Fertilité, grossesse et allaitement », voir rubrique 4.6).
Symptômes de TEV (thrombose veineuse profonde et embolie pulmonaire)
Les femmes doivent recevoir pour consigne de consulter un médecin d’urgence si elles développent les symptômes suivants et d’indiquer au professionnel de la santé qu’elles utilisent un CHC.
Les symptômes de la thrombose veineuse profonde (TVP) comprennent :
· gonflement unilatéral de la jambe et/ou du pied ou le long d’une veine de la jambe ;
· douleur ou sensibilité dans une jambe, qui peut n’être ressentie qu’en position debout ou lors de la marche ;
· sensation de chaleur accrue dans la jambe affectée ; rougeur ou modification de la coloration cutanée de la jambe.
Les symptômes de l’embolie pulmonaire (EP) comprennent :
· apparition soudaine et inexpliquée d’un essoufflement ou d’une accélération de la respiration ;
· toux soudaine, éventuellement associée à une hémoptysie ;
· vive douleur au niveau du thorax :
· sensations vertigineuses ou étourdissements sévères
· battements cardiaques rapides ou irréguliers.
Certains de ces symptômes (par ex. « essoufflement », « toux ») ne sont pas spécifiques et peuvent être interprétés à tort comme des signes d’événements plus fréquents ou moins sévères (infections des voies respiratoires, par ex.).
Les autres signes d’une occlusion vasculaire comprennent : douleur soudaine, gonflement et coloration légèrement bleutée d’une extrémité.
Si l’occlusion se produit dans l’œil, les symptômes peuvent débuter sous la forme d’une vision trouble indolore pouvant évoluer vers une perte de la vision. Dans certains cas, la perte de la vision peut survenir presque immédiatement.
Risque de thromboembolie artérielle (TEA)
Des études épidémiologiques ont montré que l’utilisation de CHC est associée à une augmentation du risque de thromboembolie artérielle (infarctus du myocarde) ou d’accident cérébrovasculaire (par ex. accident ischémique transitoire, accident vasculaire cérébral). Les événements thromboemboliques artériels peuvent être fatals.
Facteurs de risque de TEA
Chez les utilisatrices de CHC, le risque de complications thromboemboliques artérielles ou d’accident cérébrovasculaire augmente avec la présence de facteurs de risque (voir tableau). MISOLFA est contre-indiqué chez les femmes présentant un facteur de risque sévère ou de multiples facteurs de risque de TEA, qui les exposent à un risque élevé de thrombose artérielle (voir rubrique 4.3). Lorsqu’une femme présente plus d’un facteur de risque, l’augmentation du risque peut être supérieure à la somme des risques associés à chaque facteur pris individuellement.
Dans ce cas, le risque global doit être pris en compte. Si le rapport bénéfice/risque est jugé défavorable, le CHC ne doit pas être prescrit (voir tableau 3 et rubrique 4.3).
Tableau 3 : Facteurs de risque de TEA
|
Facteur de risque |
Remarque |
|
Âge |
En particulier au-delà de 35 ans. |
|
Tabagisme |
Il doit être conseillé aux femmes de ne pas fumer si elles souhaitent utiliser un CHC. Il doit être fortement conseillé aux femmes de plus de 35 ans qui continuent de fumer d’utiliser une autre méthode de contraception. |
|
Hypertension |
|
|
Obésité (indice de masse corporelle supérieur à 30 kg/m2) |
Le risque augmente considérablement avec l’IMC. Cette donnée est particulièrement importante à prendre en compte chez les femmes présentant d’autres facteurs de risque. |
|
Antécédents familiaux positifs (thromboembolie artérielle survenue dans la fratrie ou chez un parent, en particulier à un âge relativement jeune, par ex. avant 50 ans) |
Si l’on suspecte une prédisposition héréditaire, la patiente devra être adressée à un spécialiste pour avis avant de prendre toute décision concernant l’utilisation d’un CHC. |
|
Migraine |
Une augmentation de la fréquence ou de la sévérité des migraines (qui peut être un signe avant-coureur d’accident cérébrovasculaire) durant la prise de CHC peut justifier son arrêt immédiat. |
|
Autres affections médicales associées à des événements vasculaires indésirables |
Diabète sucré, hyperhomocystéinémie, valvulopathie cardiaque et fibrillation auriculaire, dyslipoprotéinémie et lupus érythémateux disséminé. |
Symptômes de TEA
Les femmes doivent recevoir pour consigne de consulter un médecin d’urgence si elles développent les symptômes suivants et d’indiquer au professionnel de la santé qu’elles utilisent un CHC.
Les symptômes d’un accident cérébrovasculaire comprennent :
· engourdissement soudain ou faiblesse soudaine au niveau du visage, des bras ou des jambes, en particulier d’un côté du corps ;
· difficulté soudaine à marcher, étourdissements, perte d’équilibre ou de coordination ;
· confusion soudaine, difficulté d’élocution ou de compréhension ;
· perte soudaine de la vision, au niveau d’un œil ou des deux yeux ;
· céphalée soudaine, sévère ou prolongée, sans cause connue ;
· perte de connaissance ou évanouissement avec ou sans crise convulsive.
Des symptômes temporaires suggèrent qu’il s’agit d’un accident ischémique transitoire (AIT).
Les symptômes d’un infarctus du myocarde (IM) comprennent :
· douleur, gêne, pression, lourdeur, sensation d’oppression ou de volume dans la poitrine, le bras ou sous le sternum ;
· sensation de gêne irradiant dans le dos, la mâchoire, la gorge, le bras, l’estomac ;
· sensation de pesanteur, d’indigestion ou de suffocation ;
· transpiration, nausées, vomissements ou étourdissements ;
· faiblesse extrême, anxiété ou essoufflement ;
· battements cardiaques rapides ou irréguliers.
Tumeurs
Sein
Une méta-analyse de 54 études épidémiologiques a montré que les femmes utilisant actuellement des contraceptifs oraux combinés présentent un risque relatif légèrement accru (RR = 1,24) de cancer du sein. Cette augmentation du risque diminue progressivement pour atteindre à nouveau le risque de base lié à l’âge dans les 10 ans après l’arrêt de l’utilisation du contraceptif oral combiné. Le cancer du sein étant rare chez les femmes âgées de moins de 40 ans, le nombre de diagnostics supplémentaires de cancer du sein chez les utilisatrices de contraceptifs oraux combinés ou chez celles qui en ont pris dans le passé, est faible comparé au risque global de développer un cancer du sein.
Col de l’utérus
Un petit nombre d’études épidémiologiques indiquent que l’utilisation à long terme de contraceptifs hormonaux par des femmes infectées par le virus du papillome humain (VPH) constitue un facteur de risque pour le développement du cancer de l’utérus. Toutefois, on ignore à ce jour dans quelle mesure d’autres facteurs (par ex. différences au niveau du nombre de partenaires sexuels ou de l’utilisation de méthodes contraceptives barrière) influencent le développement éventuel de ce cancer (voir également rubrique 4.4).
Foie
Dans de très rares cas, des adénomes hépatiques bénins ont été signalés chez des utilisatrices de contraceptifs oraux combinés. Dans quelques cas isolés, ces tumeurs ont présenté une rupture et induit des hémorragies intra-abdominales, qui ont menacé la vie des patientes. Chez les utilisatrices de contraceptifs oraux combinés, la présence d’une tumeur du foie doit être envisagée dans le diagnostic différentiel en cas de douleur épigastrique sévère, d’hépatomégalie ou de signes d’hémorragie intra-abdominale.
Les études ont mis en évidence un risque accru de développer un carcinome hépatocellulaire en cas d’utilisation prolongée de contraceptifs oraux combinés. Ce type de tumeur est cependant extrêmement rare.
Autres affections
Hypertension
Des cas d’augmentation de la tension artérielle ont été rapportés chez des utilisatrices de contraceptifs oraux combinés, en particulier chez les femmes plus âgées et lors d’une utilisation prolongée. Les études ont montré que l’incidence de l’hypertension augmente avec la teneur en progestatif. Les femmes présentant des antécédents de maladies dues à l’hypertension ou certaines maladies rénales doivent recevoir pour consigne d’utiliser une autre méthode contraceptive (voir rubriques 4.3 et 4.4).
Chloasma
Un chloasma peut survenir, surtout chez les femmes ayant des antécédents de chloasma durant la grossesse. Les femmes ayant une tendance au chloasma doivent donc éviter toute exposition au soleil et aux rayons ultraviolets durant la prise de contraceptifs oraux combinés.
Angio-œdème héréditaire
Les oestrogènes exogènes peuvent induire ou aggraver les symptômes de l’angio-oedème héreditaire ou acquis.
Saignements irréguliers
Des hémorragies intermenstruelles et du spotting ont été observés chez les utilisatrices de contraceptifs oraux combinés, en particulier au cours des premiers mois de la prise des comprimés. Par conséquent, l’évaluation de ces hémorragies intermenstruelles ne sera utile que lorsque le contraceptif a été pris pendant environ trois mois. Le type et la dose du progestatif peuvent jouer un rôle déterminant. Si des saignements irréguliers persistent ou apparaissent après des cycles précédemment réguliers, il faut envisager des causes non hormonales ; et, en présence de tout saignement vaginal inhabituel, on prendra les mesures diagnostiques appropriées afin d’exclure toute tumeur et grossesse. Lorsque ces deux éventualités ont été exclues, l’utilisatrice peut continuer à prendre MISOLFA ou passer à un autre contraceptif hormonal. Les hémorragies intermenstruelles peuvent être le signe d’une réduction de l’efficacité contraceptive (voir rubriques 4.2 et 4.5).
Certaines utilisatrices peuvent ne pas présenter d’hémorragies de privation durant la période sans comprimés. Si MISOLFA a été pris avant la première hémorragie de privation manquée contrairement aux instructions figurant à la rubrique 4.2, ou si aucune hémorragie de privation ne survient au cours des deux cycles suivants, il faut exclure toute grossesse avant que l’utilisatrice ne continue à prendre MISOLFA.
Après l’arrêt de contraceptifs hormonaux, il faut parfois attendre une période relativement longue avant que le cycle ne redevienne normal.
Efficacité réduite
L’efficacité contraceptive de MISOLFA peut être réduite
· en cas d’oubli de comprimés (voir rubrique 4.2),
· en cas de vomissements ou de diarrhée (voir rubrique 4.2),
· en cas de prise concomitante d’autres médicaments (voir rubrique 4.5).
Lorsque des contraceptifs oraux combinés sont pris en association avec le millepertuis, il est recommandé d’utiliser une méthode de contraception non hormonale complémentaire (voir rubrique 4.5).
L’état dépressif et la dépression sont des effets indésirables bien connus liés à l’utilisation de contraceptifs hormonaux (voir rubrique 4.8). La dépression peut être grave et constitue un facteur de risque bien connu de comportement suicidaire et de suicide. Il convient de conseiller aux femmes de contacter leur médecin en cas de changements d’humeur et de symptômes dépressifs, y compris peu de temps après le début du traitement.
Examen médical/consultation médicale
Avant d’instaurer ou de réinstaurer un traitement par MISOLFA, il convient de réaliser une anamnèse médicale complète (dont une anamnèse familiale) et d’exclure toute grossesse. La tension artérielle doit être mesurée et un examen clinique doit être réalisé, en se concentrant sur les contre-indications (voir rubrique 4.3) et les mises en garde (voir rubrique 4.4). Il est également important de donner à la patiente des informations sur la thrombose veineuse et artérielle, notamment sur le risque associé à la prise de MISOLFA en comparaison avec d’autres CHC, les symptômes de TEV et de TEA, les facteurs de risque connus et la conduite à tenir en cas de suspicion de thrombose.
La femme doit également être invitée à lire attentivement la notice et à suivre les conseils prodigués. La fréquence et la nature des examens doivent être déterminées sur la base des directives établies adaptées de manière individuelle à chaque femme.
Il faut avertir les femmes que les contraceptifs oraux ne protègent pas contre les infections à VIH ni contre les autres maladies sexuellement transmissibles.
Ce médicament est contre-indiqué chez les patientes présentant une intolérance au galactose, une galactosémie, un déficit en lactase de Lapp ou une malabsorption du glucose-galactose (maladies héréditaires rares).
4.5. Interactions avec d'autres médicaments et autres formes d'interactions 
Remarque : les informations de prescription des produits concomitants doivent être consultées pour connaître les interactions éventuelles.
· Influence d’autres médicaments sur MISOLFA
Des interactions peuvent se produire avec des médicaments qui induisent les enzymes microsomales. Cela peut entraîner une augmentation de la clairance des hormones sexuelles et provoquer une hémorragie de privation et/ou l’échec du contraceptif.
Prise en charge
L’induction enzymatique peut déjà s’observer après quelques jours de traitement. Elle est généralement à son maximum au bout de quelques semaines. Après l’arrêt du traitement, l’induction enzymatique peut se poursuivre pendant environ 4 semaines.
Traitement de courte durée
Les femmes sous traitement par inducteurs enzymatiques doivent temporairement utiliser une méthode barrière ou une autre méthode contraceptive en plus du COC. La méthode barrière doit s’utiliser pendant toute la durée du traitement concomitant ainsi que pendant les 28 jours qui suivent l'arrêt de celui-ci.
Si le traitement se poursuit après que la patiente arrive à la fin de sa plaquette de COC, elle devra commencer la plaquette suivante directement après la précédente sans respecter la semaine habituelle sans comprimés.
Traitement de longue durée
Pour les femmes sous traitement chronique par des substances actives ayant un effet inducteur sur les enzymes hépatiques, une autre méthode contraceptive fiable, non hormonale, est recommandée.
Les interactions suivantes ont été rapportées dans la littérature.
Substances augmentant la clairance des COC (diminution de l’efficacité des COC par induction enzymatique), par exemple :
Barbituriques, bosentan, carbamazépine, phénytoïne, primidone, rifampicine et médicaments contre le VIH ritonavir, névirapine et éfavirenz et éventuellement aussi felbamate, griséofulvine, oxcarbazépine, topiramate et produits contenant du millepertuis (Hypericum perforatum).
Substances dont les effets sur la clairance des COC sont variables :
Lors de leur administration concomitante avec un COC, beaucoup d’associations d’inhibiteurs de la protéase du VIH et d’inhibiteurs de la transcriptase inverse non nucléosidiques, y compris les associations avec inhibiteurs du VHC, peuvent augmenter ou diminuer les concentrations plasmatiques d’œstrogènes ou de progestogènes. L’effet final de ces modifications peut parfois revêtir une importance clinique.
En conséquence, les informations de prescription des médicaments contre le VIH ou le VHC pris simultanément doivent être consultées pour connaître les interactions éventuelles et les recommandations. En cas de doute, une méthode de contraception barrière supplémentaire doit être utilisée par les femmes sous traitement par inhibiteurs de protéases ou inhibiteurs de transcriptase inverse non nucléosidiques.
Substances diminuant la clairance des COC (inhibiteurs enzymatiques) :
La pertinence clinique des interactions potentielles avec les inhibiteurs enzymatiques n’est pas connue.
L’administration concomitante d’inhibiteurs puissants du CYP3A4 peut augmenter les concentrations plasmatiques des œstrogènes ou des progestogènes ou des deux.
Il a été montré que des doses d’étoricoxib allant de 60 à 120 mg/jour peuvent augmenter les concentrations plasmatiques d’éthinylestradiol d’un facteur 1,4 à 1,6, respectivement, lorsqu’elles sont administrées en même temps qu’un contraceptif hormonal combiné contenant 0,035 mg d’éthinylestradiol.
· Effets de MISOLFA sur d’autres médicaments
Les contraceptifs oraux combinés peuvent affecter le métabolisme de certaines autres substances actives. Ainsi, les concentrations plasmatiques et tissulaires peuvent augmenter (par ex. ciclosporine) ou diminuer (par ex. lamotrigine).
Des données cliniques suggèrent que l’éthinylestradiol inhibe la clairance des substrats du cytochrome CYP1A2, conduisant à une augmentation légère (par ex. théophylline) ou modérée (par ex. tizanidine) de leurs concentrations plasmatiques.
Interactions pharmacodynamiques
Au cours des essais cliniques menés chez de patients traités pour une infection par le virus de l’hépatite C (VHC) et recevant des médicaments contenant ombitasvir/paritaprévir/ritonavir et dasabuvir, avec ou sans ribavirine, il a été observé des augmentations de transaminase (ALAT) supérieures à 5 fois la limite supérieure de la normale (LSN), significativement plus fréquentes chez les femmes utilisant des médicaments contenant de l’éthinylestradiol, tel que les contraceptifs hormonaux combinés (CHC). De plus, chez les patients traités par le glécaprévir/pribrentasvir ou sofosbuvir/velpatasvir/voxilaprévir, des augmentations des ALAT ont été observées chez les femmes utilisant des médicaments contenant de l’éthinylestradiol tel que les CHC (voir rubrique 4.3)
C’est pourquoi les utilisatrices de MISOLFA doivent adopter un autre mode de contraception (par ex. un contraceptif contenant uniquement un progestatif ou une méthode non hormonale) avant de commencer ces traitements combinés. MISOLFA peut être repris 2 semaines après l’arrêt de ces traitements combinés.
Analyses de laboratoire
L’utilisation de stéroïdes contraceptifs peut influencer les résultats de certains tests de laboratoire, y compris les paramètres biochimiques de la fonction hépatique, thyroïdienne, surrénale ou rénale ; les concentrations plasmatiques de protéines (de transport), comme la transcortine et les fractions de lipides/lipoprotéines, les paramètres du métabolisme des glucides et les paramètres de coagulation et fibrinolyse. Les modifications restent généralement comprises dans les valeurs normales du laboratoire.
4.6. Fertilité, grossesse et allaitement 
Grossesse
MISOLFA est contre-indiqué pendant la grossesse.
La présence d’une grossesse doit être exclue avant que la femme ne commence à prendre ce médicament. Si une grossesse survient pendant la prise de MISOLFA, le médicament doit être arrêté immédiatement.
Le risque accru de TEV durant la période du post-partum doit être pris en compte lors de la réinstauration du traitement par MISOLFA (voir rubriques 4.2 et 4.4).
Selon de nombreuses études épidémiologiques, les enfants de femmes ayant pris des contraceptifs oraux combinés avant la grossesse ne sont pas davantage exposés à un risque de malformations ; la plupart des études épidémiologiques menées à ce jour n’ont pas mis en évidence d’effets tératogènes en cas de prise accidentelle de contraceptif oraux combinés dans les premiers stades de la grossesse. De telles études n’ont pas été menées avec MISOLFA.
Les données disponibles concernant l’utilisation de MISOLFA durant la grossesse sont trop limitées pour pouvoir formuler des conclusions concernant les effets négatifs de MISOLFA sur la grossesse, la santé du fœtus ou celle du nouveau-né. Il n’existe à ce jour aucune donnée pertinente de nature épidémiologique.
Des études effectuées chez l’animal ont mis en évidence des effets délétères pendant la grossesse et l’allaitement (voir rubrique 5.3). Sur la base des résultats obtenus dans les études effectuées chez l’animal, on ne peut exclure l’existence d’un effet hormonal indésirable des substances actives. Toutefois, l’expérience générale acquise avec les contraceptifs oraux combinés durant la grossesse n’a pas mis en évidence d’effets indésirables chez l’homme.
Allaitement
MISOLFA ne doit pas être utilisé pendant l’allaitement car la production de lait peut être réduite et de petites quantités de substances actives peuvent être excrétées dans le lait maternel. Si possible, des méthodes de contraception non hormonales doivent être utilisées jusqu’à ce que la mère allaitante ait complètement sevré son enfant.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines 
Les effets sur l’aptitude à conduire des véhicules et à utiliser des machines n’ont pas été étudiés.
Voir rubrique 4.4 pour les effets indésirables graves rapportés chez les utilisatrices.
Les fréquences des effets indésirables observés dans les études cliniques avec l’association 2 mg de dienogest/0,03 mg d’éthinylestradiol pour la contraception orale et pour le traitement de l’acné modérément sévère (N = 4 942) sont résumées dans le tableau ci-dessous.
Les catégories de fréquence des effets indésirables sont définies ainsi : très fréquent (≥ 1/10), fréquent (≥ 1/100, < 1/10), peu fréquent (≥ 1/1 000, < 1/100), rare (≥ 1/10 000, <1 /1 000), très rare (< 1/10 000) et fréquence indéterminée (ne peut être estimée sur la base des données disponibles).
Au sein de chaque groupe de fréquence, les effets indésirables sont présentés par ordre de gravité décroissante.
|
Classe de systèmes d’organes |
Fréquent |
Peu fréquent |
Rare |
Fréquence indéterminée |
|
Infections et infestations |
|
Vaginite/vulvo-vaginite candidose vaginale ou infections fongiques vulvo-vaginales |
Salpingo-oophorite, infections des voies urinaires, cystite, mastite, cervicite, infections fongiques, candidose, herpès labial, grippe, bronchite, sinusite, infection des voies respiratoires supérieures, infections virales |
Exacerbation des symptômes de l’angio-œdème héréditaire ou acquis |
|
Tumeurs bénignes, malignes et non précisées (incl. kystes et polypes) |
|
|
Fibromes utérins, lipome du sein |
|
|
Affections hématologiques et du système lymphatique |
|
|
Anémie |
|
|
Affections du système immunitaire |
|
|
Réactions allergiques |
|
|
Affections endocriniennes |
|
|
Virilisme |
|
|
Troubles du métabolisme et de la nutrition |
|
Augmentation de l’appétit |
Anorexie |
|
|
Affections psychiatriques |
|
Humeur dépressive |
Dépression, troubles mentaux, insomnies, troubles du sommeil, agressivité |
Modifications de l’humeur, diminution de la libido, augmentation de la libido |
|
Affections du système nerveux |
Céphalées |
Étourdissements, migraine |
AVC ischémique, troubles cérébro-vasculaires, dystonie |
|
|
Affections oculaires |
|
|
Sécheresse oculaire, irritation oculaire, oscillopsie, détérioration de la vue |
Intolérance aux lentilles de contact |
|
Affections de l’oreille et du labyrinthe |
|
|
Surdité soudaine, acouphènes, vertige, diminution de l’acuité auditive |
|
|
Affections cardiaques |
|
|
Affections cardiovasculaires, tachycardie1 |
|
|
Affections vasculaires |
|
Hypertension, hypotension |
Thromboembolie veineuse (TEV), Thromboembolie artérielle (TEA), thrombophlébite, embolie pulmonaire, hypertension diastolique, trouble orthostatique, bouffées de chaleur, varices, gêne ou douleur au niveau de veines |
|
|
Affections respiratoires, thoraciques et médiastinales |
|
|
Asthme, hyperventilation |
|
|
Affections gastro-intestinales |
|
Douleur abdominale2, nausées, vomissements, diarrhée |
Gastrite, entérite, dyspepsie |
|
|
Affections hépatobiliaires |
|
|
|
Augmentation des transaminases |
|
Affections de la peau et du tissu sous-cutané |
|
Acné, alopécie, éruption cutanée3, prurit4, urticaire |
Dermatite allergique, dermatite atopique/ neurodermatite, eczéma, psoriasis, hyperhidrose, chloasma, anomalies pigmentaires/hyperpigmentation, séborrhée, pellicules, hyperpilosité, modifications cutanées, réactions cutanées, peau d’orange, angiome stellaire |
Érythème noueux, érythème polymorphe |
|
Affections musculo-squelettiques et systémiques |
|
|
Dorsalgies, affections musculo-squelettiques, myalgie, douleur dans les extrémités |
|
|
Affections des organes de reproduction et du sein |
Douleur thoracique5 |
Hémorragies de privation irrégulières6, hémorragies intermenstruelles7, hypertrophie mammaire8, œdème mammaire, dysménorrhée, sécrétions vaginales, kystes ovariens, douleur pelvienne |
Dysplasie cervicale, kystes des annexes de l’utérus, douleur au niveau des annexes de l’utérus, kystes mammaires, mastopathie fibrokystique, dyspareunie, galactorrhée, troubles menstruels |
Sécrétion mammaire |
|
Troubles généraux |
|
Fatigue9 |
Douleur thoracique, œdème périphérique, maladies pseudo-grippales, inflammation, pyrexie, irritabilité |
Rétention hydrique |
|
Investigations |
|
Variations du poids10 |
Élévation des triglycérides sanguins, hypercholestérolémie |
|
|
Affections congénitales, familiales et génétiques |
|
|
Manifestation d’un sein accessoire asymptomatique |
|
1 y compris accélération de la fréquence cardiaque
2 y compris douleur dans le haut et le bas de l’abdomen, gêne/ballonnement
3 y compris éruption cutanée maculaire
4 y compris prurit généralisé
5 y compris gêne thoracique et sensibilité thoracique
6 y compris ménorragie, hypoménorrhée, oligoménorrhée et aménorrhée
7 consistant en hémorragie vaginale et métrorragie
8 y compris œdème mammaire/œdème
9 y compris asthénie et malaise général
10 y compris prise de poids, perte de poids ou fluctuation de poids
Pour décrire un effet indésirable particulier, les termes MedDRA les plus appropriés ont été utilisés. Les synonymes ou affections associées ne sont pas mentionnés, mais doivent également être envisagés.
Description d’effets indésirables sélectionnés
Un risque accru d’événements thrombotiques et thromboemboliques artériels et veineux, dont des infarctus du myocarde, des accidents vasculaires cérébraux, des accidents ischémiques transitoires, des thromboses veineuses et des embolies pulmonaires, a été observé chez les femmes utilisant des CHC ; ce risque est décrit plus en détail à la rubrique 4.4.
Les effets indésirables graves suivants, rapportés chez des femmes utilisant des contraceptifs oraux combinés, sont également décrits à la rubrique 4.4 :
· hypertension
· hypertriglycéridémie
· modifications de la tolérance au glucose ou effet sur la résistance à l’insuline périphérique
· tumeurs hépatiques (bénignes et malignes)
· dysfonction hépatique
· chloasma
· chez les femmes qui présentent un angio-œdème héréditaire, des œstrogènes administrés par voie exogène peuvent induire ou exacerber les symptômes de l’angio-œdème
· survenue ou aggravation de maladies, dont le lien avec l’utilisation de contraceptifs oraux combinés n’est pas établi à ce jour: ictère et/ou prurit en rapport avec une cholestase, formation de calculs biliaires, porphyrie, lupus érythémateux disséminé, syndrome hémolytique et urémique, chorée de Sydenham, herpès gestationis, perte d’audition liée à une otosclérose, maladie de Crohn, rectocolite hémorragique, cancer du col de l’utérus.
La fréquence du diagnostic de cancer du sein chez les utilisatrices de contraceptifs oraux combinés est légèrement accrue. L’incidence du cancer du sein étant faible chez les femmes âgées de moins de 40 ans, le nombre de cancers supplémentaires diagnostiqués est relativement faible comparé au risque global. On ignore s’il existe une relation de causalité avec l’utilisation de contraceptifs oraux combinés. Pour de plus amples informations, voir rubriques 4.3 et 4.4.
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr/.
Les symptômes d’un surdosage de contraceptifs oraux combinés chez les adultes et les enfants comprennent les manifestations suivantes : nausées, vomissements, sensibilité mammaire, stupeur, douleur abdominale, somnolence/fatigue; chez les femmes et les jeunes filles, des saignements vaginaux peuvent survenir. Il n’existe aucun antidote spécifique. Le traitement est symptomatique.
5. PROPRIETES PHARMACOLOGIQUES 
5.1. Propriétés pharmacodynamiques 
MISOLFA est un contraceptif oral combiné doté d’un effet anti-androgène, contenant de l’éthinylestradiol (œstrogène) et du diénogest (progestatif).
L’effet contraceptif de MISOLFA repose sur l’interaction de divers facteurs, dont les plus importants sont l’inhibition de l’ovulation et les modifications des sécrétions vaginales. L’index de Pearl non-ajusté est 0,454 (intervalle de confiance à 95% : 0,701) et l’index de Pearl ajusté est 0,182 (intervalle de confiance à 95% : 0,358).
L’effet anti-androgène de l’association composée d’éthinylestradiol et de diénogest repose en partie sur la diminution de la concentration d’androgènes dans le sérum. Une étude multicentrique menée avec MISOLFA a démontré une amélioration notable des symptômes d’acné légère à modérément sévère et un effet favorable sur la séborrhée.
ETHINYLESTRADIOL
L’éthinylestradiol est un œstrogène synthétique puissant, actif par voie orale. Comme l’œstradiol naturel, l’éthinylestradiol exerce une action proliférative sur l’épithélium des organes génitaux féminins. Il stimule la production de mucus cervical, en réduit la viscosité et en augmente la fibrosité. L’éthinylestradiol favorise la croissance des canaux lactifères et inhibe la lactation. Il stimule également la rétention de liquide extracellulaire. L’éthinylestradiol influence les paramètres lipidiques et le métabolisme glucidique, l’hémostase, le système rénine-angiotensine-aldostérone et les protéines de liaison sériques.
DIÉNOGEST
Le diénogest est un dérivé de la 19-nortestostérone qui possède une affinité in vitro 10 à 30 fois plus faible pour les récepteurs de la progestérone que les autres progestatifs synthétiques. Les données in vivo recueillies chez l’animal ont montré un puissant effet gestagène ainsi qu’un effet anti-androgène. Le diénogest ne possède pas d’effet androgène, minéralocorticoïde ou glucocorticoïde significatif in vivo.
La dose nécessaire pour inhiber l’ovulation avec le diénogest en monothérapie s’est avérée être de 1 mg/jour.
5.2. Propriétés pharmacocinétiques 
Absorption
Après ingestion, l’éthinylestradiol est rapidement et totalement absorbé. Des concentrations sériques maximales d’environ 67 pg/ml sont atteintes environ 1,5 à 4 heures après l’administration de MISOLFA comprimé pelliculé. Au cours de l’absorption et de l’effet de premier passage hépatique, l’éthinylestradiol est largement métabolisé, ce qui donne lieu à une biodisponibilité orale moyenne de 44 % environ.
Distribution
L’éthinylestradiol se lie fortement, mais de manière non spécifique, à l’albumine sérique (environ 98 %) et induit une augmentation des taux sériques de la globuline fixant les hormones sexuelles (SHBG). Le volume de distribution absolu de l’éthinylestradiol est de 2,8 à 8,6 l/kg.
Biotransformation
L’éthinylestradiol est métabolisé par conjugaison présystémique dans la muqueuse de l’intestin grêle et dans le foie. L’éthinylestradiol est principalement métabolisé par hydroxylation aromatique ; ce processus s’accompagne de la formation de différents métabolites hydroxylés et méthylés, qui se retrouvent dans le sérum sous la forme de métabolites libres et de dérivés glucuronoconjugués et sulfoconjugués. L’éthinylestradiol fait l’objet d’une circulation entérohépatique.
Élimination
Les concentrations sériques d’éthinylestradiol diminuent en deux phases, caractérisées par des demi-vies respectives de l’ordre d’environ 1 heure et de 10-20 heures.
L’éthinylestradiol n’est pas excrété sous forme inchangée. Ses métabolites sont éliminés dans les urines et dans la bile selon un rapport 4:6.
DIENOGEST
Absorption
Le diénogest est rapidement et quasi complètement absorbé après administration orale. Environ 2,5 heures après l’ingestion d’un comprimé pelliculé unique de MISOLFA, des concentrations sériques maximales de 51 ng/ml sont atteintes. En association avec l’éthinylestradiol, sa biodisponibilité absolue s’est avérée être d’environ 96 %.
Distribution
Le diénogest se lie à l’albumine sérique mais ne se lie ni à la SHBG, ni à la transcortine (CBG). Environ 10 % de la concentration sérique totale de substance active se retrouvent sous la forme de stéroïde non lié, et 90 % sont liés de manière non spécifique à l’albumine. Le volume apparent de distribution du diénogest varie entre 37 et 45 litres.
Biotransformation
Le diénogest est principalement métabolisé par hydroxylation et par conjugaison, pour produire des métabolites largement inactifs d’un point de vue endocrinien. Ces métabolites sont très rapidement éliminés du plasma. Ainsi, excepté le diénogest sous forme inchangée, aucune quantité significative de ses métabolites ne peut être détectée dans le plasma humain. Après une dose unique, la clairance totale (Cl/F) est de 3,6 l/h.
Élimination
Les concentrations sériques de diénogest chutent, avec une demi-vie d’environ 9 heures. Seules des quantités négligeables de diénogest sont excrétées par voie rénale sous forme inchangée. Après administration d’une dose de 0,1 mg par kg de poids corporel, le rapport excrétion rénale/fécale est de 3:2. Environ 86 % de la dose administrée est éliminée dans les 6 jours, la principale fraction (42 %) étant excrétée dans les 24 heures, principalement dans les urines.
Etat d’équilibre
La pharmacocinétique du diénogest n’est pas influencée par les taux de SHBG. En cas d’utilisation quotidienne, la concentration sérique de diénogest augmente d’un facteur 1,5 environ et l’état d’équilibre est atteint après 4 jours de traitement.
5.3. Données de sécurité préclinique 
Le profil de toxicité de l’éthinylestradiol est bien connu.
Les résultats des études effectuées sur l’animal avec les œstrogènes ont une valeur prédictive limitée pour l’utilisation chez l’homme, en raison des différences importantes existant entre les espèces.
Les études effectuées chez l’animal ont mis en évidence un effet embryolétal à une posologie relativement faible; par ailleurs, des malformations du tractus urogénital et une féminisation des fœtus mâles ont été observées.
Les études de toxicologiques des fonctions de reproduction menées avec le diénogest ont mis en évidence des effets gestagènes typiques, tels qu’une augmentation des anomalies pré- et post-implantation, un allongement de la période de gestation et une augmentation de la mortalité néonatale de la progéniture. Lors de l’administration de doses élevées de diénogest dans les dernières phases de gestation et durant la lactation, une altération de la fertilité a été observée dans la progéniture.
Les données non cliniques issues des études conventionnelles de toxicologie en administration répétée, génotoxicité et cancérogénèse n’ont pas révélé de risque particulier pour l’homme, hormis les informations qui sont déjà mentionnées dans d’autres rubriques du RCP et qui s’appliquent généralement à l’administration de contraceptifs oraux combinés.
Lactose monohydraté, amidon de maïs, povidone (30), glycolate d’amidon sodique (type A), stéarate de magnésium.
Pelliculage :
Hypromellose, hydroxypropylcellulose, talc, huile de coton hydrogénée, dioxyde de titane (E 171).
3 ans
6.4. Précautions particulières de conservation 
A conserver à une température ne dépassant pas 30°C.
6.5. Nature et contenu de l'emballage extérieur 
Plaquettes (PVC/PVDC aluminium) de 21 comprimés pelliculés. Boite de 1, 3 ou 6 plaquettes.
Toutes les présentations peuvent ne pas être commercialisées.
6.6. Précautions particulières d’élimination et de manipulation 
Pas d’exigences particulières.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE 
36 RUE BRUNEL
75017 PARIS
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE 
· 34009 301 050 9 2 : 21 comprimés sous plaquette (PVC/PVDC/Aluminium).
· 34009 301 585 2 4 : 21 comprimés sous plaquette (PVC/PVDC/Aluminium). Boîte de 3.
· 34009 550 370 6 4 : 21 comprimés sous plaquette ((PVC/PVDC/Aluminium). Boîte de 6.
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION 
[à compléter ultérieurement par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE 
[à compléter ultérieurement par le titulaire]
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES 
Liste I.
|
| Plan du site | Accessibilité | Contact | Téléchargement | Declaration de confidentialité | Service-Public.fr | Legifrance | Gouvernement.fr |