Dernière mise à jour le 01/12/2025
AZZALURE, 125 unités Speywood, poudre pour solution injectable
Indications thérapeutiques
Classe pharmacothérapeutique : autres myorelaxants à action périphérique - code ATC : M03AX01.
Azzalure contient une substance, la toxine botulinique de type A, qui provoque une relaxation des muscles. Azzalure agit au niveau de la jonction entre les nerfs et les muscles, en empêchant la libération par les terminaisons nerveuses d'un « messager » chimique, appelé l'acétylcholine, ce qui inhibe la contraction musculaire. Cette relaxation musculaire est temporaire et disparaît progressivement.
Certaines personnes ressentent très mal l'apparition de rides au niveau du visage. Azzalure peut être utilisé chez l'adulte de moins de 65 ans pour corriger temporairement les rides glabellaires modérées à sévères (les rides verticales entre les sourcils obtenues lors de leur froncement) et les rides canthales latérales (pattes d’oie).
Présentations
> 1 flacon(s) en verre
Code CIP : 393 419-2 ou 34009 393 419 2 7
Déclaration de commercialisation : 28/04/2009
Cette présentation n'est pas agréée aux collectivités
> 2 flacon(s) en verre
Code CIP : 393 420-0 ou 34009 393 420 0 9
Déclaration de commercialisation : 25/05/2009
Cette présentation n'est pas agréée aux collectivités
Service médical rendu (SMR)
Pas de SMR disponible pour ce médicament ( plus d'informations dans l'aide )
Amélioration du service médical rendu (ASMR)
Pas d'ASMR disponible pour ce médicament (plus d'informations dans l'aide )
Autres informations
- Titulaire de l'autorisation : IPSEN PHARMA
- Conditions de prescription et de délivrance :
- liste I
- médicament soumis à prescription médicale restreinte
- prescription réservée aux spécialistes et services CHIRURGIE DE LA FACE ET DU COU
- prescription réservée aux spécialistes et services CHIRURGIE MAXILLO-FACIALE
- prescription réservée aux spécialistes et services CHIRURGIE PLASTIQUE, RECONSTRUCTRICE ET ESTHETIQUE
- prescription réservée aux spécialistes et services DERMATOLOGIE
- prescription réservée aux spécialistes et services OPHTALMOLOGIE
- réservé à l'usage professionnel
- Statut de l'autorisation : Valide
- Type de procédure : Procédure décentralisée
- Code CIS : 6 686 521 1
ANSM - Mis à jour le : 18/06/2025
AZZALURE, 125 unités Speywood, poudre pour solution injectable
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Toxine botulinique de type A* : quantité correspondant à 125 unités Speywood (U)** pour un flacon.
*Complexe toxine A de Clostridium botulinum - hémagglutinine.
**Les unités Speywood d'Azzalure sont spécifiques à la préparation et ne sont pas interchangeables avec d'autres préparations de toxine botulinique.
Pour la liste complète des excipients, voir rubrique 6.1.
Poudre pour solution injectable.
La poudre est blanche.
4.1. Indications thérapeutiques
Azzalure est indiqué dans la correction temporaire :
· des rides glabellaires modérées à sévères (rides verticales intersourcilières) observées lors du froncement maximum des sourcils, et/ou,
· des rides canthales latérales (pattes d’oie) observées lors d’un sourire forcé,
chez l'adulte de moins de 65 ans, lorsque la sévérité de ces rides entraîne un retentissement psychologique important chez le patient.
4.2. Posologie et mode d'administration
Les unités de toxine botulinique sont différentes selon les produits. Les unités Speywood d’Azzalure sont spécifiques à cette spécialité et ne sont pas interchangeables avec d’autres préparations de toxine botulinique.
Population pédiatrique
La sécurité et l’efficacité d’Azzalure chez les sujets âgés de moins de 18 ans n’ont pas été établies. L’utilisation d’Azzalure n’est pas recommandée chez les patients âgés de moins de 18 ans.
Mode d’administration
Azzalure doit être administré uniquement par des médecins ayant les compétences adéquates et l’expérience de l’utilisation de ce traitement, et disposant du matériel approprié.
Après reconstitution, Azzalure doit être utilisé uniquement pour le traitement d’un seul patient, au cours d’une seule séance d’injection.
Pour les instructions concernant la reconstitution du médicament avant administration, voir la rubrique 6.6.
La peau doit au préalable être nettoyée de tout maquillage et désinfectée avec un antiseptique local.
Les injections intramusculaires doivent être effectuées à l’aide d’une aiguille stérile de diamètre adapté.
L’intervalle de temps entre deux traitements dépend de la réponse individuelle du patient, après une évaluation par le médecin.
L’intervalle entre deux traitements par Azzalure ne doit pas être inférieur à trois mois.
Les points d’injection recommandés pour les rides glabellaires (cercles blancs) et pour les rides canthales latérales (cercles noirs) sont décrits ci-dessous :
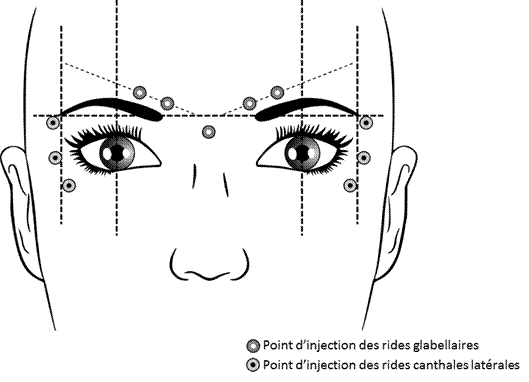
Rides glabellaires
La dose totale recommandée est de 50 unités Speywood d’Azzalure, à diviser en 5 sites d’injection, c’est-à-dire une injection intramusculaire de 10 unités Speywood à effectuer dans chacun des 5 sites suivants : 2 injections dans chacun des muscles corrugator et une injection dans le muscle procerus près de l’angle nasofrontal, comme illustré dans la figure ci-dessus.
Le repérage anatomique peut être facilité s’il est effectué et palpé lors du froncement maximum des sourcils. Avant injection, il faut placer fermement le pouce ou l’index sous le rebord orbitaire afin d’éviter l’extravasation sous le rebord orbitaire. L’aiguille doit être orientée vers le haut et vers la ligne médiane lors de l’injection. Pour diminuer le risque de ptosis, il faut éviter les injections à proximité du muscle releveur de la paupière supérieure, en particulier chez les patients dotés de puissants complexes abaisseurs des sourcils (depressor supercilii). Les injections dans le muscle corrugator doivent être effectuées dans la partie centrale du muscle, à au moins 1 cm au-dessus du rebord orbitaire.
Les études cliniques ont démontré un effet optimal sur les rides glabellaires pendant une durée allant jusqu’à 4 mois après l’injection. Certains patients étaient encore répondeurs au traitement 5 mois après l’injection (voir rubrique 5.1).
Rides canthales latérales
La dose recommandée de chaque côté est de 30 unités Speywood d’Azzalure, à diviser en 3 sites d’injection ; c’est-à-dire une injection intramusculaire de 10 unités Speywood à effectuer dans chacun des points d’injection. L’injection doit être réalisée avec un angle de 20-30° par rapport à la surface de la peau et très superficiellement. Tous les points d’injection doivent se situer au niveau de la partie externe du muscle orbicularis oculi et suffisamment loin du rebord orbitaire (environ 1 - 2 cm) comme illustré dans la figure ci-dessus.
Le repérage anatomique peut être facilité s’il est effectué par l’observation et la palpation lors d’un sourire forcé. Des précautions doivent être prises pour éviter d’injecter les muscles zygomatocus major/minor afin d’éviter une déformation de la bouche et un sourire asymétrique.
Informations générales
En cas d’échec thérapeutique ou de diminution de l’effet après des injections répétées, il convient d’envisager d’autres méthodes thérapeutiques. En cas d’échec du traitement après la première séance, il y a lieu :
· d’analyser les causes de l’échec : sélection inappropriée des muscles injectés, technique d’injection, formation d’anticorps neutralisant la toxine ;
· de réévaluer la pertinence du traitement par la toxine botulinique de type A.
La sécurité et l’efficacité d’injections répétées d’Azzalure ont été évaluées, pour les rides glabellaires, jusqu’à 24 mois et 8 cycles de traitement, et, pour les rides canthales latérales, jusqu’à 12 mois et 5 cycles de traitement.
· Hypersensibilité à la substance active ou à l’un des excipients mentionnés à la rubrique 6.1.
· En cas d’infection au niveau des sites d’injection proposés.
· En cas de myasthénie grave, de syndrome de Lambert Eaton ou de sclérose latérale amyotrophique.
4.4. Mises en garde spéciales et précautions d'emploi
Il faut veiller à ne pas injecter Azzalure dans un vaisseau sanguin.
Antécédents de troubles neuromusculaires
Azzalure doit être utilisé avec prudence chez les patients présentant un risque ou des signes cliniques de déficit marqué de la transmission neuromusculaire. Ces patients peuvent avoir une sensibilité accrue à ce type de produits, comme Azzalure, susceptible de provoquer une faiblesse musculaire excessive.
L'injection d'Azzalure n'est pas recommandée chez les patients ayant des antécédents de dysphagie ou de fausse-route (voire de pneumopathie d'inhalation).
Diffusion locale et à distance de l’effet de la toxine
Des effets indésirables, pouvant être liés à la diffusion de la toxine à distance du site d'injection, ont été très rarement rapportés après traitement par la toxine botulinique. Les patients traités à doses thérapeutiques peuvent présenter une faiblesse musculaire excessive. Les difficultés à avaler ou respirer sont des conséquences graves qui peuvent provoquer le décès.
Les patients et leur entourage doivent être informés de la nécessité de consulter immédiatement un médecin en cas d'apparition de troubles de la déglutition, de l'élocution ou de troubles respiratoires.
Il ne faut jamais dépasser la dose et la fréquence d'administration recommandées pour Azzalure.
Avant toute injection d'Azzalure, il est essentiel d'étudier l'anatomie faciale du patient. Une asymétrie faciale, un ptosis, une dermatochalasie excessive, des cicatrices et des modifications anatomiques résultant d'interventions chirurgicales antérieures doivent être prises en considération.
La prudence s'impose lorsqu'Azzalure est utilisé en présence d'une inflammation au(x) site(s) d'injection proposé(s) ou lorsque le muscle cible présente une atrophie ou une faiblesse excessive.
Comme pour toute injection intramusculaire, le traitement par Azzalure est déconseillé chez les patients présentant un temps de saignement prolongé.
Une sécheresse oculaire a été rapportée lors de l'utilisation d'Azzalure dans le traitement des rides glabellaires et des rides canthales latérales (voir rubrique 4.8). Une réduction de la production de larmes, une réduction du clignement des yeux et des troubles de la cornée peuvent survenir avec l'utilisation de toxines botuliniques, y compris Azzalure.
Formation d’anticorps
Les injections à intervalles trop rapprochés ou à doses trop élevées peuvent augmenter le risque de formation d'anticorps neutralisant la toxine botulinique. Au plan clinique, la formation d'anticorps neutralisants est susceptible de diminuer l'efficacité des traitements ultérieurs.
Les unités de toxine botulinique ne sont pas interchangeables d'un produit à l'autre. Les doses recommandées en unités Speywood sont différentes de celles des autres préparations de toxine botulinique.
Il est impératif qu'Azzalure ne soit utilisé que pour le traitement d'un seul patient, au cours d'une seule séance.
L'excédent de produit non utilisé doit être éliminé conformément aux instructions de la rubrique 6.6.
Des précautions particulières doivent être prises pour la préparation et l'administration du produit, ainsi que pour l'inactivation et l'élimination de la solution reconstituée non utilisée (voire rubrique 6.6).
Traçabilité
Afin d'améliorer la traçabilité des médicaments biologiques, le nom et le numéro de lot du produit administré doivent être clairement enregistrés.
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
Aucune étude d'interaction n'a été réalisée. Aucune autre interaction cliniquement significative n'a été rapportée
4.6. Fertilité, grossesse et allaitement
Grossesse
Azzalure ne doit pas être utilisé pendant la grossesse. Il n'existe pas de données suffisamment pertinentes concernant l'utilisation de la toxine botulinique de type A chez la femme enceinte. Des études effectuées chez l'animal ont mis en évidence une toxicité sur la reproduction à fortes doses (voir rubrique 5.3.). Le risque potentiel en clinique n'est pas connu.
Il n'existe pas de données sur le passage d'Azzalure dans le lait maternel. L'utilisation d'Azzalure est déconseillée pendant l'allaitement.
Fertilité
Il n'existe pas de données cliniques concernant l'utilisation d'Azzalure sur la fertilité. Il n'existe aucune preuve d'effet direct d’Azzalure sur la fertilité dans les études chez l’animal (voir la rubrique 5.3).
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
Environ 3 800 patients ont reçu Azzalure au cours des différentes études cliniques.
Sur la base d'essais cliniques contrôlés par placebo, les taux observés de réactions indésirables après la première injection d'Azzalure ont été de 22,3% pour le traitement des rides glabellaires (16,6% pour le placebo) et de 6,2% pour les rides canthales latérales (2,9% pour le placebo). La plupart de ces événements étaient réversibles et de sévérité légère à modérée.
Les effets indésirables les plus fréquents étaient les céphalées et les réactions au site d'injection pour les rides glabellaires, et, les céphalées, les réactions au site d'injection et l'œdème palpébral pour les rides canthales latérales. En général, les réactions liées au traitement ou à la technique d’injection se sont produites dans la première semaine suivant l'injection et étaient transitoires.
La fréquence de ces réactions a diminué avec la répétition des cycles d’injection. Les effets indésirables peuvent être liés à la substance active, à la procédure d'injection ou à la combinaison des deux.
Le profil de sécurité d'Azzalure pour le traitement concomitant des rides glabellaires et des rides canthales latérales a été évalué dans la partie ouverte de l'étude de phase III. La nature et la fréquence des effets indésirables étaient comparables à ce qui a été observé lorsque les patients étaient traités pour une seule des indications.
La fréquence des effets indésirables est classée comme suit :
Très fréquent (> 1/10), fréquent (≥ 1/100 à < 1/10), peu fréquent (≥ 1 000 à < 1/100), rare (≥ 1/10 000 à 1/1 000), très rare (< 1/10 000), fréquence indéterminée (ne peut être estimée sur la base des données disponibles).
Rides glabellaires
|
Classes de systèmes d’organes |
Effets indésirables |
|
Affections du système nerveux |
Très fréquent Céphalées Fréquent Parésie faciale temporaire (due à une parésie temporaire des muscles de la face proches des sites d’injection, surtout au niveau des sourcils) Peu fréquent Sensations vertigineuses |
|
Affections oculaires |
Fréquent Asthénopie, ptosis, œdème palpébral, augmentation de la sécrétion lacrymale, sécheresse oculaire, contractions fasciculaires (contraction involontaire des muscles autour des yeux) Peu fréquent Défauts visuels, vision trouble, diplopie Rare Anomalie de l’oculomotricité |
|
Affections de la peau et du tissu sous-cutané |
Peu fréquent Prurit, rash Rare Urticaire |
|
Troubles généraux et anomalies au site d’administration |
Très fréquent Réactions au site d’injection (par exemple, érythème, œdème, irritation, rash, prurit, paresthésie, douleur, gêne, picotements et hématome) |
|
Affections du système immunitaire |
Peu fréquent Hypersensibilité |
Rides canthales latérales
|
Classes de systèmes d’organes |
Effets indésirables |
|
Affections du système nerveux |
Fréquent Céphalée Parésie faciale temporaire (parésie temporaire des muscles de la face proches des sites d’injection) |
|
Affections oculaires |
Fréquent Œdème palpébral Ptosis Peu fréquent Sécheresse oculaire |
|
Troubles généraux et anomalies au site d'administration |
Fréquent Réactions au site d’injection (par exemple, hématome, prurit et œdème) |
Des effets indésirables, liés à la diffusion des effets de la toxine à distance du site d’injection, ont été très rarement rapportés avec la toxine botulinique (faiblesse musculaire excessive, dysphagie, pneumopathie d’inhalation d’évolution fatale dans quelques cas) (voir rubrique 4.4).
Expérience post commercialisation
|
Classes de systèmes d’organes |
Effets indésirables |
Fréquence |
|
Troubles généraux et anomalies au site d'administration |
Asthénie, fatigue, syndrome grippal |
Indéterminée |
|
Affections du système immunitaire |
Hypersensibilité |
Indéterminée |
|
Affections du système nerveux |
Hypoesthésie |
Indéterminée |
|
Affections musculosquelettiques et systémiques |
Atrophie musculaire |
Indéterminée |
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr/.
L'administration de doses excessives de toxine botulinique est susceptible de produire une faiblesse neuromusculaire associée à divers symptômes. Si le surdosage induit une paralysie des muscles respiratoires, des mesures de réanimation respiratoire peuvent s'avérer nécessaires. En cas de surdosage, une surveillance médicale du patient doit être instaurée pour rechercher d'éventuels symptômes de faiblesse musculaire excessive ou de paralysie musculaire. Un traitement symptomatique sera mis en œuvre si nécessaire.
Les symptômes de surdosage ne se manifestent pas obligatoirement juste après l'injection.
Une hospitalisation doit être envisagée chez les patients présentant des symptômes d'intoxication à la toxine botulinique de type A (par exemple association d'une faiblesse musculaire à une ptose, une diplopie, des troubles de la déglutition et du langage ou une parésie des muscles respiratoires).
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Classe pharmacothérapeutique : autres myorelaxants à action périphérique, code ATC : M03AX01.
Mécanisme d’action
Le principal effet pharmacodynamique de la toxine botulinique de type A est lié à la dénervation chimique du muscle traité, conduisant à une diminution mesurable du potentiel d'action musculaire provoquant une diminution localisée, voire une paralysie, de l'activité musculaire.
La toxine botulinique de type A est un myorelaxant qui affaiblit temporairement l'activité des muscles. Après injection, la toxine botulique de type A agit en bloquant le transport du neurotransmetteur acétylcholine à travers la jonction neuromusculaire, située entre l'extrémité nerveuse et la fibre musculaire. Le mode d'action de la toxine botulinique de type A comprend quatre étapes principales, qui doivent toutes fonctionner correctement pour que l'activité se produise. L'action entraîne l'arrêt de la contraction musculaire des muscles ciblés. L'effet dure pendant des périodes prolongées jusqu'à ce que la jonction se soit rétablie et que l'activité musculaire revienne.
Efficacité et sécurité clinique
Pendant la phase de développement clinique d'Azzalure, plus de 4 500 patients ont été inclus dans différents essais cliniques, et approximativement 3 800 patients ont été exposés à Azzalure.
Rides glabellaires
Dans ces études, 2 032 patients présentant des rides glabellaires modérées à sévères ont été traités à la dose recommandée de 50 unités Speywood, dont 305 au cours de deux études pivotales de phase III en double aveugle versus placebo, et 1200 au cours d'une étude de phase III à long terme en ouvert, à doses répétées. Les autres patients ont été traités dans le cadre d'études de recherche de dose ou d'études supportives.
Le délai médian d'apparition de la réponse a été de 2 à 3 jours après le traitement, l'effet maximum étant observé au 30ème jour. Dans les deux études pivotales de phase III contrôlées versus placebo, les injections d'Azzalure ont significativement diminué la sévérité des rides glabellaires pendant une durée allant jusqu'à 4 mois. L'effet était encore significatif au bout de 5 mois dans une de ces deux études pivotales.
Trente jours après l'injection, l'évaluation des investigateurs a montré que 90% (273/305) des patients avaient répondu au traitement (c'est-à-dire rides glabellaires absentes ou peu marquées lors du froncement maximum des sourcils), contre 3% (4/153) des patients sous placebo. Cinq mois après l'injection, 17% (32/190) des patients traités par Azzalure étaient toujours répondeurs au traitement versus 1% (1/92) sous placebo dans l'étude concernée. L'auto-évaluation des patients, 30 jours après le traitement à froncement maximum des sourcils, a montré un taux de réponse de 82% (251/305) avec Azzalure et de 6% (9/153) avec le placebo. La proportion de patients présentant une amélioration de deux grades, selon l'évaluation des investigateurs à froncement maximum des sourcils, a été de 77% (79/103) dans la seule étude pivotale de phase III ayant évalué ce critère.
Un sous-groupe de 177 patients présentait des rides glabellaires modérées ou sévères au repos avant le traitement. L'évaluation de cette population par les investigateurs, 30 jours après le traitement, a montré que 71% (125/177) des patients avec Azzalure étaient considérés comme répondeurs au traitement, versus 10% (8/78) sous placebo.
L'étude à long terme, en ouvert à doses répétées, a montré que le délai médian d'apparition de la réponse de 3 jours se maintenait lors de la répétition des cycles de traitement. Le taux de patients, à froncement maximum des sourcils, ayant répondu au traitement selon le jugement de l'investigateur 30 jours après le traitement, s'est maintenu au cours des cycles ultérieurs (taux compris entre 80 et 91% pour les 5 cycles). Le taux de réponse au repos après administrations répétées était cohérent avec les résultats obtenus lors des études à dose unique, avec 56 à 74% des patients traités par Azzalure considérés par l'investigateur comme étant répondeurs, 30 jours après le traitement.
Rides canthales latérales
Dans les études cliniques en double aveugle, 308 patients présentant des rides canthales latérales modérées à sévères lors d’un sourire forcé ont été traités à la dose recommandée de 30 unités Speywood par côté. Parmi ceux-ci, 252 ont été traitées dans une étude de phase III contrôlée par placebo en double aveugle et 56 patients ont été traités dans une étude de recherche de dose de phase II en double aveugle.
Dans l'étude de phase III, les injections d'Azzalure ont réduit de façon significative la sévérité des rides canthales latérales par rapport au placebo (p≤0,001) à 4, 8 et 12 semaines (évaluées lors d’un sourire forcé par les investigateurs). L'évaluation de la satisfaction des patients concernant l’apparence de leurs rides canthales latérales, a montré une différence statistiquement significative entre Azzalure et le placebo (p≤0,010) en faveur d’Azzalure à 4, 8 12 et 16 semaines.
Le critère primaire d'efficacité, l'évaluation par les investigateurs à 4 semaines après l'injection, a montré que 47,2% (119/252) des patients avaient répondu au traitement par AZZALURE (rides canthales latérales absentes ou légères), contre 7,2% (6/83) des patients traités par le placebo.
Dans une analyse post-hoc, à la même échéance, c’est-à-dire quatre semaines après l'injection, 75% (189/252) des patients traités par Azzalure avaient une amélioration d’au moins un grade lors d’un sourire forcé comparativement à seulement 19% (16/83) des patients du groupe traité par le placebo.
Un total de 315 sujets ont intégré la phase de suivi en ouvert de l'étude de phase III dans laquelle ils pouvaient être traités concomitamment pour les rides canthales latérales et les rides glabellaires.
Les patients traités par Azzalure dans les phases en double aveugle et ouverte de la phase III ont reçu une médiane de 3 traitements pour les rides canthales latérales. L'intervalle médian entre les injections pour les rides canthales latérales, qui était en grande partie déterminé par le protocole de l’étude, variait de 85 à 108 jours. Les résultats ont montré que l'efficacité était maintenue avec les traitements répétés sur une période d'un an.
Les niveaux de satisfaction des patients aux semaines 4, 16 et 52 montrent après le premier traitement avec Azzalure que 65,5% (165/252) des patients étaient très satisfaits ou satisfaits de l'apparence de leurs rides canthales latérales.
A la semaine 16, c’est-à-dire quatre semaines après, soit un deuxième traitement par Azzalure pour les patients randomisés dans le groupe Azzalure au cours de la première partie de l’étude, soit le premier traitement pour ceux randomisés dans le groupe placebo, la proportion de patients qui étaient très satisfaits ou satisfaits était égale à 89,0% (233/262). À la semaine 52, lorsque les patients pouvaient avoir eu jusqu'à cinq cycles de traitement par Azzalure dont le dernier, semaine 48, la proportion de patients très satisfaits ou satisfaits était de 84,7% (255/288).
Aucun patient n'a été testé positif pour les anticorps neutralisant la toxine après avoir reçu des traitements répétés avec AZZALURE pendant plus d'un an.
5.2. Propriétés pharmacocinétiques
5.3. Données de sécurité préclinique
Dans une étude de toxicité chronique chez le rat, on n'a montré aucune toxicité systémique à des doses correspondant à 75 fois la dose recommandée chez l'homme (50 U), réparties de façon égale entre les muscles fessiers droit et gauche.
Les études de toxicité aiguë, de toxicité chronique et de tolérance locale au site d'injection n'ont pas mis en évidence d'effets indésirables locaux ou systémiques inattendus après administration de doses pertinentes en clinique.
Lactose monohydraté.
2 ans.
Solution reconstituée :
La stabilité physique et chimique en cours d'utilisation a été démontrée pendant 24 heures entre 2 °C et 8 °C. Du point de vue microbiologique, à moins que la méthode de reconstitution exclue le risque de contamination microbienne, le produit doit être utilisé immédiatement. En cas d’utilisation non immédiate, les durées et conditions de conservation relèvent de la responsabilité de l’utilisateur.
6.4. Précautions particulières de conservation
A conserver au réfrigérateur (2 °C - 8 °C).
Ne pas congeler.
Pour les conditions de conservation du médicament reconstitué, voir rubrique 6.3.
6.5. Nature et contenu de l'emballage extérieur
125 unités Speywood sous forme de poudre dans un flacon (verre de type I), fermé par un bouchon (halobutyle) et une capsule de scellement (aluminium).
Boîte de 1 ou 2 flacon(s).
Toutes les présentations peuvent ne pas être commercialisées.
6.6. Précautions particulières d’élimination et de manipulation
Les instructions d’utilisation, de manipulation et d’élimination doivent être strictement respectées.
La reconstitution doit être réalisée conformément aux règles de bonnes pratiques, notamment concernant les conditions d’asepsie.
Azzalure doit être reconstitué avec une solution de chlorure de sodium à 9 mg/mL (0,9%) pour préparations injectables.
Comme indiqué dans le tableau de dilution ci-dessous, le volume requis de solution injectable de chlorure de sodium à 9 mg/mL (0,9 %) doit être prélevé à l’aide d’une seringue afin d’obtenir une solution reconstituée limpide et incolore ayant la concentration suivante :
|
Volume de solvant à utiliser (solution de chlorure de sodium à 0,9%) pour un flacon contenant 125 U |
Concentration obtenue |
|
0,63 mL |
10 U par 0,05 mL |
|
1,25 mL |
10 U par 0,1 mL |
Pour mesurer précisément le volume à utiliser pour la reconstitution (0,63 mL ou 1,25 mL), il convient d’utiliser des seringues qui comportent des graduations de 0,1 mL et 0,01 mL.
RECOMMANDATIONS POUR L’ÉLIMINATION DU MATÉRIEL CONTAMINÉ
Immédiatement après utilisation et avant élimination, la solution reconstituée d’Azzalure non utilisée (dans le flacon et/ou la seringue) doit être inactivée, en ajoutant 2 mL d’une solution diluée d’hypochlorite de sodium à 0,55 ou 1 % (solution de Dakin).
Les flacons, seringues et matériels utilisés ne doivent pas être vidés et doivent être placés dans des récipients adaptés, pour être éliminés conformément à la réglementation locale en vigueur.
RECOMMANDATIONS EN CAS D’INCIDENT LORS DE LA MANIPULATION DE LA TOXINE BOTULINIQUE
· Toute projection doit être essuyée : avec un matériel absorbant imbibé d’une solution d’hypochlorite de sodium (eau de Javel) en cas de produit lyophilisé, ou bien avec un matériel absorbant sec en cas de produit reconstitué.
· Les surfaces contaminées seront nettoyées avec un matériel absorbant, imbibé d’hypochlorite de sodium (eau de Javel), puis séchées.
· En cas de bris de flacon, procéder comme indiqué ci-dessus, ramasser soigneusement les particules de verre et essuyer le produit, en évitant les coupures cutanées.
· En cas de contact avec la peau, laver la zone touchée avec une solution d’hypochlorite de sodium (eau de Javel) puis rincer abondamment avec de l’eau.
· En cas de contact avec les yeux, rincer abondamment avec de l’eau ou avec une solution ophtalmique de lavage oculaire.
· En cas de contact du produit avec une blessure, une coupure ou une piqûre, rincer abondamment avec de l’eau et prendre les mesures médicales appropriées en fonction de la dose injectée.
Ces instructions d’utilisation, de manipulation et d’élimination doivent être strictement respectées.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
70 RUE BALARD
75015 PARIS
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· 34009 393 419 2 7 : 125 unités Speywood sous forme de poudre dans un flacon (verre de type I), fermé par un bouchon (halobutyle) et une capsule de scellement (aluminium) - Boîte de 1.
· 34009 393 420 0 9 : 125 unités Speywood sous forme de poudre dans un flacon (verre de type I), fermé par un bouchon (halobutyle) et une capsule de scellement (aluminium) - Boîte de 2.
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
[à compléter ultérieurement par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE
[à compléter ultérieurement par le titulaire]
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Liste I.
Médicament soumis à prescription médicale restreinte.
Réservé à l'usage professionnel selon l'article R.5121-80 du Code de la santé publique.
Prescription réservée aux spécialistes en chirurgie plastique, reconstructrice et esthétique, en dermatologie et en chirurgie de la face et du cou et chirurgie maxillo-faciale et en ophtalmologie.
ANSM - Mis à jour le : 18/06/2025
AZZALURE, 125 unités Speywood, poudre pour solution injectable
Toxine botulinique de type A
· Gardez cette notice. Vous pourriez avoir besoin de la relire.
· Si vous avez d’autres questions, interrogez votre médecin.
· Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
1. Qu'est-ce que AZZALURE, 125 unités Speywood, poudre pour solution injectable et dans quels cas est-il utilisé ?
2. Quelles sont les informations à connaître avant d'utiliser AZZALURE, 125 unités Speywood, poudre pour solution injectable ?
3. Comment utiliser AZZALURE, 125 unités Speywood, poudre pour solution injectable ?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver AZZALURE, 125 unités Speywood, poudre pour solution injectable ?
6. Contenu de l’emballage et autres informations.
1. QU’EST-CE QUE AZZALURE, 125 unités Speywood, poudre pour solution injectable ET DANS QUELS CAS EST-IL UTILISE ?
Classe pharmacothérapeutique : autres myorelaxants à action périphérique - code ATC : M03AX01.
Azzalure contient une substance, la toxine botulinique de type A, qui provoque une relaxation des muscles. Azzalure agit au niveau de la jonction entre les nerfs et les muscles, en empêchant la libération par les terminaisons nerveuses d'un « messager » chimique, appelé l'acétylcholine, ce qui inhibe la contraction musculaire. Cette relaxation musculaire est temporaire et disparaît progressivement.
Certaines personnes ressentent très mal l'apparition de rides au niveau du visage. Azzalure peut être utilisé chez l'adulte de moins de 65 ans pour corriger temporairement les rides glabellaires modérées à sévères (les rides verticales entre les sourcils obtenues lors de leur froncement) et les rides canthales latérales (pattes d’oie).
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT D’UTILISER AZZALURE, 125 unités Speywood, poudre pour solution injectable ?
N’ayez pas une injection d’AZZALURE, 125 unités Speywood, poudre pour solution injectable si :
· vous êtes allergique (hypersensible) à la toxine botulinique de type A (Clostridium botulinum) ou à l’un des autres composants contenus dans ce médicament, mentionnés dans la rubrique 6,
· vous présentez une infection au niveau du site d’injection proposé,
· vous êtes atteint(e) de myasthénie grave ou du syndrome de Lambert-Eaton ou de sclérose latérale amyotrophique.
Avertissez votre médecin avant toute injection d’Azzalure si :
· vous souffrez d’un trouble neuromusculaire,
· vous avez des difficultés à avaler des aliments (dysphagie),
· vous avalez souvent de travers les aliments et les boissons, ce qui vous fait tousser ou vous étrangler,
· vous présentez une inflammation au niveau du site d’injection proposé,
· les muscles au niveau du site d’injection proposé sont faibles,
· vous présentez des troubles de la coagulation, ce qui signifie que vous saignez plus longtemps que la normale, comme en cas d’hémophilie (maladie hémorragique héréditaire causée par une anomalie d’un facteur de la coagulation du sang),
· vous avez subi une intervention chirurgicale au niveau du visage ou vous allez subir bientôt une opération du visage ou un autre type d’intervention chirurgicale,
· vous avez récemment bénéficié d’injections de toxine botulinique,
· vos rides ne se sont pas améliorées de façon significative après votre dernier traitement par toxine botulinique.
Ces informations aideront votre médecin à prendre la meilleure décision concernant les risques et bénéfices potentiels du traitement pour vous.
Lorsque vous êtes traité par Azzalure, vos yeux peuvent devenir secs. Azzalure peut provoquer une diminution de la fréquence de clignement des yeux ou une diminution de la production de larmes, ce qui pourrait endommager la surface de vos yeux.
Mises en garde particulières
Très rarement, l’effet de la toxine botulinique peut provoquer une faiblesse musculaire à distance du site d’injection.
Lors de l’utilisation de toxines botuliniques avec des intervalles entre deux traitements inférieurs à 12 semaines ou à plus fortes doses pour traiter d’autres pathologies, on a pu observer dans de rares cas, la formation d’anticorps neutralisants, susceptibles de diminuer l’efficacité du traitement,
Si vous consultez un médecin, quelle qu’en soit la raison, veillez à lui signaler que vous avez reçu des injections d’Azzalure.
Enfants et adolescents
AZZALURE n’est pas indiqué chez les patients de moins de 18 ans.
Autres médicaments et AZZALURE, 125 unités Speywood, poudre pour solution injectable
Informez votre médecin si vous prenez, avez récemment pris ou pourriez prendre tout autre médicament car Azzalure peut interférer sur d’autres médicaments, notamment :
· les antibiotiques, pris pour traiter une infection (par exemple, les aminoglycosides, comme la gentamicine ou l’amikacine) ou
· les autres médicaments myorelaxants.
AZZALURE, 125 unités Speywood, poudre pour solution injectable avec des aliments et boissons
Les injections d’Azzalure peuvent être effectuées indépendamment de toute prise d’aliment ou de boisson.
Azzalure ne doit pas être utilisé pendant la grossesse.
Le traitement par Azzalure est déconseillé si vous allaitez.
Si vous êtes enceinte, si vous prévoyez de l'être ou si vous allaitez, demandez conseil à votre médecin avant de prendre tout médicament
Conduite de véhicules et utilisation de machines
Le traitement par Azzalure peut entraîner des problèmes temporaires de vision floue, de faiblesse musculaire ou de faiblesse généralisée. Il est alors déconseillé de conduire ou d'utiliser des machines.
AZZALURE, 125 unités Speywood, poudre pour solution injectable contient
Sans objet.
3. COMMENT UTILISER AZZALURE, 125 unités Speywood, poudre pour solution injectable ?
Les injections seront préparées et effectuées par votre médecin. Un flacon d'Azzalure ne doit être utilisé que pour le traitement d'un seul patient, au cours d'une seule séance.
La dose recommandée d'Azzalure est :
· Pour les rides glabellaires, 50 unités, c'est-à-dire une injection de 10 unités dans chacun des 5 sites d'injection au niveau du front, dans la région située au-dessus de votre nez, entre vos sourcils,
· Pour les rides canthales latérales, 60 unités, c'est-à-dire une injection de 10 unités dans chacun des 6 sites d'injection au niveau des zones des pattes d’oie.
Les unités utilisées pour les différents produits à base de toxine botulinique ne sont pas les mêmes. Les unités Speywood d'Azzalure sont spécifiques à ce produit et ne sont pas interchangeables avec d'autres préparations de toxine botulinique.
L'effet du traitement peut être constaté quelques jours après l’injection.
L'intervalle de temps entre les séances de traitement sera déterminé par votre médecin, mais doit être au minimum de 12 semaines.
Utilisation chez les enfants et les adolescents
Azzalure n’est pas indiqué chez les patients de moins de 18 ans.
Si vous avez reçu plus d’AZZALURE, 125 unités Speywood, poudre pour solution injectable que vous n’auriez dû :
Si vous avez reçu plus d'Azzalure que nécessaire, il est possible que des muscles autres que ceux ayant été injectés commencent à s'affaiblir. Cela ne se produit pas toujours immédiatement. Si vous vous trouvez dans cette situation, avertissez votre médecin le plus rapidement possible
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
Consultez de toute urgence un médecin si :
· Vous avez des difficultés à respirer, à avaler ou à parler,
· Votre visage gonfle, votre peau devient rouge ou vous avez une éruption qui vous démange et qui ressemble à une urticaire. Cela peut signifier que vous avez une réaction allergique à Azzalure.
Avertissez votre médecin si vous constatez l’un des effets indésirables suivants :
Pour les rides glabellaires
Très fréquent (observés chez plus d’1 utilisateur sur 10)
· Rougeurs, gonflements, irritation, éruption cutanée, démangeaisons, fourmillements, douleur, gêne, picotements ou ecchymose (« bleu ») au site d’injection.
· Maux de tête.
Fréquent (touchant 1 à 10 utilisateurs sur 100)
· Yeux fatigués ou baisse de la vision, chute de la paupière supérieure, gonflement de la paupière, larmoiement, œil sec, tressautements musculaires (contractions involontaires) des muscles autour des yeux.
· Paralysie faciale temporaire.
Peu fréquent (touchant 1 à 10 utilisateurs sur 1 000)
· Troubles visuels, vision trouble, diplopie (vision double).
· Sensations vertigineuses.
· Démangeaisons, éruption cutanée.
· Réactions allergiques.
Rare (touchant 1 à 10 utilisateurs sur 10 000)
· Éruption avec démangeaison de type urticaire.
· Troubles des mouvements oculaires.
Fréquence indéterminée (ne peut être estimée sur la base des données disponibles)
· Engourdissement.
· Atrophie des muscles.
· Faiblesse généralisée.
· Fatigue.
· Symptômes ressemblant à la grippe.
Pour les rides canthales latérales
Fréquent (touchant 1 à 10 utilisateurs sur 100)
· Maux de tête.
· Gonflement de la paupière.
· Ecchymose, démangeaisons, gonflement autour des yeux.
· Chute de la paupière supérieure.
· Paralysie faciale temporaire.
Peu fréquent (touchant 1 à 10 utilisateurs sur 1 000)
· Sécheresse des yeux.
Fréquence indéterminée (ne peut être estimée sur la base des données disponibles)
· Réactions allergiques.
· Engourdissement.
· Atrophie des muscles.
· Faiblesse généralisée.
· Fatigue.
· Symptômes ressemblant à la grippe.
Ces réactions se produisent généralement au cours de la première semaine suivant l’injection et sont transitoires. Elles ont habituellement une intensité légère ou modérée.
Très rarement, des effets indésirables ont été observés dans d’autres muscles que ceux dans lesquels l’injection a été réalisée. Ces effets indésirables incluent une faiblesse musculaire excessive, une difficulté à avaler due à une toux ou à une sensation d’étouffement en avalant (si vous avalez de travers de la nourriture ou un liquide, vous risquez des problèmes respiratoires ou une infection pulmonaire). Si vous vous trouvez dans cette situation, vous devez immédiatement consulter votre médecin.
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin, votre pharmacien ou à votre infirmier/ère. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr/.
En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.
5. COMMENT CONSERVER AZZALURE, 125 unités Speywood, poudre pour solution injectable ?
Tenir hors de la vue et de la portée des enfants.
Votre médecin ne doit pas utiliser ce médicament après la date de péremption indiquée sur l’étiquette. La date de péremption fait référence au dernier jour de ce mois.
A conserver au réfrigérateur (entre 2 °C et 8 °C). Ne pas congeler.
Votre médecin dissout Azzalure dans un liquide pour préparations injectables.
La stabilité physique et chimique en cours d'utilisation a été démontrée pendant 24 heures entre 2 °C et 8 °C. Du point de vue microbiologique, à moins que la méthode de reconstitution exclue le risque de contamination microbienne, le produit doit être utilisé immédiatement. En cas d’utilisation non immédiate, les durées et conditions de conservation relèvent de la responsabilité de l’utilisateur.
6. CONTENU DE L’EMBALLAGE ET AUTRES INFORMATIONS
Ce que contient AZZALURE, 125 unités Speywood, poudre pour solution injectable
· La substance active est :
La toxine botulinique de type A*. Chaque flacon contient 125 unités Speywood.
· Les autres composants sont : l'albumine humaine et le lactose monohydraté.
*Complexe toxine A de Clostridium botulinum (une bactérie) - hémagglutinine.
Les unités Speywood d'Azzalure sont spécifiques à cette spécialité et ne sont pas interchangeables avec d'autres préparations de toxine botulinique.
Azzalure est une poudre pour solution injectable. Boîtes de 1 ou 2 flacon(s).
Azzalure est une poudre blanche.
Titulaire de l’autorisation de mise sur le marché
70 RUE BALARD
75015 PARIS
Exploitant de l’autorisation de mise sur le marché
TOUR EUROPLAZA
20 AVENUE ANDRE PROTHIN
LA DEFENSE 4
92927 LA DEFENSE CEDEX
IPSEN MANUFACTURING IRELAND LIMITED
BLANCHARDSTOWN INDUSTRIAL PARK
BLANCHARDSTOWN
DUBLIN 15
IRLANDE
Noms du médicament dans les Etats membres de l'Espace Economique Européen
Ce médicament est autorisé dans les Etats membres de l'Espace Economique Européen sous les noms suivants : Conformément à la réglementation en vigueur.
[À compléter ultérieurement par le titulaire]
La dernière date à laquelle cette notice a été révisée est :
[à compléter ultérieurement par le titulaire]
< {MM/AAAA}>< {mois AAAA}.>
Sans objet.
Des informations détaillées sur ce médicament sont disponibles sur le site Internet de l’ANSM (France).
Les informations suivantes sont destinées exclusivement aux professionnels de santé
Posologie et mode d’administration :
Voir la rubrique 3 de la notice d’information de l’utilisateur.
Précautions particulières d’élimination et manipulation :
Les instructions d’utilisation, de manipulation et d’élimination doivent être strictement respectées.
La reconstitution doit être réalisée conformément aux règles de bonnes pratiques, notamment concernant les conditions d’asepsie.
Azzalure doit être reconstitué avec une solution de chlorure de sodium à 9 mg/mL (0,9%) pour préparations injectables.
Comme indiqué dans le tableau de dilution ci-dessous, le volume requis de solution injectable de chlorure de sodium à 9 mg/mL (0,9%) doit être prélevé à l’aide d’une seringue afin d’obtenir une solution reconstituée limpide et incolore ayant la concentration suivante :
|
Volume de solvant à utiliser (solution de chlorure de sodium à 0,9%) pour un flacon contenant 125 U |
Concentration obtenue |
|
0,63 mL |
10 U par 0,05 mL |
|
1,25 mL |
10 U par 0,1 mL |
Pour mesurer précisément le volume à utiliser pour la reconstitution (0,63 mL ou 1,25 mL), il convient d’utiliser des seringues qui comportent des graduations de 0,1 mL et 0,01 mL.
RECOMMANDATIONS POUR L’ÉLIMINATION DU MATÉRIEL CONTAMINÉ
Immédiatement après utilisation et avant élimination, la solution reconstituée d’Azzalure non utilisée (dans le flacon et/ou la seringue) doit être inactivée, en ajoutant 2 mL d’une solution diluée d’hypochlorite de sodium à 0,55 ou 1 % (solution de Dakin).
Les flacons, seringues et matériels utilisés ne doivent pas être vidés et doivent être placés dans des récipients adaptés, pour être éliminés conformément à la réglementation locale en vigueur.
RECOMMANDATIONS EN CAS D’INCIDENT LORS DE LA MANIPULATION DE LA TOXINE BOTULINIQUE
· Toute projection doit être essuyée : avec un matériel absorbant imbibé d’une solution d’hypochlorite de sodium (eau de Javel) en cas de produit lyophilisé, ou bien avec un matériel absorbant sec en cas de produit reconstitué.
· Les surfaces contaminées seront nettoyées avec un matériel absorbant, imbibé d’hypochlorite de sodium (eau de Javel), puis séchées.
· En cas de bris de flacon, procéder comme indiqué ci-dessus, ramasser soigneusement les particules de verre et essuyer le produit, en évitant les coupures cutanées.
· En cas de contact avec la peau, laver la zone touchée avec une solution d’hypochlorite de sodium (eau de Javel) puis rincer abondamment avec de l’eau.
· En cas de contact avec les yeux, rincer abondamment avec de l’eau ou avec une solution ophtalmique de lavage oculaire.
· En cas de contact du produit avec une blessure, une coupure ou une piqûre, rincer abondamment avec de l’eau et prendre les mesures médicales appropriées en fonction de la dose injectée.
Ces instructions d’utilisation, de manipulation et d’élimination doivent être strictement respectées.