Dernière mise à jour le 01/12/2025
MINIRINMELT 240 microgrammes, lyophilisat oral
Indications thérapeutiques
Classe pharmacothérapeutique - code ATC : H01BA02
MINIRINMELT appartient à une famille de médicaments appelée HORMONE ANTIDIURETIQUE. Ce médicament agit en faisant diminuer la quantité d’urine.
MINIRINMELT peut être utilisé dans les cas suivants :
· 1. Si vous avez une forme de diabète appelé insipide. Cette maladie est liée à un manque en hormone antidiurétique ce qui entraîne l’émission d’une quantité importante d’urine, en général pâle ressemblant à de l’eau. Cette maladie provoque également une soif intense et permanente.
· 2. Si vous souffrez d’énurésie nocturne. L’énurésie nocturne est l’émission involontaire d’urine pendant le sommeil (pipi au lit). Dans ce cas, le médicament est réservé à l’enfant de plus de 6 ans et à l’adulte. Le médecin vous prescrira ce médicament après avoir vérifié que ce trouble n’est pas le signe d’une autre maladie.
· 3. Si vous vous réveillez la nuit pour aller uriner (nycturie) et que la quantité d’urine est importante (polyurie nocturne). Dans ce cas, ce médicament est réservé à l’adulte de moins de 65 ans.
Présentations
> plaquette(s) thermoformée(s) PVC polyamide aluminium papier polytéréphtalate (PET) de 30 lyophilisat(s)
Code CIP : 369 317-9 ou 34009 369 317 9 4
Déclaration de commercialisation : 02/04/2007
Cette présentation est agréée aux collectivités
- Prix hors honoraire de dispensation : 57,06 €
- Honoraire de dispensation : 1,02 €
- Prix honoraire compris : 58,08 €
- Taux de remboursement :65%
- Diabète insipide d'origine centrale pitresso-sensible
- Enurésie nocturne chez le patient à partir de de six ans ; JOURNAL OFFICIEL ; 27/06/06
Service médical rendu (SMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprès de la HAS (plus d'informations dans l'aide). Les avis et synthèses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur du SMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| Important | Avis du 29/06/2016 | Renouvellement d'inscription (CT) | Le service médical rendu reste important pour : • MINIRIN, comprimé et MINIRINMELT, lyophilisat dans les indications : • « Traitement du diabète insipide d’origine centrale pitresso-sensible », • « Traitement symptomatique de l’énurésie nocturne chez le sujet âgé de plus de 6 ans et après élimination d’une pathologie organique sous-jacente». • MINIRIN SPRAY et MINIRIN 0,1mg/ml, formes endonasales, dans l’indication : « Traitement du diabète insipide d'origine centrale pitresso-sensible ». • OCTIM, dans l’ensemble des indications de l’AMM. |
| Insuffisant | Avis du 29/06/2016 | Renouvellement d'inscription (CT) | Le service médical rendu reste insuffisant pour MINIRIN comprimé et MINIRINMELT dans l’indication « Traitement symptomatique de la nycturie chez l’adulte âgé de moins de 65 ans, lorsqu’elle est associée à une polyurie nocturne ». |
Amélioration du service médical rendu (ASMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprés de la HAS (plus d'informations dans l'aide). Les avis et synthéses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur de l'ASMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| V (Inexistant) | Avis du 04/01/2006 | Inscription (CT) | Dans les indications diabète insipide et énurésie, ces spécialités sous forme de lyophilisat oral n’apportent pas d’amélioration du service médical rendu (ASMR V) par rapport à la forme en comprimés. |
ANSM - Mis à jour le : 24/07/2017
MINIRINMELT 240 microgrammes, lyophilisat oral
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
desmopressine ....................................................................................................240 microgrammes
Pour un lyophilisat oral
Pour la liste complète des excipients, voir rubrique 6.1.
Lyophilisat oral, blanc, rond, comportant sur une face l'empreinte de trois gouttes.
4.1. Indications thérapeutiques
· Traitement du diabète insipide d'origine centrale pitresso-sensible.
· Traitement symptomatique de l'énurésie nocturne chez l'enfant de plus de 6 ans et l'adulte après élimination d'une pathologie organique sous- jacente. La durée du traitement à dose minimale efficace déterminée après adaptation posologique est limitée à 3 mois, renouvelable une fois.
· Traitement symptomatique de la nycturie chez l'adulte âgé de moins de 65 ans, lorsqu'elle est associée à une polyurie nocturne.
4.2. Posologie et mode d'administration
Voie sublinguale.
La posologie sera déterminée individuellement pour chaque patient en fonction de l'efficacité obtenue et de la tolérance au traitement (effets indésirables).
Dans tous les cas, l'adaptation posologique sera progressive en respectant un délai suffisant entre chaque palier posologique.
L'administration par voie orale d'une dose de 60, 120 et 240 µg de MINIRINMELT correspond respectivement à 0,1, 0,2 et 0,4 mg de MINIRIN comprimé.
· Diabète insipide d'origine centrale pitresso-sensible :
La posologie initiale est de 60 µg 3 fois par jour par voie sublinguale ; elle peut varier en fonction de l'âge. Elle sera ensuite ajustée en fonction de la diurèse du patient.
La posologie varie en moyenne entre 120 µg et 720 µg par jour. La posologie optimale se situe, pour la majorité des patients, entre 180 µg et 360 µg par jour (généralement en 3 prises par jour, parfois 2).
· Enurésie nocturne isolée :
MINIRIN est contre-indiqué dans l'indication énurésie nocturne chez les enfants âgés de moins de 6 ans. La posologie initiale est de 120 µg par jour en 1 prise le soir. En cas d'efficacité insuffisante, celle-ci peut ensuite être progressivement augmentée par paliers de 60 µg, jusqu'à 240 µg par jour, en fonction de la réponse au traitement, en respectant un intervalle au minimum de 1 semaine entre chaque palier d'adaptation posologique. Dans des cas exceptionnels, une posologie de 360 µg par jour peut s'avérer nécessaire.
Le traitement doit être pris en une prise unique le soir.
Après 3 mois de traitement à dose minimale efficace déterminée après adaptation posologique, le traitement sera interrompu et l'énurésie réévaluée au moins une semaine après l'arrêt du traitement.
Dans certains cas, un traitement par la desmopressine peut à nouveau être envisagé, il convient alors de respecter les mêmes règles d'initiation et d'arrêt du traitement (adaptation posologique, surveillance, durée) que lors de l'instauration initiale du traitement.
La durée du traitement à dose minimale efficace déterminée après adaptation posologique est limitée à 3 mois, renouvelable une fois (voir rubrique 4.1).
· Nycturie associée à une polyurie nocturne :
MINIRIN est contre-indiqué dans l'indication nycturie avec polyurie nocturne chez les sujets âgés de plus de 65 ans (voir rubrique 4.3). La polyurie nocturne se définit comme une production d’urine nocturne excédant la capacité vésicale fonctionnelle ou excédant le tiers de la production d’urine des 24 heures. La posologie initiale est de 60 µg par jour; en cas d'efficacité insuffisante, celle-ci peut ensuite être progressivement augmentée, à 120 µg par jour, puis à 240 µg par jour, en respectant un intervalle d'une semaine entre chaque augmentation de posologie (palier hebdomadaire).
Le traitement doit être pris en une prise unique le soir au coucher. Il convient de réévaluer régulièrement l'efficacité et la tolérance du traitement.
Dans les indications énurésie nocturne isolée et nycturie associée à une polyurie nocturne, si l'effet clinique souhaité n'est pas obtenu dans les 4 semaines suivant la détermination de la dose minimale efficace, le traitement doit être interrompu.
Mode d’administration
MINIRINMELT se place sous la langue où il va se dissoudre sans apport d’eau.
Un traitement par desmopressine nécessite une restriction hydrique. Dans les indications énurésie nocturne isolée de l'enfant et nycturie de l'adulte il est impératif de restreindre toute prise de liquides au moins 1 heure avant et pendant les 8 heures suivant la prise de desmopressine (voir rubrique 4 4).
En cas de signes ou symptômes évocateurs d'une "rétention hydrique" ou d'une hyponatrémie (céphalées, nausées, vomissements, anorexie, augmentation rapide du poids corporel, état confusionnel et convulsions dans les cas sévères), le traitement doit être interrompu jusqu’à la totale résolution des symptômes. Si le traitement est repris, la restriction hydrique devra être plus stricte (voir rubrique 4 4).
· Hypersensibilité à la substance active ou à l’un des excipients mentionnés à la rubrique 6.1
· Insuffisance cardiaque.
· Etat pathologique nécessitant un traitement par les diurétiques.
· Insuffisance rénale modérée ou sévère (taux de filtration glomérulaire < 50 ml/min).
· Hyponatrémie.
· Syndrome de sécrétion inappropriée d'hormone antidiurétique.
· Polydipsie ou potomanie (avec production d'urine excédant 40 ml/kg/24h).
· Patients dans l'incapacité de respecter la restriction hydrique: troubles cognitifs sévères, démence, maladie neurologique.
· Nycturie : sujets âgés de 65 ans et plus (en raison d'un risque accru d'hyponatrémie au-delà de 65 ans).
· Enurésie nocturne : enfants de moins de 6 ans.
4.4. Mises en garde spéciales et précautions d'emploi
· de débuter le traitement à la posologie la plus faible recommandée;
· d'augmenter progressivement et prudemment la posologie (sans dépasser la posologie maximale recommandée);
· de respecter la restriction hydrique;
· de s'assurer que, chez l'enfant, l'administration se fait sous la surveillance d'un adulte.
Avant l'initiation du traitement
Avant l'initiation d'un traitement par la desmopressine dans les indications énurésie nocturne isolée de l'enfant et nycturie de l'adulte, toute anomalie organique vésico-sphinctérienne doit être éliminée.
La desmopressine doit être administrée avec prudence et sa posologie doit être réduite si nécessaire chez les sujets âgés et les patients présentant des troubles cardio-vasculaires (insuffisance coronarienne, hypertension artérielle) ainsi que chez les patients à risque d’hypertension intracrânienne.
A forte dose, notamment dans le cas du diabète insipide, la desmopressine peut parfois provoquer une légère élévation de la pression artérielle, qui disparaît avec la diminution de la posologie.
En cas d'insuffisance corticotrope ou thyroïdienne, celle-ci doit être corrigée avant le début du traitement et pendant toute sa durée, afin d'éviter la survenue d'une intoxication par l'eau.
La prise en charge thérapeutique de l'énurésie nocturne de l'enfant commence en règle générale par des mesures d'ordre hygiéno-diététique. En cas d'échec de ces mesures, un traitement par desmopressine peut être proposé en complément.
Chez les enfants atteints d'énurésie nocturne isolée, il est recommandé de demander au patient de noter avant le début du traitement la fréquence des mictions et les heures de prise de boissons pendant 48 heures, et le nombre de nuits mouillées pendant 7 jours.
Chez les patients atteints de nycturie, un calendrier mictionnel évaluant la fréquence et le volume des mictions doit être réalisé pour diagnostiquer une polyurie nocturne pendant au minimum 2 jours avant le début du traitement.
Suivi du traitement
1/ Hyponatrémie / Intoxication par l'eau
Dans les indications énurésie nocturne isolée de l'enfant et nycturie de l'adulte, il est impératif de restreindre toute prise de liquides au moins 1 heure avant et pendant les 8 heures suivant la prise de desmopressine. Les patients et le cas échéant leurs familles doivent être sensibilisés quant à la restriction hydrique.
Dans tous les cas, l'adaptation posologique sera progressive en respectant un délai suffisant entre chaque palier posologique.
Un suivi du poids du patient est recommandé dans les jours suivant l'instauration du traitement ou une augmentation de dose. Une augmentation rapide et importante du poids peut être le signe d'une rétention hydrique excessive.
Un traitement par desmopressine sans diminution parallèle de la prise liquidienne peut entraîner une intoxication par l'eau avec hyponatrémie, avec ou sans survenue de symptômes d'alarme tels que céphalées, nausées, vomissements, anorexie, prise de poids rapide, état confusionnel, voire convulsions.
En cas d'apparition de ces symptômes, dans les indications énurésie nocturne isolée de l'enfant et nycturie de l'adulte, le traitement doit être interrompu et un ionogramme sanguin réalisé pour mesurer la natrémie. Si le traitement est repris, la restriction hydrique devra être plus stricte
Les patients dont la natrémie se situe à la limite inférieure de la normale présentent un risque accru d’hyponatrémie.
Une attention particulière sera apportée aux patients prenant en association un médicament pouvant induire un syndrome de sécrétion inappropriée d’hormone antidiurétique (ex antidépresseurs tricycliques, inhibiteurs sélectifs de la recapture de la sérotonine, chlorpromazine, carbamazépine, AINS). Chez ces patients, la restriction hydrique devra être particulièrement respectée et une surveillance de la natrémie (ionogramme sanguin) sera instaurée (voir rubrique 4.5).
2/ Par ailleurs
Dans les indications énurésie nocturne isolée de l'enfant et nycturie de l'adulte, le traitement par desmopressine doit être interrompu lors d'affections intercurrentes caractérisées par un déséquilibre hydrique et/ou électrolytique telles que: épisode infectieux, fièvre, gastroentérite.
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
Les traitements diurétiques (action antagoniste et majoration du risque d'hyponatrémie).
Associations faisant l'objet de précautions d’emploi
Les médicaments connus pour induire un syndrome de sécrétion inappropriée d’hormone anti diurétique (ex : antidépresseurs tricycliques, antidépresseurs inhibiteurs sélectifs de la recapture de la sérotonine, chlorpromazine, carbamazépine, certains antidiabétiques de la famille des sulfamides hypoglycémiants et les AINS) peuvent majorer l’effet antidiurétique conduisant à un risque accru de rétention hydrique et d’hyponatrémie (voir rubrique 4.4).
Un traitement concomitant avec le lopéramide peut entraîner une multiplication par trois de la concentration en desmopressine dans le plasma et une majoration du risque de rétention hydrique et d’hyponatrémie. Bien que des études n’aient pas été menées, des médicaments ralentissant le transit intestinal pourraient avoir le même effet.
Il est peu probable que la desmopressine présente une interaction avec les médicaments agissant sur le métabolisme hépatique car les études réalisées in vitro avec des microsomes humains ont démontré que la desmopressine ne subit aucune métabolisation significative dans le foie. Néanmoins, aucune étude in vivo formelle n’a été réalisée.
4.6. Fertilité, grossesse et allaitement
Grossesse
Compte tenu des données disponibles et des indications thérapeutiques, l'utilisation de la desmopressine est envisageable avec précaution en cours de grossesse. En effet, les données animales sont rassurantes et en clinique l'utilisation de la desmopressine sur des effectifs limités n'a apparemment révélé aucun effet malformatif ou fœtotoxique particulier à ce jour.
Aucune étude évaluant l’impact de la desmopressine sur la fertilité n’a été réalisée. Il n’a pas été observé de passage transplacentaire de la desmopressine à dose thérapeutique dans les études in vitro sur les tissus placentaires humains.
La desmopressine passe dans le lait maternel; cependant, l'absorption gastro-intestinale de la desmopressine chez l'enfant est très peu probable. En conséquence, l'allaitement est vraisemblablement dénué de risque pour l'enfant.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
Le traitement sans réduction concomitante de l'ingestion de liquide, peut entraîner une intoxication par l'eau avec hyponatrémie. Il faut y penser devant la survenue de symptômes d'alarme céphalées, douleurs abdominales nausées, vomissements, anorexie, prise de poids rapide, sensation vertigineuses et vertige, état confusionnel, perte de mémoire, évanouissement, chutes et, dans les cas sévères, convulsions voire d’un coma. Chez les adultes le risque d’hyponatrémie augmente avec la posologie et le risque est plus fréquent chez les femmes. Chez l’enfant une hyponatrémie est susceptible de survenir en cas de modifications des activités quotidiennes pouvant affecter la prise de liquide ou la transpiration.
Diabète insipide et énurésie nocturne isolée
Les cas d'intoxication par l'eau avec hyponatrémie surviennent le plus souvent en début de traitement, lors d'une augmentation de la posologie, ou lors d'un changement de la voie d'administration dans l’indication diabète insipide.
Nycturie
Les effets indésirables de la desmopressine ont été décrits chez des patients, incluant la population âgée de 65 ans et plus, traités pour nycturie au cours d'essais cliniques. Au total, environ 35 % des patients ont présenté des effets indésirables pendant la phase d'adaptation posologique. La majorité des cas d'hyponatrémie cliniquement significative (natrémie < 130 mmol/L) est survenue chez des patients âgés de 65 ans ou plus (voir rubrique 4.3). L'hyponatrémie est apparue soit précocement après l'initiation du traitement, soit lors d'une augmentation de posologie. Les effets indésirables autres que l'hyponatrémie sont essentiellement mineurs. Pendant la période de traitement à long terme, 24 % des patients ont présenté des effets indésirables.
Chez l’adulte
L’effet indésirable le plus fréquemment rapporté pendant le traitement était les céphalées (12%). Les autres effets indésirables fréquemment rapportés étaient l’hyponatrémie (6%), les sensations vertigineuses (3%), l’hypertension (2%) et les troubles gastro-intestinaux (nausées (4%), vomissements (1%), douleurs abdominales (3%), diarrhée (2%) et constipation (1%)). Les effets indésirables peu fréquemment rapportés sont des modifications du rythme du sommeil/niveau de conscience comme des insomnies (0,96%), une somnolence (0,4%) ou une asthénie (0,06%). Quelques cas de réactions anaphylactiques ont été rapportés uniquement après commercialisation.
La fréquence des effets indésirables listés ci-dessous est basée sur celle reportée dans les essais cliniques évaluant la desmopressine sous forme orale chez l’adulte dans le traitement de la Nycturie (N=1557) et l’expérience post-commercialisation toutes indications confondues. Les effets indésirables rapportés uniquement après commercialisation sont listés dans la colonne « fréquence indéterminée ».
|
MedDRA Système Classe Organe |
Très fréquent (≥1/10) |
Fréquent (≥1/100, <1/10) |
Peu fréquent (≥1/1000, <1/100) |
Rare (≥1/10 000, < 1/1 000) |
Indéterminée |
|
Affections du système immunitaire |
|
|
|
|
Réaction anaphylactique |
|
Troubles du métabolisme et nutritionnels |
|
Hyponatrémie* |
|
|
Déshydratation** Hypernatrémie** |
|
Affections psychiatriques |
|
|
Insomnie |
Etat confusionnel* |
|
|
Affections du système nerveux |
Céphalées* |
Sensation vertigineuse* |
Somnolence Paresthésie |
|
Convulsions* Asthénie** Coma* |
|
Affections oculaires |
|
|
Troubles visuels |
|
|
|
Affections de l’oreille et du labyrinthe |
|
|
Vertiges* |
|
|
|
Affections cardiaques |
|
|
Palpitations |
|
|
|
Affections vasculaires |
|
Hypertension |
Hypotension orthostatique |
|
|
|
Affections respiratoires, thoraciques et médiastinales |
|
|
Dyspnée |
|
|
|
Affections gastro-intestinales |
|
Nausées* Douleurs abdominales* Diarrhée Constipation Vomissements* |
Dyspepsie Flatulences Ballonnements Distension abdominale |
|
|
|
Affections de la peau et du tissu sous-cutané |
|
|
Sudation Prurit Rash Urticaire |
Dermatite allergique |
|
|
Affections musculo-squelettiques et systémiques |
|
|
Spasmes musculaires Myalgie |
|
|
|
Affections du rein et des voies urinaires |
|
Trouble urétral et de la vessie |
|
|
|
|
Troubles généraux et anomalies au site d’administration |
|
Œdème Fatigue |
Evanouissement* Douleur dans la poitrine Maladie de type grippal |
|
|
|
Investigations |
|
|
Prise de poids* Augmentation des enzymes hépatiques Hypokaliémie |
|
|
*L’hyponatrémie peut être la cause de céphalées, douleurs abdominales, nausées, vomissements, prise de poids, sensation vertigineuses, confusion, évanouissements, perte de mémoire, vertiges, chutes et dans les cas sévères de convulsions voire d’un coma.
**Uniquement dans l’indication de diabète insipide.
Chez l’enfant et l’adolescent
L’effet indésirable le plus fréquemment rapporté durant le traitement était les céphalées (1%). Les effets indésirables les moins fréquemment rapportés étaient des perturbations émotionnelles (labilité émotionnelle (0,1%), agressivité (0,1%), anxiété (0,05%), troubles de l’humeur (0,05%), cauchemars (0,05%)) généralement réversible à l’arrêt du traitement et des troubles gastro-intestinaux (douleur abdominale (0,65%), nausées (0,35%), vomissements (0,2%) et diarrhées (0,15%)). Quelques cas de réactions anaphylactiques ont été rapportés uniquement après commercialisation.
La fréquence des effets indésirables listés ci-dessous est basée sur celle reportée dans les essais cliniques évaluant la desmopressine sous forme orale chez l’enfant et l’adolescent dans le traitement de l’énurésie nocturne (N=1923). Les effets indésirables rapportés uniquement après commercialisation sont listés dans la colonne « fréquence indéterminée »
|
MedDRA Système Classe Organe |
Très fréquent (≥1/10) |
Fréquent (≥1/100, <1/10) |
Peu fréquent (≥1/1000, <1/100) |
Rare (≥1/10 000, < 1/1 000) |
Indéterminée |
|
Affections du système immunitaire |
|
|
|
|
Réaction anaphylactique |
|
Troubles du métabolisme et nutritionnels |
|
|
|
|
Hyponatrémie* |
|
Affections psychiatriques |
|
|
Labilité émotionnelle** Agressivité*** |
Anxiété Cauchemars* Troubles de l’humeur****
|
Comportement anormal Troubles émotionnels Dépression Hallucinations Insomnie |
|
Affections du système nerveux |
|
Céphalées* |
|
Somnolence |
Troubles attentionnels Hyperactivité Convulsions* |
|
Affections vasculaires |
|
|
|
Hypertension |
|
|
Affections respiratoires, thoraciques et médiastinales |
|
|
|
|
Epistaxis |
|
Affections gastro-intestinales |
|
|
Douleurs abdominales* Nausées* Vomissements* Diarrhée |
|
|
|
Affections de la peau et du tissu sous-cutané |
|
|
|
|
Dermatite allergique Rash Sudation Urticaire |
|
Affections du rein et des voies urinaires |
|
|
Trouble urétral et de la vessie |
|
|
|
Troubles généraux et anomalies au site d’administration |
|
|
Œdème périphérique Fatigue |
Irritabilité |
|
*L’hyponatrémie peut être la cause de céphalées, douleurs abdominales, nausées, vomissements, prise de poids, sensation vertigineuses, confusion, évanouissements, perte de mémoire, vertiges, chutes et dans les cas sévères de convulsions voire d’un coma.
**Rapporté après commercialisation chez l’enfant et chez l’adolescent (<18 ans).
*** Rapporté après commercialisation quasi exclusivement chez l’enfant et l’adolescent (<18 ans).
**** Rapporté après commercialisation essentiellement chez l’enfant (<12 ans).
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : www.ansm.sante.fr.
Un surdosage augmente le risque d'hémodilution et d'intoxication par l'eau avec hyponatrémie. Les symptômes d'alerte sont une augmentation rapide du poids du patient, une tachycardie, des céphalées, des nausées, vomissements et, dans les cas sévères, convulsions voire coma.
En cas de surdosage dans le cadre du traitement du diabète insipide, la posologie doit être diminuée.
En cas de surdosage dans les indications énurésie nocturne isolée de l'enfant et nycturie de l'adulte, les recommandations générales suivantes doivent s'appliquer : interruption du traitement par la desmopressine, restriction des apports hydriques jusqu'à normalisation de la natrémie.
Un traitement symptomatique peut être prescrit si nécessaire.
En cas de surdosage important avec risque majeur d'intoxication par l'eau, des mesures spécifiques s'imposent, en milieu hospitalier, avec surveillance clinique et biologique stricte.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Classe pharmacothérapeutique : HORMONE ANTIDIURETIQUE, code ATC : H01BA02
La desmopressine est un analogue structural de synthèse de l'hormone antidiurétique naturelle, l'arginine-vasopressine.
Dans la molécule de desmopressine, l'hémicystéine en position 1 est désaminée et la L-arginine est remplacée par la D-arginine. Par rapport à l'hormone naturelle, la desmopressine se caractérise par une activité antidiurétique augmentée et prolongée, alors que son activité vasopressive est très réduite. La desmopressine se comporte comme un agoniste sélectif des récepteurs V2 de la vasopressine, situés principalement sur les cellules des tubes collecteurs du rein.
L'administration par voie orale d'une dose de 0,1 à 0,2 mg de MINIRIN comprimé (correspondant à 60 µg et 120 µg de MINIRINMELT) provoque un effet antidiurétique qui se prolonge environ 8 heures avec d'importantes variations inter-individuelles.
Nycturie: Les résultats poolés d'études cliniques contrôlées, randomisées, chez des hommes et des femmes âgés de 18 à 65 ans et plus, traités pour nycturie, par la desmopressine (Minirin comprimé) à une dose individualisée comprise entre 0,1 mg et 0,4 mg (correspondant à 60 µg et 240 µg de Minirinmelt) par jour pendant 3 semaines montrent une réduction d'au moins 50% du nombre moyen de mictions nocturnes chez 39% des patients versus 5% chez les patients sous placebo (p<0,0001).
En raison d'effets indésirables, 8 % des 448 patients sous desmopressine ont interrompu leur traitement pendant la phase d'adaptation posologique, et 2 % des 295 patients pendant la période de double aveugle (0,63 % sous desmopressine et 1,45 % sous placebo).
5.2. Propriétés pharmacocinétiques
La biodisponibilité absolue de la desmopressine (Minirinmelt) par voie sublinguale est en moyenne de 0,25 % (0,21 % - 0,31 %).
Tableau d'équivalence entre MINIRIN comprimé et MINIRINMELT :
|
MINIRIN comprimé |
MINIRINMELT lyophilisat oral |
MINIRIN comprimé |
MINIRINMELT lyophilisat oral |
|
Acétate de desmopressine |
Desmopressine base |
Desmopressine base |
Acétate de desmopressine |
|
0,1 mg |
60 µg |
89 µg |
Approx. 67 µg* |
|
0,2 mg |
120 µg |
178 µg |
Approx. 135 µg* |
|
0,4 mg |
240 µg |
356 µg |
Approx. 270 µg* |
*Calculé à des fins comparatives
Le volume de distribution de la desmopressine après administration intra-veineuse est de 33 L (0,41 L/kg).
La desmopressine ne traverse pas la barrière hémato-encéphalique.
La demi-vie moyenne d'élimination est de 2,8 heures (CV = 24 %).
Après une administration par voie intraveineuse, 45% de la quantité de desmopressine doit être retrouvée dans les urines sous 24 heures.
5.3. Données de sécurité préclinique
Gélatine, mannitol, acide citrique anhydre.
3 ans
6.4. Précautions particulières de conservation
A conserver dans son emballage d'origine, à l'abri de l'humidité.
6.5. Nature et contenu de l'emballage extérieur
Plaquette thermoformée (PVC-Polyamide-Aluminium/Papier-Polyester téréphtalate-Aluminium) de 10 lyophilisats oraux.
Boîte de 3 et 10 plaquettes thermoformées.
Toutes les présentations peuvent ne pas être commercialisées.
6.6. Précautions particulières d’élimination et de manipulation
Pas d’exigences particulières
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
7, RUE JEAN-BAPTISTE CLEMENT
94250 GENTILLY
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· CIP 34009 369 317 9 4 : 30 lyophilisats oraux sous plaquettes thermoformées (PVC-Polyamide-Aluminium/Papier-Polyester téréphtalate-Aluminium).
· CIP 34009 369 318 5 5 : 100 lyophilisats oraux sous plaquettes thermoformées (PVC-Polyamide-Aluminium/Papier-Polyester téréphtalate-Aluminium).
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
Date de dernier renouvellement : 08 août 2010
10. DATE DE MISE A JOUR DU TEXTE
[à compléter ultérieurement par le titulaire]
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Liste II
ANSM - Mis à jour le : 24/07/2017
MINIRINMELT 240 microgrammes, lyophilisat oral
desmopressine
· Gardez cette notice. Vous pourriez avoir besoin de la relire.
· Si vous avez d’autres questions, interrogez votre médecin ou votre pharmacien.
· Ce médicament vous a été personnellement prescrit. Ne le donnez pas à d’autres personnes. Il pourrait leur être nocif, même si les signes de leur maladie sont identiques aux vôtres.
· Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
1. Qu'est-ce que minirinmelt et dans quels cas est-il utilisé ?
2. Quelles sont les informations à connaître avant de prendre minirinmelt ?
3. Comment prendre minirinmelt ?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver minirinmelt ?
6. Contenu de l’emballage et autres informations.
1. QU’EST-CE QUE MINIRINMELT ET DANS QUELS CAS EST-IL UTILISE ?
Classe pharmacothérapeutique - code ATC : H01BA02
MINIRINMELT appartient à une famille de médicaments appelée HORMONE ANTIDIURETIQUE. Ce médicament agit en faisant diminuer la quantité d’urine.
MINIRINMELT peut être utilisé dans les cas suivants :
· 1. Si vous avez une forme de diabète appelé insipide. Cette maladie est liée à un manque en hormone antidiurétique ce qui entraîne l’émission d’une quantité importante d’urine, en général pâle ressemblant à de l’eau. Cette maladie provoque également une soif intense et permanente.
· 2. Si vous souffrez d’énurésie nocturne. L’énurésie nocturne est l’émission involontaire d’urine pendant le sommeil (pipi au lit). Dans ce cas, le médicament est réservé à l’enfant de plus de 6 ans et à l’adulte. Le médecin vous prescrira ce médicament après avoir vérifié que ce trouble n’est pas le signe d’une autre maladie.
· 3. Si vous vous réveillez la nuit pour aller uriner (nycturie) et que la quantité d’urine est importante (polyurie nocturne). Dans ce cas, ce médicament est réservé à l’adulte de moins de 65 ans.
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT DE PRENDRE MINIRINMELT ?
Ne prenez jamais MINIRINMELT :
· Si vous êtes allergique à la desmopressine ou à l’un des autres composants contenus dans ce médicament, mentionnés dans la rubrique 6.
· Si votre cœur ou vos reins fonctionnent mal. Si vous avez une maladie (par exemple des gonflements des membres ou une tension artérielle élevée) qui nécessite un traitement augmentant la quantité d’urine émise (médicaments diurétiques).
· Si vous avez un taux de sodium dans le sang trop bas (hyponatrémie) Si vous avez un taux d’hormone antidiurétique dans le sang trop élevé (syndrome de sécrétion inappropriée d'hormone antidiurétique).
· Si vous avez une soif excessive (polydipsie) ou un besoin irrépressible de boire (potomanie) avec une production d'urine excessive alors que vous ne souffrez pas de diabète insipide.
· Si vous souffrez de troubles mentaux. En effet, durant le traitement, le médecin vous demandera de limiter votre consommation d’eau et ces troubles peuvent vous empêcher de vous conformer à ces recommandations.
· Si vous avez 65 ans ou plus et souffrez de nycturie (reportez-vous à la rubrique 1).
· Si votre enfant a moins de 6 ans et souffre d’énurésie nocturne (reportez-vous à la rubrique 1).
Avertissements et précautions
Adressez-vous à votre médecin ou pharmacien avant de prendre MINIRINMELT.
Avertissez votre médecin si
· Vous avez une maladie des artères coronaires (vaisseaux sanguins nourrissant le cœur) ou une tension artérielle élevée.
· Vous avez une maladie de la thyroïde (glande au niveau de la gorge) ou de la glande surrénale (glande au-dessus du rein).
· Si durant le traitement vous avez une maladie responsable de fièvre, de vomissements, de diarrhées.
Si vous prenez MINIRINMELT pour traiter un diabète insipide
Si durant le traitement, vous (ou votre enfant) ressentez des maux de tête, un manque d’appétit, des nausées, des vomissements, une prise de poids rapide, un état confusionnel (paroles qui ne veulent rien dire, difficulté d’attention ), voire des convulsions (contractions violentes et involontaires d’un ou plusieurs membres), vous devez réduire votre consommation d’eau et consulter immédiatement un médecin. Il décidera soit de diminuer les doses soit de suspendre le traitement durant quelques heures.
Si vous prenez MINIRINMELT pour traiter une énurésie nocturne ou une nycturie
Il est important de réduire votre consommation de liquide (soupe, bouillon, yaourt liquide, lait, toutes boissons .) 1 heure avant de prendre ce médicament et pendant 8 heures après.
Si durant le traitement, vous (ou votre enfant) ressentez des maux de tête, un manque d’appétit, des nausées, des vomissements, une prise de poids rapide, un état confusionnel (paroles qui ne veulent rien dire, difficulté d’attention ), voire des convulsions (contractions violentes et involontaires d’un ou plusieurs membres), vous devez arrêter le traitement, réduire votre consommation d’eau et consulter immédiatement un médecin.
Enfants
Chez l'enfant, l'utilisation de ce médicament doit être réalisée sous la surveillance d'un adulte.
Autres médicaments et MINIRINMELT
Informez votre médecin ou pharmacien si vous prenez, avez récemment pris ou pourriez prendre tout autre médicament.
MINIRINMELT avec des aliments et boissons et de l’alcool
Sans objet.
Grossesse et allaitement et fertilité
Ce médicament ne sera utilisé pendant la grossesse ou l'allaitement que sur les conseils de votre médecin.
Si vous êtes enceinte ou que vous allaitez, si vous pensez être enceinte ou planifiez une grossesse, demandez conseil à votre médecin ou pharmacien avant de prendre ce médicament.
Conduite de véhicules et utilisation de machines
Sans objet.
MINIRINMELT contient
Sans objet.
3. COMMENT PRENDRE MINIRINMELT ?
Posologie
La dose doit être ajustée à chaque patient. Votre médecin et votre pharmacien vous diront combien de lyophilisats oraux vous devez prendre. Vérifiez auprès de votre médecin ou pharmacien en cas de doute.
Si vous prenez MINIRINMELT pour traiter un diabète insipide
Le traitement peut débuter par un lyophilisat oral de 60 microgrammes, trois fois par jour. La dose sera ensuite ajustée selon la quantité d’urine que vous éliminerez chaque jour. Les doses habituelles varient entre 120 et 720 microgrammes par jour. Pour la majorité des patients, la dose optimale se situe entre 60 microgrammes et 120 microgrammes trois fois par jour.
Si vous prenez MINIRINMELT pour traiter une énurésie nocturne
Le traitement débute par 120 microgrammes par jour. Le médecin pourra, si nécessaire, augmenter progressivement les doses, par palier de 60 microgrammes, jusqu’à une dose de 240 microgrammes par jour (exceptionnellement 360 microgrammes par jour).
Le traitement doit être pris en une prise unique le soir.
Votre médecin vous demandera d’interrompre le traitement au bout de 3 mois afin d’évaluer s’il est nécessaire de le poursuivre ou non.
Si vous prenez MINIRINMELT pour traiter une nycturie
Le traitement débute par un lyophilisat oral de 60 microgrammes par jour. Si la dose est insuffisante, elle sera augmentée progressivement à 120 microgrammes par jour puis à 240 microgrammes par jour.
Le traitement doit être pris en une prise unique, le soir au coucher.
Votre médecin vérifiera régulièrement l’efficacité du traitement et si vous le tolérez bien.
Mode d’administration
Ce médicament est utilisé par voie orale.
MINIRINMELT est un lyophilisat oral (c’est-à-dire un comprimé qui fond dans la bouche).
Placez le lyophilisat sous la langue et il se dispersera instantanément.
Instruction d’utilisation :
|
|
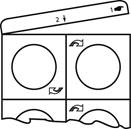
1. Retirez complètement la languette en partant du coin où se trouve le symbole de la main.
|
|
|
2. Déchirez le blister en suivant les perforations verticales.
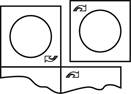
|
|
|
3. Pour sortir le lyophilisat oral de son emballage, enlevez le film protecteur en partant du coin où se trouve le symbole de la flèche.
|
|
|
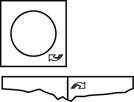
4. Pour obtenir le lyophilisat oral suivant, déchirez le blister le long de la perforation horizontale.
|
Si vous prenez MINIRINMELT pour traiter une énurésie nocturne ou une nycturie, le traitement doit être pris en une prise unique le soir.
Reportez-vous également au paragraphe « Mises en garde et précautions d’emploi »
Si vous avez pris plus de MINIRINMELT que vous n’auriez dû
Consultez immédiatement votre médecin ou votre pharmacien.
Une intoxication par l’eau (rétention d’eau excessive) peut survenir. Les signes de cette intoxication sont décrits à la rubrique 4 dans le paragraphe « Effets indésirables ».
Si vous avez pris trop de lyophilisats, reportez-vous à ce paragraphe pour connaître la conduite à tenir.
Si vous oubliez de prendre MINIRINMELT
Ne prenez pas de dose double pour compenser la dose que vous avez oublié de prendre.
Si vous arrêtez de prendre MINIRINMELT
Sans objet.
Si vous avez d’autres questions sur l’utilisation de ce médicament, demandez plus d’informations à votre médecin ou à votre pharmacien.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
Un taux de sodium dans le sang trop bas (hyponatrémie) peut être à l’origine des signes suivants : maux de tête, douleurs abdominales, nausées, vomissements, prise de poids rapide, sensation de vertiges, confusion (paroles qui ne veulent rien dire, difficulté d’attention ), évanouissements, perte de mémoire, chutes, et dans les cas sévères, des convulsions (contractions violentes et involontaires d’un ou plusieurs membres) voire un coma.
Ces signes peuvent traduire une rétention d’eau plus ou moins importante. Ils apparaissent en général avec des doses élevées de MINIRINMELT et disparaissent lorsque la dose est diminuée.
Si vous ressentez l’un de ces signes, la conduite à tenir dépend de la raison pour laquelle vous prenez ce médicament :
Si vous êtes traité pour un diabète insipide :
Réduisez votre consommation d’eau et consulter immédiatement un médecin. Il décidera soit de diminuer les doses soit de suspendre le traitement durant quelques heures.
Si vous êtes traité pour une énurésie ou une nycturie :
Arrêtez le traitement, réduisez votre consommation d’eau et consulter immédiatement un médecin.
Chez l’adulte
Effets indésirables très fréquents (affecte plus d’un patient sur 10) : maux de tête
Effets indésirables fréquents (affecte jusqu’à un patient sur 10) : taux de sodium dans le sang trop bas (hyponatrémie), sensations de vertige, tension artérielle trop élevée (hypertension), nausées, douleurs au niveau du ventre, diarrhées, constipation, vomissements, troubles de la fonction urinaire, gonflements (œdèmes), fatigue.
Effets indésirables peu fréquents (affecte jusqu’à un patient sur 100) : Insomnie, somnolence, fourmillements (paresthésie), troubles visuels, vertiges, palpitations, baisse de la tension artérielle lors d’un changement de position (hypotension orthostatique), difficultés à respirer (dyspnée), troubles au niveau de l’estomac (dyspepsie), flatulences, ballonnements, transpiration excessive, démangeaisons (prurit), éruptions sur la peau (rash, urticaire), spasmes et douleurs musculaires, évanouissement, douleur au niveau de la poitrine, maladie de type grippal, augmentation du poids, augmentation de certaines enzymes du foie, taux de potassium dans le sang trop bas (hypokaliémie).
Effets indésirables rares (affecte jusqu’à 1 patient sur 1000) : confusion (paroles qui ne veulent rien dire, difficulté d’attention), allergie au niveau de la peau (dermatite allergique).
Effets indésirables dont la fréquence est indéterminée : convulsions (contractions violentes et involontaires d’un ou plusieurs membres), fatigue (asthénie), coma.
Chez l’enfant
Effets indésirables fréquents (affecte jusqu’à un patient sur 10) : Maux de tête
Effets indésirables peu fréquents (affecte jusqu’à un patient sur 100) : Humeur instable, agressivité, douleurs au niveau du ventre, nausées, vomissements, diarrhées, troubles de la fonction urinaire, gonflements des membres (œdèmes périphériques), fatigue ;
Effets indésirables rares (affecte jusqu’à un patient sur 1000) : Anxiété, cauchemars, troubles de l’humeur, somnolence, tension artérielle trop élevée (hypertension), irritabilité.
Effets indésirables dont la fréquence est indéterminée : réaction allergique , taux de sodium dans le sang trop bas (hyponatrémie), comportement anormal, trouble émotionnel, dépression, hallucination, insomnie, trouble de l’attention, hyperactivité, convulsions (contractions violentes et involontaires d’un ou plusieurs membres), saignement de nez (épistaxis), allergie au niveau de la peau, éruption au niveau de la peau (rash, urticaire), transpiration excessive.
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet: www.ansm.sante.fr
En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.
5. COMMENT CONSERVER MINIRINMELT ?
Tenir ce médicament hors de la vue et de la portée des enfants.
N’utilisez pas ce médicament après la date de péremption indiquée sur l’emballage après Exp. La date de péremption fait référence au dernier jour de ce mois.
A conserver dans son emballage d'origine, à l'abri de l'humidité.
Ne jetez aucun médicament au tout-à-l’égout ou avec les ordures ménagères. Demandez à votre pharmacien d’éliminer les médicaments que vous n’utilisez plus. Ces mesures contribueront à protéger l’environnement.
6. CONTENU DE L’EMBALLAGE ET AUTRES INFORMATIONS
· La substance active est :
desmopressine................................................................. 240 microgrammes pour un lyophilisat oral
· Les autres composants sont : gélatine, mannitol, acide citrique anhydre
Qu’est-ce que MINIRINMELT et contenu de l’emballage extérieur
Ce médicament se présente sous forme de lyophilisat oral. Boîte de 30 ou 100.
Toutes les présentations peuvent ne pas être commercialisées.
Titulaire de l’autorisation de mise sur le marché
7, RUE JEAN-BAPTISTE CLEMENT
94250 GENTILLY
Exploitant de l’autorisation de mise sur le marché
7, RUE JEAN-BAPTISTE CLEMENT
94250 GENTILLY
WITTLAND 11
24109 KIEL
ALLEMAGNE
Noms du médicament dans les Etats membres de l'Espace Economique Européen
Sans objet.
La dernière date à laquelle cette notice a été révisée est :
[à compléter ultérieurement par le titulaire]
< {MM/AAAA}>< {mois AAAA}.>
Sans objet.
Des informations détaillées sur ce médicament sont disponibles sur le site Internet de l’ANSM (France).