Dernière mise à jour le 08/01/2026
KETAZED 0,25 mg/mL, collyre en solution
Présentations
> 1 flacon(s) polyéthylène haute densité (PEHD) de 10 ml avec pompe
Code CIP : 34009 302 196 7 6
Déclaration de commercialisation : 21/03/2022
Cette présentation est agréée aux collectivités
- Prix hors honoraire de dispensation : 7,72 €
- Honoraire de dispensation : 1,02 €
- Prix honoraire compris : 8,74 €
- Taux de remboursement :30 %
Service médical rendu (SMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprès de la HAS (plus d'informations dans l'aide). Les avis et synthèses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur du SMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| Modéré | Avis du 22/09/2021 | Inscription (CT) | Le service médical rendu par KETAZED 0,25 mg/mL, collyre en solution est modéré dans l’indication de l’AMM |
Amélioration du service médical rendu (ASMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprés de la HAS (plus d'informations dans l'aide). Les avis et synthéses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur de l'ASMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| V (Inexistant) | Avis du 22/09/2021 | Inscription (CT) | Cette spécialité est un hybride qui n’apporte pas d’amélioration du service médical rendu (ASMR V) par rapport à ZALERG 0,25 mg/mL, collyre en solution. |
ANSM - Mis à jour le : 07/07/2025
KETAZED 0,25 mg/mL, collyre en solution
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Kétotifène......................................................................................................................... 0,250 mg
Sous forme d’hydrogénofumarate de kétotifène.................................................................. 0,345 mg
Pour 1 mL
Chaque goutte contient 9,5 microgrammes de fumarate de kétotifène.
Pour la liste complète des excipients, voir rubrique 6.1.
Solution claire, incolore à légèrement colorée en jaune.pH : 4,8 - 6,4
4.1. Indications thérapeutiques
Traitement symptomatique de la conjonctivite allergique saisonnière.
4.2. Posologie et mode d'administration
Adultes, personnes âgées et enfants (dès l’âge de 3 ans) : une goutte de KETAZED 0,25 mg/mL, collyre en solution, à instiller dans le cul-de-sac conjonctival, deux fois par jour.
Population pédiatrique
La sécurité et l’efficacité de KETAZED 0,25 mg/mL, collyre en solution n’ont pas été établies chez les enfants âgés de moins de 3 ans.
Mode d’administration
Afin d’éviter toute contamination, ne toucher aucune surface avec l’embout du flacon.
Hypersensibilité à la substance active ou à l’un des excipients mentionnés à la rubrique 6.1.
4.4. Mises en garde spéciales et précautions d'emploi
Aucune mise en garde spéciale ou précaution d’emploi.
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
En cas de traitement concomitant par un autre collyre, les collyres doivent être instillés à au moins 5 minutes d’intervalle.
L’utilisation du kétotifène par voie orale peut potentialiser les effets des dépresseurs du système nerveux central, des antihistaminiques et de l’alcool. Bien que cela n’ait pas été observé avec le fumarate de kétotifène, la possibilité de telles interactions ne peut être exclue.
4.6. Fertilité, grossesse et allaitement
Grossesse
Il n’existe pas de données cliniques pertinentes concernant l’exposition des femmes enceintes au kétotifène en collyre. Des études effectuées chez l’animal utilisant des doses materno-toxiques par voie orale, ont montré une augmentation de la mortalité pré et post-natale, mais pas d’effet tératogène. Les taux systémiques observés après instillation oculaire sont très largement inférieurs à ceux observés après administration orale. Néanmoins, la prudence sera de rigueur lorsqu’on prescrira ce médicament aux femmes enceintes.
Bien que les études chez l’animal après administration orale montrent un passage dans le lait maternel, il est peu probable que l’administration topique chez l’être humain produise des quantités détectables dans le lait maternel. KETAZED 0.25 mg/mL collyre en solution peut être utilisé pendant l’allaitement.
Fertilité
Il n’y a pas de données disponibles concernant les effets du fumarate de kétotifène sur la fertilité chez l’Homme.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
Les effets indésirables sont classés par ordre de fréquence selon la convention suivante : très fréquent (≥ 1/10) ; fréquent (≥ 1/100, < 1/10) ; peu fréquent (≥ 1/1 000, < 1/100); rare (≥ 1/10 000, < 1/1 000) ; très rare (< 1/10 000) ; fréquence indéterminée (ne peut être estimée sur la base des données disponibles).
Affections du système immunitaire
Peu fréquents: Réactions d’hypersensibilité
Affections du système nerveux
Peu fréquents: Céphalées
Affections oculaires
Fréquents: Irritation oculaire, douleur oculaire, kératite ponctuée, érosion ponctuée de l'épithélium cornéen.
Peu fréquents: Vision trouble (pendant l’instillation), sécheresse oculaire, irritation des paupières, conjonctivite, photophobie, hémorragie conjonctivale.
Affections gastro-intestinales
Peu fréquents: Sécheresse buccale
Affections de la peau et du tissu sous-cutané
Peu fréquents: Éruption cutanée, eczéma, urticaire
Troubles généraux et anomalies au site d'administration
Peu fréquents: Somnolence
Effets indésirables issus des données obtenues après la mise sur le marché (fréquence non déterminée): réactions d’hypersensibilité incluant des réactions allergiques locales (principalement dermatite de contact, gonflement des yeux, irritation et œdème de la paupière), réactions allergiques systémiques incluant gonflement/œdème du visage (parfois associées à une dermatite de contact) et exacerbation d’états allergiques préexistants tels que l’asthme et l’eczéma.
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr.
Aucun cas de surdosage n’a été rapporté.
L’absorption orale du contenu d’un flacon de 10 mL équivaut à 2,5 mg de kétotifène, ce qui correspond à 125% de la posologie orale quotidienne recommandée pour un enfant de 3 ans. Les résultats cliniques n’ont pas mis en évidence de signe ou symptôme grave après absorption de doses allant jusqu’à 20 mg de kétotifène par voie orale.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Le kétotifène est un antagoniste des récepteurs H1 à l’histamine. Les études réalisées in vivo chez l’animal et les études réalisées in vitro suggèrent des mécanismes d’action additionnels telle la stabilisation de la membrane mastocytaire et l’inhibition de l’infiltration, de l’activation et de la dégranulation des éosinophiles.
5.2. Propriétés pharmacocinétiques
Au cours d'une étude pharmacocinétique réalisée chez 18 volontaires sains ayant été traités par un collyre en solution de kétotifène, les taux plasmatiques de kétotifène après une administration oculaire répétée durant 14 jours étaient inférieurs à la limite quantifiable (20 pg/mL) dans la plupart des cas.
Après administration orale, le kétotifène est éliminé de manière biphasique, avec une demi-vie initiale de 3 à 5 heures et une demi-vie terminale de 21 heures. Environ 1 % de la substance est excrétée dans l’urine sous forme inchangée en 48 heures, et 60 à 70% sont excrétés sous la forme de métabolites. Le métabolite principal est le dérivé N-glucuronoconjugué du kétotifène, qui est pratiquement inactif.
5.3. Données de sécurité préclinique
Hyaluronate de sodium, glycérol (E 422), hydroxyde de sodium (E 524), eau purifiée
Flacon avant l’ouverture : 2 ans
Après l’ouverture : 3 mois
6.4. Précautions particulières de conservation
A conserver à une température ne dépassant pas 25°C.
6.5. Nature et contenu de l'emballage extérieur
Flacon blanc en polyéthylène de haute densité de 10 mL, fermé par une pompe. Un flacon contient 10 mL de solution.
6.6. Précautions particulières d’élimination et de manipulation
Pas d’exigences particulières.
Tout médicament non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
22 ALLEE CAMILLE MUFFAT
INEDI 5
06200 NICE
FRANCE
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· 34009 302 196 7 6 : 10 mL en flacon (PEHD)
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
[à compléter ultérieurement par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE
[à compléter ultérieurement par le titulaire]
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Liste II
ANSM - Mis à jour le : 07/07/2025
KETAZED 0,25 mg/mL, collyre en solution
Kétotifène
· Gardez cette notice. Vous pourriez avoir besoin de la relire.
· Si vous avez d’autres questions, interrogez votre médecin ou votre pharmacien
· Ce médicament vous a été personnellement prescrit. Ne le donnez pas à d’autres personnes. Il pourrait leur être nocif, même si les signes de leur maladie sont identiques aux vôtres.
· Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
1. Qu'est-ce que KETAZED 0,25 mg/mL, collyre en solution et dans quels cas est-il utilisé ?
2. Quelles sont les informations à connaître avant d'utiliser KETAZED 0,25 mg/mL, collyre en solution?
3. Comment utiliser KETAZED 0,25 mg/mL, collyre en solution ?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver KETAZED 0,25 mg/mL, collyre en solution?
6. Contenu de l’emballage et autres informations.
1. QU’EST-CE QUE KETAZED 0,25 mg/mL, collyre en solution ET DANS QUELS CAS EST-IL UTILISE ?
KETAZED collyre en solution contient la substance active kétotifène qui est une molécule anti-allergique.
KETAZED collyre en solution est préconisé dans le traitement symptomatique de la conjonctivite allergique saisonnière.
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT D’UTILISER KETAZED 0,25 mg/mL, collyre en solution ?
N’utilisez jamais KETAZED 0,25 mg/mL, collyre en solution :
· si vous êtes allergique au kétotifène ou à l’un des autres composants contenus dans ce médicament, mentionnés dans la rubrique 6.
Avertissements et précautions
Adressez-vous à votre médecin ou pharmacien avant d’utiliser KETAZED 0,25 mg/mL, collyre en solution.
Enfants
Sans objet.
KETAZED ne doit pas être utilisé chez les enfants âgés de moins de 3 ans.
Autres médicaments et KETAZED 0,25 mg/mL, collyre en solution
Si vous devez utiliser un autre collyre en même temps que ce médicament, attendez au moins 5 minutes entre les deux instillations.
Informez votre médecin ou pharmacien si vous prenez, avez récemment pris ou pourriez prendre tout autre médicament, y compris des médicaments obtenus sans prescription. Il est particulièrement important de le faire si vous utilisez des médicaments pour traiter :
· la dépression, l’anxiété et des troubles du sommeil
· l’allergie (ex. antihistaminiques)
KETAZED 0,25 mg/mL, collyre en solution avec des aliments, des boissons et de l’alcool
L’utilisation de ce médicament peut augmenter l’effet de l’alcool.
Si vous êtes enceinte ou que vous allaitez, si vous pensez être enceinte ou planifiez une grossesse, demandez conseil à votre médecin ou pharmacien avant d’utiliser ce médicament.
Ce médicament peut être utilisé pendant l’allaitement.
Conduite de véhicules et utilisation de machines
Ce médicament peut causer une vision trouble ou une somnolence. Si vous présentez ces symptômes, vous devez attendre leur disparition avant de conduire un véhicule ou d’utiliser des machines.
KETAZED 0,25 mg/mL, collyre en solution contient nommer le/les excipient (s)
Sans objet.
3. COMMENT UTILISER KETAZED 0,25 mg/mL, collyre en solution?
Chez les adultes, les personnes âgées et les enfants (âgés d’au moins 3 ans), la dose recommandée est d’une goutte dans l’œil/les yeux atteint(s), deux fois par jour (matin et soir).
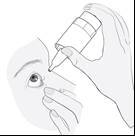
Instructions d’utilisation
|
1a
1b
|
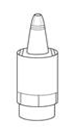
Sortez le flacon en plastique de la boîte en carton (image 1a) et écrivez la date d’ouverture du flacon sur la boîte en carton, à l’endroit prévu.
Lavez soigneusement vos mains avant d’ouvrir le flacon.
Enlevez le capuchon (image 1b). |
|
2
|
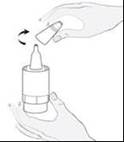
Tenez le flacon à l’envers, avec le pouce sur le rebord du flacon et les autres doigts sur le fond du flacon. Avant la première utilisation, actionnez la pompe à plusieurs reprises, environ 20 fois, jusqu’à l’obtention d’un flux constant du produit (image 2). |
|
3
|
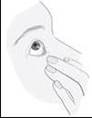
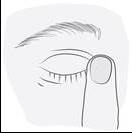
Inclinez votre tête ou la tête de votre enfant vers l’arrière. À l’aide d’un doigt propre, tirez la paupière vers le bas jusqu’à l’apparition d’une « poche » entre la paupière et l’œil. Appliquez la goutte à cet endroit (image 3). Approchez l’embout du flacon près de l’œil. Utilisez le miroir si vous en avez besoin. |
|
4
5
|
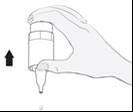
Ne touchez pas l’œil ni la paupière, ni les zones environnantes ou d’autres surfaces avec l’embout du flacon. Cela pourrait infecter la solution. Appuyez doucement sur le fond du flacon pour libérer une goutte de médicament à la fois (image 4).
Si une goutte tombe à côté de l’œil, recommencez l’application. Après avoir utilisé le médicament, pressez le coin de l’œil à l’aide d’un doigt, du côté du nez (image 5). Cela permet d’empêcher la pénétration du médicament dans le reste du corps. |
|
1-5 |
Si vous devez traiter les deux yeux, répétez les mêmes étapes (1 à 5) pour l’autre œil. Refermez le flacon à l’aide du capuchon immédiatement après l’utilisation. N’utilisez qu’un flacon de médicament à la fois. N’enlevez le capuchon du flacon qu’au moment où vous avez besoin d’utiliser le médicament. Vous devez jeter le flacon 3 mois après la première ouverture (en vérifiant la date de l’ouverture inscrite sur la boîte en carton), et utiliser un nouveau flacon. |
Si vous avez d’autres questions concernant l’utilisation de ce médicament, veuillez contacter votre médecin ou votre pharmacien.
Si vous avez utilisé plus de KETAZED 0,25 mg/mL, collyre en solution que vous n’auriez dû
Il n’y a aucun danger si vous avez utilisé plus d’une goutte dans l’œil ou si vous avez avalé accidentellement ce médicament. Si vous avez le moindre doute, demandez conseil à votre médecin ou pharmacien.
Si vous oubliez d’utiliser KETAZED 0,25 mg/mL, collyre en solution
Si vous avez oublié d’utiliser ce médicament, vous devez instiller une goutte de collyre dès que vous vous en rendez compte à la posologie recommandée (1 goutte par œil, deux fois par jour). N’instillez pas de dose double pour compenser la dose que vous avez oubliée.
Si vous arrêtez d’utiliser KETAZED 0,25 mg/mL, collyre en solution
Sans objet.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
Les effets indésirables suivants ont été signalés:
Fréquents (touchant moins de 1 patient sur 10)
· irritation ou douleur dans l’œil
· inflammation de l’œil
Peu fréquents (touchant moins de 1 patient sur 100)
· vision trouble au moment de l’application des gouttes dans l’œil
· sécheresse oculaire
· irritation des paupières
· conjonctivite
· augmentation de la sensibilité des yeux à la lumière
· saignement visible dans le blanc de l’œil
· maux de tête
· somnolence
· éruption cutanée (avec éventuellement des démangeaisons)
· eczéma (éruption avec rougeur, démangeaisons et sensation de brûlure)
· sécheresse buccale
· réaction allergique (incluant un gonflement du visage et des paupières) et aggravation d’états allergiques existants tels que l’asthme ou un eczéma
Si l’un des effets indésirables devient grave, ou si vous remarquez un effet indésirable non mentionné dans cette notice, veuillez avertir votre médecin ou votre pharmacien.
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet: https://signalement.social-sante.gouv.fr
En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.
5. COMMENT CONSERVER KETAZED 0,25 mg/mL, collyre en solution?
Tenir ce médicament hors de la vue et de la portée des enfants.
A conserver à une température ne dépassant pas 25°C.
Après son ouverture, le flacon peut se conserver pendant maximum 3 mois.
N’utilisez pas ce médicament après la date de péremption indiquée sur la boîte et le flacon après « EXP ». La date de péremption fait référence au dernier jour de ce mois.
Ne jetez aucun médicament au tout-à-l’égout ou avec les ordures ménagères. Demandez à votre pharmacien d’éliminer les médicaments que vous n’utilisez plus. Ces mesures contribueront à protéger l’environnement.
6. CONTENU DE L’EMBALLAGE ET AUTRES INFORMATIONS
Ce que contient KETAZED 0.25 mg/mL, collyre en solution.
· La substance active est :
Kétotifène................................................................................................................... 0,250 mg
Sous forme de d’hydrogénofumarate de kétotifène....................................................... 0,345 mg
Pour 1 mL
· Les autres composants sont :
Hyaluronate de sodium, glycérol (E 422), hydroxyde de sodium (E 524), eau purifiée.
Qu’est-ce que KETAZED 0.25 mg/mL, collyre en solution et contenu de l’emballage extérieur
KETAZED est présenté sous forme d’une solution claire, incolore à légèrement colorée en jaune. La solution est contenue dans un flacon en plastique blanc muni d’une pompe. Chaque flacon contient 10 mL de solution.
Titulaire de l’autorisation de mise sur le marché
22 ALLEE CAMILLE MUFFAT
INEDI 5
06200 NICE
FRANCE
Exploitant de l’autorisation de mise sur le marché
HORUS PHARMA
22 ALLEE CAMILLE MUFFAT
INEDI 5
06200 NICE
FRANCE
ZONE INDUSTRIELLE DE KRAFFT
67150 ERSTEIN
Noms du médicament dans les Etats membres de l'Espace Economique Européen
Ce médicament est autorisé dans les Etats membres de l'Espace Economique Européen sous les noms suivants : Conformément à la réglementation en vigueur.
[À compléter ultérieurement par le titulaire]
La dernière date à laquelle cette notice a été révisée est :
[À compléter ultérieurement par le titulaire]
Des informations détaillées sur ce médicament sont disponibles sur le site Internet de l’ANSM (France).