Dernière mise à jour le 08/01/2026
EQWILATE 500 UI FVW / 500 UI FVIII, poudre et solvant pour solution injectable
Indications thérapeutiques
Code ATC : B02BD06.
EQWILATE fait partie de la classe pharmacothérapeutique des médicaments désignés sous le nom de facteurs de coagulation et contient du facteur von Willebrand (FVW) et du facteur VIII de coagulation du sang humain. Ces deux protéines jouent un rôle dans la coagulation du sang.
Maladie de von Willebrand
EQWILATE s’utilise pour le traitement et la prévention des hémorragies chez les patients atteints de maladie de von Willebrand, terme qui désigne en réalité un groupe de maladies apparentées. La maladie de von Willebrand est un trouble de la coagulation sanguine qui se manifeste par des saignements anormalement long. Ce phénomène peut être dû à un manque de FVW dans le sang ou au fait que le FVW n’agit pas comme il le devrait.
Hémophilie A
EQWILATE s’utilise pour le traitement et la prévention des hémorragies chez les patients atteints d’hémophilie A. Ceci est un trouble au cours duquel un saignement peut se poursuivre pendant une durée anormalement longue. Elle est due à un déficit congénital de facteur VIII dans le sang.
Présentations
> 1 flacon(s) poudre en verre - 1 flacon(s) solvant en verre de 5 ml avec 1 boîte de matériel pour injection intraveineuse (avec 1 dispositif de transfert avec 1 trousse de perfusion avec 1 seringue jetable) avec 2 compresses alcoolisées
Code CIP : 34009 550 450 5 2
Déclaration de commercialisation : 04/06/2019
Cette présentation est agréée aux collectivités
Inscription sur la liste de rétrocession au titre de son AMM, selon les conditions précisées au Journal Officiel. Prix de cession publié au Journal Officiel.
Service médical rendu (SMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprès de la HAS (plus d'informations dans l'aide). Les avis et synthèses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur du SMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| Important | Avis du 11/07/2018 | Inscription (CT) | Le service médical rendu par EQWILATE est important dans l'indication de l’AMM : Maladie de von Willebrand. |
| Insuffisant | Avis du 11/07/2018 | Inscription (CT) | Le service médical rendu par EQWILATE est insuffisant dans la prophylaxie et le traitement des hémorragies chez les patients atteints d’hémophilie A. |
Amélioration du service médical rendu (ASMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprés de la HAS (plus d'informations dans l'aide). Les avis et synthéses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur de l'ASMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| V (Inexistant) | Avis du 11/07/2018 | Inscription (CT) | Prenant en compte : • les données cliniques issues d’études non comparatives et de faibles effectifs, qui démontrent l’efficacité d’EQWILATE dans la maladie de von Willebrand • l’absence de donnée comparative versus les alternatives thérapeutiques disponibles en termes d’efficacité ou de tolérance, la Commission considère qu’EQWILATE n’apporte pas d’ASMR (ASMR V) dans la stratégie thérapeutique actuelle de prise en charge la maladie de von Willebrand qui comprend les comparateurs pertinents (cf. 06 Comparateurs cliniquement pertinents). |
Autres informations
- Titulaire de l'autorisation : OCTAPHARMA France
- Conditions de prescription et de délivrance :
- liste I
- prescription hospitalière
- Statut de l'autorisation : Valide
- Type de procédure : Procédure de reconnaissance mutuelle
- Code CIS : 6 673 715 8
ANSM - Mis à jour le : 07/08/2025
EQWILATE 500 UI FVW / 500 UI FVIII, poudre et solvant pour solution injectable
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
EQWILATE se présente sous forme de poudre et de solvant pour solution injectable. Chaque flacon contient:
· 500 UI de facteur von Willebrand humain (FVW) et 500 UI de facteur VIII de coagulation humain par flacon de EQWILATE 500 UI FVW / 500 UI FVIII, poudre et solvant pour solution injectable.
Après reconstitution avec 5 ml d’eau pour préparations injectables contenant 0,1 % de polysorbate 80, le produit contient environ 100 UI/ml de facteur von Willebrand humain.
L’activité spécifique d’EQWILATE est ³ 67 UI de FVW:RCo/mg de protéine. L’activité du FVW (UI) est déterminée par la mesure de l’activité du cofacteur de la ristocétine (VWF:RCo) par rapport au standard international pour le concentré de facteur von Willebrand (OMS).
Après reconstitution avec 5 ml d’eau pour préparations injectables contenant 0,1 % de polysorbate 80, le produit contient environ 100 UI/ml de facteur VIII de coagulation humain.
L’activité (UI) est déterminée en utilisant le dosage chromogénique de la Pharmacopée Européenne. L’activité spécifique d’EQWILATE est ³ 67 UI FVIII:C/mg de protéine.
Produit à partir du plasma de donneurs humains.
Excipient(s) à effet notoire :
EQWILATE 500 UI FVW / 500 UI FVIII : 11,7 mg de sodium par ml de solution reconstituée (58,7 mg par flacon).
Pour la liste complète des excipients, voir rubrique 6.1.
Poudre et solvant pour solution injectable
Poudre lyophilisée: poudre ou solide friable de couleur blanche à jaune pâle.
4.1. Indications thérapeutiques
Prophylaxie et traitement des hémorragies ou des saignements d’origine chirurgicale chez des patients atteints de la maladie de von Willebrand (MVW), lorsque le traitement par la desmopressine (DDAVP) seule est inefficace ou contre-indiqué.
Hémophilie A
Prophylaxie et traitement des épisodes hémorragiques chez les patients atteints d’hémophilie A (déficit congénital en facteur VIII).
4.2. Posologie et mode d'administration
Le traitement doit être instauré sous la surveillance d’un spécialiste du traitement des troubles de la coagulation. Le produit est à usage unique et il convient d’administrer la totalité du contenu du flacon. Tout reste de produit non utilisé doit être éliminé conformément à la réglementation locale en vigueur.
Maladie de von Willebrand
Le rapport entre le FVW:RCo et le FVIII:C est de 1:1. En général, 1 UI/kg de FVW:RCo et 1 UI/kg de FVIII:C augmentent les taux plasmatiques de chaque protéine de 1,5 à 2% de l’activité normale. Habituellement, environ 20 à 50 UI d’EQWILATE/kg de poids corporel sont nécessaires pour assurer l’hémostase. Ceci permet d’augmenter le FVW:RCo et le FVIII:C d’environ 30 à 100% chez les patients.
Une dose initiale de 50 à 80 UI d’EQWILATE/kg de poids corporel peut être nécessaire, particulièrement chez les patients atteints de la maladie de von Willebrand de type 3, pour lesquels le maintien des taux plasmatiques souhaités nécessite des doses plus importantes que pour les autres types de maladie de von Willebrand.
Population pédiatrique
La sécurité et l’’efficacité d’EQWILATE chez les enfants âgés de moins de 6 ans n’ont pas encore été établies.
Prévention des hémorragies lors d’une chirurgie ou en cas de traumatisme sévère :
Pour la prévention des hémorragies lors d’une chirurgie, EQWILATE doit être administré 1-2 heures avant le début de la procédure chirurgicale. Un taux de FVW:RCo ≥ 60 UI/dl (≥ 60%) et un taux de FVIII:C ≥ 40 UI/dl (≥ 40%) doivent être atteints.
Une dose appropriée doit être ré-administrée toutes les 12 à 24 heures. La posologie et la durée du traitement dépendent de l’état clinique du patient, de la nature et de la sévérité du saignement, et des taux de FVW:RCo et de FVIII:C.
Chez les patients recevant un concentré de FVW contenant du FVIII, il convient de suivre les taux plasmatiques de FVIII:C afin de détecter la persistance éventuelle d’un taux plasmatique trop élevé de FVIII:C, susceptible d’accroître le risque d’événements thrombotiques, en particulier chez les patients présentant des facteurs de risque cliniques ou biologiques. Si l’on constate des taux plasmatiques de FVIII:C trop élevés, des doses plus faibles et/ou l’augmentation de l’intervalle entre les doses ou le recours à un produit à base de FVW contenant une plus faible concentration en FVIII doivent être envisagés.
Prophylaxie :
Pour la prophylaxie à long terme contre les saignements chez les patients atteints de la maladie de von Willebrand, des doses de 20-40 UI/kg de poids corporel doivent être administrées 2 à 3 fois par semaine. Dans certains cas, comme chez les patients présentant des saignements gastro-intestinaux, des doses plus élevées peuvent s’avérer nécessaires.
Hémophilie A
Surveillance du traitement
Au cours du traitement, il est conseillé d'effectuer une détermination appropriée des taux de facteur VIII afin d'évaluer la dose à administrer ainsi que la fréquence de renouvellement des injections. Selon les patients, la réponse au facteur VIII peut varier, entraînant des taux de récupération in vivo et des demi-vies différentes. Dans le cas d’une intervention chirurgicale majeure, en particulier, un contrôle précis du traitement substitutif par des tests de coagulation (activité plasmatique du facteur VIII) est indispensable.
Posologie
La dose et la durée du traitement de substitution dépendent de la sévérité du déficit en facteur VIII, de la localisation et de l’importance du saignement, et de l’état clinique du patient.
Le nombre d’unités de facteur VIII administré est exprimé en Unités Internationales (UI), calculées à l’aide du standard OMS pour les concentrés de facteur VIII. L’activité plasmatique du facteur VIII est exprimée en pourcentage (par rapport au plasma humain normal), ou, de préférence en unités internationales (par rapport au standard international pour le facteur VIII plasmatique).
L’activité du facteur VIII de 1 unité internationale (UI) est équivalente à la quantité de facteur VIII présente dans 1 ml de plasma humain normal.
Traitement à la demande :
Le calcul de la dose nécessaire de facteur VIII est basé sur la notion empirique que 1 unité internationale (UI) de facteur VIII par kg de poids corporel augmente le taux plasmatique de 1,5 à 2% de l’activité normale. La dose nécessaire est déterminée à l’aide de la formule suivante :
Unités nécessaires = poids corporel (kg) x augmentation souhaitée en facteur VIII (%) (UI/dl) x 0,5
La quantité à administrer et la fréquence d’administration doivent toujours être déterminées en tenant compte de l’efficacité clinique individuelle. En cas de survenue de l’un des accidents hémorragiques suivants, l’activité en facteur VIII ne doit pas être inférieure à l’activité plasmatique indiquée (en % de la normale ou UI/dl) pour la durée de traitement correspondante.
Le tableau suivant peut être utilisé pour aider à déterminer la dose nécessaire en cas d’accidents hémorragiques et d’intervention chirurgicale :
|
Degré d’hémorragie / Type de chirurgie |
Taux de facteur VIII requis [(UI/dl) ou (%)] |
Fréquence des doses (heures) / Durée du traitement (jours) |
|
Hémorragie |
|
|
|
Début d’hémarthrose de saignement musculaire ou de saignement oral |
20 - 40 |
Renouveler toutes les 12 à 24 heures, pendant au moins 1 jour, jusqu’à la résolution de l’épisode hémorragique caractérisé par la disparition de la douleur, ou l’obtention de la cicatrisation. |
|
Hémarthrose plus étendue, hémorragie musculaire ou hématome |
30 – 60 |
Renouveler l’injection toutes les 12 à 24 heures, pendant 3 à 4 jours ou plus, jusqu’à disparition de la douleur et du handicap aigu. |
|
Hémorragies mettant en jeu le pronostic vital |
60 – 100 |
Renouveler l’injection toutes les 8 à 24 heures, jusqu’à disparition du risque vital. |
|
Chirurgie |
|
|
|
Chirurgie mineure dont extraction dentaire |
30 – 60 |
Renouveler l’injection toutes les 24 heures, pendant au moins 1 jour, jusqu’à cicatrisation. |
|
Chirurgie majeure |
80 – 100 (pré et post-opératoire) |
Renouveler l’injection toutes les 8 à 24 heures jusqu’à cicatrisation satisfaisante de la plaie, puis poursuivre le traitement pendant au moins 7 jours supplémentaires pour maintenir une activité coagulante du facteur VIII entre 30% et 60%. |
Prophylaxie :
Pour une prophylaxie à long terme des saignements chez les patients atteints d’hémophilie A sévère, les doses habituelles sont de 20 à 40 UI de facteur VIII par kg de poids corporel et doivent être administrées tous les 2 à 3 jours. Dans certains cas, particulièrement chez les jeunes patients, des intervalles d’administration plus courts ou des doses plus importantes peuvent être nécessaires.
Perfusion continue :
Une analyse pharmacocinétique doit être réalisée préalablement à l’intervention chirurgicale afin d’obtenir une estimation de la clairance. La vitesse de perfusion initiale se calcule de la façon suivante :
Vitesse de perfusion (UI/kg/h) = clairance (ml/kg/h) x concentration à l’équilibre désirée (UI/ml)
Après les premières 24 heures de perfusion continue, la clairance doit être recalculée tous les jours en utilisant l’équation de l’état d’équilibre avec la concentration mesurée et la vitesse de perfusion connue.
Population pédiatrique
Les données sont insuffisantes pour recommander l’usage d’EQWILATE chez les enfants de moins de 6 ans atteints d’hémophile A.
Mode d’administration
Par voie intraveineuse.
La vitesse d’injection ou de perfusion ne doit pas dépasser 2 à 3 ml par minute.
Pour les instructions concernant la reconstitution du médicament avant administration, voir la rubrique 6.6.
Hypersensibilité à l’un des principes actifs ou à l’un des excipients décrits à la rubrique 6.1.
4.4. Mises en garde spéciales et précautions d'emploi
Traçabilité
Dans le but d’améliorer la traçabilité des médicaments biologiques, le nom et le numéro de lot du produit administré doivent être clairement enregistrés.
Hypersensibilité
EQWILATE peut causer des réactions d’hypersensibilité de type allergique. Le médicament contient des traces de protéines humaines autres que le facteur VIII. Si des symptômes d’hypersensibilité apparaissent, les patients doivent arrêter immédiatement l’administration et contacter leur médecin.
Les patients doivent être informés des signes précoces d’une réaction d’hypersensibilité comprenant des réactions urticariennes, une urticaire généralisée, une oppression thoracique, une respiration asthmatiforme, une hypotension et une anaphylaxie.
En cas de choc, le traitement médical standard relatif à l’état de choc doit être instauré.
Agents transmissibles
Les mesures habituelles de prévention du risque de transmission d’agents infectieux par les médicaments préparés à partir du sang ou du plasma humain comprennent la sélection des donneurs, la recherche des marqueurs spécifiques sur chaque don et sur les mélanges de plasma ainsi que la mise en œuvre dans le procédé de fabrication d’étapes efficaces pour l’inactivation/élimination virale. Cependant, lorsque des médicaments préparés à partir du sang ou du plasma humain sont administrés, le risque de transmission d’agents infectieux ne peut pas être totalement exclu. Ceci s’applique également aux virus inconnus ou émergents et aux autres types d’agents infectieux.
Les mesures prises sont considérées comme efficaces vis-à-vis des virus enveloppés tels que le virus de l'immunodéficience humaine (VIH), le virus de l’hépatite B (VHB) et le virus de l’hépatite C (VHC), et pour le virus non-enveloppé de l’hépatite A. Ces mesures restent cependant limitées vis-à-vis de certains virus non enveloppés comme le parvovirus B19.
L’infection par le parvovirus B19 peut être sévère chez la femme enceinte (infection fœtale) et chez les patients immunodéficients ou atteints d’une augmentation de la destruction des hématies (anémie hémolytique).
Il est recommandé que les patients traités régulièrement ou de façon répétitive par des concentrés de FVW/facteurs VIII plasmatiques humains soient correctement vaccinés (hépatite A et hépatite B).
A chaque injection d’EQWILATE, il est fortement recommandé de relever le nom et le numéro de lot du produit afin de conserver la traçabilité entre le patient et le lot du produit.
Maladie de von Willebrand
Événements thromboemboliques
Lorsqu’il utilise des concentrés de FVW contenant du FVIII, le médecin traitant doit tenir compte de l’augmentation importante de FVIII:C qui peut être provoquée par un traitement continu. Chez les patients recevant des concentrés de FVW contenant du FVIII, les taux plasmatiques de FVIII:C doivent être surveillés pour éviter un taux plasmatique de FVIII:C trop élevé, susceptible d’accroître le risque d’accidents thrombotiques.
Il existe un risque d’accidents thrombotiques lorsque des concentrés de FVW contenant du FVIII sont utilisés, particulièrement chez les patients présentant des facteurs de risque cliniques ou biologiques. Aussi, les signes précoces de thrombose doivent être surveillés chez les patients à risque. Une prophylaxie contre une thrombo-embolie veineuse doit être mise en place, conformément aux recommandations en vigueur.
Inhibiteurs
Les patients atteints de la maladie de von Willebrand, particulièrement de type 3, peuvent développer des anticorps neutralisants (inhibiteurs) du FVW. Si les niveaux d’activité plasmatique attendus pour le FVW:RCo ne sont pas atteints, ou si l’hémorragie n’est pas contrôlée avec des doses appropriées, un test biologique adapté doit être réalisé pour déterminer si un inhibiteur du FVW est présent. Chez les patients présentant des concentrations élevées d’inhibiteurs, le traitement par le FVW peut ne pas être efficace et d’autres options thérapeutiques doivent être considérées. Le suivi de tels patients doit être réalisé par des médecins expérimentés dans le traitement de patients présentant des troubles de l’hémostase.
Hémophilie A
Inhibiteurs
L'apparition d'anticorps neutralisants (inhibiteurs) du facteur VIII est une complication connue du traitement des patients atteints d'hémophilie A. Ces inhibiteurs sont habituellement des immunoglobulines IgG dirigées contre l’activité procoagulante du facteur VIII et sont mesurées en Unités Bethesda par ml de plasma par le test modifié. Le risque de développer des inhibiteurs est corrélé à la gravité de la maladie ainsi qu’à l'exposition au facteur VIII, ce risque étant le plus élevé au cours des 50 premiers jours d'exposition et présent tout au long de la vie bien qu’il soit peu fréquent.
La pertinence clinique de l’apparition d’inhibiteurs dépendra du titre d’inhibiteurs ; un faible titre d’inhibiteurs provisoire ou constant présente un risque de réponse clinique insuffisante moins élevé qu’un titre élevé d’inhibiteurs.
De manière générale, tous les patients traités avec des produits de facteur VIII de coagulation doivent faire l’objet d’une surveillance soigneuse pour détecter l’apparition d'inhibiteurs par un suivi clinique et à l'aide de tests biologiques appropriés.
Si le taux de facteur VIII plasmatique attendu n’est pas atteint ou si l’hémorragie n’est pas contrôlée par une dose adéquate, un dosage doit être réalisé afin de rechercher la présence d’un inhibiteur du facteur VIII. Chez les patients présentant un titre élevé d’inhibiteur, le traitement en facteur VIII peut ne pas être efficace et d’autres options thérapeutiques doivent être considérées.
Le suivi de tels patients doit être effectué par des médecins expérimentés dans la prise en charge de l’hémophilie et des inhibiteurs du facteur VIII.
Événements cardiovasculaires
Chez les patients présentant des facteurs de risque cardiovasculaires, le traitement de substitution en facteurs VIII peut augmenter le risque cardiovasculaire.
Complications liées au cathéter
Si un dispositif d’accès veineux central (DAVC) est nécessaire, le risque de complications liées au DAVC, notamment des infections locales, une bactériémie et une thrombose au site du cathéter, doit être envisagé.
Ce médicament contient jusqu’à 58,7 mg de sodium par flacon d’EQWILATE 500 UI FVW / 500 UI FVIII, poudre et solvant pour solution injectable, ce qui équivaut à de 2,94% de l’apport alimentaire quotidien maximal recommandé par l’OMS de 2 g de sodium par adulte.
Population pédiatrique
Les avertissements et précautions cités s’appliquent tant aux adultes qu’aux enfants.
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
Aucune interaction entre le facteur VIII de coagulation humaine et d’autres médicaments n’a été rapportée.
4.6. Fertilité, grossesse et allaitement
Aucune étude sur la reproduction animale n’a été menée avec le FVW/facteur VIII.
Maladie de von Willebrand
Il n’y a pas de données disponibles sur l’utilisation d’EQWILATE pendant la grossesse ou l’allaitement.
EQWILATE ne doit être administré qu’en cas de nécessité absolue chez les femmes présentant un déficit en FVW, au cours de la grossesse ou de l’allaitement, en tenant compte du fait que l’accouchement augmente le risque d’accidents hémorragiques chez ces patientes.
Hémophilie A
En raison du très petit nombre de cas d’hémophilie A chez la femme, il n’y a pas de données disponibles sur l’utilisation d’EQWILATE pendant la grossesse et l’allaitement. Aussi, EQWILATE ne doit être administré qu’en cas de nécessité absolue au cours de la grossesse et de l’allaitement.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
EQWILATE n’a aucun effet sur l’aptitude à conduire des véhicules et à utiliser des machines.
Résumé du profil de sécurité
Une hypersensibilité ou des réactions allergiques (qui peuvent comprendre œdème de Quincke, sensation de brûlure et de piqûre au site d’injection, frissons, rougeurs, urticaire généralisée, érythème, prurit, éruption cutanée, céphalées, réactions urticariennes, hypotension, léthargie, nausées, agitation, tachycardie, oppression thoracique, dyspnée, fourmillements, vomissements, respiration asthmatiforme) ont été rarement observées, et peuvent dans certains cas évoluer vers une réaction anaphylactique sévère (voire un état de choc).
Maladie de von Willebrand
Les patients atteints de la maladie de von Willebrand, particulièrement les patients de type 3, peuvent très rarement développer des anticorps neutralisants du FVW. L’apparition de tels inhibiteurs se caractérise par une réponse clinique inadaptée. Ces inhibiteurs surviennent en association étroite avec des réactions anaphylactiques. Aussi, la présence d’inhibiteur doit être recherchée chez les patients développant une réaction anaphylactique.
Dans de tels cas, il est recommandé de contacter un centre spécialisé dans les maladies hémorragiques (hémophilie, maladie de Willebrand, ).
Il existe un risque d’accidents thrombotiques, particulièrement chez les patients présentant des facteurs de risque cliniques ou biologiques. Une prophylaxie contre une thrombo-embolie veineuse doit être mise en place, conformément aux recommandations en vigueur.
Chez les patients recevant des concentrés de FVW contenant du FVIII, les taux plasmatiques en FVIII:C trop importants peuvent augmenter le risque d’accidents thrombotiques.
Hémophilie A
Des anticorps neutralisants (inhibiteurs) peuvent apparaître chez des patients atteints d’hémophilie A traités avec le facteur VIII, y compris avec Eqwilate (voir rubrique 5.1). Une telle apparition se manifeste par une réponse clinique insuffisante. Dans ce cas, il est recommandé de contacter un centre spécialisé en hémophilie.
Pour les informations sur la sécurité virale, voir rubrique 4.4.
Liste des effets indésirables
Le tableau suivant résume les effets indésirables observés au cours des études cliniques, des études de sécurité menées après la commercialisation du produit et proviennent d’autres sources réunissant des données post-commercialisation. Ces effets indésirables sont classés par catégorie selon la classification système-organe MedDRA (SOC), le Terme préféré (TP) et la fréquence.
Les fréquences ont été définies selon les critères suivants : très fréquent (≥1/10), fréquent (≥1/100 à <1/10), peu fréquent (≥1/1 000 à <1/100), rare (≥1/10 000 à <1/1 000), très rare (<1/10 000), fréquence indéterminée (ne peut être estimée sur la base des données disponibles).
Pour les effets indésirables rapportés spontanément après la commercialisation, la fréquence à laquelle ils ont été rapportés est classée comme « indéterminée ».
|
Norme MedDRA Classes de systèmes d’organes (SOC) |
Effets indésirables |
Fréquence des effets indésirables |
|
Affections du système immunitaire |
Hypersensibilité |
Peu fréquent |
|
Choc anaphylactique |
Très rare |
|
|
Troubles généraux et anomalies au site d’administration |
Fièvre |
Peu fréquent |
|
Douleurs thoraciques |
Indéterminé |
|
|
Affections hématologiques et du système lymphatique |
Inhibition du facteur VIII |
Peu fréquent (PPT)* Très fréquent (PUP)* |
|
Inhibition du facteur de von Willebrand |
Très rare |
|
|
Affections respiratoires, thoraciques et médiastinales |
Toux |
Indéterminé |
|
Affections du système nerveux |
Étourdissements |
Indéterminé |
|
Affections gastro-intestinales |
Douleurs abdominales |
Indéterminé |
|
Affections musculo-squelettiques et du tissu conjonctif |
Douleurs dorsales |
Indéterminé |
* La fréquence est déterminée d’après des études sur des produits de facteur VIII menées auprès de patients atteints d’hémophilie A sévère. PPT = patients précédemment traités, PUP = patients non traités précédemment (previously-untreated patients).
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr/.
Aucun symptôme lié à un surdosage avec le FVW ou le facteur VIII humain n’a été rapporté.
Des événements thromboemboliques sont possibles en cas de surdosage important.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Maladie de von Willebrand
Le FVW (issu du concentré) est un constituant normal du plasma humain et agit comme le FVW endogène.
L’administration de FVW permet la correction des anomalies de l’hémostase présentes chez les patients souffrant d’un déficit en FVW, à deux niveaux :
· Le FVW rétablit l’adhésion des plaquettes au sous-endothélium vasculaire au niveau de la lésion (en fixant à la fois le sous-endothélium vasculaire et la membrane plaquettaire), permettant l’hémostase primaire comme le montre la réduction du temps de saignement. Cet effet intervient immédiatement et dépend pour une grande part du niveau de polymérisation de la protéine ;
· Le FVW produit une correction retardée du déficit associé en facteur VIII. Administré par voie intraveineuse, le FVW se lie au facteur VIII endogène (qui est produit normalement par le patient) et, en stabilisant ce facteur, réduit sa dégradation rapide.
Pour ces raisons, l’administration de FVW pur (concentré de FVW présentant un faible taux de facteur VIII) permet de normaliser le taux de FVIII:C dans un deuxième temps après la première perfusion. L’administration de concentrés de FVW contenant du facteur VIII permet de normaliser le taux de FVIII:C immédiatement après la première perfusion.
Outre son rôle protecteur vis-à-vis du facteur VIII, le FVW intervient en tant que médiateur de l’adhésion plaquettaire au niveau des lésions vasculaires et joue un rôle dans l’agrégation plaquettaire.
Hémophilie A
Le complexe facteur VIII/facteur de von Willebrand est constitué de deux molécules (facteur VIII et facteur de von Willebrand) ayant deux fonctions physiologiques différentes. Injecté à un patient hémophile, le facteur VIII se lie au facteur de von Willebrand dans la circulation du patient.
Le facteur VIII activé agit en tant que cofacteur du facteur IX activé, en accélérant la conversion du facteur X en facteur X activé. Le facteur X activé convertit la prothrombine en thrombine. La thrombine convertit alors le fibrinogène en fibrine et un caillot peut se former.
L’hémophilie A est un déficit de la coagulation sanguine héréditaire et lié au sexe, dû à une diminution des taux du FVIII:C, et se caractérise par des hémorragies profuses dans les articulations, les muscles, ou les organes internes, soit spontanément ou à la suite de traumatismes accidentels ou chirurgicaux. A l’aide d’un traitement de substitution, les taux plasmatiques du facteur VIII sont augmentés, permettant ainsi une correction temporaire du déficit en ce facteur et une correction des risques hémorragiques.
Il est à noter que le taux de saignement annualisé (TSA) n’est pas comparable entre les différents concentrés de facteur ni entre les différentes études cliniques.
Outre son rôle en tant que protéine protectrice du facteur VIII, le facteur de von Willebrand permet l’adhésion des plaquettes aux sites des lésions vasculaires et participe à l’agrégation plaquettaire.
5.2. Propriétés pharmacocinétiques
Le FVW (issu du concentré) est un constituant normal du plasma humain et agit comme le FVW endogène.
Les résultats suivants ont été observés, sur la base d’une méta-analyse de 3 études pharmacocinétiques ayant inclus 24 patients évaluables présentant tous les types de FVW.
|
|
Tous types VWD |
VWD type 1 |
VWD type 2 |
VWD type 3 |
||||||||||||||||
|
Paramètre |
N |
Moy. |
SD |
Min. |
Max. |
N |
Moy. |
SD |
Min. |
Max. |
N |
Moy. |
SD |
Min. |
Max. |
N |
Moy. |
SD |
Min. |
Max. |
|
Récupération (%/UI/kg) |
24 |
1,56 |
0,48 |
0,90 |
2,93 |
2 |
1,19 |
0,07 |
1,14 |
1,24 |
5 |
1,83 |
0,86 |
0,98 |
2,93 |
17 |
1,52 |
0,32 |
0,90 |
2,24 |
|
ASC (0-inf) (h*%) |
23 |
1981 |
960 |
593 |
4831 |
2 |
2062 |
510 |
1701 |
2423 |
5 |
2971 |
1383 |
1511 |
4831 |
16 |
1662 |
622 |
593 |
2606 |
|
T 1/2 (h) |
24 |
23,3 |
12,6 |
7,4 |
58,4 |
2 |
39,7 |
18,3 |
26,7 |
52,7 |
5 |
34,9 |
16 |
17,5 |
58,4 |
17 |
18 |
6,2 |
7,4 |
30,5 |
|
TRM(h) |
24 |
33,1 |
19 |
10,1 |
89,7 |
2 |
53,6 |
25,9 |
35,3 |
71,9 |
5 |
53,5 |
24,6 |
27,8 |
89,7 |
17 |
24,7 |
8,5 |
10,1 |
37,7 |
|
Clairance (ml/h/kg) |
24 |
3,29 |
1,67 |
0,91 |
7,41 |
2 |
2,66 |
0,85 |
2,06 |
3,27 |
5 |
1,95 |
1,02 |
0,91 |
3,31 |
17 |
3,76 |
1,69 |
1,83 |
7,41 |
ASC : Aire sous la courbe ;TRM : Temps de résidence moyen dans l’organisme
Hémophilie A
Le facteur VIII (issu du concentré) est un constituant normal du plasma humain et agit comme le facteur VIII endogène. Après l’injection du produit, environ deux tiers à trois quarts du facteur VIII restent dans la circulation. Le taux d’activité plasmatique du facteur VIII obtenu doit être entre 80 et 120% de l’activité coagulante de l’activité du facteur VIII prévue.
L’activité plasmatique du facteur VIII diminue suivant une courbe exponentielle décroissante en deux phases. Dans la phase initiale, la distribution entre le compartiment intravasculaire et les autres compartiments (fluides corporels) se fait avec une demi-vie d’élimination plasmatique de 3 à 6 heures. Dans la phase suivante, plus lente, la demi-vie varie entre 8 et 18 heures, avec une moyenne de 15 heures. Ceci correspond à la vraie demi-vie biologique.
Les résultats suivants ont été observés dans une étude clinique incluant 12 patients (test chromogénique, détermination à double mesure) :
|
Paramètre |
Visite initiale |
Visite à 6 mois |
||
|
Moy. |
SD |
Moy. |
SD |
|
|
Récupération |
FVIII:C 2,27 |
1,20 |
FVIII:C 2,26 |
1,19 |
|
ASCnorm |
FVIII:C 31,3 |
7,31 |
FVIII:C 33,8 |
10,9 |
|
Demi-vie (h) |
FVIII:C 11,2 |
2,85 |
FVIII:C 11,8 |
3,37 |
|
TRM (u) |
FVIII:C 15,3 |
3,5 |
FVIII:C 16,3 |
4,6 |
|
Clairance |
FVIII:C |
0,86 |
FVIII:C |
1,04 |
ASC : Aire sous la courbe ; TRM : Temps de résidence moyen ; SD : Déviation standard
5.3. Données de sécurité préclinique
Les tests conventionnels de sécurité de ces composés ne sont pas requis sur les animaux étant donné qu’ils n’ajouteraient aucune information utile à l’expérience clinique existante.
Poudre : Chlorure de sodium, glycine, saccharose, citrate de sodium et chlorure de calcium.
Solvant : Eau pour préparations injectables avec 0,1% de Polysorbate 80.
Seuls les dispositifs pour injection/perfusion fournis doivent être utilisés car le traitement peut ne pas être efficace en raison de l’adsorption des facteurs VIII et facteur de von Willebrand sur la surface interne de certains matériels pour injection/perfusion.
La stabilité de la solution reconstituée est de 4 heures à température ambiante (maximum de +25°C). Afin d’éviter toute contamination, la solution doit être utilisée immédiatement après reconstitution.
6.4. Précautions particulières de conservation
Le produit peut être conservé pendant 2 mois à température ambiante (max. +25°C). Dans ce cas, la durée de conservation est de 2 mois, à partir du moment où le produit a été retiré du réfrigérateur pour la première fois. Le patient doit noter la nouvelle date de péremption sur l’emballage extérieur. La solution reconstituée doit être uniquement utilisée en une seule fois. Toute solution non utilisée doit être éliminée.
Pour les conditions de conservation du médicament après reconstitution, voir la rubrique 6.3.
6.5. Nature et contenu de l'emballage extérieur
EQWILATE 500 UI de FVW et 500 UI FVIII
Un emballage contient :
· 1 flacon de poudre en verre de type 1, fermé par un bouchon (caoutchouc bromobutyle) et scellé par un capuchon amovible.
· 1 flacon de solvant (5 ml d’eau pour préparations injectables avec 0,1% de Polysorbate 80) en verre de type 1, fermé par un bouchon (caoutchouc halogénobutyle) et scellé par un capuchon amovible.
· 1 boîte de matériel pour injection intraveineuse (1 dispositif de transfert, 1 trousse de perfusion, 1 seringue jetable)
· 2 compresses imbibées d’alcool
Toutes les présentations peuvent ne pas être commercialisées.
6.6. Précautions particulières d’élimination et de manipulation
Veuillez lire toutes les instructions et les respecter soigneusement !
Ne pas utiliser EQWILATE après la date de péremption mentionnée sur l'étiquette.
Pendant la procédure décrite ci-dessous, la stérilité doit être maintenue !
Avant l’administration, le médicament reconstitué doit être inspecté visuellement pour y déceler la présence de particules et de coloration anormale.
La solution doit être limpide ou légèrement opalescente. N'utilisez pas de solutions troubles ou présentant des dépôts.
Utiliser immédiatement la solution préparée afin de prévenir toute contamination microbienne.
N'utiliser que la trousse de perfusion fournie. L'utilisation d'un autre matériel d'injection/perfusion peut induire des risques additionnels et un échec du traitement.
Instructions pour la préparation de la solution:
Ne pas utiliser le produit directement après sa sortie du réfrigérateur. Amener le solvant et la poudre contenus dans les flacons fermés à température ambiante.
Retirer les capuchons amovibles des deux flacons et nettoyer les bouchons en caoutchouc avec l'une des compresses imbibées d'alcool fournies.
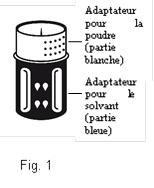
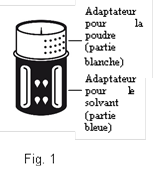
Le dispositif de transfert est représenté à la Fig. 1.
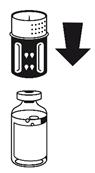
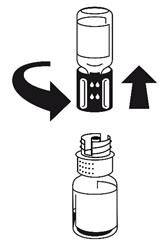
(Fig. 2 + 3). Placer le flacon de solvant sur une surface plane et le tenir fermement. Prendre le dispositif de transfert et le retourner. Placer la partie bleue du dispositif de transfert sur le dessus du flacon de solvant et appuyer fermement jusqu'à ce qu'il s'enclenche Ne pas le faire tourner au moment de le fixer.
|
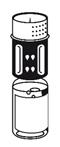
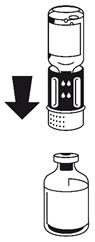
(Fig. 4). Placer le flacon de poudre sur une surface plane et le tenir fermement. Prendre le flacon de solvant avec le dispositif de transfert fixé et le retourner. Placer la partie blanche sur le dessus du flacon de poudre et appuyer fermement jusqu'à ce qu'il s'enclenche Ne pas le faire tourner au moment de le fixer. Le solvant s'écoule automatiquement dans le flacon de poudre. |
|
||
|
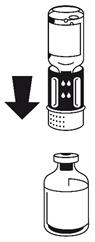
(Fig. 5) Les deux flacons toujours fixés, agiter doucement le flacon de poudre en le faisant tournoyer jusqu'à ce que le produit soit dissous. La dissolution est terminée en moins de 10 minutes à température ambiante. Il peut se produire une légère formation de mousse pendant la préparation. Dévissez le dispositif de transfert en deux parties. La mousse va disparaître. Eliminer le flacon de solvant vide avec la partie bleue du dispositif de transfert. |
|
||
|
|
|
|
|
Instructions pour l’injection :
À titre de précaution, le pouls doit être mesuré avant et pendant l'injection. S'il se produit une forte augmentation de la fréquence cardiaque, réduire la vitesse d'injection ou interrompre l'administration pendant un court moment.
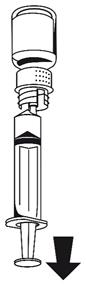
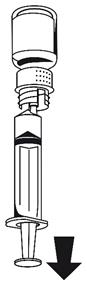
(Fig. 6).Fixer la seringue à la partie blanche du dispositif de transfert. Retourner le flacon et prélever la solution dans la seringue
La solution doit être limpide ou légèrement opalescente.
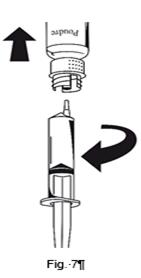
(Fig. 7). Dès que la solution a été transférée, tenir fermement le piston de la seringue (en la tenant tournée vers le bas) et retirer la seringue du dispositif de transfert
Eliminer le flacon vide ainsi que la partie blanche du dispositif de transfert.
![]()
![]()
Nettoyer le site d'injection choisi avec l'une des compresses imbibées d'alcool fournies.
Fixer la trousse de perfusion fournie à la seringue.
Introduire l'aiguille pour injection dans la veine choisie. Si un garrot a été utilisé pour rendre la veine plus facile à voir, ce garrot doit être relâché avant de commencer à injecter EQWILATE.
Du sang ne doit pas pénétrer dans la seringue, en raison du risque de formation de caillots de fibrine.
Injecter la solution dans la veine lentement, pas plus vite que 2 à 3 ml par minute.
Si plus qu'un flacon d’EQWILATE est utilisé pour un traitement, la même aiguille pour injection et la même seringue peuvent être réutilisées. Le dispositif de transfert est réservé à un usage unique.
Tout produit non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
62 BIS, AVENUE ANDRE MORIZET
92100 BOULOGNE BILLANCOURT
FRANCE
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· 34009 550 450 5 2: poudre en flacon (verre de type I) + 5 mL de solvant (5 mL d’eau pour préparations injectables avec 0,1% de polysorbate 80) en flacon (verre de type I) avec dispositifs médicaux. Boîte de 1.
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
[à compléter ultérieurement par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE
[à compléter ultérieurement par le titulaire]
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Liste I.
Médicament soumis à prescription hospitalière.
Agréé à l’usage des Collectivités. Inscrit sur la liste Rétrocession et sur la liste des spécialités prises en charge en sus des GHS.
ANSM - Mis à jour le : 07/08/2025
EQWILATE 500 UI FVW / 500 UI FVIII, poudre et solvant pour solution injectable
Facteur von Willebrand humain / facteur VIII de coagulation humain
· Gardez cette notice. Vous pourriez avoir besoin de la relire.
· Si vous avez d’autres questions, interrogez votre médecin ou votre pharmacien.
· Ce médicament vous a été personnellement prescrit. Ne le donnez pas à d’autres personnes. Il pourrait leur être nocif, même si les signes de leur maladie sont identiques aux vôtres.
· Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
1. Qu'est-ce que EQWILATE 500 UI FVW / 500 UI FVIII, poudre et solvant pour solution injectable et dans quels cas est-il utilisé ?
2. Quelles sont les informations à connaître avant d'utiliser EQWILATE 500 UI FVW / 500 UI FVIII, poudre et solvant pour solution injectable ?
3. Comment utiliser EQWILATE 500 UI FVW / 500 UI FVIII, poudre et solvant pour solution injectable ?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver EQWILATE 500 UI FVW / 500 UI FVIII, poudre et solvant pour solution injectable ?
6. Contenu de l’emballage et autres informations.
1. QU’EST-CE QUE EQWILATE 500 UI FVW / 500 UI FVIII, poudre et solvant pour solution injectable ET DANS QUELS CAS EST-IL UTILISE ?
Code ATC : B02BD06.
EQWILATE fait partie de la classe pharmacothérapeutique des médicaments désignés sous le nom de facteurs de coagulation et contient du facteur von Willebrand (FVW) et du facteur VIII de coagulation du sang humain. Ces deux protéines jouent un rôle dans la coagulation du sang.
Maladie de von Willebrand
EQWILATE s’utilise pour le traitement et la prévention des hémorragies chez les patients atteints de maladie de von Willebrand, terme qui désigne en réalité un groupe de maladies apparentées. La maladie de von Willebrand est un trouble de la coagulation sanguine qui se manifeste par des saignements anormalement long. Ce phénomène peut être dû à un manque de FVW dans le sang ou au fait que le FVW n’agit pas comme il le devrait.
Hémophilie A
EQWILATE s’utilise pour le traitement et la prévention des hémorragies chez les patients atteints d’hémophilie A. Ceci est un trouble au cours duquel un saignement peut se poursuivre pendant une durée anormalement longue. Elle est due à un déficit congénital de facteur VIII dans le sang.
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT D’UTILISER EQWILATE 500 UI FVW / 500 UI FVIII, poudre et solvant pour solution injectable ?
N’utilisez jamais EQWILATE 500 UI FVW / 500 UI FVIII, poudre et solvant pour solution injectable :
Si vous êtes allergique (hypersensible) au facteur von Willebrand, au facteur VIII de coagulation du sang ou à l’un des autres composants contenus dans ce médicament mentionnés dans la rubrique 6).
Avertissements et précautions
Adressez-vous à votre médecin ou pharmacien avant d’utiliser EQWILATE 500 UI FVW / 500 UI FVIII, poudre et solvant pour solution injectable.
EQWILATE, comme pour tout médicament contenant des protéines et injecté dans une veine (administration intraveineuse) des réactions allergiques peuvent apparaître. Soyez attentif à tout signe précoce de réaction allergique (d’hypersensibilité) tel que :
· urticaire
· éruption cutanée
· sensation d’oppression au niveau de la poitrine
· respiration sifflante
· hypotension
· anaphylaxie (lorsqu’une partie ou l’ensemble des symptômes susmentionnés se développent rapidement et intensément)
En cas d’apparition de ce type de symptômes, cessez immédiatement l’injection et contactez un médecin.
Lorsque des médicaments sont préparés à partir de sang ou de plasma humain, des mesures de prévention de la transmission d’agents infectieux sont mises en place. Celles-ci comprennent une sélection clinique soigneuse des donneurs de sang et de plasma de façon à exclure les donneurs risquant d’être porteurs d’infections, et le contrôle sur chaque don et des mélanges de plasma pour la présence de virus/d’infection. Les fabricants de ces médicaments mettent également en œuvre, dans leur procédé de fabrication, des étapes capables d’éliminer ou d’inactiver des virus.
Cependant, lorsque des médicaments préparés à partir de sang ou de plasma humain sont administrés, le risque de transmission de maladies infectieuses ne peut être totalement exclu. Ceci s’applique également à tous les virus inconnus ou émergents ou autres types d’agents infectieux.
Les mesures prises sont considérées comme efficaces contre les virus enveloppés tels que les virus de l’immunodéficience humaine (VIH), de l’hépatite B et de l’hépatite C, ainsi que contre le virus non enveloppé de l’hépatite A. Les mesures prises peuvent être d’efficacité limitée vis-à-vis de virus non enveloppés comme le parvovirus B19.
L’infection par le parvovirus B19 peut être sévère chez la femme enceinte (infection fœtale) et chez les personnes atteintes de déficit immunitaire ou de certains types d’anémie (par exemple anémie falciforme ou dégradation anormale des globules rouges).
Il est fortement recommandé, qu’à chaque administration d’EQWILATE, de prendre note du nom et du numéro de lot du produit afin de maintenir un lien entre le patient et le numéro de lot du médicament.
Une vaccination appropriée (hépatites A et B) des patients recevant des facteurs de coagulation est recommandée.
Maladie de von Willebrand
Voir la section 4. (Maladie de von Willebrand) pour connaître les effets indésirables associés au traitement de la maladie de von Willebrand.
Hémophilie A
L’apparition d’inhibiteurs du facteur VIII est une complication connue pouvant survenir pendant le traitement avec un produit de facteur VIII, peu importe lequel. Ces inhibiteurs, notamment à une forte concentration, empêchent le traitement d’être efficace ; vous ou votre enfant serez donc surveillé étroitement afin de déceler l’apparition de ces inhibiteurs. Si un saignement n’est pas correctement contrôlé avec EQWILATE, informez-en immédiatement votre médecin.
Voir la section 4. (Hémophilie A) pour connaître les effets indésirables associés au traitement de l’hémophilie A.
Enfants et adolescents
Sans objet.
Autres médicaments et EQWILATE 500 UI FVW / 500 UI FVIII, poudre et solvant pour solution injectable
Bien que l’on n’ait connaissance d’aucune influence d’autres médicaments sur EQWILATE, informez votre médecin ou pharmacien si vous prenez ou avez pris récemment un autre médicament, y compris un médicament obtenu sans ordonnance.
Ne mélangez pas EQWILATE avec un autre médicament lors de l’injection.
EQWILATE 500 UI FVW / 500 UI FVIII, poudre et solvant pour solution injectable avec des aliments et, boissons et de l’alcool
Sans objet.
Grossesse, allaitement et fertilité
Si vous êtes enceinte ou que vous allaitez, si vous pensez être enceinte ou planifiez une grossesse, demandez conseil à votre médecin ou pharmacien avant de prendre ce médicament.
Conduite de véhicules et utilisation de machines
Sans objet.
EQWILATE 500 UI FVW / 500 UI FVIII, poudre et solvant pour solution injectable contient du sodium
Ce médicament contient jusqu’à 58,7 mg de sodium composant principal du sel de cuisine/table) par flacon. Cela équivaut à 2,94% de l’apport alimentaire quotidien maximal recommandé de sodium pour un adulte.
3. COMMENT UTILISER EQWILATE 500 UI FVW / 500 UI FVIII, poudre et solvant pour solution injectable ?
Posologie
Votre médecin vous indiquera la dose et la fréquence d’administration d’EQWILATE adaptée à votre cas. Respectez toujours la posologie indiquée par votre médecin. En cas d’incertitude, consultez votre médecin ou votre pharmacien.
Si vous avez utilisé plus de EQWILATE 500 UI FVW / 500 UI FVIII, poudre et solvant pour solution injectable que vous n’auriez dû
Aucun symptôme de surdosage de FVW ou de facteur VIII humain n’a été décrit. Il convient néanmoins de ne pas dépasser la dose recommandée.
Si vous avez utilisé trop de EQWILATE 500 UI FVW / 500 UI FVIII, poudre et solvant pour solution injectable, prenez immédiatement contact avec votre médecin ou votre pharmacien.
Si vous oubliez d’utiliser EQWILATE 500 UI FVW / 500 UI FVIII, poudre et solvant pour solution injectable
Ne prenez pas de dose double pour compenser la dose que vous avez oublié de prendre.
Si vous avez d’autres questions sur l’utilisation de ce médicament, demandez plus d’informations à votre médecin ou à votre pharmacien.
Si vous arrêtez d’utiliser EQWILATE 500 UI FVW / 500 UI FVIII, poudre et solvant pour solution injectable
Sans objet.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
Comme tous les médicaments, ce médicament peut provoquer des effets indésirables, mais ils ne surviennent pas systématiquement chez tout le monde.
Bien que peu fréquentes, une hypersensibilité ou des réactions allergiques ont été observées. Les symptômes sont notamment :
· brûlure et picotement au site de perfusion
· frissons
· bouffées de chaleur
· maux de tête
· urticaire
· diminution de la tension artérielle (hypotension)
· fatigue (léthargie)
· nausées
· nervosité
· accélération de la fréquence cardiaque (tachycardie)
· sensation d’oppression au niveau de la poitrine
· sensation de fourmillements ou de picotements
· vomissements
· respiration sifflante
· gonflement de différentes parties du corps (œdème de Quincke)
Si vous présentez l’un des symptômes susmentionnés, signalez-le à votre médecin.
Vous devez cesser d’utiliser EQWILATE et consulter immédiatement un médecin en cas de symptômes d’œdème de Quincke, par exemple :
· gonflement du visage, de la langue ou de la gorge (pharynx)
· difficultés à avaler
· urticaire et difficultés à respirer
Bien que peu fréquente, de la fièvre a également été observée.
Une douleur abdominale, une douleur dorsale, une douleur thoracique, une toux et un étourdissement peuvent se manifester, mais la fréquence de ces effets indésirables est indéterminée.
Dans de très rares cas, l’hypersensibilité peut engendrer une réaction allergique sévère appelée anaphylaxie (lorsqu’une partie ou l’ensemble des symptômes ci-dessus se développent rapidement et intensément), qui peut se manifester par un choc. En cas de choc anaphylactique, un traitement conforme aux recommandations médicales actuelles lors de choc est indispensable.
Maladie de von Willebrand
Lors d’utilisation d’un produit à base de FVW contenant du facteur VIII pour le traitement de la maladie de von Willebrand, un traitement continu peut engendrer une augmentation excessive du facteur VIII dans le sang. Cela peut se traduire par un risque accru de perturbation de la circulation sanguine (thrombose).
Si vous présentez des facteurs de risque connus, vous devez faire l’objet d’un suivi pour les signes précoces de thrombose. Votre médecin envisagera éventuellement des mesures de prévention (prophylaxie) des événements thrombotiques conformément aux recommandations actuelles.
Les patients atteints de maladie de von Willebrand (particulièrement de type 3) sont susceptibles de développer des inhibiteurs (anticorps neutralisants) dirigées contre le FVW au cours du traitement par du FVW. Dans ces très rares cas, les inhibiteurs peuvent empêcher EQWILATE d’agir efficacement.
En cas de saignements persistants, il convient de rechercher la présence de ces inhibiteurs dans le sang.
Ces inhibiteurs sont susceptibles d’accroître le risque de réactions allergiques sévères (choc anaphylactique). Si vous présentez une réaction allergique, on recherchera la présence d’inhibiteurs.
Si des inhibiteurs sont présents dans votre sang, vous devez contacter un médecin possédant une expérience du traitement des patients atteint de troubles de la coagulation. Chez les patients qui présentent des quantités élevées d’inhibiteurs, un autre type de traitement peut s’avérer utile et doit être envisagé.
Hémophilie A
Chez les enfants n’ayant jamais été traités par un produit de facteur VIII, des inhibiteurs, ou anticorps, (voir rubrique 2) peuvent apparaître effet indésirable très fréquent (pouvant toucher plus d’1 patient sur 10). Cependant, chez les patients ayant déjà reçu un traitement par un produit de facteur VIII pendant plus de 150 jours, ce risque est peu fréquent (peut toucher moins d’1 patient sur 100). En cas d’apparition d’inhibiteurs, le traitement cessera d’être efficace et vous, ou votre enfant, pourriez avoir un saignement persistant. Dans ce cas, consultez immédiatement votre médecin. Ces inhibiteurs sont susceptibles d’accroître le risque de réactions allergiques sévères (choc anaphylactique). Si vous présentez une réaction allergique, on recherchera la présence d’inhibiteurs.
Peu fréquent : peut affecter jusqu’à 1 utilisateur sur 100
Rare : peut affecter jusqu’à 1 utilisateur sur 1.000
Très rare : peut affecter jusqu’à 1 utilisateur sur 10.000
On ne dispose pas de suffisamment de données pour recommander l’utilisation d’EQWILATE chez des patients non préalablement traités.
Effets indésirables supplémentaires chez les enfants
L’expérience du traitement avec EQWILATE chez les enfants de moins de 6 ans est limitée.
Pour des informations sur la sécurité virale, voir section 2. (Avertissements et précautions).
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin, votre pharmacien ou à votre infirmier/ère. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet: https://signalement.social-sante.gouv.fr/.
En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.
5. COMMENT CONSERVER EQWILATE 500 UI FVW / 500 UI FVIII, poudre et solvant pour solution injectable ?
Tenir ce médicament hors de la vue et de la portée des enfants.
Conserver la poudre et le flacon de solvant au réfrigérateur (entre +2°C et +8°C).
Ne pas congeler.
Conserver les flacons dans l’emballage extérieur d’origine à l’abri de la lumière.
N’utilisez pas ce médicament après la date de péremption indiquée sur l’étiquette après EXP. La date de péremption fait référence au dernier jour de ce mois.
EQWILATE peut être conservé à température ambiante (max. +25°C) pendant 2 mois. Dans ce cas, la durée de conservation est de 2 mois après que le produit a été retiré pour la première fois du réfrigérateur. Vous devez inscrire la nouvelle date de péremption sur l’emballage extérieur.
La poudre ne doit être dissoute qu’immédiatement avant l’injection. La stabilité de la solution a été démontrée pendant 4 heures à température ambiante. Néanmoins, pour éviter une contamination microbienne, la solution doit être utilisée immédiatement et en une seule fois.
Ne jetez aucun médicament au tout-à-l’égout ou avec les ordures ménagères. Demandez à votre pharmacien d’éliminer les médicaments que vous n’utilisez plus. Ces mesures contribueront à protéger l’environnement.
6. CONTENU DE L’EMBALLAGE ET AUTRES INFORMATIONS
Ce que contient EQWILATE 500 UI FVW / 500 UI FVIII, poudre et solvant pour solution injectable
Les substances actives sont le facteur von Willebrand humain et le facteur VIII de coagulation humain.
Les autres composants sont du chlorure de sodium, de la glycine, du saccharose, du citrate de sodium et du chlorure de calcium.
Solvant : eau pour préparations injectables avec 0,1% de polysorbate 80
Poudre lyophilisée : poudre blanche ou jaune pâle ou solide friable
Solution reconstituée : doit être lipide ou légèrement opalescente
EQWILATE est fourni sous forme de poudre et de solvant pour solution injectable. Deux conditionnements sont proposés :
· EQWILATE 500 UI FVW / 500 UI FVIII, poudre et solvant pour solution injectable, contient respectivement 500 UI de facteur von Willebrand humain et 500 UI de facteur VIII de coagulation humain par flacon. Après reconstitution avec 5 ml d’eau pour injection contenant 0,1% de polysorbate 80 (solvant), le produit contient environ 100 UI/ml de de facteur von Willebrand humain et 100 UI/ml facteur VIII de coagulation humain.
Contenu de l’emballage
1 flacon de poudre lyophilisée
1 flacon de solvant
1 boîte de matériel pour injection intraveineuse (1 dispositif de transfert, 1 trousse de perfusion, 1 seringue jetable)
2 compresses imbibées d’alcool
Titulaire de l’autorisation de mise sur le marché
62 BIS, AVENUE ANDRE MORIZET
92100 BOULOGNE BILLANCOURT
FRANCE
Exploitant de l’autorisation de mise sur le marché
62 BIS, AVENUE ANDRE MORIZET
92100 BOULOGNE BILLANCOURT
FRANCE
OCTAPHARMA PHARMAZEUTIKA PRODUKTIONS GES.M.B.H
OBERLAAER STR 235
A-1100 VIENNE
AUTRICHE
Noms du médicament dans les Etats membres de l'Espace Economique Européen
Ce médicament est autorisé dans les Etats membres de l'Espace Economique Européen sous les noms suivants : Conformément à la réglementation en vigueur.
[à compléter ultérieurement par le titulaire]
La dernière date à laquelle cette notice a été révisée est :
[à compléter ultérieurement par le titulaire]
Des informations détaillées sur ce médicament sont disponibles sur le site Internet de l’ANSM (France).
Instructions pour le traitement à domicile
Veuillez lire toutes les instructions et les respecter soigneusement !
Ne pas utiliser EQWILATE après la date de péremption mentionnée sur l'étiquette.
Pendant la procédure décrite ci-dessous, la stérilité doit être maintenue !
Avant l’administration, le médicament reconstitué doit être inspecté visuellement pour y déceler la présence de particules et de coloration anormale.
La solution doit être limpide ou légèrement opalescente. N'utilisez pas de solutions troubles ou présentant des dépôts.
Utilisez immédiatement la solution préparée afin de prévenir toute contamination microbienne.
N'utilisez que la trousse d'injection fournie. L'utilisation d'un autre matériel d'injection/perfusion peut induire des risques additionnels et un échec du traitement.
Instructions pour la préparation de la solution:
Ne pas utiliser le produit directement après la sortie du réfrigérateur. Amener le solvant et la poudre contenus dans les flacons fermés à température ambiante.
Retirer les capuchons amovibles des deux flacons et nettoyer les bouchons en caoutchouc avec l'une des compresses imbibées d'alcool fournies.
Le dispositif de transfert est représenté à la Fig. 1.
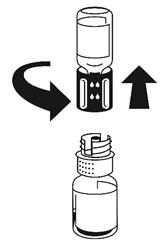
(Fig. 2 + 3) Placer le flacon de solvant sur une surface plane et le tenir fermement. Prendre le dispositif de transfert et le retourner. Placer la partie bleue du dispositif de transfert sur le dessus du flacon de solvant et appuyer fermement jusqu'à ce qu'il s'enclenche.
Ne pas le faire tourner au moment de le fixer.
![]()
![]()
![]()
![]()
|
(Fig. 4). Placer le flacon de poudre sur une surface plane et le tenir fermement. Prendre le flacon de solvant avec le dispositif de transfert fixé et le retourner. Placer la partie blanche sur le dessus du flacon de poudre et appuyer fermement jusqu'à ce qu'il s'enclenche Ne pas le faire tourner au moment de le fixer. Le solvant s'écoule automatiquement dans le flacon de poudre. |
|
|
Les deux flacons toujours fixés, agiter doucement le flacon de poudre en le faisant tournoyer jusqu'à ce que le produit soit dissous. La dissolution est terminée en moins de 10 minutes à température ambiante. Il peut se produire une légère formation de mousse pendant la préparation. (Fig. 5). Dévissez le dispositif de transfert en deux parties La mousse va disparaître. Eliminer le flacon de solvant vide avec la partie bleue du dispositif de transfert. |
|
Instructions pour l'injection:
À titre de précaution, le pouls doit être mesuré avant et pendant l'injection. S'il se produit une forte augmentation de la fréquence cardiaque, réduire la vitesse d'injection ou interrompez l'administration pendant un court moment.
|
(Fig. 6) Fixer la seringue à la partie blanche du dispositif de transfert. Retourner le flacon et prélever la solution dans la seringue. La solution doit être limpide ou légèrement opalescente. |
|
|
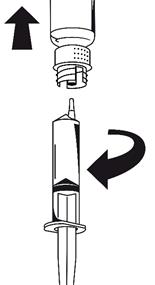
(Fig. 7) Dès que la solution a été transférée, tenir fermement le piston de la seringue (en la tenant tournée vers le bas) et retirer la seringue du dispositif de transfert.
Eliminer le flacon vide ainsi que la partie blanche du dispositif de transfert. |
|
![]()
Nettoyer le site d'injection choisi avec l'une des compresses imbibées d'alcool fournies.
Fixer la trousse de perfusion fournie à la seringue.
Introduire l'aiguille pour injection dans la veine choisie. Si un garrot a été utilisé pour rendre la veine plus facile à voir, ce garrot doit être relâché avant de commencer à injecter EQWILATE.
Du sang ne doit pas pénétrer dans la seringue, en raison du risque de formation de caillots de fibrine.
Injecter la solution dans la veine lentement, pas plus vite que 2 à 3 ml par minute.
Si plus qu'un flacon d’EQWILATE est utilisé pour un traitement, la même aiguille pour injection et la même seringue peuvent être réutilisées. Le dispositif de transfert est réservé à un usage unique.
Tout produit non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.
Ne pas mélanger EQWILATE à d’autres médicaments ni l’injecter avec d’autres médicaments (en utilisant le même matériel pour injection).
Utiliser uniquement la trousse de perfusion fournie. L’utilisation d’un autre matériel d’injection/de perfusion peut engendrer des risques supplémentaires ou un échec du traitement (adsorption du FVW /facteur VIII sur les surfaces internes de certains équipements de perfusion).