Dernière mise à jour le 01/12/2025
FOSOMEL, émulsion pour perfusion
Ce médicament n'est ou ne sera bientôt plus disponible sur le marché.
Si vous prenez actuellement ce médicament, il vous est recommandé d'en parler avec votre médecin
ou avec votre pharmacien qui pourra vous orienter vers un autre traitement.
Indications thérapeutiques
FOSOMEL contient des acides aminés (constituants utilisés pour fabriquer des protéines), du glucose (des sucres), des lipides (des graisses) et des sels (des électrolytes).
FOSOMEL est destiné à alimenter des adultes lorsque le patient ne peut pas s’alimenter suffisamment ou normalement par la bouche.
Composition en substances actives
-
émulsion ( Composition pour 1085 mL d'émulsion après mélange )
- > alanine 11,41 g
- > arginine 6,34 g
- > glycine 5,68 g
- > histidine 2,64 g
- > isoleucine 3,31 g
- > leucine 4,02 g
- lysine3,20 g
- sous forme de : chlorhydrate de lysine3,99 g
- > méthionine 2,20 g
- > phénylalanine 3,09 g
- > proline 3,75 g
- > sérine 2,76 g
- > thréonine 2,31 g
- > L-tryptophane 0,99 g
- > tyrosine 0,22 g
- > valine 3,20 g
- > acétate de sodium trihydraté 3,10 g
- > chlorure de potassium 2,47 g
- > chlorure de calcium dihydraté 0,41 g
- > sulfate de magnésium heptahydraté 1,36 g
- > glycérophosphate de sodium hydraté 3,26 g
- > sulfate de zinc heptahydraté 0,013 g
- glucose137,8 g
- sous forme de : glucose monohydraté151,5 g
Service médical rendu (SMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprès de la HAS (plus d'informations dans l'aide). Les avis et synthèses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur du SMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| Important | Avis du 22/05/2019 | Inscription (CT) | Le service médical rendu par FOSOMEL et FOSEMELPERI est important dans l’indication de l’AMM. |
Amélioration du service médical rendu (ASMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprés de la HAS (plus d'informations dans l'aide). Les avis et synthéses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur de l'ASMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| V (Inexistant) | Avis du 22/05/2019 | Inscription (CT) | Ces spécialités n’apportent pas d’amélioration du service médical rendu (ASMR V) par rapport aux autres spécialités à base de mélanges ternaires disponibles. |
ANSM - Mis à jour le : 02/01/2019
FOSOMEL, émulsion pour perfusion
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
FOSOMEL se présente sous la forme d’une poche en plastique à 3 compartiments. Chaque poche contient une combinaison stérile non pyrogène d’une solution glucidique à 42%, d’une solution d’acides aminés à 10% avec des électrolytes et d’une émulsion lipidique à 20%.
La composition de l’émulsion reconstituée, après mélange du contenu des 3 compartiments est indiquée ci-dessous :
|
Substance active |
1085 mL |
1435 mL |
1820 mL |
|
Huile de poisson, riche en acides oméga-3 |
8,24 g |
10,92 g |
13,84 g |
|
Huile d’olive raffinée |
10,30 g |
13,65 g |
17,30 g |
|
Huile de soja, raffinée |
12,36 g |
16,38 g |
20,76 g |
|
Triglycérides à chaîne moyenne |
10,30 g |
13,65 g |
17,30 g |
|
Alanine |
11,41 g |
15,09 g |
19,13 g |
|
Arginine |
6,34 g |
8,38 g |
10,63 g |
|
Glycine |
5,68 g |
7,51 g |
9,52 g |
|
Histidine |
2,64 g |
3,50 g |
4,44 g |
|
Isoleucine |
3,31 g |
4,37 g |
5,54 g |
|
Leucine |
4,02 g |
5,32 g |
6,75 g |
|
Lysine (sous forme de chlorhydrate de lysine) |
3,20 g |
4,23 g |
5,36 g |
|
Méthionine |
2,20 g |
2,92 g |
3,70 g |
|
Phénylalanine |
3,09 g |
4,08 g |
5,17 g |
|
Proline |
3,75 g |
4,96 g |
6,28 g |
|
Sérine |
2,76 g |
3,65 g |
4,62 g |
|
Thréonine |
2,31 g |
3,06 g |
3,88 g |
|
Tryptophane |
0,99 g |
1,31 g |
1,66 g |
|
Tyrosine |
0,22 g |
0,29 g |
0,37 g |
|
Valine |
3,20 g |
4,23 g |
5,36 g |
|
Acétate de sodium, trihydraté |
3,10 g |
4,10 g |
5,19 g |
|
Chlorure de potassium |
2,47 g |
3,27 g |
4,14 g |
|
Chlorure de calcium, dihydraté |
0,41 g |
0,54 g |
0,68 g |
|
Sulfate de magnésium heptahydraté |
1,36 g |
1,80 g |
2,28 g |
|
Glycérophosphate de sodium hydraté |
3,26 g |
4,32 g |
5,47 g |
|
Sulfate de zinc heptahydraté |
0,013 g |
0,017 g |
0,021 g |
|
Glucose |
137,8 g |
181,9 g |
231,0 g |
Apports nutritionnels de l’émulsion reconstituée pour chaque volume de poche :
|
|
1085 mL |
1435 mL |
1820 mL |
|
|
Azote (g) |
9,1 |
12,0 |
15,3 |
|
|
Acides aminés (g) |
55 |
73 |
92 |
|
|
Glucose (g) |
138 |
182 |
231 |
|
|
Lipides (g) a |
44 |
58 |
73 |
|
|
Energie : |
|
|
|
|
|
Calories totales (kcal) |
1184 |
1567 |
1988 |
|
|
|
Calories non protéiques (kcal) |
964 |
1276 |
1619 |
|
|
Calories glucidiques (kcal)b |
571 |
755 |
958 |
|
|
Calories lipidiques (kcal)c |
393 |
521 |
661 |
|
Ratio calories non protéiques / azote (kcal/g) |
106 |
106 |
106 |
|
|
Ratio calories glucidiques / lipidiques |
59/41 |
59/41 |
59/41 |
|
|
Ratio calories lipidiques / calories totales (kcal) |
33% |
33% |
33% |
|
|
Electrolytes : |
|
|
|
|
|
|
Sodium (mmol) |
44,1 |
58,3 |
73,9 |
|
|
Potassium (mmol) |
33,1 |
43,8 |
55,5 |
|
|
Magnésium (mmol) |
5,5 |
7,3 |
9,3 |
|
|
Calcium (mmol) |
2,8 |
3,7 |
4,7 |
|
|
Phosphore (mmol) |
10,7/13,8d |
14,1/18,3d |
17,9/23,1d |
|
|
Acétate (mmol) |
79,5 |
105 |
133 |
|
|
Chlorure (mmol) |
60,5 |
80,1 |
102 |
|
|
Sulfate (mmol) |
5,6 |
7,4 |
9,3 |
|
|
Zinc (mmol) |
0,04 |
0,06 |
0,07 |
|
pH (environ) |
6,0 |
6,0 |
6,0 |
|
|
Osmolarité (environ) (mOsm/L) |
1440 |
1440 |
1440 |
|
a En tant que somme du contenu de l’huile et des phospholipides.
b En tant que somme du contenu du glucose et du glycérol dans g x 4 kcal/g.
c En tant que somme du contenu de l’huile et des phospholipides dans g x 9 kcal/g.
d Sans le phosphore de l’émulsion lipidique / avec le phosphore de l’émulsion lipidique.
Pour la liste complète des excipients, voir rubrique 6.1.
Aspect du médicament avant reconstitution :
· Les solutions d’acides aminés et de glucose sont claires, incolores ou légèrement jaunes et exemptes de particules.
· L’émulsion lipidique est blanche et homogène.
Après le mélange des 3 compartiments, le produit a l’apparence d’une émulsion blanche.
Osmolarité : env. 1440 mosmol/L
pH après mélange : env. 6,0
4.1. Indications thérapeutiques
4.2. Posologie et mode d'administration
Après ouverture de la poche, il est recommandé d’utiliser le contenu immédiatement et de ne pas le conserver pour une perfusion ultérieure.
Pour les instructions concernant l’administration, la préparation et la manipulation de l’émulsion pour perfusion, voir la rubrique 6.6.
Posologie
La posologie dépend de la dépense énergétique, de l’état clinique, du poids corporel du patient et de sa capacité à métaboliser les constituants de FOSOMEL, ainsi que du supplément d’énergie ou de protéines administré par voie orale/entérale ; le volume de la poche doit donc être choisi en conséquence.
Les besoins journaliers moyens chez l’adulte sont :
· Chez les patients présentant un état nutritionnel normal ou un léger stress catabolique : 0,6 à 0,9 g d’acides aminés/kg/jour (0,10 à 0,15 g d’azote/kg/jour).
· Chez les patients présentant un stress métabolique modéré à élevé, avec ou sans malnutrition : 0,9 à 1,6 g d’acides aminés/kg/jour (0,15 à 0,25 g d’azote/kg/jour).
· Chez les patients présentant un état pathologique particulier (brûlures ou anabolisme marqué par exemple), les besoins azotés peuvent même être supérieurs.
La dose quotidienne maximale dépend de l’état clinique du patient et peut varier d’un jour à l’autre.
Le débit d’administration doit normalement être augmenté progressivement au cours de la première heure et ajusté ensuite en fonction de la dose à administrer, de l’apport volumique journalier et de la durée de la perfusion. (Voir rubrique 4.9).
La durée de perfusion recommandée est comprise entre 14 et 24 heures.
L’intervalle posologique de 13 mL à 31 mL/kg/jour fournira 0,7 à 1,6 g d’acides aminés par kg/jour (ce qui correspond à 0,11 à 0,26 g d’azote/kg/jour) et à 14 à 33 kcal/kg/jour d’énergie totale (11 à 27 kcal/kg/jour d’énergie non protéique).
Le débit maximal de perfusion est de 0,25 g/kg/h pour le glucose, de 0,1 g/kg/h pour les acides aminés et de 0,15 g/kg/h pour les lipides.
Le débit de perfusion ne doit pas dépasser 2,0 mL/kg/h (ce qui correspond à 0,10 g d’acides aminés ; 0,25 g de glucose et 0,08 g de lipides/kg/h).
La dose maximale recommandée est de 35 ml/kg/jour, ce qui apportera 1,8 g d’acides aminés/kg/jour (ce qui correspond à 0,29 g d’azote/kg/jour) ; 4,5 g de glucose/kg/jour ; 1,40 g de lipides/kg/jour et à une énergie totale de 38 kcal/kg/jour (ce qui correspond à 30 kcal/kg/jour d’énergie non protéique).
Population pédiatrique
La sécurité et l’efficacité de FOSOMEL chez les enfants et les adolescents âgés de moins de 18 ans n’ont pas été établies.
Aucune donnée n’est disponible.
Patients insuffisants rénaux/hépatiques
La posologie doit être adaptée à l’état clinique du patient (voir rubrique 4.4).
Mode d’administration
Voie intraveineuse, par perfusion dans une veine centrale.
Pour les instructions concernant la reconstitution du médicament avant administration, voir la rubrique 6.6.
Pour obtenir des informations sur le mélange avec d’autres perfusions/avec le sang avant ou pendant l’administration, voir rubriques 4.5 et 6.6.
· Hyperlipidémie grave
· Insuffisance hépatique grave
· Troubles graves de la coagulation sanguine
· Anomalies congénitales du métabolisme des acides aminés
· Insuffisance rénale grave sans accès à l’hémofiltration ou à la dialyse
· Hyperglycémie non contrôlée
· Concentrations plasmatiques pathologiquement élevées de l’un des électrolytes contenus dans l’émulsion
· Contre-indications générales à un traitement par perfusion : œdème pulmonaire aigu, hyperhydratation et insuffisance cardiaque décompensée
· Etat instable (par exemple, état post-traumatique critique, diabète sucré non compensé, infarctus du myocarde aigu, accident vasculaire cérébral, embolie, acidose métabolique, septicémie sévère, déshydratation hypotonique et coma hyperosmolaire)
4.4. Mises en garde spéciales et précautions d'emploi
Ne peut être administré que dans une veine centrale.
Hypersensibilité ou réaction anaphylactique
La perfusion doit être immédiatement arrêtée en cas d’apparition de signes ou de symptômes d’une réaction allergique (tels que fièvre, frissons, rashs cutanés ou dyspnée).
FOSOMEL contient de l’huile de soja, de l’huile de poisson et des phospholipides d’œuf, qui provoquent des réactions allergiques dans de rares cas. Des réactions d’allergie croisée ont été observées entre les protéines de soja et d’arachide.
FOSOMEL contient du glucose dérivé du maïs, qui peut provoquer des réactions d’hypersensibilité chez les patients allergiques au maïs ou aux produits dérivés du maïs (voir rubrique 4.3).
Précipités vasculaires pulmonaires
Des précipités vasculaires pulmonaires, entraînant une embolie pulmonaire d’origine vasculaire et une détresse respiratoire, d’issue fatale dans certains cas, ont été rapportés chez des patients recevant une nutrition parentérale. L’ajout excessif de calcium et de phosphate augmente le risque de formation de précipités de phosphate de calcium. Il a également été signalé des précipités en l’absence de sel de phosphate dans la solution. Il a également été signalé une formation suspecte de précipités in vivo.
En plus de l'inspection de la solution, le dispositif de perfusion et le cathéter doivent aussi être régulièrement contrôlés afin de détecter toute formation de précipités.
En cas d’apparition de signes de détresse respiratoire, la perfusion doit être arrêtée et une évaluation médicale initiée.
Infection et septicémie
Comme l’utilisation d’une veine induit un risque élevé d’infection, des précautions strictes d’asepsie doivent être prises pour éviter toute contamination lors de l’insertion et de la manipulation du cathéter.
Syndrome de surcharge graisseuse
Un « syndrome de surcharge graisseuse » a été rapporté avec des produits similaires. Il peut être provoqué par une administration incorrecte (par exemple surdosage et/ou vitesse de perfusion supérieure à celle recommandée) ; toutefois, les signes et symptômes de ce syndrome peuvent également survenir lorsque le produit est administré conformément aux instructions. Une capacité réduite ou limitée à métaboliser les lipides contenus dans FOSOMEL, accompagnée d’une prolongation de la clairance plasmatique peut conduire à un « syndrome de surcharge graisseuse ». Ce syndrome est associé à une brusque altération de l’état clinique du patient et se caractérise par des symptômes tels qu’une fièvre, une anémie, une leucopénie, une thrombocytopénie, des troubles de la coagulation, une hyperlipidémie, des infiltrations lipidiques du foie (hépatomégalie), une détérioration de la fonction hépatique et des manifestations au niveau du système nerveux central (p. ex. coma). Le syndrome est généralement réversible après l’arrêt de la perfusion de l’émulsion lipidique.
Utilisation chez des patients présentant un déficit du métabolisme des lipides
Surveiller la capacité du patient à éliminer les lipides en vérifiant son taux de triglycérides. Le taux sérique de triglycérides ne doit pas excéder 4,6 mmol/L pendant la perfusion.
A utiliser avec précaution en cas de déficit du métabolisme des lipides. Cela peut survenir chez des patients présentant une insuffisance rénale, un diabète sucré, une pancréatite, une insuffisance hépatique, une hypothyroïdie et une septicémie.
Le glucose sérique, les électrolytes et l’osmolarité, ainsi que l’équilibre liquidien, l’équilibre acido-basique et les examens des enzymes hépatiques doivent être surveillés.
Syndrome de renutrition
La renutrition de patients fortement dénutris peut entraîner l’apparition du syndrome de renutrition, caractérisé par un changement de la répartition intracellulaire du potassium, du phosphore et du magnésium lors de la phase d’anabolisme. Une déficience en thiamine et une rétention liquidienne peuvent également se développer. Une surveillance attentive et une augmentation progressive de l’apport en nutriments tout en évitant une sur-alimentation peuvent permettre d’éviter l’apparition de ces complications. Ce syndrome a été signalé avec des produits similaires.
Chez les patients souffrant de malnutrition, l’instauration de la nutrition parentérale peut précipiter un déséquilibre liquidien, provoquant un œdème pulmonaire et une insuffisance cardiaque congestive ainsi qu’une baisse de la concentration sérique du potassium, du phosphore, du magnésium ou des vitamines hydrosolubles. Ces changements peuvent survenir dans les 24 à 48 heures ; aussi la nutrition parentérale doit être initiée lentement et avec précaution, tout en surveillant étroitement et en ajustant correctement les taux de liquides, d’électrolytes, d’oligo-éléments et de vitamines.
Hépatopathie de la nutrition parentérale
À utiliser avec prudence chez les patients présentant une insuffisance hépatique, y compris une cholestase et/ou une élévation des enzymes hépatiques. Les paramètres de la fonction hépatique doivent être étroitement surveillés.
Hyperglycémie
Les cas d’hyperglycémie doivent être traités selon la situation médicale en administrant une dose adaptée d’insuline et/ou en adaptant le débit de perfusion (voir rubrique 4.9).
Insuffisance rénale
A utiliser avec prudence chez les patients atteints d’insuffisance rénale. Il convient de maîtriser attentivement l’apport en phosphate, magnésium et potassium pour éviter une hyperphosphatémie, une hypermagnésémie et/ou une hyperkaliémie. Il conviendra de rétablir l’équilibre électrolytique et liquidien (taux sérique d’électrolytiques anormalement élevé ou bas par exemple) avant de commencer la perfusion.
Equilibre hydroélectrolytique
L’équilibre hydroélectrolytique, l’osmolarité sérique, les triglycérides sériques, l’équilibre acido-basique, la glycémie, la fonction hépatique et rénale, la numération sanguine incluant les plaquettes et les paramètres de coagulation, doivent être contrôlés pendant toute la durée du traitement.
Acidose lactique
A utiliser avec précaution chez les patients présentant une acidose lactique, un apport insuffisant d’oxygène aux cellules et/ou une augmentation de l’osmolarité sérique.
Utilisation à long terme
Une perfusion intraveineuse d’acides aminés s’accompagne d’une excrétion urinaire accrue d’oligo-éléments, notamment de cuivre et de zinc. Il faut en tenir compte dans le dosage des oligo-éléments, notamment en cas de nutrition par voie intraveineuse de longue durée. La quantité de zinc administrée avec FOSOMEL doit être prise en compte.
Système cardiovasculaire
A utiliser avec prudence chez les patients atteints d’œdème pulmonaire ou d’insuffisance cardiaque. Le statut liquidien doit être surveillé de près chez les patients recevant une nutrition parentérale.
Perfusion excessive d’acides aminés
Comme avec les autres solutions d’acides aminés, les acides aminés contenus dans FOSOMEL peuvent provoquer des effets indésirables en cas de dépassement du débit de perfusion recommandé. Ces effets sont des nausées, des vomissements, des frissons et une sécrétion de sueur. La perfusion d’acides aminés peut aussi provoquer une augmentation de la température corporelle. En cas de troubles de la fonction rénale, on peut observer une augmentation du taux de métabolites contenant de l’azote (créatinine, urée par exemple).
Rétention électrolytique
FOSOMEL doit être administré avec prudence chez les patients ayant une tendance à la rétention électrolytique. Une surveillance clinique particulière est requise au début d’une perfusion intraveineuse. Tout signe anormal doit entraîner l’interruption immédiate de la perfusion.
Administration d’une NP excessive
Pour prévenir les risques liés à des débits de perfusion excessivement rapides, il est conseillé de respecter une perfusion continue et contrôlée en utilisant, si possible, une pompe volumétrique (voir aussi rubrique 4.9).
Interférence avec des examens de laboratoire
Les lipides contenus dans cette émulsion peuvent interférer avec les résultats de certains examens de laboratoire (voir rubrique 4.5).
Population pédiatrique
Aucune étude sur FOSOMEL n’a été réalisée dans la population pédiatrique.
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
Aucune étude d’interaction sur FOSOMEL n’a été réalisée.
FOSOMEL ne doit pas être administré simultanément avec du sang par la même tubulure de perfusion en raison du risque de pseudo-agglutination.
La ceftriaxone ne doit pas être mélangée ni administrée simultanément par voie intraveineuse avec des solutions contenant du calcium, dont FOSOMEL, par la même ligne de perfusion (exemple, raccord en Y) en raison du risque de précipitation entre le sel de calcium et la ceftriaxone.
Si la même ligne de perfusion est utilisée pour administrer ces produits l’un après l’autre, elle devra être minutieusement rincée entre les perfusions avec un liquide compatible.
De la vitamine K1 est naturellement présente dans l’huile de soja. Toutefois, la concentration contenue dans FOSOMEL est trop faible pour que l’on puisse s’attendre à des effets significatifs sur le processus de coagulation chez les patients traités par des dérivés de la coumarine.
Les lipides contenus dans cette émulsion peuvent interférer avec les résultats de certains examens de laboratoire (par exemple, bilirubine, lactate déshydrogénase, saturation du sang en oxygène, hémoglobine sanguine) si le prélèvement sanguin a été réalisé avant l’élimination des lipides (ceux-ci sont normalement éliminés après 5 à 6 heures sans apport de lipides) (voir rubrique 4.4).
4.6. Fertilité, grossesse et allaitement
Grossesse
Allaitement
Il n’existe pas de données suffisantes sur l’excrétion des composants/métabolites de FOSOMEL dans le lait maternel. Une nutrition parentérale peut devenir nécessaire pendant l’allaitement. FOSOMEL ne doit être administré à des femmes qui allaitent qu’après mûre réflexion.
Fertilité
Il n’existe pas de données appropriées disponibles.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
Les réactions indésirables suivantes ont été signalées avec d’autres produits similaires. La fréquence de ces événements ne peut être estimée sur la base des données disponibles :
|
Classes de systèmes d’organes |
Terme préférentiel MedDRA |
|
Affections du système immunitaire |
Hypersensibilité |
|
Troubles du métabolisme et de la nutrition |
Syndrome de renutrition, Hyperglycémie |
|
Affections du système nerveux |
Sensation vertigineuse, Céphalée |
|
Affections vasculaires |
Thrombophlébite |
|
Affections respiratoires, thoraciques et médiastinales |
Embolie pulmonaire (voir rubrique 4.4) Détresse respiratoire (voir rubrique 4.4) Dyspnée |
|
Affections gastro-intestinales |
Nausées, Vomissements |
|
Troubles généraux et anomalies au site d’administration |
Fièvre, Extravasation |
|
Investigations |
Enzymes hépatiques augmentées |
|
Lésions, intoxications et complications liées aux procédures |
Syndrome de surcharge graisseuse Hépatopathie de la nutrition parentérale |
Description de certaines réactions indésirables
· Syndrome de surcharge graisseuse
Un syndrome de surcharge graisseuse a été rapporté avec des produits similaires. Il peut être provoqué par une administration incorrecte (par exemple surdosage et/ou vitesse de perfusion supérieure à celle recommandée, voir rubrique 4.9) ; toutefois, les signes et symptômes de ce syndrome peuvent également survenir au début d’une perfusion lorsque le produit est administré conformément aux instructions. Une capacité réduite ou limitée à métaboliser les lipides contenus dans FOSOMEL, accompagnée d’une prolongation de la clairance plasmatique peut conduire à un « syndrome de surcharge graisseuse » (voir rubrique 4.4).
· Syndrome de renutrition
La renutrition de patients fortement dénutris peut entraîner l’apparition du syndrome de renutrition, caractérisé par un changement de la répartition intracellulaire du potassium, du phosphore et du magnésium lors de la phase d’anabolisme. Une déficience en thiamine et une rétention liquidienne peuvent également se développer.
Chez les patients souffrant de malnutrition, l’instauration de la nutrition parentérale peut précipiter un déséquilibre liquidien, provoquant un œdème pulmonaire et une insuffisance cardiaque congestive ainsi qu’une baisse de la concentration sérique du potassium, du phosphore, du magnésium ou des vitamines hydrosolubles. Ces changements peuvent survenir dans les 24 à 48 heures.
Pour obtenir des recommandations spécifiques, voir rubrique 4.4.
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : www.signalement-sante.gouv.fr.
En cas de surdosage, des nausées, des vomissements, des frissons, une hyperglycémie, des perturbations électrolytiques et des signes d’hypervolémie ou d’acidose peuvent survenir. Dans de telles situations, la perfusion doit être arrêtée immédiatement (voir rubrique 4.4).
Les cas d’hyperglycémie doivent être traités selon la situation médicale en administrant une dose adaptée d’insuline et/ou en adaptant le débit de perfusion. Un surdosage peut en outre provoquer une surcharge liquidienne, des déséquilibres électrolytiques et une hyperosmolalité.
Si les symptômes persistent après l’interruption de la perfusion, une hémodialyse, une hémofiltration ou une hémodiafiltration peut être envisagée.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Mécanisme d’action
Emulsion lipidique
La composante lipidique de FOSOMEL est un mélange lipidique composé de quatre sources d’huile différentes : huile de soja (30%), huile de triglycérides à chaîne moyenne (25%), huile d’olive (25%) et huile de poisson (20%).
· L’huile de soja a une forte teneur en acides gras essentiels. Le plus abondant est l’acide linoléique, un acide gras oméga-6 (env. 55 à 60%). Elle contient environ 8% d’acide alphalinolénique, un acide gras oméga-3. Cette partie de FOSOMEL apporte la quantité nécessaire en acides gras.
· Les acides gras à chaîne moyenne sont rapidement oxydés et apportent une forme d’énergie immédiatement disponible à l’organisme.
· L’huile d’olive apporte de l’énergie principalement sous la forme d’acides gras monoinsaturés, qui sont bien moins sujets à la peroxydation que la quantité correspondante d’acides gras polyinsaturés.
· L’huile de poisson se caractérise par sa forte teneur en acide eicosapentanoïque (AEP) et en acide docosahexaénoïque (ADH). L’ADH est un important composant structurel des membranes cellulaires, tandis que l’AEP est un précurseur des éicosanoïdes, tels que les prostaglandines, les thromboxanes et les leucotriènes.
Acides aminés et électrolytes
Les acides aminés, constituants des protéines dans l’alimentation ordinaire, sont utilisés pour la synthèse protéique des tissus et tout surplus est canalisé dans un certain nombre de voies métaboliques. Des études ont montré un effet thermogène de la perfusion d’acides aminés.
Glucose
Le glucose doit servir de source d’énergie et contribuer au maintien d’un état nutritionnel normal.
5.2. Propriétés pharmacocinétiques
Chaque triglycéride administré dans des émulsions lipidiques a des taux de clairance différents des autres mais des données portant sur des émulsions lipidiques similaires utilisées en association ont montré que ces mélanges sont plus rapidement éliminés que les émulsions de triglycérides à chaîne longue (TCL). Parmi les composants, c’est l’huile d’olive qui a le taux de clairance le plus lent (un peu plus lent que les TCL) et les triglycérides à chaîne moyenne (TCM) qui ont le plus rapide. L’huile de poisson dans un mélange de TCL a le même taux de clairance que les TCL seuls.
Acides aminés et électrolytes
Les principales propriétés pharmacocinétiques des acides aminés et des électrolytes perfusés sont globalement les mêmes que celles des acides aminés et des électrolytes apportés par l’alimentation ordinaire. Toutefois, les acides aminés des protéines alimentaires entrent d’abord dans la veine porte, puis dans la circulation systémique, tandis que les acides aminés administrés par perfusion intraveineuse arrivent directement dans la circulation systémique.
5.3. Données de sécurité préclinique
La ceftriaxone ne doit pas être mélangée ni administrée simultanément par voie intraveineuse avec des solutions contenant du calcium, dont FOSOMEL (voir rubrique 4.5).
FOSOMEL ne doit pas être administré simultanément avec du sang par la même tubulure de perfusion (voir rubrique 4.5).
2 ans.
Après reconstitution :
Il est recommandé d’utiliser le produit immédiatement après ouverture des soudures non permanentes situées entre les 3 compartiments. Toutefois, une fois reconstituée, la stabilité de l’émulsion a été démontrée pendant 7 jours entre 2°C et 8°C, suivis de 48 heures à une température ne dépassant pas 25°C.
Après ajout de suppléments (électrolytes, oligo-éléments et vitamines, voir rubrique 6.6) :
Pour des mélanges spécifiques, la stabilité en cours d’utilisation a été démontrée pendant 7 jours (entre 2°C et 8°C), suivis de 48 heures à une température ne dépassant pas 25°C.
Toutefois, d’un point de vue microbiologique, tout produit mélangé doit être utilisé immédiatement.
En cas d’utilisation non immédiate, les durées et conditions de conservation, après mélange et avant utilisation, relèvent de la seule responsabilité de l’utilisateur et ne devraient pas dépasser 24 heures à une température comprise entre 2°C et 8°C, sauf si l’addition de suppléments a été réalisée en conditions d’asepsie dûment contrôlées et validées.
6.4. Précautions particulières de conservation
A conserver dans le suremballage d’origine.
Pour les conditions de conservation du médicament après reconstitution, voir la rubrique 6.3.
6.5. Nature et contenu de l'emballage extérieur
La poche à trois compartiments est une poche en plastique multicouches sans PVC, avec trois tubes d’administration :
Un site d’administration est situé dans le compartiment de glucose, un site de perfusion dans le compartiment des acides aminés et un tube d’administration dans le compartiment des lipides, qui est scellé pour éviter tout ajout à ce compartiment.
Le matériau de la couche intérieure de la poche (qui est en contact avec la solution) est un mélange de copolymères élastomères de polyoléfine/polyoléfiniques. Les autres couches sont constituées de polypropylène et d’un mélange de copolymères élastomères de polyoléfine/polyoléfiniques.
Présentations
4 x 1085 mL, 4 x 1435 mL, 4 x 1820 mL
Toutes les présentations peuvent ne pas être commercialisées.
6.6. Précautions particulières d’élimination et de manipulation
Pour ouvrir
· Retirer le suremballage de protection.
· Jeter l’absorbeur d’oxygène.
· Utiliser uniquement si la poche n’est pas endommagée, si les soudures non permanentes sont intactes (c’est-à-dire, sans mélange des contenus des trois compartiments), si la solution d’acides aminés et la solution de glucose sont limpides, incolores ou légèrement jaunes, et pratiquement exemptes de particules visibles et si l’émulsion lipidique est un liquide homogène d’aspect laiteux.
Mélange des solutions et de l’émulsion
· S’assurer que le produit est à température ambiante avant de rompre les soudures non permanentes.
· Enrouler manuellement la poche sur elle-même en commençant par le haut de la poche (côté œillet de suspension). Les soudures non permanentes disparaîtront du côté des embouts. Continuer d’enrouler la poche jusqu’à ce que les soudures soient ouvertes sur environ la moitié de leur longueur.
· Mélanger en retournant la poche au moins 3 fois.
· Après reconstitution, le mélange est une émulsion homogène d’apparence laiteuse.
Après le retrait du protecteur en plastique du port de médication, il est possible d’ajouter des suppléments compatibles par le port de médication.
Aucun élément ne doit être ajouté à la poche si sa compatibilité n’a pas été vérifiée au préalable car la formation de précipités ou la déstabilisation de l’émulsion lipidique peut entraîner une occlusion vasculaire.
Les ajouts doivent se faire de manière aseptique.
FOSOMEL peut être mélangé aux suppléments suivants :
· Préparations avec plusieurs vitamines
· Préparations avec plusieurs oligo-éléments
· Sélénium
· Zinc
· Sel de sodium
· Sel de potassium
· Sel de magnésium
· Sel de calcium
· Sel de phosphate
Le tableau de comptabilité ci-dessous indique les ajouts possibles de produits contenant plusieurs oligo-éléments, comme Nutryelt, et contenant plusieurs vitamines, comme Cernevit, ainsi que de produits génériques contenant des électrolytes et des oligo-éléments en quantités définies. En cas d’ajout d’électrolytes et d’oligo-éléments nécessaires au patient, les électrolytes déjà présents dans la poche doivent être pris en compte.
|
Supplément |
Contenu total après l’ajout pour tous les formats de poches de FOSOMEL |
|
Nutryelt (Composition par flacon : Zinc 153 µmol ; Cuivre 4,7 µmol ; Manganèse 1,0 µmol ; Fluorine 50 µmol ; Iode 1,0 µmol ; Sélénium 0,9 µmol ; Molybdène 0,21 µmol ; Chrome 0,19 µmol ; Fer 18 µmol) |
2 flaconsa/poche |
|
Cernevit (Composition par flacon : Vit. A (sous forme de palmitate de rétinol) 3500 UI, Vit. D3 (Cholécalciférol) 220 UI, Vit. E (Alpha-tocophérol) 11,2 UI, Vit. C (Acide ascorbique) 125 mg, Vit. B1 (Thiamine) 3,51 mg, Vit. B2 (Riboflavine) 4,14 mg, Vit. B6 (Pyridoxine) 4,53 mg, Vit. B12 (Cyanocobalamine) 6 µg, Vit. B9 (Acide folique) 414 µg, Vit. B5 (Acide pantothénique) 17,25 mg, Vit. B8 (Biotine) 69 µg, Vit. PP (Nicotinamide) 46 mg) |
2 flaconsb/poche |
|
Sodium |
138 mmol/L |
|
Potassium |
138 mmol/L |
|
Magnésium |
5 mmol/L |
|
Calcium |
4,6 mmol/L |
|
Phosphate (organique, comme le glycérophosphate de sodium) Ou Phosphate (minéral, comme le phosphate de potassium) |
18,5 mmol/L
5,5 mmol/L |
|
Sélénium |
7,6 µmol/L |
|
Zinc |
0,31 mmol/L |
a Volume du flacon : 10 mL de solution concentrée
b Volume du flacon : 5 mL de lyophilisat
La compatibilité peut varier selon les sources et il est conseillé aux professionnels de santé de faire les vérifications adaptées s’ils veulent mélanger FOSOMEL à d’autres solutions parentérales.
Bien mélanger les éléments de la poche et inspecter visuellement le mélange. Il ne doit pas y avoir de signes de séparation des phases dans l’émulsion. Le mélange est une émulsion homogène blanche d’aspect laiteux.
En cas de supplémentation, l’osmolarité finale du mélange doit être mesurée avant administration.
Retirer le protecteur en plastique de l’embout d’administration et insérer le set de perfusion. Suspendre la poche au pôle intraveineux et réaliser la perfusion en utilisant la technique standard.
Une fois la poche ouverte, utiliser immédiatement son contenu. Ne jamais conserver la poche ouverte pour une perfusion ultérieure.
Ne pas reconnecter des poches partiellement utilisées. Ne pas connecter de poches en série afin d’éviter tout risque d’embolie gazeuse.
Tout médicament non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
IMMEUBLE BERLIOZ
4 BIS RUE DE LA REDOUTE
78280 GUYANCOURT
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· 34009 301 687 2 1 : Emulsion en poche à 3 compartiments (plastique multicouches sans PVC), 4 poches de 1435 mL.
· 34009 301 687 3 8 : Emulsion en poche à 3 compartiments (plastique multicouches sans PVC), 4 poches de 1820 mL.
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
[à compléter ultérieurement par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE
[à compléter ultérieurement par le titulaire]
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Liste I
ANSM - Mis à jour le : 02/01/2019
FOSOMEL, émulsion pour perfusion
· Gardez cette notice. Vous pourriez avoir besoin de la relire.
· Si vous avez d’autres questions, interrogez votre médecin ou votre infirmier/ère.
· Ce médicament vous a été personnellement prescrit. Ne le donnez pas à d’autres personnes. Il pourrait leur être nocif, même si les signes de leur maladie sont identiques aux vôtres.
· Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre infirmier/ère. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
1. Qu'est-ce que FOSOMEL, émulsion pour perfusion et dans quels cas est-il utilisé ?
2. Quelles sont les informations à connaître avant d'utiliser FOSOMEL, émulsion pour perfusion ?
3. Comment utiliser FOSOMEL, émulsion pour perfusion ?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver FOSOMEL, émulsion pour perfusion ?
6. Contenu de l’emballage et autres informations.
1. QU’EST-CE QUE FOSOMEL, émulsion pour perfusion ET DANS QUELS CAS EST-IL UTILISE ?
FOSOMEL contient des acides aminés (constituants utilisés pour fabriquer des protéines), du glucose (des sucres), des lipides (des graisses) et des sels (des électrolytes).
FOSOMEL est destiné à alimenter des adultes lorsque le patient ne peut pas s’alimenter suffisamment ou normalement par la bouche.
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT D’UTILISER FOSOMEL, émulsion pour perfusion ?
N’utilisez jamais FOSOMEL, émulsion pour perfusion :
· Si vous êtes allergique aux protéines de poissons, d’œuf, de soja, d’arachide ou au maïs et aux produits dérivés du maïs (voir également la rubrique « Avertissements et précautions » ci-dessous) ou à l’un des autres composants contenus dans ce médicament, mentionnés dans la rubrique 6.
· Si votre sang contient un taux particulièrement élevé de graisses.
· Si vous avez de graves problèmes hépatiques.
· Si vous avez des problèmes de coagulation sanguine.
· Si vous présentez un trouble qui empêche votre corps d’assimiler les acides aminés.
· Si vous avez de graves problèmes rénaux.
· Si vous avez trop de sucre dans le sang.
· Si vous avez une quantité anormalement élevée de l’un des électrolytes (sodium, potassium, magnésium, calcium et/ou phosphore) dans le sang.
· Si, lorsque vous recevez de grands volumes de liquides dans les veines, vous souffrez de problèmes tels qu’œdème pulmonaire aigu, hyperhydratation et décompensation cardiaque.
· Si vous souffrez d’un problème de santé aigu et grave, tel qu’un état post-traumatique critique, un diabète sucré non contrôlé, un infarctus du myocarde aigu, un accident vasculaire cérébral, une embolie, une acidose métabolique, une septicémie sévère (bactéries dans le sang), une déshydratation hypotonique et un coma hyperosmolaire).
Dans tous les cas, votre médecin décidera de vous prescrire ce médicament en tenant compte de critères tels que votre âge, votre poids et votre état de santé, et des résultats d’éventuels examens réalisés.
Avertissements et précautions
Adressez-vous à votre médecin ou à votre infirmier/ère avant que FOSOMEL ne vous soit administré si :
· Vous souffrez d’un problème rénal grave. Vous devez aussi avertir votre médecin si vous êtes sous dialyse (rein artificiel) ou si vous avez un autre type de traitement de purification du sang.
· Vous souffrez d’un problème hépatique grave.
· Vous avez des problèmes de coagulation du sang.
· Vos glandes surrénales ne fonctionnent pas correctement (insuffisance surrénalienne). Les glandes surrénales sont des glandes en forme de triangle situées au-dessus de vos reins.
· Vous souffrez de défaillance cardiaque.
· Vous avez une maladie des poumons.
· De l’eau s’accumule dans votre organisme (hyperhydratation).
· Votre organisme manque d’eau (déshydratation).
· Vous présentez une glycémie élevée (diabète) pour laquelle vous ne recevez pas de traitement.
· Vous présentez une crise cardiaque ou un état de choc dû à une insuffisance cardiaque soudaine.
· Vous souffrez d’une acidose métabolique grave (sang trop acide).
· Vous souffrez d’une infection grave (septicémie).
La perfusion doit être immédiatement arrêtée en cas d’apparition de signes anormaux ou de symptômes d’une réaction allergique, comme de la fièvre, des frissons, des rashs cutanés ou des difficultés à respirer. Ce médicament contient de l’huile de poisson, de l’huile de soja, des protéines de phosphatide d’œuf et du glucose dérivé du maïs, qui peuvent provoquer des réactions d’hypersensibilité. Des réactions d’allergie croisée ont été observées entre les protéines de soja et d’arachide.
Des difficultés à respirer peuvent également être le signe que de petites particules se sont formées, bloquant ainsi les vaisseaux sanguins pulmonaires (précipités vasculaires pulmonaires). Si vous éprouvez des difficultés à respirer, informez-en votre médecin ou votre infirmier/ère. Ils décideront des actions à entreprendre.
Pendant la perfusion, si vous constatez une douleur, une sensation de brûlure, une raideur, un gonflement ou une coloration anormale de la peau au site de perfusion ou une fuite de la perfusion, informez-en votre médecin ou votre infirmier/ère. L’administration sera immédiatement interrompue et reprise dans une autre veine.
Il existe un risque particulièrement élevé d’infection ou de septicémie (présence de bactéries ou de toxines dans le sang) lorsqu’une tubulure (cathéter intraveineux) est placée dans une veine. Votre médecin surveillera attentivement l’apparition de tout signe d’infection. L’utilisation de techniques aseptiques (« sans germes ») lors de la mise en place et de l’entretien du cathéter et lors de la préparation de la formulation nutritionnelle peut réduire le risque d’infection.
Un « syndrome de surcharge graisseuse » a été rapporté avec des produits similaires. Une capacité réduite ou limitée de l’organisme à éliminer les graisses contenues dans FOSOMEL peut entraîner un « syndrome de surcharge graisseuse » (voir rubrique 4 – Quels sont les effets indésirables éventuels ?).
Si vous êtes sévèrement dénutri au point d’avoir besoin de recevoir une alimentation par une veine, il est recommandé de débuter le traitement lentement et prudemment.
Examens supplémentaires de suivi
L’équilibre en eau et en électrolytes dans votre corps ainsi que les perturbations du métabolisme seront corrigés avant de débuter la perfusion. Pour contrôler l’efficacité et la sécurité de l’administration, votre médecin effectuera des examens cliniques et de laboratoire pendant que vous recevez ce médicament. Votre médecin surveillera votre état pendant toute la durée du traitement et pourra modifier la posologie ou prescrire des traitements supplémentaires.
Enfants et adolescents
Aucune expérience n’est disponible sur l’utilisation de FOSOMEL PERI chez des enfants et des adolescents.
Autres médicaments et FOSOMEL, émulsion pour perfusion
Informez votre médecin si vous prenez ou utilisez, avez récemment pris ou utilisé ou pourriez prendre ou utiliser tout autre médicament.
FOSOMEL contient du calcium. Il ne doit pas être administré en même temps ou par la même tubulure que l’antibiotique ceftriaxone en raison du risque de formation de particules. Si le même dispositif est utilisé pour vous administrer successivement ces médicaments, il doit être minutieusement rincé.
Les huiles d’olive et de soja présentes dans FOSOMEL contiennent de la vitamine K. Cela n’influence normalement pas l’action des médicaments fluidifiant le sang (anticoagulants) tels que la coumarine. Néanmoins, si vous prenez des anticoagulants, vous devez en avertir votre médecin.
Les lipides contenus dans cette émulsion peuvent interférer avec les résultats de certains examens de laboratoire si le prélèvement sanguin a été réalisé avant l’élimination des lipides de votre circulation sanguine (ceux-ci sont normalement éliminés après 5 à 6 heures sans apport de lipides).
FOSOMEL, émulsion pour perfusion avec des aliments, boissons et de l’alcool
Sans objet
Grossesse et allaitement
Si vous êtes enceinte ou que vous allaitez, si vous pensez être enceinte ou planifiez une grossesse, demandez conseil à votre médecin avant de recevoir ce médicament. On ne dispose d’aucune donnée sur l’utilisation de FOSOMEL chez les femmes enceintes ou qui allaitent. L’utilisation de ce médicament peut être envisagée pendant la grossesse et l’allaitement, si cela est nécessaire et conformément aux indications de votre médecin.
Conduite de véhicules et utilisation de machines
Sans objet car ce médicament est administré à l’hôpital.
FOSOMEL, émulsion pour perfusion contient
Sans objet.
3. COMMENT UTILISER FOSOMEL, émulsion pour perfusion ?
Veillez à toujours utiliser ce médicament en suivant exactement les indications de votre médecin.
Vérifiez auprès de votre médecin en cas de doute.
Ce médicament est administré par une perfusion intraveineuse (goutte-à-goutte) par un petit tube, inséré directement dans une veine.
Votre médecin décidera de la dose à vous administrer selon votre poids et de votre état. FOSOMEL vous sera administré par un professionnel de santé.
Utilisation chez les enfants
Ce médicament ne doit pas être donné aux enfants et aux adolescents de moins de 18 ans.
Si vous avez reçu plus de FOSOMEL, émulsion pour perfusion que vous n'auriez dû
Il est peu probable que vous receviez trop de médicament car FOSOMEL vous est administré par un professionnel de santé.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
· Réactions d'hypersensibilité (pouvant provoquer des symptômes tels que gonflements, fièvre, chute de la pression artérielle, rashs cutanés, papules œdémateuses (zones rouges et bombées), bouffée congestive, maux de tête)
· Syndrome de renutrition (maladie qui survient quand on reçoit de la nourriture après une longue période de jeûne)
· Taux du sucre sanguin élevé (hyperglycémie)
· Sensation vertigineuse
· Maux de tête
· Inflammation des veines (thrombophlébite)
· Embolie pulmonaire
· Difficultés à respirer
· Nausées
· Vomissements
· Légère augmentation de la température corporelle
· Taux sanguins (plasmatiques) élevés de composés hépatiques
· Syndrome de surcharge graisseuse
· Fuite de la perfusion dans les tissus environnants (extravasation)
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou à votre infirmier/ère. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet: www.signalement-sante.gouv.fr.
En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.
5. COMMENT CONSERVER FOSOMEL, émulsion pour perfusion ?
Tenir ce médicament hors de la vue et de la portée des enfants.
A conserver dans le suremballage. Ne pas congeler.
N’utilisez pas ce médicament après la date de péremption indiquée sur la poche et la boîte après EXP. La date de péremption fait référence au dernier jour de ce mois.
N’utilisez pas ce médicament si vous remarquez des particules visibles dans la solution ou si la poche est endommagée.
Ne jetez aucun médicament au tout-à-l’égout ni avec les ordures ménagères. Demandez à votre pharmacien d’éliminer les médicaments que vous n’utilisez plus. Ces mesures contribueront à protéger l’environnement.
6. CONTENU DE L’EMBALLAGE ET AUTRES INFORMATIONS
Ce que contient FOSOMEL, émulsion pour perfusion
· Les substances actives sont :
Alanine........................................................................................................................... 10,52 g
Arginine........................................................................................................................... 5,84 g
Glycine............................................................................................................................ 5,23 g
Histidine.......................................................................................................................... 2,44 g
Isoleucine........................................................................................................................ 3,05 g
Leucine............................................................................................................................ 3,71 g
Lysine (sous forme de chlorhydrate).................................................................................. 3,68 g
Méthionine....................................................................................................................... 2,03 g
Phénylalanine................................................................................................................... 2,84 g
Proline............................................................................................................................. 3,45 g
Sérine.............................................................................................................................. 2,54 g
Thréonine......................................................................................................................... 2,13 g
Tryptophane..................................................................................................................... 0,91 g
Tyrosine........................................................................................................................... 0,20 g
Valine.............................................................................................................................. 2,95 g
Acétate de sodium trihydraté............................................................................................ 2,85 g
Chlorure de potassium...................................................................................................... 2,28 g
Chlorure de calcium dihydraté........................................................................................... 0,38 g
Sulfate de magnésium heptahydraté.................................................................................. 1,25 g
Glycérophosphate de sodium hydraté............................................................................... 3,01 g
Sulfate de zinc heptahydraté........................................................................................... 0,012 g
Glucose (sous forme de monohydrate)............................................................................ 139,5 g
Huile de soja, raffinée..................................................................................................... 11,40 g
Huile d’olive, raffinée........................................................................................................ 9,50 g
Triglycérides à chaîne moyenne......................................................................................... 9,50 g
Huile de poisson, riche en acides oméga-3........................................................................ 7,60 g
Pour 1000 mL
· Les autres composants sont :
Acide acétique glacial, acide chlorhydrique, phospholipides d’œuf pour préparations injectables, glycérol, oléate de sodium, tout-rac-alpha-tocophérol, hydroxyde de sodium, eau pour préparations injectables.
Qu’est-ce que FOSOMEL, émulsion pour perfusion et contenu de l’emballage extérieur
Après le mélange des trois compartiments, le produit a l’apparence d’une émulsion blanche.
Présentations
4 x 1085 mL, 4 x 1435 mL, 4 x 1820 mL
Titulaire de l’autorisation de mise sur le marché
IMMEUBLE BERLIOZ
4 BIS RUE DE LA REDOUTE
78280 GUYANCOURT
Exploitant de l’autorisation de mise sur le marché
IMMEUBLE BERLIOZ
4 BIS RUE DE LA REDOUTE
78280 GUYANCOURT
BAXTER S.A.
BOULEVARD RENE BRANQUART, 80
7860 LESSINES
BELGIQUE
Noms du médicament dans les Etats membres de l'Espace Economique Européen
Ce médicament est autorisé dans les Etats membres de l'Espace Economique Européen sous les noms suivants : Conformément à la réglementation en vigueur.
[à compléter ultérieurement par le titulaire]
La dernière date à laquelle cette notice a été révisée est :
[à compléter ultérieurement par le titulaire]
{MM/AAAA}.
Des informations détaillées sur ce médicament sont disponibles sur le site Internet de l’ANSM (France).
----------------------------------------------------------------------------------------------------------------------------------------
Les informations suivantes sont destinées exclusivement aux professionnels de santé :
A. COMPOSITION QUALITATIVE ET QUANTITATIVE
FOSOMEL se présente sous la forme d’une poche en plastique à 3 compartiments. Chaque poche contient une combinaison stérile non pyrogène d’une solution glucidique à 42%, d’une solution d’acides aminés à 10% avec des électrolytes et d’une émulsion lipidique à 20%.
La composition de l’émulsion reconstituée après le mélange du contenu des trois compartiments est indiquée ci-dessous :
|
Substance active |
1085 mL |
1435 mL |
1820 mL |
|
Huile de poisson, riche en acides oméga-3 |
8,24 g |
10,92 g |
13,84 g |
|
Huile d’olive raffinée |
10,30 g |
13,65 g |
17,30 g |
|
Huile de soja, raffinée |
12,36 g |
16,38 g |
20,76 g |
|
Triglycérides à chaîne moyenne |
10,30 g |
13,65 g |
17,30 g |
|
Alanine |
11,41 g |
15,09 g |
19,13 g |
|
Arginine |
6,34 g |
8,38 g |
10,63 g |
|
Glycine |
5,68 g |
7,51 g |
9,52 g |
|
Histidine |
2,64 g |
3,50 g |
4,44 g |
|
Isoleucine |
3,31 g |
4,37 g |
5,54 g |
|
Leucine |
4,02 g |
5,32 g |
6,75 g |
|
Lysine (sous forme de chlorhydrate de lysine) |
3,20 g |
4,23 g |
5,36 g |
|
Méthionine |
2,20 g |
2,92 g |
3,70 g |
|
Phénylalanine |
3,09 g |
4,08 g |
5,17 g |
|
Proline |
3,75 g |
4,96 g |
6,28 g |
|
Sérine |
2,76 g |
3,65 g |
4,62 g |
|
Thréonine |
2,31 g |
3,06 g |
3,88 g |
|
Tryptophane |
0,99 g |
1,31 g |
1,66 g |
|
Tyrosine |
0,22 g |
0,29 g |
0,37 g |
|
Valine |
3,20 g |
4,23 g |
5,36 g |
|
Acétate de sodium, trihydraté |
3,10 g |
4,10 g |
5,19 g |
|
Chlorure de potassium |
2,47 g |
3,27 g |
4,14 g |
|
Chlorure de calcium, dihydraté |
0,41 g |
0,54 g |
0,68 g |
|
Sulfate de magnésium heptahydraté |
1,36 g |
1,80 g |
2,28 g |
|
Glycérophosphate de sodium hydraté |
3,26 g |
4,32 g |
5,47 g |
|
Sulfate de zinc heptahydraté |
0,013 g |
0,017 g |
0,021 g |
|
Glucose |
137,8 g |
181,9 g |
231,0 g |
B. POSOLOGIE ET MODE D’ADMINISTRATION
Posologie
La posologie dépend de la dépense énergétique, de l’état clinique, du poids corporel du patient et de sa capacité à métaboliser les constituants de FOSOMEL, ainsi que du supplément d’énergie ou de protéines administré par voie orale/entérale : le volume de la poche doit donc être choisi en conséquence.
Les besoins journaliers moyens chez l’adulte sont :
· Chez les patients présentant un état nutritionnel normal ou un léger stress catabolique : 0,6 à 0,9 g d’acides aminés/kg/jour (0,10 à 0,15 g d’azote/kg/jour).
· Chez les patients présentant un stress métabolique modéré à élevé, avec ou sans malnutrition : 0,9 à 1,6 g d’acides aminés/kg/jour (0,15 à 0,25 g d’azote/kg/jour).
· Chez les patients présentant un état pathologique particulier (brûlures ou anabolisme marqué par exemple) les besoins azotés peuvent même être supérieurs.
La dose quotidienne maximale dépend de l’état clinique du patient et peut varier d’un jour à l’autre.
Le débit d’administration doit normalement être augmenté progressivement au cours de la première heure et ajusté ensuite en fonction de la dose à administrer, de l’apport volumique journalier et de la durée de la perfusion.
La durée de perfusion recommandée est de 14 à 24 heures.
L’intervalle posologique de 13 mL à 31 mL/kg/jour fournira 0,7 à 1,6 g d’acides aminés par kg/jour (ce qui correspond à 0,11 à 0,26 g d’azote/kg/jour) et à 14 à 33 kcal/kg/jour d’énergie totale (11 à 27 kcal/kg/jour d’énergie non protéique).
Le débit maximal de perfusion est de 0,25 g/kg/h pour le glucose, de 0,1 g/kg/h pour les acides aminés et de 0,15 g/kg/h pour les lipides.
Le débit de perfusion ne doit pas dépasser 2,0 mL/kg/h (ce qui correspond à 0,10 g d’acides aminés ; 0,25 g de glucose et 0,08 g de lipides/kg/h).
La dose maximale recommandée est de 35 ml/kg/jour, ce qui apportera 1,8 g d’acides aminés/kg/jour (ce qui correspond à 0,29 g d’azote/kg/jour) ; 4,5 g de glucose/kg/jour ; 1,40 g de lipides/kg/jour et à une énergie totale de 38 kcal/kg/jour (ce qui correspond à 30 kcal/kg/jour d’énergie non protéique).
Population pédiatrique
Aucune étude sur FOSOMEL n’a été réalisée dans la population pédiatrique.
Patients insuffisants rénaux/hépatiques
À utiliser avec prudence chez les patients présentant une insuffisance hépatique, y compris une cholestase et/ou une élévation des enzymes hépatiques. Les paramètres de la fonction hépatique doivent être étroitement surveillés.
Mode d’administration
Voie intraveineuse, par perfusion dans une veine périphérique ou centrale.
Pour les instructions concernant la reconstitution du médicament avant administration, voir la rubrique E PRECAUTIONS PARTICULIERES D’ELIMINATION ET DE MANIPULATION.
Pour obtenir des informations sur le mélange avec d’autres perfusions/avec le sang avant ou pendant l’administration, voir rubrique C INCOMPATIBILITES.
C. INCOMPATIBILITES
Ce médicament ne doit pas être mélangé avec d’autres médicaments dont la compatibilité n’est pas connue.
La ceftriaxone ne doit pas être mélangée ni administrée simultanément par voie intraveineuse avec des solutions contenant du calcium, dont FOSOMEL.
FOSOMEL ne doit pas être administré simultanément avec du sang par la même tubulure de perfusion.
D. SURDOSAGE
En cas de surdosage, des nausées, des vomissements, des frissons, une hyperglycémie, des perturbations électrolytiques et des signes d’hypervolémie ou d’acidose peuvent survenir. Dans de telles situations, la perfusion doit être arrêtée immédiatement.
Les cas d’hyperglycémie doivent être traités selon la situation médicale en administrant une dose adaptée d’insuline et/ou en adaptant le débit de perfusion. Un surdosage peut en outre provoquer une surcharge liquidienne, des déséquilibres électrolytiques et une hyperosmolalité.
Si les symptômes persistent après l’interruption de la perfusion, une hémodialyse, une hémofiltration ou une hémodiafiltration peut être envisagée.
E. PRECAUTIONS PARTICULIERES D’ELIMINATION ET DE MANIPULATION
Pour ouvrir
· Retirer le suremballage de protection.
· Jeter l’absorbeur d’oxygène.
· Utiliser uniquement si la poche n’est pas endommagée, si les soudures non permanentes sont intactes (c’est-à-dire, sans mélange des contenus des trois compartiments) ; si la solution d’acides aminés et la solution de glucose sont limpides, incolores ou légèrement jaunes, et exemptes de particules visibles ; et si l’émulsion lipidique est un liquide homogène d’aspect laiteux.
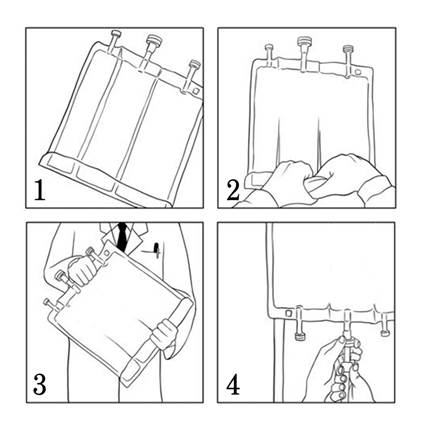
Pour mélanger les compartiments
· S’assurer que le produit est à température ambiante avant de rompre les soudures non permanentes.
· Enrouler manuellement la poche sur elle-même en commençant par le haut de la poche (côté œillet de suspension). (Image 1) Les soudures non permanentes disparaîtront du côté des embouts. Continuer d’enrouler la poche jusqu’à ce que les soudures soient ouvertes sur environ la moitié de leur longueur. (Image 2)
· Mélanger en retournant la poche au moins 3 fois. (Image 3)
· Après reconstitution, le mélange est une émulsion homogène et d’aspect laiteux.
Après le retrait du protecteur en plastique du port de médication, il est possible d’ajouter des suppléments compatibles par le port de médication. (voir la sous-rubrique «Supplémentations»)
Retirer le protecteur en plastique de l’embout d’administration et insérer le set de perfusion. Suspendre la poche au pôle intraveineux et réaliser la perfusion en utilisant la technique standard. (Image 4)
Une fois la poche ouverte, utiliser immédiatement son contenu. Ne jamais conserver la poche ouverte pour une perfusion ultérieure.
Ne pas reconnecter des poches partiellement utilisées. Ne pas connecter de poches en série afin d’éviter tout risque d’embolie gazeuse.
Supplémentations
Aucun élément ne doit être ajouté à la poche si sa compatibilité n’a pas été vérifiée au préalable car la formation de précipités ou la déstabilisation de l’émulsion lipidique peut entraîner une occlusion vasculaire.
Les ajouts doivent se faire de manière aseptique.
FOSOMEL peut être mélangé aux suppléments suivants :
· Préparations avec plusieurs vitamines
· Préparations avec plusieurs oligo-éléments
· Sélénium
· Zinc
· Sel de sodium
· Sel de potassium
· Sel de magnésium
· Sel de calcium
· Sel de phosphate
Le tableau de comptabilité ci-dessous indique les ajouts possibles de produits contenant plusieurs oligo-éléments, comme Nutryelt, et contenant plusieurs vitamines, comme Cernevit, ainsi que de produits génériques contenant des électrolytes et des oligo-éléments en quantités définies. En cas d’ajout d’électrolytes et d’oligo-éléments nécessaires au patient, les électrolytes déjà présents dans la poche doivent être pris en compte.
|
Supplément |
Contenu total après l’ajout pour tous les formats de poches de FOSOMEL |
|
Nutryelt (Composition par flacon : Zinc 153 µmol ; Cuivre 4,7 µmol ; Manganèse 1,0 µmol ; Fluorine 50 µmol ; Iode 1,0 µmol ; Sélénium 0,9 µmol ; Molybdène 0,21 µmol ; Chrome 0,19 µmol ; Fer 18 µmol) |
2 flacons a /poche |
|
Cernevit (Composition par flacon : Vit. A (sous forme de palmitate de rétinol) 3500 UI, Vit. D3 (Cholécalciférol) 220 UI, Vit. E (Alpha-tocophérol) 11,2 UI, Vit. C (Acide ascorbique) 125 mg, Vit. B1 (Thiamine) 3,51 mg, Vit. B2 (Riboflavine) 4,14 mg, Vit. B6 (Pyridoxine) 4,53 mg, Vit. B12 (Cyanocobalamine) 6 µg, Vit. B9 (Acide folique) 414 µg, Vit. B5 (Acide pantothénique) 17,25 mg, Vit. B8 (Biotine) 69 µg, Vit. PP (Nicotinamide) 46 mg) |
2 flacons b /poche |
|
Sodium |
138 mmol/L |
|
Potassium |
138 mmol/L |
|
Magnésium |
5 mmol/L |
|
Calcium |
4,6 mmol/L |
|
Phosphate (organique, comme le glycérophosphate de sodium) Ou Phosphate (minéral, comme le phosphate de potassium) |
18,5 mmol/L
9,2 mmol/L |
|
Sélénium |
7,6 µmol/L |
|
Zinc |
0,31 mmol/L |
a Volume du flacon : 10 mL de solution concentrée
b Volume du flacon : 5 mL de lyophilisat
La compatibilité peut varier selon les sources et il est conseillé aux professionnels de santé de faire les vérifications adaptées s’ils veulent mélanger FOSOMEL à d’autres solutions parentérales.
Bien mélanger les éléments de la poche et inspecter visuellement le mélange. Il ne doit pas y avoir de signes de séparation des phases dans l’émulsion. Le mélange est une émulsion homogène blanche d’aspect laiteux.
En cas de supplémentation, l’osmolarité finale du mélange doit être mesurée avant administration.