Dernière mise à jour le 06/11/2025
ISTENDO 1 g/5 ml, solution pour instillation endotrachéobronchique en ampoule
Indications thérapeutiques
Classe pharmacothérapeutique : MUCOLYTIQUE
(R : système respiratoire)
Indications thérapeutiques
Ce médicament est un fluidifiant des sécrétions bronchiques.
Il est préconisé, en instillation trachéale, en cas d’encombrement des voies respiratoires chez les patients trachéotomisés.
Présentations
> 6 ampoule(s) en verre brun de 5 ml
Code CIP : 380 263-9 ou 34009 380 263 9 9
Déclaration de commercialisation : 07/11/2007
Cette présentation est agréée aux collectivités
- Prix hors honoraire de dispensation : 5,40 €
- Honoraire de dispensation : 1,02 €
- Prix honoraire compris : 6,42 €
- Taux de remboursement :15%
Service médical rendu (SMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprès de la HAS (plus d'informations dans l'aide). Les avis et synthèses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur du SMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| Insuffisant | Avis du 05/06/2019 | Renouvellement d'inscription (CT) | Le service médical rendu par MUCOMYSTENDO est insuffisant pour justifier d’une prise en charge par la solidarité nationale dans l’indication de l’AMM « Soins aux trachéotomisés : traitement de l’encombrement des voies respiratoires en instillation locale ». |
Amélioration du service médical rendu (ASMR)
Pas d'ASMR disponible pour ce médicament (plus d'informations dans l'aide )
ANSM - Mis à jour le : 05/11/2021
ISTENDO 1 g/5 ml, solution pour instillation endotrachéobronchique en ampoule
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Acétylcystéine................................................................................................................. 1,00000 g
Pour 1 ampoule de 5 ml de solution
Pour la liste complète des excipients, voir rubrique 6.1.
Solution pour instillation endotrachéobronchique en ampoule.
4.1. Indications thérapeutiques
Soins aux trachéotomisés : traitement de l’encombrement des voies respiratoires en instillation locale.
4.2. Posologie et mode d'administration
Posologie
1 à 2 ml de solution diluée dans une quantité égale de sérum physiologique ou d’eau distillée, en instillation par la canule de trachéotomie.
Voie endo-trachéale.
Ne pas injecter.
Hypersensibilité à la substance active ou à l’un des excipients mentionnés à la rubrique 6.1.
4.4. Mises en garde spéciales et précautions d'emploi
ISTENDO 1 g/5 ml est à utiliser avec prudence chez les sujets ayant des antécédents asthmatiques ou de bronchospasmes.
Après administration locale du produit, il conviendra de s’assurer de l’évacuation des sécrétions.
Beaucoup de patients atteints de bronchospasmes sont rapidement soulagés par l'utilisation d'un bronchodilatateur sous forme de nébulisation. Si le bronchospasme progresse, ISTENDO 1 g/5 ml doit être immédiatement arrêté.
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
4.6. Fertilité, grossesse et allaitement
Grossesse
Les études chez l’animal n’ont pas mis en évidence d’effet tératogène. Les données cliniques disponibles chez la femme enceinte avec l’acétylcystéine sont limitées. Néanmoins, compte tenu du mode d’administration de ISTENDO en instillation endotrachéobronchique, le risque de retentissement sur une grossesse en cours est peu probable.
Il est possible d’allaiter en cas de traitement par ce médicament.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
· Bronchospasme,
· Inondation bronchique,
· Sensation de brûlure trachéale ou toux d’irritation (en particulier si le produit est insuffisamment dilué ou utilisé pur),
· Réactions d’hypersensibilité avec possibilité de choc anaphylactique, réactions anaphylactoïdes, angioedème, rashs cutanés,
· Des cas de rhinorrhée, somnolence, moiteur, oppression thoracique, ont été rapportés.
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : www.signalement-sante.gouv.fr.
Aucun cas de surdosage n’a été rapporté, cependant, un surdosage éventuel risque d’entraîner une exacerbation des effets indésirables.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Classe pharmacothérapeutique : mucolytique (R : système respiratoire)
L’acétylcystéine est un mucomodificateur de type mucolytique. Elle exerce son action sur la phase gel du mucus, vraisemblablement en rompant les ponts disulfures des glycoprotéines, et facilite ainsi la fluidification des sécrétions.
Mécanisme d’action
L’acétylcystéine est un mucomodificateur de type mucolytique. Elle exerce son action sur la phase gel du mucus, vraisemblablement en rompant les ponts disulfures des glycoprotéines, et facilite ainsi la fluidification des sécrétions.
5.2. Propriétés pharmacocinétiques
Sans objet.
5.3. Données de sécurité préclinique
Edétate de sodium, hydroxyde de sodium, eau pour préparations injectables.
La N-acétylcystéine étant un réducteur :
· Certaines matières (par exemple : le caoutchouc et certains métaux, notamment le fer et le cuivre) risquent de réagir avec ISTENDO 1 g/5 ml. Par conséquent, ne pas mettre ISTENDO 1 g/5 ml en contact avec ces matières.
· Il existe une probabilité d’incompatibilités physico-chimiques avec les antibiotiques ou les corticoïdes. Par conséquent, ne pas mélanger ISTENDO 1 g/5 ml avec ces produits dans un même récipient.
3 ans.
Dès l’ouverture de l’ampoule : le produit est à utiliser immédiatement.
6.4. Précautions particulières de conservation
Pas de précautions particulières de conservation.
6.5. Nature et contenu de l'emballage extérieur
Ampoule en verre brun de type I de 5 ml. Boîte de 6 et 30.
6.6. Précautions particulières d’élimination et de manipulation
Pas d’exigences particulières
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
49 RUE ROUELLE
75015 PARIS
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· 380 263-9 ou 34009 380 263 9 9: 6 ampoule(s) en verre brun de 5 ml.
· 570 956-5 ou 34009 570 956 5 9: 30 ampoule(s) en verre brun de 5 ml.
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
[à compléter ultérieurement par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE
[à compléter ultérieurement par le titulaire]
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Liste II
ANSM - Mis à jour le : 05/11/2021
ISTENDO 1 g/5 ml, solution pour instillation endotrachéobronchique en ampoule
N-acétylcystéine
Veuillez lire attentivement cette notice avant de prendre ce médicament car elle contient des informations importantes pour vous.
· Gardez cette notice. Vous pourriez avoir besoin de la relire.
· Si vous avez d’autres questions, interrogez votre médecin ou votre infirmier/ère.
· Ce médicament vous a été personnellement prescrit. Ne le donnez pas à d’autres personnes. Il pourrait leur être nocif, même si les signes de leur maladie sont identiques aux vôtres.
· Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin, ou votre infirmier/ère. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
1. Qu'est-ce que ISTENDO 1 g/5 ml, solution pour instillation endotrachéobronchique et dans quels cas est-il utilisé ?
2. Quelles sont les informations à connaître avant de prendre ISTENDO 1 g/5 ml, solution pour instillation endotrachéobronchique ?
3. Comment prendre ISTENDO 1 g/5 ml, solution pour instillation endotrachéobronchique ?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver ISTENDO 1 g/5 ml, solution pour instillation endotrachéobronchique ?
6. Contenu de l’emballage et autres informations.
1. QU’EST-CE QUE ISTENDO 1 g/5 ml, solution pour instillation endotrachéobronchique en ampoule ET DANS QUELS CAS EST-IL UTILISE ?
Classe pharmacothérapeutique : MUCOLYTIQUE
(R : système respiratoire)
Indications thérapeutiques
Ce médicament est un fluidifiant des sécrétions bronchiques.
Il est préconisé, en instillation trachéale, en cas d’encombrement des voies respiratoires chez les patients trachéotomisés.
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT DE PRENDRE ISTENDO 1 g/5 ml, solution pour instillation endotrachéobronchique en ampoule?
N’utilisez jamais ISTENDO 1 g/5 ml, solution pour instillation endotrachéobronchique :
· Si vous êtes allergique (hypersensible) à l’acétylcystéine ou à l'un des autres composants contenus dans ISTENDO.
EN CAS DE DOUTE, VOUS DEVEZ DEMANDER L'AVIS DE VOTRE MEDECIN OU DE VOTRE PHARMACIEN.
Avertissements et précautions
Adressez-vous à votre médecin ou votre infirmier/ère avant d’utiliser ISTENDO 1 g/5 ml, solution pour instillation endotrachéobronchique.
ISTENDO 1 g/5 ml est à utiliser avec prudence chez les sujets ayant des antécédents asthmatiques ou de bronchospasmes.
Après administration locale du produit, il conviendra de bien évacuer les sécrétions afin d’éviter de majorer l’encombrement bronchique.
Beaucoup de patients atteints de bronchospasmes sont rapidement soulagés par l'utilisation d'un bronchodilatateur sous forme de nébulisation. Si le bronchospasme progresse, ISTENDO 1 g/5 ml doit être immédiatement arrêté.
Adressez-vous à votre médecin ou votre pharmacien avant de prendre ISTENDO 1 g/5 ml, solution pour instillation endotrachéobronchique.
Enfants
Sans objet.
Autres médicaments et ISTENDO 1 g/5 ml, solution pour instillation endotrachéobronchique
Informez votre médecin ou pharmacien si vous prenez, avez récemment pris ou pourriez prendre tout autre médicament.
ISTENDO 1 g/5 ml, solution pour instillation endotrachéobronchique avec des aliments et boissons
Sans objet.
Il est préférable de ne pas utiliser ce médicament pendant la grossesse. Si vous découvrez que vous êtes enceinte pendant le traitement, consultez votre médecin car lui seul peut juger de la nécessité de le poursuivre.
Il est possible d'allaiter votre enfant en cas de traitement par ce médicament.
Si vous êtes enceinte ou que vous allaitez, si vous pensez être enceinte ou planifiez une grossesse, demandez conseil à votre médecin ou pharmacien avant de prendre ce médicament.
Conduite de véhicules et utilisation de machines
Sans objet.
ISTENDO 1 g/5 ml, solution pour instillation endotrachéobronchique contient
Edétate de sodium, hydroxyde de sodium, eau pour préparations injectables.
3. COMMENT UTILISER ISTENDO 1 g/5 ml, solution pour instillation endotrachéobronchique en ampoule?
1 à 2 ml de solution diluée dans une quantité égale de sérum physiologique ou d'eau distillée, en instillation par la canule de trachéotomie.
Mode et voie d'administration
Voie endo-trachéale.
Mode d’emploi pour ouvrir les ampoules
|
|
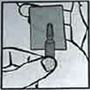
1- Tapoter le haut de l'ampoule pour faire descendre le liquide. Tenir le corps de l'ampoule d'une main avec le point blanc dirigé vers le haut et face à vous |
|
|
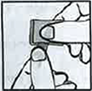
2- Recouvrir le haut de l'ampoule avec une compresse et placer le pouce sur le point blanc. |
|
|
3- L'ampoule s'ouvre en exerçant une pression vers l'arrière de l'ampoule avec le pouce (effet de levier) en résistant avec l'index opposé (point d'appui), comme indiqué sur le schéma. |
Note : il est difficile lors des premières manipulations d'anticiper la force à exercer sur l'ampoule.
NE PAS INJECTER.
Si vous avez pris plus de ISTENDO 1 g/5 ml, solution pour instillation endotrachéobronchique que vous n’auriez dû :
Une aggravation des effets indésirables est possible.
Veuillez contacter votre médecin.
Si vous oubliez de prendre ISTENDO 1 g/5 ml, solution pour instillation endotrachéobronchique
Sans objet.
Si vous arrêtez de prendre ISTENDO 1 g/5 ml, solution pour instillation endotrachéobronchique :
Sans objet.
Si vous avez d’autres questions sur l’utilisation de ce médicament, demandez plus d’informations à votre médecin ou à votre pharmacien.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
· Un bronchospasme peut survenir après administration du produit, se traduisant par une majoration brutale de la gêne respiratoire, en particulier chez les sujets ayant des antécédents d'asthme. Dans ce cas, ne pas renouveler l'administration et contacter votre médecin.
· Risque d'encombrement bronchique après l'administration du produit
· Possibilité de sensation de brûlure au niveau de la trachée, de toux d'irritation, notamment en cas de dilution insuffisante de la solution
· Possibilité de réactions allergiques pouvant se manifester par un brusque gonflement du visage et du cou, une éruption cutanée ou par un malaise brutal avec chute de la pression artérielle.
· Des cas de rhinorrhée, somnolence, moiteur, oppression thoracique ont été rapportés.
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet: www.signalement-sante.gouv.fr
En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.
5. COMMENT CONSERVER ISTENDO 1 g/5 ml, solution pour instillation endotrachéobronchique en ampoule?
Tenir ce médicament hors de la vue et de la portée des enfants.
N’utilisez pas ce médicament après la date de péremption indiquée sur le conditionnement extérieur.
Dès l’ouverture de l’ampoule : le produit est à utiliser immédiatement.
Ne jetez aucun médicament au tout-à-l’égout ou avec les ordures ménagères. Demandez à votre pharmacien d’éliminer les médicaments que vous n’utilisez plus. Ces mesures contribueront à protéger l’environnement.
6. CONTENU DE L’EMBALLAGE ET AUTRES INFORMATIONS
Ce que contient ISTENDO 1 g/5 ml, solution pour instillation endotrachéobronchique en ampoule
· La substance active est :
Acétylcystéine ..................................................................................................................... 1 g
Pour 1 ampoule de 5 ml
· Les autres composants sont : Edétate de sodium, hydroxyde de sodium, eau pour préparations injectables.
Titulaire de l’autorisation de mise sur le marché
49 RUE ROUELLE
75015 PARIS
Exploitant de l’autorisation de mise sur le marché
49 RUE ROUELLE
75015 PARIS
1 RUE COMTE DE SINARD
26250 LIVRON SUR DROME
FRANCE
Noms du médicament dans les Etats membres de l'Espace Economique Européen
Sans objet.
La dernière date à laquelle cette notice a été révisée est :
Des informations détaillées sur ce médicament sont disponibles sur le site Internet de l’ANSM (France).