Dernière mise à jour le 13/10/2025
AURICULARUM, poudre et solvant pour suspension pour instillation auriculaire
Présentations
> 1 flacon(s) polyéthylène de poudre - 1 ampoule(s) polyéthylène basse densité (PEBD) de 10 ml de solvant
Code CIP : 34009 301 922 5 2
Déclaration de commercialisation : 26/02/2020
Cette présentation est agréée aux collectivités
- Prix hors honoraire de dispensation : 5,25 €
- Honoraire de dispensation : 1,02 €
- Prix honoraire compris : 6,27 €
- Taux de remboursement :15 %
Service médical rendu (SMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprès de la HAS (plus d'informations dans l'aide). Les avis et synthèses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur du SMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| Faible | Avis du 21/03/2018 | Réévaluation SMR | Le service médical rendu par AURICULARUM, poudre et solvant pour suspension pour instillation auriculaire, est faible dans le traitement local des otites chroniques : • en préopératoire pour assèchement, • en post-opératoire pour les cavités d’évidement pétro-mastoïdien avec ou sans tympanoplastie. |
| Faible | Avis du 09/11/2017 | Réévaluation SMR | Le service médical rendu par AURICULARUM, poudre et solvant pour instillation auriculaire, devient faible dans le traitement local des otites externes d’origine bactérienne et/ou mycosique. |
| Modéré | Avis du 16/12/2015 | Renouvellement d'inscription (CT) | Le service médical rendu par AURICULARUM est modéré dans les indications de l’AMM. |
Amélioration du service médical rendu (ASMR)
Pas d'ASMR disponible pour ce médicament (plus d'informations dans l'aide )
ANSM - Mis à jour le : 03/09/2020
AURICULARUM, poudre et solvant pour suspension pour instillation auriculaire
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Chlorhydrate d’oxytétracycline............................................................................................ 100,0 mg
Sulfate de polymyxine B...................................................................................................... 12,3 mg
Phosphate sodique de dexaméthasone................................................................................ 10,0 mg
Nystatine...................................................................................................................... 1 000 000 UI
Pour un flacon
Excipient(s) à effet notoire : Laurylsulfate de sodium
Pour la liste complète des excipients, voir rubrique 6.1.
Poudre et solvant pour suspension pour instillation auriculaire.
4.1. Indications thérapeutiques
· des otites externes d’origine bactérienne et/ou mycosique ;
· des otites chroniques :
o en préopératoire pour assèchement,
o en post-opératoire pour les cavités d’évidement pétro-mastoïdien avec ou sans tympanoplastie.
Il convient de tenir compte des recommandations officielles concernant l'utilisation appropriée des antibactériens.
4.2. Posologie et mode d'administration
Voie locale auriculaire.
Sous forme de poudre :
Insuffler une dose de produit obtenue par une pression sur le flacon dans le conduit auditif de l’oreille atteinte 1 à 2 fois par jour, ou tous les 2 à 3 jours.
Sous forme de suspension :
Instiller 5 à 10 gouttes de la suspension obtenue dans le conduit auditif de l’oreille atteinte, 1 à 2fois par jour.
Mode d’administration
Sous forme de poudre :
Orienter le flacon souple, tête en bas ; ramener en tassant la totalité de la poudre vers la partie du col ;
Exercer une pression sur le flacon pour obtenir une dose de produit ;
Sous forme de suspension :
Dans certains cas particuliers, il est possible d’utiliser la poudre mise en suspension avec le contenu de l’ampoule de solvant.
Cette suspension auriculaire préparée au moment de l’emploi conserve son activité pendant 8 jours entre + 2°C et +8°C (au réfrigérateur).
Tiédir le flacon au moment de l’emploi en le maintenant quelques minutes dans la paume de la main, afin d’éviter le contact désagréable de la solution froide dans l’oreille. Bien agiter avant utilisation.
Instiller, tête penchée, les gouttes dans l’oreille atteinte en tirant à plusieurs reprises sur le pavillon de l’oreille. Maintenir la tête penchée sur le côté pendant environ 5 minutes, afin de faciliter la pénétration des gouttes dans le conduit auditif externe. Répéter, si nécessaire, dans l’autre oreille.
A la fin du traitement, le reste du flacon doit être éliminéet ne doit pas être conservé en vue d’une réutilisation.
Durée du traitement :
La durée du traitement est habituellement de 7 jours, pouvant aller jusqu’à 15 jours maximum dans le traitement de l’otomycose.
Perforation tympanique sèche (cf.4.4 Mises en garde et précaution particulière d’emploi).
Infections virales du conduit auditif externe incluant la varicelle et les infections à Herpès simplex.
4.4. Mises en garde spéciales et précautions d'emploi
Vérifier l’état tympanique avant toute prescription.
Ce produit contient de l’oxytétracycline, antibiotique appartenant à la famille des cyclines connue, lors d’administration par voie générale, pour sa toxicité sur les dents chez l’enfant de moins de 8 ans, ainsi que pour son risque de photosensibilisation.
En l’absence de donnée avec ce médicament administré sous forme de poudre ou de suspension auriculaire, ces risques ne peuvent être totalement écartés mais sont sûrement minimes, vues les quantités administrées ; le passage d’oxytétracycline dans la circulation générale est encore plus aléatoire lorsque ce médicament est administré sous forme de poudre.
L’administration d’antibiotiques locaux participe à la survenue de sensibilisation à ces substances actives, avec possiblement la survenue de réactions générales.
La présence d’un corticoïde n’empêche pas les manifestations d’allergie à l’antibiotique, mais peut modifier leur expression clinique.
Interrompre le traitement dès les premiers signes d’apparition d’un rash cutané ou de tout autre signe d’hypersensibilité locale ou générale.
L’attention des sportifs est attirée sur le fait que cette spécialité contient un principe actif (la dexaméthasone) pouvant induire une réaction positive des tests pratiqués lors de contrôles anti-dopage.
La persistance d’un dépôt de poudre brunâtre dans le conduit auditif externe peut nécessiter un nettoyage.
Une attention particulière sera portée aux patients porteurs d’appareils auditifs ; en effet, la persistance de ce dépôt peut gêner le bon fonctionnement de l’appareil.
Ne pas injecter, ne pas avaler.
Au moment de l’emploi, éviter la mise en contact de l’embout avec l’oreille ou les doigts afin de limiter les risques de contamination.
Il est conseillé de ne pas associer ce médicament à un autre traitement local.
Si au bout de 10 jours, voire 15 jours en cas d’otomycose, les symptômes persistent, il faut revoir le patient pour réévaluer la pathologie et le traitement.
Ce médicament contient 3,25 mg de laurylsulfate de sodium par flacon.
Le laurylsulfate de sodium peut provoquer des réactions cutanées locales (comme une sensation de piqûre ou de brûlure) ou augmenter les réactions cutanées causées par d'autres produits lorsqu'ils sont appliqués sur la même zone.
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
4.6. Fertilité, grossesse et allaitement
Grossesse
L’utilisation de ce médicament ne sera envisagée au cours de la grossesse que si nécessaire.
Ce médicament peut être prescrit au cours de l’allaitement.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
· Exceptionnellement : sensation de cuisson ou de prurit en début de traitement, allergie locale, sensation vertigineuse.
· Persistance de résidus brunâtres dans le conduit auditif (voir rubrique 4.4.).
· Sélection de germes résistants.
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : www.signalement-sante.gouv.fr
Sans objet.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
La dexaméthasone est un anti-inflammatoire stéroïdien.
L’oxytétracycline est un antibiotique de la famille des cyclines.
La polymyxine B est un antibiotique de la famille des polypeptides.
La nystatine est un antifongique.
Activité antibiotique, antifongique et anti-inflammatoire en otologie due aux propriétés anti-inflammatoires de la dexaméthasone, au pouvoir antifongique de la nystatine et au pouvoir antibactérien de deux antibiotiques d’activité complémentaire.
L’association de ces deux antibiotiques se justifie par leur bonne tolérance locale et par la flore microbienne rencontrée dans les infections de l’oreille moyenne. De plus, l’association d’oxytétracycline et de polymyxine B est synergique. Cette propriété permet d’élargir le spectre aux Pseudomonas et à tous les Proteus.
SPECTRE D'ACTIVITE ANTI-BACTERIENNE DE L’OXYTETRACYCLINE ET DE LA POLYMYXINE B.
OXYTETRACYCLINE
Les concentrations critiques séparent les souches sensibles des souches de sensibilité intermédiaire et ces dernières, des résistantes : S ![]() 4 mg/l et R > 8 mg/l.
4 mg/l et R > 8 mg/l.
La prévalence de la résistance acquise peut varier en fonction de la géographie et du temps pour certaines espèces. Il est donc utile de disposer d'informations sur la prévalence de la résistance locale, surtout pour le traitement d'infections sévères. Ces données ne peuvent apporter qu'une orientation sur les probabilités de la sensibilité d'une souche bactérienne à cet antibiotique.
Lorsque la variabilité de la prévalence de la résistance en France est connue pour une espèce bactérienne, elle est indiquée dans le tableau ci-dessous :
Catégories |
Fréquence de résistance acquise en France (> 10%) (valeurs extrêmes) |
|
|
ESPÈCES SENSIBLES |
||
|
Aérobies à Gram positif |
||
|
Bacillus |
||
|
Entérocoques |
40 - 80 % |
|
|
Staphylococcus méti-S * |
||
|
Staphylococcus méti-R ** |
70 - 80 % |
|
|
Streptococcus A |
20 % |
|
|
Streptococcus B |
80 - 90 % |
|
|
Streptococcus pneumoniae |
20 - 40 % |
|
|
Aérobies à Gram négatif |
||
|
Branhamella catarrhalis |
||
|
Brucella |
||
|
Escherichia coli |
20 - 40 % |
|
|
Haemophilus influenzae |
10 % |
|
|
Klebsiella |
10 - 30 % |
|
|
Neisseria gonorrhoeae |
||
|
Pasteurella |
||
|
Vibrio cholerae |
||
|
Anaérobies |
||
|
Propionibacterium acnes |
||
|
Autres |
|
|
Borrelia burgdorferi |
|
|
Chlamydia |
|
|
Coxiella burnetii |
|
|
Leptospira |
|
|
Mycoplasma pneumoniae |
|
|
Rickettsia |
|
|
Treponema pallidum |
|
|
Ureaplasma urealyticum |
|
|
ESPÈCES RÉSISTANTES |
|
|
Aérobies à Gram négatif |
|
|
Acinetobacter |
|
|
Proteus mirabilis |
|
|
Proteus vulgaris |
|
|
Pseudomonas |
|
|
Serratia |
|
* Efficacité clinique démontrée pour les souches sensibles dans l’indication clinique approuvée en association avec la polymyxine B.
** La fréquence de résistance à la méticilline est environ de 30 à 50 % de l'ensemble des staphylocoques et se rencontre surtout en milieu hospitalier.
POLYMYXINE B
Les concentrations critiques séparent les souches sensibles des souches de sensibilité intermédiaire et ces dernières, des résistantes : S £ 2 mg/l et R > 2 mg/l
La prévalence de la résistance acquise peut varier en fonction de la géographie et du temps pour certaines espèces. Il est donc utile de disposer d'informations sur la prévalence de la résistance locale, surtout pour le traitement d'infections sévères. Ces données ne peuvent apporter qu'une orientation sur les probabilités de la sensibilité d'une souche bactérienne à cet antibiotique.
Lorsque la variabilité de la prévalence de la résistance en France est connue pour une espèce bactérienne, elle est indiquée dans le tableau ci-dessous :
|
Catégories |
Fréquence de résistance acquise en France (>10%) (valeurs extrêmes) |
|
ESPÈCES SENSIBLES |
|
|
Aérobies à Gram négatif |
|
|
Acinetobacter |
|
|
Aeromonas |
|
|
Alcaligenes |
|
|
Citrobacter freundii |
|
|
Citrobacter koseri |
|
|
Enterobacter |
|
|
Escherichia coli |
|
|
Klebsiella |
|
|
Moraxella |
|
|
Pseudomonas aeruginosa* |
|
|
Salmonella |
|
|
Shigella |
|
|
Stenotrophomonas maltophilia |
0 – 30 % |
|
Catégories
|
|
|
ESPÈCES RÉSISTANTES |
|
|
Aérobies à Gram positif |
|
|
Cocci et bacilles |
|
|
Aérobies à Gram négatif |
|
|
Branhamella catarrhalis |
|
|
Brucella |
|
|
Burkholderia cepacia Burkholderia pseudomallei Campylobacter |
|
|
Chryseobacterium meningosepticum |
|
|
Legionella |
|
|
Morganella |
|
|
Neisseria |
|
|
Proteus |
|
|
Providencia |
|
|
Serratia |
|
|
Vibrio cholerae El Tor Anaérobies |
|
|
Cocci et bacilles |
|
|
Autres |
|
|
Mycobactéries |
|
* Efficacité clinique démontrée pour les souches sensibles dans l’indication clinique approuvée en association avec l’oxytétracycline.
Remarque : ce spectre correspond à celui de la forme systémique de ces antibiotiques. Avec les présentations pharmaceutiques locales, les concentrations obtenues in situ sont très supérieures aux concentrations plasmatiques. Quelques incertitudes demeurent sur la cinétique des concentrations in situ, sur les conditions physico-chimiques locales qui peuvent modifier l'activité de l'antibiotique et sur la stabilité du produit in situ.
NYSTATINE
Antifongique de contact de la famille des polyènes, extrait de culture de Streptomyces noursei.
La nystatine agirait par fixation sur une fraction stérolique de la membrane du champignon, provoquant des modifications de la perméabilité membranaire.
Spectre d’action antifongique : la nystatine est active sur une large variété de champignons levuriformes et filamenteux, incluant les principaux agents responsables d’otomycose (Candida, Aspergillus).
5.2. Propriétés pharmacocinétiques
En cas de brèche tympanique, il n’existe pas de passage systémique.
5.3. Données de sécurité préclinique
Sans objet.
Composition du solvant : chlorure de sodium, eau purifiée.
Après reconstitution : la suspension pour instillation auriculaire doit être conservée au maximum 8 jours.
6.4. Précautions particulières de conservation
Avant reconstitution : à conserver à une température ne dépassant pas +25°C.
Après reconstitution, la suspension pour instillation auriculaire doit être conservée entre +2°C et + 8°C (au réfrigérateur).
6.5. Nature et contenu de l'emballage extérieur
Flacon (PE) de poudre et 10 ml de solvant en ampoule (PEBD) ; boîte de 1.
6.6. Précautions particulières d’élimination et de manipulation
Tout médicament non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
44 AVENUE GEORGES POMPIDOU
92300 LEVALLOIS-PERRET
FRANCE
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· 34009 301 922 5 2 : 1 flacon(s) polyéthylène - 1 ampoule(s) polyéthylène basse densité (PEBD) de 10 ml
· 34009 364 014 8 8 : 1 flacon(s) polyéthylène - 1 ampoule(s) polyéthylène basse densité (PEBD) de 10 ml
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
[à compléter ultérieurement par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE
[à compléter ultérieurement par le titulaire]
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
ANSM - Mis à jour le : 03/09/2020
AURICULARUM, poudre et solvant pour suspension pour instillation auriculaire
Veuillez lire attentivement cette notice avant de prendre ce médicament car elle contient des informations importantes pour vous.
· Gardez cette notice. Vous pourriez avoir besoin de la relire.
· Si vous avez d’autres questions, interrogez votre médecin ou votre pharmacien. Ce médicament vous a été personnellement prescrit. Ne le donnez pas à d’autres personnes. Il pourrait leur être nocif, même si les signes de leur maladie sont identiques aux vôtres.
· Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin, ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
1. Qu'est-ce que AURICULARUM, poudre et solvant pour suspension pour instillation auriculaire xxx et dans quels cas est-il utilisé ?
2. Quelles sont les informations à connaître avant d'utiliser AURICULARUM, poudre et solvant pour suspension pour instillation auriculaire ?
3. Comment utiliser AURICULARUM, poudre et solvant pour suspension pour instillation auriculaire ?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver AURICULARUM, poudre et solvant pour suspension pour instillation auriculaire ?
6. Contenu de l’emballage et autres informations.
1. QU’EST-CE QUE AURICULARUM, poudre et solvant pour suspension pour instillation auriculaire ET DANS QUELS CAS EST-IL UTILISE ?
Ce médicament est indiqué dans le traitement local de certaines otites.
Vous devez vous adresser à votre médecin si vous ne ressentez aucune amélioration ou si vous vous sentez moins bien après 10 jours, voire 15 jours en cas d'infection due à un champignon.
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT D’UTILISERAURICULARUM, poudre et solvant pour suspension pour instillation auriculaire?
N’utilisez jamais AURICULARUM, poudre et solvant pour suspension pour instillation auriculaire:
· si vous êtes allergique (hypersensible) à l'oxytétracycline ou à un autre médicament de la famille des cyclines
· si vous êtes allergique (hypersensible) à la polymyxine B
· si vous êtes allergique (hypersensible) à la nystatine
· si vous êtes allergique (hypersensible) à la dexaméthasone ou à l’un des autres constituants contenus dans ce médicament, mentionnés dans la rubrique 6.
· si vous avez une perforation du tympan sans écoulement (due à un traumatisme)
· si vous avez une infection virale au niveau de l'oreille (varicelle, Herpes, )
Avertissements et précautions
Adressez-vous à votre médecin ou votre pharmacien avant d’utiliser AURICULARUM, poudre et solvant pour suspension pour instillation auriculaire.
Il faut faire vérifier l'état de votre tympan par votre médecin avant toute prescription.
Arrêter le traitement dès l'apparition d'une éruption cutanée et de toute autre réaction d'allergie locale ou générale. Consultez alors votre médecin.
Des résidus brunâtres peuvent persister dans le conduit auditif. Ils sont sans danger mais peuvent nécessiter un nettoyage par le médecin en fin de traitement.
Une attention particulière sera portée aux patients porteurs d'appareils auditifs ; en effet, la persistance de ce dépôt peut gêner le bon fonctionnement des appareils.
Il est conseillé de ne pas administrer d'autres médicaments dans l'oreille en même temps.
Ne pas injecter, ni avaler ce médicament.
Au moment de l'emploi, éviter la mise en contact de l'embout avec l'oreille ou les doigts afin de limiter les risques de contamination
Si au bout de 10 jours les symptômes persistent, voire 15 jours en cas d'infection due à un champignon, il faut reconsulter.
Ce médicament contient 3,25 mg de laurylsulfate de sodium par flacon.
Le laurylsulfate de sodium peut provoquer des réactions cutanées locales (comme une sensation de piqûre ou de brûlure) ou augmenter les réactions cutanées causées par d'autres produits lorsqu'ils sont appliqués sur la même zone.
en cas de doute ne pas hésiter à demander l'avis de votre médecin ou de votre pharmacien
Autres médicaments et AURICULARUM, poudre et solvant pour suspension pour instillation auriculaire
Informez votre médecin ou votre pharmacien si vous prenez, avez récemment pris ou pourriez prendre tout autre médicament.
AURICULARUM, poudre et solvant pour suspension pour instillation auriculaire avec des aliments, des boissons et de l’alcool
Sans objet.
L’utilisation de ce médicament ne sera envisagée au cours de la grossesse que si nécessaire. Ce médicament peut être prescrit au cours de l’allaitement.
Demandez conseil à votre médecin ou à votre pharmacien avant de prendre tout médicament.
Conduite de véhicules et utilisation de machines
Sans objet.
AURICULARUM, poudre et solvant pour suspension pour instillation auriculaire contient du laurylsulfate de sodium.
3. COMMENT UTILISER AURICULARUM, poudre et solvant pour suspension pour instillation auriculaire ?
Voie locale auriculaire
A titre indicatif, la posologie usuelle est la suivante :
1)- Sous forme de poudre : Une dose 1 à 2 fois par jour, ou tous les 2 à 3 jours selon le monde d’administration suivant (schéma n°4).
Orienter le flacon souple, tête en bas avec son bouchon ; ramener en tassant la totalité de la poudre vers la partie du col;
Ouvrir le flacon en le laissant tête en bas, et positionner selon le schéma n°4 ;
Exercer une pression sur le flacon pour obtenir une dose de produit ;
2)- Sous forme de suspension : 5 à 10 gouttes 1 à 2 fois par jour selon le mode d’administration suivant (schémas n°1 à 4).
Dans certains cas particuliers, il est possible d'utiliser la poudre mise en suspension avec le contenu de l’ampoule de solvant.
Orienter le flacon souple, tête en haut, tasser la poudre dans le fond du flacon.
Ouvrir le flacon.
Retirer l’embout transparent du flacon.
Ouvrir l’ampoule de solvant.
Introduire le contenu de l’ampoule de solvant dans le flacon.
Remettre l’embout transparent au flacon, puis refermer le flacon et bien agiter.
Puis, tiédir le flacon au moment de l'emploi en le maintenant quelques minutes dans la paume de la main afin d'éviter le contact désagréable de la solution froide dans l'oreille.
Bien agiter avant utilisation
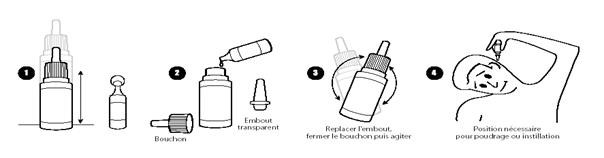
Pour mettre les gouttes dans une oreille et faire un bain d'oreille :
Il faut d'abord pencher la tête du côté opposé à l'oreille atteinte pour que l'oreille atteinte se trouve en haut.
Mettre les gouttes dans l'oreille atteinte.
Tirer à différentes reprises sur le pavillon de l'oreille pour que les gouttes coulent bien dans le fond de l'oreille.
Attendre environ 5 minutes en gardant la tête ainsi penchée.
Lorsque vous relevez la tête, les gouttes peuvent ressortir un peu ; il faut alors essuyer avec un papier absorbant qui n'a pas besoin d'être stérile.
Il est important de bien suivre cette recommandation car il en va de l'efficacité de votre traitement : en effet, il faut garder suffisamment longtemps la tête penchée pour permettre une bonne pénétration du médicament dans l'oreille. Redresser trop tôt la tête va provoquer une perte du médicament car les gouttes couleront le long de votre visage et n'iront pas dans le fond de l'oreille ; ceci expose alors à une moindre efficacité du traitement.
Refermez le flacon immédiatement après usage.
A la fin du traitement, le reste du flacon doit être éliminéet ne pas être conservé en vue d'une réutilisation (voir rubrique 5).
Durée du traitement
La durée du traitement est habituellement de 7 jours pouvant aller jusqu'à 15 jours en cas d'infection due à un champignon.
Pour être efficace, cet antibiotique doit être utilisé régulièrement aux doses prescrites et aussi longtemps que votre médecin vous l'aura conseillé.
La disparition des symptômes ne signifie pas que vous êtes complètement guéri. L'éventuelle impression de fatigue n'est pas due au traitement antibiotique mais à l'infection elle-même. Le fait de réduire ou de suspendre votre traitement serait sans effet sur cette impression et retarderait votre guérison.
Si vous avez utilisé plus de d’AURICULARUM, poudre et solvant pour suspension pour instillation auriculaire que vous n’auriez dû
Consultez immédiatement votre médecin ou votre pharmacien.
Si vous oubliez d’utiliser AURICULARUM, poudre et solvant pour suspension pour instillation auriculaire :
Ne prenez pas de dose double pour compenser la dose que vous avez oubliée d’utiliser.
Si vous arrêtez de prendre d’utiliser AURICULARUM, poudre et solvant pour suspension pour instillation auriculaire :
Sans objet.
Si vous avez d’autres questions sur l’utilisation de ce médicament, demandez plus d’informations à votre médecin, à votre pharmacien.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
Exceptionnellement: sensation de cuisson ou de démangeaisons en début de traitement ; allergie locale, vertiges.
Persistance de résidus brunâtres dans le conduit auditif (voir. Avertissement et précautions)
Sélection de germes résistants.
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet: www.signalement-sante.gouv.fr
En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.
5. COMMENT CONSERVER AURICULARUM, poudre et solvant pour suspension pour instillation auriculaire ?
Tenir ce médicament hors de la vue et de la portée des enfants.
N’utilisez pas ce médicament après la date de péremption indiquée sur l’emballage. La date de péremption fait référence au dernier jour de ce mois.
Avant reconstitution : à conserver à une température ne dépassant pas +25°C.
Après reconstitution : la suspension pour instillation auriculaire conserve son activité pendant 8 jours entre +2°C et +8°C (au réfrigérateur).
Ne jetez aucun médicament au tout-à-l’égout ou avec les ordures ménagères. Demandez à votre pharmacien d’éliminer les médicaments que vous n’utilisez plus. Ces mesures contribueront à protéger l’environnement.
6. CONTENU DE L’EMBALLAGE ET AUTRES INFORMATIONS
Ce que contient AURICULARUM, poudre et solvant pour suspension pour instillation auriculaire
· Les substances actives sont :
Chlorhydrate d'oxytétracycline...................................................................................... 100,0 mg
Sulfate de polymyxine B................................................................................................ 12,3 mg
Phosphate sodique de dexaméthasone.......................................................................... 10,0 mg
Nystatine................................................................................................................ 1 000 000 UI
Pour un flacon.
· Les autres composants sont :
Laurylsulfate de sodium.
Composition du solvant : chlorure de sodium, eau purifiée.
Ce médicament se présente sous forme de poudre et solvant pour instillation auriculaire. Boîte de 1
Titulaire de l’autorisation de mise sur le marché
44 AVENUE GEORGES POMPIDOU
92300 LEVALLOIS-PERRET
FRANCE
Exploitant de l’autorisation de mise sur le marché
ZA DES BOUTRIES, RUE VERMONT
78704 CONFLANS SAINTE HONORINE CEDEX
FRANCE
ZA DES BOUTRIES, RUE VERMONT
78704 CONFLANS SAINTE HONORINE CEDEX
FRANCE
Noms du médicament dans les Etats membres de l'Espace Economique Européen
Sans objet.
La dernière date à laquelle cette notice a été révisée est :
[à compléter ultérieurement par le titulaire]
CONSEILS/EDUCATION SANITAIRE
Que savoir sur les antibiotiques ?
Les antibiotiques sont efficaces pour combattre les infections dues aux bactéries. Ils ne sont pas efficaces contre les infections dues aux virus.
Aussi votre médecin a choisi de vous prescrire cet antibiotique parce qu’il convient précisément à votre cas et à votre maladie actuelle.
Les bactéries ont la capacité de survivre ou de se reproduire malgré l’action d’un antibiotique. Ce phénomène est appelé résistance : il rend certains traitements antibiotiques inactifs.
La résistance s’accroit par l’usage abusif ou inapproprié des antibiotiques.
Vous risquez de favoriser l’apparition de bactéries résistantes et donc de retarder votre guérison ou même de rendre inactif ce médicament si vous ne respectez pas :
· la dose à prendre ;
· les moments de prise
· et la durée du traitement.
En conséquence, pour préserver l’efficacité de ce médicament :
1) N’utilisez un antibiotique que lorsque votre médecin vous l’a prescrit.
2) Respectez strictement votre ordonnance.
3) Ne réutilisez pas un antibiotique sans prescription médicale même si vous pensez combattre une maladie apparemment semblable.
4) Ne donnez jamais votre antibiotique à une autre personne, il n’est peut-être pas adapté à sa maladie
5) Une fois votre traitement terminé, rapportez à votre pharmacien toutes les boîtes entamées pour une destruction correcte et appropriée de ce médicament.
Des informations détaillées sur ce médicament sont disponibles sur le site Internet de l’ANSM (France).