Dernière mise à jour le 06/11/2025
MIRENA 52 mg (20 microgrammes/24 heures), dispositif intra-utérin
Indications thérapeutiques
Qu’est-ce que MIRENA ?
MIRENA est un dispositif intra-utérin (plus communément appelé stérilet) qui est placé par un professionnel de santé à l’intérieur de votre utérus. Il contient une hormone : un progestatif (le lévonorgestrel), qui a un effet contraceptif.
Dans quels cas est-il utilisé ?
MIRENA est utilisé :
· soit pour éviter une grossesse (contraception),
· soit pour traiter des règles trop abondantes (ménorragies fonctionnelles).
Enfants et adolescents
MIRENA n’a pas d’indication avant l’apparition des premières règles (ménarche).
Présentations
> 1 plaquette(s) polytéréphtalate (PET) polyéthylène de 1 dispositif(s)
Code CIP : 339 292-8 ou 34009 339 292 8 2
Déclaration de commercialisation : 19/10/1997
Cette présentation est agréée aux collectivités
- Prix hors honoraire de dispensation : 82,32 €
- Honoraire de dispensation : 1,02 €
- Prix honoraire compris : 83,34 €
- Taux de remboursement :65%
Documents de bon usage du médicament
- Contraception chez la femme en post-partum
Auteur : Haute autorité de santé
Type : Fiche mémo
Date de mise à jour :Septembre 2019
- Contraception d’urgence
Auteur : Haute autorité de santé
Type : Fiche mémo
Date de mise à jour :Septembre 2019
- Contraception chez l’homme
Auteur : Haute autorité de santé
Type : Fiche mémo
Date de mise à jour :Septembre 2019
- Stérilisation à visée contraceptive chez l’homme et chez la femme
Auteur : Haute autorité de santé
Type : Fiche mémo
Date de mise à jour :Septembre 2019
- Contraception chez la femme adulte et de l'adolescente en âge de procréer (hors post-partum et post-IVG)
Auteur : Haute autorité de santé
Type : Fiche mémo
Date de mise à jour :Septembre 2019
- Contraception chez la femme à risque cardio-vasculaire
Auteur : Haute autorité de santé
Type : Fiche mémo
Date de mise à jour :Septembre 2019
- Contraception : prescriptions et conseils aux femmes
Auteur : Haute autorité de santé
Type : Fiche mémo
Date de mise à jour :Septembre 2019
- Contraception hormonale orale : dispensation en officine
Auteur : Haute autorité de santé
Type : Fiche mémo
Date de mise à jour :Septembre 2019
- Contraception d’urgence : dispensation en officine
Auteur : Haute autorité de santé
Type : Fiche mémo
Date de mise à jour :Septembre 2019
- Contraception estroprogestative transdermique ou vaginale : dispensation en officine
Auteur : Haute autorité de santé
Type : Fiche mémo
Date de mise à jour :Septembre 2019
- Contraception chez la femme après une interruption volontaire de grossesse (IVG)
Auteur : Haute autorité de santé
Type : Fiche mémo
Date de mise à jour :Septembre 2019
- Méthodes contraceptives : Focus sur les méthodes les plus efficaces disponibles
Auteur : Haute autorité de santé
Type : Evaluation des technologies de santé
Date de mise à jour :Novembre 2017
Service médical rendu (SMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprès de la HAS (plus d'informations dans l'aide). Les avis et synthèses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur du SMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| Important | Avis du 08/02/2017 | Renouvellement d'inscription (CT) | Le service médical rendu par MIRENA reste important dans les indications « contraception intra-utérine » et « Ménorragies fonctionnelles (après recherche et élimination de causes organiques décelables) ». |
Amélioration du service médical rendu (ASMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprés de la HAS (plus d'informations dans l'aide). Les avis et synthéses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur de l'ASMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| V (Inexistant) | Avis du 08/02/2017 | Renouvellement d'inscription (CT) | Prenant en compte : • La majoration du risque de perforation utérine, • la qualité de la démonstration (limites et biais méthodologiques), insuffisante pour permettre une évaluation comparative pertinente de l’efficacité contraceptive, la Commission considère que MIRENA n’apporte pas d’amélioration du service médical rendu (ASMR V) par rapport aux dispositifs intra-utérins au cuivre. |
| IV (Mineur) | Avis du 06/02/2013 | Renouvellement d'inscription (CT) | Dans l'indication contraception intra-utérine, MIRENA présente une amélioration du service médical rendu mineure (ASMR IV), en termes de tolérance par rapport aux dispositifs intra-utérins au cuivre. Cette tolérance est améliorée chez les femmes présentant des ménorragies avec les dispositifs intra-utérins au cuivre. |
| V (Inexistant) | Avis du 06/02/2013 | Renouvellement d'inscription (CT) | Dans l'indication ménorragies fonctionnelles, MIRENA n’apporte pas d’amélioration du service médical rendu (ASMR V, inexistante), dans la prise en charge des ménorragies fonctionnelles (après recherche et élimination de causes organiques décelables). |
ANSM - Mis à jour le : 24/04/2025
MIRENA 52 mg (20 microgrammes/24 heures), dispositif intra‑utérin
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Lévonorgestrel................................................................................................................... 52,00 mg
Pour un dispositif.
Pour la liste complète des excipients, voir rubrique 6.1.
Dispositif intra-utérin (DIU).
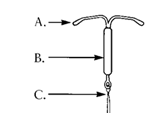
Le dispositif est composé d’un réservoir médicamenteux blanc ou blanchâtre recouvert d’une membrane semi-opaque, monté sur la tige verticale du corps en T.
Le corps blanc en T est doté d’une boucle à une extrémité de la tige verticale et de deux bras horizontaux à l’autre extrémité. Les fils de retrait de couleur marron sont fixés sur la boucle. Le corps en T de MIRENA contient du sulfate de Baryum qui le rend visible à la radiographie.
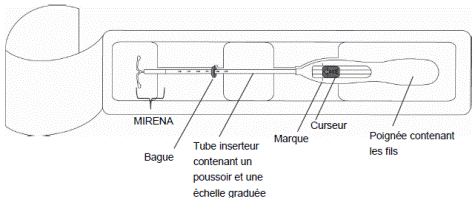
La tige verticale du DIU est placée dans le tube d’insertion, à l’extrémité de l’inserteur.
4.1. Indications thérapeutiques
· Contraception intra-utérine.
· Ménorragies fonctionnelles (après recherche et élimination de causes organiques décelables).
4.2. Posologie et mode d'administration
MIRENA doit être inséré dans la cavité utérine. Il reste efficace pendant 8 ans dans l’indication contraception intra-utérine et 5 ans dans l’indication ménorragies fonctionnelles. Pour connaître les délais de retrait/renouvellement, voir la section « Retrait/Renouvellement ».
Population pédiatrique
MIRENA n’a pas d’indication avant l’apparition des premières règles (ménarche).
Sujets âgés
MIRENA n’a pas d’indication chez la femme de plus de 65 ans.
Insuffisance hépatique
MIRENA est contre-indiqué chez la femme atteinte d’affection hépatique aiguë ou de tumeur hépatique (voir rubrique 4.3).
Insuffisance rénale
MIRENA n’a pas été étudié chez la femme atteinte d’insuffisance rénale.
Mode d’administration
Insertion
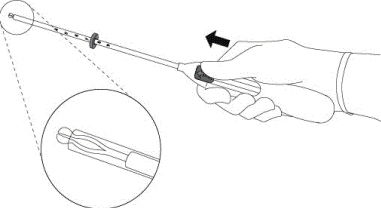
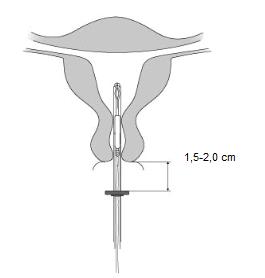
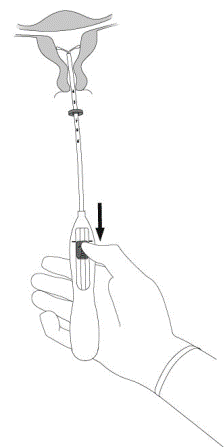
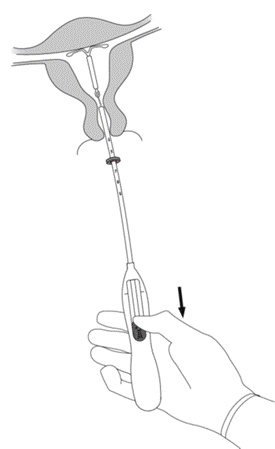
Il est fortement recommandé que l’insertion de MIRENA soit réalisée exclusivement par un professionnel de santé familiarisé avec la technique d’insertion de MIRENA et/ou ayant été suffisamment formé à la technique d’insertion de MIRENA.
Toute grossesse doit être exclue avant l’insertion. Interroger la femme sur sa période d’ovulation et sur une possible conception avant d’utiliser ce produit. MIRENA ne doit pas être utilisé comme une méthode de contraception post-coïtale (voir rubriques 4.3 et 4.4 sous le paragraphe « Examen médical/ consultation »).
Tableau 1 : Quand insérer MIRENA chez les femmes en âge de procréer
|
Commencer avec MIRENA |
-MIRENA doit être inséré dans la cavité utérine au cours des 7 jours qui suivent le début des règles. Dans ce cas, MIRENA assure une protection contraceptive dès l’insertion et aucune contraception supplémentaire n’est nécessaire. -Si l’insertion n’est pas possible au cours des 7 jours qui suivent le début des règles ou si la femme n’a pas de règles régulières, MIRENA peut être inséré à n’importe quel moment du cycle à condition qu’une fécondation ait été exclue de manière fiable par le professionnel de santé. Cependant, dans ce cas, la protection contraceptive immédiate après l'insertion n'est plus assurée de manière fiable. Par conséquent, une méthode contraceptive barrière doit être utilisée ou la patiente doit s'abstenir de rapports sexuels vaginaux pendant les 7 jours suivants pour éviter une grossesse. |
|
Insertion post partum |
En plus des instructions ci-dessus (« Commencer avec MIRENA ») : Au cours du post-partum, le dispositif ne peut être mis en place qu’après involution complète de l’utérus et, dans tous les cas, au plus tôt 6 semaines après l’accouchement. Si l’involution utérine est significativement retardée, il convient d’attendre jusqu’à 12 semaines après l’accouchement |
|
Insertion après le premier trimestre d’avortement |
MIRENA peut être inséré immédiatement après un avortement du premier trimestre. Dans ce cas, aucune contraception supplémentaire n’est nécessaire. |
|
Renouveler MIRENA |
MIRENA peut être remplacé par un nouveau dispositif à n’importe quel moment du cycle. Dans ce cas, aucune contraception supplémentaire n’est nécessaire. |
|
Relai après une autre méthode contraceptive (par exemple après contraceptifs hormonaux combinés, implant) |
-MIRENA peut être inséré immédiatement s'il est raisonnablement certain que la femme n'est pas enceinte. -Une contraception supplémentaire est nécessaire : si cela fait plus de 7 jours que les saignements menstruels ont commencé, la femme doit alors s'abstenir de rapports sexuels vaginaux ou utiliser une protection contraceptive supplémentaire pendant les 7 jours suivants. |
Informations importantes à prendre en compte pendant ou après l’insertion
· En cas d’insertion difficile et/ou de douleurs ou de saignements particuliers pendant ou après l’insertion, il faut envisager la possibilité d’une perforation et prendre les mesures appropriées telles qu’un examen clinique et une échographie.
· Après l'insertion, les femmes doivent être réexaminées après 4 à 6 semaines pour vérifier les fils et pour s'assurer que le dispositif est bien positionné. Un examen clinique seul (avec vérification des fils de retrait) peut ne pas être suffisant pour exclure une perforation partielle et une échographie peut être envisagée (voir rubrique 4.4).
· L'étui de MIRENA contient une carte à remettre à la patiente. Le professionnel de santé qui a inséré MIRENA pourra y inscrire son nom et son numéro de téléphone, le nom de la patiente, la date d'insertion de MIRENA ainsi que la date limite de retrait.
Retrait/Renouvellement
Dans l’indication contraception intra-utérine :
· Le retrait ou le renouvellement du dispositif se fera après 8 ans d’utilisation au maximum.
Poursuite de la contraception après le retrait
· Si la patiente souhaite utiliser la même méthode, un nouveau dispositif peut être inséré immédiatement après le retrait.
· Si la patiente ne souhaite pas continuer à utiliser la même méthode mais qu’une grossesse n’est pas souhaitée, le dispositif doit être retiré pendant les 7 premiers jours du cycle menstruel, si la patiente présente un cycle menstruel régulier. Si le dispositif est retiré à un autre moment du cycle ou que la patiente n’a pas de règles régulières, et si elle a eu des rapports sexuels dans la semaine précédente, l’efficacité contraceptive n’est pas assurée. Pour assurer une contraception continue, une contraception barrière doit être utilisée (telle que les préservatifs) et débutée au moins 7 jours avant le retrait. Après le retrait, la nouvelle contraception doit être commencée immédiatement (suivre les instructions d’utilisation de la nouvelle méthode contraceptive).
· Si la femme a un désir de grossesse, la conception d’un enfant est possible dès le retrait de MIRENA, celui-ci n’altérant pas la fertilité.
Dans l’indication ménorragies fonctionnelles :
· Le dispositif doit être retiré ou renouvelé en cas de retour des symptômes de ménorragies fonctionnelles. En cas de non-résurgence des symptômes après 5 ans d'utilisation, le maintien du dispositif peut être envisagé. Il peut être retiré ou renouvelé au plus tard au bout de 8 ans.
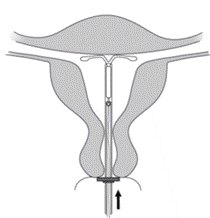
Le retrait de MIRENA est effectué en tirant délicatement sur les fils à l’aide d’une pince. L’utilisation d’une force excessive ou d’instruments pointus lors du retrait peut entrainer la casse du dispositif. Après le retrait de MIRENA, le dispositif doit être inspecté pour s’assurer qu’il est intact et qu’il a été complètement retiré. Lors de retraits difficiles, des cas isolés ont été rapportés où le cylindre contenant l'hormone avait glissé sur les bras latéraux les cachant ainsi de la vue du professionnel de santé. Cette situation ne nécessite pas d'autre intervention dès que l'intégrité du DIU retiré a été vérifiée. Les extrémités arrondies des bras latéraux empêchent généralement le cylindre de se détacher complètement des bras. Si les fils ne sont pas visibles mais que la présence du système dans la cavité utérine est confirmée par l’échographie ou par une autre méthode, celui-ci peut être retiré à l’aide d’une pince spécifique ; une dilatation du canal cervical ou une autre intervention chirurgicale peut alors parfois être nécessaire.
Ce médicament est contre-indiqué dans les situations suivantes :
· Grossesse suspectée ou avérée ;
· Maladie inflammatoire pelvienne, en cours ou récurrente ;
· Infection génitale basse (cervicite, vaginite ) ;
· Endométrite du post-partum ;
· Dysplasie cervicale ;
· Antécédent d’avortement septique au cours des 3 derniers mois ;
· Etat médical associé à une sensibilité accrue aux infections ;
· Hémorragie génitale anormale sans diagnostic ;
· Anomalies congénitales ou acquises de l’utérus y compris les fibromes s’ils déforment la cavité utérine ;
· Affection maligne du col ou du corps utérin ;
· Tumeurs sensibles aux progestatifs, par exemple, cancer du sein ;
· Affections hépatiques aiguës ou tumeur hépatique ;
· Hypersensibilité à la substance active ou à l’un des excipients mentionnés à la rubrique 6.1.
4.4. Mises en garde spéciales et précautions d'emploi
MIRENA est conditionné stérilement et le sachet stérile ne doit pas avoir été ouvert ou endommagé avant l’insertion. Il est recommandé que l’insertion de MIRENA soit réalisée exclusivement par un professionnel de santé familiarisé avec la technique d’insertion de MIRENA et/ou ayant été suffisamment formé à la technique d’insertion de MIRENA. L’insertion doit être réalisée dans des conditions d’asepsie. Se reporter à la notice de pose présente dans l’emballage et respecter strictement les recommandations d’insertion.
L’indication de MIRENA devra être discutée, éventuellement après consultation spécialisée, dans les circonstances suivantes : migraine, hypertension artérielle, antécédent de pathologie artérielle sévère (accident vasculaire cérébral, infarctus du myocarde).
Le retrait du DIU (dispositif intra-utérin) devra être envisagé :
· en cas de survenue ou aggravation de migraine, migraine ophtalmique avec perte de vision asymétrique, ou autre symptôme évoquant une ischémie cérébrale transitoire.
· en cas de survenue ou de récidive :
o de céphalée exceptionnellement sévère,
o d’ictère,
o d’augmentation importante de la pression artérielle,
o de suspicion ou de diagnostic d’une tumeur sensible aux progestatifs, y compris cancer du sein,
o de pathologie artérielle sévère telle qu’un accident vasculaire cérébral ou un infarctus du myocarde,
o d’une infection génitale haute,
o d’évènement thromboembolique veineux aigu.
Les données épidémiologiques disponibles ne montrent pas d’augmentation du risque de thrombose veineuse associée à l’utilisation de MIRENA par rapport aux femmes n’utilisant pas de contraception hormonale.
MIRENA n’est pas recommandé chez les femmes présentant une cardiopathie congénitale ou une valvulopathie cardiaque et de ce fait exposées à un risque d’endocardite infectieuse.
Des saignements irréguliers peuvent masquer certains symptômes et signes de polypes ou de cancer endométrial ; se reporter à la section Examen médical / consultation, en rubrique 4.4.
Le lévonorgestrel à faible dose peut affecter la tolérance au glucose et la glycémie doit être surveillée chez les utilisatrices de MIRENA atteintes de diabète.
MIRENA n’est pas une méthode contraceptive de première intention des jeunes femmes nullipares.
Dans l’indication ménorragies :
· Un bilan initial sera pratiqué afin de diagnostiquer une éventuelle anémie ferriprive associée. Un apport en fer peut s’avérer nécessaire afin de compenser cette anémie.
· Avant la mise en place de MIRENA, un examen gynécologique et une exploration diagnostique des ménorragies doivent être envisagés afin d’éliminer toute cause organique non décelée auparavant qui pourrait être masquée par les saignements irréguliers survenant durant les premiers mois.
· La patiente sera informée des alternatives médicales et chirurgicales du traitement des ménorragies : autres traitements médicaux, résection endométriale ou hystérectomie.
Examen médical/consultation :
Avant l’insertion, la patiente doit être informée de l’efficacité, des risques (y compris les signes et symptômes de ces risques tels que décrits dans la notice) et des effets indésirables de MIRENA. Un examen gynécologique complet comportant au minimum un examen pelvien et un examen des seins doit être réalisé. Un frottis cervical peut être réalisé, si besoin, selon l’évaluation du professionnel de santé. Toute éventualité de grossesse doit être éliminée (notamment par un test de grossesse), ainsi que toute éventualité d’IST (infection sexuellement transmissible). Les infections génitales devront être correctement traitées.
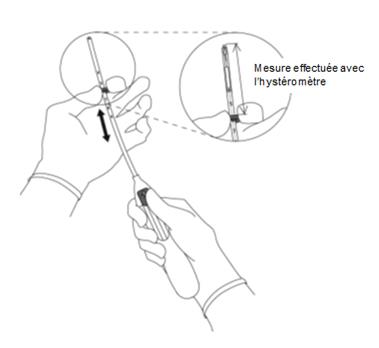
La position de l’utérus et la taille de la cavité utérine devront être déterminées. Le positionnement fundique de MIRENA est particulièrement important afin d’assurer une exposition uniforme de l’endomètre au progestatif, d’éviter l’expulsion du DIU et d’assurer son efficacité maximale. De ce fait les instructions d’insertion devront être suivies soigneusement.
L’insertion et le retrait peuvent provoquer des douleurs et des saignements ; l’insertion peut également entraîner une syncope (réaction vasovagale) ou une crise convulsive chez les patientes épileptiques.
La patiente doit être à nouveau examinée 4 à 6 semaines après l’insertion. Une échographie vaginale peut être envisagée afin de vérifier que le système est bien placé correctement. Si MIRENA ne peut être localisé dans la cavité utérine, la possibilité d’une expulsion ou d’une perforation complète (voir rubrique « Perforation » ci-dessous) doit être envisagée, et une radiographie peut être réalisée. Par la suite, un réexamen est recommandé tous les ans, ou plus fréquemment si cela est cliniquement indiqué. MIRENA ne doit pas être utilisé en tant que contraception post‑coïtale.
Si des saignements irréguliers surviennent lors d’un traitement prolongé, des mesures diagnostiques appropriées doivent être prises.
MIRENA ayant un effet sur le volume des règles, une augmentation du flux menstruel peut être le signe d’une expulsion.
Perforation
Le contraceptif intra-utérin peut pénétrer ou perforer l’utérus, le plus souvent lors de l’insertion, bien que cela ne puisse être détecté que quelque temps plus tard et puisse réduire l’efficacité de MIRENA. Si l’insertion a été difficile ou particulièrement douloureuse, ou que des douleurs persistent après 30 minutes de repos ou apparaissent à distance de l’insertion, il faudra s’assurer du bon positionnement de MIRENA dans la cavité utérine, notamment par échographie, un examen clinique seul (avec vérification des fils de retrait) pouvant ne pas être suffisant pour exclure une perforation partielle. Dans certains cas, le système peut être situé hors de la cavité utérine. Dans de telles situations, MIRENA doit être retiré et une intervention chirurgicale peut s’avérer nécessaire.
Dans une importante étude de cohorte prospective, non interventionnelle et comparative chez des utilisatrices de DIU (N = 61 448 femmes) avec une période d’observation de 1 an, l’incidence de perforation a été de 1,3 (IC à 95 % : 1,1 - 1,6) pour 1000 insertions dans la cohorte globale de l’étude. Cette incidence a été de 1,4 (IC à 95 % : 1,1 - 1,8) pour 1000 insertions dans la cohorte MIRENA et de 1,1 (IC à 95 % : 0,7 - 1,6) pour 1000 insertions dans la cohorte DIU au cuivre.
L’étude a montré que l’allaitement au moment de l’insertion et une insertion dans les 36 semaines après l’accouchement étaient tous deux associés à un risque accru de perforation (voir tableau 2). Ces deux facteurs de risque étaient indépendants du type de DIU utilisé.
Tableau 2 : Incidence de perforation pour 1000 insertions pour la cohorte globale de l’étude observée sur 1 an, stratifiée en fonction de l’allaitement et du temps écoulé depuis l’accouchement au moment de l’insertion (femmes pares)
|
|
Allaitement au moment de l’insertion |
Pas d’allaitement au moment de l’insertion |
|
Insertion ≤ 36 semaines après l’accouchement |
5,6 (IC à 95 % : 3,9-7,9 ; N = 6047 insertions) |
1,7 (IC à 95 % : 0,8-3,1 ; N = 5927 insertions) |
|
Insertion > 36 semaines après l’accouchement |
1,6 (IC à 95 % : 0,0-9,1 ; N = 608 insertions) |
0,7 (IC à 95 % : 0,5-1,1 ; N = 41 910 insertions) |
En prolongeant la période d’observation à 5 ans dans un sous-groupe de cette étude (N = 39 009 femmes utilisatrices de MIRENA ou d’un DIU au cuivre, des informations étaient disponibles pour 73% de ces femmes sur les 5 années complètes de suivi), l’incidence des perforations détectées à tout moment pendant toute la période de 5 ans était de 2,0 (IC à 95% : 1,6 – 2,5) pour 1000 insertions. L’allaitement au moment de l’insertion et l’insertion dans les 36 semaines après l’accouchement ont été confirmés comme facteurs de risque également dans le sous-groupe suivi pendant 5 ans.
Le risque de perforation peut être augmenté chez la femme présentant un utérus rétroversé fixé.
L’examen de contrôle après l’insertion doit suivre les recommandations fournies ci-dessus au paragraphe « Examen médical/consultation » y compris la possibilité de réaliser une échographie vaginale pour vérifier la position correcte du système 4 à 6 semaines après l’insertion. Ces recommandations peuvent être adaptées selon la situation clinique, notamment chez les femmes présentant des facteurs de risque de perforation.
Une perforation utérine peut être diagnostiquée lors de la mise en évidence d’une grossesse ou lors d’un accouchement.
Disparition des fils :
Si les fils de retrait ne sont pas visibles au niveau du col pendant lors d’un examen de contrôle, une grossesse doit être exclue. Les fils peuvent être remontés dans l’utérus ou le canal cervical et réapparaître lors des règles suivantes. Une fois la présence d’une grossesse exclue, les fils peuvent généralement être localisés en explorant délicatement à l’aide d’un instrument approprié. S’ils restent introuvables, il faut envisager l’éventualité d’une expulsion ou d’une perforation.
On peut recourir à l’échographie vaginale pour préciser la position exacte du système. En cas d’échec de l’échographie ou en cas d’impossibilité d’y recourir, MIRENA peut être localisé grâce aux rayons X. Dans le cas où MIRENA devrait être retiré il peut être ôté à l’aide d’une pince fine. Une dilatation du canal cervical ou une intervention chirurgicale peut alors parfois être nécessaire.
Oligo/aménorrhée :
Une oligoménorrhée ou une aménorrhée ont été rapportées chez respectivement 57% et 16% des utilisatrices après un an d’utilisation. À la fin de la huitième année d'utilisation de MIRENA, une oligoménorrhée ou une aménorrhée ont été rapportées chez respectivement 26 % et 34 % des utilisatrices de MIRENA.
Si les règles ne surviennent pas dans les 6 semaines suivant les règles précédentes, l’éventualité d’une grossesse doit être envisagée et écartée. Devant la persistance d’une aménorrhée, la répétition du test de grossesse n’est justifiée que si d’autres signes de grossesse sont présents.
Infections pelviennes :
Le tube inserteur permet d’éviter la contamination bactérienne de MIRENA lors de l’insertion et l’inserteur a été conçu afin de minimiser le risque d’infections. Chez les utilisatrices de DIU au cuivre, la fréquence des infections pelviennes est maximale le premier mois suivant l’insertion et diminue ensuite.
L’un des facteurs de risques connu d’infection pelvienne est la multiplicité des partenaires sexuels. L’infection pelvienne peut avoir des conséquences graves qui peuvent retentir sur la fertilité et augmenter le risque de grossesses ectopiques.
Une infection sévère ou une septicémie (y compris une septicémie à streptocoques du groupe A) peut survenir après l'insertion du DIU, comme cela peut également être le cas avec d'autres interventions gynécologiques ou chirurgicales. Ce type d’évènement est extrêmement rare.
MIRENA doit être retiré si la femme présente une endométrite ou une maladie inflammatoire pelvienne évolutive ou récidivante, ou en cas d’infection aiguë sévère ne répondant pas au traitement en quelques jours.
Des examens bactériologiques sont indiqués et une surveillance est recommandée, même en cas de symptômes mineurs évocateurs d’une infection.
Expulsions :
Dans les essais cliniques menés avec MIRENA dans l’indication contraception, l’incidence des expulsions a été faible (< 4 % des insertions) et du même ordre que celle décrite pour les autres systèmes ou dispositifs intra-utérins.
L’expulsion partielle ou complète de MIRENA peut se manifester par des saignements ou des douleurs. Elle peut aussi toutefois passer totalement inaperçue et conduire à une perte de l’effet contraceptif. Dans la mesure où MIRENA diminue le flux menstruel, l'augmentation du flux menstruel peut être le signe d’une expulsion.
Le risque d'expulsion est augmenté chez :
· Les femmes ayant des antécédents de saignements menstruels abondants (y compris les femmes qui utilisent MIRENA pour le traitement des saignements menstruels abondants),
· Les femmes ayant un IMC supérieur à la normale au moment de l'insertion ; ce risque augmente progressivement avec l'augmentation de l'IMC.
Les femmes doivent être conseillées sur les signes possibles d'expulsion et sur la manière de vérifier les fils de MIRENA et de contacter un professionnel de santé si elles ne sentent plus les fils. Une méthode contraceptive barrière (tel qu’un préservatif) doit être utilisée jusqu'à ce que le positionnement de MIRENA ait été confirmé. En cas d’expulsion partielle, l’efficacité de MIRENA peut être diminuée.
En cas d’expulsion partielle, MIRENA doit être retiré. Un nouveau système peut être inséré au moment du retrait, à condition que toute grossesse ait été exclue.
Grossesses extra-utérines :
Les patientes ayant des antécédents de grossesse extra-utérine, de chirurgie tubaire ou d’infection pelvienne, ont un risque plus élevé de GEU (grossesse extra-utérine).
Il faut envisager l’éventualité d’une GEU, en présence d’une douleur abdominale basse et plus particulièrement lorsqu’elle est associée à l’absence de règles, ou en cas de métrorragie chez une patiente aménorrhéique.
Le risque absolu de grossesse extra-utérine chez les utilisatrices de MIRENA est faible car la probabilité d’une grossesse est réduite par rapport aux femmes n’utilisant aucune contraception.
Dans une importante étude de cohorte prospective, non interventionnelle et comparative, avec une période d’observation d’un an, le taux de grossesse extra-utérine observé avec MIRENA a été de 0,02 %. Lors des essais cliniques, la fréquence absolue de grossesses extra-utérines chez les utilisatrices de MIRENA a été d’environ 0,1 % par an, comparé à 0,3 - 0,5 % par an chez les femmes n'utilisant pas de contraception.
Cependant si une femme développe une grossesse avec MIRENA in situ, le risque relatif de survenue d’une grossesse extra-utérine est augmenté.
Follicules de grande taille :
L’effet contraceptif du dispositif étant principalement dû à son effet local, des cycles ovulatoires avec rupture des follicules sont généralement observés chez les femmes en âge de procréer. L’atrésie du follicule est quelquefois retardée et la folliculogénèse peut se poursuivre.
Les follicules de grande taille ne peuvent être distingués cliniquement des kystes ovariens. Des cas de kystes ovariens ont été rapportés comme effet indésirable chez environ 7% des utilisatrices. La plupart des follicules sont asymptomatiques mais certains peuvent s’accompagner de douleurs pelviennes ou de dyspareunie. Dans la majorité des cas, les kystes ovariens disparaissent spontanément au bout de 2 ou 3 mois. Dans le cas contraire, une surveillance échographique continue ainsi que d’autres mesures thérapeutiques ou diagnostiques sont recommandées. Une intervention chirurgicale est rarement nécessaire.
Cancer du sein :
Une méta-analyse de 54 études épidémiologiques a montré une légère augmentation du risque (risque relatif = 1,24) de diagnostic d’un cancer du sein chez les femmes utilisant un contraceptif oral combiné (COC). L’augmentation de ce risque disparaît dans les 10 ans qui suivent l’arrêt de l’utilisation du COC. Comme le cancer du sein est rare chez les femmes de moins de 40 ans, le nombre supplémentaire de cas diagnostiqués de cancer du sein chez les femmes utilisant actuellement un COC est faible par rapport au risque global de cancer du sein.
Le risque d'avoir un cancer du sein diagnostiqué chez les femmes utilisant un contraceptif uniquement progestatif est potentiellement similaire à celui associé aux COCs.
Cependant, pour les contraceptifs uniquement progestatifs, les preuves sont basées sur des populations plus petites et sont donc moins concluantes qu’avec les COCs.
Troubles psychiatriques :
L’état dépressif et la dépression sont des effets indésirables bien connus liés à l’utilisation de contraceptifs hormonaux (voir rubrique 4.8). La dépression peut être grave et constitue un facteur de risque bien connu de comportement suicidaire et de suicide. Il convient de conseiller aux femmes de contacter leur professionnel de santé en cas de changements d’humeur et de symptômes dépressifs, y compris peu de temps après le début du traitement.
Précautions au moment du retrait :
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
Le métabolisme des progestatifs peut être augmenté par l'utilisation concomitante de médicaments inducteurs d'enzymes métaboliques, comme les enzymes du cytochrome P450. Il s’agit notamment des anticonvulsivants (par exemple le phénobarbital, la phénytoïne, la carbamazépine), et des anti-infectieux (par exemple la rifampicine, la rifabutine, la névirapine, l'éfavirenz). L'influence de ces médicaments sur l'efficacité contraceptive de MIRENA n'est pas connue, mais on peut penser qu’elle n’a pas d’impact majeur étant donné le mécanisme d’action local du système.
4.6. Fertilité, grossesse et allaitement
Grossesse
L’utilisation de MIRENA est contre-indiquée lorsqu’une grossesse est suspectée ou avérée (voir rubrique 4.3).
Risque lié au DIU :
En cas de grossesse sous MIRENA et comme pour tout DIU, une grossesse extra-utérine doit être exclue.
En cas de grossesse intra-utérine débutant sous MIRENA, le système doit être retiré dès que possible car le maintien en place de tout contraceptif intra-utérin peut augmenter le risque d’avortement et de travail prématuré.
Le retrait de MIRENA ou l’exploration de l’utérus peuvent également provoquer un avortement. Si la patiente souhaite poursuivre la grossesse et si le système ne peut pas être retiré, elle devra être informée du risque de naissance prématurée du bébé et de ses conséquences pour l’enfant.
Toute grossesse se déroulant dans un tel contexte doit faire l’objet d’une étroite surveillance. La patiente doit recevoir pour instruction de signaler tous les symptômes évocateurs de complications gestationnelles, tels que des crampes abdominales accompagnées de fièvre.
Risque lié au lévonorgestrel :
Un risque accru d’effets virilisants chez un fœtus féminin en raison de l’exposition intra-utérine au lévonorgestrel ne peut être exclu. Des cas isolés de virilisation des organes génitaux externes des fœtus féminins ont été rapportés à la suite d’une exposition locale au lévonorgestrel avec un système intra-utérin au lévonorgestrel maintenu en place pendant la grossesse.
La dose et les concentrations sanguines quotidiennes de lévonorgestrel sont plus faibles avec MIRENA qu'avec n'importe quel autre contraceptif hormonal, bien que la présence de lévonorgestrel ait été mise en évidence dans le lait maternel.
Une dose de lévonorgestrel d’environ 0,1 % passe dans le lait maternel.
Aucun effet délétère sur la croissance et le développement du nourrisson n’a été rapporté après l’insertion de MIRENA 6 semaines après l'accouchement.
Les méthodes uniquement progestatives ne semblent pas avoir d’impact sur la quantité ni sur la qualité du lait maternel. Par conséquent, MIRENA peut être utilisé en cas d’allaitement
Fertilité
L'utilisation de MIRENA n'altère pas le retour à la fertilité.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
MIRENA n’a pas d’effets connus sur l’aptitude à conduire des véhicules et à utiliser des machines.
La plupart des femmes connaissent des changements de leur cycle menstruel après l’insertion de MIRENA. Pendant les 90 premiers jours après l’insertion de MIRENA, des saignements prolongés et des saignements irréguliers apparaissent respectivement chez 22 % et 67 % des utilisatrices ; ces taux diminuent pour atteindre 3 % et 19 % respectivement, à la fin de la première année. En parallèle, une aménorrhée et une oligoménorrhée apparaissent respectivement dans 0 % et 11 % des cas au cours des 90 premiers jours, augmentant respectivement à 16 % et 57 % à la fin de la première année d’utilisation. À la fin de la huitième année d'utilisation de MIRENA, des saignements prolongés et des saignements irréguliers sont constatés respectivement chez 3 % et 10 % des utilisatrices de MIRENA ; une aménorrhée survient chez 34 % des utilisatrices et une oligoménorrhée chez 26 % des utilisatrices.
Les fréquences des effets indésirables rapportés pour MIRENA sont reprises dans le tableau ci-dessous. Les fréquences y sont définies comme suit: très fréquent (≥ 1/10), fréquent (≥ 1/100 à < 1/10), peu fréquent (≥ 1/1000 à < 1/100), rare (≥ 1/10000 à < 1/1000) et fréquence non déterminée.
Le tableau 3 ci-dessous décrit les effets indésirables par classe de système-organe selon la classification MedDRA.
Les fréquences correspondent aux incidences brutes observées au cours des essais cliniques incluant 5091 femmes et 12 101 années-femmes.
Le terme MedDRA le plus approprié est utilisé afin de décrire un certain type de réaction ainsi que ses synonymes et pathologies liées.
Tableau 3 : effets indésirables
|
Classification Système-Organe |
Très fréquent (³ 1/10) |
Fréquent (≥ 1/100 à < 1/10) |
Peu fréquent (≥ 1/1000 à < 1/100) |
Fréquence non déterminée |
|
Tumeurs bénignes, malignes et non précisées (incl. kystes et polypes) |
|
|
|
Cancer du sein – voir rubrique 4.4. |
|
Infections et infestations |
|
|
|
Septicémie (y compris septicémie à streptocoques du groupe A) – voir rubrique 4.4. |
|
Affections du système immunitaire |
|
|
|
Hypersensibilité y compris rash, urticaire et œdème de Quincke |
|
Affections psychiatriques |
|
Humeur dépressive/ Dépression Nervosité Baisse de la libido |
|
|
|
Affections du système nerveux |
Céphalées |
Migraine |
|
|
|
Affections vasculaires |
|
Sensations vertigineuses |
|
|
|
Affections gastro-intestinales |
Douleurs abdominales/ pelviennes Distension abdominale |
Nausées |
|
|
|
Affections de la peau et du tissu sous-cutané |
|
Acné / Séborrhée Hirsutisme
|
Alopécie Chloasma Hyperpigmentation de la peau Prurit Eczéma |
|
|
Affections musculo-squelettiques et systémiques |
|
Douleurs dorsales |
|
|
|
Affections des organes de reproduction et du sein
|
Modification des saignements y compris augmentation ou diminution des règles, spotting, oligoménorrhée et aménorrhées Vulvo-vaginite Leucorrhée |
Kystes ovariens Dysménorrhée Douleur mammaire Expulsion du DIU (complète ou partielle) |
Perforation utérine* Infection pelvienne Endométrite Cervicite Modification bénigne du frottis |
|
|
Troubles généraux et anomalies au site d’administration |
|
|
Œdème |
Fatigue ou asthénie |
|
Investigations |
|
Prise de poids |
|
Augmentation de la pression artérielle |
* Cette fréquence est basée sur une importante étude de cohorte prospective, non interventionnelle et comparative chez des utilisatrices de DIU, qui a montré que l’allaitement au moment de l’insertion et l’insertion dans les 36 semaines après l’accouchement sont des facteurs de risque de perforation indépendants (voir rubrique 4.4). Dans les essais cliniques avec MIRENA qui excluaient les femmes qui allaitent, la fréquence de perforation était « rare ». Certains cas de perforation peuvent résulter en une localisation intra-abdominale ou intra-péritonéale du dispositif (voir la rubrique 4.4).
Une étude distincte portant sur 362 femmes qui ont utilisé MIRENA au-delà de 5 ans a montré un profil cohérent d'effets indésirables de la 6ème à la 8ème année.
· Si une femme développe une grossesse avec MIRENA in situ, le risque relatif de survenue d’une grossesse extra-utérine est augmenté.
· Les fils de retrait peuvent être ressentis par le partenaire lors des rapports sexuels.
· Les effets indésirables suivants ont été rapportés en lien avec l’insertion ou le retrait de MIRENA : douleurs, saignements, réaction vasovagale avec vertiges ou syncope. La pose ou le retrait de MIRENA peut provoquer également une crise convulsive chez les patientes épileptiques.
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr
Sans objet.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Mécanisme d’action
Le lévonorgestrel est un progestatif utilisé sous diverses formes : en association dans les contraceptifs oraux combinés, seul dans les contraceptifs minidosés ainsi que dans les thérapies substitutives hormonales ou les implants. Le lévonorgestrel peut également être administré directement dans la cavité utérine, à partir d’un DIU. Ceci entraîne la libération d’une faible quantité journalière de lévonorgestrel directement au niveau de l’endomètre.
Le mécanisme d’action de MIRENA est différent de celui des DIU classiques au cuivre. Il repose principalement sur les modifications suivantes :
· épaississement de la glaire cervicale prévenant le passage cervical des spermatozoïdes,
· effet local du DIU sur l’endomètre et prévention de la prolifération de l’endomètre pouvant constituer un terrain hostile aux nombreux phénomènes qui interviennent dans le mécanisme de reproduction.
L’ovulation peut être inhibée chez certaines femmes.
Efficacité et sécurité clinique
L'efficacité contraceptive de MIRENA a été étudiée dans des études cliniques majeures réalisées chez 3330 femmes. L'efficacité contraceptive au-delà de 5 ans a été étudiée auprès de 362 femmes dans une étude clinique utilisant MIRENA, 221 femmes ont terminé la 8ème année de l’étude. De la 6ème à la 8ème année d’utilisation de MIRENA, l’indice de Pearl était de 0,28 (IC à 95% : 0,03 - 1,00). L’efficacité contraceptive de MIRENA est résumée dans le tableau 4.
Tableau 4 : taux d’échec cumulé (%) et indice de Pearl
|
Année |
Taux d’échec cumulé (%)* (IC à 95%) |
Indice de Pearl (IC à 95%) |
|
|
Efficacité contraceptive de la 1ère à la 5ème année (N = 3330, Données regroupées provenant d'essais sur les contraceptifs jusqu'à 5 ans) |
|||
|
À 1 an |
0,20 (0,09 – 0,46) |
0,21 (0,08 – 0,45) |
|
|
À 5 ans |
0,71 (0,37 -1,33) |
|
|
|
Efficacité contraceptive de la 6ème à la 8ème année (N=362, Etude d’extension MIRENA) |
|||
|
Lors de la 6ème année |
0,29 (0,04 – 2,05) |
0,34 (0,01 – 1,88) |
|
|
Lors de la 7ème année |
|
0,40 (0,01 – 2,25) |
|
|
Lors de la 8ème année |
|
0,00 (0,00 – 1,90) |
|
|
De la 6ème à la 8ème année |
0,68 (0,17 – 2,71) |
0,28 (0,03 – 1,00) |
|
* Méthode Kaplan Meier
Les taux d’échec prennent aussi en compte les grossesses par expulsions ou perforations non-décelées. Une efficacité contraceptive similaire a été observée lors d’une étude post‑marketing incluant plus de 17000 femmes sous MIRENA (âge moyen : 40 ans). MIRENA ne nécessitant pas une prise journalière, les taux de grossesse en « utilisation habituelle » sont semblables à ceux observés dans les essais cliniques contrôlés (« utilisation parfaite »).
L'utilisation de MIRENA n'altère pas le retour à la fertilité. Environ 80% des femmes qui désirent une grossesse sont enceintes dans les 12 mois qui suivent le retrait du DIU.
MIRENA peut entraîner une diminution du volume des règles.
Chez les femmes souffrant de ménorragies, les saignements menstruels diminuent de 62-94 % au bout de trois mois d’utilisation et de 71‑95% au bout de 6 mois d’utilisation. Chez ces patientes, suite à la réduction des saignements, on note une augmentation du taux d’hémoglobine sanguine.
La fréquence des dysménorrhées diminue également avec une fréquence identique à celle des contraceptifs oraux.
5.2. Propriétés pharmacocinétiques
Tableau 5 : taux de libération in vivo estimés pour MIRENA
|
Délai |
Taux de libération in vivo estimé [microgrammes/24 heures] |
|
24 jours après l’insertion |
21 |
|
60 jours après l’insertion |
21 |
|
1 an après l’insertion |
19 |
|
3 ans après l’insertion |
14 |
|
5 ans après l’insertion |
11 |
|
8 ans après l’insertion |
7 |
|
En moyenne sur la 1ère année |
20 |
|
En moyenne sur les 3 premières années |
18 |
|
En moyenne sur les 5 premières années |
15 |
|
En moyenne sur 8 ans |
13 |
Absorption
La résorption du lévonorgestrel à partir du dispositif MIRENA ne peut être estimée d’une manière fiable. Notamment, en raison du profil de libération à partir du dispositif et des faibles concentrations circulantes. Toutefois, en se référant à l’exposition systémique observée par la voie intraveineuse, la résorption du lévonorgestrel apparait virtuellement comme complète (supérieure à 90%). Le Iévonorgestrel est détectable dans le sérum/plasma une heure après I'insertion du dispositif. La concentration plasmatique maximale est atteinte environ deux semaines suivant l'insertion et s'élève à environ 180 ng/L (CV 38,3 %). En raison de la baisse progressive du taux de libération du Iévonorgestrel, la concentration géométrique moyenne dans le sérum/plasma diminue en continu, comme indiqué dans le tableau 6.
Tableau 6 : Concentrations totales de lévonorgestrel plasmatique
|
Délai après insertion |
Concentrations totales de lévonorgestrel plasmatique [ng/L] (Coefficient de variation géométrique CV%) |
|
24 jours |
175 (37,6) |
|
2 mois |
169 (37,1) |
|
1 an |
159 (37,4) |
|
3 ans |
139 (37,8) |
|
5 ans |
123 (38,2) |
|
8 ans |
100 (39,9) |
Distribution
Au niveau plasmatique, le lévonorgestrel est fortement lié aux protéines circulantes, principalement la Sex Hormone-Binding Globulin (SHBG), mais aussi à l’albumine. Moins de 2% du lévonorgestrel circulant est présent sous forme de stéroïde libre. Le lévonorgestrel se lie avec une forte affinité à la SHBG.
En conséquence, les modifications des concentrations sériques de SHBG entraînent une augmentation (à des concentrations plus élevées de SHBG) ou une diminution (à des concentrations inférieures de SHBG) de la concentration totale de lévonorgestrel dans le sérum. La concentration de SHBG a diminué en moyenne d’environ 20% pendant les deux premiers mois après l’insertion de MIRENA et elle est restée stable par la suite n’augmentant que légèrement jusqu’à la fin des 8 ans d’utilisation. Le volume de distribution est d’environ 106 L.
Élimination
La clairance plasmatique totale du lévonorgestrel est d'environ 1,0 ml/min/kg.
Le lévonorgestrel est excrété principalement sous forme de métabolites à part égale par voie rénale et fécale. Seules des traces de lévonorgestrel sont excrétées sous forme inchangée. La demi-vie d'élimination, représentée principalement par les métabolites, est d’environ 1 jour.
5.3. Données de sécurité préclinique
Les études précliniques de pharmacologie, de pharmacocinétique, de toxicité par administration unique ou répétée, génotoxicité, cancérogénicité et de toxicité sur les fonctions de reproduction conduites avec le lévonorgestrel n’ont pas révélé de risque particulier pour l’homme.
Aucun signe d'embryotoxicité n'a été observé chez le lapin suite à l'administration intra‑utérine de lévonorgestrel. L’évaluation de la sécurité des composants élastomères du réservoir d'hormones, du matériel en polyéthylène, et de la combinaison de substances élastomères et de lévonorgestrel n'a pas mis en évidence de bio-incompatibilités ou de potentiel génotoxique.
Composition du manchon :
Polydiméthylsiloxane (Elastomère), silice colloïdale anhydre.
Composition du corps en T :
Polyéthylène, sulfate de baryum.
Fils de retrait :
Polyéthylène, oxyde de fer.
Aucune incompatibilité n’est connue à ce jour avec MIRENA.
3 ans.
6.4. Précautions particulières de conservation
Pas de précautions particulières de conservation.
6.5. Nature et contenu de l'emballage extérieur
Dispositif intra-utérin en blister (PET/PE).
6.6. Précautions particulières d’élimination et de manipulation
Voir rubrique 4.2.
Pour les instructions particulières relatives à sa mise en place, se reporter à la notice à l’intérieur du conditionnement.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
1 RUE CLAUDE BERNARD
59000 LILLE
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· 34009 339 292 8 2 : 1 dispositif intra-utérin en blister (PET/PE).
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
[à compléter ultérieurement par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE
[à compléter ultérieurement par le titulaire]
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
CONDITIONS DE PRESCRIPTION ET DE DELIVRANCE
Liste I.
ANSM - Mis à jour le : 24/04/2025
MIRENA 52 mg (20 microgrammes/24 heures), dispositif intra-utérin
Lévonorgestrel
· Gardez cette notice. Vous pourriez avoir besoin de la relire.
· Si vous avez d’autres questions, interrogez votre médecin ou votre pharmacien.
· Ce médicament vous a été personnellement prescrit. Ne le donnez pas à d’autres personnes. Il pourrait leur être nocif, même si les signes de leur maladie sont identiques aux vôtres.
· Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin, ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
1. Qu'est-ce que MIRENA 52 mg (20 microgrammes/24 heures), dispositif intra-utérin et dans quels cas est-il utilisé ?
2. Quelles sont les informations à connaître avant d'utiliser MIRENA 52 mg (20 microgrammes/24 heures), dispositif intra-utérin ?
3. Comment utiliser MIRENA 52 mg (20 microgrammes/24 heures), dispositif intra-utérin ?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver MIRENA 52 mg (20 microgrammes/24 heures), dispositif intra-utérin ?
6. Contenu de l’emballage et autres informations.
1. QU’EST-CE QUE MIRENA 52 mg (20 microgrammes/24 heures), dispositif intra‑utérin ET DANS QUELS CAS EST-IL UTILISE ?
Qu’est-ce que MIRENA ?
MIRENA est un dispositif intra-utérin (plus communément appelé stérilet) qui est placé par un professionnel de santé à l’intérieur de votre utérus. Il contient une hormone : un progestatif (le lévonorgestrel), qui a un effet contraceptif.
Dans quels cas est-il utilisé ?
MIRENA est utilisé :
· soit pour éviter une grossesse (contraception),
· soit pour traiter des règles trop abondantes (ménorragies fonctionnelles).
Enfants et adolescents
MIRENA n’a pas d’indication avant l’apparition des premières règles (ménarche).
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT D’UTILISER MIRENA 52 mg (20 microgrammes/24 heures), dispositif intra-utérin ?
MIRENA ne doit pas être utilisé comme une méthode de contraception d’urgence (contraceptif post-coïtal).
N’utilisez jamais MIRENA 52 mg (20 microgrammes/24 heures), dispositif intra-utérin :
· si vous êtes allergique à la substance active (le lévonorgestrel) ou à l’un des autres composants contenus dans ce médicament, mentionnés dans la rubrique 6 ;
· si vous êtes enceinte ou si vous pensez l’être ;
· si vous présentez une infection au niveau des organes génitaux bas (cervicite, vaginite ) ;
· si vous présentez actuellement ou avez eu à plusieurs reprises une maladie inflammatoire des organes génitaux hauts (utérus, trompes par exemple) ou de l’abdomen ;
· si, après un accouchement, vous avez eu une infection de l’utérus (endométrite) ;
· si vous avez une modification anormale des cellules du col de l’utérus (dysplasie cervicale) ;
· si vous avez eu un avortement avec une infection au cours des 3 derniers mois ;
· si votre état de santé favorise la survenue d’infections ;
· si vous avez des saignements anormaux au niveau des organes génitaux dont on ne connait pas la cause ;
· si vous avez une anomalie de l’utérus (anomalies congénitales ou acquises de l’utérus y compris les fibromes qui déforment votre utérus) ;
· si vous avez une affection maligne (cancer) de l’utérus ou du col de l’utérus ;
· si vous avez un cancer dont le développement est influencé par les progestatifs (par exemple un cancer du sein) ;
· si vous avez une maladie aigüe du foie ou un cancer du foie.
Avertissements et précautions
L’éventualité d’une grossesse doit être exclue avant l’insertion de MIRENA (notamment par la réalisation d’un test de grossesse).
Adressez-vous à votre médecin ou pharmacien avant d’utiliser MIRENA 52 mg (20 microgrammes/24 heures), dispositif intra-utérin.
Vous devez informer le professionnel de santé qui vous prescrit MIRENA :
· si vous n’avez jamais été enceinte car MIRENA ne peut généralement pas être utilisé chez les femmes n’ayant jamais eu d’enfant.
· si vous avez une maladie du cœur depuis votre naissance ou si vous avez une maladie des valves du cœur, car vous risquez d’avoir une infection au niveau du cœur (endocardite). MIRENA n’est pas recommandé si vous êtes dans ces situations.
· si vous êtes diabétique ; il est alors recommandé de suivre votre glycémie.
· si vous présentez un des symptômes suivants avant ou pendant l’utilisation de MIRENA :
o des migraines importantes ou inhabituelles, ou une apparition brutale de troubles de la vue (perte asymétrique de la vue),
o des maux de tête exceptionnellement intenses,
o une coloration jaune de la peau liée à une maladie du foie (jaunisse),
o une augmentation importante de la tension artérielle,
o si vous avez (ou si votre médecin le soupçonne) un cancer du sein, de l’utérus ou tout autre cancer dont le développement est influencé par les progestatifs,
o un caillot de sang dans une artère du cœur (infarctus du myocarde) ou du cerveau (accident vasculaire cérébral),
o un caillot de sang dans un vaisseau sanguin de la jambe (phlébite) ou du poumon (embolie pulmonaire),
o une infection génitale haute.
Si vous avez l’un des symptômes ci-dessus avant le traitement, l’insertion du dispositif ne pourra être envisagée qu’avec précaution et après l’avis d’un médecin spécialisé.
Si l’un de ces symptômes apparaît ou s’aggrave pendant le traitement, votre médecin envisagera de vous retirer MIRENA.
Si vous utilisez MIRENA pour traiter des règles trop abondantes (ménorragies fonctionnelles) :
Avant de mettre en place MIRENA, le professionnel de santé qui vous posera MIRENA :
· vous informera des autres traitements médicaux et/ou chirurgicaux possibles,
· vous demandera d’effectuer des examens complémentaires pour s’assurer que vous pouvez utiliser MIRENA et valider le diagnostic de ménorragies fonctionnelles,
· vérifiera que vos règles trop importantes n’ont pas provoqué une baisse du nombre de globules rouges dans votre sang (anémie) ; si besoin, un traitement sera mis en place.
La mise en place de MIRENA se fera avec précaution.
Examen médical et consultation :
· L’insertion de MIRENA doit être réalisée par un professionnel de santé familiarisé avec la technique d’insertion de MIRENA. Avant l’insertion de MIRENA, le professionnel de santé vous informera de l’efficacité, des risques et des possibles effets indésirables. Il réalisera alors un examen gynécologique complet. Cet examen comprend :
o une évaluation de la taille et de la position de votre utérus,
o un examen des seins,
o la recherche d’une éventuelle infection au niveau de vos organes génitaux.
Au cours de cet examen, le professionnel de santé vérifiera également que vous n’êtes pas enceinte (test de grossesse) et que vous n’avez pas d’infection sexuellement transmissible (IST). Il pourra réaliser un prélèvement (frottis) s’il le juge nécessaire.
· Le professionnel de santé vous prescrira ensuite un examen de contrôle 4 à 6 semaines après l’insertion, puis une fois par an, ou plus fréquemment si nécessaire. Il déterminera la fréquence et le type d’examen nécessaires à votre cas particulier. Apportez la carte patiente que vous avez reçue de votre professionnel de santé lors de chaque consultation.
Insertion ou retrait de MIRENA :
L’insertion ou le retrait de MIRENA peut provoquer des douleurs ou des saignements. Un malaise, parfois associé à une perte de connaissance (syncope) ou des convulsions (chez les épileptiques) peuvent également survenir lors de l’insertion. Après la mise en place de MIRENA, votre professionnel de santé vous donnera une carte patiente pour vos examens de suivi. Apportez celle-ci avec vous lors de chaque consultation.
Pendant le traitement :
Troubles du cycle
· Après plusieurs mois d’utilisation de MIRENA, vos règles peuvent diminuer, voire disparaître. En général, l’absence de vos règles ne signifie pas que vous êtes enceinte.
· Cependant, si vos règles deviennent complètement absentes, vous devez consulter un professionnel de santé afin d’exclure une éventuelle grossesse (examen gynécologique et test de grossesse). Si l’absence de vos règles persiste, il n’est pas nécessaire de refaire un test de grossesse, sauf si vous avez d’autres signes habituels d’une grossesse.
· Si vous avez des saignements irréguliers, le professionnel de santé vous prescrira des examens complémentaires car ces saignements pourraient masquer certaines maladies de l’utérus.
Infections
Vous devez consulter immédiatement un médecin si vous êtes dans l’une des situations suivantes :
· si vous avez des douleurs persistantes dans le bas-ventre,
· si vous avez de la fièvre,
· si vous avez des rapports sexuels douloureux,
· si vous avez des saignements anormaux.
En effet, une infection au niveau de vos organes génitaux peut être à l’origine de ces signes et peut nécessiter le retrait de MIRENA. Une infection sévère ou une septicémie (infection généralisée) peut survenir de façon extrêmement rare.
Expulsion ou déplacement de MIRENA
Votre utérus peut se contracter pendant vos règles et provoquer quelquefois, le déplacement ou l’expulsion de MIRENA. Cela est plus susceptible de se produire si vous êtes en surpoids au moment de la pose du dispositif ou si vous avez des antécédents de règles abondantes. Si le dispositif est déplacé, il peut ne pas fonctionner comme prévu et, par conséquent, le risque de grossesse est augmenté. Si le système MIRENA est expulsé, vous n’êtes plus protégée contre une grossesse.
L’expulsion peut se manifester par des douleurs et des saignements anormaux, toutefois, l’expulsion de MIRENA peut aussi passer totalement inaperçue. Dans la mesure où MIRENA diminue le flux menstruel, l’augmentation du flux menstruel peut être le signe d’une expulsion.
Il est recommandé que vous vérifiiez les fils avec votre doigt, par exemple lorsque vous prenez une douche. Voir également la section 3 "Comment utiliser MIRENA ? " Si vous présentez des signes indiquant une expulsion ou si vous ne sentez pas les fils, vous devez utiliser un autre contraceptif (comme des préservatifs) et consulter votre professionnel de santé. Ne tirez pas sur les fils car vous risqueriez de retirer accidentellement MIRENA.
Il est recommandé d’utiliser des serviettes hygiéniques. Si vous utilisez des tampons ou des coupes menstruelles, vous devez faire attention, lors de leur retrait, à ne pas tirer sur les fils de MIRENA. Si vous pensez avoir retiré MIRENA, évitez les rapports sexuels ou utilisez une méthode contraceptive barrière (telle que des préservatifs) et contactez votre professionnel de santé.
Perforation de l’utérus
Une perforation ou une pénétration de la paroi de l’utérus peut se produire, le plus souvent lors de la pose, mais peut n’être décelée que plus tard, ce qui peut parfois aboutir à une localisation du dispositif en dehors de votre utérus (par exemple dans votre abdomen). En cas de perforation, MIRENA n’est plus efficace pour empêcher une grossesse. Le dispositif doit être retiré et une intervention chirurgicale peut être nécessaire.
Le risque de perforation est augmenté chez les femmes qui allaitent et chez les femmes qui ont accouché dans les 36 semaines précédant l’insertion de MIRENA. Ce risque peut également être augmenté chez les femmes dont l’utérus est positionné vers l’arrière et fixé (utérus dit rétroversé fixé).
Les symptômes et signes possibles d’une perforation incluent :
· des douleurs intenses (semblables aux douleurs de règles) ou plus importantes que prévu,
· des saignements importants (après l’insertion),
· des douleurs ou des saignements qui persistent plus que quelques semaines,
· un changement soudain de vos règles,
· des douleurs lors des relations sexuelles,
· vous ne sentez plus les fils de retrait de MIRENA si vous vérifiez par vous-même la présence de ces fils dans le vagin (tel que décrit dans le paragraphe « Expulsion et déplacement de MIRENA »)
Si l’insertion a été difficile et/ou douloureuse, si vous ressentez l’un des signes/symptômes décrits ci‑dessus et que vous suspectez une perforation, vous devez consulter rapidement un médecin ou le professionnel de santé qui vous a inséré MIRENA. Rappelez‑leur que vous utilisez MIRENA, notamment si le professionnel de santé que vous consultez n’est pas la personne qui vous a inséré ce dispositif.
Grossesse extra-utérine
Les grossesses sous MIRENA sont très rares. Cependant si vous découvrez que vous êtes enceinte alors que vous utilisez MIRENA, le risque d’avoir une grossesse à l’extérieur de votre utérus (grossesse extra-utérine) est augmenté. Le taux de grossesses extra-utérines chez les utilisatrices de MIRENA est d’environ 0,1 pour 100 années-femmes.
Pour plus d’informations, veuillez-vous reporter à la rubrique « Grossesse » de cette notice.
Follicules ovariens (cellules situées dans l’ovaire et responsables de la formation de l’ovule)
L’effet contraceptif de MIRENA est principalement dû à son effet local au niveau de l’utérus et la plupart des femmes conservent des cycles avec ovulation. Cependant dans certains cas, des follicules de grande taille peuvent se développer dans l’ovaire et s’accompagner de douleurs dans le bas du ventre ou lors des rapports sexuels. En général, ces follicules disparaissent spontanément au bout de 2 ou 3 mois, mais ils peuvent dans certains cas nécessiter une surveillance médicale, voire une échographie (examen médical permettant de visualiser un organe).
Une intervention chirurgicale est rarement nécessaire.
En cas de doute n’hésitez pas à demander l’avis du professionnel de santé qui vous suit ou de votre pharmacien. Rappelez aux professionnels de santé que vous utilisez MIRENA, particulièrement si ce ne sont pas eux qui vous ont inséré ce dispositif.
Cancer du sein
Des cas de cancers du sein ont été rapportés chez les utilisatrices de contraception hormonale, y compris MIRENA.
Troubles psychiatriques
Certaines femmes qui utilisent des contraceptifs hormonaux dont MIRENA ont fait état d’une dépression ou d’un état dépressif. La dépression peut être grave et peut parfois donner lieu à des idées suicidaires. Si vous présentez des changements d’humeur et des symptômes dépressifs, sollicitez les conseils de votre médecin dès que possible.
Enfants et adolescents
MIRENA n’a pas d’indication avant l’apparition des premières règles (ménarche).
Patientes âgées (de plus de 65 ans) :
MIRENA n’a pas été étudié chez les femmes de plus de 65 ans.
Patientes souffrant d’insuffisance hépatique :
Vous ne devez pas utiliser MIRENA si vous êtes atteinte d’insuffisance hépatique (maladie du foie) (voir rubrique 2 « N’utilisez jamais MIRENA »).
Patientes souffrant d’insuffisance rénale :
MIRENA n’a pas été étudié chez les femmes souffrant d’insuffisance rénale (maladie du rein).
Autres médicaments et MIRENA 52 mg (20 microgrammes/24 heures), dispositif intra‑utérin
Informez votre médecin ou votre pharmacien si vous prenez, avez récemment pris ou pourriez prendre tout autre médicament.
L'influence de ces médicaments sur l'efficacité contraceptive de MIRENA n'est pas connue, mais en raison du mode d'action local de MIRENA, on peut penser qu’elle n’a pas d’importance majeure.
MIRENA 52 mg (20 microgrammes/24 heures), dispositif intra‑utérin avec des aliments et boissons
Sans objet.
Grossesse, allaitement et fertilité
Grossesse :
Vous ne devez pas utiliser MIRENA si vous êtes enceinte ou si vous pensez l’être.
Les grossesses sous MIRENA sont très rares. Le taux d’échec peut être augmenté si MIRENA est expulsé ou si la paroi de l’utérus est perforée.
Cependant, si vous découvrez que vous êtes enceinte alors que vous utilisez MIRENA, le professionnel de santé qui vous suit doit s’assurer qu’il ne s’agit pas d’une grossesse à l’extérieur de votre utérus. En effet, ce risque est augmenté, en particulier pour les femmes qui ont déjà eu ce type de grossesse, une chirurgie des trompes (organe qui relie l’utérus aux ovaires) ou une infection au niveau des organes génitaux.
C’est pourquoi, vous devez consulter immédiatement un médecin si vous présentez brutalement l’un des signes suivants :
· des saignements alors que vous n’aviez plus vos règles,
· des douleurs importantes du bas du ventre associées à une absence de règles,
· des signes habituels de grossesse associés à des saignements et des malaises.
Risques liés au dispositif intra-utérin au lévonorgestrel :
Si vous tombez enceinte alors que le système MIRENA est en place, vous devez consulter immédiatement votre professionnel de santé afin que MIRENA soit retiré. Le retrait peut provoquer une fausse couche. Cependant, si MIRENA est laissé en place pendant la grossesse, non seulement le risque de faire une fausse couche est plus élevé, mais également le risque de travail prématuré. Si MIRENA ne peut pas être retiré, discutez avec votre professionnel de santé des bénéfices et des risques liés à la poursuite de la grossesse. Si la grossesse se poursuit, vous serez étroitement surveillée pendant votre grossesse et vous devez contacter immédiatement votre professionnel de santé si vous ressentez des crampes d'estomac, des douleurs à l'estomac ou de la fièvre.
En cas de maintien du dispositif pendant la grossesse, le risque de complications obstétricales peut être augmenté : infection, fausse couche, rupture prématurée de la poche des eaux, accouchement prématuré.
MIRENA contient une hormone, appelée lévonorgestrel, et il y a eu des cas isolés d'effets sur les organes génitaux féminins de nourrissons en cas d'exposition à des dispositifs intra-utérins au lévonorgestrel dans l'utérus.
Allaitement :
Une dose de lévonorgestrel d’environ 0,1 % passe dans le lait maternel. Aucun effet délétère sur la croissance et le développement du nourrisson n’a été rapporté après l’insertion de MIRENA 6 semaines après l'accouchement. Par conséquent, MIRENA peut être utilisé en cas d’allaitement.
Fertilité :
La conception d’un enfant est possible dès le retrait de MIRENA.
Demandez conseil à votre médecin ou à votre pharmacien avant de prendre tout médicament.
Conduite de véhicules et utilisation de machines
MIRENA n’a pas d’effet connu sur la capacité de conduire des véhicules ou d’utiliser des machines.
3. COMMENT UTILISER MIRENA 52 mg (20 microgrammes/24 heures), dispositif intra‑utérin ?
Après insertion, MIRENA reste efficace pendant une durée maximale de 8 ans lorsqu'il est utilisé pour éviter une grossesse (contraception). Si vous utilisez MIRENA pour cette raison, il doit être retiré ou renouvelé au plus tard au bout de 8 ans.
MIRENA reste efficace 5 ans lorsqu’il est utilisé pour traiter des règles trop abondantes (ménorragies fonctionnelles). Si vous utilisez MIRENA pour cette raison, il doit être retiré ou renouvelé en cas de retour de règles trop abondantes ou après 8 ans au plus tard.
MIRENA libère directement dans l’utérus le progestatif (le lévonorgestrel) avec une dose définie dans le temps : à titre d’information, environ 20 microgrammes par 24 heures en début de traitement.
Cette dose diminue progressivement à environ 11 microgrammes par 24 heures au bout de 5 ans et à 7 microgrammes par 24 heures au bout de 8 ans.
Mode d’administration
Il est recommandé que l’insertion de MIRENA soit réalisée exclusivement par un professionnel de santé familiarisé avec la technique d’insertion de MIRENA et/ou ayant été suffisamment formé à la technique d’insertion de MIRENA.
Il placera MIRENA à l’intérieur de votre utérus (voie intra-utérine).
Mise en place de MIRENA
Commencer à utiliser MIRENA
Avant d’insérer MIRENA, il faut s’assurer que vous n’êtes pas enceinte.
MIRENA doit être inséré dans les 7 jours qui suivent le début de vos règles. Lorsque MIRENA est inséré à cette période, MIRENA fonctionne immédiatement et vous protégera d’une grossesse.
Si MIRENA ne peut pas être inséré dans les 7 jours après le début de vos règles ou si votre cycle est irrégulier, alors MIRENA peut être inséré à n'importe quel autre moment. Dans ce cas, vous ne devez pas avoir eu de rapport sexuel non protégé depuis vos dernières règles et vous devez avoir un test de grossesse négatif avant l’insertion. De plus, MIRENA ne peut pas empêcher une grossesse immédiatement et de manière fiable. Donc, vous devez utiliser une méthode de contraception barrière (telle que des préservatifs) ou éviter les rapports sexuels vaginaux pendant 7 jours après l’insertion de MIRENA.
MIRENA ne doit pas être utilisé comme méthode de contraception d’urgence (contraceptif post-coïtal).
Utilisation après un accouchement
Voir également « Commencer avec MIRENA » ci-dessus pour en savoir davantage sur le moment de l’insertion.
Utilisation après un avortement
MIRENA peut être inséré immédiatement après un avortement qui s’est déroulé au cours des 3 premiers mois de grossesse si vous n’avez pas d’infection au niveau de vos organes génitaux. MIRENA fonctionnera alors immédiatement.
Retrait de MIRENA
MIRENA peut être retiré à tout moment par le professionnel de santé qui vous suit et doit être retiré au plus tard à la fin de la 8ème année lorsqu’il est utilisé pour éviter une grossesse (contraception) et à la fin de la 5ème année lorsqu’il est utilisé pour traiter des règles trop abondantes (ménorragies fonctionnelles). Si vous utilisez MIRENA pour cette raison, il doit être retiré ou renouvelé en cas de retour de règles trop abondantes ou après 8 ans au plus tard.
Poursuite de la contraception après le retrait
Si vous ne souhaitez pas une grossesse, s’il persiste un cycle menstruel, MIRENA doit être retiré durant les sept premiers jours des règles. Si MIRENA est retiré en dehors de cette période, vous devez utiliser une autre méthode de contraception barrière (par exemple préservatifs) pendant au moins sept jours avant le retrait du dispositif. De même, si vous avez des règles irrégulières ou si vos règles (menstruations) ont disparu, vous devez utiliser une méthode de contraception barrière (par exemple préservatifs) pendant sept jours avant le retrait du dispositif. Si vous ne souhaitez pas continuer à utiliser la même méthode, demandez conseil à votre professionnel de santé sur d'autres méthodes contraceptives fiables.
Renouvellement de MIRENA
MIRENA peut être remplacé par un nouveau dispositif à n’importe quelle période du cycle. MIRENA fonctionnera alors immédiatement. Dans ce cas, vous n’avez pas besoin de contraception supplémentaire.
Si vous désirez changer de méthode contraceptive, vous devrez utiliser une contraception mécanique (un préservatif par exemple) au moins 7 jours avant la date prévue du retrait et la poursuivre pendant la durée indiquée par le professionnel de santé qui vous suit.
Relai après une autre méthode contraceptive (comme les contraceptifs hormonaux combinés, implant)
· MIRENA peut être inséré immédiatement s'il est raisonnablement certain que vous n'êtes pas enceinte.
· Si plus de 7 jours se sont écoulés depuis le début de vos saignements menstruels, vous devez éviter les rapports sexuels vaginaux ou utiliser une protection contraceptive supplémentaire pendant les 7 jours suivants.
Si vous désirez une grossesse
MIRENA peut être retiré à tout moment par le professionnel de santé qui vous suit. La conception d’un enfant est possible dès le retrait de MIRENA.
Si vous avez utilisé plus de MIRENA 52 mg (20 microgrammes/24 heures), dispositif intra‑utérin que vous n’auriez dû
Sans objet.
Si vous oubliez d’utiliser MIRENA 52 mg (20 microgrammes/24 heures), dispositif intra‑utérin
Si vous arrêtez d’utiliser MIRENA 52 mg (20 microgrammes/24 heures), dispositif intra‑utérin
Sans objet.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
Les effets indésirables très fréquemment observés (chez plus de 10 femmes sur 100) sont les suivants :
· des maux de tête (céphalées) ;
· des douleurs au niveau du ventre et du bas-ventre, un gonflement abdominal ;
· des troubles des règles notamment des saignements entre les règles, des règles plus abondantes ou moins abondantes, prolongées ou raccourcies, ou des périodes prolongées sans saignements ;
· un écoulement vaginal ;
· une inflammation de la vulve ou du vagin.
Les effets indésirables fréquemment observés (chez 1 à 10 femmes sur 100) sont les suivants :
· une humeur dépressive, une dépression, de la nervosité, une baisse de la libido ;
· des migraines ;
· des sensations vertigineuses ;
· des nausées ;
· de l’acné / la peau grasse ;
· un hirsutisme (augmentation excessive des poils) ;
· des douleurs dorsales ;
· des règles douloureuses ;
· des kystes au niveau des ovaires ;
· des douleurs au niveau des seins ;
· une expulsion de MIRENA (complète ou partielle) ;
· une prise de poids.
Les effets indésirables peu fréquemment observés (chez 1 à 10 femmes sur 1000) sont les suivants :
· une perforation de l’utérus. Dans certains cas, le DIU peut se retrouver localisé en dehors de votre utérus ;
· une perte des cheveux (alopécie) ;
· une infection des voies génitales supérieures (par exemple : de l’utérus, des ovaires ou des trompes), une inflammation de l’utérus (endométrite), une inflammation du col de l’utérus (cervicite), une modification bénigne du frottis cervical ;
· un prurit, de l’eczéma ;
· un chloasma (taches brun doré en particulier sur le visage, appelé « masque de grossesse ») ;
· une hyperpigmentation de la peau ;
· un œdème.
Les effets indésirables suivants ont également été rapportés mais sans que l’on puisse en déterminer la fréquence :
· une réaction d’hypersensibilité (réaction allergique). Vous reconnaitrez les signes d’une allergie par des boutons, des rougeurs (rash cutané), des démangeaisons (urticaire), un brusque gonflement du visage et une difficulté à respirer (œdème de Quincke) ;
· une augmentation de la pression artérielle ;
· une septicémie (infection généralisée) après insertion du dispositif ;
· un cancer du sein ;
· une fatigue ou faiblesse.
Si vous tombez enceinte alors que vous utilisez MIRENA, il est possible qu’une grossesse à l’extérieur de votre utérus survienne (voir rubrique 2. Quelles sont les informations à connaître avant d’utiliser MIRENA 52 mg (20 microgrammes/24 heures), dispositif intra-utérin ? – « Grossesse extra-utérine »).
Les fils de retrait peuvent être ressentis par le partenaire lors des rapports sexuels.
Les effets indésirables suivants peuvent survenir au moment de l’insertion ou du retrait de MIRENA : douleurs, saignements, malaise vagal (vertige ou évanouissement). Chez les patientes atteintes d’épilepsie (maladie neurologique caractérisée par la survenue de contractions involontaires des muscles ou convulsions), une crise convulsive peut se produire.
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet: https://signalement.social-sante.gouv.fr.
En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.
5. COMMENT CONSERVER MIRENA 52 mg (20 microgrammes/24 heures), dispositif intra‑utérin ?
Tenir ce médicament hors de la vue et de la portée des enfants.
N’utilisez pas ce médicament après la date de péremption indiquée sur l’emballage.
Ne jetez aucun médicament au tout-à-l’égout ou avec les ordures ménagères. Demandez à votre pharmacien d’éliminer les médicaments que vous n’utilisez plus. Ces mesures contribueront à protéger l’environnement.
6. CONTENU DE L’EMBALLAGE ET AUTRES INFORMATIONS
Ce que contient MIRENA 52 mg (20 microgrammes / 24 heures), dispositif intra‑utérin
· La substance active est :
Lévonorgestrel............................................................................................................ 52,00 mg
Pour un dispositif
· Les autres composants sont :
Composition du manchon : Polydiméthylsiloxane (Elastomère), silice colloïdale anhydre.
Composition du corps en T : Polyéthylène, sulfate de baryum.
Fils de retrait : Polyéthylène, oxyde de fer.
MIRENA est un dispositif intra-utérin en forme de T. La tige verticale du corps blanc en T comporte un réservoir qui contient le lévonorgestrel. Deux fils de retrait de couleur marron sont fixés sur la boucle située à l’extrémité inférieure de la tige verticale.
MIRENA est conditionné dans un blister.
Titulaire de l’autorisation de mise sur le marché
1 RUE CLAUDE BERNARD
59000 LILLE
Exploitant de l’autorisation de mise sur le marché
BAYER HEALTHCARE SAS
1 RUE CLAUDE BERNARD
59000 LILLE
PANSIONTIE 47
20210 TURKU
FINLANDE
Noms du médicament dans les Etats membres de l'Espace Economique Européen
Sans objet.
La dernière date à laquelle cette notice a été révisée est :
[à compléter ultérieurement par le titulaire]
Des informations détaillées et mises à jour sur ce médicament sont disponibles en scannant le QR Code apposé sur la notice, l’étui carton et la carte patiente à l’aide d’un smartphone. Ces informations sont également disponibles via le lien suivant : www.pi.bayer.com/mirena/fr et sur le site Internet de l’ANSM (France) : www.ansm.sante.fr.
{QR code renvoyant vers la Notice patiente}
Les informations suivantes sont destinées exclusivement aux professionnels de santé:
MIRENA 52 mg (20 microgrammes/24 heures), dispositif intra-utérin
MIRENA doit être posé par un professionnel de santé familiarisé avec la technique d’insertion de MIRENA en respectant les conditions d'asepsie.
MIRENA et le tube inserteur sont présentés dans un emballage stérile qui ne doit pas être ouvert avant la pose. MIRENA est à usage unique et ne doit pas être restérilisé. Ne pas utiliser le dispositif lorsque l'emballage interne est endommagé ou ouvert. Ne pas insérer après la date d'expiration figurant sur la boîte.
MIRENA doit être mis en place dans les 7 jours qui suivent le début des règles afin de limiter le risque de pose en début de grossesse et de faciliter son insertion. Le remplacement de MIRENA peut se faire à n’importe quel moment du cycle.
Pour plus d’informations sur le choix du moment de la mise en place et la conduite à tenir, veuillez consulter le RCP de MIRENA.
MIRENA est fourni avec une carte patiente à l’intérieur de l’étui carton. Remplissez la carte patiente et remettez-la à la patiente après l’insertion.
Préparation pour la pose
· Examiner la patiente afin d’éliminer toute contre-indication à la pose de MIRENA et d’exclure une grossesse (voir rubriques 4.3 et 4.4 du RCP sous le paragraphe « Examen médical/ consultation »)
· Placez le spéculum, visualisez le col, puis désinfectez minutieusement le vagin et le col à l'aide d'une solution antiseptique adaptée.
· Saisissez la lèvre antérieure du col utérin avec une pince de Pozzi pour aligner le canal cervical et la cavité utérine. Dans le cas d'un utérus rétroversé, il peut être plus adapté de saisir la lèvre postérieure du col utérin. Une légère traction sur la pince permet d'aligner le canal cervical. La pince doit être maintenue en place et une légère traction sur le col doit être exercée pendant toute la durée de la pose.
· Insérez délicatement un hystéromètre à travers le canal cervical et jusqu'au fond de la cavité utérine pour déterminer la profondeur et la direction de la cavité utérine et écarter l'éventualité d'anomalies intra-utérines (ex. : septum, fibromes sous-muqueux) ou la présence d'un dispositif intra-utérin préalablement posé qui n'aurait pas été retiré. Utilisez de préférence un hystéromètre souple. En cas de difficulté, il faut envisager la dilatation du canal cervical. Lorsqu'une dilatation cervicale est requise, le recours aux analgésiques peut être conseillé.
|
Description de MIRENA
A. Bras latéraux B. Cylindre contenant l’hormone C. Fils |
|
|
|
|
|
|
|
2. Poussez le curseur vers le haut de la poignée dans le sens de la flèche jusqu'au bout pour faire entrer MIRENA dans le tube inserteur (Figure 2). |
|
|
|
|
|
IMPORTANT ! Ne pas ramener le curseur vers le bas car cette action pourrait libérer MIRENA prématurément. Une fois libéré, MIRENA ne peut pas être replacé dans le tube inserteur. |
|
|
3. Tout en maintenant le curseur en position haute, positionnez le bord supérieur de la bague au niveau de la valeur correspondant à la profondeur de la cavité utérine préalablement mesurée avec l’hystéromètre (Figure 3). |
|
|
|
|
|
4. Tout en maintenant le curseur en position haute, introduisez le tube inserteur dans le canal cervical jusqu’à ce que la bague soit à une distance d'environ 1,5 à 2,0 cm de l'orifice externe du col utérin (Figure 4) |
|
|
|
|
|
IMPORTANT ! Ne pas forcer lors de l’introduction du tube inserteur. Si nécessaire, dilatez le canal cervical. |
|
|
5. Tout en tenant fermement l’inserteur, ramenez le curseur jusqu'à la marque pour déployer les bras latéraux de MIRENA dans la cavité utérine (Figure 5). Attendre 5 à 10 secondes pour que les bras latéraux de MIRENA se déploient entièrement. |
|
|
|
|
|
6. Poussez délicatement l’inserteur vers le fond de l'utérus jusqu'à ce que la bague soit au contact du col de l’utérus. MIRENA est maintenant plaqué sur le fond utérin (Figure 6). |
|
|
|
|
|
7. Tout en maintenant le tube inserteur en place, ramenez complètement le curseur vers le bas pour libérer MIRENA (Figure 7). MIRENA est alors libéré. Retirez le tube inserteur tout en gardant le curseur dans la position basse. Couper les fils à environ 2 ou 3 cm du col utérin pour les laisser visibles. |
|
|
|
|
|
IMPORTANT ! En cas de doute sur le bon positionnement de MIRENA, vérifier sa position (par exemple par une échographie). En cas de mauvaise position dans la cavité utérine, MIRENA doit être retiré. Ne jamais réinsérer un système qui a été retiré. |
|
|
Retrait/remplacement MIRENA doit être remplacé au bout d’une durée maximale de 8 ans dans l’indication contraception intra-utérine. Dans l’indication ménorragies fonctionnelles, le dispositif doit être retiré ou renouvelé en cas de retour des symptômes de ménorragies fonctionnelles. En cas de non-résurgence des symptômes après 5 ans d'utilisation, le maintien du dispositif peut être envisagé. Il peut être retiré ou renouvelé au plus tard au bout de 8 ans. Pour retirer MIRENA, tirez délicatement sur les fils avec une pince (Figure 8). |
|
|
|
|
|
Vous pouvez insérer un nouveau MIRENA immédiatement après le retrait du MIRENA précédent. Après le retrait de MIRENA, le dispositif doit être inspecté pour s’assurer qu’il est intact et qu’il a été complètement retiré. Si la patiente souhaite continuer à utiliser cette méthode, un nouveau DIU peut être inséré lors de la même consultation. Si la femme souhaite changer de méthode contraceptive, il faudra utiliser une contraception mécanique pendant au moins 7 jours avant la date prévue du retrait du dispositif et la poursuivre jusqu’à ce que la nouvelle contraception soit efficace. Si la femme a un désir de grossesse, la conception d’un enfant est possible dès le retrait de MIRENA, celui-ci n’altérant pas la fertilité. Après le retrait de MIRENA, le dispositif doit être inspecté pour s’assurer qu’il est intact et qu’il a été retiré entièrement. Lors de retraits difficiles, des cas isolés ont été rapportés où le cylindre contenant l'hormone avait glissé sur les bras latéraux les cachant ainsi à la vue du médecin. Cette situation ne nécessite pas d'autre intervention dès que l'intégrité du dispositif retiré a été vérifiée. Les extrémités arrondies des bras latéraux empêchent généralement le cylindre de se détacher complètement des bras. |
{QR code renvoyant vers le Résumé des Caractéristiques du Produit}
Résumé des Caractéristiques du Produit de MIRENA en ligne sur www.pi.bayer.com/mirena/fr
FABRICANT :
BAYER OY
PANSIONTIE 47
20210 TURKU
FINLANDE
DATE DE MISE A JOUR DU TEXTE :
Mentions devant figurer sur les autres composants du conditionnement
Carte patiente
Apportez cette carte avec vous lors de toute consultation prévue.
MIRENA 52 mg (20 microgrammes/24 heures), dispositif intra-utérin.
Lévonorgestrel
{QR code renvoyant vers la notice patiente}
www.pi.bayer.com/mirena/fr
{Nom et adresse du titulaire de l’autorisation de mise sur le marché}
MIRENA est utilisé :
· soit pour éviter une grossesse (contraception),
· soit pour traiter des règles trop abondantes (ménorragies fonctionnelles)
Nom de la patiente : {Nom de la patiente}
Nom et numéro de téléphone du professionnel de santé : {Nom et numéro de téléphone du professionnel de santé}
Date d’insertion : {Date d’insertion}
Date limite de retrait : {Date limite de retrait}
LOT {numéro}
Informations importantes
Les informations importantes disponibles pour ce médicament sont les suivantes :
- Les stérilets contenant le plus d'hormone présenteraient davantage de risque de troubles dépressifs
- Progestatifs et méningiome : pas d'augmentation du risque avec les DIU au lévonorgestrel mais confirmation du risque pour 3 nouvelles substances
- Progestatifs et risque de méningiomes intracrâniens : le BMJ publie une étude épidémiologique française