Dernière mise à jour le 01/12/2025
FLUTICASONE FUROATE TEVA 27,5 microgrammes/pulvérisation, suspension pour pulvérisation nasale
Indications thérapeutiques
Classe pharmacothérapeutique : Préparations nasales, corticoïdes, code ATC : R01AD12.
FLUTICASONE FUROATE TEVA diminue l’inflammation due à l’allergie (rhinite) et par conséquent, réduit les symptômes de l'allergie.
FLUTICASONE FUROATE TEVA, suspension pour pulvérisation nasale est utilisé pour traiter les symptômes de la rhinite allergique : nez bouché, irrité ou qui coule, éternuements, yeux rouges ou irrités, larmoiements des yeux, chez l’adulte et l’enfant à partir de 6 ans.
Les symptômes de l’allergie peuvent survenir soit à des moments précis de l’année en rapport avec une allergie aux pollens des graminées ou des arbres (rhume des foins), soit toute l’année en rapport à une allergie aux animaux, acariens ou moisissures, pour ne citer que quelques-unes des allergies les plus fréquentes.
Présentations
> 1 flacon en verre brun de 10,4 g (correspondant à 120 pulvérisations) de suspension avec pompe doseuse et pulvérisateur nasal
Code CIP : 34009 302 933 2 4
Déclaration de commercialisation : 13/01/2025
Cette présentation est agréée aux collectivités
- Prix hors honoraire de dispensation : 3,78 €
- Honoraire de dispensation : 1,02 €
- Prix honoraire compris : 4,80 €
- Taux de remboursement :30 %
Service médical rendu (SMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprès de la HAS (plus d'informations dans l'aide). Les avis et synthèses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur du SMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| Modéré | Avis du 26/06/2024 | Inscription (CT) | Le service médical rendu FLUTICASONE FUROATE TEVA est modéré dans l’indication de l’AMM. |
Amélioration du service médical rendu (ASMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprés de la HAS (plus d'informations dans l'aide). Les avis et synthéses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur de l'ASMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| V (Inexistant) | Avis du 26/06/2024 | Inscription (CT) | Cette spécialité est un hybride qui n’apporte pas d’amélioration du service médical rendu (ASMR V) par rapport à la spécialité de référence AVAMYS. |
ANSM - Mis à jour le : 10/06/2025
FLUTICASONE FUROATE TEVA 27,5 microgrammes/pulvérisation, suspension pour pulvérisation nasale
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Chaque pulvérisation délivre 27,5 microgrammes de furoate de fluticasone.
Excipient à effet notoire : chaque pulvérisation délivre 8,25 microgrammes de chlorure de benzalkonium.
Pour la liste complète des excipients, voir rubrique 6.1.
Suspension pour pulvérisation nasale.
Suspension blanche.
4.1. Indications thérapeutiques
FLUTICASONE FUROATE TEVA est indiqué dans le traitement des symptômes de la rhinite allergique.
4.2. Posologie et mode d'administration
Adultes et adolescents (à partir de 12 ans)
La posologie initiale recommandée est de deux pulvérisations (27,5 microgrammes de furoate de fluticasone par pulvérisation) dans chaque narine, une fois par jour (dose journalière totale = 110 microgrammes).
Dès qu’un contrôle adéquat des symptômes est obtenu, une réduction de la posologie à une pulvérisation dans chaque narine (dose journalière totale = 55 microgrammes) peut être efficace en traitement d’entretien.
La dose doit être ajustée à la dose minimale efficace permettant de maintenir le contrôle des symptômes.
Enfants (âgés de 6 à 11 ans)
La posologie initiale recommandée est d’une pulvérisation (27,5 microgrammes de furoate de fluticasone par pulvérisation) dans chaque narine, une fois par jour (dose journalière totale = 55 microgrammes).
Les enfants ne répondant pas complètement au traitement par une pulvérisation dans chaque narine, une fois par jour (dose journalière totale = 55 microgrammes) peuvent recevoir deux pulvérisations dans chaque narine, une fois par jour (dose journalière totale = 110 microgrammes).
Dès qu’un contrôle adéquat des symptômes est obtenu, il est recommandé de réduire la posologie à une pulvérisation dans chaque narine, une fois par jour (dose journalière totale = 55 microgrammes).
Pour obtenir l’effet thérapeutique optimal, une utilisation régulière est recommandée. Un effet apparaît dès 8 heures après la première administration. Cependant, plusieurs jours de traitement peuvent être nécessaires pour obtenir l’efficacité maximale, et le patient doit être informé que ses symptômes s’amélioreront grâce à une prise régulière et continue du traitement (voir rubrique 5.1). La durée du traitement doit être limitée à la période d’exposition allergénique.
Enfants âgés de moins de 6 ans
La sécurité et l’efficacité de FLUTICASONE FUROATE TEVA chez les enfants âgés de moins de 6 ans n’ont pas été établies. Les données disponibles à ce jour sont décrites aux rubriques 5.1 et 5.2, mais aucune recommandation sur la posologie ne peut être faite.
Patients âgés
Aucun ajustement posologique n’est nécessaire dans cette population (voir rubrique 5.2).
Insuffisance rénale
Aucun ajustement posologique n’est nécessaire dans cette population (voir rubrique 5.2).
Insuffisance hépatique
Aucun ajustement posologique n’est nécessaire chez les patients ayant une insuffisance hépatique (voir rubrique 5.2).
Mode d’administration
FLUTICASONE FUROATE TEVA, suspension pour pulvérisation nasale est destiné à une administration par voie nasale uniquement.
Le pulvérisateur nasal doit être agité avant utilisation. Le capuchon protecteur doit ensuite être retiré. Avant la première utilisation, le pulvérisateur doit être amorcé en pressant sur la pompe et en la relâchant pendant au moins 6 pulvérisations (jusqu’à l’apparition d’une fine brume), en tenant le flacon bien droit.
Un réamorçage (environ 6 pulvérisations jusqu’à l’apparition d’une fine brume) est nécessaire si le capuchon a été retiré pendant 5 jours ou si le pulvérisateur n’a pas été utilisé pendant au moins 30 jours.
Après chaque utilisation, le pulvérisateur doit être nettoyé et le capuchon remis en place.
Hypersensibilité à la substance active ou à l’un des excipients mentionnés à la rubrique 6.1.
4.4. Mises en garde spéciales et précautions d'emploi
Effets systémiques liés aux corticoïdes
Des effets systémiques liés aux corticoïdes administrés par voie nasale peuvent apparaître, en particulier en cas de fortes doses prescrites sur des périodes prolongées. Le risque de survenue de ces effets est beaucoup moins important qu’avec les corticoïdes administrés par voie orale et ces effets peuvent varier en fonction des patients et des préparations de corticoïdes utilisées. Les effets systémiques potentiels peuvent inclure un syndrome de Cushing, un tableau cushingoïde, une inhibition de la fonction surrénalienne, un retard de croissance chez l’enfant et l’adolescent, une cataracte, un glaucome et, plus rarement, divers effets psychologiques ou comportementaux, incluant hyperactivité psychomotrice, troubles du sommeil, anxiété, dépression ou agressivité (en particulier chez l’enfant). Un traitement par corticoïdes administrés par voie nasale à des doses supérieures à celles recommandées peut entraîner une freination corticosurrénalienne avec retentissement clinique. Si des doses supérieures à celles recommandées doivent être utilisées, une corticothérapie de supplémentation par voie générale devra être envisagée pendant les périodes de stress ou en cas d’intervention chirurgicale.
Aucune freination de l’axe hypothalamo-hypophyso-surrénalien (HHS) n’a été observée chez les sujets adultes, adolescents ou pédiatriques recevant le furoate de fluticasone à la dose de 110 microgrammes en une prise par jour. Cependant, il convient de toujours réduire la dose de furoate de fluticasone administrée par voie nasale à la dose minimale permettant un maintien du contrôle efficace des symptômes de la rhinite. Comme avec tous les corticoïdes par voie nasale, l’exposition systémique totale qui peut résulter d’une corticothérapie associée par d’autres voies d’administration doit être prise en compte.
En cas de suspicion d’une altération des fonctions surrénaliennes, la prudence est recommandée lors d’un relais d’une corticothérapie systémique par le furoate de fluticasone.
Troubles visuels
Des troubles visuels peuvent être rapportés lors de l’utilisation d'une corticothérapie par voie systémique ou locale. Si un patient présente des symptômes tels qu’une vision trouble ou d’autres troubles visuels, il convient de l'adresser à un ophtalmologiste pour qu'il évalue les causes possibles, notamment la cataracte, le glaucome, ou des maladies rares telles que la choriorétinopathie séreuse centrale (CRSC), qui ont été rapportés après l’administration de corticostéroïdes par voie systémique ou locale.
Retard de croissance
Un retard de croissance a été rapporté chez des enfants ayant reçu des corticoïdes par voie nasale à la posologie préconisée. Un ralentissement de la croissance a été observé chez les enfants traités par furoate de fluticasone à la dose de 110 microgrammes par jour pendant un an (voir rubriques 4.8 et 5.1). Il convient par conséquent de maintenir la dose minimale efficace pour contrôler les symptômes chez les enfants (voir rubrique 4.2). La surveillance régulière de la croissance des enfants recevant une corticothérapie par voie nasale au long cours est donc recommandée. Si un ralentissement de la croissance est observé, le traitement devra être réévalué afin de réduire, si possible, la dose de corticoïdes par voie nasale à la dose minimale permettant un maintien du contrôle des symptômes. De plus, il conviendra d’envisager l’orientation du patient vers un spécialiste en pédiatrie (voir rubrique 5.1).
Patients sous traitement par ritonavir
L’administration concomitante de ritonavir n’est pas recommandée en raison du risque d’augmentation de l’exposition systémique au furoate de fluticasone (voir rubrique 4.5).
Excipients
Ce médicament contient du chlorure de benzalkonium. Une utilisation prolongée peut provoquer un œdème de la muqueuse nasale.
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
Interaction avec les inhibiteurs du CYP3A
Le furoate de fluticasone est rapidement éliminé par un effet de premier passage hépatique important, médié par le cytochrome P450 3A4.
Par analogie avec les résultats observés avec un autre corticoïde (propionate de fluticasone), également métabolisé par le CYP3A4, l’administration concomitante de ritonavir n’est pas recommandée en raison du risque d’augmentation de l’exposition systémique au furoate de fluticasone.
La prudence est recommandée lors de l’administration concomitante de furoate de fluticasone avec des inhibiteurs puissants du CYP3A (incluant les médicaments contenant du cobicistat) car une augmentation du risque de survenue d'effets indésirables systémiques est attendue. Leur co-administration doit être évitée à moins que le bénéfice attendu l'emporte sur le risque accru de survenue d'effets indésirables systémiques des corticoïdes ; si cela devait être le cas, les patients devront être surveillés afin de détecter d'éventuels effets indésirables systémiques liés aux corticoïdes. Une étude d’interaction médicamenteuse du furoate de fluticasone administré par voie nasale avec le kétoconazole (inhibiteur puissant du CYP3A4) a montré que le nombre de sujets présentant des concentrations mesurables de furoate de fluticasone était plus important dans le groupe traité par kétoconazole (6 sujets sur 20) que dans le groupe recevant le placebo (1 sujet sur 20). Cette légère augmentation de l’exposition systémique n’a pas entraîné de différence statistiquement significative sur la cortisolémie des 24 heures entre les deux groupes.
Les données relatives à l'induction et à l'inhibition enzymatiques suggèrent, en théorie, l’absence de risque d’interactions métaboliques entre le furoate de fluticasone et les autres composés métabolisés par le cytochrome P450, aux doses cliniquement préconisées par voie nasale. En conséquence, aucune étude clinique n'a été conduite pour étudier les interactions entre le furoate de fluticasone et d'autres médicaments.
4.6. Fertilité, grossesse et allaitement
Grossesse
Il n'existe pas de données fiables concernant l'utilisation du furoate de fluticasone chez la femme enceinte. Des études effectuées chez l'animal ont montré que les glucocorticoïdes induisaient des malformations avec fentes palatines et des retards de croissance intra-utérine. Il est peu probable que cela soit pertinent pour l’être humain compte tenu des doses nasales recommandées qui entraînent une exposition systémique minimale (voir rubrique 5.2). Le furoate de fluticasone ne doit être utilisé pendant la grossesse que si les bénéfices attendus pour la mère sont supérieurs aux risques potentiels encourus par le fœtus oule nouveau-né.
Le passage du furoate de fluticasone dans le lait maternel après administration par voie nasale n’est pas connu.
L’administration de furoate de fluticasone aux femmes qui allaitent ne doit être envisagée que si les bénéfices attendus pour la mère sont supérieurs aux risques potentiels encourus par le nourrisson.
Fertilité
Il n’existe aucune donnée concernant l'effet du furoate de fluticasone sur la fertilité dans l’espèce humaine.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
Résumé du profil de sécurité
Les effets indésirables les plus fréquemment rapportés au cours du traitement par furoate de fluticasone sont l’épistaxis, l’ulcération nasale et les céphalées. Les effets indésirables les plus graves rapportés sont de rares cas de réactions d’hypersensibilité, incluant l’anaphylaxie (moins de 1 cas pour 1 000 patients).
Tableau listant les effets indésirables
Plus de 2 700 patients ont été traités par furoate de fluticasone dans les études d’efficacité et de sécurité dans la rhinite allergique saisonnière et perannuelle. La population pédiatrique exposée au furoate de fluticasone dans les études d’efficacité et de sécurité dans la rhinite allergique saisonnière et perannuelle a inclus 243 patients âgés de 12 à < 18 ans, 790 patients âgés de 6 à < 12 ans et 241 patients âgés de 2 à < 6 ans.
Des données issues des études cliniques de grande envergure ont été utilisées pour déterminer la fréquence des effets indésirables.
La convention suivante a été utilisée afin d’établir une classification des fréquences : Très fréquent ≥ 1/10 ; Fréquent ≥ 1/100 à < 1/10 ; Peu fréquent ≥ 1/1 000 à < 1/100 ; Rare ≥ 1/10 000 à < 1/1 000 ; Très rare < 1/10 000 ; fréquence indéterminée (ne peut être estimée sur la base des données disponibles).
|
Affections du système immunitaire |
|
|
Rare : |
Réactions d’hypersensibilité incluant anaphylaxie, angioœdème, rash et urticaire |
|
Affections du système nerveux |
|
|
Fréquent : |
Céphalées |
|
Fréquence indéterminée : |
Dysgueusie, agueusie, anosmie |
|
Affections oculaires |
|
|
Fréquence indéterminée : |
Modifications oculaires transitoires (voir Expérience clinique), vision floue (voir également rubrique 4.4) |
|
Affections respiratoires, thoraciques et médiastinales |
|
|
Très fréquent : |
* Epistaxis |
|
Fréquent : |
Ulcération nasale, dyspnée** |
|
Peu fréquent : |
Rhinalgie, gêne nasale (incluant brûlure nasale, irritation nasale et douleur nasal), sécheresse nasale |
|
Très rare : |
Perforation de la cloison nasale |
|
Fréquence indéterminée : |
Bronchospasme, dysphonie, aphonie |
|
Affections musculosquelettiques et du tissu conjonctif (enfants) |
|
|
Fréquence indéterminée : |
*** Retard de croissance (voir Expérience clinique) |
Description d’effets indésirables sélectionnés
Epistaxis
* L’épistaxis était en général d’intensité faible à modérée. Chez les adultes et les adolescents, l’incidence de l’épistaxis était supérieure lors d’une utilisation au long cours (plus de 6 semaines) par rapport à une utilisation à court terme (jusqu’à 6 semaines).
Effets systémiques
L’administration de corticoïdes par voie nasale, notamment quand ils sont prescrits à fortes doses pendant des périodes prolongées, peut entraîner des effets systémiques (voir rubrique 4.4). Des cas de retard de croissance ont été rapportés chez les enfants sous corticothérapie par voie nasale.
** Des cas de dyspnée ont été rapportés chez plus de 1 % des patients dans les essais cliniques réalisés avec le furoate de fluticasone ; des taux similaires ont également été observés dans les groupes placebo.
Population pédiatrique
La sécurité chez les enfants de moins de 6 ans n’a pas été entièrement établie. La fréquence, le type et la sévérité des effets indésirables observés dans la population pédiatrique sont similaires à ceux observés dans la population adulte.
Epistaxis
* Dans les études cliniques pédiatriques d’une durée allant jusqu’à 12 semaines, l’incidence de l’épistaxis était similaire pour les patients traités par furoate de fluticasone et par placebo.
Retard de croissance
*** Au cours d'une étude clinique d'un an évaluant la croissance chez des enfants prépubères recevant 110 microgrammes de furoate de fluticasone une fois par jour, une différence moyenne de la vitesse de croissance de -0,27 cm par an a été observée dans le groupe de traitement par rapport au placebo (voir Efficacité et sécurité clinique).
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr/.
Au cours d’une étude de biodisponibilité, aucun effet indésirable systémique n’a été observé après l’administration, pendant trois jours, de doses intranasales allant jusqu’à 2 640 microgrammes par jour (voir rubrique 5.2).
Un surdosage aigu ne nécessite pas en général de mesure particulière autre que la surveillance du patient.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Classe pharmacothérapeutique : Préparations nasales, corticoïdes, code ATC : R01AD12.
Mécanisme d’action
Le furoate de fluticasone est un corticoïde synthétique trifluoré ayant une très grande affinité pour le récepteur aux glucocorticoïdes et exerçant une activité anti-inflammatoire puissante.
Efficacité et sécurité cliniques
Rhinite allergique saisonnière chez les adultes et adolescents
Comparé au placebo, le furoate de fluticasone en pulvérisation nasale à la dose de 110 microgrammes en une prise par jour a significativement amélioré les symptômes nasaux (incluant rhinorrhée, congestion nasale, éternuements et prurit nasal) et les symptômes oculaires (incluant prurit/brûlure, larmoiement/écoulement et rougeur des yeux) dans chacune des 4 études réalisées. L’efficacité a été maintenue pendant les 24 heures suivant l’administration du produit en une prise par jour.
Un effet thérapeutique est apparu dès 8 heures après la première administration, avec une amélioration supplémentaire au cours de l’administration les jours suivants.
Dans chacune des 4 études réalisées, la réponse globale au traitement perçue par les patients ainsi que leur évaluation sur une échelle de qualité de vie (RQLQ = « Rhinoconjunctivitis Quality of Life Questionnaire », questionnaire de qualité de vie relatif à la rhinoconjonctivite) étaient significativement améliorées avec le furoate de fluticasone en pulvérisation nasale.
Rhinite allergique perannuelle chez les adultes et adolescents
Dans trois études, les symptômes nasaux et la réponse globale au traitement perçue par les patients étaient significativement améliorés avec le furoate de fluticasone en pulvérisation nasale à la dose de 110 microgrammes en une prise par jour, par rapport au placebo.
Dans une étude, les symptômes oculaires ainsi que la qualité de vie (RQLQ) étaient significativement améliorés avec le furoate de fluticasone en pulvérisation nasale à la dose de 110 microgrammes en une prise par jour, par rapport au placebo.
L’efficacité a été maintenue pendant les 24 heures suivant l’administration du produit en une prise par jour.
Dans une étude de deux ans évaluant la tolérance oculaire du furoate de fluticasone (110 microgrammes une fois par jour en pulvérisation intranasale), des adultes et des adolescents présentant une rhinite allergique perannuelle ont reçu soit du furoate de fluticasone (n = 367) soit un placebo (n = 181). Les principaux résultats [délai d'apparition d'une opacification sous-capsulaire postérieure du cristallin (≥ 0,3 par rapport aux valeurs initiales selon le système de classification des opacités du cristallin (Lens Opacities Classification System), version III (grade LOCS III)) et délai d'apparition d'une augmentation de la pression intraoculaire (PIO : ≥ 7 mmHg par rapport aux valeurs initiales)] n'ont pas montré de différences statistiquement significatives entre les deux groupes. Des augmentations de l'opacité sous-capsulaire postérieure du cristallin (≥ 0,3 par rapport aux valeurs initiales) ont été plus fréquemment observées chez les sujets traités par 110 microgrammes de furoate de fluticasone [14 (4 %)] que chez les sujets recevant le placebo [4 (2 %)] ; ces augmentations ont été transitoires pour dix sujets du groupe furoate de fluticasone et pour deux sujets du groupe placebo. Des augmentations de la PIO (≥ 7 mmHg par rapport aux valeurs initiales) ont été plus fréquemment observées chez les sujets traités par 110 microgrammes de furoate de fluticasone une fois par jour : n = 7 (2 %) que dans le groupe placebo : n = 1 (< 1 %). Ces événements ont été transitoires pour six sujets du groupe furoate de fluticasone et un sujet du groupe placebo. Une opacité sous-capsulaire postérieure du cristallin dans la limite de ± 0,1 par rapport aux valeurs initiales a été observée pour chaque œil chez 95 % des sujets des deux groupes de traitement aux semaines 52 et 104, et une augmentation de l'opacité sous-capsulaire postérieure du cristallin ≥ 0,3 par rapport aux valeurs initiales a été observée chez ≤ 1 % des sujets des deux groupes de traitement à la semaine 104. Des valeurs de PIO dans la limite de ± 5 mmHg par rapport aux valeurs initiales ont été observées chez la majorité des sujets (> 95 %) aux semaines 52 et 104. Les augmentations de l'opacité sous-capsulaire postérieure du cristallin ou de la PIO n'ont été accompagnées d'aucun effet indésirable de type cataractes ou glaucomes.
Population pédiatrique
Rhinite allergique saisonnière et perannuelle chez les enfants
La posologie pédiatrique repose sur l’évaluation de données d’efficacité chez des enfants ayant une rhinite allergique.
Dans la rhinite allergique saisonnière, le furoate de fluticasone en pulvérisation nasale à la dose de 110 microgrammes en une prise par jour s’est montré efficace ; néanmoins, à la dose de 55 microgrammes en une prise par jour, aucune différence significative n’a été observée entre le furoate de fluticasone et le placebo sur l’ensemble des critères d’évaluation.
Dans la rhinite allergique perannuelle, le furoate de fluticasone en pulvérisation nasale à la dose de 55 microgrammes en une prise par jour s’est montré plus efficace que le furoate de fluticasone à la dose de 110 microgrammes en une prise par jour sur les 4 semaines de traitement. Une analyse post-hoc des données recueillies à 6 et 12 semaines dans cette étude, ainsi qu’une étude de tolérance de 6 semaines sur l’axe HHS, ont montré l’efficacité du furoate de fluticasone en pulvérisation nasale à la dose de 110 microgrammes en une prise par jour. Dans une étude sur 6 semaines ayant évalué l’effet du furoate de fluticasone en pulvérisation nasale à la dose de 110 microgrammes en une prise par jour sur la fonction surrénalienne chez des enfants âgés de 2 à 11 ans, aucun effet significatif sur la cortisolémie des 24 heures n’a été mis en évidence, par rapport au placebo.
Une étude multicentrique randomisée, en double aveugle, contrôlée versus placebo, en groupes parallèles a évalué les effets d'un traitement par furoate de fluticasone en pulvérisation nasale à la dose de 110 microgrammes une fois par jour pendant un an sur la vitesse de croissance avec stadiométrie, chez 474 enfants prépubères (âgés de 5 à 7,5 ans pour les filles et de 5 à 8,5 ans pour les garçons). Sur une période de traitement de 52 semaines, une vitesse de croissance moyenne plus faible a été observée chez les patients recevant le furoate de fluticasone (5,19 cm/an) par rapport à ceux recevant le placebo (5,46 cm/an). La différence moyenne observée dans le groupe de traitement était de -0,27 cm par an [IC à 95 % : -0,48 à -0,06].
Rhinite allergique saisonnière et perannuelle chez les enfants (de moins de 6 ans)
Des études de tolérance et d’efficacité ont été réalisées dans la rhinite allergique saisonnière et perannuelle chez un total de 271 patients âgés de 2 à 5 ans, parmi lesquels 176 ont été exposés au furoate de fluticasone. La tolérance et l’efficacité n’ont pas été clairement établies dans ce groupe.
5.2. Propriétés pharmacocinétiques
Le furoate de fluticasone est partiellement absorbé par voie digestive et subit un effet de premier passage hépatique et intestinal important qui conduit à une exposition systémique négligeable. Une dose journalière intranasale de 110 microgrammes n’entraîne pas habituellement des concentrations plasmatiques quantifiables (< 10 pg/mL). La biodisponibilité absolue du furoate de fluticasone administré par voie nasale est de 0,50 %, ce qui signifie que moins de 1 microgramme de furoate de fluticasone serait disponible au niveau systémique après l’administration de 110 microgrammes (voir rubrique 4.9).
Distribution
La liaison du furoate de fluticasone aux protéines plasmatiques est supérieure à 99 %. Le furoate de fluticasone est largement distribué avec un volume de distribution à l’état d’équilibre qui atteint, en moyenne, 608 L.
Biotransformation
Le furoate de fluticasone est rapidement éliminé (clairance plasmatique totale de 58,7 L/h) de la circulation systémique, principalement par métabolisation hépatique, par l’enzyme CYP3A4 du cytochrome P450, en un métabolite 17ß-carboxylé inactif (GW694301X). La principale voie métabolique est une hydrolyse de la fonction S-fluorométhyl-carbothioate en un métabolite acide 17ß-carboxylique. Les études in vivo n’ont pas montré de clivage du composé furoate pour former la fluticasone.
Elimination
Après administration par voie orale et intraveineuse, l’élimination est principalement fécale, indiquant une excrétion du furoate de fluticasone et de ses métabolites par la bile. Après administration intraveineuse, la demi-vie d’élimination est en moyenne de 15,1 heures. L’excrétion urinaire correspond approximativement à 1 et 2 % de la dose administrée respectivement par voie orale et intraveineuse.
Population pédiatrique
Chez la majorité des patients, le furoate de fluticasone n’est pas quantifiable (< 10 pg/mL) après administration nasale d’une dose journalière de 110 microgrammes. Des concentrations plasmatiques mesurables ont été observées chez 15,1 % des patients pédiatriques après administration nasale d’une dose journalière de 110 microgrammes et chez seulement 6,8 % des patients pédiatriques après administration d’une dose journalière de 55 microgrammes. Il n’a pas été retrouvé d’augmentation des concentrations de furoate de fluticasone chez les plus jeunes enfants (âgés de moins de 6 ans). Chez les sujets chez qui les taux plasmatiques étaient mesurables après administration de 55 microgrammes, les valeurs médianes de la concentration en furoate de fluticasone étaient de 18,4 pg/mL et de 18,9 pg/mL chez les enfants âgés respectivement de 2 à 5 ans et 6 à 11 ans.
A la dose de 110 microgrammes, les concentrations moyennes chez les sujets ayant des taux quantifiables étaient de 14,3 pg/mL et de 14,4 pg/mL chez les enfants âgés respectivement de 2 à 5 ans et 6 à 11 ans. Ces valeurs sont similaires à celles observées chez les adultes (plus de 12 ans) pour lesquels les concentrations moyennes chez les sujets ayant des taux mesurables étaient respectivement de 15,4 pg/mL et de 21,8 pg/mL aux doses de 55 microgrammes et de 110 microgrammes.
Personnes âgées
Des données pharmacocinétiques ne sont disponibles que pour un faible nombre de patients âgés (≥ 65 ans, n = 23/872 ; 2,6 %). Il n’a pas été observé une incidence accrue de patients âgés chez qui le furoate de fluticasone plasmatique a pu être quantifié, par rapport aux patients plus jeunes.
Insuffisance rénale
Le furoate de fluticasone n’a pas été détecté dans les urines des volontaires sains après administration par voie nasale. Moins de 1 % de la dose administrée est excrété dans les urines. Ainsi, une insuffisance rénale ne devrait pas avoir de retentissement sur la pharmacocinétique du furoate de fluticasone.
Insuffisance hépatique
Il n’existe pas de données après administration par voie nasale du furoate de fluticasone chez les patients ayant une insuffisance hépatique. Les données disponibles ont été obtenues après administration de furoate de fluticasone (sous forme de furoate de fluticasone ou de l'association furoate de fluticasone/vilantérol) par voie inhalée chez des patients ayant une insuffisance hépatique. Ces données peuvent être extrapolées à l'administration par voie nasale. Chez des patients présentant une insuffisance hépatique modérée (classe B de Child-Pugh), une étude portant sur l’inhalation orale d’une dose unique de 400 microgrammes de furoate de fluticasone a montré une augmentation de la Cmax (42 %) et de l’ASC(0-∞) (172 %) et une diminution modérée (23 % en moyenne) des taux de cortisol chez ces patients par rapport aux sujets sains. Après administration répétée de furoate de fluticasone/vilantérol par voie inhalée pendant 7 jours, l'exposition systémique au furoate de fluticasone (mesurée par l'ASC(0– 24)) était augmentée (en moyenne d'un facteur deux), chez les sujets ayant une insuffisance hépatique modérée ou sévère (classe B ou C de Child-Pugh) par rapport aux sujets sains. L'augmentation de l'exposition systémique au furoate de fluticasone chez les sujets ayant une insuffisance hépatique modérée (furoate de fluticasone/vilantérol 200/25 microgrammes) a été associée à une réduction de la cortisolémie de 34 % en moyenne par rapport aux sujets sains. Aucun effet sur la cortisolémie n'a été observé chez les sujets ayant une insuffisance hépatique sévère (furoate de fluticasone/vilantérol 100/12,5 microgrammes). Ces observations suggèrent que l’exposition moyenne attendue avec une dose de 110 microgrammes de furoate de fluticasone par voie nasale ne devrait pas avoir d’effet inhibiteur sur le cortisol dans cette population de patients.
5.3. Données de sécurité préclinique
Les résultats des études de toxicologie générale ont été similaires à ceux observés avec d’autres glucocorticoïdes et sont le reflet d’une amplification des effets pharmacologiques. Ces observations ne semblent pas pertinentes pour l’être humain, compte tenu des doses par voie nasale recommandées, qui entraînent une exposition systémique faible. Aucun effet génotoxique du furoate de fluticasone n’a été observé au cours des tests conventionnels de génotoxicité. Par ailleurs, il n’a pas été retrouvé d’augmentation dose dépendante de l’incidence des tumeurs au cours des études menées sur deux ans de traitement par inhalation chez les rats et les souris.
2 ans
Durée de conservation après première utilisation : 2 mois
6.4. Précautions particulières de conservation
Ne pas mettre au réfrigérateur. Ne pas congeler.
Toujours garder le capuchon sur le pulvérisateur.
6.5. Nature et contenu de l'emballage extérieur
Flacon (verre brun) de type III de 12 mL avec pompe doseuse (polypropylène/aluminium), applicateur nasal (pulvérisateur) (polypropylène) et capuchon protecteur.
Le médicament est disponible en une seule présentation : 1 flacon de 120 pulvérisations.
6.6. Précautions particulières d’élimination et de manipulation
Pas d’exigences particulières pour l’élimination.
Tout médicament non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
SWENSWEG 5
2031 GA HAARLEM
PAYS-BAS
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· 34009 302 933 2 4 : 10,4 g (correspondant à 120 pulvérisations) de suspension en flacon (verre brun) avec pompe doseuse et pulvérisateur nasal.
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
[à compléter ultérieurement par le titulaire]
Date de première autorisation:{JJ mois AAAA}
10. DATE DE MISE A JOUR DU TEXTE
[à compléter ultérieurement par le titulaire]
{JJ mois AAAA}
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Liste I
ANSM - Mis à jour le : 10/06/2025
FLUTICASONE FUROATE TEVA 27,5 microgrammes/pulvérisation, suspension pour pulvérisation nasale
Furoate de fluticasone
· Gardez cette notice. Vous pourriez avoir besoin de la relire.
· Si vous avez d’autres questions, interrogez votre médecin, votre pharmacien ou votre infirmier/ère.
· Ce médicament vous a été personnellement prescrit. Ne le donnez pas à d’autres personnes. Il pourrait leur être nocif, même si les signes de leur maladie sont identiques aux vôtres.
· Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin, votre pharmacien ou votre infirmier/ère. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
1. Qu'est-ce que FLUTICASONE FUROATE TEVA 27,5 microgrammes/pulvérisation, suspension pour pulvérisation nasale et dans quels cas est-il utilisé ?
2. Quelles sont les informations à connaître avant d'utiliser FLUTICASONE FUROATE TEVA 27,5 microgrammes/pulvérisation, suspension pour pulvérisation nasale ?
3. Comment utiliser FLUTICASONE FUROATE TEVA 27,5 microgrammes/pulvérisation, suspension pour pulvérisation nasale ?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver FLUTICASONE FUROATE TEVA 27,5 microgrammes/pulvérisation, suspension pour pulvérisation nasale ?
6. Contenu de l’emballage et autres informations.
Guide d’utilisation du pulvérisateur nasal étape par étape
1. QU’EST-CE QUE FLUTICASONE FUROATE TEVA 27,5 microgrammes/pulvérisation, suspension pour pulvérisation nasale ET DANS QUELS CAS EST-IL UTILISE ?
Classe pharmacothérapeutique : Préparations nasales, corticoïdes, code ATC : R01AD12.
FLUTICASONE FUROATE TEVA diminue l’inflammation due à l’allergie (rhinite) et par conséquent, réduit les symptômes de l'allergie.
FLUTICASONE FUROATE TEVA, suspension pour pulvérisation nasale est utilisé pour traiter les symptômes de la rhinite allergique : nez bouché, irrité ou qui coule, éternuements, yeux rouges ou irrités, larmoiements des yeux, chez l’adulte et l’enfant à partir de 6 ans.
Les symptômes de l’allergie peuvent survenir soit à des moments précis de l’année en rapport avec une allergie aux pollens des graminées ou des arbres (rhume des foins), soit toute l’année en rapport à une allergie aux animaux, acariens ou moisissures, pour ne citer que quelques-unes des allergies les plus fréquentes.
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT D’UTILISER FLUTICASONE FUROATE TEVA 27,5 microgrammes/pulvérisation, suspension pour pulvérisation nasale ?
· si vous êtes allergique au furoate de fluticasone ou à l’un des autres composants contenus dans ce médicament, mentionnés dans la rubrique 6.
Avertissements et précautions
Enfants et adolescents
Ne pas utiliser chez les enfants de moins de 6 ans.
Le traitement par FLUTICASONE FUROATE TEVA :
· peut, lorsqu’il est pris pendant longtemps, ralentir la croissance chez l’enfant. Votre médecin vérifiera régulièrement la taille de votre enfant, et s’assurera que celui-ci prend la dose efficace la plus faible ;
· peut entraîner des troubles oculaires comme un glaucome (augmentation de la pression à l'intérieur de l'œil) ou une cataracte (voile au niveau du cristallin de l'œil). Contactez votre médecin si vous avez déjà eu de tels troubles ou en cas de vision floue ou d’autres troubles visuels au cours de votre traitement par FLUTICASONE FUROATE TEVA.
Autres médicaments et FLUTICASONE FUROATE TEVA 27,5 microgrammes/pulvérisation, suspension pour pulvérisation nasale
Informez votre médecin ou pharmacien si vous prenez, avez récemment pris ou pourriez prendre tout autre médicament, y compris des médicaments obtenus sans ordonnance.
Il est particulièrement important d’informer votre médecin si vous prenez ou avez récemment pris les médicaments suivants :
· corticoïdes en comprimés ou injectables ;
· corticoïdes en crème ;
· médicaments pour l’asthme ;
· ritonavir ou cobicistat, utilisés pour traiter le Virus de l’Immunodéficience Humaine (VIH) ;
· kétoconazole, utilisé pour traiter les infections fongiques (champignons).
Votre médecin évaluera si vous pouvez prendre FLUTICASONE FUROATE TEVA avec ces médicaments. Votre médecin peut être amené à vous suivre plus particulièrement si vous prenez l'un de ces médicaments car ils peuvent augmenter les effets indésirables de FLUTICASONE FUROATE TEVA.
FLUTICASONE FUROATE TEVA ne doit pas être utilisé en même temps que d’autres médicaments pour pulvérisation nasale contenant des corticoïdes.
FLUTICASONE FUROATE TEVA 27,5 microgrammes/pulvérisation, suspension pour pulvérisation nasale avec des aliments et boissons
Sans objet.
Si vous êtes enceinte ou que vous allaitez, si vous pensez être enceinte ou planifiez une grossesse, demandez conseil à votre médecin ou pharmacien avant de prendre ce médicament.
N’utilisez pas FLUTICASONE FUROATE TEVA si vous êtes enceinte, ou si vous planifiez une grossesse, sauf si votre médecin ou votre pharmacien vous l’a indiqué.
N’utilisez pas FLUTICASONE FUROATE TEVA si vous allaitez, sauf si votre médecin ou votre pharmacien vous l’a indiqué.
Conduite de véhicules et utilisation de machines
Il est peu probable que FLUTICASONE FUROATE TEVA affecte votre capacité à conduire ou à utiliser des machines.
FLUTICASONE FUROATE TEVA 27,5 microgrammes/pulvérisation, suspension pour pulvérisation nasale contient du chlorure de benzalkonium
Ce médicament contient 8,25 microgrammes de chlorure de benzalkonium par pulvérisation délivrée de 27,5 microgrammes de furoate de fluticasone. Le chlorure de benzalkonium peut provoquer des irritations ou un gonflement à l’intérieur du nez, surtout s’il est utilisé sur une longue période. Informez votre médecin ou votre pharmacien si vous ressentez une gêne lors de l’utilisation du pulvérisateur.
3. COMMENT UTILISER FLUTICASONE FUROATE TEVA 27,5 microgrammes/pulvérisation, suspension pour pulvérisation nasale ?
Quand utiliser FLUTICASONE FUROATE TEVA
· Une fois par jour
· A la même heure chaque jour.
Cela traitera vos symptômes durant le jour et la nuit.
En combien de temps FLUTICASONE FUROATE TEVA est-il efficace
Certaines personnes ne ressentiront pas les effets complets avant plusieurs jours d’utilisation de FLUTICASONE FUROATE TEVA. Cependant, il est habituellement efficace après 8 à 24 heures d’utilisation.
Quelle quantité utiliser
Adultes et enfants à partir de 12 ans
· La dose habituelle initiale est de 2 pulvérisations dans chaque narine, une fois par jour.
· Une fois que les symptômes sont contrôlés, vous pourrez diminuer la dose à 1 pulvérisation dans chaque narine, une fois par jour.
Enfants de 6 à 11 ans
· La dose habituelle initiale est de 1 pulvérisation dans chaque narine, une fois par jour.
· Si les symptômes sont très importants, votre médecin peut augmenter la dose à 2 pulvérisations dans chaque narine, une fois par jour, jusqu’à ce que les symptômes soient contrôlés. Il sera alors possible de réduire la dose à 1 pulvérisation dans chaque narine, une fois par jour.
Comment utiliser le pulvérisateur nasal
FLUTICASONE FUROATE TEVA n’a quasiment aucun goût ni aucune odeur. Il est pulvérisé dans le nez sous forme d’une fine brume. Faites attention à ne pas pulvériser le produit dans vos yeux. En cas de pulvérisation dans les yeux, rincez-les avec de l’eau.
Un guide d’utilisation du pulvérisateur nasal étape par étape figure après la rubrique 6 de cette notice. Suivez attentivement ce guide pour bénéficier de la meilleure utilisation de FLUTICASONE FUROATE TEVA.
Voir le Guide d’utilisation du pulvérisateur nasal étape par étape, après la rubrique 6.
Si vous avez utilisé plus de FLUTICASONE FUROATE TEVA 27,5 microgrammes/pulvérisation, suspension pour pulvérisation nasale que vous n’auriez dû
Parlez-en à votre médecin ou à votre pharmacien.
Si vous oubliez d’utiliser FLUTICASONE FUROATE TEVA 27,5 microgrammes/pulvérisation, suspension pour pulvérisation nasale
Si vous oubliez de prendre une dose, prenez-la lorsque vous vous en souvenez.
Si le moment de votre dose suivante est proche, attendez jusque-là. Ne prenez pas de dose double pour compenser la dose que vous avez oublié de prendre.
Si vous arrêtez d’utiliser FLUTICASONE FUROATE TEVA 27,5 microgrammes/pulvérisation, suspension pour pulvérisation nasale
Sans objet.
Si vous avez d’autres questions sur l’utilisation de ce médicament, ou si vous ressentez une gêne liée à l’utilisation du pulvérisateur nasal, demandez plus d’informations à votre médecin, à votre pharmacien ou à votre infirmier/ère.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
Réactions allergiques : consultez immédiatement un médecin.
Les réactions allergiques à FLUTICASONE FUROATE TEVA sont rares et touchent moins de 1 personne sur 1 000. Chez un petit nombre de personnes, les réactions allergiques peuvent devenir un problème plus grave, voire un problème mettant en jeu le pronostic vital si elles ne sont pas traitées. Les symptômes incluent :
· le fait de siffler en respirant, de tousser ou d’avoir des difficultés à respirer ;
· une soudaine sensation de fatigue ou de vertige (pouvant s’accompagner d’une chute de la pression artérielle ou d'une perte de conscience) ;
· un gonflement du visage ;
· des éruptions cutanées ou des rougeurs.
Dans de nombreux cas, ces symptômes représentent des signes d’effets indésirables moins graves. Mais vous devez être conscient(e) qu’ils sont potentiellement graves - donc si vous remarquez l’un de ces symptômes :
Contactez un médecin dès que possible.
Effets indésirables très fréquents (ils peuvent concerner plus de 1 personne sur 10)
· Saignements de nez (généralement mineurs), en particulier si vous utilisez FLUTICASONE FUROATE TEVA continuellement pendant plus de 6 semaines.
Effets indésirables fréquents (ils peuvent concerner jusqu’à 1 personne sur 10)
· Ulcération nasale, pouvant entraîner une irritation ou une gêne intranasale. Vous pouvez également constater des traces de sang lorsque vous vous mouchez.
· Maux de tête.
· Essoufflement.
Effets indésirables peu fréquents (ils peuvent concerner jusqu'à 1 personne sur 100)
· Douleur, sensation de brûlure, irritation, inconfort ou sécheresse au niveau nasal.
Effets indésirables très rares (ils peuvent concerner jusqu'à 1 personne sur 10 000)
· Petits trous (perforations) au niveau de la cloison nasale (cloison séparant les deux cavités nasales).
Fréquence indéterminée (la fréquence ne peut être estimée sur la base des données disponibles)
· Ralentissement de la croissance chez les enfants.
· Vision floue ou modifications temporaires de la vision lors d'une utilisation au long cours.
· Oppression thoracique pouvant entraîner des difficultés à respirer.
· Trouble de la voix, perte de la voix.
· Trouble du goût, perte du goût, perte de l’odorat.
L’administration de corticoïdes par voie nasale peut affecter la production normale d'hormones par l'organisme, particulièrement en cas de doses élevées sur de longues périodes. Chez les enfants, cet effet indésirable peut entraîner un ralentissement de la croissance.
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin, votre pharmacien ou à votre infirmier/ère. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr/
En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.
5. COMMENT CONSERVER FLUTICASONE FUROATE TEVA 27,5 microgrammes/pulvérisation, suspension pour pulvérisation nasale ?
Tenir ce médicament hors de la vue et de la portée des enfants.
Toujours garder le capuchon sur le pulvérisateur.
N'utilisez pas ce médicament après la date de péremption indiquée sur l’étiquette et la boîte. La date de péremption fait référence au dernier jour de ce mois. Le pulvérisateur nasal de FLUTICASONE FUROATE TEVA doit être utilisé dans les 2 mois suivant la première utilisation.
Ne pas mettre au réfrigérateur. Ne pas congeler.
Ne jetez aucun médicament au tout-à-l’égout ou avec les ordures ménagères. Demandez à votre pharmacien d’éliminer les médicaments que vous n’utilisez plus. Ces mesures contribueront à protéger l’environnement.
6. CONTENU DE L’EMBALLAGE ET AUTRES INFORMATIONS
· La substance active est furoate de fluticasone. Chaque pulvérisation délivre 27,5 microgrammes de furoate de fluticasone.
· Les autres composants sont : glucose, cellulose microcristalline (E460), carmellose sodique (E466), polysorbate 80 (E433), chlorure de benzalkonium, édétate disodique, eau pour préparations injectables (voir rubrique 2).
Le médicament est une suspension pour pulvérisation nasale, de couleur blanche, contenue dans un flacon en verre brun, avec une pompe doseuse, un applicateur et un capuchon protecteur. FLUTICASONE FUROATE TEVA est disponible en une seule présentation pouvant délivrer 120 pulvérisations.
Titulaire de l’autorisation de mise sur le marché
SWENSWEG 5
2031 GA HAARLEM
PAYS-BAS
Exploitant de l’autorisation de mise sur le marché
TEVA SANTE
100-110, esplanade du Général de Gaulle
92931 Paris La Défense Cedex
OSTRAVSKA 305/29
747 70 OPAVA - KOMAROV
REPUBLIQUE TCHEQUE
Noms du médicament dans les Etats membres de l'Espace Economique Européen
Ce médicament est autorisé dans les Etats membres de l'Espace Economique Européen sous les noms suivants : Conformément à la réglementation en vigueur.
[À compléter ultérieurement par le titulaire]
La dernière date à laquelle cette notice a été révisée est :
[à compléter ultérieurement par le titulaire]
{mois AAAA}.
Des informations détaillées sur ce médicament sont disponibles sur le site Internet de l’ANSM (France).
GUIDE D’UTILISATION DU PULVERISATEUR NASAL ETAPE PAR ETAPE
A quoi ressemble le pulvérisateur nasal
Le pulvérisateur nasal se trouve dans un flacon en verre brun avec une pompe doseuse, un applicateur et un capuchon protecteur. Il contient 120 pulvérisations.
Cinq éléments importants à connaître concernant l’utilisation du pulvérisateur nasal
· FLUTICASONE FUROATE TEVA est contenu dans un flacon en verre brun. Si vous avez besoin de vérifier la quantité restante, tenez le pulvérisateur nasal bien droit face à une lumière intense. Vous pourrez ainsi voir le niveau à travers le flacon.
· Lors de votre première utilisation du pulvérisateur nasal, vous devez le secouer vigoureusement avec le capuchon en place pendant environ 10 secondes. Ceci est important car FLUTICASONE FUROATE TEVA est une suspension épaisse qui devient liquide quand on l’a bien agitée. La pulvérisation ne se fera que lorsque la suspension sera liquide.
· Vous devez appuyer fermement sur la pompe jusqu'au bout pour libérer la brume à travers la buse.
· Gardez toujours le capuchon en place sur le pulvérisateur nasal lorsque vous ne l’utilisez pas. Le capuchon protège de l’entrée de la poussière, conserve la pression dans le pulvérisateur et empêche la buse de se boucher.
· N’utilisez jamais une aiguille ou un objet pointu pour nettoyer la buse. Cela risque d’endommager le pulvérisateur nasal.
Préparation pour l’utilisation du pulvérisateur nasal
Vous devez préparer le pulvérisateur nasal :
· avant la première utilisation ;
· si vous avez enlevé le capuchon pendant 5 jours ou si vous n’avez pas utilisé le pulvérisateur depuis 30 jours ou plus.
La préparation du pulvérisateur nasal permet de vous assurer que vous prendrez toujours la dose complète du médicament. Suivez ces étapes :
1. Secouez vigoureusement le pulvérisateur nasal avec le capuchon en place pendant environ 10 secondes.
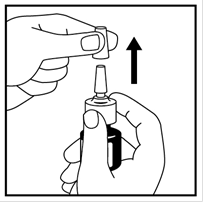
2. Otez le capuchon - voir image 1.
Image 1
|
|
3. Tenez bien droit le pulvérisateur nasal, ensuite inclinez-le et pointez la buse loin de vous.
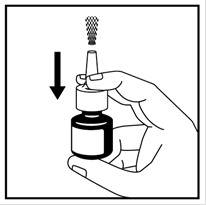
4. Amorcez la pompe en plaçant deux doigts de chaque côté de la pompe de pulvérisation et en plaçant le pouce sur le fond du flacon. Appuyez sur la pompe et relâchez-la. Recommencez cette opération au moins 6 fois jusqu'à libération d'une fine brume de pulvérisation dans l'air - voir image 2.
Image 2
|
|
5. Le pulvérisateur nasal est maintenant prêt à l’emploi.
Utilisation du pulvérisateur nasal
1. Secouez vigoureusement le pulvérisateur nasal.
2. Otez le capuchon.
3. Mouchez votre nez pour nettoyer vos narines, ensuite inclinez légèrement la tête en avant.
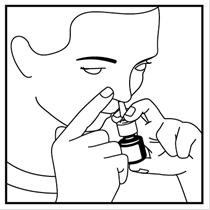
4. Placez la buse dans l’une de vos narines et fermez l’autre narine avec votre doigt - voir image 3. Pointez légèrement l’extrémité de la buse vers le côté extérieur, loin de la cloison nasale centrale. Ceci permet de pulvériser le médicament dans la bonne partie du nez.
5. Appuyez fermement sur la pompe jusqu'au bout, pendant que vous inspirez par le nez.
Image 3
|
|
6. Retirez la buse de votre nez et expirez par la bouche.
7. Si la dose qui vous a été prescrite est de 2 pulvérisations par narine, répétez les étapes 4 à 6.
8. Répétez les étapes 4 à 7 pour traiter l’autre narine.
9. Replacez le capuchon sur le pulvérisateur nasal.
Nettoyage du pulvérisateur nasal
Après chaque utilisation :
1. Essuyez la buse et l’intérieur du capuchon avec un mouchoir propre et sec.
2. N’utilisez pas d’eau pour nettoyer le pulvérisateur nasal.
3. N’utilisez jamais une aiguille ou un objet pointu sur la buse.
4. Replacez toujours le capuchon une fois que vous avez fini.
Si le pulvérisateur nasal semble ne pas fonctionner :
· Vérifiez qu’il reste encore du médicament. Regardez le niveau à travers le flacon. Si le niveau est très bas, il se peut qu’il ne reste pas assez de médicament pour que le pulvérisateur nasal fonctionne.
· Vérifiez que le pulvérisateur nasal n’est pas endommagé.
· Si vous pensez que la buse est bouchée, n’utilisez pas une aiguille ou un objet pointu pour la déboucher.
· Essayez de le réamorcer en suivant les instructions mentionnées dans la partie « Préparation pour l’utilisation du pulvérisateur nasal ».
· Si le pulvérisateur nasal ne fonctionne toujours pas, ou s’il produit un jet de liquide, rapportez-le à la pharmacie pour obtenir des conseils.