
ANSM - Mis à jour le : 14/05/2024
JOSACINE 250 mg/5 ml, granulés pour suspension buvable
2. COMPOSITION QUALITATIVE ET QUANTITATIVE 
Josamycine base................................................................................................................. 250 mg
(Sous forme de propionate de josamycine)
Pour 5 ml de suspension reconstituée.
Excipients à effet notoire par 5 ml de suspension buvable: saccharose (654 mg), parahydroxybenzoate de méthyle (E218 ; 6,625 mg), parahydroxybenzoate de propyle (E216 ; 0,875 mg), sodium (moins de 3,8 mg) et alcool benzylique (0,001 mg) (présent dans l’arôme fraise).
Pour la liste complète des excipients, voir rubrique 6.1.
Granulés pour suspension buvable.
Fins granulés roses avec une odeur de fraise.
4.1. Indications thérapeutiques 
Elles sont limitées aux infections dues aux germes définis comme sensibles :
· angines documentées à streptocoque A bêta-hémolytique, en alternative au traitement par bêta-lactamines, particulièrement lorsque celui-ci ne peut être utilisé.
· sinusites aiguës. Compte-tenu du profil microbiologique de ces infections, les macrolides sont indiqués lorsqu'un traitement par une bêta-lactamine est impossible.
· surinfections des bronchites aiguës.
· exacerbations des bronchites chroniques.
· pneumopathies communautaires chez des sujets :
o sans facteurs de risque,
o sans signes de gravité clinique,
o en l'absence d'éléments cliniques évocateurs d'une étiologie pneumococcique.
En cas de suspicion de pneumopathie atypique, les macrolides sont indiqués quels que soient la gravité et le terrain.
· infections cutanées bénignes : impétigo, impétiginisation des dermatoses, ecthyma, dermo-hypodermite infectieuse (en particulier, érysipèle), érythrasma.
· infections stomatologiques.
· infections génitales non gonococciques.
· chimioprophylaxie des rechutes du RAA en cas d'allergie aux bêta-lactamines.
Il convient de tenir compte des recommandations officielles concernant l'utilisation appropriée des antibactériens.
4.2. Posologie et mode d'administration 
Cette présentation est réservée à l’enfant de 5 à 10 kg.
La posologie est de 50 mg/kg de poids et par jour, à répartir en deux prises par jour.
Soit en pratique : 1 prise (25 mg/kg) le matin et 1 prise (25 mg/kg) le soir.
La dose par prise, est indiquée en fonction du poids de l'enfant sur le piston de la seringue pour administration orale graduée en kilo. Elle se lit directement sur les graduations de la seringue. Ainsi le poids indiqué correspond à la dose pour une prise.
La seringue pour administration orale est graduée de 2 à 10 kg, chaque graduation successive de 1 kg correspond à 25 mg de josamycine.
Attention, cette seringue pour administration orale ne doit pas être utilisée pour un autre médicament, la graduation étant spécifique à ce produit.
Deux prises par jour sont nécessaires.
Par exemple, pour un enfant de 5 kg, la dose à administrer par prise correspond à la seringue remplie jusqu'à la graduation 5.
Cas particuliers :
Angines : 50 mg/kg/jour à répartir en 2 prises journalières.
Soit en pratique : 1 prise (25 mg/kg) le matin et 1 prise (25 mg/kg) le soir.
La durée du traitement des angines est de 5 jours.
Mode d’administration
VOIE ORALE.
Préparation de la suspension
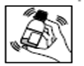 1) Agiter le flacon
1) Agiter le flacon
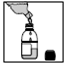 2) Puis ajouter de l’eau jusqu’au trait
2) Puis ajouter de l’eau jusqu’au trait
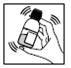 3) Agiter de nouveau et laisser reposer
3) Agiter de nouveau et laisser reposer
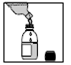 4) Compléter avec de l’eau jusqu’au trait du flacon
4) Compléter avec de l’eau jusqu’au trait du flacon
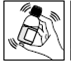 5) Agiter de nouveau
5) Agiter de nouveau
Administration du médicament
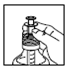 1) Plonger la seringue graduée dans le flacon
1) Plonger la seringue graduée dans le flacon
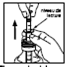 2) Tirer sur le piston pour aspirer la suspension jusqu’au trait correspondant au poids de l’enfant
2) Tirer sur le piston pour aspirer la suspension jusqu’au trait correspondant au poids de l’enfant
 3) Après utilisation, rincer la seringue avec de l’eau
3) Après utilisation, rincer la seringue avec de l’eau
 4) Coller le support sur le côté du flacon
4) Coller le support sur le côté du flacon
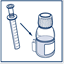 5) Replacer la seringue dans son support
5) Replacer la seringue dans son support
Attention, cette seringue pour administration orale ne doit pas être utilisée pour un autre médicament, la graduation étant spécifique à ce produit.
Utiliser uniquement la seringue graduée fournie (correspondant à ce dosage).
Ce médicament NE DOIT PAS ETRE UTILISÉ dans les cas suivants :
· hypersensibilité à la substance active ou à l'un des excipients mentionnés à la rubrique 6.1,
· en association avec :
o l'ergotamine et la dihydroergotamine,
o le pimozide,
o l’ivabradine,
o la colchicine,
(voir rubrique 4.5).
4.4. Mises en garde spéciales et précautions d'emploi 
En cas d'insuffisance hépatique, l'administration de josamycine n'est pas recommandée. Si elle est nécessaire, elle justifie alors une surveillance régulière des tests hépatiques et éventuellement une réduction de posologie.
Des cas de colite pseudomembraneuse ont été rapportés avec la josamycine (voir rubrique 4.8) ; il est donc important d'évoquer ce diagnostic chez les patients présentant une diarrhée sévère pendant ou après un traitement par josamycine. Dans cette situation, des mesures thérapeutiques adéquates doivent être initiées immédiatement. Les médicaments inhibant le péristaltisme sont contre-indiqués dans cette situation.
Ce médicament est généralement déconseillé en association avec :
· les alcaloïdes de l'ergot de seigle dopaminergiques (bromocriptine, cabergoline, lisuride, pergolide),
· l'halofantrine,
· le tacrolimus.
(voir rubrique 4.5).
L’administration de josamycine doit se faire avec prudence chez les patients présentant une hypersensibilité connue à l’érythromycine ou à d’autres antibiotiques de la famille des macrolides.
Une résistance croisée avec d’autres antibiotiques de la famille des macrolides peut être observée.
Des cas d’arythmie ont été rapportés chez des patients prenant des macrolides, dont la josamycine (voir rubrique 4.8). La josamycine doit être administrée avec prudence chez les patients à haut risque suivants :
· Patients ayant une cardiopathie préexistante ou concomitante, en particulier chez les patients très jeunes (nouveau-né, nourrisson) et âgés.
· Patients ayant d’autres affections (non cardiaques) potentiellement arythmogènes (par ex., troubles/détresse respiratoire(s), déséquilibre électrolytique).
· Patients sous traitement concomitant potentiellement arythmogène (par ex., digoxine).
Ce médicament contient du saccharose. Les patients présentant une intolérance au fructose, un syndrome de malabsorption du glucose et du galactose ou un déficit en sucrase/isomaltase (maladies héréditaires rares) ne doivent pas prendre ce médicament.
Ce médicament contient du parahydroxybenzoate de méthyle et de propyle et peut provoquer des réactions allergiques (éventuellement retardées).
Ce médicament contient moins de 1 mmol (23 mg) de sodium pour 5 ml de suspension buvable, c’est-à-dire qu’il est essentiellement « sans sodium ».
Ce médicament contient également de l’alcool benzylique présent dans l’arôme fraise.
Ce médicament contient 0,001 mg pour 5 ml de suspension buvable. L’alcool benzylique peut provoquer des réactions allergiques.
L’alcool benzylique est associé à un risque d’effets indésirables graves y compris des problèmes respiratoires (appelés « syndrome de suffocation ») chez les jeunes enfants. Ne pas utiliser chez le nouveau-né (jusqu’à 4 semaines) sauf en cas de nécessité uniquement.
Du fait du risque accru en raison de l’accumulation chez les jeunes enfants, ne pas utiliser pendant plus d’une semaine chez les jeunes enfants (moins de 3 ans) sauf en cas de nécessité uniquement.
Les volumes élevés doivent être utilisés avec prudence et en cas de nécessité uniquement, en particulier chez les personnes atteintes d’insuffisance hépatique ou rénale en raison du risque d’accumulation et de toxicité (acidose métabolique).
4.5. Interactions avec d'autres médicaments et autres formes d'interactions 
De nombreux cas d'augmentation de l'activité des antivitamines K ont été rapportés chez des patients recevant des antibiotiques. Le contexte infectieux ou inflammatoire marqué, l'âge et l'état général du patient apparaissent comme des facteurs de risque. Dans ces circonstances, il apparaît difficile de faire la part entre la pathologie infectieuse et son traitement dans la survenue du déséquilibre de l'INR. Cependant, certaines classes d'antibiotiques sont davantage impliquées : il s'agit notamment des fluoroquinolones, des macrolides, des cyclines, du cotrimoxazole et de certaines céphalosporines, qui imposent, dans ces conditions, de renforcer la surveillance de l’INR.
Associations contre-indiquées
+ Dihydroergotamine
Ergotisme avec possibilité de nécrose des extrémités (inhibition de l'élimination hépatique de l’alcaloïde de l'ergot de seigle).
+ Ergotamine
Ergotisme avec possibilité de nécrose des extrémités (diminution de l'élimination hépatique de l’ergotamine).
+ Pimozide
Risque majoré de troubles du rythme ventriculaire, notamment de torsades de pointes.
+ Ivabradine
Augmentation des concentrations plasmatiques de l’ivabradine et par conséquent de ses effets indésirables (inhibition de son métabolisme hépatique par la josamycine).
+ Colchicine
Augmentation des effets indésirables de la colchicine aux conséquences potentiellement fatales.
+ Alcaloïdes de l'ergot de seigle dopaminergiques (bromocriptine, cabergoline, lisuride, pergolide)
Augmentation des concentrations plasmatiques du dopaminergique avec accroissement possible de son activité ou apparition de signes de surdosage.
+ Halofantrine
Risque majoré de troubles du rythme ventriculaire, notamment de torsades de pointes.
Si cela est possible, interrompre le macrolide. Si l'association ne peut être évitée, contrôle préalable du QT et surveillance ECG monitorée.
+ Tacrolimus
Augmentation des concentrations sanguines de tacrolimus et de la créatininémie, par inhibition du métabolisme hépatique du tacrolimus par la josamycine.
Associations faisant l'objet de précautions d’emploi
+ Carbamazépine
Augmentation des concentrations plasmatiques de carbamazépine avec signes de surdosage, par diminution de son métabolisme hépatique.
Surveillance clinique et, si besoin, dosage plasmatique et réduction éventuelle de la posologie de la carbamazépine.
+ Ciclosporine
Risque d'augmentation des concentrations sanguines de ciclosporine et de la créatininémie. Dosage des concentrations sanguines de la ciclosporine, contrôle de la fonction rénale et adaptation de la posologie pendant l'association et après l'arrêt du macrolide.
+ Disopyramide
Risque de majoration des effets indésirables du disopyramide : hypoglycémies sévères, allongement de l'intervalle QT et troubles du rythme ventriculaire graves, notamment à type de torsade de pointes.
Surveillance clinique, biologique et électrocardiographique régulière.
+ Antivitamines K
Augmentation de l'effet de l'antivitamine K et du risque hémorragique.
Contrôle plus fréquent de l'INR. Adaptation éventuelle de la posologie de l'antivitamine K pendant le traitement par le macrolide et après son arrêt.
+ Sildénafil
Augmentation des concentrations plasmatiques de sildénafil, avec risque d’hypotension. Débuter le traitement par sildénafil à la dose minimale en cas d’association avec la josamycine.
Associations à prendre en compte
+ Théophylline (et, par extrapolation, aminophylline)
Risque d'augmentation de la théophyllinémie, particulièrement chez l'enfant.
+ Digoxine
Augmentation de la digoxinémie par majoration de son absorption.
Surveillance clinique et éventuellement de la digoxinémie pendant le traitement par josamycine et après son arrêt.
4.6. Fertilité, grossesse et allaitement 
Bien que cette présentation soit réservée à l’enfant, les données portant sur la grossesse et l’allaitement sont les suivantes :
Grossesse
Les données cliniques chez la femme enceinte sont limitées. Les études effectuées chez l’animal ont mis en évidence une toxicité sur la reproduction à doses élevées. Il est préférable, par mesure de précaution, d’éviter l’utilisation de la josamycine au cours de la grossesse, sauf si nécessaire.
Le passage de la plupart des macrolides dans le lait maternel est documenté, avec des concentrations dans le lait égales ou supérieures aux concentrations plasmatiques. Cependant, les quantités ingérées par le nouveau-né restent faibles au regard des posologies pédiatriques. Le risque majeur consiste en une modification de la flore intestinale de l’enfant. En conséquence, l’allaitement est possible. En cas de survenue de troubles digestifs chez le nourrisson (candidose intestinale, diarrhée), il est nécessaire d’interrompre l’allaitement (ou le médicament).
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines 
Affections cardiaques
Arythmie (voir rubrique 4.4)
Affections gastro-intestinales
Nausées, vomissements, gastralgies, diarrhée, douleurs abdominales, colite pseudomembraneuse, stomatite (fréquence indéterminée).
Affections de la peau et du tissu sous-cutané
Eruption érythémateuse ou maculopapuleuse, érythème multiforme, dermatose bulleuse, syndrome de Stevens-Johnson, syndrome de Lyell (nécrolyse épidermique toxique).
Affections du système immunitaire
· Réactions d'hypersensibilité à type de prurit, urticaire, œdème de la face, œdème de Quincke (angiœdème), gêne respiratoire, réaction et choc anaphylactique;
· Maladie sérique.
Affections hépatobiliaires
Augmentation des transaminases et phosphatases alcalines, ictère, hépatite cholestatique ou hépatite cytolytique.
Affections vasculaires
Purpura, vascularite cutanée.
Troubles du métabolisme et de la nutrition
Diminution de l’appétit (fréquence indéterminée).
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr/.
Un surdosage avec la josamycine peut entraîner des troubles gastro-intestinaux tels que nausées et diarrhées, et doivent être traités en conséquence.
5. PROPRIETES PHARMACOLOGIQUES 
5.1. Propriétés pharmacodynamiques 
Classe pharmacothérapeutique : ANTIBACTERIENS A USAGE SYSTEMIQUE, code ATC : J01FA07.
Antibiotique antibactérien de la famille des macrolides.
SPECTRE D'ACTIVITE ANTIBACTERIENNE
Les concentrations critiques séparent les souches sensibles des souches de sensibilité intermédiaire et ces dernières, des résistantes :
S ≤ 1 mg/l et R > 4 mg/l
La prévalence de la résistance acquise peut varier en fonction de la géographie et du temps pour certaines espèces. Il est donc utile de disposer d'informations sur la prévalence de la résistance locale, surtout pour le traitement d'infections sévères. Ces données ne peuvent apporter qu'une orientation sur les probabilités de la sensibilité d'une souche bactérienne à cet antibiotique.
Lorsque la variabilité de la prévalence de la résistance en France est connue pour une espèce bactérienne, elle est indiquée dans le tableau ci-dessous :
|
Catégories |
Fréquence de résistance acquise en France (> 10%) (valeurs extrêmes) |
|
ESPÈCES SENSIBLES |
|
|
Aérobies à Gram positif |
|
|
Bacillus cereus |
|
|
Corynebacterium diphtheriae |
|
|
Entérocoques |
50 - 70 % |
|
Rhodococcus equi |
|
|
Staphylococcus méti-S |
|
|
Staphylococcus méti-R * |
70 - 80 % |
|
Streptococcus B |
|
|
Streptococcus non groupable |
30 - 40 % |
|
Streptococcus pneumoniae |
35 - 70 % |
|
Streptococcus pyogenes |
16 – 31 % |
|
|
|
|
Aérobies à Gram négatif |
|
|
Bordetella pertussis |
|
|
Branhamella catarrhalis |
|
|
Campylobacter |
|
|
Legionella |
|
|
Moraxella |
|
|
|
|
|
Anaérobies |
|
|
Actinomyces |
|
|
Bacteroides |
30 - 60 % |
|
Eubacterium |
|
|
Mobiluncus |
|
|
Peptostreptococcus |
30 - 40 % |
|
Porphyromonas |
|
|
Prevotella |
|
|
Propionibacterium acnes |
|
|
|
|
|
Autres |
|
|
Borrelia burgdorferi |
|
|
Chlamydia |
|
|
Coxiella |
|
|
Leptospires |
|
|
Mycoplasma pneumoniae |
|
|
Treponema pallidum |
|
|
|
|
|
ESPÈCES MODÉRÉMENT SENSIBLES |
|
|
(in vitro de sensibilité intermédiaire) |
|
|
|
|
|
Aérobies à Gram négatif |
|
|
Neisseria gonorrhoeae |
|
|
Anaérobies |
|
|
Clostridium perfringens |
|
|
Autres |
|
|
Ureaplasma urealyticum |
|
|
|
|
|
ESPÈCES RÉSISTANTES |
|
|
|
|
|
Aérobies à Gram positif |
|
|
Corynebacterium jeikeium |
|
|
Nocardia asteroïdes |
|
|
Aérobies à Gram négatif |
|
|
Acinetobacter |
|
|
Entérobactéries |
|
|
Haemophilus |
|
|
Pseudomonas |
|
|
Anaérobies |
|
|
Fusobacterium |
|
|
Autres |
|
|
Mycoplasma hominis |
|
La josamycine possède une activité in vitro et in vivo sur Toxoplasma gondii.
* La fréquence de résistance à la méticilline est environ de 30 à 50 % de l'ensemble des staphylocoques et se rencontre surtout en milieu hospitalier.
5.2. Propriétés pharmacocinétiques 
Prise par voie orale, la josamycine est absorbée rapidement au niveau de la partie initiale de l'intestin grêle.
Distribution
Le pic sérique est obtenu entre 1 et 4 heures après la prise orale. La concentration plasmatique maximale atteint 0,2 à 0,3 mg/l après absorption de 1 g de josamycine base et 0,3 à 0,4 mg/l après absorption de 1 g de propionate de josamycine.
La pharmacocinétique de la josamycine après dose unique comme à l'équilibre, montre une grande variabilité inter et intra individuelle. Ainsi, sa Cmax peut varier dans un rapport de 1 à 7 pour le propionate et de 1 à 10 pour la forme base. Le degré de variation est du même ordre pour l'AUC.
La josamycine présente une très forte affinité tissulaire qui se traduit par une diffusion rapide vers les parenchymes notamment dans les poumons et les végétations adénoïdes. Les concentrations tissulaires sont élevées : après administration de 1 g de josamycine en doses multiples, les valeurs médianes atteignent 1,4 microgrammes/gramme pour une moyenne de 3,4 microgrammes/gramme dans le parenchyme pulmonaire, et de 0,7 microgrammes/gramme pour les valeurs médianes et moyennes comparables dans les végétations adénoïdes.
Il faut noter une pénétration de la josamycine dans la plupart des tissus et milieux biologiques tels que les sinus, la prostate, les amygdales, les sécrétions bronchiques, le pus de l'oreille, la salive, la sueur et les larmes.
Les macrolides pénètrent et s'accumulent dans les phagocytes (polynucléaires neutrophiles, monocytes, macrophages péritonéaux et alvéolaires).
Les concentrations intra-phagocytaires sont élevées chez l'homme. Ces propriétés expliquent l'activité de la josamycine sur les bactéries intracellulaires.
Le passage transplacentaire de la josamycine est faible. La josamycine diffuse très bien dans le lait maternel avec un rapport lait maternel/plasma de 100 %. La josamycine ne diffuse pas dans le liquide céphalo-rachidien.
La liaison aux protéines plasmatiques est de l'ordre de 15 %.
Biotransformation
La biotransformation s'effectue au niveau du foie et ne concerne que 40 à 50 % de la josamycine absorbée.
Les 2 principaux métabolites, qui sont des métabolites hydroxylés, conservent la même activité bactériologique sur le plan qualitatif.
Élimination
L'élimination est principalement digestive : bile et fèces pour 90 % environ.
L'élimination urinaire est très faible (< 10 %).
La demi-vie d'élimination est de l'ordre de 2 heures.
5.3. Données de sécurité préclinique 
Dans des études chez des souris et des rates portant sur l’administration de propionate de josamycine au cours de l’organogénèse, un ralentissement de la prise de poids et une splénomégalie ont été rapportés à des doses élevées (2,0 g/kg/jour) chez la souris femelle gravide.
5 ans.
Après reconstitution, la durée de conservation de la suspension est de 7 jours.
6.4. Précautions particulières de conservation 
Flacon non-ouvert : pas de précautions particulières de conservation.
Pour les conditions de conservation du médicament après reconstitution, voir rubrique 6.3.
6.5. Nature et contenu de l'emballage extérieur 
15 g en flacon (verre) correspondant à 60 ml de suspension reconstituée avec une seringue pour administration orale.
20 g en flacon (verre) correspondant à 80 ml de suspension reconstituée avec une seringue pour administration orale.
25 g en flacon (verre) correspondant à 100 ml de suspension reconstituée avec une seringue pour administration orale.
Toutes les présentations peuvent ne pas être commercialisées.
6.6. Précautions particulières d’élimination et de manipulation 
Pas d’exigences particulières.
Tout médicament non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE 
9 PLACE MARIE-JEANNE BASSOT
92300 LEVALLOIS-PERRET
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE 
· 34009 323 070 0 5 : 15 g en flacon (verre) correspondant à 60 ml de suspension reconstituée + seringue pour administration orale.
· 34009 323 071 7 3 : 20 g en flacon (verre) correspondant à 80 ml de suspension reconstituée + seringue pour administration orale.
· 34009 323 072 3 4 : 25 g en flacon (verre) correspondant à 100 ml de suspension reconstituée + seringue pour administration orale.
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION 
[à compléter ultérieurement par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE 
[à compléter ultérieurement par le titulaire]
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES 
Liste I.
|
| Plan du site | Accessibilité | Contact | Téléchargement | Declaration de confidentialité | Service-Public.fr | Legifrance | Gouvernement.fr |