Dernière mise à jour le 01/12/2025
SYMBICORT RAPIHALER 200/6 microgrammes par dose, suspension pour inhalation en flacon pressurisé
Indications thérapeutiques
SYMBICORT RAPIHALER 200/6 microgrammes par dose, suspension pour inhalation en flacon pressurisé est un inhalateur qui est utilisé dans le traitement symptomatique de la bronchopneumopathie chronique obstructive (BPCO) chez les adultes âgés de 18 ans et plus. La BPCO est une maladie chronique des voies aériennes du poumon souvent causée par le tabagisme. Symbicort contient deux substances actives différentes : le budésonide et le fumarate de formotérol dihydraté.
· Le budésonide est un « corticoïde ». Il agit en diminuant l’inflammation dans vos poumons.
· Le formotérol est un « bêta2-agoniste de longue durée d’action » ou « bronchodilatateur ». Il agit en relâchant les muscles qui entourent vos bronches ; ce qui vous aide à respirer plus facilement.
Présentations
> 1 flacon(s) pressurisé(s) aluminium de 120 dose(s) avec valve(s) doseuse(s) avec embout(s) buccal(aux)
Code CIP : 34009 300 598 7 6
Déclaration de commercialisation : 18/05/2017
Cette présentation est agréée aux collectivités
- Prix hors honoraire de dispensation : 28,65 €
- Honoraire de dispensation : 1,02 €
- Prix honoraire compris : 29,67 €
- Taux de remboursement :30%
Service médical rendu (SMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprès de la HAS (plus d'informations dans l'aide). Les avis et synthèses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur du SMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| Modéré | Avis du 30/11/2016 | Inscription (CT) | Le service médical rendu par SYMBICORT RAPIHALER est modéré dans l’indication de l’AMM. |
Amélioration du service médical rendu (ASMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprés de la HAS (plus d'informations dans l'aide). Les avis et synthéses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur de l'ASMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| V (Inexistant) | Avis du 30/11/2016 | Inscription (CT) | SYMBICORT RAPIHALER n’apporte pas d’amélioration du service médical rendu (ASMR V) dans la prise en charge thérapeutique des symptômes de la bronchopneumopathie chronique obstructive. |
ANSM - Mis à jour le : 28/11/2024
SYMBICORT RAPIHALER 200/6 microgrammes par dose, suspension pour inhalation en flacon pressurisé
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Cela correspond à une dose mesurée de 200 microgrammes de budésonide et 6 microgrammes de fumarate de formotérol dihydraté.
Pour la liste complète des excipients, voir rubrique 6.1.
Suspension pour inhalation en flacon pressurisé.
Suspension blanche dans une cartouche en aluminium placée dans un boîtier rouge avec un capuchon gris.
4.1. Indications thérapeutiques
Bronchopneumopathie chronique obstructive (BPCO)
SYMBICORT RAPIHALER est indiqué en traitement symptomatique de la BPCO chez les adultes âgés de 18 ans et plus dont le VEMS (mesuré après administration d’un bronchodilatateur) est inférieur à 70% de la valeur théorique et ayant des antécédents d’exacerbations malgré un traitement bronchodilatateur continu (voir également rubrique 4.4).
4.2. Posologie et mode d'administration
Posologie
BPCO
Posologie préconisée :
Adultes : 2 inhalations 2 fois par jour.
Populations à risque :
Sujets âgés : pas de recommandations posologiques spécifiques.
Patients insuffisants rénaux ou insuffisants hépatiques : aucune donnée n'est disponible chez les patients insuffisants rénaux ou insuffisants hépatiques. Néanmoins, compte tenu du métabolisme essentiellement hépatique du budésonide et du formotérol, une augmentation de l’exposition systémique, est attendue chez les insuffisants hépatiques sévères.
Population pédiatrique
Il n’y a pas d’utilisation justifiée de SYMBICORT RAPIHALER 200/6 microgrammes chez les enfants âgés de 11 ans et moins ni chez les adolescents âgés de 12 à 17 ans, dans le traitement symptomatique de la BPCO.
Voie d’administration : voie inhalée.
Instructions pour une utilisation correcte de Symbicort
Lors de l’activation de SYMBICORT, un volume de la suspension est éjecté de la cartouche à une vitesse élevée. Lorsque le patient inhale à travers l’embout buccal et active en même temps l’inhalateur, la substance va suivre l’air inspiré dans les voies aériennes.
L’utilisation d’une chambre d’inhalation (par exemple AeroChamber Plus Flow ou AeroChamber Plus) avec SYMBICORT (suspension pour inhalation en flacon pressurisé) est généralement recommandé, particulièrement pour les patients qui ont, ou sont susceptibles d’avoir des difficultés à coordonner l’activation du dispositif d’inhalation avec l’inspiration (voir section 5.2).
Note : Il est important que les patients reçoivent les instructions appropriées pour l’utilisation et l’entretien de leur inhalateur et de leur chambre d’inhalation et que leur technique d’inhalation soit adaptée pour assurer un dépôt pulmonaire optimal. Il convient de recommander au patient :
· de lire attentivement le mode d'emploi dans la notice d'information jointe avec chaque inhalateur,
· si une chambre d’inhalation doit être utilisée, de lire attentivement le mode d’emploi dans la notice d’information qui est jointe à chaque chambre d’inhalation,
· de ne pas utiliser l’inhalateur si le sachet de l’agent dessicant, présent à l’intérieur de l’emballage est endommagé,
· de bien agiter l’inhalateur pendant au moins 5 secondes avant chaque utilisation pour mélanger correctement son contenu,
· d'amorcer l’inhalateur en l’actionnant 2 fois dans l’air ambiant lors de sa première utilisation ou lorsqu'il n'a pas été utilisé depuis plus d'une semaine ou encore s'il est tombé,
· de retirer le capuchon de l’embout buccal avant chaque inhalation,
· de tenir l’inhalateur en position verticale lors de l'inhalation,
· de placer l’embout buccal dans la bouche, puis tout en inspirant lentement et profondément, d'appuyer fermement sur le dispositif pour libérer le médicament. Le patient devra continuer d’inspirer et maintenir l’inspiration pendant environ 10 secondes ou aussi longtemps que possible. Le fait d’inhaler tout en appuyant en même temps sur le dispositif pour le déclencher permet l'inhalation de la substance active,
· d'agiter de nouveau l’inhalateur avant de répéter l’opération,
· de replacer le capuchon sur l’embout buccal après chaque utilisation,
· de se rincer la bouche à l'eau après inhalation de la dose prescrite, afin de diminuer le risque de candidose oro-pharyngée,
· de nettoyer régulièrement l’embout buccal de l’inhalateur, au moins une fois par semaine avec un tissu propre et sec,
· de ne jamais mettre l’inhalateur dans l’eau.
Hypersensibilité aux substances actives ou à l’un des excipients mentionnés à la rubrique 6.1.
4.4. Mises en garde spéciales et précautions d'emploi
Conseils d’administration
Il convient d’informer les patients qu’ils doivent avoir en permanence à leur disposition leur inhalateur dit "de secours" pour traiter les symptômes aigus.
Il conviendra de rappeler aux patients de prendre le traitement continu de fond par SYMBICORT RAPIHALER même en l’absence de symptômes.
Afin de prévenir le risque de candidose oro-pharyngée (voir rubrique 4.8), il sera recommandé au patient de se rincer la bouche à l'eau après chaque prise du médicament.
Il est conseillé de ne pas arrêter le traitement avec SYMBICORT RAPIHALER sans avis médical.
Détérioration de la maladie
Si le contrôle des symptômes reste insuffisant malgré le traitement par SYMBICORT RAPIHALER ou si le patient dépasse les doses maximales recommandées, la conduite thérapeutique devra être réévaluée. Une détérioration soudaine ou progressive du contrôle des symptômes de la BPCO nécessite un avis médical urgent car elle peut annoncer une évolution vers un état clinique grave engageant le pronostic vital. Il conviendra alors d'envisager une augmentation de la corticothérapie (avec par exemple une cure de corticoïdes oraux) ou une antibiothérapie en cas d’infection.
Remplacement d’une corticothérapie orale
En cas de suspicion d’inhibition des fonctions surrénaliennes induite par une corticothérapie préalable par voie générale, il convient de rester vigilant lors de la mise en route d’un traitement par SYMBICORT RAPIHALER.
L’administration de budésonide par voie inhalée permet généralement la diminution du recours aux corticoïdes oraux, cependant, lors du sevrage de la corticothérapie orale, le risque d'inhibition de la fonction surrénalienne peut persister pendant une durée très prolongée. L'administration de budésonide inhalé chez les patients cortico-dépendants ne compense pas une insuffisance cortico-surrénalienne résiduelle qui peut persister pendant une période très prolongée. Dans ce cas, la fonction de l’axe hypothalamo-hypophyso-surrénalien doit être surveillé régulièrement.
Lors du remplacement d'une corticothérapie orale par SYMBICORT RAPIHALER, l’effet systémique du corticoïde est diminué ce qui peut entrainer la réapparition de symptômes allergiques (tels que rhinite, eczéma) et/ou rhumatologiques (telles que douleurs musculaires et articulaires). Un traitement spécifique devra être instauré. Une insuffisance cortico-surrénalienne doit être suspectée si, dans de rares cas, les symptômes suivants surviennent : fatigue, céphalée, nausée et vomissements. Une augmentation temporaire des doses de corticoïdes oraux peut alors parfois être nécessaire.
Interactions avec d’autres médicaments
Il convient d’éviter l’administration concomitante d’itraconazole, de ritonavir ou d’un autre inhibiteur puissant de l’isoenzyme CYP3A4 (voir rubrique 4.5). Si ces traitements ne peuvent être évités, l’intervalle de temps entre leur administration et celle de SYMBICORT RAPIHALER devra être le plus long possible.
Précaution avec certaines pathologies
SYMBICORT RAPIHALER doit être administré avec précaution chez les patients présentant les pathologies suivantes : thyrotoxicose, phéochromocytome, diabète sucré, hypokaliémie non traitée, cardiomyopathie obstructive, sténose aortique sous-valvulaire idiopathique, hypertension artérielle sévère, anévrisme ou autres troubles cardiovasculaires graves, telle que cardiopathie ischémique, tachyarythmies ou insuffisance cardiaque sévère.
La prudence est requise chez les patients présentant un prolongement de l'intervalle QTc. Le formotérol peut lui-même induire un prolongement de l’intervalle QTc.
Une hypokaliémie susceptible d’entraîner des conséquences graves peut être observée après administration de doses élevées de β2 mimétiques. L’administration concomitante de β2 mimétiques avec des médicaments ayant un effet hypokaliémiant ou pouvant potentialiser cet effet comme les dérivés xanthiques, les corticoïdes ou les diurétiques peut induire une augmentation du risque d’hypokaliémie. Il est recommandé de surveiller la kaliémie dans tous ces cas.
Comme avec tous les β2 mimétiques, des contrôles supplémentaires de la glycémie peuvent être justifiés chez les patients diabétiques.
L’intérêt de la corticothérapie inhalée devra être réévalué en cas de tuberculose pulmonaire active ou quiescente et d’infections fongique ou virale des voies aériennes.Une perturbation visuelle peut être signalée lors d’une utilisation systémique et topique de corticoïdes. Si un patient présente des symptômes tels qu’une vision trouble ou d'autres troubles visuels, le patient doit être dirigé vers un ophtalmologiste afin d'évaluer les causes possibles, ce qui peut inclure la cataracte, le glaucome ou des maladies rares et des maladies telles que la Choriorétinopathie Séreuse Centrale (CRSC), qui ont été rapportés après utilisation de corticoïdes systémiques et topiques.
Fonction surrénalienne
La corticothérapie orale de supplémentation ne doit pas être arrêtée brusquement.
Un traitement prolongé par corticoïdes inhalés à doses élevées, notamment à des doses supérieures à celles recommandées, peut également entraîner une insuffisance surrénale cliniquement significative. Une corticothérapie de supplémentation adaptée peut s’avérer nécessaire dans les situations de stress telles qu’une infection sévère ou une intervention chirurgicale. La réduction rapide de la dose de corticoïdes peut induire une insuffisance surrénale aigue. Les symptômes et les signes d’une insuffisance surrénale aigue peuvent être non spécifiques : anorexie, douleurs abdominales, perte de poids, fatigue, céphalées, nausées, vomissements, perte de connaissance, convulsions, hypotension et hypoglycémie.
Bronchospasme paradoxal
Comme avec d’autres produits inhalés, un bronchospasme paradoxal peut survenir, se manifestant par une augmentation des sifflements bronchiques et une dyspnée immédiatement après la prise. Le bronchospasme paradoxal sera traité avec un bronchodilatateur d’action rapide qui devra être administré immédiatement. La survenue d’un bronchospasme paradoxal doit conduire à un arrêt du traitement par SYMBICORT et à un examen clinique du patient. La conduite thérapeutique devra être réévaluée pour envisager si nécessaire les alternatives thérapeutiques (voir rubrique 4.8).
Patients présentant une bronchopneumopathie chronique obstructive (BPCO)
Il n'a pas été conduit d'étude clinique chez des patients présentant une BPCO et ayant un VEMS pré-bronchodilatateur >50% de la valeur théorique et un VEMS post-bronchodilatateur <70% de la valeur théorique (voir rubrique 5.1).
Une augmentation de l’incidence des cas de pneumonie, ayant ou non nécessité une hospitalisation, a été observée chez les patients présentant une BPCO et recevant une corticothérapie inhalée. Bien que cela ne soit pas formellement démontré dans toutes les études cliniques disponibles, ce risque semble augmenter avec la dose de corticoïde administré.
Les données disponibles ne permettent pas de considérer que le niveau du risque de survenue de pneumonie varie en fonction du corticostéroïde inhalé utilisé.
Il convient de rester vigilant chez les patients présentant une BPCO, les symptômes de pneumonie pouvant s'apparenter aux manifestations cliniques d'une exacerbation de BPCO.
Le tabagisme, un âge avancé, un faible indice de masse corporelle (IMC) ainsi que la sévérité de la BPCO sont des facteurs de risques de survenue de pneumonie.
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
Interactions pharmacocinétiques
Une augmentation significative des taux sanguins de budésonide peut être observée avec les inhibiteurs puissants du CYP3A4 (ex : kétoconazole, itraconazole, voriconazole, posaconazole, clarithromycine, télithromycine, néfazodone et inhibiteurs des protéases du VIH). La prise concomitante de ces médicaments doit être évitée. Si cette association ne peut être évitée, un intervalle de temps suffisamment long devra être respecté entre l’administration de l’inhibiteur du CYP3A4 et celle du budésonide (voir rubrique 4.4).
Les concentrations plasmatiques de budésonide ont été 6 fois plus importantes lors de l’administration concomitante de budésonide par voie orale (dose unique de 3 mg) et de kétoconazole 200 mg une fois par jour. Lorsque le kétoconazole était administré 12 heures après le budésonide, les concentrations plasmatiques du budésonide n’étaient augmentées que d'un facteur 3, traduisant une interaction pharmacocinétique moindre lorsque les produits sont administrés à distance. Des données limitées avec le budésonide administré à forte dose indiquent également une augmentation significative des taux plasmatiques de budésonide (en moyenne d’un facteur 4) lors de l'administration concomitante d’itraconazole 200 mg en une prise par jour et de budésonide inhalé (en une dose unique de 1000 μg).
Interactions pharmacodynamiques
Les bêta-bloquants peuvent diminuer ou inhiber les effets du formotérol. Sauf en cas de nécessité absolue, l'administration de bêta-bloquants (y compris en collyres) doit être évitée au cours du traitement par SYMBICORT RAPIHALER.
L'administration concomitante de quinidine, de disopyramide, de procaïnamide, de phénothiazine et d'antidépresseurs tricycliques peut favoriser l’allongement de l'intervalle QTc et majorer le risque d'arythmies ventriculaires.
De plus, la L-Dopa, la L-thyroxine, l'ocytocine et l'alcool peuvent diminuer la tolérance cardiaque aux β2 mimétiques.
L'administration concomitante d'IMAO, ou de produits ayant des propriétés similaires tels que la furazolidone et la procarbazine, peut favoriser les poussées hypertensives.
Le risque d'arythmie est augmenté chez les patients recevant des anesthésiques volatils halogénés.
L'administration concomitante d'autres bêta-adrénergiques ou d’anticholinergiques peut potentialiser les effets de ces bronchodilatateurs.
L’existence d’une hypokaliémie augmente le risque d’arythmie chez les patients recevant un traitement par des digitaliques.
4.6. Fertilité, grossesse et allaitement
Grossesse
Il n’y a pas de données fiables concernant l'utilisation du formotérol chez la femme enceinte. Au cours des études animales, le formotérol a entraîné des effets toxiques lors d’expositions systémiques très élevées (voir rubrique 5.3).
Les données disponibles pour environ deux mille grossesses, n’ont pas révélé d’augmentation du risque tératogène associé à l’utilisation du budésonide inhalé. Chez l’animal, les glucocorticoïdes induisent des malformations (voir rubrique 5.3). Toutefois ces observations ne semblent pas pertinentes chez la femme enceinte aux doses thérapeutiques.
Chez l'animal l’administration de glucocorticoïdes à doses élevées mais inférieures aux doses tératogènes pendant la période prénatale a entraîné un risque accru de retard de croissance intra-utérine et de maladies cardiovasculaires à l'âge adulte, une modification permanente de la densité en glucorécepteurs, une altération de la recapture des neuromédiateurs et des modifications du comportement.
SYMBICORT RAPIHALER ne sera utilisé chez la femme enceinte que si nécessaire.
Allaitement
Le budésonide est excrété dans le lait maternel. Toutefois, aux doses thérapeutiques, il n’est pas attendu de retentissement sur l’enfant allaité. En clinique humaine, aucune donnée n’est disponible sur le passage du formotérol dans le lait maternel. Chez le rat, de faibles quantités de formotérol ont été retrouvées dans le lait. En conséquence, l’utilisation de SYMBICORT RAPIHALER au cours de l’allaitement ne sera envisagée que si nécessaire.
Fertilité
Il n’y a pas de données disponibles sur l’effet potentiel du budésonide sur la fertilité. Les études de reproduction chez l’animal avec le formotérol ont montré une tendance à la diminution de la fertilité chez les rats mâles lors d’une forte exposition systémique (voir rubrique 5.3).
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
SYMBICORT RAPIHALER n'a pas d’influence, ou une influence négligeable sur l’aptitude à conduire des véhicules ou à utiliser des machines.
SYMBICORT RAPIHALER contenant du budésonide et du formotérol, les effets indésirables sont les mêmes que ceux observés avec chacun des principes actifs. Il n'a pas été observé d'augmentation de la fréquence des effets indésirables suite à l'administration concomitante des deux principes actifs. Les évènements les plus fréquemment observés sont ceux qui sont liés à l’effet β2 mimétique, tels que tremblements et palpitations. Ils sont le plus souvent transitoires et régressent lors de la poursuite du traitement.
Les événements indésirables imputables au budésonide ou au formotérol sont présentés ci-après par classe-organe et par fréquence. Les fréquences sont définies telles que : très fréquents (≥ 1/10), fréquents (≥ 1/100 et < 1/10), peu fréquents (≥ 1/1000 et < 1/100), rares (≥ 1/10 000 et < 1/1000) et très rares (< 1/10 000).
Tableau 1
|
Classe de systèmes d’organes |
Fréquence |
Effets indésirables |
|
Infections et infestations |
Fréquent |
Candidose oro-pharyngée, pneumonie (chez les patients atteints de BPCO) |
|
Troubles du système immunitaire |
Rare |
Réactions d’hypersensibilité immédiate et retardée, telles que : exanthème, urticaire, prurit, dermatite, angioedème et réaction anaphylactique |
|
Troubles endocriniens |
Très rare |
Signes ou symptômes d’effets systémiques des glucocorticoïdes tels que : Syndrome de Cushing, inhibition des fonctions surrénaliennes, retard de croissance, diminution de la densité minérale osseuse |
|
Troubles du métabolisme et de la nutrition |
Rare |
Hypokaliémie |
|
Très rare |
Hyperglycémie |
|
|
Troubles psychiatriques |
Peu fréquent |
Agressivité, hyperactivité psychomotrice, anxiété, troubles du sommeil |
|
Très rare |
Dépression, troubles du comportement (principalement chez les enfants) |
|
|
Troubles du système nerveux |
Fréquent |
Céphalées, tremblements |
|
Peu fréquent |
Etourdissements |
|
|
Très rare |
Dysgueusie |
|
|
Troubles oculaires |
Très rare |
Cataracte et glaucome |
|
Peu fréquent |
Vision trouble (voir section 4.4) |
|
|
Troubles cardiaques |
Fréquent |
Palpitations |
|
Peu fréquent |
Tachycardie |
|
|
Rare |
Arythmies cardiaques telles que : fibrillation auriculaire, tachycardie supraventriculaire, extrasystoles |
|
|
Très rare |
Angor, allongement de l’intervalle QTc |
|
|
Troubles vasculaires |
Très rare |
Variation de la pression artérielle |
|
Troubles respiratoires, thoraciques et médiastinales |
Fréquent |
Irritation légère de la gorge, toux, dysphonie incluant la raucité de la voix |
|
Rare |
Bronchospasme |
|
|
Troubles gastro-intestinaux |
Peu fréquent |
Nausées |
|
Troubles de la peau et du tissu sous-cutané |
Peu fréquent |
Ecchymoses |
|
Troubles musculo-squelettiques et systémiques |
Peu fréquent |
Crampes musculaires |
La survenue de candidoses oropharyngées est liée à un dépôt du médicament sur les muqueuses. Afin de réduire leur risque d’apparition, il doit être recommandé au patient de se rincer la bouche à l’eau après chaque dose. En général, la candidose oropharyngée peut être traitée par un antifongique local sans qu’il soit nécessaire d’arrêter le traitement par corticoïde inhalé.
Comme avec les autres produits inhalés, un bronchospasme paradoxal peut survenir dans de très rares cas (chez moins de 1 personne sur 10 000) se manifestant par une augmentation du sifflement bronchique et une dyspnée à la suite de l’inhalation du produit. Le bronchospasme paradoxal sera traité avec un bronchodilatateur d’action rapide qui devra être administré immédiatement. La survenue d’un bronchospasme paradoxal doit conduire à un arrêt du traitement par SYMBICORT RAPIHALER et à un examen clinique du patient. La conduite thérapeutique devra être réévaluée pour envisager si nécessaire les alternatives thérapeutiques (voir rubrique 4.4).
La corticothérapie inhalée peut entraîner des effets systémiques, en particulier lors de traitements prolongés à fortes doses. La survenue de ces effets est néanmoins beaucoup moins probable qu’au cours d’une corticothérapie orale. Les effets systémiques possibles incluent : syndrome de Cushing, tableau Cushingoïde, freination de la fonction surrénalienne, retard de croissance chez l’enfant et l’adolescent, diminution de la densité minérale osseuse, cataracte et glaucome. Une susceptibilité accrue aux infections et une diminution de la capacité à s’adapter aux situations de stress peuvent également être observées. Ces effets sont probablement dépendants de la dose, de la durée d’exposition, d’un traitement concomitant ou antérieur par corticostéroïdes et varient en fonction de la sensibilité individuelle.
Le traitement par β2 mimétique peut entraîner une augmentation des taux sanguins d’insuline, d’acides gras libres, glycérol et corps cétoniques.
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr/.
L’administration de 90 microgrammes sur 3 heures chez des patients ayant une obstruction bronchique n’a pas entraîné de conséquences cliniques en termes de sécurité.
Un surdosage aigu en budésonide, même à dose très élevée, ne constitue pas une urgence vitale. L’administration chronique de doses supérieures aux doses recommandées entraîne le risque d’apparition d’effets glucocorticoïdes systémiques, tels que hypercorticisme et freination surrénalienne.
Si le traitement par SYMBICORT RAPIHALER doit être interrompu en raison d’un surdosage du composant formotérol, le remplacement par un traitement corticoïde inhalé approprié doit être envisagé.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Mécanisme d’action
SYMBICORT contient 2 principes actifs de mécanisme d’action différents (formotérol et budésonide) exerçant un effet additif sur la diminution des exacerbations de la BPCO.
Effets pharmacodynamiques
Budésonide
Le budésonide est un glucocorticoïde, qui, lorsqu’il est inhalé, exerce un effet anti-inflammatoire dose-dépendant au niveau des voies aériennes, résultant en une diminution des symptômes et des exacerbations de la BPCO. Le budésonide par voie inhalée a moins d’effets indésirables sévères que les corticoïdes administrés par voie générale. Le mécanisme d’action exact à l’origine de l’effet anti-inflammatoire exercé par les glucocorticoïdes n’est pas connu.
Formotérol
Le formotérol est un agoniste sélectif des récepteurs β2 adrénergiques qui, lorsqu’il est inhalé, entraîne une relaxation rapide et de longue durée des muscles lisses bronchiques chez les patients présentant une broncho-constriction réversible. L’effet bronchodilatateur est dose-dépendant et se produit dans les 1 à 3 minutes. La durée de l’effet après administration d’une dose unique persiste pendant au moins 12 heures.
Efficacité et sécurité clinique
L’efficacité et la sécurité clinique de SYMBICORT RAPIHALER 200/6 microgrammes, suspension pour inhalation en flacon pressurisé, ont été évaluées dans le traitement de la BPCO dans 2 études de 12 mois (Études 001 et 003) et une étude de 6 mois (Étude 002). SYMBICORT RAPIHALER 200/6 microgrammes administré à la dose de 2 inhalations 2 fois par jour a été comparé à la dose correspondante de 6 microgrammes de fumarate de formotérol dihydraté (soit 2 inhalations 2 fois par jour) dans les Études 001, 002 et 003 et la dose correspondante de 200 microgrammes de budésonide (soit 2 inhalations 2 fois par jour) dans l’Étude 002.
Les critères principaux d’évaluation étaient le VEMS pré-dose mesuré avant administration du traitement et le VEMS post-dose, mesuré 1h après l’administration (Études 001 et 002) ainsi que les exacerbations de BPCO (Étude 003). Un total de 4887 patients présentant une BPCO modérée à sévère ont été randomisés dans 3 essais dans lesquels 1178 patients étaient traités par SYMBICORT RAPIHALER 200/6 microgrammes. Le critère d’inclusion pour les 3 études était un VEMS pré-bronchodilatateur <50% de la valeur théorique. A l’inclusion, la valeur médiane du VEMS pré-bronchodilatateur était de 39 % de la valeur théorique.
Dans les Études 001 et 002, l'augmentation moyenne du VEMS post-dose était supérieure dans le groupe traité par SYMBICORT RAPIHALER 200/6 microgrammes comparativement au placebo (respectivement 180 mL et 170 mL) ainsi que celle du VEMS pré-dose (respectivement 90 mL et 80 mL).
Dans les Études 001 et 002, l'augmentation moyenne du VEMS post-dose dans le groupe traité par SYMBICORT RAPIHALER 200/6 microgrammes comparativement au groupe traité par formotérol (respectivement 30 mL et 40 mL) ainsi que celle du VEMS pré-dose (respectivement 40 mL et 40 mL).
Dans l’étude de 12 mois (001), le taux d'exacerbations sévères (définies comme une aggravation de la BPCO nécessitant l’utilisation de corticoïdes oraux et/ou une hospitalisation) était significativement réduit dans le groupe traité par SYMBICORT RAPIHALER 200/6 microgrammes de 37 % comparativement au placebo (p<0,001) et de 25 % comparativement au formotérol (p=0,004). Le risque de survenue de la première exacerbation était réduit de 34 % comparativement au placebo (p<0,001) et de 23 % comparativement au formotérol (p=0,015).
Dans les 2 études, la dyspnée, la consommation quotidienne de bronchodilatateurs utilisés en traitements dits "de secours", les réveils nocturnes et la qualité de vie en relation avec l'état de santé (mesurée à l'aide du score total du questionnaire respiratoire de St-George) étaient significativement améliorés dans le groupe Symbicort comparativement au groupe placebo.
Des mesures répétées du VEMS sur 12 heures ont été réalisées dans des sous-groupes de patients dans les 2 Études 001 et 002. Le temps médian d'apparition de la bronchodilatation (>15% d’amélioration du VEMS) était de 5 minutes dans le groupe de patients recevant du SYMBICORT RAPIHALER 200/6 microgrammes. L’amélioration maximale du VEMS survenait approximativement au bout de 2 heures après l'administration et l’effet bronchodilatateur post-dose était généralement maintenu pendant 12 heures.
Dans une deuxième étude de 12 mois (003), Le nombre d'exacerbations sévères était significativement réduit de 35% dans le groupe traité par SYMBICORT RAPIHALER 200/6 microgrammes comparativement au formotérol (p<0,001) et le risque de première exacerbation était réduit de 21% (p=0,026).
Le traitement a été bien toléré. L’évaluation de la tolérance des 3 essais a révélé un profil de sécurité pour SYMBICORT RAPIHALER qui correspondait à celui de SYMBICORT TURBUHALER ainsi qu'à celui du budésonide et du formotérol administré seul.
Population pédiatrique
Il n’y a pas d’utilisation justifiée de SYMBICORT RAPIHALER 200/6 microgrammes chez les enfants ou adolescents dans le traitement symptomatique de la BPCO.
5.2. Propriétés pharmacocinétiques
Après administration de SYMBICORT RAPIHALER 200/6 microgrammes, suspension pour inhalation en flacon pressurisé, à la dose de 2 ou 4 inhalations 2 fois par jour pendant 5 jours chez des sujets sains, la concentration plasmatique du budésonide a augmenté en moyenne proportionnellement à la dose. Le taux d'accumulation dans le groupe ayant reçu 2 inhalations 2 fois par jour était de 1,32 pour le budésonide et de 1,77 pour le formotérol.
Dans une étude en dose unique, 12 inhalations de SYMBICORT 100/6 microgrammes, suspension pour inhalation en flacon pressurisé, ont été administrées à des patients présentant une BPCO. Le pic de concentration plasmatique moyen de 3,3 nmol/L de budésonide a été atteint 30 minutes après l’administration et le pic de concentration plasmatique moyen de 167 pmol/L de formotérol a été rapidement atteint en 15 minutes après l’administration.
Dans une étude en dose unique, 8 inhalations de SYMBICORT RAPIHALER 200/6 microgrammes, suspension pour inhalation en flacon pressurisé et de SYMBICORT TURBUHALER 200/6 microgrammes (soit une dose totale de 1280/36 microgrammes) ont été administrées à des volontaires sains. Les concentrations sanguines de principes actifs étaient comparables entre SYMBICORT RAPIHALER, suspension pour inhalation en flacon pressurisé, et SYMBICORT TURBUHALER. L’aire sous la courbe du budésonide mesuré après administration de SYMBICORT RAPIHALER, suspension pour inhalation en flacon pressurisé, correspondait à 90% de celle du comparateur SYMBICORT TURBUHALER. L’aire sous la courbe du formotérol, après administration de SYMBICORT RAPIHALER, (suspension pour inhalation en flacon pressurisé, correspondait à 116 % de celle du comparateur SYMBICORT TURBUHALER.
L’exposition systémique du budésonide et du formotérol de SYMBICORT RAPIHALER 200/6 microgrammes (suspension pour inhalation en flacon pressurisé) avec et sans la chambre d’inhalation AeroChamber Plus Flow Vu a été évaluée dans une étude menée chez des volontaires sains.
L’exposition systémique totale de SYMBICORT RAPIHALER (suspension pour inhalation en flacon pressurisé), administré à l’aide de la chambre d’inhalation AeroChamber Plus Flow Vu était augmentée comparée à une administration sans chambre d’inhalation, avec une ASC moyenne de 68% et 77% plus élevée pour le budésonide et le formotérol, respectivement. Cependant, les augmentations les plus importantes d’exposition avec la chambre d’inhalation ont été observées chez des sujets montrant une exposition faible sans chambre d’inhalation (due le plus probablement à une mauvaise technique d’inhalation).
Il n’a pas été mis en évidence d’interactions pharmacocinétiques entre le budésonide et le formotérol.
Distribution
La liaison aux protéines plasmatiques est d'environ 50% pour le formotérol et 90% pour le budésonide. Le volume de distribution est d'environ 4 l/kg pour le formotérol et 3 l/kg pour le budésonide.
Biotransformation
Le formotérol est métabolisé par conjugaison (formation de métabolites actifs O-déméthylés et de métabolites déformylés, qui sont essentiellement retrouvés sous forme de conjugués inactifs). Le budésonide subit une métabolisation importante (environ 90%) en composé d’action glucocorticoïde réduite par effet de premier passage hépatique. L'activité glucocorticoïde des métabolites les plus importants, 6 bêta-hydroxy-budésonide et 16 alpha-hydroxy-prednisolone, est de moins de 1% de celle du budésonide. Il n’y a pas d’éléments en faveur d’interactions métaboliques ou de déplacement des liaisons aux protéines plasmatiques entre le formotérol et le budésonide.
Élimination
Le formotérol est essentiellement métabolisé par voie hépatique avant élimination urinaire. Après inhalation, 8 à 13% de la dose délivrée de formotérol est excrétée dans les urines sous forme inchangée. La clairance plasmatique du formotérol est élevée (environ 1,4 l/min), et sa demi-vie d'élimination tardive est en moyenne de 17 heures.
Le budésonide est métabolisé principalement par l’isoenzyme CYP3A4. Les métabolites du budésonide sont éliminés dans les urines en partie sous forme conjuguée. Le budésonide est retrouvé en quantité négligeable sous forme inchangée. La clairance plasmatique du budésonide est élevée (environ 1,2 l/min) et la demi-vie d'élimination après administration intraveineuse est en moyenne de 4 heures.
Les paramètres pharmacocinétiques du formotérol et du budésonide ne sont pas établis chez les patients insuffisants rénaux. Les expositions systémiques au budésonide et au formotérol peuvent être augmentées en cas d’insuffisance hépatique.
Linéarité/non-linéarité
L’exposition systémique au budésonide et au formotérol est corrélée de façon linéaire à la dose administrée.
5.3. Données de sécurité préclinique
Chez l’animal, la toxicité du budésonide et du formotérol administrés séparément ou en association, est liée à une exacerbation de l’effet pharmacologique.
Des malformations ont été observées au cours des études de reproduction menées chez l’animal, avec les glucocorticoïdes tels que le budésonide (fente palatine, malformations squelettiques). Toutefois, ces résultats expérimentaux observés chez l’animal ne sont pas extrapolables à l’homme aux doses recommandées.
Les études de reproduction menées avec le formotérol chez l’animal, ont mis en évidence une tendance à la réduction de la fertilité du rat mâle lorsque l’exposition systémique était élevée. Des pertes implantatoires, une diminution du taux de survie post-natale précoce ainsi qu’une diminution du poids de naissance ont également été observés lorsque les expositions systémiques étaient très supérieures à celles observées en clinique. Ces résultats expérimentaux observés chez l’animal ne semblent pas pertinents chez l’homme.
Les données précliniques sur le gaz propulseur HFA 227 ne contenant pas de CFC ne révèlent aucun risque particulier pour l’homme sur la base d’études conventionnelles de pharmacologie de sécurité, de toxicité après administrations de doses répétées, de génotoxicité, de cancérogénicité et de la toxicité sur la reproduction et le développement.
Povidone
Macrogol 1000
Après première ouverture : 3 mois.
6.4. Précautions particulières de conservation
Remettre en place le capuchon de l’embout buccal fermement après utilisation.
Comme pour beaucoup de médicaments inhalés en flacon pressurisé, l’effet thérapeutique de ce médicament diminue quand le flacon est froid. Ce médicament doit être maintenu à température ambiante avant son utilisation. La cartouche contient un liquide pressurisé. Ne pas exposer à des températures supérieures à 50°C. Ne pas percer la cartouche. La cartouche ne doit pas être cassée, percée ou brûlée, même si elle semble vide.
6.5. Nature et contenu de l'emballage extérieur
La suspension est contenue dans une cartouche recouverte intérieurement d’aluminium et dotée d’une valve doseuse et d’un indicateur de doses. Le flacon est placé dans un inhalateur en plastique rouge muni d’un embout buccal en plastique blanc recouvert d’un capuchon de couleur grise. Après le premier amorçage, chaque inhalateur délivre 120 inhalations (bouffées) de budésonide/fumarate de formotérol dihydraté 200/6 microgrammes. Chaque inhalateur est enveloppé individuellement dans un sachet en aluminium laminé contenant un agent dessicant.
6.6. Précautions particulières d’élimination et de manipulation
Pas d’exigences particulières pour l’élimination.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
Tour Carpe Diem
31 place des Corolles
92400 COURBEVOIE
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· 34009 300 598 7 6 : 1 flacon(s) pressurisé(s) aluminium de 120 doses avec valve(s) doseuse(s) avec embout(s) buccal (aux)
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
[À compléter ultérieurement par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE
[À compléter ultérieurement par le titulaire]
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Liste I.
ANSM - Mis à jour le : 28/11/2024
SYMBICORT RAPIHALER 200/6 microgrammes par dose, suspension pour inhalation en flacon pressurisé
Budésonide/Fumarate de formotérol dihydraté
Veuillez lire attentivement cette notice avant d’utiliser ce médicament car elle contient des informations importantes pour vous.
· Gardez cette notice. Vous pourriez avoir besoin de la relire.
· Si vous avez d’autres questions, interrogez votre médecin, ou votre pharmacien.
· Ce médicament vous a été personnellement prescrit. Ne le donnez pas à d’autres personnes. Il pourrait leur être nocif, même si les signes de leur maladie sont identiques aux vôtres.
· Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin, ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
2. Quelles sont les informations à connaître avant d'utiliser SYMBICORT RAPIHALER 200/6 microgrammes par dose, suspension pour inhalation en flacon pressurisé ?
3. Comment utiliser SYMBICORT RAPIHALER 200/6 microgrammes par dose, suspension pour inhalation en flacon pressurisé ?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver SYMBICORT RAPIHALER 200/6 microgrammes par dose, suspension pour inhalation en flacon pressurisé ?
6. Contenu de l’emballage et autres informations.
1. QU’EST-CE QUE SYMBICORT RAPIHALER 200/6 microgrammes par dose, suspension pour inhalation en flacon pressurisé ET DANS QUELS CAS EST-IL UTILISE ?
SYMBICORT RAPIHALER 200/6 microgrammes par dose, suspension pour inhalation en flacon pressurisé est un inhalateur qui est utilisé dans le traitement symptomatique de la bronchopneumopathie chronique obstructive (BPCO) chez les adultes âgés de 18 ans et plus. La BPCO est une maladie chronique des voies aériennes du poumon souvent causée par le tabagisme. Symbicort contient deux substances actives différentes : le budésonide et le fumarate de formotérol dihydraté.
· Le budésonide est un « corticoïde ». Il agit en diminuant l’inflammation dans vos poumons.
· Le formotérol est un « bêta2-agoniste de longue durée d’action » ou « bronchodilatateur ». Il agit en relâchant les muscles qui entourent vos bronches ; ce qui vous aide à respirer plus facilement.
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT D’UTILISER 200/6 microgrammes par dose, suspension pour inhalation en flacon pressurisé ?
N’utilisez jamais SYMBICORT RAPIHALER 200/6 microgrammes par dose, suspension pour inhalation en flacon pressurisé :
· si vous êtes allergique au budésonide, au formotérol ou à l’un des autres composants contenus dans ce médicament, mentionnés dans la rubrique 6.
Avertissements et précautions
Adressez-vous à votre médecin ou pharmacien avant d’utiliser SYMBICORT si :
· vous êtes diabétique.
· vous avez une infection pulmonaire.
· vous êtes hypertendu ou vous avez eu un problème cardiaque (tels que des battements irréguliers du cœur, un pouls trop rapide, un rétrécissement du calibre des artères ou une insuffisance cardiaque).
· vous avez des problèmes de thyroïde ou de glandes surrénales.
· vous avez un taux de potassium sanguin trop bas.
· vous avez des problèmes hépatiques sévères.
Contactez votre médecin si vous développez une vision trouble ou d'autres troubles visuels.
SYMBICORT RAPIHALER n’est pas recommandé chez les enfants et les adolescents âgés de moins de 18 ans.
Autres médicaments et SYMBICORT RAPIHALER 200/6 microgrammes par dose, suspension pour inhalation en flacon pressurisé
Informez votre médecin ou pharmacien si vous utilisez, avez récemment utilisé ou pourriez utiliser tout autre médicament.
En particulier, indiquez à votre médecin, si vous utilisez l’un des médicaments suivants :
· les médicaments destiné à traiter les battements cardiaques trop rapides ou irréguliers (tels que la quinidine),
· les médicaments à base de digoxine, généralement utilisés pour traiter l’insuffisance cardiaque,
· les diurétiques (comme le furosémide) qui sont utilisés dans le traitement de l’hypertension,
· les corticoïdes oraux (comme la prednisolone),
· les dérivés xanthiques (comme les médicaments à base de théophylline ou d’aminophylline) qui sont souvent utilisés dans le traitement de la BPCO ou de l’asthme,
· les autres médicaments bronchodilatateurs (comme par exemple le salbutamol),
· les antidépresseurs tricycliques (comme par exemple l’amitriptyline) et l’antidépresseur néfazodone,
· les phénothiazines (comme la chlorpromazine et la prochlorperazine),
· les médicaments inhibiteurs de protéase du virus VIH (comme le ritonavir) utilisés pour le traitement des infections au VIH,
· les médicaments destinés au traitement de certaines infections (comme par exemple le ketoconazole, l’itraconazole, le voriconazole, le posaconazole, la clarithromycine et la télithromycine),
· les médicaments utilisés pour le traitement de la maladie de Parkinson (comme par exemple la lévodopa),
· les médicaments utilisés pour les problèmes de thyroïde (comme la levothyroxine).
Si vous prenez l’un de ces médicaments, ou en cas de doute, parlez-en à votre médecin ou à votre pharmacien avant d’utiliser SYMBICORT.
Informez également votre médecin ou votre pharmacien si vous devez avoir une anesthésie pour une opération chirurgicale ou des soins dentaires.
SYMBICORT RAPIHALER 200/6 microgrammes par dose, suspension pour inhalation en flacon pressurisé avec des aliments, boissons et de l’alcool
Sans objet.
Grossesse, allaitement et fertilité
Grossesse
Ce médicament ne sera utilisé pendant la grossesse que suivant la prescription de votre médecin. Si vous découvrez que vous êtes enceinte pendant le traitement n’arrêtez pas de prendre SYMBICORT mais consultez votre médecin car lui seul peut juger du traitement le mieux adapté à votre cas.
Demandez conseil à votre médecin ou à votre pharmacien avant de prendre tout médicament.
Allaitement
Demandez conseil à votre médecin ou à votre pharmacien avant de prendre tout médicament.
Sportifs
Sans objet.
Conduite de véhicules et utilisation de machines
SYMBICORT RAPIHALER 200/6 microgrammes par dose, suspension pour inhalation en flacon pressurisé contient : Sans objet.
3. COMMENT UTILISER SYMBICORT RAPIHALER 200/6 microgrammes par dose, suspension pour inhalation en flacon pressurisé ?
· Il est important d’utiliser SYMBICORT tous les jours, même pendant les périodes où vous n’avez pas de symptômes de BPCO.
La dose usuelle est de 2 inhalations (bouffées) 2 fois par jour. SYMBICORT RAPIHALER n’est pas recommandé chez les enfants et les adolescents de moins de 18 ans
Si vous prenez des corticoïdes en comprimés par voie orale pour traiter votre BPCO, votre médecin réduira progressivement le nombre de ces comprimés lorsque vous commencerez à prendre SYMBICORT. Si vous avez été traité par corticoïdes oraux en comprimés pendant une longue période au préalable, il se peut que votre médecin vous prescrive des examens sanguins réguliers. Pendant la période où les comprimés sont progressivement diminués, il se peut que vous ressentiez une sensation de malaise général, alors même que les symptômes d’asthme s’améliorent. Il se peut également que des symptômes d'allergies tels que rhinites (sensation de nez bouché ou écoulement nasal) ou éruption cutanée (eczéma) réapparaissent. De même, vous pouvez ressentir une faiblesse, des douleurs musculaires ou articulaires. Si ces symptômes sont gênants ou s’il apparait des maux de tête, une sensation de fatigue anormale, des nausées ou vomissements, contactez votre médecin immédiatement. Vous pourriez avoir besoin d’un autre traitement pour traiter les symptômes allergiques ou articulaires. Consultez votre médecin qui vous dira si vous devez continuer à prendre SYMBICORT.
En cas d’évènements particuliers tels que la survenue d’une infection respiratoire ou avant une intervention chirurgicale, votre médecin peut être amené à vous prescrire des corticoïdes en comprimés en plus de votre traitement habituel.
Informations importantes concernant la BPCO
Si vous êtes essoufflé ou si votre respiration devient de plus en plus difficile au cours du traitement par SYMBICORT, vous devez continuer à prendre SYMBICORT et consulter votre médecin le plus rapidement possible. Un traitement supplémentaire peut s’avérer nécessaire.
Contactez rapidement votre médecin :
· si votre difficulté à respirer s’intensifie ou que les symptômes vous réveillent la nuit
· si vous ressentez une oppression dans la poitrine le matin ou que cette sensation se prolonge.
Ces symptômes peuvent signifier que votre BPCO n’est pas correctement contrôlée et il se peut que vous ayez besoin d’un traitement différent ou supplémentaire immédiatement.
Il se peut que votre médecin vous prescrive d’autres médicaments bronchodilatateurs, par exemple des anticholinergiques (tels que le tiotropium ou le bromure d’ipratropium) pour votre BPCO.
Information sur votre SYMBICORT RAPIHALER
· Avant de commencer à utiliser votre SYMBICORT RAPIHALER, enlevez-le de l’emballage. Jetez l’emballage ainsi que l’agent dessicant qui est à l’intérieur de l’emballage. Si le sachet de l’agent dessicant est endommagé, ne pas utiliser le dispositif d’inhalation.
· Après avoir enlevé le dispositif d’inhalation de son emballage, vous devez l’utiliser dans les 3 mois. Ecrivez la date de fin d’utilisation (3 mois à partir de l’ouverture de l’emballage) sur l’étiquette du dispositif d’inhalation pour vous rappeler quand arrêter son utilisation.
· Votre dispositif d’inhalation est présenté sur le dessin ci-dessous. Le dispositif d’inhalation sera déjà assemblé quand vous le recevrez. Ne le démontez pas. Si la cartouche se détache, remettez-la dans le dispositif d’inhalation et continuez d’utiliser celui-ci.
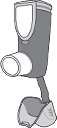
|
|
Préparation de votre SYMBICORT RAPIHALER
Vous devez préparer votre dispositif d’inhalation pour son utilisation dans les situations suivantes :
· si vous l’utilisez pour la première fois.
· si vous ne l’avez pas utilisé depuis plus de 7 jours
· s’il est tombé.
Pour préparer votre dispositif d’inhalation à l’utilisation, suivez les instructions suivantes :
1. agitez bien le dispositif d’inhalation pendant au moins 5 secondes pour mélanger le contenu dans la cartouche
2. enlevez le capuchon de l’embout buccal en exerçant une légère pression de chaque côté du capuchon de l’embout buccal ; la lanière du capuchon restera attachée au dispositif d’inhalation.
3. tenez le dispositif d’inhalation en position verticale ; appuyer sur l’indicateur de doses (sur le haut de l’inhalateur), pour libérer une bouffée dans l’air. Vous pouvez utiliser une ou deux mains, comme indiqué sur les dessins.
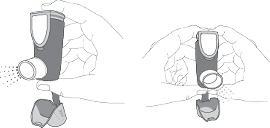 |
4. enlevez votre (vos) doigt(s) de l’indicateur de doses,
5. attendez 10 secondes, agitez bien et recommencez ensuite les étapes 3 et 4,
6. votre dispositif d’inhalation est maintenant prêt à l’emploi.
Comment prendre une dose de votre médicament
Chaque fois que vous devez prendre une dose, suivez les instructions suivantes :
1. agitez bien le dispositif d’inhalation pendant au moins 5 secondes pour mélanger le contenu dans la cartouche.
2. enlevez le capuchon de l’embout buccal en exerçant une légère pression sur les côtés de celui-ci ; vérifiez que l’embout buccal n’est pas bloqué.
3. tenez le dispositif d’inhalation en position verticale (en utilisant une ou deux mains). Expirez doucement.
 4. placez l’embout buccal doucement entre vos dents ; fermez les lèvres.
4. placez l’embout buccal doucement entre vos dents ; fermez les lèvres.
5. commencez à inspirer lentement et profondément par la bouche; appuyer fermement sur le haut du dispositif d’inhalation (au niveau de l’indicateur de doses) pour libérer une bouffée de médicament. Continuez à inspirer pendant quelques instants après avoir appuyé sur l’indicateur de doses. L’inspiration et l’appui sur l’indicateur de doses doivent être réalisés en même temps pour que le médicament atteigne vos poumons.
6. retenez votre respiration pendant 10 secondes ou aussi longtemps que vous le pouvez.
7. avant d’expirer, enlevez votre doigt de l’indicateur de doses et retirez le dispositif d’inhalation de votre bouche ; maintenez le dispositif d’inhalation en position verticale.
8. expirez ensuite lentement. Pour prendre une autre inhalation, agitez bien l’inhalateur pendant au moins 5 secondes et répétez les étapes 3 à 7.
9. remettez le capuchon de l’embout buccal en place.
10. rincez votre bouche avec de l’eau après vos doses quotidiennes du matin et du soir et recrachez l'eau.
Utilisation d’une chambre d’inhalation
Votre médecin, infirmier/ère ou pharmacien peut vous conseiller d’utiliser une chambre d’inhalation (par exemple AeroChamber Plus Flow Vu ou Aero Chamber Plus). Suivez les instructions dans la notice qui est jointe avec la chambre d’inhalation.
Nettoyage de votre SYMBICORT RAPIHALER
· Nettoyer au moins une fois par semaine l'extérieur et l’intérieur de l'embout buccal avec un linge sec.
· N'utilisez ni 'eau ni aucun autre liquide et n’enlevez pas la cartouche du dispositif d’inhalation.
Quand devez-vous commencer à utiliser un nouveau dispositif d’inhalation ?
· L’indicateur de doses au-dessus de votre dispositif d’inhalation indique le nombre d’inhalation restant dans votre SYMBICORT RAPIHALER. Il débute à 120 inhalations (bouffées) quand le flacon dans le dispositif d’inhalation est plein.
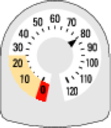
· Chaque fois que vous prenez une inhalation ou libérez une bouffée dans l’air, la flèche décroit vers (’0’)
· Quand la flèche atteint pour la première fois la zone jaune, cela signifie qu’il reste environ 20 bouffées.
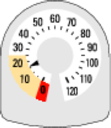
· Quand la flèche atteint le ’0’, vous devez arrêter d’utiliser votre SYMBICORT RAPIHALER. Votre dispositif d’inhalation peut ne pas sembler vide et laisser penser qu’il fonctionne encore. Cependant, vous ne recevrez pas la quantité correcte de médicament si vous continuez à l’utiliser.
Utilisation chez les enfants et les adolescents
Sans objet.
Si vous avez utilisé plus de SYMBICORT RAPIHALER 200/6 microgrammes par dose, suspension pour inhalation en flacon pressurisé que vous n’auriez dû :
Consultez immédiatement votre médecin ou votre pharmacien.
Les symptômes suivants peuvent survenir : tremblements, maux de tête ou battements cardiaques rapides.
Si vous oubliez d’utiliser SYMBICORT RAPIHALER 200/6 microgrammes par dose, suspension pour inhalation en flacon pressurisé :
Si vous oubliez de prendre une dose, prenez là dès que vous vous en souvenez. Toutefois si vous êtes proche du moment de la prise suivante, ne prenez pas la dose oubliée.
Ne prenez pas de dose double pour compenser la dose simple que vous avez oubliée de prendre. Prenez la dose suivante comme prescrit.
Si vous avez d’autres questions sur l’utilisation de ce médicament, demandez plus d’informations à votre médecin ou à votre pharmacien.
Si vous arrêtez d’utiliser SYMBICORT RAPIHALER 200/6 microgrammes par dose, suspension pour inhalation en flacon pressurisé :
Sans objet.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
En cas d’apparition de l’un des effets indésirables suivants, cessez d’utiliser SYMBICORT et parlez-en à votre médecin immédiatement :
· Gonflement du visage, en particulier au pourtour de la bouche (langue, et/ou gorge et/ou difficulté pour avaler) ou urticaire associé à des difficultés pour respirer (angioedème) et/ou sensation soudaine de malaise. Ces effets sont les signes d’une réaction allergique. Leur fréquence est rare, survenant chez moins de 1 personne sur 1000.
· Sifflements bronchiques ou difficultés à respirer survenant soudainement après inhalation du médicament. En cas d’apparition d’un de ces symptômes, arrêtez immédiatement de prendre Symbicort et utilisez votre bronchodilatateur d’action rapide. Contacter votre médecin immédiatement car il se peut qu’il change votre traitement. La fréquence d’apparition est très rare, survenant chez moins de 1 personne sur 10 000.
Autres effets indésirables possibles :
Fréquents (peut survenir chez jusqu’à 1 personne sur 10)
· Palpitations, tremblements (de plus ou moins grande intensité). Ces effets sont en général modérés et disparaissent généralement avec la poursuite du traitement.
· Candidose buccale (infection de la bouche due à des champignons microscopiques : les candidas). Elle peut être prévenue en se rinçant la bouche après inhalation du produit.
· Irritation légère de la gorge, toux et enrouement
· Maux de tête
· Pneumonie (infection pulmonaire) chez les patients atteints de bronchopneumopathie chronique obstructive (BPCO).
Si vous présentez l’un des effets indésirables suivants pendant la prise de Symbicort Turbuhaler, informez-en votre médecin, car ils pourraient être les symptômes d’une infection pulmonaire :
· fièvre ou frissons
· augmentation ou changement de coloration des expectorations (crachats)
· augmentation de la toux ou aggravation de l'essoufflement
Peu fréquents (peut survenir chez jusqu’à 1 personne sur 100)
· Sensation d’impatience, de nervosité ou d’agitation
· Troubles du sommeil
· Sensation de vertige
· Nausées
· Battements cardiaques trop rapides
· Ecchymoses
· Crampes musculaires
· Vision trouble
Rares (peut survenir chez jusqu’à 1 personne sur 1000)
· Eruption cutanée, démangeaisons
· Bronchospasme (resserrement des bronches se traduisant par un sifflement bronchique). Si le sifflement apparaît brusquement après l’utilisation de Symbicort ne renouvelez pas la prise de Symbicort et contactez votre médecin.
· Diminution du taux de potassium dans le sang
· Battements de coeur irréguliers
Très rares (peut survenir chez jusqu’à 1 personne sur 10 000)
· Dépression
· Troubles du comportement, principalement chez les enfants
· Douleur dans la poitrine ou sensation de serrement dans la poitrine (angine de poitrine)
· Augmentation du taux de sucre dans le sang (glycémie)
· Troubles du goût tel que goût désagréable dans la bouche
· Variation de la pression artérielle
Les corticoïdes inhalés peuvent interférer sur la production normale des hormones stéroïdiennes de l’organisme, en particulier lors de traitements au long cours à forte dose. Ces effets comprennent :
· des modifications de la densité minérale osseuse (ostéoporose)
· cataracte (opacification du cristallin)
· glaucome (augmentation de la pression interne dans l’œil)
· ralentissement de la croissance des enfants et des adolescents
· des effets sur les fonctions assurées par les glandes surrénales (petite glande située sur chaque rein)
Le risque de survenue de ces effets est beaucoup moins probable avec les corticoïdes inhalés que les corticoïdes oraux (en comprimés).
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr/
En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.
5. COMMENT CONSERVER SYMBICORT RAPIHALER 200/6 microgrammes par dose, suspension pour inhalation en flacon pressurisé ?
Tenir ce médicament hors de la vue et de la portée des enfants.
N’utilisez pas ce médicament après la date de péremption indiquée sur l’étiquette, la boîte et l’emballage en aluminium après {EXP}. La date de péremption fait référence au dernier jour de ce mois.
Comme avec beaucoup de médicaments inhalés en flacon pressurisé, l’effet du médicament peut diminuer quand la cartouche est froide. Pour de meilleurs résultats, ce médicament doit être conservé à température ambiante avant son utilisation. Ne pas réfrigérer ou congeler. Protéger du gel et de la lumière directe du soleil.
Après avoir enlevé le dispositif d’inhalation de son emballage en aluminium, vous devez l’utiliser dans les 3 mois. Écrivez la date de fin d’utilisation (3 mois à partir de l’ouverture de l’emballage) sur l’étiquette du dispositif d’inhalation pour vous rappeler quand arrêter son utilisation.
Toujours remettre en place le capuchon de l’embout buccal fermement après utilisation.
Ne jetez aucun médicament au tout-à-l’égout ni avec les ordures ménagères. Demandez à votre pharmacien d’éliminer les médicaments que vous n’utilisez plus. Ces mesures contribueront à protéger l’environnement.
6. CONTENU DE L’EMBALLAGE ET AUTRES INFORMATIONS
· Les substances actives sont :
Budésonide .............................................................................................. 160,00 microgrammes
Fumarate de formotérol dihydraté................................................................... 4,50 microgrammes
Pour une dose.
· Les autres composants excipients sont : apaflurane (HFA 227), povidone et macrogol.
L’inhalateur ne contient pas de CFC.
Ce médicament contient des gaz à effet de serre fluorés. Chaque inhalateur contient 10,6 g d’apaflurane (HFC-227ea) correspondant à 0,034 tonne équivalent CO2 (potentiel de réchauffement global (PRG) = 3 220).
SYMBICORT RAPIHALER est un dispositif d’inhalation contenant votre médicament. La cartouche (flacon pressurisé avec indicateur de doses) contient une suspension blanche pour inhalation. Cette cartouche est placée dans un boîtier en plastique rouge avec un embout buccal en plastique blanc et un capuchon gris. Chaque dispositif d’inhalation contient 120 bouffées (doses à inhaler) après qu’il ait été préparé à l’utilisation. Chaque dispositif d’inhalation est enveloppé individuellement dans un emballage en aluminium contenant un agent dessicant.
SYMBICORT RAPIHALER 200/6 microgrammes par dose, suspension pour inhalation en flacon pressurisé (Budésonide/fumarate de formotérol dihydraté) est présenté dans des boîtes contenant 1 dispositif d’inhalation.
Titulaire de l’autorisation de mise sur le marché
Tour Carpe Diem
31 place des Corolles
92400 COURBEVOIE
FRANCE
Exploitant de l’autorisation de mise sur le marché
Tour Carpe Diem
31 place des Corolles
92400 COURBEVOIE
FRANCE
ASTRAZENECA DUNKERQUE PRODUCTION
224 AVENUE DE LA DORDOGNE
59640 DUNKERQUE
FRANCE
Noms du médicament dans les Etats membres de l'Espace Economique Européen
Ce médicament est autorisé dans les Etats membres de l'Espace Economique Européen sous les noms suivants :
[À compléter ultérieurement par le titulaire]
La dernière date à laquelle cette notice a été révisée est :
[À compléter ultérieurement par le titulaire]
Sans objet.