
ANSM - Mis à jour le : 29/09/2020
IDRYLINE, collyre en solution en récipient unidose
2. COMPOSITION QUALITATIVE ET QUANTITATIVE 
Bryonia 5 CH........................................................................................................................ 0,002 g
Nux moschata 5 CH.............................................................................................................. 0,002 g
Pour un récipient unidose de 0,4 ml
Pour la liste complète des excipients, voir rubrique 6.1.
Collyre en solution en récipient unidose
4.1. Indications thérapeutiques 
4.2. Posologie et mode d'administration 
Médicament réservé à l'adulte et l’enfant à partir de 12 ans.
La sécheresse oculaire chez l’enfant de moins de 12 ans doit amener à consulter un médecin.
Posologie
1 à 2 gouttes dans chaque œil, matin et soir, pendant un minimum de 15 jours.
Un avis médical devra être pris si les symptômes persistent au-delà de 15 jours.
Mode d’administration
Voie ophtalmique
Se laver les mains avant l’instillation.
Afin d’administrer une solution toujours stérile, le produit doit être utilisé immédiatement après ouverture du récipient unidose.
1. Ouvrir le sachet.
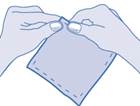
2. Détacher un récipient unidose. Fermer soigneusement le sachet contenant les autres récipients unidoses en repliant le côté ouvert.

3. Ouvrir le récipient unidose en tournant l’embout.
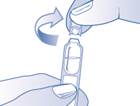
4. Déposer 1 à 2 gouttes de collyre dans le cul de sac conjonctival en regardant vers le haut, en tirant légèrement la paupière vers le bas et en évitant le contact de l'embout avec l'œil ou les paupières.

5. Cligner plusieurs fois des paupières afin que le collyre puisse se répartir de façon optimale sur la surface de l’œil.
Ce collyre en récipient unidose ne contient pas de conservateur, ne pas conserver le récipient unidose ouvert pour une utilisation ultérieure.
· Hypersensibilité aux substances actives ou à l’un des excipients mentionnés à la rubrique 6.1.
· Enfants de moins de 12 ans.
4.4. Mises en garde spéciales et précautions d'emploi 
· NE PAS AVALER, NE PAS INJECTER
· Ne pas administrer dans le nez, ou l’oreille.
· En l'absence d'amélioration comme en cas d’aggravation des symptômes, consulter un médecin.
· En cas de diminution de l’acuité visuelle, de difficulté à tenir les yeux ouverts ou de douleur aigüe et persistante, consulter un médecin.
· En cas de traitement avec un autre collyre, espacer les instillations de 15 minutes.
4.5. Interactions avec d'autres médicaments et autres formes d'interactions 
4.6. Fertilité, grossesse et allaitement 
Compte tenu des hauteurs de dilution des souches composant ce médicament, IDRYLINE, collyre en solution en récipient unidose peut être utilisé pendant la grossesse et l’allaitement.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines 
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : www.signalement-sante.gouv.fr.
5. PROPRIETES PHARMACOLOGIQUES 
5.1. Propriétés pharmacodynamiques 
Classe pharmacothérapeutique : Médicament homéopathique
En l’absence de données scientifiques, l’indication de ce médicament repose sur l’usage homéopathique traditionnel de ses composants.
L’administration de ce médicament homéopathique sous la forme d’un collyre en solution permet également une hydratation de l’œil au moment de l’instillation.
5.2. Propriétés pharmacocinétiques 
5.3. Données de sécurité préclinique 
Chlorure de sodium, eau purifiée.
Avant ouverture du sachet : 3 ans
Après ouverture du sachet : 1 mois
6.4. Précautions particulières de conservation 
Après ouverture du sachet : conserver les récipients unidoses non utilisés dans le sachet
Après ouverture du récipient unidose :
· Jeter le récipient unidose après utilisation.
· Ne pas le conserver pour une utilisation ultérieure.
6.5. Nature et contenu de l'emballage extérieur 
Récipients unidoses (PEBD) de 0,4 ml conditionnés en sachet (Aluminium). Boîte de 30 ou 40 récipients unidoses.
Toutes les présentations peuvent ne pas être commercialisées.
6.6. Précautions particulières d’élimination et de manipulation 
Pas d’exigences particulières.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE 
2 AVENUE DE L’OUEST LYONNAIS
69510 MESSIMY
FRANCE
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE 
· 34009 302 112 1 2 : 0,4 ml en récipient unidose (PEBD), boîte de 30 unidoses 34009 302 112 2 9 : 0,4 ml en récipient unidose (PEBD), boîte de 40 unidoses.
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION 
[à compléter ultérieurement par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE 
[à compléter ultérieurement par le titulaire]
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES 
Médicament non soumis à prescription médicale.
|
| Plan du site | Accessibilité | Contact | Téléchargement | Declaration de confidentialité | Service-Public.fr | Legifrance | Gouvernement.fr |