Dernière mise à jour le 02/02/2026
FRAGMINE 5 000 U.I. anti Xa/0,2 mL, solution injectable en seringue pré-remplie
Indications thérapeutiques
Classe pharmacothérapeutique : Anti-thrombotiques - code ATC : B01AB04.
Ce médicament est un anticoagulant de la famille des héparines dites de «bas poids moléculaire ».
FRAGMINE est indiqué chez l’adulte de plus de 18 ans pour :
La prévention de la formation d'une thrombose (caillot dans une veine ou une artère) et la prévention de la récidive.
Une héparine de bas poids moléculaire peut être prescrite :
· en traitement préventif, pour éviter une thrombose,
· en traitement curatif, dans le cas d'une thrombose déjà existante.
Ce médicament est utilisé, dans certains cas, en chirurgie pour prévenir le risque de phlébite.
Il est également utilisé pour la prévention de la coagulation dans les circuits de dialyse (en cas d'insuffisance rénale).
FRAGMINE est indiqué chez l’enfant pour :
Le traitement des caillots sanguins dans les veines (thromboembolie veineuse ou TEV) chez les enfants et les adolescents âgés de 1 mois et plus.
Présentations
> 2 seringue(s) préremplie(s) en verre de 0,2 ml avec piston(s) polypropylène avec système de sécurité Needle-Trap avec protège-aiguille caoutchouc
Code CIP : 330 107-3 ou 34009 330 107 3 7
Déclaration de commercialisation : 19/11/1988
Cette présentation est agréée aux collectivités
- Prix hors honoraire de dispensation : 10,13 €
- Honoraire de dispensation : 1,02 €
- Prix honoraire compris : 11,15 €
- Taux de remboursement :65%
> 10 seringue(s) préremplie(s) en verre de 0,2 ml avec piston(s) polypropylène avec système de sécurité Needle-Trap avec protège-aiguille caoutchouc
Code CIP : 556 085-0 ou 34009 556 085 0 9
Déclaration de commercialisation : 19/11/1988
Cette présentation est agréée aux collectivités
> 5 seringue(s) préremplie(s) en verre de 0,2 ml avec piston(s) polypropylène avec système de sécurité Needle-Trap avec protège-aiguille caoutchouc
Code CIP : 34009 302 729 8 5
Déclaration de commercialisation : 03/06/2024
Cette présentation est agréée aux collectivités
- Prix hors honoraire de dispensation : 25,21 €
- Honoraire de dispensation : 1,02 €
- Prix honoraire compris : 26,23 €
- Taux de remboursement :65 %
Service médical rendu (SMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprès de la HAS (plus d'informations dans l'aide). Les avis et synthèses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur du SMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| Important | Avis du 04/10/2023 | Inscription (CT) | Le service médical rendu par FRAGMINE (daltéparine sodique) 2 500 U.I. anti-Xa/0,2 ml et 5 000 U.I. anti-Xa/0,2 ml est important dans les indications de l’AMM faisant l’objet de cette demande d’inscription (indications chez l’adulte) : • Traitement prophylactique de la maladie thromboembolique veineuse (MTEV) en chirurgie, dans les situations à risque modéré ou élevé ainsi qu'en chirurgie oncologique . • Prévention de la coagulation du circuit de circulation extracorporelle au cours de l'hémodialyse (séance en général d'une durée = 4 heures) « • Uniquement pour le dosage à 5 000 U.I. anti-Xa/0,2 ml : Traitement prophylactique des thromboses veineuses profondes (TVP) chez les patients alités pour une affection médicale aiguë : • une insuffisance cardiaque de stade III ou IV de la classification NYHA, • une insuffisance respiratoire aiguë, • ou un épisode d'infection aiguë ou d'affection rhumatologique aiguë, associé à au moins un autre facteur de risque thromboembolique veineux. |
| Important | Avis du 22/01/2014 | Renouvellement d'inscription (CT) | Le service médical rendu par FRAGMINE reste important dans les indications de l’AMM. |
Amélioration du service médical rendu (ASMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprés de la HAS (plus d'informations dans l'aide). Les avis et synthéses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur de l'ASMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| V (Inexistant) | Avis du 04/10/2023 | Inscription (CT) | Ces spécialités sont un complément de gamme qui n’apportent pas d’amélioration du service médical rendu (ASMR V) par rapport aux présentations déjà inscrites. |
ANSM - Mis à jour le : 09/10/2025
FRAGMINE 5 000 U.l. anti Xa/0,2 mL, solution injectable en seringue pré-remplie
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Daltéparine sodique .............................................................................................. 5 000 U.l. anti-Xa
Pour une seringue pré-remplie de 0,2 mL.
Pour la liste complète des excipients, voir rubrique 6.1 Liste des excipients.
Solution injectable en seringue pré-remplie.
4.1. Indications thérapeutiques
Cette héparine est une héparine de bas poids moléculaire (HBPM).
Ses indications sont les suivantes :
Population adulte
· Traitement prophylactique de !a maladie thromboembolique veineuse (MTEV) en chirurgie, dans les situations à risque modéré ou élevé ainsi qu'en chirurgie oncologique.
· Traitement prophylactique des thromboses veineuses profondes (TVP) chez les patients alités pour une affection médicale aiguë :
o une insuffisance cardiaque de stade III ou IV de la classification NYHA,
o une insuffisance respiratoire aiguë,
o ou un épisode d'infection aiguë ou d'affection rhumatologique aiguë, associé à au moins un autre facteur de risque thromboembolique veineux.
· Prévention de la coagulation du circuit de circulation extracorporelle au cours de l'hémodialyse (séance en général d'une durée ≤ 4 heures).
Population pédiatrique
Traitement de la thromboembolie veineuse (TEV) symptomatique chez les patients pédiatriques âgés de 1 mois et plus.
4.2. Posologie et mode d'administration
Les seringues pré-remplies à 2 500 U.l. et 5 000 U.l. anti-Xa de daltéparine se présentent sous un volume identique (0,2 mL).
Recommandation générale
La surveillance régulière de la numération plaquettaire est impérative en raison du risque de thrombopénie induite par l'héparine (TIH) (voir rubrique 4.4 Mises en garde spéciales et précautions d'emploi).
Population adulte
Traitement prophylactique de la MTEV en chirurgie
Ces recommandations s'appliquent en règle générale aux interventions chirurgicales effectuées sous anesthésie générale.
Pour les techniques de rachianesthésie et d'anesthésie péridurale, l'intérêt de l'injection préopératoire doit être évalué en raison du risque théorique accru d'hématome intra-rachidien (voir rubrique 4.4 Mises en garde spéciales et précautions d’emploi).
Fréquence d'administration : 1 injection par jour.
Dose administrée : elle doit être fonction du niveau de risque individuel, lié au patient et au type de chirurgie.
· Situation à risque thrombogène modéré :
Dans le cas d'une chirurgie à risque thrombogène modéré et lorsque les patients ne présentent pas de risque thrombo-embolique élevé, la prévention efficace de la maladie thrombo-embolique est obtenue par une injection quotidienne d'une dose de 2 500 U.l. anti-Xa.
Le schéma thérapeutique étudié comporte une première injection effectuée 2 heures avant l'intervention.
· Situation à risque thrombogène élevé : chirurgie de la hanche et du genou :
La posologie est de 5 000 U.l. anti-Xa à raison d'une injection quotidienne.
La première injection sera pratiquée :
o soit dans les 2 heures avant l'intervention dans le cas d'une moitié de dose (2 500 U.l. anti-Xa) ; la même dose sera renouvelée 12 heures plus tard.
o soit le soir précédant l'intervention dans le cas d'une dose totale (5 000 U.l. anti-Xa) ; la même dose sera renouvelée 24 heures plus tard.
· Autres situations :
Lorsque le risque thrombo-embolique lié au type de chirurgie (notamment cancérologique) et/ou au patient (notamment antécédents de maladie thrombo-embolique) paraît majoré, on peut envisager le recours à une posologie prophylactique identique à celle de l'orthopédie à risque élevé (hanche, genou).
En chirurgie oncologique, la daltéparine a établi son efficacité à la posologie de 5 000 U.l. anti-Xa par jour, selon le même schéma posologique qu'en chirurgie orthopédique de hanche.
Durée du traitement :
Le traitement par HBPM, accompagné des techniques habituelles de contention élastique des membres inférieurs, doit être maintenu jusqu'à déambulation active et complète du patient :
· en chirurgie générale, la durée du traitement par HBPM doit être inférieure à 10 jours, en dehors d'un risque thromboembolique veineux particulier lié au patient (voir rubrique 4.4 Mises en garde spéciales et précautions d’emploi, surveillance plaquettaire) ;
· l'intérêt d'un traitement prophylactique en chirurgie orthopédique de hanche, par une injection de daltéparine sodique à la dose de 5 000 U.l. anti-Xa/j durant 35 jours après l'intervention, a été établi ;
· si le risque thromboembolique veineux persiste au-delà de la période de traitement recommandée, il est nécessaire d'envisager la poursuite de la prophylaxie, notamment par les anticoagulants oraux. Toutefois, le bénéfice clinique d'un traitement à long terme par héparine de bas poids moléculaire ou par anti-vitamine K n'est pas évalué à l'heure actuelle.
Traitement prophylactique en milieu médical
Dose administrée :
La posologie est de 5 000 U.l. anti-Xa/0,2 mL, à raison d'une injection sous-cutanée par jour.
Durée du traitement :
Le bénéfice du traitement a été établi pour une durée de traitement comprise entre 12 et 14 jours. Aucune donnée n'est actuellement disponible concernant l'efficacité et la sécurité d'une prophylaxie prolongée au-delà de 14 jours. Si les facteurs de risque thromboemboliques persistent, il est nécessaire d'envisager un traitement prophylactique prolongé, notamment par anti-vitamine K.
Prévention de la coagulation du circuit de circulation extracorporelle/hémodialyse
FRAGMINE doit être administré dans la ligne artérielle du circuit de la dialyse.
Chez les patients bénéficiant de séances d'hémodialyse itératives, la prévention de la coagulation dans le circuit d'épuration extra-rénale est obtenue en injectant une dose initiale en bolus unique de 5 000 U.l. Anti-Xa dans la ligne artérielle du circuit de dialyse, en début de séance.
La dose initiale recommandée est de 5 000 U.I ; alternativement, une dose initiale plus faible peut être utilisée lorsque cela est cliniquement indiqué.
La dose initiale de 5 000 U.I pour le schéma posologique en bolus unique peut être ajustée, d’une séance à l’autre, en fonction du résultat de la dialyse précédente ; la dose peut être augmentée ou diminuée par paliers de 500 ou 1 000 U.I anti-Xa jusqu’à l’obtention d’un résultat satisfaisant (voir rubrique 5.1 Propriétés pharmacodynamiques). Cette dose, administrée en bolus intravasculaire unique, n’est adaptée que pour les séances de dialyse de 4 heures ou moins. Cette dose est susceptible d’être modifiée en raison de l’importante variabilité intra et interindividuelle et de la durée de la séance.De plus, les posologies recommandées pour des séances > 4 heures sont :
· dose initiale : injection directe de 30 à 35 U.l. anti-Xa/kg,
· dose d'entretien : perfusion de 10 à 15 U.l. anti-Xa/kg/h.
Population pédiatrique
Traitement de la thromboembolie veineuse (TEV) symptomatique chez les patients pédiatriques âgés de 1 mois et plus.
Une concentration de 2 500 U.I./mL est recommandée pour garantir l’exactitude du dosagepour la cohorte d’âge la plus jeune. Lorsqu’une dilution est nécessaire, elle doit être effectuée par un professionnel de santé (voir rubrique 6.6). Pour les enfants âgés de moins de 3 ans, une présentation sans alcool benzylique doit être utilisée.
Traitement de la thromboembolie veineuse symptomatique chez les patients pédiatriques
La dose initiale recommandée en fonction de l’âge pédiatrique est indiquée dans le tableau ci-dessous.
|
Tableau 1 - Doses initiales pour les patients pédiatriques présentant une TEV symptomatique |
|
|
Groupe d’âge |
Dose initiale |
|
1 mois à moins de 2 ans |
150 U.I./kg deux fois par jour |
|
2 ans à moins de 8 ans |
125 U.I./kg deux fois par jour |
|
8 ans à moins de 18 ans |
100 U.I./kg deux fois par jour |
Tableau 2 - Tableau de dilution pédiatrique
|
Age |
Concentration recommandée pour l’administration |
Concentration telle que fournie* |
|
|
10 000 U.I./mL** |
25 000 U.I./mL** |
||
|
1 mois – 2 ans |
2 500 U.I./mL |
V (actif) + 3V (diluant) |
V (actif) + 9V (diluant) |
|
2 ans – 8 ans |
10 000 U.I./mL |
Aucune dilution requise |
V (actif) + 1,5V (diluant) |
|
8 ans – 17 ans |
10 000 U.I./mL |
Aucune dilution requise |
V (actif) + 1,5V (diluant)*** |
|
Le volume final pour l’injection doit être compris entre 0,15 mL et 1,0 mL ; s’il est inférieur/supérieur à cet intervalle, une solution moins/plus concentrée (respectivement) pour l’administration doit être préparée. * Prélever un volume (V) pratique d’au moins 1,0 mL de la solution telle que fournie, puis ajouter du diluant (le volume de diluant est exprimé comme un multiple de V) ; administrer le volume correct de la solution diluée. Pour les enfants pesant > 20 kg, la concentration de 12 500 U.I./mL peut également être administrée directement, sans dilution. ** Les flacons multidoses de 10 000 U.I./mL (flacon de 10 mL) et de 25 000 U.I./mL (flacon de 4 mL) contiennent de l’alcool benzylique. Pour les enfants âgés de moins de 3 ans, une présentation sans alcool benzylique doit être utilisée. *** Pour les enfants pesant > 50 kg, la solution de 25 000 U.I./mL peut également être administrée directement, sans dilution. |
|||
FRAGMINE est compatible avec les solutions pour perfusion de chlorure de sodium (9 mg/mL) ou de glucose (50 mg/mL) dans des flacons en verre et des récipients en plastique (voir rubrique 6.6).
Contrôle de l’activité anti-Xa chez l’enfant :
Après l’instauration du traitement par FRAGMINE, le taux d’anti-Xa doit être mesuré initialement après la première, la deuxième ou la troisième dose. Les échantillons pour le taux d’anti-Xa doivent être prélevés 4 heures après l’administration.
Les doses doivent être ajustées par incréments de 25 U.I./kg pour atteindre un taux d’anti-Xa cible compris entre 0,5 U.I./mL et 1 U.I./mL et le taux d’anti-Xa doit être mesuré après chaque ajustement. La dose d’entretien doit être individualisée sur la base de la dose permettant d’atteindre le taux cible d’anti-Xa prélevé 4 heures après l’administration.
La surveillance des taux d’anti-Xa doit être poursuivie jusqu’à ce qu’une dose d’entretien adéquate soit établie et doit être poursuivie périodiquement pour maintenir le taux d’anti-Xa cible. Chez les enfants les plus jeunes, il est recommandé de commencer la surveillance initiale du taux d'anti-Xa après la première dose et une surveillance plus fréquente peut être nécessaire par la suite pour guider les ajustements posologiques jusqu'à ce que les taux d'anti-Xa cibles soient atteints (voir rubriques 5.1 et 5.2).
En cas de fonction rénale diminuée et physiologiquement variable, tel qu’observée chez les nouveau-nés, une surveillance étroite de l’activité anti-Xa est nécessaire.
Comme avec tous les anti-thrombotiques, il existe un risque de saignement systémique lors de l’administration de FRAGMINE. Une attention particulière doit être portée aux patients récemment opérés, lors de l’administration de doses élevées. Après l’instauration du traitement, une surveillance accrue devra être mise en place en vue d’éviter des complications hémorragiques. Cela peut se faire par un examen clinique de ces patients, par une observation minutieuse du drainage chirurgical, ainsi que les dosages périodiques du taux d’hémoglobine et de l’activité anti-Xa.
La sécurité et l’efficacité de la daltéparine sodique pour la prophylaxie de la TEV chez les enfants n’ont pas été établies. Les données actuellement disponibles sur la prophylaxie de la TEV sont décrites à la rubrique 5.1 mais aucune recommandation sur la posologie ne peut être donnée.
Mode d’administration
VOIE SOUS-CUTANEE (à l’exception de l’indication hémodialyse pour laquelle l’administration a lieu dans la ligne artérielle du dialyseur).
Ne pas injecter par voie I.M.
Utilisation du système de sécurité de l’aiguille (voir rubrique 6.6 Précautions particulières d’élimination et de manipulation).
Technique d’injection sous-cutanée
Population adulte
· Ne pas purger la bulle d’air.
· L’injection sous-cutanée de la daltéparine doit être réalisée de préférence chez le patient en décubitus, dans le tissu cellulaire sous-cutané de la ceinture abdominale antérolatérale et postérolatérale, alternativement du côté droit et du côté gauche.
· L’aiguille doit être introduite perpendiculairement et non tangentiellement, sur toute sa longueur, dans l’épaisseur d’un pli cutané réalisé entre le pouce et l’index de l’opérateur. Ce pli cutané doit être maintenu pendant toute la durée de l’injection.
Population pédiatrique
FRAGMINE est administré par voie sous-cutanée, de préférence dans le tissu sous-cutané abdominal de manière antérolatérale ou postérolatérale, ou dans la partie latérale de la cuisse selon un angle compris entre 45° et 90°.
Des instructions complètes pour l’administration de FRAGMINE sont fournies dans la rubrique réservée aux professionnels de santé de la notice.
Ce médicament NE DOIT PAS ETRE UTILISE dans les situations suivantes :
· hypersensibilité à la daltéparine sodique, à d’autres héparines de bas poids moléculaire/ héparines ou à l’un des excipients mentionnés à la rubrique 6.1 Liste des excipients,
· antécédents de thrombopénie immuno-allergique induite par l'héparine (ou TIH) grave de type II confirmée ou soupçonnée induite sous héparine non fractionnée ou sous héparine de bas poids moléculaire (voir rubrique 4.4 Mises en garde spéciales et précautions d'emploi),
· manifestations ou tendances hémorragiques liées à des troubles de l'hémostase (les coagulations intravasculaires disséminées peuvent être une exception à cette règle, lorsqu'elles ne sont pas liées à un traitement par l'héparine (voir rubrique 4.4 Mises en garde spéciales et précautions d'emploi),
· lésion organique susceptible de saigner,
· ulcère gastro-duodénal aigu,
· hémorragie intracérébrale ou autre hémorragie active,
· troubles sévères de la coagulation,
· endocardite infectieuse aiguë ou subaiguë,
· lésions ou interventions chirurgicales au niveau du système nerveux central, des yeux ou des oreilles,
· une anesthésie péridurale ou une ponction lombaire ne doivent jamais être effectuées lors d’un traitement curatif à doses élevées par HBPM (telles que celles nécessaires pour traiter une thrombose veineuse profonde aiguë, une embolie pulmonaire ou une coronaropathie instable).
Ce médicament est GENERALEMENT DECONSEILLE dans les cas suivants :
· insuffisance rénale sévère, (clairance de créatinine de l'ordre de 30 mL/min, selon l'estimation de la formule de Cockroft voir rubrique 4.4 Mises en garde spéciales et précautions d'emploi).
4.4. Mises en garde spéciales et précautions d'emploi
FRAGMINE ne doit pas être injecté par voie intramusculaire. En raison du risque d’hématome, l’injection intramusculaire d’autres médicaments doit être évitée quand la dose quotidienne de daltéparine sodique est supérieure à 5 000 U.I..
Mises en garde spéciales
La prudence est recommandée en cas de thrombopénie et d’anomalie de la fonction plaquettaire, d’insuffisance hépatique et rénale sévères, d’hypertension non-contrôlée, de rétinopathie hypertensive ou diabétique.
La prudence est également recommandée en cas de traitement par de fortes doses de daltéparine sodique (telles que celles nécessaires pour traiter une thrombose veineuse profonde aigüe, une embolie pulmonaire ou une coronaropathie instable), chez les patients qui viennent d’être opérés et également lorsqu’un risque accru d’hémorragie est soupçonné.
Risque hémorragique
Il est impératif de respecter les schémas thérapeutiques recommandés (posologies et durées de traitement). Dans le cas contraire, des accidents hémorragiques peuvent s'observer, surtout chez les sujets à risque (sujets âgés, insuffisants rénaux...).
Les accidents hémorragiques graves ont notamment été observés :
· chez le sujet âgé, notamment du fait de la détérioration de la fonction rénale liée à l'âge, y compris à l’intérieur de la fourchette thérapeutique,
· en cas d'insuffisance rénale,
· en cas de poids inférieur à 40 kg,
· en cas de traitement prolongé au-delà de la durée moyenne préconisée de 10 jours,
· en cas de non-respect des modalités thérapeutiques conseillées (notamment durées de traitement et adaptation de la dose en fonction du poids pour les traitements curatifs),
· en cas d'association à des médicaments majorant le risque hémorragique (voir rubrique 4.5 Interactions avec d'autres médicaments et autres formes d'interactions).
Les patients âgés (en particulier âgés de 80 ans et plus) peuvent présenter un risque accru de complications hémorragiques dans la gamme posologique thérapeutique. Une surveillance clinique attentive est recommandée.
Dans tous les cas, une surveillance particulière est indispensable chez les patients âgés et/ou insuffisants rénaux, ainsi qu'en cas de traitement prolongé au-delà de 10 jours.
Pour détecter une accumulation, une mesure de l'activité anti-Xa peut-être utile dans certains cas (voir Précautions d’emploi/Surveillance biologique).
Risque de thrombopénie induite par l'héparine (TIH)
Devant un patient traité par HBPM (à dose curative ou préventive) qui présente un événement thrombotique, tel que :
· une aggravation de la thrombose pour laquelle il est traité,
· une phlébite,
· une embolie pulmonaire,
· une ischémie aiguë des membres inférieurs,
· voire un infarctus du myocarde ou un accident vasculaire cérébral ischémique, il faut systématiquement penser à une thrombopénie induite par l'héparine (TIH) et faire pratiquer en urgence une numération des plaquettes (voir Précautions d’emploi).
Utilisation dans la population pédiatrique
L’activité anti-Xa doit être surveillée pendant l’instauration du traitement et après toute adaptation de la dose (voir rubrique 4.2).
Il n'existe pas de données chez les enfants atteints de thrombose des veines cérébrales et des sinus qui présentent une infection du SNC. Le risque d'hémorragie doit faire l’objet d’une évaluation attentive avant et pendant le traitement par la daltéparine.
Réactions allergiques
Le protège-aiguille des seringues préremplies de FRAGMINE peut contenir du latex (caoutchouc naturel) ce qui peut provoquer des réactions allergiques graves chez les personnes présentant une hypersensibilité au latex (caoutchouc naturel).
Prophylaxie médicale
· dans le cas d'un épisode aigu d'une maladie infectieuse ou rhumatologique, le traitement prophylactique n'est justifié qu'en cas d'association à au moins un des facteurs de risque thrombo-embolique veineux suivants :
o âge > 75 ans,
o cancer,
o antécédents thromboemboliques veineux,
o obésité,
o traitement hormonal,
o insuffisance cardiaque,
o insuffisance respiratoire chronique ;
· en prophylaxie médicale, l'expérience disponible chez les patients âgés de plus de 80 ans et de poids inférieur à 40 kg est très limitée.
Précautions d'emploi
En cas d'association à des médicaments majorant le risque hémorragique (voir rubrique 4.5 Interactions avec d'autres médicaments et autres formes d'interactions).
Si un patient atteint de coronaropathie instable (angor instable et infarctus du myocarde sans onde Q) est frappé d’un infarctus du myocarde, un traitement thrombolytique peut s’avérer nécessaire. Cela n’implique pas la suspension du traitement par la daltéparine sodique, mais le risque d’hémorragie est augmenté.
Fonction rénale
Avant d'instaurer un traitement par HBPM, il est indispensable d'évaluer la fonction rénale, et plus particulièrement chez le sujet âgé à partir de 75 ans, en calculant la clairance de la créatinine (Clcr) à l'aide de la formule de Cockroft, en disposant d'un poids récent du patient :
Chez l'homme, Clcr = (140-âge) x poids / (0,814 x créatininémie) avec l'âge exprimé en années, le poids en kg, la créatininémie en µmol/l.
Cette formule doit être corrigée pour les femmes en multipliant le résultat par 0,85.
Lorsque la créatinine est exprimée en mg/mL, multiplier par un facteur 8,8.
Dans le traitement au long cours de la coronaropathie instable, c’est-à-dire en attente d'intervention de revascularisation, la diminution des doses doit être envisagée en cas de fonction rénale déficiente (créatininémie > 150 µmol/l).
La mise en évidence d'une insuffisance rénale sévère (Clcr de l'ordre de 30 mL/min) contre-indique la prescription d'HBPM dans les indications curatives (voir rubrique 4.3 Contre-indications).
Surveillance biologique
Une numération plaquettaire est recommandée avant l’initiation du traitement par la daltéparine, et devra être poursuivie de façon régulière tout au long du traitement.
Surveillance plaquettaire des patients sous HBPM et risque de Thrombopénie Induite par l’Héparine (ou TIH de type II) :
· Les HBPM peuvent induire des TIH de type II, thrombopénies graves d’origine immunologique, responsables d’accidents thromboemboliques artériels ou veineux pouvant menacer le pronostic vital ou fonctionnel des patients (voir aussi rubrique 4.8 Effets indésirables). Afin de pouvoir détecter les TIH de manière optimale, il est nécessaire de surveiller les patients de la manière suivante :
o Dans un contexte chirurgical ou traumatique récent (dans les 3 mois) :
Une surveillance biologique systématique est nécessaire, que l’indication du traitement soit préventive ou curative, chez tous les patients, compte tenu de l’incidence des TIH > 0,1 %, voire > 1 %, en chirurgie et en traumatologie. Elle consiste à pratiquer une numération plaquettaire :
· avant le traitement par HBPM ou au plus tard dans les 24 heures après l’instauration du traitement,
· puis 2 fois par semaine pendant un mois (période de risque maximal),
· puis une fois par semaine jusqu’à l’arrêt du traitement en cas de traitement prolongé.
o En dehors d’un contexte chirurgical ou traumatique récent (dans les 3 mois) :
Une surveillance biologique systématique est nécessaire que l’indication du traitement soit préventive ou curative, selon les mêmes modalités qu’en chirurgie et en traumatologie (voir paragraphe ci-dessus) chez les patients :
· ayant des antécédents d’exposition à l’HNF ou aux HBPM dans les 6 derniers mois, compte tenu de l’incidence des TIH > 0,1 %, voire > 1 %,
· atteints de comorbidités importantes, compte tenu de la gravité potentielle des TIH chez ces patients.
Dans les autres cas, compte tenu de l’incidence des TIH plus faible (< 0,1 %), la surveillance de la numération plaquettaire peut être réduite à :
· une seule numération plaquettaire en début de traitement ou au plus tard dans les 24 heures après l’instauration du traitement,
· une numération plaquettaire en cas de manifestation clinique évocatrice de TIH (tout nouvel épisode thromboembolique artériel et/ou veineux, toute lésion cutanée douloureuse au site d’injection, toute manifestation allergique ou anaphylactoïde sous traitement). Le patient doit être informé de la possibilité de survenue de ces manifestations et de la nécessité de prévenir son médecin référent le cas échéant.
Une attention particulière est nécessaire lors de la survenue rapide et sévère d’une thrombopénie (< 100 000/µl) associée à des résultats positifs ou non connus de la recherche in vitro d’anti-corps plaquettaires en présence de daltéparine ou d’autres héparines de bas poids moléculaires et/ou d’héparine.
Une TIH doit être suspectée devant un nombre de plaquettes < 150 000/mm3 (ou 150 Giga/l) et/ouune chute relative des plaquettes de l’ordre de 50 %, voire 30 %, par rapport à la numération plaquettaire avant tout traitement. Elle apparaît essentiellement entre le 5ème et le 21ème jour suivant l'instauration du traitement héparinique (avec un pic de fréquence aux environs du 10ème jour). Mais elle peut survenir beaucoup plus précocement, lorsque des antécédents de thrombopénie sous héparine existent, et des cas isolés ont été rapportés au-delà de 21 jours.
De tels antécédents seront donc systématiquement recherchés au cours d'un interrogatoire approfondi avant le début du traitement. Dans tous les cas, l'apparition d'une TIH constitue une situation d'urgence et nécessite un avis spécialisé.
Toute baisse significative (30 à 50 % de la valeur initiale) de la numération plaquettaire doit donner l'alerte, avant même que cette valeur n'atteigne un seuil critique. La constatation d'une diminution du nombre de plaquettes impose dans tous les cas :
1) - un contrôle immédiat de la numération ;
2) - la suspension du traitement héparinique, si la baisse est confirmée, voire accentuée, lors de ce contrôle, en l'absence d'une autre étiologie évidente.
Un prélèvement doit être réalisé sur tube citraté pour réaliser des tests d'agrégation plaquettaire in vitro et des tests immunologiques. Mais, dans ces conditions, la conduite à tenir immédiate ne repose pas sur le résultat de ces tests d'agrégation plaquettaire in vitro ou immunologiques, car seuls quelques laboratoires spécialisés les pratiquent en routine et le résultat n'est obtenu, dans le meilleur des cas, qu'au bout de plusieurs heures.
Ces tests doivent cependant être réalisés pour aider au diagnostic de cette complication, car en cas de poursuite du traitement héparinique, le risque de thrombose est majeur.
3) - la prévention ou le traitement des complications thrombotiques de la TIH.
Si la poursuite de l'anticoagulation semble indispensable, l'héparine doit être relayée par une autre classe d'antithrombotiques : danaparoïde sodique ou lépirudine, prescrits suivant les cas à dose préventive ou curative.
Le relais par les AVK ne sera pris qu'après normalisation de la numération plaquettaire, en raison du risque d'aggravation du phénomène thrombotique par les AVK.
Relais de l'héparine par les AVK
· Renforcer alors la surveillance clinique et biologique (temps de Quick exprimé en INR) pour contrôler l'effet des AVK.
· En raison du temps de latence précédant le plein effet de l'antivitamine K utilisé, l'héparine doit être maintenue à dose équivalente pendant toute la durée nécessaire pour que l'INR soit dans la zone thérapeutique souhaitable de l'indication lors de deux contrôles successifs.
Contrôle de l'activité anti-Xa
· La majorité des études cliniques qui ont démontré l'efficacité des HBPM ayant été conduites avec une dose adaptée au poids et sans surveillance biologique particulière, l'utilité d'une surveillance biologique n'a pas été établie pour apprécier l'efficacité d'un traitement par HBPM.
Toutefois, la surveillance biologique par détermination de l'activité anti-Xa n’est pas obligatoire mais peut être utile pour certaines populations pour gérer le risque hémorragique, dans certaines situations cliniques fréquemment associées à un risque de surdosage. Ces situations concernent essentiellement les indications curatives des HBPM, en raison des doses administrées, quand existe :
o une insuffisance rénale légère à modérée avec clairance estimée selon la formule de Cockroft entre 30 mL/min à 60 mL/min : en effet, contrairement à l'héparine standard non fractionnée, les HBPM s'éliminent en grande partie par le rein et toute insuffisance rénale peut conduire à un surdosage relatif. La nécessité d’ajustements posologiques et de contrôles de l’activité anti-Xa est, en général, moindre chez les patients sous hémodialyse chronique traités par daltéparine sodique. Les patients sous hémodialyse aiguë peuvent être plus instables et doivent avoir un suivi plus systématique de l’activité anti-Xa. L'insuffisance rénale sévère constitue quant à elle, une contre-indication à l'utilisation des HBPM aux doses curatives (voir rubrique 4.3 Contre-indications) ;
o un poids extrême (maigreur voire cachexie, obésité) ;
o une hémorragie inexpliquée.
o un risque accru de saignement ou de rethrombose ;
o chez l’enfant ;
o chez la femme enceinte.
A l'inverse, la surveillance biologique n'est pas recommandée aux doses prophylactiques si le traitement par HBPM est conforme aux modalités thérapeutiques conseillées (en particulier pour la durée du traitement), ainsi qu'au cours de l'hémodialyse.
Afin de détecter une possible accumulation après plusieurs administrations, il est le cas échéant recommandé de prélever le sang du patient au pic maximal d'activité (selon les données disponibles), c'est-à-dire :
· environ 4 heures après la 3ème administration, lorsque le médicament est délivré en 2 injections SC par jour.
La répétition du dosage de l'activité anti-Xa pour mesurer l'héparinémie, par exemple tous les 2 à 3 jours, sera discutée au cas par cas, en fonction des résultats du dosage précédent, et une éventuelle modification de la dose d'HBPM sera envisagée.
Pour chaque HBPM et chaque schéma thérapeutique, l'activité anti-Xa générée est différente.
A titre indicatif, d'après les données disponibles, la moyenne observée (± écart-type) à la 4ème heure pour la daltéparine sodique délivrée à la dose de 100 U.l. anti-Xa/kg en 2 injections par 24 h a été de 0,59 ± 0,25 ; 0,60 ± 0,21 ; 0,62 ± 0,22 ; 0,67 ± 0,21 ; 0,69 ± 0,26 U.l. anti-Xa respectivement au jour 2, 4, 6, 8 et 10 du traitement.
Ces valeurs moyennes ont été observées au cours des essais cliniques pour les dosages d'activité anti-Xa effectués par méthode chromogénique (amidolytique).
Temps de céphaline activée (TCA)
Le temps nécessaire à la coagulation, mesuré par le TCA (temps de céphaline activée), est prolongé de façon modérée seulement, par la daltéparine sodique. L’augmentation de la dose dans le but d’allonger le TCA pourrait constituer un risque de surdosage et d’hémorragie. Pour la surveillance biologique des effets, la détermination du taux d’anti-facteur Xa plasmatique est recommandée.
Réalisation d'une rachianesthésie/anesthésie péridurale en cas de traitement préventif par HBPM
· Comme avec les autres anticoagulants, de rares cas d'hématomes intra-rachidiens entraînant une paralysie prolongée ou permanente ont été rapportés lors de l'administration d'HBPM au décours d'une rachianesthésie ou d'une anesthésie péridurale.Le risque d'hématome intra-rachidien paraît plus important avec la péridurale avec cathéter, qu'avec la rachianesthésie.Le risque de ces événements rares peut être augmenté par l'utilisation post-opératoire prolongée de cathéters périduraux.
· Si un traitement pré-opératoire par HBPM est nécessaire (alitement prolongé, traumatisme) et que le bénéfice d'une anesthésie loco-régionale rachidienne a été soigneusement évalué, cette technique pourra être utilisée chez un patient ayant reçu une injection pré-opératoire d'HBPM, à condition de respecter un délai d'au moins 12 h entre l'injection d'héparine et la réalisation de l'anesthésie rachidienne. Une surveillance neurologique attentive est recommandée, en raison du risque d'hématome intra-rachidien.
· Dans la quasi-totalité des cas, le traitement prophylactique par HBPM pourra être débuté dans les 6 à 8 heures qui suivent la réalisation de la technique ou l'ablation du cathéter, sous couvert d'une surveillance neurologique.
· Une attention particulière sera portée en cas d'association avec d'autres médicaments interférant avec l'hémostase (notamment anti-inflammatoires non stéroïdiens, aspirine).
Situations à risque
La surveillance du traitement sera renforcée dans les cas suivants :
· insuffisance hépatique,
· antécédents d'ulcères digestifs ou de toute autre lésion organique susceptible de saigner,
· maladies vasculaires de la choriorétine,
· en période post-opératoire après chirurgie du cerveau et de la moelle épinière,
· la réalisation d'une ponction lombaire devra être discutée en tenant compte du risque de saignement intra-rachidien. Elle devra être différée chaque fois que possible.
En cas d'anesthésie neuraxiale (péridurale/rachianesthésie) ou de ponction lombaire, les patients présentent le risque de développer un hématome épidural ou rachidien, pouvant entraîner une paralysie à long terme ou permanente. Le risque de survenue de ces événements est accru lors de l’utilisation de cathéters épiduraux ou l'utilisation concomitante de médicaments affectant l'hémostase, tels que les anti-inflammatoires non stéroïdiens (AINS), les antiagrégants plaquettaires et d'autres anticoagulants. Le risque semble également augmenter en cas de ponction péridurale ou rachidienne traumatique ou répétée. Les patients doivent être surveillés fréquemment afin de détecter tout signe et symptôme d’atteinte neurologique lorsqu’un traitement anticoagulant est administré en association avec une anesthésie péridurale/rachianesthésie.
La pose ou le retrait du cathéter péridural ou rachidien doit être différé de 10-12 heures après l'administration des doses de daltéparine pour la prophylaxie de la thrombose, et de 24 heures minimum chez les patients recevant des doses thérapeutiques plus élevées (p. ex. 100 - 120 U.I./kg toutes les 12 heures ou 200 U.I./kg une fois par jour).
Si un médecin juge approprié d'administrer un traitement anticoagulant dans le contexte d'une anesthésie péridurale ou d'une rachianesthésie, une vigilance extrême et une surveillance fréquente sont de rigueur afin de détecter tout signe et symptôme de trouble neurologique tel que des maux de dos, des atteintes sensorielles ou motrices (engourdissement et faiblesse des membres inférieurs) et un dysfonctionnement des intestins ou de la vessie. Le personnel infirmier doit être formé afin de détecter ces signes et symptômes. Les patients doivent être informés de la nécessité d'avertir immédiatement un infirmier/ère ou un clinicien si l’un de ces signes et symptômes se manifeste.
En cas de suspicion de signes ou de symptômes d'hématome épidural ou rachidien, le diagnostic et le traitement d’urgence peuvent inclure la décompression de la moelle épinière.
Il n’y a pas eu d’études appropriées pour évaluer la sécurité et l’efficacité de FRAGMINE dans la prévention de thromboses valvulaires chez les patients ayant des prothèses valvulaires cardiaques. Les doses prophylactiques de FRAGMINE ne sont pas suffisantes pour prévenir les thromboses valvulaires chez les patients ayant des prothèses valvulaires cardiaques. L’utilisation de FRAGMINE ne peut être recommandée dans ce cas.
Surveillance de la kaliémie :
L’héparine peut inhiber la sécrétion surrénalienne de l’aldostérone provoquant une hyperkaliémie, en particulier chez les patients qui présentent, un diabète, une insuffisance rénale chronique, une acidose métabolique préexistante, un taux de potassium plasmatique élevé ou prenant un traitement hyperkaliémiant. Le risque d’une hyperkaliémie semble augmenter en cas de traitement prolongé mais est, habituellement, réversible. Les taux plasmatiques de potassium doivent être surveillés avant de commencer un traitement par héparine, chez les patients à risque, et doivent être suivis régulièrement par la suite, surtout si le traitement se prolonge au-delà de 7 jours.
Excipient :
FRAGMINE 5 000 U.I. anti-Xa/0,2 mL contient moins de 1 mmol (23 mg) de sodium par seringue préremplie, c.-à-d. qu’il est essentiellement « sans sodium ». Les patients suivant un régime hyposodé et les parents dont les enfants reçoivent le traitement par FRAGMINE peuvent être informés que ces formulations de médicaments sont essentiellement « sans sodium ».
Ce médicament peut être dilué davantage avec des solutions contenant du sodium (voir rubrique 4.2 et rubrique 6.6) et ceci doit être pris en compte par rapport à la quantité totale de sodium provenant de toutes les sources qui seront administrées au patient.
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
1. INDEPENDAMMENT DE L’INDICATION
Médicaments augmentant les effets de la daltéparine
Associations déconseillées
L'utilisation conjointe de médicaments agissant à divers niveaux de l'hémostase tels que antiagrégants plaquettaires, AINS, antagonistes des récepteurs GP IIb/IIIa, antagonistes de la vitamine K, thrombolytiques et Dextran peut intensifier l’effet anticoagulant de la daltéparine.
+ Défibrotide
Risque hémorragique accru.
Associations faisant l'objet de précautions d’emploi
+ Anticoagulants oraux
Augmentation du risque hémorragique.
Si l'association ne peut être évitée, renforcer la surveillance clinique et, le cas échéant, biologique.
+ Cobimétinib
Augmentation du risque hémorragique.
Surveillance clinique.
Associations à prendre en compte
+ Antiagrégants plaquettaires
Augmentation du risque hémorragique.
+ Autres hyperkaliémiants
Risque de majoration de l’hyperkaliémie, potentiellement létale.
Certains médicaments ou classes thérapeutiques sont susceptibles de favoriser la survenue d'une hyperkaliémie : les sels de potassium, les diurétiques hyperkaliémiants, les inhibiteurs de l'enzyme de conversion, les antagonistes de l'angiotensine II, les anti-inflammatoires non stéroïdiens, les héparines (de bas poids moléculaire ou non fractionnées), les immunosuppresseurs comme la ciclosporine et le tacrolimus, le triméthoprime.
L’association de ces médicaments majore le risque d'une hyperkaliémie. Ce risque est particulièrement important avec les diurétiques épargneurs de potassium, notamment lorsqu’ils sont associés entre eux ou avec des sels de potassium, tandis que l’association d’un IEC et d’un AINS, par exemple, est à moindre risque dès l’instant que sont mises en œuvre les précautions recommandées.
Pour connaître les risques et les niveaux de contrainte spécifiques aux médicaments hyperkaliémiants, il convient de se reporter aux interactions propres à chaque substance.
Toutefois, certaines substances, comme le triméthoprime, ne font pas l’objet d’interactions spécifiques au regard de ce risque. Néanmoins, ils peuvent agir comme facteurs favorisants lorsqu’ils sont associés à d’autres médicaments déjà mentionnés dans ce chapeau.
+ Les AINS et les analgésiques ASA à doses anti-inflammatoires diminuent la production de prostaglandines vasodilatatrices et en conséquence diminuent le flux sanguin rénal et l’excrétion rénale. Une attention particulière doit être portée lors de l’administration concomitante de la daltéparine sodique et des AINS ou des ASA à fortes doses, chez les insuffisants rénaux.
Cependant, en l’absence de contre-indications spécifiques, les patients souffrant de coronaropathies instables (angor instable et infarctus du myocarde sans onde Q) peuvent être traités par de faibles doses d’acide acétylsalicylique.
+ Glucocorticoïdes (sauf hydrocortisone)
Augmentation du risque hémorragique.
Médicaments antagonisant les effets de la daltéparine
+ L'utilisation concomitante de la daltéparine et de l’andexanet alfa peut réduire l'efficacité de la daltéparine. Il a été démontré que l'andexanet alfa, un facteur Xa de coagulation humain recombinant modifié utilisé pour inverser l'anticoagulation par l'apixaban ou le rivaroxaban, se lie à l'antithrombine III (ATIII) liée à l'héparine et peut réduire l'effet anticoagulant de la daltéparine.
Autres interactions
+ Il a été démontré qu’il existe des interactions entre l’héparine et les médicaments suivants : la nitroglycérine intraveineuse, la pénicilline à doses élevées, la sulfinpyrazone, le probénécide et l’acide étacrinique, les agents cytostatiques, la quinine, les antihistaminiques, la digitaline, les tétracyclines et également avec le tabac et l’acide ascorbique.
Ces interactions doivent également être prises en compte avec la daltéparine sodique.
2. AUX DOSES CURATIVES ET/OU CHEZ LE SUJET AGE
Associations déconseillées
+ Acide acétylsalicylique à des doses anti-inflammatoires (≥ 1 g par prise et/ou ≥ 3 g par jour), à des doses antalgiques ou antipyrétiques (≥ 500 mg par prise et/ou < 3 g par jour)
Augmentation du risque hémorragique (inhibition de la fonction plaquettaire et agression de la muqueuse gastroduodénale par l’acide acétylsalicylique).
Utiliser un autre anti-inflammatoire ou un autre antalgique ou antipyrétique.
+ Anti-inflammatoires non stéroïdiens
Augmentation du risque hémorragique (agression de la muqueuse gastroduodénale par les anti-inflammatoires non stéroïdiens).
Si l'association ne peut être évitée, surveillance clinique étroite.
+ Dextran 40
Augmentation du risque hémorragique (inhibition de la fonction plaquettaire par le Dextran 40).
Associations à prendre en compte
+ Acide acétylsalicylique à des doses antiagrégantes (de 50 mg à 375 mg par jour)
Augmentation du risque hémorragique (inhibition de la fonction plaquettaire et agression de la muqueuse gastroduodénale par l’acide acétylsalicylique).
+ Thrombolytiques
Augmentation du risque hémorragique.
3. AUX DOSES PREVENTIVES
Dans le cas de leur utilisation à doses prophylactiques (en dehors du sujet âgé), l’utilisation de médicaments agissant à divers niveaux de l’hémostase majore le risque de saignement.
Ainsi, chez le sujet non âgé, l’association de l’héparine ou de molécules apparentées, en traitement préventif, à des anticoagulants oraux, des antiagrégants plaquettaires ou des thrombolytiques, doit être prise en compte, en maintenant une surveillance régulière, clinique et, le cas échéant, biologique.
Associations à prendre en compte
+ Acide acétylsalicylique
L’utilisation conjointe de médicaments agissant à divers niveaux de l’hémostase majore le risque de saignement. Ainsi chez le sujet de moins de 65 ans, l’association de l’héparine à doses préventives, ou de substances apparentées, à l’acide acétylsalicylique, quelle que soit la dose, doit être prise en compte en maintenant une surveillance clinique et éventuellement biologique.
+ Anti-inflammatoires non stéroïdiens
Augmentation du risque hémorragique.
4.6. Fertilité, grossesse et allaitement
Grossesse
La daltéparine ne traverse pas la barrière placentaire.
Un grand nombre de données sur les femmes enceintes (plus de 1 000 expositions) n'indiquent aucune toxicité malformative ni aucune toxicité fœtale ni néonatale. FRAGMINE peut être utilisé pendant la grossesse en cas de nécessité clinique.
Plus de 2 000 cas (études, séries de cas et rapports de cas) sur l’administration de daltéparine pendant la grossesse ont été publiés. Les résultats indiquent un risque moindre d'hémorragie et de fracture ostéoporotique en comparaison avec l'héparine non fractionnée (HNF).
La plus grande étude prospective « Efficacité de la thromboprophylaxie comme intervention chez la femme enceinte » (Efficacy of Thromboprophylaxis as an Intervention during Gravidity (EThIG)), portait sur 810 femmes enceintes et étudiait une classification du risque spécifique à la grossesse (risque faible, élevé, très élevé de thromboembolie veineuse) avec des doses quotidiennes de daltéparine comprises entre 50 et 150 U.I./kg (dans certains cas jusqu'à max. 200 U.I./kg). Cependant, seules quelques études contrôlées randomisées sont disponibles sur l'utilisation d'héparines de bas poids moléculaire au cours de la grossesse.
Les études effectuées chez l'animal n'ont pas mis en évidence d'effet tératogène ni fœtotoxique de la daltéparine sodique (voir rubrique 5.3 Données de sécurité préclinique).
L’anesthésie péridurale est une contre-indication absolue chez la femme enceinte traitée par de fortes doses d’anticoagulants (voir rubrique 4.3 Contre-indications). La prudence est de mise lors du traitement de patientes présentant un risque accru d'hémorragie, telles que les femmes en état périnatal (voir rubrique 4.4 Mises en garde spéciales et précautions d'emploi).
Au cours du dernier trimestre de la grossesse, la demi-vie de l’activité anti Xa de la daltéparine est de 4 à 5 heures.
Des échecs thérapeutiques ont été rapportés chez des femmes enceintes portant des prothèses de valves cardiaques artificielles et traitées par des doses anticoagulantes d'héparine de bas poids moléculaire uniquement. L'utilisation de FRAGMINE n'a pas été correctement étudiée chez les femmes enceintes munies de prothèses de valves cardiaques.
De faibles quantités de daltéparine sodique sont excrétées dans le lait maternel. A ce jour, les études ont révélé des taux d’anti-facteur Xa au niveau du lait maternel de 2 à 8 % par rapport aux taux plasmatiques (15 femmes, 3ème au 5ème jour d’allaitement, 2 à 3 heures après l’administration sous-cutanée de la daltéparine sodique). Aucun effet anticoagulant chez le nourrisson allaité n’est attendu. Cependant, le traitement par la daltéparine sodique ne peut être instauré pendant l’allaitement que si les bénéfices pour la mère sont supérieurs aux risques potentiels pour le nourrisson.
Un risque pour l'enfant allaité ne peut être exclu. La décision de poursuivre ou d'interrompre l'allaitement ou le traitement avec FRAGMINE doit être prise en analysant le bénéfice de l'allaitement pour l'enfant et du traitement par FRAGMINE pour la mère.
Fertilité
Sur la base des données cliniques actuelles, rien ne prouve que la daltéparine sodique affecte la fertilité. Aucun effet sur la fertilité, l’acte sexuel, ou le développement péri- et postnatal n'a été remarqué lorsque la daltéparine sodique a été testée chez les animaux.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
FRAGMINE n’a aucun effet sur l’aptitude à conduire des véhicules et à utiliser des machines.
Environ 3% des patients ayant reçu un traitement prophylactique ont fait l’objet d’un rapport d’effets secondaires.
Les effets indésirables rapportés qui peuvent être liés à la daltéparine sodique, sont listés ci-dessous selon la classification par système-organe et par leur fréquence : fréquents (³ 1/100, < 1/10), peu fréquents (³ 1/1 000, < 1/100), rares (³ 1/10 000).
|
Classe de système d'organe |
Fréquence |
Réactions indésirables |
|
Affections hématologiques et du système lymphatique |
Fréquent |
Thrombopénie modérée (Type I), généralement réversible pendant le traitement |
|
Rare |
Thrombopénie immuno-allergique induite par l'héparine (Type II, avec ou sans complications thrombotiques associées) |
|
|
Fréquence indéterminée* |
Possibilité d'élévation asymptomatique et réversible de la numération plaquettaire |
|
|
Affections du système immunitaire |
Peu fréquent |
Hypersensibilité |
|
Fréquence indéterminée* |
Réactions anaphylactiques |
|
|
Troubles du métabolisme et de la nutrition |
Fréquent |
Hyperkaliémie** |
|
Affections du système nerveux |
Fréquence indéterminée* |
Des hémorragies intracrâniennes ont été rapportées, dont certaines fatales |
|
Affections vasculaires |
Fréquent |
Hémorragie |
|
Affections gastro-intestinales |
Fréquence indéterminée* |
Des hémorragies rétro-péritonéales ont été rapportées, dont certaines fatales |
|
Affections hépatobiliaires |
Fréquent |
Elévation transitoire des transaminases |
|
Affections de la peau et du tissu sous-cutané |
Rare |
Nécrose cutanée au site d'injection a été rapportée avec des héparines. Ces réactions peuvent être précédées d'un purpura ou de placards érythémateux infiltrés et douloureux. La suspension du traitement doit être immédiate. Alopécie transitoire. |
|
Fréquence indéterminée* |
Eruption cutanée |
|
|
Troubles généraux et anomalies au site d'administration |
Fréquent |
Hématome sous-cutané au site d'injection Douleur au site d'injection |
|
Lésions, intoxications et complications liées aux procédures |
Rare |
Hématome rachidien ou épidural (voir rubriques 4.3 Contre-indications et 4.4 Mises en garde spéciales et précautions d'emploi) |
|
*(Ne peut être estimée sur la base des données disponibles) ** Les produits à base d’héparine peuvent provoquer un hypoaldostéronisme, pouvant conduire à une augmentation du potassium plasmatique. Une hyperkaliémie significative sur le plan clinique peut se produire, surtout chez les patients atteints d'insuffisance rénale chronique et de diabète sucré (voir rubrique 4.4 Mises en garde spéciales et précautions d'emploi). |
||
· Manifestations hémorragiques : elles surviennent essentiellement en présence :
o de facteurs de risque associés : lésions organiques susceptibles de saigner, certaines associations médicamenteuses (voir rubriques 4.3 Contre-indications et 4.5 Interactions avec d'autres médicaments et autres formes d'interactions), âge, insuffisance rénale, faible poids ;
o de non-respect des modalités thérapeutiques, notamment durée de traitement et adaptation de la dose en fonction du poids (voir rubrique 4.4 Mises en garde spéciales et précautions d'emploi/risque hémorragique),
Le risque d’hémorragie est dose-dépendant. La plupart des hémorragies sont modérées. Certains cas graves ont été rapportés, dont certains fatals.
De rares cas d'hématomes intrarachidiens ont été rapportés lors de l'administration d'héparine de bas poids moléculaire au cours d'une rachianesthésie, d'une analgésie ou d'une anesthésie péridurale. Ces événements ont entraîné des lésions neurologiques de gravité variable dont des paralysies prolongées ou permanentes (voir rubrique 4.4 Mises en garde spéciales et précautions d’emploi).
· L'administration par voie sous-cutanée peut entraîner la survenue d'hématomes au point d'injection. Ils sont majorés par le non-respect de la technique d'injection ou l'utilisation d'un matériel d'injection inadéquat. Des nodules fermes disparaissant en quelques jours traduisent un processus inflammatoire et ne sont pas un motif d'arrêt du traitement.
· Des thrombopénies ont été rapportées. Elles sont de deux types :
o les plus fréquentes, de type I, sont habituellement modérées (> 100 000/mm3), précoces (avant le 5ème jour) et ne nécessitent pas l'arrêt du traitement,
o rarement des thrombopénies immuno-allergiques graves de type II (TIH). Leur prévalence est encore mal évaluée (voir rubrique 4.4 Mises en garde spéciales et précautions d'emploi).
· Rares manifestations allergiques cutanées ou générales susceptibles, dans certains cas, de conduire à l'arrêt du médicament.
· Le risque d'ostéoporose ne peut être exclu, comme avec les héparines non fractionnées, lors de traitement prolongé, bien que ce risque n’ait pas été observé avec la daltéparine.
Population pédiatrique
La fréquence, le type et la gravité des effets indésirables attendus chez l’enfant semblent être identiques à ceux observés chez l’adulte. La sécurité sur une administration à long terme de dalteparine n’a pas été établie.
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr/.
Le surdosage accidentel après administration sous-cutanée de doses massives d'héparine de bas poids moléculaire pourrait entraîner des complications hémorragiques.
La protamine exerce un effet inhibiteur sur l'hémostase primaire et ne doit être utilisée qu'en cas d'urgence.
En cas d'hémorragie, un traitement par sulfate de protamine (1 mg) peut être indiqué pour son effet anticoagulant dans certains cas, en tenant compte des faits suivants :
· son efficacité est nettement inférieure à celle rapportée lors d'un surdosage par l'héparine non fractionnée ;
· en raison de ses effets indésirables (notamment choc anaphylactique), le rapport bénéfice/risque du sulfate de protamine sera soigneusement évalué avant prescription.
La neutralisation est dans ce cas effectuée par l'injection intraveineuse lente de protamine (sulfate ou chlorhydrate).
La dose de protamine utile est fonction :
· de la dose d'héparine injectée (on peut utiliser 100 UAH de protamine pour neutraliser l'activité de 100 U.l. anti-Xa d'héparine de bas poids moléculaire),
· du temps écoulé depuis l'injection de l'héparine, avec éventuellement une réduction des doses de l'antidote.
Néanmoins, il n'est pas possible de neutraliser totalement l'activité anti-Xa.
Par ailleurs, la cinétique de résorption de l'héparine de bas poids moléculaire peut rendre cette neutralisation transitoire et nécessiter de fragmenter la dose totale calculée de protamine en plusieurs injections (2 à 4), réparties sur 24 heures.
En cas d'ingestion, même massive, d'héparine de bas poids moléculaire (aucun cas rapporté), aucune
conséquence grave n'est, a priori, à redouter, compte tenu de la très faible résorption du produit aux
niveaux gastrique et intestinal.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Classe pharmacothérapeutique : Anti-thrombotiques, code ATC : B01AB04.
La daltéparine est une héparine de bas poids moléculaire dans laquelle les activités antithrombotique et anticoagulante de l'héparine standard ont été dissociées.
Elle est caractérisée par une activité anti-Xa plus élevée que l'activité anti-lla ou antithrombinique. Pour la daltéparine, le rapport entre ces deux activités est de 2,5.
Aux doses prophylactiques, la daltéparine n'entraîne pas de modification notable du TCA.
Etude Parrot (A6301091) : Etude de phase IIIb en ouvert chez des adultes âgés de 18 à 85 ans dont le but est d’optimiser le traitement préventif de la coagulation dans le système extracorporel pendant les procédures d’hémodialyse des sujets atteints d’insuffisance rénale chronique.
Tableau 3 : Données démographiques et conception de l’étude
|
Diagnostic |
Dose de daltéparine, voie d’administration et durée |
Sujets de l’étude |
|
Sujets atteints d’insuffisance rénale terminale nécessitant 3 ou 4 séances d’hémodialyse (de 4 heures ou moins) par semaine, sans autre risque connu de saignement. |
5 000 U.I. de bolus unique administré dans la ligne artérielle du dialyseur au début de la procédure. Cette dose pouvait être ajustée par augmentation/diminution de 500 U.I. ou 1 000 U.I, à la discrétion de l’investigateur. Les critères d’ajustement posologique étaient la survenue d’une coagulation de grade 3 ou 4, un saignement mineur pendant l’hémodialyse ou entre les séances d’hémodialyse, un temps de compression d’accès prolongé (> 10 minutes) ou d’autres événements cliniques. Durée de l’étude de 20 séances d’hémodialyse maximum. |
152 sujets inclus et traités.
Sexe : 106 hommes, 46 femmes. |
La proportion moyenne de séances d’hémodialyse réussies (définies comme une séance d’hémodialyse terminée comme prévu, sans qu’il soit nécessaire de l’arrêter prématurément en raison de la coagulation dans le circuit d’hémodialyse) était de 99,9 % (2774 des 2776 séances d’hémodialyse évaluables ; 50 séances d’hémodialyse ont été exclues de l’analyse parce que l’effet de la daltéparine sodique n’a pas pu être évalué), avec un IC à 95 % de 99,7 % à 100,0 %. Aucune séance d’hémodialyse n’a été interrompue prématurément en raison d’un événement de sécurité lié à un saignement.
Pour les sujets ayant terminé au moins une séance d’hémodialyse, la dose de daltéparine a été ajustée pour 79 sujets (52,3 %) et 72 sujets (47,7 %) ont reçu la dose fixe standard de 5 000 U.I. par séance d’hémodialyse à toutes les séances d’hémodialyse.
Il n’y avait aucune preuve de bioaccumulation des taux sériques d’anti-X. Pour 2 sujets seulement, la valeur avant la séance d’hémodialyse était supérieure au seuil de <0,4 U.I./mL à l’hémodialyse 10, mais cela a été résolu à la séance 20 d’hémodialyse.
Traitement prophylactique de la maladie thrombo-embolique veineuse chez des patients alités pour une affection médicale aiguë
Une étude randomisée (PREVENT) en double insu comparant l'efficacité et la tolérance de la daltéparine 5 000 U.l. anti-Xa/0,2 mL à un placebo administrés une fois par jour, par voie sous-cutanée, pendant 12 à 14 jours dans la prophylaxie de la maladie thrombo-embolique veineuse a été réalisée chez 3706 patients à risque thrombo-embolique veineux considéré comme modéré, alités pour une affection médicale aiguë depuis 3 jours au plus.
Ces patients âgés de plus de 40 ans présentaient une insuffisance cardiaque (classe NYHA III ou IV), une insuffisance respiratoire aiguë, une maladie infectieuse ou rhumatologique aiguë associée à au moins un autre facteur de risque thrombo-embolique veineux (âge > 75 ans, cancer, antécédents thrombo-emboliques veineux, obésité, varices veineuses, traitement hormonal, insuffisance cardiaque ou respiratoire chronique, syndrome myéloprolifératif).
Les patients médicaux à haut risque de complication thrombo-embolique veineuse (infarctus du myocarde à la phase aiguë, pathologie cardiaque nécessitant un traitement anticoagulant comme une arythmie ou une pathologie valvulaire, patients intubés ou ayant fait un accident vasculaire cérébral dans les 3 mois) n'ont pas été inclus dans l'étude.
Le critère principal d'efficacité était l'incidence des événements thrombo-emboliques veineux cliniquement significatifs évalués jusqu'au 21ème jour (+ 3) et définis par la survenue :
· d'une thrombose veineuse profonde (TVP) symptomatique, proximale ou distale, confirmée par échographie Doppler (et phlébographie si nécessaire) ;
· d'une embolie pulmonaire (EP) symptomatique fatale ou non fatale, confirmée par scintigraphie de ventilation-perfusion, angiographie, tomographie, IRM ou autopsie ;
· d'une TVP proximale asymptomatique documentée par échographie Doppler (et phlébographie si nécessaire) ;
· ou d'un décès subit.
L'incidence des évènements thrombo-emboliques veineux était de 2,77 % (42/1518) dans le groupe daltéparine par rapport à 4,96 % (73/1473) dans le groupe placebo (différence : -2,19 ; IC : -3,57 à -0,81 ; p = 0,0015), soit une réduction du risque de 45 %.
Sur le plan de la tolérance, la fréquence des hémorragies majeures comme mineures était faible :
Hémorragies majeures :
· 0,49 % (9/1849) dans le groupe daltéparine par rapport à 0,16 % (3/1833) dans le groupe placebo (RR : 2,98)
Hémorragies mineures :
· 1,03 % (19/1849) dans le groupe daltéparine par rapport à 0,55 % (10/1833) dans le groupe placebo (RR : 1,88 ; IC : 0,88 à 4,04).
Dans une étude multicentrique, contrôlée et randomisée (PROTECT, PROphylaxis for ThromboEmbolism in Critical Care Trial), l’effet thromboprophylactique de la daltéparine (5 000 U.I. anti-Xa une fois par jour) a été comparé à la posologie de l'héparine non fractionnée (HNF, 5 000 U.I. deux fois par jour) chez 3746 patients présentant un état médical critique (76 %) et patients chirurgicaux, admis en unité de soins intensifs (USI) depuis au moins 3 jours.
Le critère principal d'évaluation était la thrombose veineuse profonde (TVP) proximale du membre inférieur, diagnostiquée par échographie de compression régulière.
Environ 90 % des patients ont nécessité une ventilation artificielle. Le traitement des patients avec le médicament de l'étude était autorisé pendant une durée maximale de 90 jours en soins intensifs. La durée médiane d'administration du médicament de l'étude dans les deux groupes, était de 7 jours (intervalle interquartile, 4 à 12). Une évaluation en insu des événements thrombotiques et hémorragiques a été réalisée.
Il n’y a pas eu de réduction du risque de TVP proximale du membre inférieur entre les deux groupes (5,1% vs 5,8 %, HR 0,92 ; IC 95% : 0,68 - 1,23 ; P = 0,57).
Concernant les critères d’évaluation secondaires, bien qu’il n’y ait pas de réduction des événements thrombotiques (HR 0,87, IC 95% : 0,69 - 1,10, P = 0,24), ni de la mortalité à l’hôpital (HR 0,92, IC 95% : 0,80 – 1,05, P = 0,21), l’incidence des embolies pulmonaires est diminuée par le traitement par daltéparine (1,3% vs 2,3%, IC 95% : 0,30 – 0,88 ; P = 0,01).
Pour ce qui est des hémorragies majeures, il n’y a pas de différence significative entre les deux groupes (HR 1,00 ; IC 95% : 0,75 - 1,34 ; P = 0,98).
Population pédiatrique
Traitement de la thromboembolie veineuse (TEV) symptomatique chez les patients pédiatriques
Un essai clinique de phase II, en ouvert et multicentrique, a étudié 38 patients pédiatriques présentant une thrombose veineuse profonde (TVP) et/ou une embolie pulmonaire (EP) aiguës diagnostiquées de manière objective. (24 hommes ; 14 femmes) représentant 5 groupes d’âge, avec cancer (N = 26) et sans cancer (N = 12). Au total, 26 patients ont terminé l’étude et 12 l’ont interrompue prématurément (4 en raison d’événements indésirables, 3 patients ont retiré leur consentement et 5 pour d’autres raisons). Les patients ont été traités avec de la daltéparine deux fois par jour pendant 3 mois maximum, avec des doses initiales en fonction de l’âge et du poids et en utilisant un incrément d’adaptation posologique de 25 U.I./kg.
L’efficacité du traitement en termes de régression, de progression, de résolution ou d’absence de changement de la TEV qualifiante a été évaluée par des modalités d’imagerie lors de la sélection et à la fin de l’étude (FE).
A la fin de l’étude (N = 34), 21 (61,8 %) patients avaient obtenu la résolution de la TEV qualifiante ; 7 (20,6 %) patients ont montré une régression, 2 (5,9 %) patients n’ont montré aucun changement, aucun patient n’a présenté de progression et 4 (11,8 %) patients n’ont pas fourni de données pour cette analyse. En outre, 1 (2,9 %) patient a présenté une nouvelle TEV au cours de l’étude.
Les doses médianes de daltéparine (U.I./kg) nécessaires pour atteindre un taux thérapeutique d’anti-Xa (0,5 à 1,0 U.I./mL) pendant la période d’adaptation de la dose de 7 jours sont présentées dans le tableau 4. Les taux thérapeutiques d’anti-Xa (0,5 à 1,0 U.I./mL) ont été atteints en 2,6 jours (moyenne). Les événements hémorragiques chez les patients ayant reçu au moins une dose du médicament à l’étude (N = 38) comprenaient 1 (2,6 %) événement hémorragique majeur ; 0 (0 %) événement hémorragique non majeur cliniquement pertinent ; 16 (42,1 %) événements hémorragiques mineurs ; et 14 (36,8 %) patients n’ont présenté aucun événement hémorragique.
Tableau 4 - Doses d’entretien médianes de daltéparine (U.I./kg) après adaptation de la dose (par incréments de 25 U.I./kg) associées à un taux d’anti-Xa thérapeutique (0,5 à 1,0 U.I./mL) par cohorte d’âge (N = 34)
|
Cohorte d’âge |
N |
Dose médiane (U.I./kg) |
|
0 à moins de 8 semaines |
0 |
N/A |
|
Supérieure ou égale à 8 semaines et inférieure à 2 ans |
2 |
208 |
|
Supérieure ou égale à 2 ans et inférieure à 8 ans |
8 |
128 |
|
Supérieure ou égale à 8 ans et inférieure à 12 ans |
7 |
125 |
|
Supérieure ou égale à 12 ans et inférieure à 19 ans |
17 |
117 |
Un essai clinique prospectif, multicentrique, randomisé et contrôlé a évalué la durée du traitement de la thrombose chez 18 enfants (0 à 21 ans) recevant un traitement anticoagulant par daltéparine deux fois par jour et a déterminé la dose de daltéparine par kilogramme nécessaire pour obtenir un taux d’anti-Xa de 0,5 à 1,0 U.I./mL 4 à 6 heures après l’administration de la dose, par groupe d’âge (pré-spécifié comme nourrissons < 12 mois, enfants 1 – < 13 ans, et adolescents 13 – < 21 ans).
Les résultats de cette étude ont révélé que les doses thérapeutiques médianes (intervalle) par groupe d’âge étaient les suivantes : nourrissons (n = 3), 180 U.I./kg (146 – 181 U.I./kg) ; enfants (n = 7), 125 U.I./kg (101 – 175 U.I./kg) ; et adolescents (n = 8), 100 U.I./kg (91 – 163 U.I./kg).
Une analyse rétrospective a examiné les résultats cliniques et de laboratoire de l’utilisation prophylactique et thérapeutique de la daltéparine chez les enfants (0 – 18 ans) dans une seule institution (Mayo Clinic) pour le traitement de la TEV du 1er décembre 2000 au 31 décembre 2011.
Les données de traitement de 166 patients au total ont été examinées, dont 116 patients ayant reçu des doses prophylactiques de daltéparine et 50 patients ayant reçu des doses thérapeutiques. Les 50 patients ayant reçu des doses thérapeutiques, soit une ou deux fois par jour, comprenaient 13 patients âgés de moins de 1 an et 21 patients atteints de tumeurs malignes. Les résultats ont révélé que les patients âgés de moins de 1 an nécessitaient une dose basée sur le poids significativement plus élevée pour atteindre des taux d’anti-Xa thérapeutiques par rapport aux enfants (1 – 10 ans) ou aux adolescents (> 10 – 18 ans) (dose moyenne en unités/kg/jour ; 396,6 contre 236,7 et 178,8 respectivement, p < 0,0001).
Sur les 50 enfants traités dans le cadre de cette étude rétrospective, 17 étaient des nourrissons âgés de moins de 2 ans (âge moyen de 6 mois ; 10/17 garçons). La plupart des nourrissons (12/17) ont été traités deux fois par jour avec une dose initiale médiane de daltéparine de 151 U.I./kg (intervalle : 85– 174 U.I./kg) ; 5 nourrissons ont été traités une seule fois par jour, avec des doses similaires. Les 17 nourrissons ont été traités pendant 1 à 3 mois (médiane : 2 mois) et la résolution de la TEV est survenue chez 82 % d'entre eux ; aucun n'a présenté de complications hémorragiques ou d'effets indésirables liés à la daltéparine.
Prophylaxie de la thromboembolie veineuse chez les patients pédiatriquesUne grande étude prospective (Nohe et al, 1999) a étudié l’efficacité, la sécurité et la relation entre la dose et l’activité anti-Xa plasmatique avec la daltéparine dans le traitement prophylactique et curatif des thromboses veineuses et artérielles chez 48 patients pédiatriques (32 hommes, 16 femmes ; 31 semaines avant terme jusqu’à 18 ans).
Huit enfants présentant des facteurs de risque de thrombose (obésité, déficit en protéine C, carcinome) ont reçu de la daltéparine pour la prophylaxie d’immobilisation et 2 pour la prophylaxie « à haut risque » après une chirurgie cardiaque (groupe I). Trente-six enfants ont reçu de la daltéparine à visée thérapeutique après des événements thromboemboliques artériels ou veineux (groupes II – IV). Dans le groupe thérapeutique, 8/36 enfants (22 %) ont été traités par la daltéparine pour la prophylaxie de réocclusion après un traitement thrombolytique réussi (groupe II), 5/36 (14 %) après l’échec d’un traitement thrombolytique inférieur par rtPA ou urokinase (groupe III) et 23/36 (64 %) pour un traitement antithrombotique primaire en raison de contre-indications à la thrombolyse (groupe IV).
Dans cette étude, 10 patients ayant reçu de la daltéparine pour la thromboprophylaxie ont eu besoin d’une dose d’entretien de 95 ± 52 U.I./kg par voie sous-cutanée (SC) une fois par jour afin d’atteindre un taux d’anti-Xa de 0,2 à 0,4 U.I./mL sur une durée de 3 à 6 mois. Aucun événement thromboembolique n’est survenu chez les 10 patients recevant de la daltéparine pour la thromboprophylaxie.
5.2. Propriétés pharmacocinétiques
Les paramètres pharmacocinétiques sont étudiés à partir de l'évolution des activités anti-Xa plasmatiques.
Absorption
Après injection par voie sous-cutanée, la résorption du produit est rapide et proche de 100% ; l'activité plasmatique maximale est observée entre la 3ème et la 4ème heure si la daltéparine est administrée en 2 injections par jour.
Ce pic est décalé entre la 4ème et la 6ème heure si la daltéparine est administrée en 1 injection par jour.
Distribution
Après injection par voie sous-cutanée, la demi-vie de l'activité anti-Xa est supérieure pour les héparines de bas poids moléculaire, comparativement aux héparines non fractionnées.
Cette demi-vie est de l'ordre de 3 à 4 heures.
Quant à l'activité anti-lla, elle disparaît plus rapidement du plasma que l'activité anti-Xa avec les héparines de bas poids moléculaire.
Biotransformation
Elle s'effectue essentiellement au niveau hépatique (désulfatation, dépolymérisation).
Élimination
L'élimination s'effectue principalement par voie rénale sous forme peu ou pas métabolisée.
Populations à risque
Sujet âgé :
Chez le sujet âgé, la fonction rénale étant physiologiquement diminuée, l'élimination est ralentie. Cette modification n'a pas d'influence sur les doses et le rythme des injections en traitement préventif tant que la fonction rénale de ces patients reste dans des limites acceptables, c'est à dire faiblement altérée.
Il est indispensable d'évaluer systématiquement la fonction rénale des sujets âgés de plus de 75 ans par la formule de Cockroft, avant l'instauration d'un traitement par HBPM (voir rubrique 4.4 Mises en garde spéciales et précautions d'emploi).
Hémodialyse :
L'héparine de bas poids moléculaire est injectée dans la ligne artérielle du circuit de dialyse, à des doses suffisantes pour éviter la coagulation du circuit.
Les paramètres pharmacocinétiques ne sont en principe pas modifiés, sauf avec des doses importantes, où le passage dans la circulation générale peut donner lieu à une activité anti-Xa élevée, en rapport avec l'insuffisance rénale terminale.
Population pédiatrique
La pharmacocinétique de la daltéparine administrée deux fois par jour par voie sous-cutanée (SC), mesurée par l’activité anti-Facteur Xa, a été caractérisée chez 89 sujets pédiatriques atteints ou non de cancer provenant de deux études cliniques et de 1 étude observationnelle. La pharmacocinétique (PK) de la daltéparine a été décrite par un modèle à 1 compartiment avec absorption et élimination linéaires et les paramètres PK sont présentés dans le tableau 5. Après correction pour le poids corporel, la clairance (CL/F) diminue avec l’âge, tandis que le volume de distribution à l’état d’équilibre (Vd/F) reste similaire. La demi-vie d’élimination moyenne a augmenté avec l’âge.
Tableau 5 - Paramètres pharmacocinétiques de la daltéparine dans la population pédiatrique
|
Paramètre |
Naissance à < 8 semaines |
≥ 8 semaines à < 2 ans |
≥ 2 ans à < 8 ans |
≥ 8 ans à < 12 ans |
≥ 12 ans à < 19 ans |
|
Nombre de patients (N) |
6 |
13 |
14 |
11 |
45 |
|
Âge médian (intervalle) (années) |
0,06 (0,04 – 0,14) |
0,5 (0,2 – 1,91) |
4,47 (2,01 – 7,6) |
9,62 (8,01 – 10,5) |
15,9 (12,0 – 19,5) |
|
Moyenne dérivée (ET) CL/F (mL/h/kg) |
55,8 (3,91) |
40,4 (8,49) |
26,7 (4,75) |
22,4 (3,40) |
18,8 (3,01) |
|
Moyenne dérivée (ET) Vd/F (mL/kg) |
181 (15,3) |
175 (55,3) |
160 (25,6) |
165 (27,3) |
171 (38,9) |
|
Moyenne dérivée (ET) t½β (h) |
2,25 (0,173) |
3,02 (0,688) |
4,27 (1,05) |
5,11 (0,509) |
6,28 (0,937) |
|
CL = clairance ; F = biodisponibilité absolue ; ET = écart-type ; t½β = demi-vie d’élimination ; Vd = volume de distribution. |
|||||
5.3. Données de sécurité préclinique
Hydroxyde de sodium, acide chlorhydrique, eau pour préparations injectables.
3 ans.
D’un point de vue microbiologique, à moins que la méthode d’ouverture et de dilution n’exclue le risque de contamination microbienne, le produit doit être utilisé immédiatement. S’il n’est pas utilisé immédiatement, les durées et conditions de conservation en cours d’utilisation relèvent de la responsabilité de l’utilisateur.
6.4. Précautions particulières de conservation
A conserver à une température inférieure à 30° C.
A conserver dans son emballage jusqu'à l'utilisation.
6.5. Nature et contenu de l'emballage extérieur
La solution injectable est fournie dans une seringue préremplie unidose (verre de type I) avec un protège-aiguille (caoutchouc), un joint de piston (caoutchouc chlorobutyle), une tige de piston (polypropylène) et un système de sécurité Needle-Trap. Le protège-aguille peut contenir du latex (voir rubrique 4.4).
Boîte de 2, 5, 6 ou 10.
Toutes les présentations peuvent ne pas être commercialisées.
6.6. Précautions particulières d’élimination et de manipulation
Utilisation du système de sécurité de l’aiguille :
Le système de sécurité de l’aiguille consiste en un dispositif de sécurité en plastique rattaché à l’étiquette collée sur la seringue. Il est destiné à éviter les piqûres accidentelles après injection.
Le système de sécurité nécessite pour être activé, les actions suivantes :
· Saisir le bout du système de sécurité en plastique et l’éloigner du capuchon protecteur de l’aiguille.
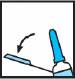
· Ôter le capuchon protecteur de l’aiguille.

· Injecter selon le protocole habituel.
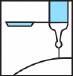
· Retirer l’aiguille du patient.
· Placer le système de sécurité de l’aiguille en plastique contre une surface dure et stable.
· Faire pivoter avec une main le corps de la seringue vers le haut de manière à introduire l’aiguille dans le dispositif : un clic audible confirme le verrouillage de l’aiguille.
· Plier l’aiguille jusqu’à ce que la seringue excède un angle de 45 degrés avec la surface plane pour la rendre inutilisable de manière irréversible.
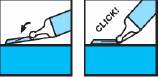
· Eliminer la seringue de manière appropriée.
Lorsqu’une dilution à une concentration de 2 500 U.I./mL est nécessaire, FRAGMINE peut être dilué avec des solutions pour perfusion de chlorure de sodium (9 mg/mL) ou de glucose (50 mg/mL) dans des flacons en verre et des récipients en plastique. Voir le tableau des dilutions à la rubrique 4.2.
Il est recommandé qu’une fois diluée, la solution soit utilisée immédiatement (voir rubrique 6.3).
Tout médicament non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.
Des instructions complètes pour l’administration de FRAGMINE sont fournies à la rubrique « Instructions destinées à la personne qui administre ce médicament » de la notice.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
23-25, AVENUE DU DOCTEUR LANNELONGUE
75014 PARIS
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· 34009 330 107 3 7 : 0,2 mL en seringue pré-remplie (verre) avec système de sécurité de l’aiguille ; boîte de 2.
· 34009 302 729 8 5 : 0,2 mL en seringue pré-remplie (verre) avec système de sécurité de l’aiguille ; boîte de 5.
· 34009 335 298 1 9 : 0,2 mL en seringue pré-remplie (verre) avec système de sécurité de l’aiguille ; boîte de 6.
· 34009 556 085 0 9 : 0,2 mL en seringue pré-remplie (verre) avec système de sécurité de l’aiguille ; boîte de 10.
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
[à compléter ultérieurement par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE
[à compléter ultérieurement par le titulaire]
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Liste I.
ANSM - Mis à jour le : 09/10/2025
FRAGMINE 5 000 U.I. anti-Xa/0,2 mL, solution injectable en seringue pré-remplie
Daltéparine sodique
· Gardez cette notice. Vous pourriez avoir besoin de la relire.
· Si vous avez d’autres questions, interrogez votre médecin, votre pharmacien ou votre infirmier/ère.
· Ce médicament vous a été personnellement prescrit. Ne le donnez pas à d’autres personnes. Il pourrait leur être nocif, même si les signes de leur maladie sont identiques aux vôtres.
· Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin, votre pharmacien ou votre infirmier/ère. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4 QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?.
Que contient cette notice ?
1. Qu'est-ce que FRAGMINE 5 000 U.I. anti-Xa/0,2 mL, solution injectable en seringue pré-remplie et dans quels cas est-il utilisé ?
2. Quelles sont les informations à connaître avant d'utiliser FRAGMINE 5 000 U.I. anti-Xa/0,2 mL, solution injectable en seringue pré-remplie ?
3. Comment utiliser FRAGMINE 5 000 U.I. anti-Xa/0,2 mL, solution injectable en seringue pré-remplie ?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver FRAGMINE 5 000 U.I. anti-Xa/0,2 mL, solution injectable en seringue pré-remplie ?
6. Contenu de l’emballage et autres informations.
1. QU’EST-CE QUE FRAGMINE 5 000 U.I. anti-Xa/0,2 mL, solution injectable en seringue pré-remplie ET DANS QUELS CAS EST-IL UTILISE ?
Classe pharmacothérapeutique : Anti-thrombotiques - code ATC : B01AB04.
Ce médicament est un anticoagulant de la famille des héparines dites de «bas poids moléculaire ».
FRAGMINE est indiqué chez l’adulte de plus de 18 ans pour :
La prévention de la formation d'une thrombose (caillot dans une veine ou une artère) et la prévention de la récidive.
Une héparine de bas poids moléculaire peut être prescrite :
· en traitement préventif, pour éviter une thrombose,
· en traitement curatif, dans le cas d'une thrombose déjà existante.
Ce médicament est utilisé, dans certains cas, en chirurgie pour prévenir le risque de phlébite.
Il est également utilisé pour la prévention de la coagulation dans les circuits de dialyse (en cas d'insuffisance rénale).
FRAGMINE est indiqué chez l’enfant pour :
Le traitement des caillots sanguins dans les veines (thromboembolie veineuse ou TEV) chez les enfants et les adolescents âgés de 1 mois et plus.
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT D’UTILISER FRAGMINE 5 000 U.I. anti-Xa/0,2 mL, solution injectable en seringue pré-remplie ?
N'utilisez jamais FRAGMINE 5 000 U.I. anti-Xa/0,2 mL, solution injectable en seringue pré-remplie :
|
L'UTILISATION de ce médicament est |
CONTRE-INDIQUEE |
DECONSEILLEE |
|
DANS TOUS LES CAS |
· si vous êtes allergique à la daltéparine sodique ou à l’un des autres composants contenus dans ce médicament, mentionnés dans la rubrique 6 CONTENU DE L’EMBALLAGE ET AUTRES INFORMATIONS · si vous avez déjà eu dans le passé un épisode grave de baisse des plaquettes due à l'héparine (les plaquettes sont des éléments du sang importants pour la coagulation sanguine) · si vous avez une maladie connue de la coagulation · en cas de lésion (interne ou externe) risquant de saigner. · en cas d’ulcère de l’estomac ou du duodénum · en cas d’hémorragie cérébrale · lors de la plupart des endocardites (infections du cœur) · en cas de lésions ou interventions chirurgicales au niveau du système nerveux central, des yeux ou des oreilles · en cas d’anesthésie péridurale ou de rachianesthésie ou de ponction lombaire |
· en cas d'insuffisance rénale sévère |
Avertissements et précautions
Adressez-vous à votre médecin, pharmacien ou votre infirmier/ère avant d’utiliser FRAGMINE 5 000 U.I. anti-Xa/0,2 mL, solution injectable en seringue pré-remplie.
Avertissements
Pour éviter la survenue de saignement, il est impératif de ne pas dépasser la dose et la durée de traitement que votre médecin vous a indiquées (voir Précautions).
Ce traitement nécessite des prises de sang répétées pour un contrôle régulier du nombre de vos plaquettes (en général deux fois par semaine).
En effet, très rarement, il peut survenir au cours du traitement par héparine une baisse importante du nombre de plaquettes. Ceci impose un arrêt de l'héparine et une surveillance accrue car des complications graves peuvent survenir, notamment des thromboses de manière paradoxale.
Prévention des thromboses des veines chez les patients alités pour une affection médicale aigüe :
Dans le cas d’une infection aigüe ou d’une maladie rhumatologique aigüe, le traitement n’est justifié que si l’un des critères suivants est présent : âge > 75 ans, tumeur, antécédents de maladie veineuse, obésité, un traitement par les hormones, insuffisance cardiaque, insuffisance respiratoire chronique.
Ce médicament nécessite une surveillance particulière chez l’enfant.
NE PAS INJECTER PAR VOIE INTRAMUSCULAIRE. Les modalités d'injection doivent être très précisément respectées.
Adressez-vous à votre médecin, votre pharmacien ou votre infirmier/ère avant d’utiliser FRAGMINE si vous êtes allergique ou soupçonnez une allergie potentielle au latex (caoutchouc naturel) ou si le protège-aiguille des seringues préremplies de FRAGMINE sera manipulé par une personne qui a une allergie connue ou potentielle au latex (caoutchouc naturel). Le protège-aiguille des seringues préremplies de FRAGMINE peut contenir du latex (caoutchouc naturel) ce qui peut provoquer des réactions allergiques graves chez les personnes allergiques au latex (caoutchouc naturel).
Précautions
Dans certains cas, notamment lors d'un traitement curatif, il peut exister un risque de saignement :
· pour les patients âgés, (risque accru de complications hémorragiques),
· en cas de poids inférieur à 40 kg,
· en cas d'insuffisance rénale,
· en cas de traitement curatif prolongé au-delà de la durée habituelle de 10 jours,
· en cas d'association à certains médicaments (voir rubrique Autres médicaments et FRAGMINE 5 000 U.I. anti-Xa/0,2 mL, solution injectable en seringue pré-remplie),
· en cas d'association à des médicaments majorant le risque hémorragique (voir rubrique Autres médicaments et FRAGMINE 5 000 U.I. anti-Xa/0,2 mL, solution injectable en seringue pré-remplie).
Ces situations peuvent nécessiter une surveillance particulière : examens médicaux et prises de sang éventuelles.
Une anesthésie péridurale ou une rachianesthésie n'est pas contre-indiquée en cas de traitement préventif par ce médicament. Cependant certaines précautions devront être respectées : délai entre l'injection et l'anesthésie, surveillance particulière.
Si vous avez ou si vous avez eu une maladie hépatique ou rénale, une hypertension, une maladie de la rétine due à une hypertension ou à un diabète, un ulcère ou une autre lésion susceptible de saigner, si vous présentez des troubles de la coagulation, prévenez votre médecin.
Enfants et adolescents
FRAGMINE n’est pas utilisé pour les nouveau-nés âgés de moins de 1 mois.
Autres médicaments et FRAGMINE 5 000 U.I. anti-Xa/0,2 mL, solution injectable en seringue pré-remplie
En raison de la survenue possible de saignement, prévenez systématiquement votre médecin si vous prenez l'un des médicaments suivants :
· du défibrotide,
· de l'aspirine,
· des anti-inflammatoires non stéroïdiens (AINS),
· du dextran 40 (médicament utilisé en réanimation),
· des anticoagulants oraux (anti-vitamines K),
· du cobimétinib,
· des antiagrégants plaquettaires,
· des médicaments thrombolytiques,
· des médicaments pouvant accroître le taux de potassium dans le sang (hyperkaliémiants),
· des glucocorticoïdes (sauf hydrocortisone).
Les médicaments susceptibles de réduire l'effet de FRAGMINE comprennent :
L’andexanet alfa (médicament utilisé pour inverser les effets de certains anticoagulants, tels que l'apixaban ou le rivaroxaban).
Informez votre médecin ou pharmacien si vous prenez, avez récemment pris ou pourriez prendre tout autre médicament.
Votre médecin pourra adapter les modalités de votre traitement en conséquence.
FRAGMINE 5 000 U.I. anti-Xa/0,2 mL, solution injectable en seringue pré-remplie avec des aliments et boissons
Sans objet.
Grossesse
FRAGMINE peut être utilisé au cours de la grossesse si votre médecin le juge nécessaire.
L’anesthésie péridurale à l’accouchement est contre indiquée lors d’un traitement par de fortes doses de FRAGMINE.
Allaitement
Votre médecin vous indiquera si vous pouvez allaiter pendant votre traitement.
Si vous êtes enceinte ou que vous allaitez, si vous pensez être enceinte ou planifiez une grossesse, demandez conseil à votre médecin ou pharmacien avant de prendre ce médicament.
Conduite de véhicules et utilisation de machines
FRAGMINE n’a aucun effet sur l’aptitude à conduire des véhicules et à utiliser des machines.
FRAGMINE 5 000 U.I. anti-Xa/0,2 mL, solution injectable en seringue pré-remplie contient du sodium
FRAGMINE 5000 U.I. anti-Xa/0,2 mL contient moins de 1 mmol (23 mg) de sodium par seringue préremplie, c.-à-d. qu’il est essentiellement « sans sodium ». Les patients suivant un régime hyposodé et les parents dont les enfants reçoivent le traitement par FRAGMINE peuvent être informés que ces formulations de médicaments sont essentiellement « sans sodium ».
Ce produit peut être préparé avec une solution qui contient du sodium. Informez votre médecin si vous ou votre enfant suivez un régime pauvre en sel (sodium).
3. COMMENT UTILISER FRAGMINE 5 000 U.I. anti-Xa/0,2 mL, solution injectable en seringue pré-remplie ?
Utilisation chez les adultes
Posologie
La dose et la durée du traitement sont déterminées par votre médecin en fonction de votre poids et en fonction de l'indication.
1 mL de FRAGMINE 5 000 U.I. anti-Xa/0,2 mL correspond environ à 25 000 U.I. anti-Xa de daltéparine sodique.
Si ce médicament doit être remplacé par un anticoagulant pris par voie orale, les injections ne seront arrêtées qu'après quelques jours pendant lesquels vous prendrez les 2 traitements en même temps. Il s'agit du temps nécessaire pour que le second traitement soit actif et que les examens sanguins de la coagulation soient au niveau souhaité par votre médecin.
Mode et voie d'administration
VOIE SOUS CUTANEE (en dehors de l'indication dans les circuits de dialyse pour laquelle FRAGMINE est injecté dans le tube de la machine de dialyse).
Ne pas injecter par voie intramusculaire.
Fréquence d'administration
1 ou 2 injections par jour, en fonction de votre cas.
Durée du traitement
En chirurgie générale, la durée du traitement n’excède pas en général 10 jours, sauf quand il est prescrit après certaines opérations de la hanche.
En cas d’affection médicale aigüe, la durée du traitement est de 12 à 14 jours.
Aucune donnée justifiant un traitement prolongé au-delà de 14 jours n’est actuellement disponible.
Utilisation chez les enfants et les adolescents
Traitement des caillots sanguins dans les veines (thromboembolie veineuse symptomatique TEV)
Les doses recommandées dépendent du poids corporel et du groupe d’âge de l’enfant et seront calculées par votre médecin. Votre médecin vous conseillera au sujet de la dose individualisée de FRAGMINE en fonction de ces critères. Ne modifiez pas la posologie et le calendrier de traitement sans consulter votre médecin.
Le tableau suivant indique la dose initiale recommandée pour les enfants et les adolescents en fonction de leur âge :
Enfants âgés de 1 mois à moins de 2 ans : 150 U.I./kg deux fois par jour.
Enfants âgés de 2 ans à moins de 8 ans : 125 U.I./kg deux fois par jour.
Enfants âgés de 8 ans à moins de 18 ans : 100 U.I./kg deux fois par jour.
L’effet de FRAGMINE sera surveillé après la dose initiale et l’adaptation ultérieure de la dose sera effectuée à l’aide d’une analyse de sang.
Si vous avez utilisé plus de FRAGMINE 5 000 U.I. anti-Xa/0,2 mL, solution injectable en seringue pré-remplie que vous n'auriez dû :
Consultez immédiatement votre médecin, en raison d'un risque de saignement.
Si vous oubliez d’utiliser FRAGMINE 5 000 U.I. anti-Xa/0,2 mL, solution injectable en seringue pré-remplie :
Ne prenez pas de dose double pour compenser la dose que vous avez oublié de prendre.
Si vous arrêtez d’utiliser FRAGMINE 5 000 U.I. anti-Xa/0,2 mL, solution injectable en seringue pré-remplie :
Sans objet.
Si vous avez d’autres questions sur l’utilisation de ce médicament, demandez plus d’informations à votre médecin, à votre pharmacien ou à votre infirmier/ère.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
· Saignements de gravité variable, extériorisés ou non. Il faut avertir immédiatement votre médecin ou l'infirmière ; ils peuvent être favorisés par une lésion risquant de saigner, par une insuffisance rénale ou par certains médicaments pris pendant la même période,
· Hémorragies dans la partie postérieure de l'abdomen ou hémorragies intracrâniennes, certaines pouvant être graves,
· Baisse du nombre de plaquettes dans le sang, qui peut dans certains cas être grave et qu'il importe de signaler immédiatement au médecin traitant (voir Avertissements et précautions). C'est pourquoi le nombre de plaquettes sera contrôlé régulièrement,
· Augmentation du taux de potassium dans le sang (hyperkaliémie) (fréquence : fréquent),
· Possibilité d'élévation asymptomatique et réversible des plaquettes,
· Rares réactions cutanées sévères au point d'injection,
· Chute des cheveux ou des poils,
· Il est fréquent de voir apparaître des hématomes ou de sentir des nodules («boules») sous la peau au point d'injection, ce qui peut être plus ou moins douloureux. Ceux-ci disparaîtront spontanément et ne doivent pas faire interrompre le traitement,
· Allergies locales ou générales,
· Risque d'ostéoporose (déminéralisation du squelette entraînant une fragilité osseuse) lors de traitement prolongé,
· Autres effets : élévation du taux sanguin de certaines enzymes du foie,
· Dans de rares cas, des lésions neurologiques de gravité variable ont été rapportées lors de l'administration de ce type de médicament au cours de certaines anesthésies.
Effets indésirables supplémentaires chez les enfants
Les effets indésirables attendus chez l’enfant semblent être identiques à ceux observés chez l’adulte, cependant il existe peu d’information quant aux possibles effets secondaires à long terme chez l’enfant.
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin, votre pharmacien ou à votre infirmier/ère. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr/.
En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.
5. COMMENT CONSERVER FRAGMINE 5 000 U.I. anti-Xa/0,2 mL, solution injectable en seringue pré-remplie ?
Tenir ce médicament hors de la vue et de la portée des enfants.
N’utilisez pas ce médicament après la date de péremption indiquée sur l’étiquette et la boîte. La date de péremption fait référence au dernier jour de ce mois.
A conserver à une température inférieure à 30 °C.
D'un point de vue microbiologique, la solution diluée doit être utilisée immédiatement. Si elle n'est pas utilisée immédiatement, les durées de conservation en cours d'utilisation et les conditions préalables à l'utilisation relèvent de la responsabilité de l'utilisateur.
A conserver dans son emballage jusqu'à l'utilisation.
Ne jetez aucun médicament au tout-à-l’égout ou avec les ordures ménagères. Demandez à votre pharmacien d’éliminer les médicaments que vous n’utilisez plus. Ces mesures contribueront à protéger l’environnement.
6. CONTENU DE L’EMBALLAGE ET AUTRES INFORMATIONS
Ce que contient FRAGMINE 5 000 U.I. anti-Xa/0,2 ml, solution injectable en seringue pré-remplie
· La substance active est :
Daltéparine sodique ....................................................................................... 5 000 U.I. anti-Xa
Pour une seringue pré-remplie de 0,2 mL.
· Les autres composants sont :
Hydroxyde de sodium, acide chlorhydrique et eau pour préparations injectables.
Ce médicament se présente sous forme de solution injectable en seringue pré-remplie. Boîte de 2, 5, 6 ou 10.
Toutes les présentations peuvent ne pas être commercialisées.
Titulaire de l’autorisation de mise sur le marché
23-25, AVENUE DU DOCTEUR LANNELONGUE
75014 PARIS
Exploitant de l’autorisation de mise sur le marché
23-25, AVENUE DU DOCTEUR LANNELONGUE
75014 PARIS
CATALENT FRANCE LIMOGES S.A.S.
Z.I. NORD
53, RUE DE DION BOUTON
87280 LIMOGES
FRANCE
Ou
PFIZER MANUFACTURING BELGIUM NV
RIJKSWEG 12
2870 PUURS-SINT-AMANDS
BELGIQUE
Noms du médicament dans les Etats membres de l'Espace Economique Européen
Sans objet.
La dernière date à laquelle cette notice a été révisée est :
[à compléter ultérieurement par le titulaire]
Des informations détaillées sur ce médicament sont disponibles sur le site Internet de l’ANSM (France).
Les informations suivantes sont destinées exclusivement aux professionnels de santé :
INSTRUCTIONS DESTINEES A LA PERSONNE QUI ADMINISTRE CE MEDICAMENT
Utiliser la présentation adaptée à la dose prescrite.
1 mL de FRAGMINE 5 000 U.I. anti-Xa/0,2 mL correspond environ à 25 000 U.I. anti-Xa de daltéparine sodique.
Mode et voie d'administration
VOIE SOUS CUTANEE (en dehors de l'indication dans les circuits de dialyse pour laquelle FRAGMINE est injecté dans le tube de la machine de dialyse).
Ne pas injecter par voie intramusculaire.
Comment injecter FRAGMINE
FRAGMINE est administré sous la peau (par voie sous-cutanée). Cette rubrique de la notice explique comment vous devez injecter FRAGMINE à vous-même ou à votre enfant. Vous ne devez suivre ces instructions qu’après avoir été formé(e) par votre médecin. Si vous n’êtes pas sûr(e) de ce que vous devez faire, parlez-en immédiatement à votre médecin. Vous devez injecter (ou administrer) la dose de FRAGMINE aux moments recommandés par votre médecin.
Lorsqu’une dilution est nécessaire avant d’administrer FRAGMINE aux enfants, elle doit être effectuée par un professionnel de santé. Vous devez suivre les instructions de votre médecin sur la manière d’injecter et le moment auquel il faut injecter le médicament dilué qui vous est fourni.
Veuillez suivre les étapes expliquées ci-dessous
Etape 1 : la façon de préparer votre seringue pour l’injection dépendra de la présentation spécifique de FRAGMINE que vous allez utiliser.
Si vous utilisez une seringue préremplie avec système de sécurité Needle-Trap :
Le système de sécurité Needle-Trap est spécialement conçu pour aider à prévenir les accidents d’aiguille après la bonne utilisation de FRAGMINE. Il s’agit d’un dispositif de sécurité en plastique fixé sur l’étiquette collée à la seringue. Il est utilisé pour éviter les piqûres accidentelles après la bonne injection de FRAGMINE. Le Needle-Trap se compose d’une languette en plastique (pince) parallèle au long de l’aiguille, fermement attaché à l’étiquette sur le corps de la seringue.
Le système de sécurité nécessite les actions suivantes pour être activé : Prenez la seringue, saisissez la pointe du récupérateur d’aiguille en plastique et pliez-le pour l’éloigner de la protection (voir figure 1).
Figure 1
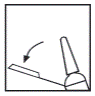
Retirez le capuchon en caoutchouc gris en le tirant tout droit (voir figure 2)
Figure 2
Vous remarquerez une bulle d’air dans la seringue. Elle est censée être là et vous pouvez simplement l’ignorer. Il est important de ne pas appuyer sur le piston tout de suite car une partie du médicament pourrait être perdue. La bulle d’air dans les seringues jetables ne doit pas être expulsée avant l’injection, car cela peut entrainer une perte de médicament et donc une diminution de la dose.
Le flacon doit être utilisé avec des aiguilles de très fin calibre (au maximum 0,5 mm de diamètre).
Vous êtes maintenant prêt(e) à effectuer l’injection. Passez à l’étape 2.
Etape 2 : choix et préparation de la zone d’injection sous-cutanée
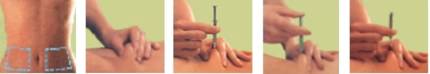
Zone en forme de « U » autour du nombril.
Côté de la partie médiane des cuisses.
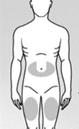
· Utilisez un site d’injection différent à chaque administration d’une dose.
· N’effectuez pas l’injection dans des zones où la peau est sensible, meurtrie, rouge ou dure. Evitez les zones présentant des cicatrices.
· Si vous ou l’enfant souffrez de psoriasis, n’injectez pas directement dans des plaques de peau surélevées, épaisses, rouges ou squameuses (« lésions cutanées de psoriasis »).
· Lavez-vous les mains et séchez-les.
· Nettoyez le site d’injection avec un nouveau tampon imbibé d’alcool, en effectuant un mouvement circulaire. Laissez la peau sécher complètement. Ne touchez plus cette zone avant d’effectuer l’injection.
Etape 3 : adopter la bonne position
Vous ou votre enfant devez être assis(e) ou allongé(e) pour l’administration d’une injection sous-cutanée. Si vous effectuez une auto-injection, mettez-vous dans une position assise confortable où vous pouvez voir votre ventre (voir figure 4).
Figure 4
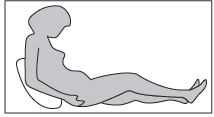
Etape 4 :
Avec le pouce et l’index, soulevez un pli cutané d’une main. De l’autre main, tenez la seringue comme un crayon. Ce sera le site d’injection.
Etape 5 :
Si vous injectez FRAGMINE à un adulte ou à vous-même, tenez la seringue au-dessus de la peau pliée en la maintenant à angle droit (c’est-à-dire verticalement, comme indiqué sur le schéma, et non en biais). Insérez l’aiguille dans la peau jusqu’à ce que l’aiguille soit complètement insérée (voir figure 5).
Figure 5
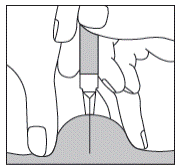
Figure 6
![]()
Etape 6 :
Poussez le piston à fond, à un rythme lent et régulier, pour administrer la dose appropriée. Continuez à pincer le pli cutané pendant l’injection, puis relâchez le pli cutané et retirez l’aiguille.
S’il y a un écoulement de sang au site d’injection, exercez une légère pression. Ne frottez pas le site d’injection, car cela pourrait favoriser la formation d’un hématome.
Pressez un tampon de coton sur le site d’injection pendant 10 secondes. Un léger saignement peut se produire. Ne frottez pas le site d’injection. Vous pouvez placer un pansement sur le site d’injection.
Etape 7 : Si votre seringue a un Needle-Trap, activez le Needle-Trap
Placez le dispositif de protection en plastique contre une surface dure et stable et, d’une main, faites pivoter le corps de la seringue vers le haut de manière à introduire l’aiguille dans le dispositif de protection. Un clic audible confirme le verrouillage de l’aiguille dans le dispositif.
Continuez à plier l’aiguille jusqu’à ce que la seringue excède un angle de 45 degrés avec la surface plane pour la rendre inutilisable de manière irréversible.
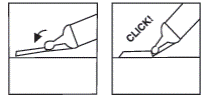
Etape 8 :
Jetez la seringue et l’aiguille dans un récipient pour objets pointus ou tranchants. Gardez votre récipient pour objets pointus ou tranchants hors de portée des autres personnes. Lorsque le récipient pour objets pointus ou tranchants est presque plein, jetez-le en suivant les instructions ou parlez-en à votre médecin ou à votre infirmier/ère.