Dernière mise à jour le 01/12/2025
LIKOZAM 1 mg/ml, suspension buvable
Indications thérapeutiques
Classe pharmacothérapeutique : Anxiolytiques - code ATC : N05BA09
L’ingrédient actif de ce médicament est le clobazam. Le clobazam fait partie d’un groupe de médicaments appelés benzodiazépines. Il agit en produisant un effet sédatif sur le cerveau.
LIKOZAM peut être utilisé pour :
· le traitement symptomatique de l’anxiété sévère (utilisation à court terme seulement) ;
· le traitement de l’épilepsie (crises convulsives) chez l’adulte et l’enfant de plus de 2 ans (en association avec d’autres médicaments) ;
· les maladies mentales comme la schizophrénie (en association avec d’autres traitements).
Présentations
> flacon(s) en verre jaune(brun) de 150 ml avec fermeture de sécurité enfant avec seringue : corps en polypropylène et piston en polyéthylène haute densité (PEHD) avec adaptateur pour flacon polyéthylène basse densité (PEBD)
Code CIP : 34009 300 162 8 2
Déclaration de commercialisation : 10/06/2016
Cette présentation n'est pas agréée aux collectivités
Documents de bon usage du médicament
- Quelle place pour les benzodiazépines dans l’anxiété ?
Auteur : Haute autorité de santé
Type : Fiche Bon Usage du Médicament
Date de mise à jour :Juillet 2018
- Arrêt des benzodiazépines et médicaments apparentés : démarche du médecin traitant en ambulatoire
Auteur : Haute autorité de santé
Type : Fiche mémo
Date de mise à jour :Juin 2015
Service médical rendu (SMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprès de la HAS (plus d'informations dans l'aide). Les avis et synthèses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur du SMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| Important | Avis du 21/09/2016 | Inscription (CT) | Le service médical rendu par LIKOZAM est important dans : • le traitement symptomatique à court terme de l'anxiété sévère, invalidante ou responsable d’un état de détresse inacceptable, y compris les états d’anxiété associés à des troubles affectifs, • le traitement de l’épilepsie partielle ou généralisée, en association avec un autre traitement antiépileptique chez les adultes ou les enfants de plus de 2 ans, en cas d’échec de deux monothérapies consécutives. |
| Insuffisant | Avis du 21/09/2016 | Inscription (CT) | Le service médical rendu par LIKOZAM est insuffisant dans le traitement symptomatique à court terme (2-4 semaines) de l'excitation et de l'agitation chez les patients atteints de schizophrénie ou d'autres troubles psychotiques pour une prise en charge par la solidarité nationale. |
Amélioration du service médical rendu (ASMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprés de la HAS (plus d'informations dans l'aide). Les avis et synthéses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur de l'ASMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| V (Inexistant) | Avis du 21/09/2016 | Inscription (CT) | Compte tenu de l’absence de comparaison d’efficacité entre le clobazam sous forme de comprimés et le clobazam sous sa forme en suspension buvable, LIKOZAM n’apporte pas d’amélioration du service médical rendu (ASMR V) par rapport aux spécialités URBANYL, clobazam en comprimés, dans le traitement symptomatique à court terme de l'anxiété sévère, invalidante ou responsable d’un état de détresse inacceptable, y compris les états d’anxiété associés à des troubles affectifs. La commission de la Transparence reconnaît l’intérêt de la forme en suspension buvable du clobazam, particulièrement chez les patients pour qui la forme en comprimés n’est pas adaptée ainsi que chez les enfants âgés de moins de 6 ans. Cependant, compte tenu de : • l’absence de comparaison d’efficacité entre le clobazam sous forme de comprimés et le clobazam sous sa forme en suspension buvable chez l’adulte et l’enfant de plus de 6 ans, • l’absence de données d’efficacité du clobazam sous sa forme en suspension buvable chez l’enfant de plus de 2 ans à 6 ans, LIKOZAM, en association avec un autre traitement antiépileptique n’apporte pas d’amélioration du service médical rendu (ASMR V) dans la stratégie de traitement de l’épilepsie partielle ou généralisée chez les adultes ou les enfants de plus de 2 ans, qui comprend notamment le clobazam sous forme de comprimés jusqu’à 6 ans, en cas d’échec de deux monothérapies consécutives. |
Autres informations
- Titulaire de l'autorisation : TAW PHARMA (IRELAND) LIMITED
- Conditions de prescription et de délivrance :
- liste I
- prescription limitée à 12 semaines
- Statut de l'autorisation : Valide
- Type de procédure : Procédure décentralisée
- Code CIS : 6 589 960 2
ANSM - Mis à jour le : 06/05/2025
LIKOZAM 1 mg/ml, suspension buvable
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Clobazam............................................................................................................................... 1 mg
Pour 1 ml.
Excipients à effet notoire : parahydroxybenzoate de méthyle sodique (E219) (1,32 mg), parahydroxybenzoate de propyle sodique (E217) (0,33 mg), maltitol liquide (E965) (0,3 g), propylène glycol (E1520) (6,21 mg).
Pour la liste complète des excipients, voir rubrique 6.1.
La coloration de la suspension est blanc cassé.
4.1. Indications thérapeutiques
Dans le traitement des états d'anxiété associés à des troubles affectifs, LIKOZAM doit être utilisé en association avec des traitements adéquats pour le trouble sous-jacent.
Chez les patients atteints de schizophrénie ou d’autres troubles psychotiques, l’utilisation de benzodiazépines n’est recommandée que pour la prise en charge des symptômes à court terme de l'excitation et de l'agitation. Les benzodiazépines ne possèdent pas de propriétés antipsychotiques.
LIKOZAM peut être utilisé en association avec un autre traitement antiépileptique chez les adultes ou les enfants de plus de 2 ans, lorsque le traitement avec un ou plusieurs antiépileptiques est inefficace: traitement des épilepsies partielles simples ou complexes, avec ou sans généralisation secondaire et traitement de tous les types d’épilepsie généralisée (crises toniques / cloniques, crises myocloniques, crises d’absence).
4.2. Posologie et mode d'administration
Si de faibles doses sont requises, la présentation à 1 mg/ml est la plus appropriée. Si de fortes doses sont requises, la forme à 2 mg/ml est la présentation la plus appropriée.
Traitement de l'anxiété
Adultes
La dose anxiolytique habituelle pour les adultes est de 20 à 30 mg par jour en doses fractionnées ou en une seule dose administrée au coucher. Des doses allant jusqu’à 60 mg par jour ont été utilisées dans le traitement de patients adultes atteints d’anxiété sévère.
La plus faible dose qui permet de contrôler les symptômes doit être utilisée. Après amélioration des symptômes, la dose peut être réduite.
LIKOZAM ne doit pas être utilisée pendant plus de 4 semaines. L’utilisation chronique à long terme comme anxiolytique n’est pas recommandée. Dans certains cas, une extension au-delà de la période maximale de traitement peut être nécessaire ;
Le traitement ne doit pas être prolongé sans une réévaluation de l’état du patient par un spécialiste. Il est fortement recommandé d’éviter des périodes prolongées de traitement ininterrompu, car elles peuvent entraîner une dépendance.
Le traitement doit toujours être arrêté progressivement. La période de diminution des doses peut être plus longue chez les patients qui ont pris LIKOZAM pendant une longue période.
Personnes âgées
Pour traiter l’anxiété chez les personnes âgées qui sont plus sensibles aux effets des agents psychoactifs, des doses de 10-20 mg par jour peuvent être utilisées. Le traitement nécessite des doses initiales faibles et une augmentation graduelle de la dose sous observation attentive.
Traitement de l’épilepsie, en association avec un ou plusieurs autres antiépileptiques
Adultes
Dans l’épilepsie, une dose initiale de 20 à 30 mg/jour est recommandée, en augmentant le cas échéant jusqu’à un maximum de 60 mg par jour.
Sujets âgés
Le traitement doit être instauré à faibles doses et l’augmentation des doses doit être progressive, sous surveillance médicale attentive.
Patients pédiatriques de plus de 2 ans
Les doses de LIKOZAM doivent être adaptées individuellement. Elles peuvent être prises en une fois ou fractionnées en 2 à 3 prises par jour, en conservant la même dose totale.
Le patient doit être réévalué après une période ne dépassant pas 4 semaines, puis régulièrement toutes les 4 semaines afin de décider de la nécessité de poursuivre le traitement. Si un phénomène de tolérance pharmacologique apparaît, il peut être bénéfique de suspendre le traitement pour le reprendre ensuite à faible dose. En cas d’arrêt, un arrêt brutal du traitement pouvant augmenter le risque de phénomène de sevrage ou de phénomène de rebond, il est recommandé de diminuer progressivement la dose (y compris chez les patients qui répondent mal au traitement).
Lorsqu’il est prescrit à des enfants, le traitement doit être instauré avec des doses initiales faibles qui seront progressivement augmentées sous surveillance médicale attentive. Le clobazam est généralement instauré à faible dose, souvent 5 mg/j ou de 0,1 mg/kg/j pour les patients plus jeunes, puis la dose est augmentée progressivement par palier de 0,1 à 0,2 mg/kg/j à intervalles de 7 jours, jusqu’à l’obtention d’une dose minimale efficace ou l’apparition d’effets secondaires. Des études ont suggéré qu’une titration lente contribue à éviter les effets indésirables et que lorsque des effets secondaires surviennent, ils peuvent être réduits ou éliminés en diminuant la dose.
Le schéma de titration présenté ci-après a été proposé dans la littérature afin de tenir compte de la grande variabilité du métabolisme liée à la maturation du système P450, en particulier en présence d’inducteurs et d’inhibiteurs, et doit être utilisé avec une augmentation de la dose de 0,1 à 0,2 mg/kg chaque semaine jusqu’à la dose cible.
Une dose d’entretien de 0,3 à 1 mg/kg de poids corporel par jour est habituellement suffisante.
La suspension buvable est particulièrement recommandée pour les enfants et les adultes ayant des difficultés à avaler, car elle permet un dosage sûr et précis.
LIKOZAM ne doit pas être utilisé comme traitement antiépileptique chez les enfants de 6 mois à 2 ans, sauf dans des situations exceptionnelles, lorsqu’il existe une indication manifeste. La dose initiale dans ces indications exceptionnelles doit être la plus faible (0,1 mg/kg/j) et la plus grande prudence s’impose pour la titration, qui ne doit pas dépasser 0,1 mg/kg/j car, dans cette population, les voies de métabolisation du clobazam risquent de ne pas être entièrement développées. À ce jour, aucune recommandation posologique précise ne peut être émise pour cette population.
Insuffisance hépatique et rénale
Le traitement nécessite des doses initiales faibles et une augmentation graduelle de la dose sous observation attentive quel que soit le groupe d’âge du patient.
Mode d’administration
Voie orale uniquement.
Une fois que la dose efficace de clobazam a été atteinte, les patients doivent maintenir leur traitement; la prudence s'impose en cas de changement entre différentes formulations. (Voir rubrique 4.4 - Passage d'une formulation a une autre).
Ce produit peut se sédimenter pendant le stockage. Bien agiter le flacon avant emploi.
LIKOZAM peut être pris avec ou sans aliments.
LIKOZAM ne doit pas être utilisé :
· Chez les patients présentant une hypersensibilité aux benzodiazépines ou à l’un des excipients de LIKOZAM mentionnées à la rubrique 6.1.
· Chez les patients ayant des antécédents de toxicomanie ou de dépendance à l’alcool (risque accru de développement de dépendance).
· Chez les patients atteints de myasthénie (risque d'aggravation de la faiblesse musculaire).
· Chez les patients présentant une insuffisance respiratoire sévère (risque d'aggravation).
· Chez les patients atteints du syndrome d'apnée du sommeil (risque d'aggravation).
· Chez les patients présentant une insuffisance hépatique sévère (risque de déclencher une encéphalopathie).
· Durant l'allaitement.
· En cas d'intoxication aigüe à l'alcool ou à des substances agissant sur le SNC.
Les benzodiazépines ne doivent pas être administrées aux enfants sans une évaluation minutieuse de la nécessité de leur utilisation.
LIKOZAM ne doit pas être utilisé chez les enfants âgés de 6 mois à 2 ans, sauf dans des cas exceptionnels comme traitement antiépileptique, lorsque l'indication d'épilepsie est incontestable.
4.4. Mises en garde spéciales et précautions d'emploi
L'introduction d'un médicament antiépileptique peut, rarement, être suivie d'une recrudescence des crises ou de l'apparition d'un nouveau type de crise chez le patient, et ce indépendamment des fluctuations observées dans certaines maladies épileptiques. En ce qui concerne les benzodiazépines, les causes de ces aggravations peuvent être : un choix de médicament mal approprié vis à vis des crises ou du syndrome épileptique du patient, une modification du traitement antiépileptique concomitant ou une interaction pharmacocinétique avec celui-ci, une toxicité ou un surdosage. Il peut ne pas y avoir d'autre explication qu'une réaction paradoxale.
Passage d'une formulation à une autre
Chez certains individus prenant LIKOZAM, le médicament atteint des niveaux plasmatiques plus élevés que ceux observés pour la même dose de clobazam prise sous forme de comprimé. Cela peut conduire à un risque accru de dépression respiratoire et de sédation, particulièrement lors du passage à ce médicament à partir de comprimés. Par conséquent, la prudence est de rigueur lors du passage d'une formulation de clobazam à l'autre, car la Cmax moyenne après administration d'une dose unique de formulation en suspension est supérieure à celle observée pour la formulation en comprimés.
Population pédiatrique
Des données concernant l'utilisation du produit chez les patients âgés de moins de 2 ans ne sont pas disponibles. Par conséquent, pour toute administration pour le traitement de l'épilepsie chez les enfants de moins de 2 ans, une évaluation minutieuse et la mise en place d'un suivi étroit par le médecin est nécessaire. Plus encore que chez l'adulte, le rapport bénéfice/risque sera scrupuleusement évalué et la durée du traitement aussi brève que possible.
Il est recommandé aux patients de ne pas boire d’alcool pendant leur traitement avec le clobazam (augmentation du risque de sédation et d’autres effets indésirables) (voir rubrique 4.5).
Les benzodiazépines, y compris le clobazam, doivent être utilisées avec extrême précaution chez les patients ayant des antécédents de dépendance médicamenteuse ou non, y compris alcoolique.
Risque lié à l’utilisation concomitante d’opioïdes
L’utilisation concomitante de LIKOZAM et d’opioïdes peut entraîner une sédation, une dépression respiratoire, un coma et le décès. En raison de ces risques, la prescription concomitante de médicaments sédatifs tels que les benzodiazépines ou médicaments apparentés tels que LIKOZAM avec des opioïdes doit être réservée aux patients pour lesquels d’autres options thérapeutiques ne sont pas possibles.
Si la décision de prescrire du clobazam en même temps que des opioïdes est prise, la dose efficace la plus faible doit être utilisée et la durée de traitement doit être aussi courte que possible (voir la rubrique 4.2).
Les patients doivent faire l’objet d’une surveillance étroite afin de détecter tout signe et symptôme de dépression respiratoire et de sédation. À cet égard, il est fortement recommandé d’informer les patients et leurs soignants des symptômes à surveiller (voir la rubrique 4.5).
Tolérance
Une diminution de l’effet anxiolytique des benzodiazépines peut survenir au bout de quelques semaines, suite à l'utilisation répétée du médicament pendant quelques semaines.
En cas d’utilisation de benzodiazépines, y compris de clobazam, pour le traitement de l’épilepsie, il convient de tenir compte de la possibilité d’une diminution de l’effet antiépileptique (développement de la tolérance) pendant le traitement.
Comme avec les autres médicaments antiépileptiques, certains patients peuvent présenter une augmentation de la fréquence des crises ou l’apparition de nouveaux types de crises avec le clobazam. Ces phénomènes peuvent être la conséquence d'un surdosage, d'une diminution des concentrations plasmatiques des antiépileptiques utilisés en association, d'une progression de la maladie ou d'un effet paradoxal.
Dépendance
Tout traitement par des benzodiazépines et apparentés, y compris le clobazam, et plus particulièrement en cas d’utilisation prolongée, peut entrainer un état de pharmacodépendance physique et psychique pour ces produits. Le risque de développer une dépendance augmente avec la dose et la durée du traitement ; il est également plus élevé chez les patients ayant des antécédents de dépendances médicamenteuses, d'abus d'alcool ou de toxicomanie. Par conséquent, la durée du traitement doit être aussi courte que possible (voir rubrique 4.2).
Une pharmacodépendance peut survenir à doses thérapeutiques et/ou chez des patients sans facteur de risque individualisé.
Quand il existe une dépendance physique, l'arrêt brutal du traitement peut entrainer des symptômes de sevrage (ou phénomène de rebond). Ceux-ci comprennent des maux de tête, des douleurs musculaires, une insomnie, une anxiété extrême, une tension, une nervosité, une confusion et une irritabilité. D’autres symptômes sont plus rares: agitation voire épisode confusionnel, paresthésies des extrémités, déréalisation, dépersonnalisation, hyperacousie, engourdissements et picotements dans les extrémités, hypersensibilité à la lumière, au bruit et au contact physique, hallucinations, convulsions et crises d'épilepsie.
Les symptômes du sevrage peuvent se manifester dans les jours qui suivent l'arrêt du traitement.
Un syndrome de sevrage peut également se produire lors du passage brusque d'une benzodiazépine à longue durée d'action (par exemple, LIKOZAM) à une benzodiazépine à courte durée d'action.
Effet rebond sur l’insomnie et l’anxiété : A l’arrêt du traitement, un syndrome transitoire peut se manifester sous la forme d'une exacerbation des troubles qui avaient motivé le traitement par les benzodiazépines et apparentés. Il peut être accompagné par d'autres réactions telles que des sautes d'humeur, de l'anxiété ou des troubles du sommeil et de l'agitation. Puisque le risque de syndrome de sevrage ou de rebond est plus élevé lorsque le traitement est arrêté brusquement, il est recommandé d'arrêter le traitement progressivement.
Pour les benzodiazépines à durée d'action brève, et surtout si elles sont données à doses élevées, des symptômes de sevrage peuvent même se manifester dans l'intervalle qui sépare deux prises. Cela n'est pas attendu avec le clobazam, compte-tenu de sa longue demi-vie (voir rubrique 5.2). En cas d’utilisation prolongée de benzodiazépines à longue durée d’action (comme LIKOZAM), il est important de mettre en garde contre le passage à une benzodiazépine de courte durée d’action, des symptômes de sevrage pouvant survenir.
L'association de plusieurs benzodiazépines risque, quelle qu'en soit l'indication anxiolytique ou hypnotique, d'accroître le risque de pharmacodépendance.
Des cas d'abus ont également été rapportés.
Durée du traitement :
La durée du traitement doit être aussi courte que possible (voir rubrique 4.2). Le traitement ne doit pas être prolongé sans réévaluation de la situation. Au début du traitement, le patient doit être informé de la durée limitée du traitement et de la diminution progressive de la dose. En outre, il est important que le patient soit conscient de la possibilité d'un effet rebond, afin de ne pas être inquiété par ces symptômes lorsqu’ils se produiront, à l'arrêt du traitement.
Amnésie et altérations des fonctions psychomotrices
Réactions paradoxales et psychiatriques
Les benzodiazépines ne sont pas recommandées pour le traitement de première intention des maladies psychotiques.
Troubles du comportement
Chez certains sujets, les benzodiazépines et produits apparentés peuvent entraîner un syndrome associant à des degrés divers une altération de l'état de conscience et des troubles du comportement et de la mémoire.
Des réactions telles que l’aggravation de l’insomnie, impatience, agitation, nervosité, irritabilité, agressivité, délire, colères, cauchemars, idées délirantes, hallucinations, état confuso-onirique, psychoses, comportement inapproprié désinhibition avec impulsivité, euphorie, irritabilité, amnésié antérograde, suggestibilité et autres effets comportementaux indésirables sont associés à l’utilisation des benzodiazépines. Ce syndrome peut s'accompagner de troubles potentiellement dangereux pour le patient ou pour autrui, à type de comportement inhabituel pour le patient, comportement auto- ou hétéro-agressif, notamment si l’entourage tente d’entraver l’activité du patient, conduites automatiques avec amnésie post-événementielle. La survenue de celles-ci impose l’arrêt du traitement.
Risque d’accumulation
Les benzodiazépines et apparentés (comme tous les médicaments) persistent dans l'organisme pour une période de l'ordre de 5 demi-vies (voir rubrique 5.2).
Chez des personnes âgées ou souffrant d'insuffisance rénale ou hépatique, la demi-vie peut s'allonger considérablement. Lors de prises répétées, le médicament ou ses métabolites atteignent le plateau d'équilibre beaucoup plus tard et à un niveau beaucoup plus élevé. Ce n'est qu'après l'obtention d'un plateau d'équilibre qu'il est possible d'évaluer à la fois l'efficacité et la sécurité du médicament.
Une adaptation posologique peut être nécessaire (voir rubrique 4.2).
Grossesse
Compte-tenu des données disponibles, par mesure de prudence, l’utilisation de clobazam est déconseillée au cours de la grossesse quel qu’en soit le terme et chez les femmes en âge de procréer n’utilisant pas de contraception efficace (voir rubrique 4.6).
Modalités d’arrêt progressif du traitement
Elles doivent être énoncées au patient de façon précise.
Outre la nécessité de décroissance progressive des doses, les patients devront être avertis de la possibilité d'un phénomène de rebond, afin de minimiser l'anxiété qui pourrait découler des symptômes liés à cette interruption, même progressive.
Le patient doit être prévenu du caractère éventuellement inconfortable de cette phase.
Sujet âgé
Les benzodiazépines et produits apparentés doivent être utilisés avec prudence chez le sujet âgé, en raison d’une susceptibilité accrue à des réactions telles que somnolence, sensations ébrieuses, faiblesse musculaire, pouvant favoriser les chutes, avec des conséquences souvent graves dans cette population. Une réduction de la dose est recommandée.
Réactions cutanées sévères
Des réactions cutanées sévères, dont le syndrome de Stevens-Johnson (SJS) et syndrome de Lyell également appelé nécrolyse épidermique toxique (NET), ont été rapportées après commercialisation du clobazam chez les enfants et les adultes. La plupart des cas ont été rapportés lors de l’emploi concomitant du clobazam et d’autres antiépileptiques, connus pour entraîner des réactions cutanées sévères.
Le SSJ/NET peuvent conduire à une issue fatale. L’apparition de signes ou symptômes liés à ces réactions cutanées sévères doit être étroitement surveillée chez les patients, particulièrement durant les 8 premières semaines de traitement ou lors de la réintroduction du traitement après une période d’arrêt. Si un SSJ/NET est suspecté, le clobazam doit être arrêté immédiatement, ne plus être ré-administré et une alternative thérapeutique doit être considérée (voir rubrique 4.8).
Insuffisance respiratoire
La fonction respiratoire doit être surveillée chez les patients souffrant d'insuffisance respiratoire sévère chronique ou aigüe et une réduction de la dose de clobazam peut être nécessaire. Le clobazam est contre-indiqué chez les patients souffrant d’insuffisance respiratoire sévère (voir rubrique 4.3).
Chez l'insuffisant respiratoire, il convient de prendre en compte l'effet dépresseur des benzodiazépines et apparentés (d'autant que l'anxiété et l'agitation peuvent constituer des signes d'appel d'une décompensation de la fonction respiratoire qui justifie le passage en unité de soins intensifs).
Insuffisance rénale et hépatique
Faiblesse musculaire
Le clobazam peut provoquer une faiblesse musculaire. Par conséquent, chez les patients présentant une faiblesse musculaire préexistante ou une ataxie cérébelleuse ou spinale, une surveillance particulière est indispensable et une réduction de la dose peut être nécessaire. Le clobazam est contre-indiqué chez les patients atteints de myasthénie grave.
Dépression et troubles de la personnalité
Des effets désinhibiteurs peuvent se manifester de diverses manières. Le traitement peut majorer les risques suicidaires chez les patients qui sont déprimés. Il peut également majorer un comportement agressif envers soi-même ou envers autrui. II est donc nécessaire d'être très prudent dans la prescription de benzodiazépines chez les patients atteints de troubles de la personnalité.
Chez le sujet présentant un épisode dépressif majeur, les benzodiazépines et apparentés ne doivent pas être prescrits seuls car ils laissent la dépression évoluer pour son propre compte avec persistance ou majoration du risque suicidaire.
Métaboliseurs lents du CYP2C19
Utilisation concomitante de cannabidiol
L'utilisation concomitante de clobazam avec des médicaments ou produits non-médicamenteux, contenant du cannabidiol, peut entraîner une exposition accrue au N-desméthylclobazam (N-CLB), conduisant à une augmentation des cas de somnolence et de sédation. Un ajustement de la posologie du clobazam peut être nécessaire. Les produits non-médicamenteux contenant du cannabidiol ne doivent pas être pris en association avec le clobazam car ils contiennent des quantités inconnues de cannabidiol et sont d’une qualité inégale (voir rubriques 4.5 et 5.2).
Mises en garde liées aux excipients
· Ce médicament contient du parahydroxybenzoate de méthyle sodique (E219) et du parahydroxybenzoate de propyle sodique (E217) et peut provoquer des réactions allergiques. Cette allergie peut survenir quelque temps après le début du traitement.
· Ce médicament contient 0,3 g de maltitol liquide (E965) pour 1ml. Les patients présentant des problèmes héréditaires rares d’intolérance au fructose ne devraient pas prendre ce médicament.
· Ce médicament contient 6,21 mg de propylène glycol (E1520) pour 1 ml. L’administration concomitante avec n’importe quel substrat pour l’alcool déshydrogénase comme l’éthanol peut induire des effets indésirables graves chez les nouveau-nés.
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
Il faut prendre en compte le fait que de nombreux médicaments ou substances peuvent additionner leurs effets dépresseurs du système nerveux central et contribuer à diminuer la vigilance. Il s’agit des dérivés morphiniques (analgésiques, antitussifs, et traitements de substitution), des neuroleptiques, des barbituriques, des benzodiazépines, des anxiolytiques autres que les benzodiazépines (par exemple, le méprobamate), des hypnotiques, des antidépresseurs sédatifs (amitryptiline, doxépine, miansérine, mirtazipine, trimipramine), des antihistaminiques H1 sédatifs, des antihypertenseurs centraux, du baclofène et de la thalidomide.
Associations déconseillées
Alcool
La consommation concomitante d'alcool peut augmenter la biodisponibilité du clobazam de 50 % (voir rubrique 5.2) et donc augmenter les effets du clobazam, par exemple la sédation (voir rubrique 4.5).
L'altération de la vigilance peut rendre dangereuses la conduite de véhicules et l'utilisation de machines. Eviter la prise de boissons alcoolisées et de médicaments contenant de l'alcool.
Médicaments dépresseurs du système nerveux central
En particulier lorsque le clobazam est administré à dose élevée, une augmentation de l'effet dépressif central peut se produire en cas d'utilisation concomitante d'antipsychotiques (neuroleptiques), d'hypnotiques, d'anxiolytiques, de sédatifs, d'antidépresseurs, d'analgésiques narcotiques, d'anticonvulsivants, d'anesthésiques et de sédatifs antihistaminiques. Une attention particulière est également nécessaire lorsque le clobazam est administré dans les cas d'intoxication avec de telles substances ou au lithium.
Oxybate de sodium
L’utilisation concomitante d’oxybate de sodium participe à la majoration de la dépression centrale. L’altération de la vigilance peut rendre dangereuses la conduite de véhicules et l’utilisation de machines.
Association faisant l’objet de précautions d’emploi
Stiripentol
Le stiripentol augmente les taux plasmatiques de clobazam et de son métabolite actif N desméthylclobazam, avec risque de surdosage par inhibition du CYP3A et du CYP2C19. La surveillance des taux sanguins de clobazam et de son métabolite actif est recommandée, avant l'instauration du stiripentol, puis lorsque la nouvelle concentration à l'état d'équilibre est atteinte, c'est-à-dire après 2 semaines environ.
Une surveillance clinique, un dosage plasmatique, lorsque cela est possible, du clobazam associé au stiripentol est recommandée et un ajustement de la dose peut être nécessaire.
.Association à prendre en compte
L’utilisation concomitante de benzodiazépines, telles que le clobazam, avec des opioïdes augmente le risque de sédation, dépression respiratoire, coma voire de décès en raison d’un effet dépresseur additionnel sur le système nerveux central (SNC). La dose et la durée du traitement concomitant doivent être limitées (voir rubrique 4.4).
Avec la buprénorphine utilisée en traitement de substitution : Risque majoré de dépression respiratoire, pouvant être fatale.
Evaluer attentivement le rapport bénéfice/risque de cette association. Informer le patient de la nécessité de respecter les doses prescrites.
Anticonvulsivants
L'ajout de clobazam à des médicaments anticonvulsivants (par exemple, phénytoïne, acide valproïque) peut provoquer une variation des taux plasmatiques de ces médicaments. S'il est utilisé en association dans l'épilepsie, la posologie de LIKOZAM doit être déterminée en surveillant l'EEG et la concentration plasmatique des autres médicaments contrôlés.
La phénytoïne et la carbamazépine peuvent causer une augmentation de la conversion métabolique du clobazam en métabolite actif, le N-desméthylclobazam.
IMAO
L’administration concomitante de médicaments inhibant le système monooxygénase, tels que la cimétidine et l’érythromycine, peut augmenter les effets de clobazam.
Analgésiques narcotiques
Si le clobazam est utilisé en association avec les analgésiques narcotiques, une euphorie accentuée peut être possible, ce qui peut conduire à accroître de la dépendance psychologique.
Myorelaxants
Les effets des myorelaxants, des analgésiques et du protoxyde d’azote peuvent être renforcés.
Risque accru de collapsus avec arrêt respiratoire et / ou cardiaque.
Barbituriques
Risque majoré de dépression respiratoire, pouvant être fatale en cas de surdosage.
Autres médicaments sédatifs
Majoration de la dépression centrale.
L’altération de la vigilance peut rendre dangereuses la conduite de véhicules et l’utilisation de machines.
Inhibiteurs du CYP 2C19
Les inhibiteurs puissants et modérés du CYP2C19 peuvent entraîner une exposition accrue au N-desméthylclobazam (N-CLB), le métabolite actif du clobazam.
Un ajustement de la posologie du clobazam peut être nécessaire lorsqu'il est administré en association avec un des inhibiteurs puissants (par exemple, fluconazole, fluvoxamine, ticlopidine) ou modérés (par exemple, l’oméprazole) du CYP2C19 (voir rubrique 5.2).
Utilisation concomitante du clobazam et du cannabidiol
Quand le cannabidiol et le clobazam sont administrés de façon concomitante, il se produit des interactions pharmacocinétiques bidirectionnelles. Sur la base d’une étude sur des volontaires sains, une augmentation des taux (3 à 4 fois) de N-desméthylclobazam (N-CLB, un métabolite actif du clobazam) peut se produire, lorsqu’il est combiné au cannabidiol, probablement due à l'inhibition du CYP2C19. L’augmentation des taux systémiques de ces substances actives peuvent conduire à une augmentation des effets pharmacologiques et une augmentation des effets indésirables du médicament. L’utilisation concomitante du cannabidiol et du clobazam augmente la fréquence des cas de somnolence et de sédation. Une diminution de la posologie en clobazam doit être considérée si la somnolence ou la sédation sont ressenties, quand le clobazam est coadministré avec du cannabidiol.
Substrats du CYP 2D6
Le clobazam est un inhibiteur faible du CYP2D6. Un ajustement posologique des médicaments métabolisés par le CYP2D6 (par exemple, dextrométhorphane, pimozide, paroxétine, nébivolol) peut être nécessaire.
4.6. Fertilité, grossesse et allaitement
Grossesse
De nombreuses données issues d’études de cohorte n’ont pas mis en évidence la survenue d’effets malformatifs lors d’une exposition aux benzodiazépines au cours du 1er trimestre de la grossesse. Cependant, dans certaines études épidémiologiques cas-témoins, une augmentation de la survenue de fentes labio-palatines a été observée avec les benzodiazépines. Selon ces données, l’incidence des fentes labio-palatines chez les nouveau-nés serait inférieure à 2/1000 après exposition aux benzodiazépines au cours de la grossesse alors que le taux attendu dans la population générale est de 1/1000.
En cas de prise de benzodiazépines à fortes doses aux 2ème et/ou 3°ème trimestres de grossesse une diminution des mouvements actifs fœtaux et une variabilité du rythme cardiaque fœtal ont été décrits. Un traitement en fin de grossesse par benzodiazépines même à faibles doses, peut être responsable chez le nouveau-né de signes d'imprégnation tels qu'hypotonie axiale, troubles de la succion entraînant une faible prise de poids. Ces signes sont réversibles, mais peuvent durer 1 à 3 semaines en fonction de la demi-vie de la benzodiazépine prescrite. A doses élevées, une dépression respiratoire ou des apnées, et une hypothermie peuvent apparaître chez le nouveau-né. Par ailleurs, un syndrome de sevrage néo-natal est possible, même en l'absence de signes d'imprégnation. Il est caractérisé notamment par une hyperexcitabilité, une agitation et des trémulations du nouveau-né survenant à distance de l'accouchement. Le délai de survenue dépend de la demi-vie d'élimination du médicament et peut être important quand celle-ci est longue.
Compte-tenu de ces données,
· par mesure de prudence, l’utilisation de clobazam est déconseillée au cours de la grossesse quel qu’en soit le terme et chez la femme en âge de procréer n’utilisant pas de contraception efficace.
· si une grossesse est envisagée ou en cas de grossesse, les femmes doivent être informées des risques et la nécessité du traitement doit être réévaluée.
Si après réévaluation, un traitement par clobazam s’avère réellement nécessaire, il conviendrait,
· en début de grossesse : d’utiliser la dose minimale efficace et d’instaurer une surveillance prénatale spécialisée notamment orientée sur face.
· en fin de grossesse, d’éviter de prescrire des doses élevées et de mettre en place une surveillance du nouveau-né, en tenant compte des effets précédemment décrits.
Le clobazam est excrété en quantité importante dans le lait maternel (> 10 % de la dose maternelle ajustée sur le poids corporel). Des effets indésirables (sédation, difficultés de succion, mauvaise prise de poids, syndrome de sevrage, troubles respiratoires) ont été observés chez les nouveau-nés allaités de mères traitées. Par conséquent, clobazam est contre-indiqué pendant l’allaitement (voir rubrique 4.3).
Fertilité
Dans une étude de fertilité conduite chez le rat, les anomalies des spermatozoïdes et les pertes préimplantatoires étaient augmentées à la forte dose (750mg/kg/jour).
Les données sont insuffisantes pour évaluer les effets du clobazam sur la fertilité humaine.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
Ce médicament peut altérer les fonctions cognitives et peut affecter la capacité du patient à conduire en toute sécurité. Lors de la prescription de ce médicament, les patients doivent être avertis de ce qui suit :
· Le médicament est susceptible d'affecter votre capacité à conduire.
· Ne conduisez pas tant que vous ne savez pas comment vous réagissez à ce médicament.
Les fréquences des effets indésirables ont été classées de la façon suivante : très fréquent (≥ 1/10), fréquent (≥ 1/100, < 1/10), peu fréquent (≥ 1/1 000, < 1/100), rare (≥ 1/10 000, < 1/1 000), très rare (< 1/10 000), fréquence indéterminée (ne peut être estimée sur la base des données disponibles).
Troubles du métabolisme et de la nutrition
· Fréquent : diminution de l’appétit.
Affections psychiatriques
· Fréquent : irritabilité, agressivité, nervosité, dépression (une dépression préexistante peut parfois être révélée), tolérance au médicament (en particulier lors de traitement prolongé) (voir rubrique 4.4), agitation.
· Peu Fréquent : troubles du comportement, confusion, anxiété, délire, cauchemars, perte de la libido (en particulier à fortes doses ou lors de traitement prolongé, réversible).
· Fréquence indéterminée : dépendance physique et psychiques (surtout lors d'une utilisation prolongée) (voir rubrique 4.4), mêmes à doses thérapeutiques avec syndrome de sevrage ou rebond à l’arrêt du traitement, insomnie d’endormissement, hallucinations, colère, trouble psychotique, mauvaise qualité du sommeil, idées suicidaires.
Affections du système nerveux
· Très fréquent : somnolence, en particulier chez le sujet âgé, au début de traitement et lorsque des doses élevées sont utilisées.
· Fréquent : sédation, baisse de vigilance, sensations ébrieuses, trouble de l’attention, trouble de l’élocution / dysarthrie / trouble de la parole (en particulier à fortes doses ou lors de traitement prolongé, réversible), céphalées, tremblements, ataxie.
· Peu fréquent : Troubles des émotions, amnésie (parfois associée à un trouble du comportement), troubles de la mémoire, amnésie antérograde (à doses normales, mais particulièrement à fortes doses).
· Fréquence indéterminée : troubles cognitifs, altération de l’état de conscience (particulièrement chez le sujet âgé, parfois associée à des troubles respiratoires), nystagmus (en particulier à fortes doses ou lors de traitement prolongé), trouble de la marche et autres fonctions motrices (en particulier à fortes doses ou lors de traitement prolongé, réversible).
Affections oculaires
· Peu fréquent : diplopie (en particulier à fortes doses ou lors de traitement prolongé, réversible).
Affections respiratoires, thoraciques et médiastinales
· Fréquence inconnue : dépression respiratoire (en particulier à fortes doses), insuffisance respiratoire (en particulier chez les patients ayant une fonction respiratoire diminuée préexistante, par exemple chez les patients asthmatiques ou atteints de lésions cérébrales) (voir rubriques 4.3 et 4.4).
Affections gastro intestinales
· Fréquent : bouche sèche, nausées, constipation.
Affections de la peau et du tissu sous-cutané
· Peu fréquent : rash.
· Fréquence inconnue : réactions photosensibles, urticaire, syndrome de Stevens-Johnson, Syndrome de Lyell (nécrolyse épidermique toxique (dont quelques cas d’issue fatale)).
Affections musculo-squelettiques et systémiques
· Fréquence inconnue : spasmes musculaires, faiblesse musculaire.
Troubles généraux et réaction au site d’administration
· Très fréquent : asthénie, surtout en début de traitement et lorsque des doses élevées sont utilisées.
· Fréquence inconnue : réponse lente aux stimuli, hypothermie.
Investigations
· Peu fréquent : prise de poids (en particulier à fortes doses ou lors de traitement prolongé, réversible).
Blessure, empoisonnement et complications procédurales
· Peu fréquent : chute.
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr/.
Le surdosage en benzodiazépines se manifeste généralement par différents degrés de dépression du système nerveux central, allant de la somnolence au coma. Dans les cas légers, les symptômes comprennent une somnolence, une confusion mentale et une léthargie et, dans les cas plus graves, les symptômes peuvent inclure une ataxie, une hypotonie, une hypotension artérielle, une dépression respiratoire, rarement un coma et très rarement conduire au décès.
Dans la prise en charge du surdosage, il est recommandé que la participation éventuelle d'agents multiples soit prise en considération.
Après un surdosage en benzodiazépines administrées par voie orale, les vomissements devront être induits (dans l'heure qui suit) si le patient est conscient. En alternative, si le patient est inconscient, un lavage gastrique avec protection des voies aériennes pourra être effectué. S'il n'y a aucun intérêt à vider l'estomac, du charbon activé pourra être administré afin de réduire l’absorption. Une attention particulière doit être portée aux fonctions respiratoires et cardiovasculaires en soins intensifs.
L'élimination secondaire de clobazam (par diurèse forcée ou hémodialyse) est inefficace.
L'administration de flumazénil peut être utile pour le diagnostic et/ou le traitement d'un surdosage intentionnel ou accidentel en benzodiazépines.
L'antagonisme par le flumazénil de l'effet des benzodiazépines peut favoriser l'apparition de troubles neurologiques (convulsions), notamment chez le patient épileptique.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Classe pharmacothérapeutique : Anxiolytiques, code ATC : N05BA09.
Le clobazam est une 1,5-benzodiazépine, et son activité pharmacodynamique est qualitativement similaire à celle des autres composés de cette classe :
· Myorelaxante
· Anxiolytique
· Sédative
· Hypnotique
· Anticonvulsivante
· Amnésique
Ces effets sont liés à une action agoniste spécifique d'une unité centrale du complexe de récepteurs macromoléculaires « GABA-OMÉGA ». Également connus comme BZ1 et BZ2 et modulant l'ouverture du canal chlore.
En doses uniques allant jusqu'à 20 mg, ou en doses fractionnées allant jusqu'à 30 mg, le clobazam n'affecte pas les fonctions psychomotrices, les performances motrices, la mémoire ou les fonctions mentales supérieures.
5.2. Propriétés pharmacocinétiques
Après administration orale, le clobazam est rapidement et largement absorbé.
Le temps nécessaire pour atteindre le pic des concentrations plasmatiques (Tmax) est de 0,5 à 4,0 heures.
Dans une étude de bioéquivalence, randomisée, croisée, le pic de concentration plasmatique de clobazam après administration orale de LIKOZAM 2 mg/ml suspension buvable était supérieur à celui observé après l'administration en dose unique d'un comprimé de 10 mg de référence (Cmax moyenne 263,1±54,38 ng et 224,00±22,96 ng/ml, respectivement).
La prise concomitante d'alcool peut augmenter la biodisponibilité du clobazam de 50 %.
Distribution
Après administration d’une dose unique de 20 mg de clobazam, une variabilité interindividuelle marquée des concentrations plasmatiques maximales (de 222 à 709 ng/ml) a été observée après 0,25 à 4 heures.
Le clobazam est lipophile et se distribue rapidement dans tout le corps. Sur la base d’une analyse pharmacocinétique de population, le volume apparent de distribution à l’état d’équilibre est d’environ 102 L, et est indépendant de la concentration dans la plage thérapeutique. Environ 80 à 90 % du clobazam est lié aux protéines plasmatiques.
Le clobazam s'accumule environ 2-3 fois à l'état d'équilibre tandis que le métabolite actif N desméthylclobazam (N-CLB) s'accumule environ 20 fois après administration de clobazam répétée deux fois par jour. Les concentrations à l'état d'équilibre sont atteintes après environ 2 semaines.
Métabolisme
Le clobazam est rapidement et largement métabolisé dans le foie. Le métabolisme du clobazam s'effectue principalement par déméthylation hépatique du N-desméthylclobazam (N-CLB), médiée par la CYP3A4 et, dans une moindre mesure, par le CYP2C19. Le N-CLB est un métabolite actif et le principal métabolite circulant trouvé dans le plasma humain.
Le N-CLB subit une ultérieure biotransformation dans le foie pour former le 4-hydroxy-N desméthylclobazam, principalement médiée par le CYP2C19.
Les métaboliseurs lents du CYP2C19 présentent une concentration plasmatique 5 fois plus élevée de N-CLB que les métaboliseurs rapides.
Le clobazam est un inhibiteur faible du CYP2D6. L'administration concomitante de dextrométhorphane a entraîné une augmentation de 90 % de l'ASC et de 59 % des valeurs de Cmax pour le dextrométhorphane.
L'administration concomitante de 400 mg de kétoconazole (inhibiteur du CYP3A4) a augmenté l'ASC de clobazam de 54 % sans effet sur la Cmax. Ces changements ne sont pas considérés comme cliniquement importants.
Élimination
Sur la base d’une analyse pharmacocinétique de population, les demi-vies d’élimination plasmatique du clobazam et du N-CLB ont été estimées à 36 heures et 79 heures respectivement.
Le clobazam est éliminé principalement par métabolisme hépatique et élimination rénale successive. Dans une étude de bilan de masse, environ 80 % de la dose administrée a été retrouvée dans l’urine et environ 11 % dans les fèces. Moins de 1 % du clobazam inchangé et moins de 10 % de N-CLB inchangé sont excrétés par les reins.
Population à risque
Personnes âgées
Le métabolisme hépatique diminue ainsi que la clairance totale avec augmentation des concentrations à l’équilibre, de la fraction libre et des demi-vies. Il est important de diminuer la dose.
Insuffisance hépatique
Il y a une diminution de la clairance totale.
5.3. Données de sécurité préclinique
Dans les études de toxicité chronique chez le rat avec administration quotidienne de clobazam par voie orale de 12 à 1000 mg/kg, l’activité spontanée était réduite de manière dose-dépendante, alors qu’une dépression respiratoire et une hypothermie étaient observées à la dose la plus élevée. Une sédation, une somnolence, l’ataxie et des tremblements dose-dépendants étaient évidents chez les chiens ayant reçu des doses orales quotidiennes de clobazam de 2,5 à 80 mg/kg, et ces effets étaient presque complètement inversés au cours de l’étude. Des effets dose-dépendants similaires ont été observés chez des singes après l’administration orale quotidienne de 2,5 à 20 mg/kg.
Toxicité reproductive
Dans une étude de fertilité conduite chez le rat, les anomalies des spermatozoïdes et les pertes préimplantatoires étaient augmentées à la forte dose (750mg/kg/jour). Les études de toxicité reproductive chez la souris, le rat et le lapin n'ont révélé aucun potentiel tératogène après administrations quotidiennes de clobazam allant jusqu'à 100 mg/kg.
Génotoxicité et cancérogénicité
Le clobazam n'est pas génotoxique et n'entraine pas la formation de tumeurs. Les adénomes folliculaires étaient significativement augmentés chez les rats sous haute dose de clobazam (100 mg/kg). Contrairement à d'autres espèces (souris, chien, singe), le clobazam est connu pour activer la glande thyroïde chez les rats comme d'autres agents contenant des benzodiazépines. Aucun effet sur la fonction thyroïdienne humaine n'a été observé à des doses cliniquement pertinentes (20-80 mg).
Après ouverture : 28 jours
6.4. Précautions particulières de conservation
À conserver à une température ne dépassant pas 25 °C. Ne pas réfrigérer, ni congeler.
6.5. Nature et contenu de l'emballage extérieur
Flacon : Ambré (verre de type III)
Système de fermeture : HDPE, EPE ouaté, fermeture sécurisée pour les enfants
Taille des présentations : 150 ml
Seringue : Corps en polypropylène et piston en HDPE, d’une capacité de 5 ml
Adaptateur de flacon : Polyéthylène à basse densité. L’adaptateur du flacon n’est pas pré-installé.
6.6. Précautions particulières d’élimination et de manipulation
Tout médicament non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
104 LOWER BAGGOT STREET
DUBLIN 2
D02 Y940
IRLANDE
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· 34009 300 162 8 2 : flacon(s) en verre jaune (brun) de 150 ml avec fermeture de sécurité enfant avec seringue(s) polypropylène avec adaptateur(s) pour flacon polyéthylène basse densité (PEBD)
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
[À compléter ultérieurement par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE
[À compléter ultérieurement par le titulaire]
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Liste I
Durée de prescription limitée à 12 semaines
ANSM - Mis à jour le : 06/05/2025
LIKOZAM 1 mg/ml, suspension buvable
Clobazam
· Gardez cette notice. Vous pourriez avoir besoin de la relire.
· Si vous avez d’autres questions, interrogez votre médecin ou votre pharmacien.
· Ce médicament vous a été personnellement prescrit. Ne le donnez pas à d’autres personnes. Il pourrait leur être nocif, même si les signes de leur maladie sont identiques aux vôtres.
· Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
1. Qu'est-ce que LIKOZAM 1 mg/ml, suspension buvable et dans quels cas est-il utilisé ?
2. Quelles sont les informations à connaître avant de prendre LIKOZAM 1 mg/ml, suspension buvable ?
3. Comment prendre LIKOZAM 1 mg/ml, suspension buvable ?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver LIKOZAM 1 mg/ml, suspension buvable ?
6. Contenu de l’emballage et autres informations.
1. QU’EST-CE QUE LIKOZAM 1 mg/ml, suspension buvable ET DANS QUELS CAS EST-IL UTILISE ?
Classe pharmacothérapeutique : Anxiolytiques - code ATC : N05BA09
L’ingrédient actif de ce médicament est le clobazam. Le clobazam fait partie d’un groupe de médicaments appelés benzodiazépines. Il agit en produisant un effet sédatif sur le cerveau.
LIKOZAM peut être utilisé pour :
· le traitement symptomatique de l’anxiété sévère (utilisation à court terme seulement) ;
· le traitement de l’épilepsie (crises convulsives) chez l’adulte et l’enfant de plus de 2 ans (en association avec d’autres médicaments) ;
· les maladies mentales comme la schizophrénie (en association avec d’autres traitements).
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT DE PRENDRE LIKOZAM 1 mg/ml, suspension buvable ?
Ne prenez jamais LIKOZAM 1 mg/ml, suspension buvable :
· si vous êtes allergique au clobazam ou à l’un des autres composants contenus dans ce médicament mentionnés dans la rubrique 6. Les signes d’une réaction allergique peuvent inclure un gonflement du visage, des lèvres, de la langue ou de la gorge, des difficultés à respirer ou à avaler, de fortes démangeaisons cutanées ;
· si vous avez des antécédents de dépendance à l’alcool ou à d’autres médicaments ;
· si vous avez une maladie qui provoque une faiblesse musculaire (« myasthénie grave ») ;
· si vous avez des problèmes respiratoires (insuffisance respiratoire grave) ;
· si vous arrêtez de respirer pendant de courtes périodes pendant que vous dormez (« syndrome de l’apnée du sommeil ») ;
· si vous avez des troubles hépatiques graves (insuffisance hépatique) ;
· si vous allaitez (voir rubrique 2) ;
· si le patient est âgé de moins de 2 ans sauf si le médecin décide que cela est nécessaire.
Ne prenez pas ce médicament si l’un des cas ci-dessus s’applique à vous. En cas de doute, demandez conseil à votre médecin ou à votre pharmacien avant de prendre LIKOZAM.
Avertissements et précautions
Note : Assurez-vous de recevoir le même médicament à base de clobazam chaque fois que vous renouvelez votre ordonnance, sauf si votre médecin a accepté de changer pour un médicament à base de clobazam différent. Si l’aspect de ce médicament n’est pas le même que d’habitude ou si les instructions posologiques ont changé, parlez-en dès que possible à votre médecin ou à votre pharmacien afin de vous assurer que vous avez le bon médicament.
Adressez-vous à votre médecin ou pharmacien avant de prendre LIKOZAM :
· si vous avez des problèmes de contrôle de vos mouvements (« ataxie spinale ou cérébelleuse ») ;
· si vous avez une dépression, des peurs irrationnelles ou des obsessions ;
· si vous avez une insuffisance respiratoire ;
· si vous avez une maladie du foie (insuffisance hépatique) ;
· si vous avez des problèmes rénaux (insuffisance rénale) ;
· si vous avez déjà présenté une dépendance à d’autres médicaments ou à l’alcool. Il faut éviter de prendre de l’alcool pendant le traitement par LIKOZAM car l’alcool augmente le risque de survenue des effets secondaires ;
· si vous êtes enceinte ;
· si vous avez plus de 65 ans. Il existe une sensibilité accrue aux effets indésirables chez les personnes âgées, comme somnolence, étourdissements et faiblesse musculaire. Il y a également un risque accru de chute qui pourrait entraîner des blessures graves ;
· avec des produits non-médicamenteux contenant du cannabidiol car cela peut augmenter les effets indésirables ;
· avec des médicaments contenant du cannabidiol car cela peut augmenter les effets indésirables.
Avant de prendre LIKOZAM 1 mg/ml, suspension buvable, vous devez savoir que :
· Une anxiété peut révéler un autre trouble physique ou psychique. Une évaluation médicale doit être effectuée avant la prescription de ce médicament.
· Ce médicament ne traite pas la dépression. Si vous souffrez également de dépression, votre médecin vous prescrira un traitement approprié. Si la dépression n’est pas traitée, elle peut s’aggraver avec une persistance ou une augmentation possible du risque suicidaire.
· Si votre anxiété persiste ou s’aggrave après une période courte de traitement, consultez votre médecin.
Dans les heures qui suivent la prise du médicament, il peut survenir :
· Une perte de la mémoire concernant les évènements survenus pendant le traitement (amnésie antérograde),
· Des troubles du comportement (tels qu’agressivité ou actes automatiques), agitation, nervosité, euphorie ou irritabilité, tension,
· Une insomnie, des cauchemars
· Une altération de l’état de conscience,
· Une difficulté à coordonner certains mouvements (altération des fonctions psychomotrices).
Ces troubles peuvent être dangereux pour vous et pour autrui. Dans de tels cas, vous devez arrêter le traitement.
L’abus de LIKOZAM 1 mg/ml, suspension buvable, la prise associée d’alcool ou d’autres médicaments agissant sur l’état de vigilance, semblent augmenter le risque de tels comportements. Dans de tels cas, l’arrêt du traitement est recommandé.
· Si vous souffrez d’épilepsie, si la fréquence de vos crises augmente ou si des crises d’un type différent apparaissent : consultez immédiatement votre médecin.
L’utilisation concomitante de LIKOZAM et d’opioïdes augmente le risque de somnolence, de difficultés respiratoires, de coma et peut être mortelle. Pour cette raison, l’utilisation concomitante ne doit être envisagée que lorsque d’autres options de traitement ne sont pas possibles. Veuillez informer votre médecin de tous les médicaments opioïdes que vous prenez et respectez strictement les doses recommandées par votre médecin.
Si l’un des cas ci-dessus vous concerne (ou en cas de doute), consultez votre médecin ou votre pharmacien avant de prendre LIKOZAM.
Idées suicidaires
Certaines études ont montré un risque accru d’idées suicidaires, de tentatives de suicide et de suicides chez les patients, prenant certains sédatifs et hypnotiques, y compris ce médicament. Cependant il n’a pas été établi si cela est dû au médicament ou s'il peut y avoir d'autres raisons.
Prévenez votre médecin immédiatement si vous commencez à penser au suicide ou à vous faire du mal. Certains patients ont eu des pensées suicidaires alors qu'ils prenaient des médicaments contenant du clobazam, surtout s'ils étaient aussi déprimés.
Ce médicament ne traite pas la dépression. Chez le sujet présentant une dépression, il ne doit pas être utilisé seul car il laisserait la dépression évoluer pour son propre compte avec persistance ou majoration du risque suicidaire.
Dépendance, sevrage et tolérance
Vous pouvez devenir dépendant au LIKOZAM si vous le prenez pendant une longue période de temps, surtout si vous buvez régulièrement beaucoup d'alcool ou faites usage de drogues. Cela signifie que vous pouvez sentir que vous devez continuer le traitement avec LIKOZAM afin de vous sentir bien (« dépendance psychologique »).
Divers facteurs semblent favoriser la dépendance :
· Si vous prenez LIKOZAM 1 mg/ml, suspension buvable de façon prolongée,
· Si vous prenez une dose importante,
· Si vous avez déjà présenté une dépendance à d’autres médicaments, substances ou à l’alcool,
· Si vous prenez un autre médicament de la famille des benzodiazépines tel qu’un somnifère ou un autre anxiolytique.
Si vous cessez soudainement de prendre LIKOZAM vous pouvez ressentir :
· une aggravation des symptômes pour lesquels vous étiez traité à l'origine ;
· des sautes d'humeur, un sentiment d'anxiété, d'agitation, de dépression ou de confusion ;
· des problèmes de sommeil ;
· une perte d'appétit.
Ces symptômes sont connus comme « symptômes de sevrage » et peuvent être évités en réduisant lentement votre dose. Parlez-en à votre médecin ou à votre pharmacien si vous êtes inquiet au sujet d'une « dépendance psychologique » ou des « symptômes de sevrage ».
Si vous prenez LIKOZAM pour l'épilepsie pendant une longue période de temps, il est alors possible que vous deveniez « tolérants » à ce médicament. Cela signifie qu'il ne fonctionnera pas aussi bien qu'il l'a fait en début de traitement. Parlez-en à votre médecin si vous sentez que LIKOZAM ne vous aide plus à contrôler vos symptômes – il pourra vous suggérer de suspendre pour une courte période ce médicament.
Utilisation chez les personnes âgées de plus de 65 ans
LIKOZAM 1 mg/ml, suspension buvable doit être utilisé avec prudence chez les personnes âgées en raison du risque de somnolence, sensations de vertiges et de relâchement musculaire qui peuvent favoriser les chutes. Les chutes ont souvent des conséquences graves chez les personnes âgées.
Utilisation chez les personnes ayant un métabolisme du foie modifié (métaboliseurs lents)
LIKOZAM 1 mg/ml, suspension buvable doit être utilisé avec prudence en cas d’association avec certains médicaments. Votre médecin adaptera la dose du traitement en conséquence.
Réactions sévères de la peau
Des réactions sévères de la peau comme le syndrome de Stevens-Johnson et le syndrome de Lyell peuvent survenir et mettre votre vie en danger. Vous devez immédiatement arrêter le traitement et consulter un médecin si des symptômes évocateurs de ces syndromes apparaissent : éruption de bulles avec décollement de la peau pouvant rapidement s’étendre de façon très grave à tout le corps, fièvre, érosions dans la bouche ou sur les organes génitaux.
Ces syndromes surviennent surtout si vous prenez deux médicaments en même temps dont les antiépileptiques qui sont associés à des réactions sévères de la peau.
Enfants de moins de 2 ans
Epilepsie (crises convulsives) : LIKOZAM ne doit être administré aux enfants de moins de 2 ans que si le médecin décide que cela est nécessaire.
Autres médicaments et LIKOZAM 1 mg/ml, suspension buvable
Informez votre médecin ou pharmacien si vous prenez, avez récemment pris ou pourriez prendre tout autre médicament. Ceci inclut les médicaments obtenus sans ordonnance, y compris les médicaments à base de plante. Ceci parce que LIKOZAM peut modifier le mécanisme d'action de certains médicaments.
Certains médicaments peuvent également modifier le mécanisme d’action de LIKOZAM.
Informez notamment votre médecin ou pharmacien si vous prenez :
· médicaments ayant un effet sédatif, parmi lesquels des dérivés morphiniques (utilisés pour traiter la douleur, la toux et la dépendance) (par exemple dextrométhorphane), des neuroleptiques (utilisés pour traiter certains troubles de l’humeur et du comportement) (par exemple pimozide), des barbituriques, des benzodiazépines, des anxiolytiques autres que les benzodiazépines (par exemple, le méprobamate), des hypnotiques, des antidépresseurs sédatifs (amitryptiline, doxépine, miansérine, mirtazipine, trimipramine), des antihistaminiques H1 sédatifs, des antihypertenseurs centraux, du baclofène et de la thalidomide
· des médicaments contre l'épilepsie comme la phénytoïne, la carbamazépine, l'acide valproïque ou stiripentol ;
· des médicaments pour la dépression comme la trazodone, « ISRS » (tels que la fluoxétine ou le citalopram), des « antidépresseurs tricycliques » (tels que l'amitriptyline ou la nortriptyline) ou des « IMAO » (tels que la phénelzine ou le moclobémide) ;
· des médicaments pour des problèmes graves de santé mentale appelés « neuroleptiques » tels que la chlorpromazine, l'halopéridol, la clozapine et le pimozide ;
· des analgésiques tels que les médicaments contenant de la codéine, de la dihydrocodéine ou de la morphine ;
· des somnifères comme zolpidem ou témazépam ;
· des médicaments pour l'anxiété comme le diazépam ou le lorazépam ;
· des relaxants musculaires comme le baclofène ;
· des antihistaminiques qui vous font sentir somnolents comme la chlorphénamine, la prométhazine ou la diphénhydramine ;
· du lithium, utilisé pour un problème de santé mentale grave appelée « trouble bipolaire » (changements d'humeur entre un état de grande excitabilité ou des émotions exagérées et la dépression) ;
· de la cimétidine, utilisée pour traiter les brûlures d'estomac et les ulcères à l'estomac ;
· de l'oméprazole, utilisé pour traiter les symptômes de reflux acides tels que les brûlures d'estomac ou les régurgitations d'acide ;
· de la ticlopidine, un médicament antiagrégant plaquettaire utilisé chez les patients avec un risque accru d'accident vasculaire cérébral ;
· du fluconazole, utilisé dans le traitement d'affections fongiques ;
· du dextrométhorphane, utilisé pour soulager la toux sèche irritante ;
· du nébivolol, ou des médicaments utilisés pour traiter une tension artérielle élevée ;
· oxybate de sodium, utilisé dans le traitement de lla narcolepsie ;
· produits contenant du cannabidiol (médicaments ou produits non-médicamenteux).
Lorsque vous prenez LIKOZAM, vous ne devez pas commencer à prendre des médicaments différents contenant du clobazam, à moins que votre médecin vous l'indique. Si vous le faites, cela pourra causer une somnolence et des difficultés respiratoires.
En cas de doute concernant l'un des cas ci-dessus consultez votre médecin ou votre pharmacien.
Opérations
Si vous devez subir une opération ou effectuer des soins dentaires, indiquez à votre médecin ou dentiste que vous prenez LIKOZAM. C'est parce qu'ils peuvent avoir besoin de changer la quantité de médicament (anesthésique ou relaxant musculaire) qu'ils vous donnent.
LIKOZAM 1 mg/ml, suspension buvable avec des aliments, boissons et de l’alcool
Ne buvez pas d'alcool pendant que vous prenez LIKOZAM. C'est parce que l'alcool peut modifier l’effet de LIKOZAM.
LIKOZAM peut être pris avec ou sans nourriture.
Grossesse, allaitement et fertilité
Ce médicament est déconseillé pendant la grossesse et chez les femmes en âge de procréer n’utilisant pas de contraception efficace. Si vous découvrez que vous êtes enceinte ou que vous souhaitez l'être, consultez votre médecin afin qu'il vous informe, juge de la nécessité de votre traitement et prenne les mesures adéquates.
Si vous prenez LIKOZAM 1 mg/ml, suspension buvable au cours du 1er trimestre de la grossesse : de nombreuses données n'ont pas montré d'effet malformatif des benzodiazépines. Cependant, certaines études ont décrit un risque potentiellement augmenté de survenue de fente labio-palatine chez le nouveau-né par rapport au risque présent dans la population générale. Une fente labio-palatine (parfois nommée « bec de lièvre ») est une malformation congénitale causée par une fusion incomplète du palais et de la lèvre supérieure. Selon ces données, l'incidence des fentes labio-palatines chez les nouveau-nés serait inférieure à 2/1000 après exposition aux benzodiazépines au cours de la grossesse alors que le taux attendu dans la population générale est de 1/1000. Un suivi échographique adapté sera effectué.
Si vous prenez LIKOZAM 1 mg/ml, suspension buvable au 2ème et/ou 3ème trimestres de grossesse, une diminution des mouvements actifs fœtaux et une variabilité du rythme cardiaque fœtal peuvent survenir.
Si vous prenez LIKOZAM 1 mg/ml, suspension buvable en fin de grossesse, informez en l'équipe médicale, une surveillance du nouveau-né pourrait être effectuée : une faiblesse musculaire (hypotonie axiale), des difficultés d'alimentation (troubles de la succion entrainant une faible prise de poids), une hyperexcitabilité, une agitation ou des tremblements peuvent survenir chez le nouveau-né, ces troubles étant réversibles. À fortes doses, une insuffisance respiratoire ou des apnées, une baisse de la température centrale du corps (hypothermie) pourraient également survenir chez le nouveau-né.
Si votre bébé présente un ou plusieurs de ces symptômes à la naissance ou à distance de la naissance, contactez votre médecin et/ou votre sage-femme.
Demandez conseil à votre médecin ou à votre pharmacien avant de prendre tout médicament.
Ce médicament passe en grande quantité dans le lait maternel. Des troubles ont été observés chez des enfants allaités par une mère traitée : sédation, difficultés d'alimentation (troubles de la succion entrainant une faible prise de poids), syndrome de sevrage ou troubles respiratoires. Par conséquent, vous ne devez pas prendre LIKOZAM 1 mg/ml, suspension buvable pendant l’allaitement.
Les données sont insuffisantes pour évaluer les effets du clobazam sur la fertilité humaine.
Conduite de véhicules et utilisation de machines
Vous pouvez vous sentir somnolent ou avoir des problèmes de concentration ou de mémoire après la prise de ce médicament. Vous pouvez également rencontrer des troubles de la vision comme une vision double ou vous pouvez réagir plus lentement aux faits. Dans ce cas, ne conduisez pas et n'utilisez pas d'outils ou de machines.
Le médicament peut affecter votre capacité à conduire car il peut vous faire sentir somnolent ou étourdi.
· Ne conduisez pas tant que vous ne savez pas comment vous réagissez à ce médicament
· Si vous ne dormez pas suffisamment (au moins 7 à 8 heures), le risque de somnolence et de diminution de la vigilance est augmenté après avoir pris LIKOZAM 1 mg/ml, suspension buvable.
L’utilisation simultanée de LIKOZAM 1 mg/ml, suspension buvable avec d’autres médicaments sédatifs (tranquillisants, somnifères, certains médicaments contre la toux ) est déconseillée en cas de conduite automobile ou d’utilisation de machines.
Parlez-en à votre médecin ou votre pharmacien si vous n'êtes pas sûr de pouvoir conduire en toute sécurité tout en prenant ce médicament.
LIKOZAM 1 mg/ml, suspension buvable, contient du maltitol liquide, du parahydroxybenzoate de méthyle et de propyle sodiques, du sodium et du propylène glycol.
· Maltitol liquide (0,3 g/ml) - un type de sucre : Si votre médecin vous a informé(e) d’une intolérance à certains sucres, contactez-le avant de prendre ce médicament.
· Parahydroxybenzoate de méthyle sodique et parahydroxybenzoate de propyle sodique : Peut provoquer des réactions allergiques (éventuellement retardées).
· Sodium : Ce médicament contient 2,3 mg de sodium (composant principal du sel de cuisine/table) par ml. Cela équivaut à 0,12 % de l’apport alimentaire quotidien maximal recommandé de sodium pour un adulte. A prendre en compte chez les patients suivant un régime hyposodé.
· Propylène glycol : Ce médicament contient 6,21 mg de propylène glycol par ml. Si votre bébé a moins de 4 semaines, demandez à votre médecin ou à votre pharmacien avant de lui administrer ce médicament, en particulier si le bébé reçoit d’autres médicaments contenant du propylène glycol ou de l’alcool.
3. COMMENT PRENDRE LIKOZAM 1 mg/ml, suspension buvable ?
Veillez à toujours prendre ce médicament en suivant exactement les indications de votre médecin.
Vérifiez auprès de votre médecin ou pharmacien en cas de doute.
Posologie
LIKOZAM est habituellement administré pendant 2 à 4 semaines. Après quoi, votre médecin décidera si vous devez continuer à prendre ce médicament.
· Respectez toujours la dose prescrite par votre médecin.
· Si vous avez l’impression que ce médicament est moins efficace au cours du temps, n’augmentez pas les doses et consultez votre médecin.
· Si vous avez plus de 65 ans, si vous avez des problèmes au niveau du rein ou du foie, votre médecin pourra être amené à adapter les doses.
· Chez l’enfant, votre médecin pourra être amené à adapter les doses
Mode d’administration
Pour prendre ce médicament
· Ce médicament contient 1 milligramme (mg) de clobazam dans chaque millilitre (ml) de suspension.
· Ce médicament est à prendre par voie orale.
· Ce médicament ne doit pas être mélangé avec d’autres médicaments ou boissons.
· Toujours agiter la bouteille avant de l'utiliser.
· Toujours utiliser la seringue fournie dans la boîte.
· LIKOZAM, peut être pris avec ou sans nourriture.
Mesurer votre dose
Mode d’emploi de la seringue
Si vous prenez une dose importante, vous devrez peut-être prélever la solution plusieurs fois avec la seringue. II peut être utile d'écrire sur un morceau de papier le nombre de fois que vous devez utiliser la seringue. Chaque fois que vous prenez la dose, cochez une dose sur le papier.
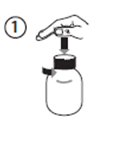
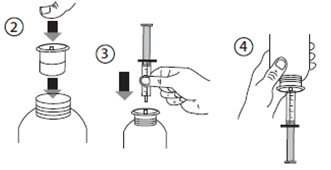
· Ouvrir le flacon : appuyer sur le bouchon et le tourner dans le sens opposé des aiguilles d'une montre (figure 1).
· Insérer l’adaptateur de la seringue dans le goulot du flacon (figure 2).
· Saisir la seringue et l'insérer dans l'ouverture de l'adaptateur (figure 3).
· Retourner la bouteille (figure 4).
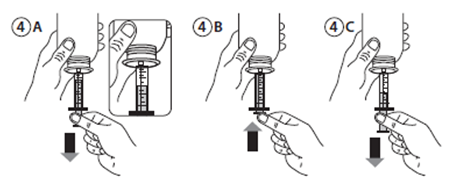
· Remplir la seringue avec une petite quantité de solution en tirant sur le piston (figure 4A). Repousser alors le piston afin d’éliminer les possibles bulles (figure 4B). Enfin, retirer le piston jusqu'à la graduation correspondant à la quantité en millilitres prescrite par votre médecin (figure 4C).
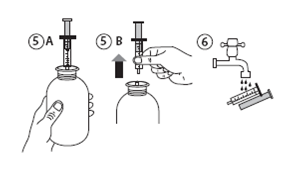
· Retourner le flacon, le bon côté vers le haut (figure 5A).
· Retirer la seringue de l'adaptateur (figure 5B). Placer l'extrémité de la seringue dans votre bouche et pousser lentement sur le piston pour avaler le médicament.
· Laver la seringue à l'eau et la laisser sécher avant de la réutiliser (figure 6).
· Fermer le flacon avec le bouchon en plastique - laisser l'adaptateur de la seringue dans le flacon.
Fréquence d'administration
Quelle quantité prendre
Si de faibles doses sont requises, le produit à concentration de 1 mg/ml est la présentation la plus appropriée. Si de fortes doses sont requises, le produit à concentration de 2 mg/ml est la présentation la plus appropriée.
Durée du traitement
Adultes
La dose habituelle est de 20 mg (20 ml) à 30 mg (30 ml) chaque jour. Cette dose peut être fractionnée en 2 prises ou en une seule à prendre au coucher.
Votre médecin peut augmenter la dose jusqu’à 60 mg (60 ml) chaque jour.
Votre médecin peut diminuer la dose si cela vous convient.
Enfants (2 ans et plus)
La dose initiale habituelle est de 0,1 mg/kg par jour.
Le médecin modifiera ensuite la dose en fonction du poids de votre enfant.
Personnes âgées
La dose habituelle pour le traitement de l'anxiété est de 10 mg (10 ml) à 20 mg (20 ml) chaque jour.
Si vous avez pris plus de LIKOZAM 1 mg/ml, suspension buvable que vous n’auriez dû
Si vous avez pris plus de LIKOZAM que vous n’auriez dû, parlez-en à votre médecin ou allez immédiatement à l’hôpital le plus proche. Prenez la boîte de médicament avec vous. Ne conduisez pas vous-même parce que vous pourriez commencer à vous sentir somnolent.
Si vous oubliez de prendre LIKOZAM 1 mg/ml, suspension buvable
Si vous oubliez de prendre une dose, sautez la dose oubliée. Puis attendez le moment venu pour la prochaine dose.
Ne prenez pas de dose double pour compenser la dose que vous avez oublié de prendre.
Si vous arrêtez de prendre LIKOZAM 1 mg/ml, suspension buvable
Continuez à prendre ce médicament jusqu’à ce que votre médecin vous dise d’arrêter. N’arrêtez pas de prendre ce médicament, juste parce que vous vous sentez mieux.
Lorsque votre médecin vous dira que vous pouvez arrêter de prendre LIKOZAM, vous aurez besoin de le faire progressivement. Votre médecin vous aidera à le faire.
Arrêter brusquement ce médicament peut provoquer des effets de sevrage (voir la rubrique 2 « Dépendance, sevrage et tolérance »). Parlez-en à votre médecin ou votre pharmacien si cela se produit.
Si vous avez d’autres questions sur l’utilisation de ce médicament, demandez à votre médecin ou à votre pharmacien.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
Arrêtez de prendre LIKOZAM 1 mg/ml, suspension buvable et consultez un médecin ou allez à l’hôpital immédiatement si vous notez l’effet indésirable suivant. Il est grave et vous pouvez avoir besoin de traitement médical d’urgence :
· réaction allergique - les signes peuvent inclure un gonflement de votre visage, de vos lèvres, de votre langue ou de votre gorge, une difficulté à respirer ou à avaler, de fortes démangeaisons de la peau avec apparition de bulles et décollement de la peau.
Cessez de prendre LIKOZAM et consultez un médecin ou allez à l'hôpital immédiatement si vous notez les symptômes énumérés ci-dessus.
Prévenez votre médecin immédiatement si vous avez l’un des effets indésirables suivants :
Effets indésirables fréquents (peuvent affecter jusqu’à 1 personne sur 10) :
· irritabilité ou agitation.
Effets indésirables peu fréquents (peuvent affecter jusqu’à 1 personne sur 100) :
· trous de mémoire concernant les évènements survenus pendant le traitement avec LIKOZAM (amnésie) ou comportement anormal ;
· cauchemars ;
· anxiété ;
· croire en des choses qui ne sont pas réelles (idées délirantes) ;
· possibilité accrue de trébucher ou de chuter, en particulier chez le sujet âgé.
Fréquence indéterminée (ne peut être estimée sur la base des données disponibles) :
· troubles du sommeil qui s’aggravent après la prise de LIKOZAM ;
· sentir des choses qui ne sont pas réelles (hallucinations) ;
· baisse de vigilance (particulièrement chez les personnes âgées) ;
· idées suicidaires ;
· éruption cutanée entrainant la formation de cloques ou d’ulcère autour des lèvres, des yeux, de la bouche, du nez et des organes génitaux accompagnée de symptômes pseudo-grippaux et de la fièvre. Il peut s’agir d’un « Syndrome de Stevens-Johnson » ;
· éruption cutanée sévère entrainant la formation de cloques pouvant conduire à un décollement laissant de grandes surfaces de peau à vif exposées sur tout le corps. Ces symptômes s’accompagnent d’une sensation de malaise généralisé avec fièvre, frisson et douleurs musculaires. Il peut s’agir d’une Nécrolyse Épidermique Toxique (NET). Le Syndrome de Stevens-Johnson et le syndrome de Lyell (NET) peuvent être fatals.
Prévenez votre médecin ou votre pharmacien si un des effets indésirables suivants devient grave, dure plus de quelques jours ou si vous ressentez un effet indésirable qui ne serait pas mentionné dans cette notice.
Effets secondaires très fréquents (peuvent affecter plus d’1 personne sur 10) :
· difficulté à rester éveillé ou alerte.
Effets secondaires fréquents (peuvent affecter jusqu'à 1 personne sur 10) :
· somnolence, sensation de vertige ;
· agitation, agressivité ;
· dépression ;
· maux de tête ;
· manque de concentration ;
· difficulté à parler ;
· tremblements des doigts ;
· difficulté à marcher ou difficulté à coordonner certains mouvements ;
· efficacité diminuée de LIKOZAM (plus particulièrement en cas d’utilisation prolongée) ;
· sécheresse de la bouche, constipation ;
· perte d’appétit, sensation de malaise (nausée).
Effets secondaires peu fréquents (peuvent affecter jusqu'à 1 personne sur 100) :
· perte du désir sexuel ;
· troubles de la mémoire, confusion ;
· vision double ;
· éruption cutanée ;
· prise de poids.
Fréquence indéterminée (ne peut être estimée sur la base des données disponibles)
· dépendance au LIKOZAM (dépendance physique et psychologique) (plus particulièrement en cas d’utilisation prolongée) ;
· sentiment de ne pas être en lien avec la réalité et d’être incapable de raisonner ou de porter un jugement clair sur les évènements (psychose) ;
· colère ;
· problèmes respiratoires ;
· troubles de la marche ;
· sensibilité au soleil ;
· éruption cutanée (urticaire), démangeaisons ;
· spasmes musculaires ou faiblesse musculaire ;
· réactions plus lentes que d’habitude ;
· mouvement rapide et incontrôlable des yeux ;
· difficultés d’apprentissage ;
· température corporelle anormalement basse.
Si vous prenez ce médicament pendant une longue période, vous êtes plus susceptible d’avoir les effets indésirables suivants : anxiété, confusion, dépression, perte d'appétit et troubles du sommeil.
Ce médicament peut entrainer une dépendance physique. Arrêter brutalement ce traitement peut provoquer l'apparition d'effets secondaires. Si vous pensez avoir développé une dépendance à ce produit, parlez-en à votre médecin.
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr/.
En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.
5. COMMENT CONSERVER LIKOZAM 1 mg/ml, suspension buvable ?
Tenir ce médicament hors de la vue et de la portée des enfants.
À conserver à une température ne dépassant pas 25 °C. Ne pas réfrigérer, ni congeler.
Ne pas utiliser plus de 28 jours après la première ouverture. Ramenez-le à la pharmacie.
N’utilisez pas ce médicament après la date de péremption indiquée sur l’emballage et sur l’étiquette du flacon après EXP. La date de péremption fait référence au dernier jour de ce mois.
N’utilisez pas ce médicament si vous remarquez une anomalie quelconque concernant le médicament. Parlez-en à votre médecin ou votre pharmacien.
Ne jetez aucun médicament au tout-à-l’égout ou avec les ordures ménagères. Demandez à votre pharmacien d’éliminer les médicaments que vous n’utilisez plus. Ces mesures contribueront à protéger l’environnement.
6. CONTENU DE L’EMBALLAGE ET AUTRES INFORMATIONS
Ce que contient LIKOZAM 1 mg/ml, suspension buvable
· La substance active est :
Clobazam................................................................................................................................ 1mg
Pour 1 ml.
· Les autres composants sont :
Silicate d'aluminium et de magnésium, acide citrique monohydraté (E330), phosphate disodique dihydraté, émulsion de siméthicone, sucralose (E955), polysorbate 80 (E433), arôme de masquage (contient du propylène glycol (E1520)), arôme framboise 545724E (contient du propylène glycol (E1520)), gomme xanthane (E415), parahydroxybenzoate de méthyle sodique (E219) (conservateur), parahydroxybenzoate de propyle sodique (E217) (conservateur), maltitol liquide (E965), eau purifiée.
Qu’est-ce que LIKOZAM 1 mg/ml, suspension buvable et contenu de l’emballage extérieur
LIKOZAM est une suspension de couleur blanc cassé. Il se présente sous forme de flacon en verre brun ambré contenant 150 ml de suspension buvable, d’une seringue de 5 ml et d’un adaptateur pour le flacon.
L’adaptateur du flacon n’est pas préinstallé.
Titulaire de l’autorisation de mise sur le marché
104 LOWER BAGGOT STREET
DUBLIN 2
D02 Y940
IRLANDE
Exploitant de l’autorisation de mise sur le marché
ADVICENNE
262 RUE DU FAUBOURG SAINT HONORE
75008 PARIS
UNIT 15, DAINGEAN HALL
N4 AXIS CENTRE
LONGFORD
N39 W6K0
IRLANDE
Noms du médicament dans les Etats membres de l'Espace Economique Européen
Ce médicament est autorisé dans les Etats membres de l'Espace Economique Européen sous les noms suivants : Conformément à la réglementation en vigueur.
[À compléter ultérieurement par le titulaire]
La dernière date à laquelle cette notice a été révisée est :
[À compléter ultérieurement par le titulaire]
Des informations détaillées sur ce médicament sont disponibles sur le site Internet de l’ANSM (France).
Informations importantes
Les informations importantes disponibles pour ce médicament sont les suivantes :
- L'ANSM lance une campagne de sensibilisation au bon usage des médicaments dans le traitement de l'anxiété et de l'insomnie
- Antiépileptiques pendant la grossesse entre 2013 et 2021 : une étude du GIS EPI-PHARE met en évidence une baisse importante de l'exposition au valproate et dérivés, mais moindre pour le topiramate et la carbamazépine