
ANSM - Mis à jour le : 10/10/2023
TESTAVAN 20 mg/g, gel transdermique
2. COMPOSITION QUALITATIVE ET QUANTITATIVE 
Un gramme de gel contient 20 mg de testostérone. Chaque pression sur la pompe délivre 1,15 g (1,25 mL) de gel, équivalant à 23 mg de testostérone.
Excipient à effet notoire : Un gramme de gel contient 0,2 g de propylèneglycol.
Pour la liste complète des excipients, voir rubrique 6.1.
Gel homogène, translucide à légèrement opalescent.
4.1. Indications thérapeutiques 
4.2. Posologie et mode d'administration 
Hommes adultes
La posologie initiale recommandée pour TESTAVAN 20 mg/g, gel transdermique est une application de 23 mg de testostérone (une pression) une fois par jour. Afin de garantir une posologie adéquate, la testostéronémie doit être régulièrement mesurée et la dose adaptée pour maintenir les taux de testostérone sériques à un niveau eugonadique (voir rubrique 4.4.).
Le taux sérique de testostérone doit être mesuré 2 à 4 heures après l'application, environ 14 jours et 35 jours après l'instauration du traitement ou après un ajustement posologique. Si la concentration sérique de testostérone est inférieure à 17,3 nmol/L (500 ng/dL), la dose quotidienne de TESTAVAN 20 mg/g, gel transdermique pourra être augmentée d'une pression. Si la concentration sérique de testostérone dépasse 36,4 nmol/L (1050 ng/dL), la dose quotidienne de TESTAVAN 20 mg/g, gel transdermique pourra être réduite d'une pression.
L’ajustement posologique devra être basé sur la testostéronémie et la présence de signes cliniques et de symptômes liés au déficit en testostérone.
Patients âgés
La posologie est la même que chez l'adulte. Cependant, la diminution des valeurs physiologiques de testostérone avec l’âge doit être prise en compte (voir rubrique 4.4).
Dose maximale recommandée
La dose maximale recommandée est de 69 mg de testostérone par jour, ce qui équivaut à 3 pressions sur la pompe.
Insuffisants rénaux et hépatiques
Aucune étude spécifique n'a été menée pour démontrer l'efficacité et la tolérance de ce médicament chez les patients atteints d'insuffisance rénale ou hépatique. En conséquence, le traitement substitutif à base de testostérone doit être utilisé avec prudence chez ces patients (voir rubrique 4.4). Après traitement par TESTAVAN 20 mg/g, gel transdermique, les taux de testostérone sont similaires chez les patients atteints d'insuffisance rénale légère ou modérée par rapport à ceux ayant une fonction rénale normale (voir rubrique 5.2).
Femmes
TESTAVAN 20 mg/g, gel transdermique n'est pas indiqué chez les femmes.
Population pédiatrique
TESTAVAN 20 mg/g, gel transdermique n'est pas indiqué chez l'enfant et n’a pas été évalué cliniquement chez les garçons de moins de 18 ans.
Mode d’administration
Voie transdermique.
TESTAVAN 20 mg/g, gel transdermique est un gel qui doit être appliqué sur le haut du bras et l'épaule en utilisant l'applicateur. Les patients doivent être informés qu'ils ne doivent pas appliquer TESTAVAN 20 mg/g, gel transdermique avec les doigts ou les mains.
Amorçage d'une nouvelle pompe
Afin de garantir une dose correcte, le patient doit être informé de la nécessité d'amorcer chaque nouvelle pompe avant la première utilisation en pressant à fond la tête de la pompe dans un mouchoir en papier jusqu'à l'apparition du gel. Éliminer la première dose de gel et jeter en toute sécurité le mouchoir en papier usagé.
Administration
TESTAVAN 20 mg/g, gel transdermique doit être appliqué une fois par jour, approximativement au même moment de la journée, de préférence le matin, sur une peau propre, sèche et saine, au niveau du haut du bras et de l’épaule, en utilisant l'applicateur. Une plus faible quantité de testostérone sera délivrée si TESTAVAN 20 mg/g, gel transdermique est appliqué sur l'abdomen ou la cuisse ; le changement de site d'application n'est donc pas recommandé (voir rubrique 5.2).
Après avoir retiré le capuchon de l'applicateur, pour appliquer le gel appuyer une fois à fond sur la tête de la pompe au-dessus de l'applicateur. Les patients doivent être informer qu’ils ne doivent effectuer qu'une seule pression à la fois sur l'applicateur. L'applicateur doit être utilisé pour étaler uniformément le gel en couvrant le maximum de surface sur le haut du bras et l'épaule, en veillant à ne pas faire couler de gel sur les mains. Lorsque des pressions supplémentaires sont requises pour atteindre la posologie quotidienne, la procédure doit être répétée sur le bras et l'épaule opposés.
|
Dose |
Méthode d'application |
|
23 mg (1 pression) |
Appliquer le contenu d'une pression sur le haut du bras et l'épaule. |
|
46 mg (2 pressions) |
Appliquer le contenu d'une pression sur le haut du bras et l'épaule. Répéter la procédure pour appliquer une autre pression sur le haut du bras et l'épaule opposés. |
|
69 mg (3 pressions) |
Appliquer le contenu d'une pression sur le haut du bras et l'épaule. Répéter la procédure pour appliquer une autre pression sur le haut du bras et l'épaule opposés. Répéter à nouveau la procédure pour appliquer une troisième pression sur le haut du bras et l'épaule initialement traités. |
Nettoyage de l'applicateur
Après utilisation, l'applicateur doit être nettoyé avec un mouchoir, et le capuchon de protection replacé sur la tête de l'applicateur. Le mouchoir en papier usagé doit être jeté en toute sécurité et le produit conservé hors de portée des enfants.
Après administration
En cas de contact du gel avec les mains pendant la procédure d'application, le patient doit se laver les mains avec de l'eau et du savon immédiatement après l'application de TESTAVAN 20 mg/g, gel transdermique.
Il doit être recommandé au patient de laisser la zone d'application sécher complètement avant de s'habiller.
Il doit également être recommandé au patient d'attendre au moins 2 heures avant de prendre une douche, de nager ou de prendre un bain, afin d'éviter une réduction de l'absorption de testostérone (voir rubrique 4.4).
Porter systématiquement un vêtement recouvrant la zone d'application afin d’éviter tout transfert accidentel sur d'autres personnes.
· Carcinome du sein ou de la prostate suspecté ou confirmé
4.4. Mises en garde spéciales et précautions d'emploi 
Avant d’instaurer un traitement substitutif à base de testostérone, tous les patients doivent subir un examen approfondi afin d’écarter tout risque de cancer de la prostate préexistant.
Une surveillance attentive et régulière des seins et de la prostate, selon les méthodes recommandées (toucher rectal et dosage du PSA - Antigène Spécifique de la Prostate) doit être effectuée au moins une fois par an chez tout patient suivant un traitement à base de testostérone et deux fois par an chez les patients âgés et les patients à risque (facteurs de risque cliniques ou familiaux).
Les taux de testostérone doivent être surveillés au début et à intervalles réguliers pendant le traitement. La posologie doit être ajustée individuellement par les cliniciens afin de garantir le maintien des taux de testostérone au niveau eugonadique. Certains signes cliniques de type irritabilité, nervosité, prise de poids, érections prolongées ou fréquentes, peuvent indiquer que l’exposition aux androgènes est excessive et nécessite une adaptation posologique.
Les androgènes peuvent accélérer la progression d’un cancer de la prostate subclinique ou d’une hyperplasie bénigne de la prostate.
TESTAVAN 20 mg/g, gel transdermique doit être utilisé avec prudence chez les patients atteints de cancer présentant un risque d'hypercalcémie (et d'hypercalciurie associée) dû à des métastases osseuses. Une surveillance régulière des concentrations plasmatiques de calcium est recommandée chez ces patients.
TESTAVAN 20 mg/g, gel transdermique n'est pas un traitement de la stérilité masculine ou de l'impuissance.
L’expérience concernant la sécurité d'emploi et l’efficacité de TESTAVAN 20 mg/g, gel transdermique est limitée chez les patients âgés de plus de 65 ans. Actuellement, il n'existe pas de consensus concernant les valeurs de référence spécifiques à l'âge pour la testostérone. Cependant, la diminution des valeurs physiologiques de testostérone sérique avec l’âge doit être prise en compte.
La testostérone peut entraîner une augmentation de la pression artérielle. TESTAVAN 20 mg/g, gel transdermique doit être utilisé avec prudence chez les hommes souffrants d’hypertension.
Chez les patients souffrant d'insuffisance cardiaque, hépatique ou rénale sévères, ou de cardiopathie ischémique, un traitement à base de testostérone peut causer des complications sévères caractérisées par un œdème avec ou sans insuffisance cardiaque congestive. Dans ce cas, le traitement doit être immédiatement interrompu.
Troubles de la coagulation :
La testostérone doit être utilisée avec prudence chez les patients souffrant de thrombophilie ou présentant des facteurs de risque de thromboembolie veineuse (TEV) car des cas d'événements thromboemboliques ont été rapportés chez ces patients sous traitement par testostérone lors d’études et de suivis post-commercialisation (par exemple, thrombose veineuse profonde, embolie pulmonaire, thrombose oculaire). Chez les patients atteints de thrombophilie, des cas de TEV ont été rapportés même sous traitement anticoagulant. Par conséquent, la poursuite du traitement par la testostérone après un premier événement thrombotique doit être évaluée attentivement. En cas de poursuite du traitement, d’autres mesures doivent être prises afin de réduire au maximum le risque de TEV.
La testostérone doit être utilisée avec prudence chez les patients atteints de cardiopathie ischémique, d'épilepsie et de migraine, ces pathologies pouvant être aggravées.
Des publications ont rapporté un risque majoré d'apnée du sommeil chez des hommes hypogonadiques traités par des esters de testostérone, en particulier chez ceux ayant des facteurs de risque tels qu'une obésité ou une maladie respiratoire chronique.
En cas de développement d'une réaction sévère au site d'application, le traitement doit être reconsidéré et arrêté si nécessaire.
Chez les patients recevant une thérapie androgénique au long cours, les paramètres biologiques suivants doivent également être surveillés régulièrement : hémoglobine, hématocrite, tests de la fonction hépatique et profil lipidique.
TESTAVAN 20 mg/g, gel transdermique ne doit pas être utilisé chez les femmes en raison d'effets virilisants potentiels.
Dans la mesure où la toilette après l'administration de TESTAVAN 20 mg/g, gel transdermique réduit les taux de testostérone, il est conseillé aux patients de ne pas se laver ou prendre de douche pendant au moins 2 heures après l'application de TESTAVAN 20 mg/g, gel transdermique. Une toilette réalisée dans les 2 heures suivant l'application du gel peut entraîner une réduction de l'absorption de testostérone.
TESTAVAN 20 mg/g, gel transdermique contient du propylèneglycol, ce qui peut provoquer une irritation cutanée.
TESTAVAN 20 mg/g, gel transdermique contient de l’éthanol. Ce médicament contient 538,70 mg d’alcool (éthanol), dans chaque dose de 1,15 g, ce qui équivaut à 468,40 mg/g (46,84 % v/v).
Les produits à base d'alcool, y compris TESTAVAN 20 mg/g, gel transdermique, sont inflammables ; par conséquent, il convient d'éviter de s'approcher du feu, des flammes, ou de fumer jusqu'à ce que le gel ait séché.
Risque de transfert
Si aucune précaution n’est prise, un transfert de testostérone à d’autres personnes peut se produire lors d’un contact cutané direct avec la zone d’application du gel, induisant une augmentation du taux de testostérone et, en cas de contact répété (androgénisation accidentelle) de possibles effets indésirables (par exemple augmentation de la pilosité sur le visage et le corps, acné, mue de la voix, irrégularités du cycle menstruel).
Le médecin doit soigneusement informer le patient sur le risque de transfert de testostérone et sur les consignes de sécurité (voir ci-dessous). TESTAVAN 20 mg/g, gel transdermique ne doit pas être prescrit aux patients présentant un risque élevé de non-observance des précautions d’utilisation (par exemple en cas d’alcoolisme sévère, d’abus de drogue, de troubles psychiatriques sévères).
Le port d’un vêtement recouvrant la zone d'application ou la prise d’une douche préalablement au contact permet d’éviter ce transfert.
En conséquence, les précautions suivantes sont recommandées :
Pour le patient :
· Utiliser l'embout applicateur pour administrer le produit sans contact avec les mains, afin de réduire le risque d'exposition secondaire à la testostérone.
· En cas de contact des mains avec le gel pendant la procédure d'application, se laver soigneusement les mains avec de l'eau et du savon après avoir appliqué le gel.
· Couvrir la zone d'application avec un vêtement dès que le gel a séché.
· Prendre une douche préalablement à toute situation où un contact cutané direct avec une autre personne est prévisible.
Pour les personnes non traitées par TESTAVAN 20 mg/g, gel transdermique :
· En cas de contact avec une zone d’application non lavée ou non couverte par un vêtement, laver, dès que possible, à l'eau et au savon, la zone cutanée sur laquelle le transfert de testostérone a pu se produire.
· Signaler l’apparition de signes d’androgénisation tels que l’acné ou une modification de la pilosité.
Pour garantir la sécurité du partenaire, il faudra conseiller au patient par exemple, de porter un T-shirt couvrant la zone d'application pendant la durée du contact ou de prendre une douche avant un rapport sexuel.
De plus, durant les périodes de contact avec un enfant, il est également recommandé de porter un T-shirt couvrant la zone d’application afin d’éviter un risque de contamination de la peau de l'enfant.
Les femmes enceintes doivent éviter tout contact avec les zones d’application de TESTAVAN 20 mg/g, gel transdermique. En cas de grossesse de la partenaire, le patient devra être d’autant plus vigilant quant aux précautions d’utilisation (voir rubrique 4.6).
Les patients doivent veiller à minimiser l'utilisation de crèmes corporelles et de produits solaires sur la zone d'application, au moment et juste après l'application de TESTAVAN 20 mg/g, gel transdermique.
Interactions avec les analyses biologiques : Les androgènes peuvent diminuer les concentrations de la protéine liant la thyroxine, entraînant une diminution de la concentration sérique de la thyroxine (T4) totale et une augmentation du captage sur résine de la triiodothyronine (T3) et de la T4. La concentration en hormones thyroïdienne libre reste néanmoins inchangée, et aucun signe clinique en faveur d’un dysfonctionnement thyroïdien n’a été mis en évidence.
4.5. Interactions avec d'autres médicaments et autres formes d'interactions 
L’administration concomitante de testostérone et d’ACTH (Adrenocorticotropic hormone) ou de corticostéroïdes peut augmenter le risque d’apparition d’œdèmes. Par conséquent, ces médicaments devront être utilisés avec prudence, en particulier chez les patients souffrant de maladie cardiaque, rénale ou hépatique.
Une amélioration de la sensibilité à l’insuline peut être observée chez les patients traités par androgènes et présentant des concentrations plasmatiques de testostérone normales sous traitement substitutif.
Aucune étude d'interaction avec les lotions corporelles et les produits solaires n'a été réalisée.
4.6. Fertilité, grossesse et allaitement 
TESTAVAN 20 mg/g, gel transdermique est destiné à l'utilisation chez l'homme uniquement.
Aucune étude clinique n'a été menée avec TESTAVAN 20 mg/g, gel transdermique pour l'évaluation de la fertilité masculine. Une suppression réversible de la spermatogenèse peut survenir avec TESTAVAN 20 mg/g, gel transdermique (voir rubrique 5.3).
Les femmes enceintes doivent éviter tout contact cutané avec les sites d'application de TESTAVAN 20 mg/g, gel transdermique (voir rubrique 4.4).
En cas de contact direct entre la peau d'une femme enceinte et une peau non lavée ou non recouverte d'un vêtement sur laquelle TESTAVAN 20 mg/g, gel transdermique a été appliqué, toute la zone de contact chez la femme doit être immédiatement lavée avec de l'eau et du savon.
La testostérone peut induire des effets virilisants sur le fœtus.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines 
a. Résumé du profil de sécurité
Les réactions indésirables les plus fréquemment rapportées dans les études cliniques de phase II et de phase III durant une période jusqu'à 9 mois étaient des réactions au site d'application (4%) incluant : rash, érythème, prurit, dermatite, sècheresse et irritation cutanée. La majorité de ces réactions était d'intensité légère à modérée.
b. Tableau résumant les événements indésirables
Les réactions indésirables rapportées dans les études cliniques de phase II et de phase III avec TESTAVAN 20 mg/g, gel transdermique sont listés dans le tableau suivant. Tous les réactions indésirables rapportées ayant une relation causale suspectée sont listées par classe et en fonction des fréquences suivantes : fréquent (≥ 1/100 à < 1/10) ; peu fréquent (≥ 1/1 000 à < 1/100).
Réactions indésirables liées à l’utilisation de TESTAVAN 20 mg/g, gel transdermique rapportées dans les études cliniques avec plus d'un cas (N=379)
|
MedDRA Système Classe Organe |
Fréquent (≥ 1/100 à < 1/10) |
Peu fréquent (≥ 1/1 000 à < 1/100) |
|
Troubles généraux et anomalies au site d’administration |
Réaction au site d’application (incluant rash, érythème, prurit, dermatite, sècheresse et irritation cutanée) |
|
|
Investigations |
Triglycérides sanguins augmentés/Hypertriglycéridémie, Antigène spécifique prostatique (PSA) augmenté, Hématocrite augmenté |
Hémoglobine augmentée |
|
Affections vasculaires |
Hypertension |
|
|
Affection du système nerveux |
|
Céphalée |
Sur la base de la littérature et des déclarations spontanées issues de l'utilisation de gels de testostérone, d'autres effets indésirables connus sont listés dans le tableau ci-dessous :
|
MedDRA Système Classe Organe |
Réactions indésirables – Preferred term |
|
Affections hématologiques et du système lymphatique |
Polyglobulie, Anémie |
|
Affections psychiatriques |
Insomnie, Dépression, Anxiété, Agression, Nervosité, Hostilité |
|
Affections du système nerveux |
Céphalée, Sensation vertigineuse, Paresthésie |
|
Affections vasculaires |
Bouffées de chaleur (vasodilatation), Thrombose veineuse profonde |
|
Affections respiratoires, thoraciques et médiastinales |
Dyspnée, Syndrome d’apnée du sommeil |
|
Affections gastro-intestinales |
Nausée |
|
Affections de la peau et du tissu sous-cutané |
Diverses réactions cutanées peuvent se produire, incluant Acné, Séborrhée et Alopécie (Calvitie), Hyperhidrose, Hypertrichose |
|
Affections musculosquelettiques et du tissu conjonctif |
Douleur musculosquelettique, Contractures musculaires |
|
Affections du rein et des voies urinaires |
Dysurie, Obstruction des voies urinaires |
|
Affections des organes de reproduction et du sein |
Gynécomastie, Erection augmentée, Trouble testiculaire, Oligospermie, Hypertrophie bénigne de la prostate, troubles de la libido (il est fréquent que lors d’un traitement avec des préparations de testostérone à fortes doses, la spermatogénèse soit interrompue de manière réversible ou réduite, diminuant ainsi la taille des testicules ; le traitement substitutif à base de testostérone de l'hypogonadisme peut, dans de rares cas, provoquer des érections persistantes et douloureuses (Priapisme), des anomalies prostatiques, et des cancers de la prostate*) |
|
Troubles généraux et anomalies au site d’administration |
Asthénie, Malaise, Réaction au site d'application. L'administration de dose élevée ou à long terme de testostérone peut occasionnellement majorer la survenue de rétention liquidienne et d'œdèmes ; des réactions d'hypersensibilité peuvent survenir. |
|
Investigations |
Poids augmenté, Antigène spécifique prostatique (PSA) augmenté, Hématocrite augmenté, Numération des globules rouges ou Hémoglobine augmentée |
|
Troubles du métabolisme et de la nutrition |
Ionogramme sanguin anormal (rétention de sodium, chlorure, potassium, calcium, phosphate inorganique et d'eau) lors de traitement à forte dose et/ou prolongé. |
|
Affections hépatobiliaires |
Ictère, Tests hépatiques anormaux. |
* Les données sur le risque d’apparition d’un cancer de la prostate en association avec le traitement par testostérone sont peu concluantes.
En raison de la présence d'alcool dans le produit, les applications fréquentes sur la peau peuvent provoquer une irritation et une sècheresse cutanées.
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr/
Aucun cas de surdosage avec TESTAVAN 20 mg/g, gel transdermique n'a été rapporté dans les études cliniques.
Symptômes
Des signes cliniques tels que irritabilité, nervosité, poids augmenté, érections prolongées ou fréquentes, peuvent indiquer une surexposition aux androgènes ; la testostéronémie doit donc être mesurée.
Traitement
La prise en charge du surdosage consiste en l'arrêt de TESTAVAN 20 mg/g, gel transdermique associé à un traitement symptomatique d'appoint approprié et des soins de soutien.
5. PROPRIETES PHARMACOLOGIQUES 
5.1. Propriétés pharmacodynamiques 
Classe pharmacothérapeutique : Androgènes, code ATC : G03B A03.
La testostérone et la dihydrotestostérone (DHT), androgènes endogènes, sont responsables de la croissance normale et du développement des organes génitaux masculins, ainsi que du maintien des caractères sexuels secondaires.
Ces effets incluent : la croissance et la maturation de la prostate, des vésicules séminales, du pénis et du scrotum, le développement de la pilosité masculine au niveau du visage, de la poitrine, des aisselles et du pubis, l’élargissement du larynx et l’épaississement des cordes vocales, la modification de la musculature et la répartition des graisses corporelles.
Une sécrétion insuffisante de testostérone due à une insuffisance testiculaire, à une pathologie hypophysaire ou à un déficit en GnRH (l'hormone de libération des gonadotrophines hypophysaires) conduit à un hypogonadisme masculin et à une concentration plasmatique de testostérone basse. Les symptômes associés à une testostéronémie basse incluent une diminution du désir sexuel accompagnée ou non d’impuissance, fatigue, perte de la masse musculaire, humeur dépressive et régression des caractères sexuels secondaires.
La restauration des taux de testostérone à des valeurs normales peut conduire après un certain temps à une amélioration de la masse musculaire, de l'humeur, du désir sexuel, de la libido et des fonctions sexuelles incluant la performance sexuelle et le nombre d’érections spontanées.
Lors de l’administration exogène de testostérone à des hommes en bonne santé, la sécrétion de testostérone endogène peut diminuer du fait de l’inhibition, par rétrocontrôle négatif, de l’hormone lutéinisante (LH) hypophysaire. En cas d’administration de fortes doses d’androgènes exogènes la spermatogenèse peut également être supprimée en raison de l’inhibition de l’hormone folliculostimulante (FSH) hypophysaire.
L’administration d’androgènes induit une rétention de sodium, d’azote, de potassium, de phosphore et une diminution de l’excrétion urinaire de calcium. Il a été rapporté que les androgènes augmentent l’anabolisme protéique et diminuent le catabolisme protéique. L’équilibre azoté n’est amélioré qu’avec un apport suffisant de calories et de protéines. Il a été rapporté que les androgènes stimulent la production des globules rouges par augmentation de la production d’érythropoïétine.
5.2. Propriétés pharmacocinétiques 
TESTAVAN 20 mg/g, gel transdermique délivre une quantité physiologique de testostérone qui produit un niveau de testostérone circulante similaire aux taux normaux chez les hommes en bonne santé (à savoir 300-1050 ng/dL). TESTAVAN 20 mg/g, gel transdermique a été évalué dans une étude clinique de phase III multicentrique, ouverte, de 120 jours (étude 000127), menée chez 159 hommes hypogonadiques âgés de 18 à 75 ans (âge moyen, 54,1 ans). Les patients étaient caucasiens (77%), afro-américains (20%), asiatiques (2%), et d'origines multiples (1%). Dans cette étude de phase III, à la fin de la période de traitement de 90 jours pendant laquelle la dose de TESTAVAN 20 mg/g, gel transdermique a pu être titrée sur la base des concentrations totales de testostérone, 76,1% des hommes avaient des concentrations de testostérone moyennes sur un intervalle de 24 heures (Cm) à un niveau eugonadique (300 – 1050 ng/dL).
Le profil de concentration moyenne de testostérone au jour 90 est présenté en Figure 1, et les paramètres pharmacocinétiques pour la testostérone totale au jour 90 sont résumés pour chaque dose de TESTAVAN 20 mg/g, gel transdermique au
Tableau 1.
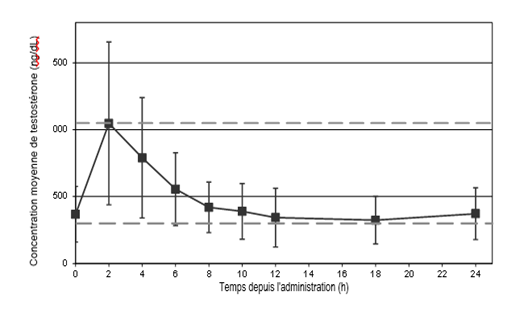
Figure 1 Concentrations sériques moyennes ± ET de testostérone au jour 90 après la titration de dose de TESTAVAN 20 mg/g, gel transdermique
Tableau 1 Paramètres pharmacocinétiques pour la testostérone totale, au jour 90 suivant la titration, ensemble complet d'analyse de l'étude 000127
|
Dose de TESTAVAN 20 mg/g, gel transdermique au jour 90 |
N |
Cmin Moyenne ±ET |
Cm Moyenne ±ET |
Cmax Moyenne ±ET |
Tmax Médiane |
|
23 mg |
5 |
191 ± 49 |
368 ± 121 |
721 ± 254 |
4,02 |
|
46 mg |
45 |
277 ± 140 |
506 ± 207 |
1 228 ± 640 |
2,02 |
|
69 mg |
89 |
229 ± 82 |
438 ± 164 |
1 099 ± 595 |
2,08 |
Cmin: concentration minimale ; Cm: concentration moyenne sur un intervalle de 24 heures ; Cmax: concentration maximale ; Tmax: temps jusqu'à la concentration maximale ; ET : écart-type
Absorption
TESTAVAN 20 mg/g, gel transdermique assure une délivrance transdermique de testostérone, avec un Tmax médian d'environ 2-4 heures après l'administration. Les concentrations totales de testostérone reviennent à des valeurs pré-dose approximativement 12 heures après l'application et aucune accumulation ne se produit après une application quotidienne pendant 10 jours. L'application sur le haut du bras et de l'épaule produit des concentrations sériques plus élevées de testostérone que l'application sur l'abdomen ou l'intérieur de la cuisse. La Cmax moyenne était respectivement de 926,451 et 519 ng/dL, et la Cm moyenne respectivement de 557,372 et 395 ng/dL.
Les résultats de l'étude de phase II ont démontré que les concentrations de testostérone totale augmentaient avec l’augmentation de l’application quotidienne de 23, 46 et 69 mg de TESTAVAN 20 mg/g, gel transdermique.
Distribution
La testostérone circulante est principalement liée à la globuline liant les hormones sexuelles (sex-hormone-binding-globulin, SHBG) et à l’albumine. La fraction de testostérone liée à l’albumine se sépare facilement de l’albumine et est présumée être la fraction biologiquement active. La fraction de testostérone liée à la SHBG n’est pas considérée comme biologiquement active. Environ 40% de la testostérone plasmatique sont liés à la SHBG, 2% restent libres, le reste est lié à l’albumine et aux autres protéines.
Biotransformation
La littérature rapporte un temps de demi-vie de la testostérone très variable, allant de 10 à 100 minutes.
La testostérone est métabolisée en plusieurs 17-cétostéroïdes via deux voies métaboliques différentes. Les principaux métabolites actifs de la testostérone sont l’estradiol et la dihydrotestostérone (DHT).
Élimination
Environ 90% de la testostérone administrée par voie intramusculaire est excrétée dans les urines sous forme d’acides glucuroniques et sulfoniques de testostérone conjugués et ses métabolites ; 6% environ de la dose est excrétée dans les fèces, principalement sous forme non conjuguée.
Effets de la douche
Une douche prise entre 1 heure et 2 heures après l'administration de TESTAVAN 20 mg/g, gel transdermique a diminué la Cm respectivement de 19,2% et de 14,3%, comparé aux patients n'ayant pas pris de douche après l'administration de TESTAVAN 20 mg/g, gel transdermique. Une douche prise 6 heures après l'administration de TESTAVAN 20 mg/g, gel transdermique n'a pas entraîné de diminution de la Cm.
Fonction rénale
La Cm et la Cmax de la testostérone sont similaires chez les sujets ayant une fonction rénale normale et ceux ayant une insuffisance rénale légère et modérée. Aucune donnée n'est disponible chez les patients atteints d'insuffisance rénale sévère.
5.3. Données de sécurité préclinique 
Les études sur la fertilité chez les rongeurs et les primates ont démontré que le traitement par testostérone peut altérer la fertilité masculine en supprimant la spermatogenèse de manière dose dépendante.
Il a été observé que la testostérone est non mutagène in vitro en utilisant le modèle de mutation reverse (test d'Ames) ou une lignée de cellules ovariennes de hamster chinois. Une relation causale entre le traitement androgénique et la survenue de certaines formes de cancer a été observée chez des animaux de laboratoire. Les données chez les rats ont démontré une incidence accrue de cancers de la prostate après traitement par testostérone.
Les hormones sexuelles sont connues pour favoriser le développement de certains types de tumeurs induites par des agents carcinogènes connus. Aucune corrélation n'a été établie entre ces observations et le risque réel chez l'homme.
3 ans.
6.4. Précautions particulières de conservation 
Ce médicament ne nécessite pas de précautions particulières de conservation.
6.5. Nature et contenu de l'emballage extérieur 
TESTAVAN 20 mg/g, gel transdermique est délivré en récipient multidose constitué d'une pompe doseuse avec ou sans un sachet en aluminium laminé contenu dans un flacon, et fourni avec un embout applicateur muni d'un capuchon hygiénique. Les pompes doseuses sans applicateurs de bouchons seront équipées d'un couvercle supplémentaire sur le dessus de la tête de pompe.
La pompe est constituée de polypropylène, de monomère diène de propylène éthylène et d'acier inoxydable ; le sachet est un stratifié composé de polyéthylène/polyéthylène téréphthalate/aluminium/ polyéthylène enfermé dans un flacon en polypropylène rigide.
Le produit est disponible en étuis contenant un ou trois (3x1) récipients multidoses. Chaque pompe contient 85,5 g de TESTAVAN 20 mg/g, gel transdermique et peut dispenser 56 doses mesurées.
Toutes les présentations peuvent ne pas être commercialisées.
6.6. Précautions particulières d’élimination et de manipulation 
Tout médicament non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE 
THE SIMPLE PHARMA COMPANY LIMITED
GROUND FLOOR, 71 LOWER BAGGOT STREET
DUBLIN, D02 P593
IRLANDE
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE 
· 34009 301 468 0 4 : récipient multidose (constitué d'une pompe doseuse et d’un sachet contenu dans un flacon) avec un embout applicateur, boite de 1 récipient
· récipient multidose (constitué d'une pompe doseuse et d’un sachet contenu dans un flacon) avec un embout applicateur, boite de 3 récipients
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION 
[à compléter ultérieurement par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE 
[à compléter ultérieurement par le titulaire]
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES 
Liste I
Prescription initiale réservée aux spécialistes en endocrinologie - diabétologie - nutrition, en urologie, en gynécologie ou en médecine et biologie de la reproduction - andrologie.
Renouvellement non restreint.
|
| Plan du site | Accessibilité | Contact | Téléchargement | Declaration de confidentialité | Service-Public.fr | Legifrance | Gouvernement.fr |