Dernière mise à jour le 01/12/2025
FLIXOVATE 0,05 %, crème
Indications thérapeutiques
Classe pharmacothérapeutique : corticoïde d’activité forte (groupe III) - code ATC : D07AC17
Ce médicament contient du propionate de fluticasone qui est un corticoïde local d'activité forte, il est destiné à une application cutanée.
Ce médicament est préconisé chez l'adulte et l'enfant à partir de l'âge de 1 an, dans certaines maladies de peau comme l'eczéma de contact, la dermatite atopique, le psoriasis. Ce médicament est également utilisé chez le nourrisson, à partir de l'âge de 3 mois, uniquement pour traiter la dermatite atopique.
Présentations
> 1 tube(s) aluminium de 30 g
Code CIP : 336 839-6 ou 34009 336 839 6 2
Déclaration de commercialisation : 28/11/2001
Cette présentation est agréée aux collectivités
- Prix hors honoraire de dispensation : 3,12 €
- Honoraire de dispensation : 1,02 €
- Prix honoraire compris : 4,14 €
- Taux de remboursement :65%
Service médical rendu (SMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprès de la HAS (plus d'informations dans l'aide). Les avis et synthèses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur du SMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| Important | Avis du 16/05/2018 | Renouvellement d'inscription (CT) | Le service médical rendu par FLIXOVATE reste important dans les dermatoses inflammatoires cortico-sensibles. le service médical rendu par FLIXOVATE 0,05 % crème et FLIXOVATE 0,005 % pommade reste: • chez l’adulte et l’enfant à partir de 12 mois dans le traitement curatif et la prévention des récurrences de la dermatite atopique important chez les patients atteints de dermatite atopique sévère avec poussées fréquentes (au moins 5 poussées par an) •¿chez le nourrisson de 3 à 12 mois important dans le traitement curatif de la dermatite atopique uniquement dans les formes sévères, très inflammatoires ou très lichénifiées, résistantes aux émollients et aux dermocorticoïdes d’activité modérée et selon les modalités suivantes : cure courte, sur de petites surfaces en évitant les plis et les zones génitales et ne doit pas être utilisé sur le visage. |
| Modéré | Avis du 16/05/2018 | Renouvellement d'inscription (CT) | Le service médical rendu par FLIXOVATE 0,05 % crème et FLIXOVATE 0,005 % pommade reste modéré chez les patients atteints de dermatite atopique sévère avec moins de 5 poussées par an et chez ceux ayant une dermatite atopique non sévère. • |
Amélioration du service médical rendu (ASMR)
Pas d'ASMR disponible pour ce médicament (plus d'informations dans l'aide )
ANSM - Mis à jour le : 06/11/2023
FLIXOVATE 0,05 %, crème
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Propionate de fluticasone....................................................................................................... 0,05 g
Pour 100 g.
Excipients à effet notoire : alcool cétostéarylique, propylène glycol, imidurée (produisant du formaldéhyde).
Pour la liste complète des excipients, voir rubrique 6.1.
Crème.
4.1. Indications thérapeutiques
Nourrisson, à partir de l'âge de 3 mois :
· dermatite atopique.
Adulte, enfant à partir de l'âge de 12 mois :
1. Indications privilégiées où la corticothérapie locale est tenue pour le meilleur traitement :
· eczéma de contact,
· dermatite atopique (traitement curatif et prévention des récurrences, voir paragraphe 4.2 Posologie et mode d'administration),
· lichénification.
2. Indications où la corticothérapie locale est l'un des traitements habituels :
· dermite de stase,
· psoriasis (à l'exclusion des plaques très étendues),
· lichen,
· prurigo non parasitaire,
· dyshidrose,
· lichen scléro-atrophique génital,
· granulome annulaire,
· lupus érythémateux discoïde,
· dermite séborrhéique à l'exception du visage,
· traitement symptomatique du prurit du mycosis fongoïde.
3. Indications de circonstance pour une durée brève :
· piqûres d'insectes et prurigo parasitaire après traitement étiologique.
La forme crème est plus particulièrement destinée aux lésions aiguës, suintantes.
Remarque : chaque dermatose doit être traitée par un corticoïde de niveau le mieux approprié en sachant qu’en fonction des résultats on peut être conduit à lui substituer un produit d’une activité plus forte ou moins forte sur tout ou partie des lésions.
4.2. Posologie et mode d'administration
Posologie
· Traitement de la dermatite atopique :
Nourrisson à partir de l'âge de 3 mois :
1 application par jour.
· Traitement des dermatoses inflammatoires :
Adulte et enfant à partir de l'âge de 12 mois :
1 à 2 applications par jour.
943 patients âgés de 3 mois à 14 ans ont été traités par du propionate de fluticasone (crème, lotion ou pommade) dont 63 enfants âgés de 3 mois à 1 an étaient traités pour une dermatite atopique. La durée du traitement était inférieure ou égale à 4 semaines. L'efficacité et la tolérance lors d'un traitement plus long ou d'autres affections dermatologiques sont peu ou (mal) connues.
Une augmentation du nombre d'applications quotidiennes risquerait d'aggraver les effets indésirables sans améliorer les effets thérapeutiques.
Certaines dermatoses (psoriasis, dermatite atopique...) rendent souhaitable un arrêt progressif. Il peut être obtenu par la diminution de la fréquence des applications et/ou par l'utilisation d'un corticoïde moins fort ou moins dosé.
· Prévention des récurrences de dermatite atopique :
1 application par jour, 2 jours par semaine.
Après avoir traité efficacement l'épisode aigu, Flixovate devra être appliqué sur les zones précédemment lésées ou à risque de récurrence.
Il est conseillé d'associer ce traitement à des produits émollients quotidiennement.
L'efficacité et la tolérance ont été évaluées au cours des essais cliniques sur des durées de traitement allant de 16 à 20 semaines.
Mode d'administration
Chez l'adulte comme chez l'enfant et le nourrisson à partir de 3 mois, afin de mieux préciser la quantité de crème à appliquer sur une surface donnée, on peut utiliser la méthode de l'unité phalangette. L'unité phalangette correspond à la quantité de crème déposée d'un trait continu sur toute la longueur de la dernière phalange de l'index d'un adulte. Cette quantité ainsi délivrée permet de traiter une surface de peau correspondant à la surface des 2 mains d'un adulte (soit environ 250 à 300 cm²). Une unité phalangette correspond à 0,5 g de produit. Un tube de 30 grammes contient 60 unités phalangettes.
Le traitement de grandes surfaces nécessite une surveillance du nombre de tubes utilisés.
Appliquer en fine couche sur la surface à traiter et faire pénétrer par léger massage, jusqu'à ce que la crème soit entièrement absorbée. Se laver les mains après application.
Il est conseillé d'appliquer le produit en touches espacées, puis de l'étaler en massant légèrement jusqu'à ce qu'il soit entièrement absorbé.
Prévoir suffisamment de temps pour permettre l’absorption du produit après chaque application avant d’appliquer un émollient.
En cas d’aggravation ou d’absence d’amélioration au bout de 2 à 4 semaines, le traitement et le diagnostic doivent être réévalués.
Lorsqu’un épisode aigu a été traité efficacement avec un traitement continu de corticoïde local, un traitement intermittent peut être envisagé. En cas d’utilisation intermittente chronique, la fonction de l’axe hypothalamo-hypophyso-surrénalien devra être évaluée régulièrement.
· Hypersensibilité à la substance active ou à l’un des excipients mentionnés à la rubrique 6.1,
· infections cutanées non traitées virales (par exemple : Herpes simplex, varicelle), bactériennes (exemple impétigo...), mycosiques ou parasitaires ,
· lésions ulcérées,
· acné,
· dermatite péri-orale,
· prurit péri-anal et génital,
· dermatoses chez les nourrissons de moins de trois mois, y compris dermatite et érythème fessier,
· rosacée.
· L’utilisation de ce médicament n’est pas indiquée dans le traitement des lésions cutanées primitives causées par des champignons ou des bactéries.
4.4. Mises en garde spéciales et précautions d'emploi
Mises en garde spéciales
Des manifestations d’hypercorticisme (Syndrome de Cushing) et une inhibition réversible de l’axe hypothalamo-hypophyso-surrénalien, engendrant une insuffisance corticosurrénalienne (cortisol plasmatique matinal inférieur à 5 microgrammes/dL), peuvent se produire chez certains sujets en raison d’une augmentation de l’absorption systémique des corticoïdes locaux ou en cas d'application du corticoïde local sur plus de 50% de la surface corporelle d’un adulte et de plus de 20 g par jour.
Dans l’un ou l’autre cas, il conviendra d’arrêter progressivement le médicament en réduisant la fréquence d’application, ou en lui substituant un corticoïde d'activité moins forte. Un arrêt brutal du traitement peut engendrer une insuffisance surrénalienne (voir rubrique 4.8).
Les facteurs susceptibles d’accroitre les effets systémiques sont les suivants :
· Activité et formulation du corticoïde local,
· durée de l’exposition,
· application sur une zone étendue,
· application cutanée occlusive (par ex., sur des zones intertrigineuses ou sous pansement occlusif (chez les nourrissons, les couches peuvent avoir les mêmes conséquences qu’un pansement occlusif),
· augmentation de l’hydratation de la couche cornée,
· Application sur des surfaces cutanées fines comme le visage,
· Application sur des lésions cutanées ou autres situations dans lesquelles il y a une altération de la barrière cutanée,
· Comparé à l’adulte, l’enfant, particulièrement chez le nourrisson et l'enfant en bas âge peut absorber des quantités proportionnellement plus importantes de corticoïdes locaux et est donc davantage exposé aux effets indésirables systémiques (syndrome cushingoïde et ralentissement de la croissance). Ceci s’explique par le fait que les enfants ont une barrière cutanée immature et un ratio surface corporelle /poids plus importante comparé à l’adulte. Ces effets disparaissent à l'arrêt du traitement, mais un arrêt brutal peut être suivi d'une insuffisance surrénale aiguë.
Précautions d’emploi
Risque d’infection en cas d’occlusion
Chez le nourrisson en dessous de l'âge de 3 mois, il est préférable d'éviter les corticoïdes d'activité forte. Il faut se méfier particulièrement des phénomènes d'occlusion spontanés pouvant survenir dans les plis ou sous les couches.
L’infection bactérienne est favorisée par la chaleur et l’humidité présentes dans les plis cutanés ou sous un pansement occlusif. En cas d’utilisation d’un pansement occlusif, la peau devra être nettoyée avant chaque changement du pansement.
Emploi en cas de psoriasis
Les corticoïdes locaux doivent être utilisés avec prudence dans les cas de psoriasis, car des effets rebond, le développement d’une accoutumance, un risque de psoriasis pustuleux généralisé et une toxicité locale ou systémique due à l’altération de la barrière cutanée ont été rapportés dans certains cas. Une utilisation dans le traitement du psoriasis impose une surveillance médicale attentive.
Application sur le visage
Une application prolongée sur le visage est déconseillée, cette zone étant davantage sujette aux risques d’atrophie cutanée. L'utilisation prolongée sur le visage de corticoïdes à activité forte expose à la survenue d'une dermite cortico-induite et paradoxalement cortico-sensible avec rebond après chaque arrêt. Un sevrage progressif, particulièrement difficile, est alors nécessaire.
Application sur les paupières
Une application prolongée sur les paupières est déconseillée en raison du risque de cataracte et de glaucome. En cas d’application sur cette zone, il conviendra de veiller à ce que le dermocorticoïde ne pénètre pas dans l’œil.
Infection concomitante
Un traitement antimicrobien approprié devra être utilisé chaque fois que les lésions inflammatoires traitées s’infectent. Une propagation de l’infection impose l’interruption de la corticothérapie locale et l’administration d’un traitement antimicrobien adapté.
Ulcères chroniques de jambe
Les corticoïdes locaux sont parfois utilisés en traitement des dermatites entourant les ulcères chroniques de jambe. Cet usage peut être associé à une augmentation des réactions d’hypersensibilité locale et du risque d’infection locale.
Risque d’inflammabilité
FLIXOVATE 0,05 % crème contient de la paraffine. Informez vos patients de ne pas fumer ni de s’approcher de flammes nues en raison du risque de brûlures graves. Les tissus (vêtements, literie, pansements, etc.) qui ont été en contact avec ce produit brûlent plus facilement et peuvent constituer un risque d’incendie. Le lavage des vêtements et de la literie peut réduire l’accumulation de produit, mais ne peut pas l’éliminer totalement.
Si une intolérance locale apparaît, le traitement doit être interrompu et la cause doit en être recherchée.
Eviter tout contact avec les yeux et les muqueuses.
Troubles visuels
Des troubles visuels peuvent apparaitre lors d'une corticothérapie par voie systémique ou locale. En cas de vision floue ou d'apparition de tout autre symptôme visuel apparaissant au cours d'une corticothérapie, un examen ophtalmologique est requis à la recherche notamment d'une cataracte, d'un glaucome, ou d'une lésion plus rare telle qu'une choriorétinopathie séreuse centrale, décrits avec l'administration de corticostéroïdes par voie systémique ou locale.
Ce médicament contient un excipient, l’imidurée, dont la dégradation produit du formaldéhyde sous forme de traces. Le formaldéhyde peut provoquer des réactions cutanées locales (par exemple : eczéma).
Ce médicament contient de l’alcool cétostéarylique et peut provoquer des réactions cutanées locales (par exemple dermatite de contact)
Ce médicament contient 100 mg de propylène glycol dans chaque gramme de crème. Le propylène glycol peut causer une irritation cutanée.
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
Des troubles métaboliques comme une diminution de la tolérance au glucose sont observés lors de l'utilisation concomitante de corticoïdes locaux et d'antidiabétiques. Prévenir le patient et renforcer l'autosurveillance glycémique et urinaire, surtout en début de traitement.
4.6. Fertilité, grossesse et allaitement
Grossesse
L’administration de corticoïdes à des animaux gravides peut engendrer des anomalies fœtales (voir rubrique 5.3 Données de sécurité préclinique).
La pertinence de cet effet chez l’Homme n’a pas été établie. Toutefois, l’administration de propionate de fluticasone pendant la grossesse ne doit être envisagée que si le bénéfice escompté pour la mère est supérieur aux risques potentiels pour le fœtus. Il conviendra d’utiliser la quantité minimale pendant une durée minimale.
Allaitement
L’excrétion du propionate de fluticasone dans le lait maternel humain n’a pas été étudiée.
Par voie locale, le passage transdermique et donc le risque d'excrétion du corticoïde dans le lait sera fonction de la surface traitée, du degré d'altération épidermique et de la durée du traitement.
Des concentrations mesurables de propionate de fluticasone chez des rates allaitantes, après administration sous-cutanée de propionate de fluticasone, montrent que le propionate de fluticasone est excrété dans le lait maternel.
Cependant, les concentrations plasmatiques chez les patients après application cutanée de propionate de fluticasone aux doses recommandées sont susceptibles d’être faibles.
L’administration de propionate de fluticasone pendant l’allaitement est possible.
Le contact prolongé du nourrisson avec la zone de peau traitée de la mère devra être évité.
En cas d'application sur les seins, la peau devra être nettoyée avant chaque tétée afin d’éviter toute ingestion accidentelle par le nourrisson.
Fertilité
Il n’existe aucune donnée permettant d’évaluer l’effet du propionate de fluticasone sur la fertilité humaine.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
Aucune étude évaluant l’effet du propionate de fluticasone sur l’aptitude à conduire des véhicules ou à utiliser des machines n’a été réalisée. Un effet néfaste sur ces activités ne peut pas être anticipé d’après le profil des effets indésirables connus du propionate de fluticasone par voie topique.
Les effets indésirables sont listés ci-dessous par classe organique et par fréquence. Les fréquences sont définies en : très fréquent (≥1/10), fréquent (≥1/100 et <1/10), peu fréquents (≥1/1000 et <1/100), rare (≥1/10000 et <1/1000), très rare (<1/10000) incluant les rapports isolés, et fréquence indéterminée (ne pouvant être estimée sur la base des données disponibles).
Les effets indésirables très fréquents, fréquents et peu fréquents ont généralement été déterminés à partir des données d’études cliniques.
Les fréquences des groupes placebo et comparateur n’ont pas été pris en compte lors de l’attribution des fréquences des effets indésirables issus des essais cliniques car elles étaient généralement comparables à celles du groupe de traitement actif.
Après la commercialisation, des effets rares et très rares ont été rapportés.
Infections et infestations
Très rare : infections secondaires.
Des infections secondaires, particulièrement sous pansement occlusif ou dans les plis ont été rapportées lors de l’utilisation de corticoïdes locaux.
Affections du système immunitaire
Très rare : hypersensibilité.
Si des signes d’hypersensibilité apparaissent, le traitement doit être interrompu immédiatement.
Affections endocriniennes
Très rare : possibilité d’effets systémiques (voir rubrique 4.4) par freination de l’axe hypothalamo-hypophyso-surrénalien.
Syndrome cushingoïde (qui se traduit notamment par un faciès lunaire, une obésité centrale) et dont les troubles cutanés sont : atrophie cutanée, amincissement de la peau, sécheresse cutanée, vergetures, télangiectasies.
Affections vasculaires
Très rare : télangiectasies.
L’utilisation prolongée de corticoïdes d’activité forte peut entraîner des télangiectasies (à redouter particulièrement sur le visage).
Affections de la peau et du tissu sous-cutané
Fréquent : prurit.
Peu fréquent : brûlure cutanée locale.
Très rare : l’utilisation prolongée de corticoïdes d’activité forte peut entraîner une atrophie cutanée, des vergetures (à la racine des membres notamment, et survenant plus volontiers chez les adolescents), une hypertrichose, des modifications de la pigmentation, un purpura ecchymotique secondaire à l’atrophie, une fragilité cutanée.
Des éruptions acnéiformes ou pustuleuses, une hypertrichose, des modifications de la pigmentation, des éruptions cutanées, des dermatites allergiques de contact, des exacerbations de syndromes sous-jacents, des érythèmes, des urticaires, un psoriasis pustuleux ont été rapportés.
Des brûlures locales et prurit ont été rapportés, cependant dans des essais cliniques, l’incidence de ces effets indésirables était généralement comparable aux groupes placebo et comparateur.
Au visage, les corticoïdes peuvent créer une dermatite péri-orale ou bien aggraver une rosacée (voir rubriques 4.4 et 4.3).
Il peut être observé un retard de cicatrisation des plaies atones, des escarres, des ulcères de jambe (voir rubrique 4.3).
Des exacerbations des signes et des symptômes de dermatoses et de dermatites de contact allergiques ont été rapportés avec l’utilisation des corticoïdes.
Le traitement du psoriasis avec un corticoïde (ou son arrêt) peut provoquer une forme pustuleuse de la maladie.
Affections oculaires
Fréquence indéterminée : Vision floue (voir rubrique 4.4)
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr/.
Signes et symptômes
L’absorption de propionate de fluticasone appliqué localement peut être suffisante pour engendrer des effets systémiques. Un surdosage aigu est très peu probable, mais, en cas de surdosage chronique ou de mésusage, des symptômes d’hypercortisolisme peuvent apparaître (voir rubrique 4.8).
Traitement
En cas de surdosage, le propionate de fluticasone devra être arrêté progressivement, en réduisant les fréquences d’application ou en lui substituant un dermocorticoïde d'activité moins forte, en raison du risque d’insuffisance corticosurrénalienne.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Classe pharmacothérapeutique : Corticoïde d'activité forte (groupe III), code ATC : D07AC17
Les dermocorticoïdes sont classés en 4 niveaux d'activité selon les tests de vasoconstriction cutanée : activité très forte, forte, modérée, faible.
Le propionate de fluticasone, substance active de FLIXOVATE 0,05 %, crème est d'activité forte.
Actif sur certains processus inflammatoires (par exemple : hypersensibilité de contact) et l'effet prurigineux qui leur est lié. Vasoconstricteur. Inhibe la multiplication cellulaire.
Mécanisme d’action
Les corticoïdes locaux ont des propriétés anti-inflammatoires reposant sur des mécanismes multiples ; ils inhibent la phase tardive des réactions allergiques, diminuent notamment la densité des mastocytes, la chimiotaxie et l’activation des éosinophiles, diminuent la production de cytokines par les lymphocytes, les monocytes, les mastocytes et les éosinophiles, et inhibent le métabolisme de l’acide arachidonique.
Effets pharmacodynamiques
Les corticoïdes locaux ont des propriétés anti-inflammatoires, antiprurigineuses et vasoconstrictrices.
5.2. Propriétés pharmacocinétiques
L'importance du passage transdermique et des effets systémiques dépend de l'importance de la surface traitée, du degré d'altération épidermique, de la durée du traitement. Ces effets sont d'autant plus à redouter que le traitement est prolongé.
Absorption
Les corticoïdes locaux peuvent être absorbés par une peau saine et passer dans la circulation générale. L’importance de l’absorption percutanée des corticoïdes locaux dépend de facteurs divers, comme le véhicule et l’intégrité de la barrière épidermique. Une application sous occlusion, une inflammation et/ou d’autres processus pathologiques cutanés peuvent également augmenter l’absorption percutanée.
Certains facteurs sont susceptibles d’accroître les effets systémiques (voir rubrique 4.4).
Métabolisme
Une fois absorbés à travers la peau, les corticoïdes locaux suivent les mêmes voies pharmacocinétiques que les corticoïdes administrés par voie générale. Ils sont métabolisés principalement par le foie.
Elimination
Les corticoïdes locaux sont excrétés par les reins.
5.3. Données de sécurité préclinique
Des études de reproduction suggèrent que l'administration de corticoïdes aux animaux gravides peut entraîner des anomalies du développement fœtal incluant des fentes palatines ou de la lèvre. Cependant, chez l'homme, il n'existe aucune donnée concluante d'anomalies congénitales, comme la fente palatine ou de la lèvre.
L'administration sous-cutanée de propionate de fluticasone à des souris (150 microgrammes/kg/jour), à des rates (100 microgrammes/kg/jour) ou à des lapines (300 microgrammes/kg/jour) gravides a entraîné des anomalies fœtales, dont des fentes palatines. L'administration orale n'a pas conduit à des anomalies fœtales, ce qui est en cohérence avec la faible biodisponibilité du propionate de fluticasone par voie orale.
Paraffine liquide, myristate d'isopropyle, alcool cétostéarylique, éther monocétylique de polyoxyéthylène glycol 1000, propylène glycol, imidurée, hydrogénophosphate de sodium dodécahydraté, acide citrique monohydraté, eau purifiée.
Sans objet.
2 ans.
6.4. Précautions particulières de conservation
A conserver à une température inférieure à 30°C.
6.5. Nature et contenu de l'emballage extérieur
Tube (aluminium) de 30 g.
6.6. Précautions particulières d’élimination et de manipulation
Pas d’exigences particulières.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
LABORATOIRE GLAXOSMITHKLINE
23 RUE FRANCOIS JACOB
92500 RUEIL-MALMAISON
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· 34009 336 839 6 2 : 30 g en tube (Aluminium).
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
[à compléter ultérieurement par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE
[à compléter ultérieurement par le titulaire]
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Sans objet.
Liste I.
ANSM - Mis à jour le : 06/11/2023
FLIXOVATE 0,05 %, crème
Propionate de fluticasone
Veuillez lire attentivement cette notice avant d’utiliser ce médicament car elle contient des informations importantes pour vous.
· Gardez cette notice. Vous pourriez avoir besoin de la relire.
· Si vous avez d’autres questions, interrogez votre médecin ou votre pharmacien.
· Ce médicament vous a été personnellement prescrit. Ne le donnez pas à d’autres personnes. Il pourrait leur être nocif, même si les signes de leur maladie sont identiques aux vôtres.
· Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
1. Qu'est-ce que FLIXOVATE 0,05 %, crème et dans quels cas est-il utilisé ?
2. Quelles sont les informations à connaître avant d'utiliser FLIXOVATE 0,05 %, crème ?
3. Comment utiliser FLIXOVATE 0,05 %, crème ?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver FLIXOVATE 0,05 %, crème ?
6. Contenu de l’emballage et autres informations.
1. QU’EST-CE QUE FLIXOVATE 0,05 %, crème ET DANS QUELS CAS EST-IL UTILISE ?
Classe pharmacothérapeutique : corticoïde d’activité forte (groupe III) - code ATC : D07AC17
Ce médicament contient du propionate de fluticasone qui est un corticoïde local d'activité forte, il est destiné à une application cutanée.
Ce médicament est préconisé chez l'adulte et l'enfant à partir de l'âge de 1 an, dans certaines maladies de peau comme l'eczéma de contact, la dermatite atopique, le psoriasis. Ce médicament est également utilisé chez le nourrisson, à partir de l'âge de 3 mois, uniquement pour traiter la dermatite atopique.
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT D’UTILISER FLIXOVATE 0,05 %, crème ?
N’utilisez jamais FLIXOVATE 0,05 %, crème dans les cas suivants :
· si vous êtes allergique à la substance active, le propionate de fluticasone ou à l’un des autres composants contenus dans ce médicament, mentionnés dans la rubrique 6,
· lésions ulcérées,
· acné,
· rosacée (affection de la peau, siégeant sur le visage, provoquant des rougeurs sur le nez, les joues, le menton, le front ou la totalité du visage, pouvant engendrer une dilatation des petits vaisseaux sanguins et l'apparition de boutons (papules) parfois remplis de pus (pustules)),
· dermatite péri-orale (éruption et rougeur autour de la bouche),
· démangeaisons autour de l’anus ou des zones génitales (pénis et vagin),
· maladies de la peau chez le nourrisson de moins de trois mois, y compris dermatite et érythème fessier,
· maladies infectieuses de la peau non traitées d'origine virale (herpès, zona, varicelle...), bactérienne (exemple impétigo...), mycosique (dues à des champignons microscopiques) ou parasitaire.
Avertissements et précautions
Adressez-vous à votre médecin ou votre pharmacien avant d’utiliser FLIXOVATE 0,05 %, crème.
· Eviter tout contact avec les yeux et les muqueuses.
· Ne pas appliquer sur les paupières en cas de traitement prolongé en raison du risque de cataracte et de glaucome.
· Ne pas appliquer sur le visage en cas de traitement prolongé en raison du risque d'atrophie cutanée (amincissement de la peau) sauf en cas de prescription formelle de votre médecin.
Il est souhaitable d'éviter les applications sur une grande surface, sous un pansement ou couche imperméable en particulier chez les enfants et nourrissons en raison de la possibilité de passage d'une partie du principe actif dans le sang.
· Un risque de passage dans le sang de ce corticoïde local existe par augmentation de sa pénétration cutanée dans les situations suivantes :
o Traitement prolongé
o Application sur une zone étendue
o Application cutanée sous occlusion : par ex. au niveau des plis ou sous pansement occlusif ou chez les nourrissons où les couches peuvent avoir les mêmes conséquences qu’un pansement occlusif.
o Augmentation de l’hydratation de la peau
o Application sur des surfaces cutanées fines comme le visage
o Application sur des lésions cutanées
o Application chez l’enfant, particulièrement chez le nourrisson et l'enfant en bas âge car plus à risque d'effets indésirables généraux que l'adulte en raison d'une peau immature et d'un rapport surface corporelle / poids plus important que l’adulte. Ces effets disparaissent à l'arrêt du traitement, mais un arrêt progressif est nécessaire.
· En cas d'occlusion chez le nourrisson, il existe un risque d'infection bactérienne favorisée par la chaleur et l’humidité présentes dans les plis cutanés ou sous un pansement occlusif ou sous les couches. En cas d’utilisation d’un pansement occlusif, la peau devra être nettoyée avant chaque changement du pansement.
· Une utilisation dans le traitement du psoriasis nécessite une surveillance médicale attentive des rechutes, le développement d’une accoutumance, un risque de psoriasis pustuleux généralisé et une toxicité locale ou générale due à l’altération de la barrière cutanée.
· Signalez toute irritation ou infection à votre médecin car un traitement antimicrobien approprié devra être utilisé chaque fois que les lésions inflammatoires traitées s’infectent. Si l’infection se propage, il faut arrêter la corticothérapie locale et traiter l'infection.
· Ulcères chroniques de jambe
Les corticoïdes locaux sont parfois utilisés en traitement des lésions inflammatoires de la peau (dermatites) entourant les ulcères chroniques de jambe. Cet usage peut être associé à une augmentation des réactions allergiques locales et du risque d’infection locale.
Lors de l’utilisation de FLIXOVATE 0,05 % crème, ne pas fumer ni s'approcher de flammes nues en raison du risque de brûlures graves. Les tissus (vêtements, literie, pansements, etc.) qui ont été en contact avec ce produit brûlent plus facilement et peuvent constituer un risque d'incendie. Le lavage des vêtements et de la literie peut réduire l'accumulation de produit, mais ne peut pas l'éliminer totalement.
Si une allergie locale apparaît, vous devez arrêter le traitement et consulter votre médecin.
· chez le nourrisson, en l'absence de données cliniques en dessous de l'âge de 3 mois, il est préférable d'éviter l'utilisation des dermocorticoïdes d'activité forte.
En raison du risque d'insuffisance corticosurrénalienne, chez le nourrisson et l’enfant de moins de 12 ans, le traitement doit être soumis à une stricte surveillance médicale, avec un traitement limité à quelques jours seulement et une réévaluation chaque semaine.
En cas d’allergie connue au formaldéhyde : FLIXOVATE 0,05%, crème contient de l’imidurée. Il est possible que votre organisme transforme l’imidurée en petites quantités en une substance chimique appelée formaldéhyde. Cette substance chimique peut provoquer des réactions cutanées locales (par exemple : eczéma).
Contactez votre médecin en cas de vision floue ou d’autres troubles visuels.
Autres médicaments et FLIXOVATE 0,05 %, crème
Informez votre médecin ou pharmacien si vous utilisez, avez récemment utilisé ou pourriez utiliser tout autre médicament.
Lors de l'utilisation concomitante de corticoïdes locaux et d'antidiabétiques, une diminution de la tolérance au glucose a été observée. Vous devez par conséquent renforcer votre autosurveillance glycémique et urinaire, surtout en début de traitement.
FLIXOVATE 0,05 %, crème avec des aliments et boissons
Sans objet.
Grossesse, allaitement et fertilité
Si vous êtes enceinte ou que vous allaitez, si vous pensez être enceinte ou planifiez une grossesse, demandez conseil à votre médecin ou pharmacien avant d'utiliser ce médicament.
Grossesse
Si nécessaire, ce médicament peut être utilisé pendant la grossesse.
Allaitement
L’administration de propionate de fluticasone pendant l’allaitement est possible.
Il faut éviter que le nourrisson soit en contact prolongé avec la zone de peau traitée de la mère.
En cas d'application de FLIXOVATE sur les seins, la peau devra être nettoyée avant chaque tétée afin d’éviter tout risque d’ingestion par le nourrisson.
Ne pas appliquer sur les seins lors de l'allaitement, en raison du risque d'ingestion du produit par le nouveau-né.
Conduite de véhicules et utilisation de machines
Sans objet.
FLIXOVATE 0,05 %, crème contient de l’alcool cétostéarylique, du propylène glycol et de l’imidurée
En raison de la présence d’alcool cétostéarylique et d’imidurée (produisant du formaldéhyde), ce médicament peut provoquer des réactions cutanées locales (par exemple dermatite de contact).
Ce médicament contient 100 mg de propylène glycol dans chaque gramme de crème. Le propylène glycol peut causer une irritation cutanée.
3. COMMENT UTILISER FLIXOVATE 0,05 %, crème ?
Veillez à toujours utiliser ce médicament en suivant exactement les indications de votre médecin ou pharmacien. Vérifiez auprès de votre médecin ou de votre pharmacien en cas de doute.
Posologie
Adulte et enfant à partir de l’âge de 1 an : 1 à 2 applications par jour.
Nourrisson à partir de l’âge de 3 mois uniquement dans la dermatite atopique : 1 application par jour.
Ne pas augmenter le nombre d'applications par jour.
En fonction des résultats obtenus, votre médecin pourra substituer FLIXOVATE 0,05 %, crème par un dermocorticoïde d’activité plus forte ou moins forte sur tout ou partie des lésions.
Mode d’administration
Voie cutanée.
Afin d'utiliser à chaque application la bonne quantité de médicament pour vous-même ou votre enfant, il est conseillé d'utiliser la méthode suivante : l'unité phalangette.
Presser doucement le tube de façon à déposer, sur toute la longueur de la dernière phalange de votre index, un trait continu de produit.
Par définition, cette quantité de produit déposée sur la dernière phalange de votre index (= 1 unité phalangette) permet de traiter une surface de peau correspondant à la surface de vos deux mains.
1 unité phalangette correspond à la surface des deux mains jointes.

Ainsi, pour mesurer la surface à traiter, vous comptez combien de mains (posées à plat avec les doigts joints) sont nécessaires pour couvrir les lésions : si cela correspond par exemple à 4 mains, alors vous devez utiliser 2 unités phalangettes ; ou si cela correspond à 1 main, vous devez utiliser 0,5 unité phalangette (c. à. d. une demi-longueur de la dernière phalange de votre index).
En pratique, voici le nombre d'unités phalangette nécessaires suivant la localisation de la zone à traiter au cas où chaque zone serait à traiter en totalité.
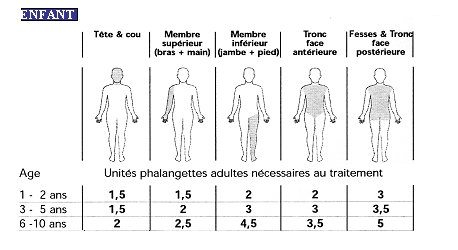
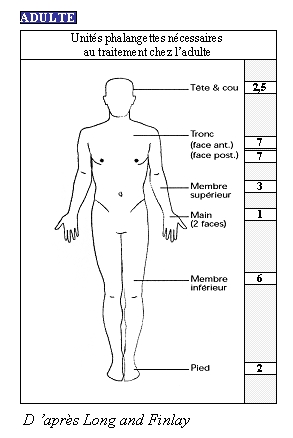
Appliquer en fine couche sur la surface à traiter seulement et faire pénétrer par léger massage, jusqu'à ce que la crème soit entièrement absorbée.
Lavez-vous les mains après chaque utilisation, sauf si vous devez également traiter les mains.
Si vous utilisez simultanément un produit émollient (hydratant), laissez pénétrer FLIXOVATE avant d’appliquer l’émollient.
Durée du traitement
En cas d’aggravation ou d’absence d’amélioration au bout de 2 à 4 semaines, le traitement et le diagnostic doivent être réévalués par votre médecin.
L'arrêt du traitement se fera de façon progressive en espaçant les applications et/ou en utilisant un corticoïde local moins fort ou moins dosé.
Si vous avez utilisé plus de FLIXOVATE 0,05 %, crème que vous n’auriez dû :
Consultez immédiatement votre médecin ou votre pharmacien.
Si vous avez appliqué une grande quantité de FLIXOVATE 0,05 %, crème, des effets généraux tels que des symptômes d’hypercorticisme (prise de poids, gonflement, hypertension...) peuvent apparaître.
Si vous oubliez d’utiliser FLIXOVATE 0,05 %, crème :
Si vous avez oublié d’utiliser FLIXOVATE 0,05 %, crème, appliquez-le dès que possible et poursuivez le traitement normalement.
N’appliquez pas davantage de FLIXOVATE 0,05 %, crème pour compenser les applications oubliées.
Si vous arrêtez d’utiliser FLIXOVATE 0,05 %, crème :
Si vous utilisez FLIXOVATE 0,05 %, crème régulièrement, vous devez demander l’avis de votre médecin avant d’arrêter le traitement.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
Comme tous les médicaments, ce médicament peut provoquer des effets indésirables, mais ils ne surviennent pas systématiquement chez tout le monde.
Les effets indésirables peuvent survenir avec les fréquences suivantes :
Fréquent : pouvant affecter jusqu’à 1 personne sur 10
· Démangeaisons
Peu fréquent : pouvant affecter jusqu’à 1 personne sur 100
· Brûlure cutanée locale
Très rare : pouvant affecter jusqu’à 1 personne sur 10 000
· Infections cutanées, particulièrement sous pansement occlusif ou dans les plis,
· Allergie locale,
· Fonction surrénalienne diminuée à l'arrêt brutal du traitement,
· Syndrome cushingoïde dont les symptômes incluent notamment un visage "lunaire", gonflé, une obésité, ainsi que les signes cutanés suivants : amincissement et fragilité de la peau, vergetures, dilatation de petits vaisseaux sanguins,
· Réactions cutanées allergiques au site d'application,
· Réaction cutanée inflammatoire +/- allergique, rougeur, éruption cutanée, urticaire, psoriasis pustuleux (inflammation chronique de la peau accompagnée de pustules),
· Modifications de la coloration de la peau,
· Développement de pilosité en dehors du point d'application,
· Irritation au site d’application.
Fréquence indéterminée : ne peut être estimé sur la base des données disponibles
· Vision floue
Surtout en cas d’utilisation prolongée, il y a un risque d’amincissement et de fragilité de la peau accompagnée d'une dilatation de petits vaisseaux sanguins avec des « bleus » (purpura ecchymotique).
En cas d'application sur le visage, il y a également un risque de rougeurs et d’irritations autour de la bouche.
Un retard de cicatrisation des plaies, des escarres, des ulcères de jambes est également possible.
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou à votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet: https://signalement.social-sante.gouv.fr/.
En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.
5. COMMENT CONSERVER FLIXOVATE 0,05 %, crème ?
Tenir ce médicament hors de la vue et de la portée des enfants.
N’utilisez pas ce médicament après la date de péremption indiquée sur la boîte et le tube après {EXP}. La date de péremption fait référence au dernier jour de ce mois.
A conserver à une température inférieure à 30°C.
Ne jetez aucun médicament au tout-à-l’égout ou avec les ordures ménagères. Demandez à votre pharmacien d’éliminer les médicaments que vous n’utilisez plus. Ces mesures contribueront à protéger l’environnement.
6. CONTENU DE L’EMBALLAGE ET AUTRES INFORMATIONS
Ce que contient FLIXOVATE 0,05 %, crème
· La substance active est :
Propionate de fluticasone....................................................................................................... 0,05 g
Pour 100g.
· Les autres composants sont :
Paraffine liquide, myristate d'isopropyle, alcool cétostéarylique*, éther monocétylique de polyoxyéthylène glycol 1000, propylène glycol*, imidurée, hydrogénophosphate de sodium dodécahydraté, acide citrique monohydraté, eau purifiée.
* Voir rubrique 2
Qu’est-ce que FLIXOVATE 0,05 %, crème et contenu de l’emballage extérieur
Ce médicament se présente sous forme de crème. Tube de 30 g.
Titulaire de l’autorisation de mise sur le marché
LABORATOIRE GLAXOSMITHKLINE
23 RUE FRANCOIS JACOB
92500 RUEIL-MALMAISON
Exploitant de l’autorisation de mise sur le marché
LABORATOIRE GLAXOSMITHKLINE
23 RUE FRANCOIS JACOB
92500 RUEIL-MALMAISON
Delpharm Poznań Spółka Akcyjna
ul. Grunwaldzka 189
60-322 Poznan
Pologne
Ou
Glaxosmithkline Trading Services Limited
12 Riverwalk,
Citywest Business Campus
Dublin 24
Irlande
Noms du médicament dans les Etats membres de l'Espace Economique Européen
Sans objet.
La dernière date à laquelle cette notice a été révisée est :
[à compléter ultérieurement par le titulaire]
Des informations détaillées sur ce médicament sont disponibles sur le site Internet de l’ANSM (France).