Dernière mise à jour le 06/11/2025
ENGERIX B 10 microgrammes/0,5 mL, suspension injectable en seringue préremplie. Vaccin de l'hépatite B (ADNr), (adsorbé) (VHB)
Indications thérapeutiques
Classe pharmacothérapeutique - code ATC :
Sans objet.
Ce vaccin peut être administré aux nouveau-nés, aux enfants et aux adolescents jusqu’à l’âge de 15 ans inclus.
L'hépatite B est une maladie infectieuse du foie causée par un virus. Certaines personnes portent le virus de l'hépatite B dans leur organisme, mais ne peuvent pas s’en débarrasser. Elles peuvent toujours infecter d’autres personnes et sont considérées comme porteuses du virus. La maladie est propagée par le virus qui pénètre dans l'organisme après un contact avec des fluides corporels, le plus souvent par le sang d'une personne infectée.
Si la mère est porteuse du virus ; elle peut le transmettre à son bébé à la naissance. Il est également possible d'attraper le virus d’un porteur, par exemple, par le biais de rapports sexuels non protégés, de partage d’aiguilles d'injection ou lors d’un traitement par un équipement médical n’ayant pas été correctement stérilisé.
Les principaux signes de la maladie incluent maux de tête, fièvre, nausées et jaunisse (jaunissement de la peau et des yeux) mais, chez environ 3 patients sur 10 il n'y a aucun signe de maladie.
Chez les personnes infectées par l'hépatite B, 1 adulte sur 10 et jusqu’à 9 bébés sur 10 deviendront porteurs du virus et seront susceptibles de continuer à développer des lésions hépatiques graves et, dans certains cas un cancer du foie.
Comment ENGERIX B 10 microgrammes/0,5 mL fonctionne :
ENGERIX B 10 microgrammes/0,5 mL contient une petite quantité de « l’enveloppe externe » du virus de l'hépatite B. Cette « enveloppe externe » n'est pas contagieuse et ne peut pas vous rendre malade.
· Lorsque l’on vous administrera le vaccin, il va déclencher le système immunitaire de votre corps pour le préparer à se protéger contre ces virus dans le futur.
· ENGERIX B 10 microgrammes/0,5 mL ne vous protègera pas si vous êtes déjà infecté par le virus de l'hépatite B.
· ENGERIX B 10 microgrammes/0,5 mL peut seulement vous aider à vous protéger contre l'infection par le virus de l'hépatite B.
Présentations
> 1 seringue(s) préremplie(s) en verre de 0,5 ml avec aiguille(s)
Code CIP : 351 670-9 ou 34009 351 670 9 5
Déclaration de commercialisation : 15/02/2001
Cette présentation est agréée aux collectivités
- Prix hors honoraire de dispensation : 9,18 €
- Honoraire de dispensation : 1,02 €
- Prix honoraire compris : 10,20 €
- Taux de remboursement :65%
Documents de bon usage du médicament
- Actualisation des recommandations et obligations pour les étudiants et professionnels des secteurs sanitaire, médicosocial et en contacts étroits avec de jeunes enfants (Volet 1/2 : diphtérie, tétanos, poliomyélite, hépatite B, Covid-19)
Auteur : Haute autorité de santé
Type : Recommandation vaccinale
Date de mise à jour :Septembre 2023
Service médical rendu (SMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprès de la HAS (plus d'informations dans l'aide). Les avis et synthèses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur du SMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| Important | Avis du 03/02/2016 | Renouvellement d'inscription (CT) | Le service médical rendu par ces vaccins reste important dans l’indication et la population recommandée. |
Amélioration du service médical rendu (ASMR)
Pas d'ASMR disponible pour ce médicament (plus d'informations dans l'aide )
ANSM - Mis à jour le : 13/06/2024
ENGERIX B 10 microgrammes/0,5 mL, suspension injectable en seringue préremplie
Vaccin de l’hépatite B (ADNr), (adsorbé) (VHB)
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
1 dose (0,5 mL) contient :
Antigène de surface de l’hépatite B 1,2.................................................................... 10 microgrammes
1 adsorbé sur de l’hydroxyde d’aluminium, hydraté Total : 0,25 milligramme Al3+
2 produit dans des cellules de levures (Saccharomyces cerevisiae) par la technique de l’ADN recombinant
Pour la liste complète des excipients, voir rubrique 6.1.
Suspension injectable en seringue préremplie.
La suspension est blanche trouble.
4.1. Indications thérapeutiques
La survenue d’une hépatite D devrait être prévenue du fait de l’immunisation par ENGERIX B, l’hépatite D (provoquée par le virus delta) n’apparaissant pas en l’absence d’infection par le virus de l’hépatite B.
4.2. Posologie et mode d'administration
Dosage
ENGERIX B 10 microgrammes/0,5 mL est destiné aux sujets jusqu’à l’âge de 15 ans inclus, dont les nouveau-nés.
ENGERIX B 20 microgrammes/1 mL est destiné aux sujets âgés de 16 ans et plus.
Cependant, chez les sujets âgés de 11 à 15 ans inclus, ENGERIX B 20 microgrammes/1 mL peut être aussi utilisé, avec un schéma 2 doses, dans les cas où il n’existe qu’un faible risque d’infection par le virus de l’hépatite B durant la période de vaccination et si l’observance au schéma complet de vaccination peut être assurée (voir rubrique 5.1. et résumé des caractéristiques du produit (RCP) d’ENGERIX B 20 microgrammes/1 mL).
Schéma de primovaccination
· Sujets jusqu’à 15 ans inclus :
Deux schémas de primovaccination peuvent être proposés :
Un schéma, avec injection à 0, 1, et 6 mois qui confère une protection optimale au 7ème mois et produit une concentration en anticorps élevée.
Un schéma accéléré, avec injection à 0, 1 et 2 mois, qui confère une protection plus rapide, et doit permettre une meilleure compliance du sujet. Avec ce schéma, une quatrième dose doit être administrée au 12ème mois pour assurer une protection à long terme puisque la concentration en anticorps après la 3ème dose est plus faible que celle obtenue avec le schéma 0, 1 et 6 mois. Chez l’enfant, ce schéma permet l’administration simultanée du vaccin contre l’hépatite B et d’autres vaccins de l’enfance.
· Patients insuffisants rénaux incluant les patients hémodialysés :
Les patients souffrant d’insuffisance rénale incluant les patients hémodialysés ont une réponse immunitaire réduite envers les vaccins contre l’hépatite B. ENGERIX B 10 microgrammes/0,5 mL peut être administré selon l’un des schémas 0, 1, 2, 12 mois ou 0, 1, 6 mois. Sur la base de l’expérience chez l’adulte, une vaccination avec une dose d’antigènes plus élevée peut augmenter la réponse immunitaire. Des tests sérologiques doivent être envisagés après une vaccination. Des doses de vaccin supplémentaires peuvent être nécessaires pour assurer un niveau protecteur d’anticorps antiHBs supérieur ou égal à 10 mUI/mL.
· Exposition avérée ou supposée au virus de l’hépatite B :
Dans des circonstances où l’exposition au virus de l’hépatite B est récente (par exemple : piqûre avec une aiguille contaminée), la première dose d’ENGERIX B peut être administrée simultanément avec des immunoglobulines anti-hépatite B qui doivent cependant être administrées en un site d’injection séparé (voir rubrique 4.5). Le schéma de primovaccination 0, 1, 2 et 12 mois doit être préféré.
· Nouveau-nés de mère antigène HBs positif :
L’immunisation par ENGERIX B 10 microgrammes/0,5 mL de ces nouveau-nés doit commencer à la naissance et deux schémas d'immunisation peuvent être suivis. Les schémas 0, 1, 2, 12 mois ou 0, 1, 6 mois peuvent être utilisés ; cependant le premier schéma confère une réponse immunitaire plus rapide. Si disponible, et pour améliorer l’efficacité protectrice, des immunoglobulines anti hépatite B doivent être administrées simultanément avec ENGERIX B dans des sites d’injection différents.
Ces schémas d'immunisation peuvent être adaptés pour tenir compte des recommandations de politique nationale en fonction de l’âge recommandé pour l’administration des autres vaccins de l’enfance.
Dose de Rappel
Les données actuelles ne justifient pas la nécessité d’une dose de rappel chez les sujets sains ayant reçu un schéma complet de primovaccination. Cependant chez des sujets immunodéprimés comme les patients insuffisants rénaux, les patients hémodialysés, les patients VIH positifs, des rappels devront être administrés pour maintenir une concentration en anticorps anti-HBs supérieure ou égale au niveau protecteur admis de 10 mUI/mL. Pour ces sujets immunodéprimés, il est recommandé de contrôler le statut post-vaccinal tous les 6-12 mois.
Les recommandations nationales sur la vaccination de rappel doivent être prises en considération.
Interchangeabilité des vaccins contre l’hépatite B
Voir rubrique 4.5.
Mode d’administration
Ce vaccin doit être injecté par voie intramusculaire dans la région deltoïdienne chez les enfants, ou dans la région antéro-latérale de la cuisse chez les nouveau-nés, les nourrissons et les jeunes enfants.
Exceptionnellement, le vaccin peut être administré par voie sous-cutanée chez des patients ayant une thrombocytopénie ou chez des patients sujets à des hémorragies.
Comme pour les autres vaccins, l’administration d’ENGERIX B doit être différée chez les sujets souffrant de maladies fébriles sévères aiguës. La présence d’une infection mineure n’est cependant pas une contre-indication à la vaccination.
4.4. Mises en garde spéciales et précautions d'emploi
Afin d'améliorer la traçabilité des médicaments biologiques, le nom et le numéro de lot du produit administré doivent être clairement enregistrés.
Précautions d'emploi
Une syncope (évanouissement) peut survenir après toute vaccination, voire même avant, en particulier chez les adolescents, comme réaction psychogène à l’injection avec une aiguille. Ceci peut s’accompagner de plusieurs signes neurologiques comme un trouble transitoire de la vision, des paresthésies et des mouvements tonico-cloniques des membres durant la phase de récupération. Il est important que des mesures soient mises en place afin d’éviter des blessures en cas d’évanouissement.
ENGERIX B ne doit pas être administré dans le muscle fessier ou par voie intradermique, ces modes d'administration pouvant entraîner une réponse immunitaire plus faible.
ENGERIX B ne doit jamais être administré par voie intravasculaire.
Comme pour tous les vaccins injectables, il est recommandé de toujours disposer d’un traitement médical approprié pour le cas rare d’une réaction anaphylactique suivant l’administration du vaccin.
Protection
Etant donné la longue période d'incubation de l'hépatite B, il est éventuellement possible que l'infection, non reconnue, soit présente au moment de la vaccination. Dans de tels cas, il se peut que la vaccination soit sans effet sur le développement de l'hépatite B.
Le vaccin ne protège pas contre l'infection provoquée par d'autres pathogènes connus du foie tels que les virus de l’hépatite A, C et E.
Comme pour tous les vaccins, une réponse immunitaire protectrice peut ne pas être obtenue chez tous les sujets vaccinés.
Il a été observé que certains facteurs réduisent la réponse immunitaire aux vaccins contre l’hépatite B. Ces facteurs incluent l’âge avancé, le sexe masculin, l’obésité, le tabagisme, la voie d’administration et certaines maladies chroniques sous-jacentes. Un test sérologique devra être envisagé chez ces sujets à risque de ne pas être séroprotégés après un schéma complet de vaccination par ENGERIX B. Des doses supplémentaires peuvent être envisagées chez les sujets ne répondant pas ou répondant moins bien après un schéma de primovaccination.
Population particulière
Les patients présentant une hépatopathie chronique ou une infection à VIH ou les porteurs du virus de l’hépatite C ne doivent pas être écartés d'une vaccination contre l'hépatite B. Le vaccin peut être recommandé dans la mesure où l’infection par le virus de l’hépatite B peut être sévère chez ces patients : la vaccination contre l'hépatite B doit donc être considérée au cas par cas par le médecin.
Chez les patients infectés par le VIH et aussi chez les patients insuffisants rénaux incluant les patients hémodialysés et les patients ayant un déficit immunitaire, une concentration suffisante en anticorps anti-HBs peut ne pas être obtenue après le schéma de primovaccination ; chez ces patients des administrations répétées du vaccin sont donc recommandées.
Nourrissons prématurés
Le risque potentiel d'apnée avec nécessité d’une surveillance respiratoire pendant 48-72 h doit être soigneusement pris en compte lors de l'administration des doses de primovaccination chez les grands prématurés (nés à 28 semaines de grossesse ou moins) et particulièrement chez ceux ayant des antécédents d'immaturité respiratoire. En raison du bénéfice élevé de la vaccination chez ces nourrissons, l'administration ne doit pas être suspendue ou reportée.
Teneur en sodium
Ce vaccin contient moins de 1 mmol (23mg) de sodium par dose, c’est-à-dire qu’il est essentiellement « sans sodium ».
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
ENGERIX B peut être utilisé en même temps que le vaccin BCG, les vaccins contre Haemophilus influenzae type b, l’hépatite A, la poliomyélite, la rougeole, les oreillons, la rubéole, la diphtérie, le tétanos, la coqueluche.
ENGERIX B peut être utilisé en même temps que le vaccin contre le Papillomavirus Humain (HPV).
L’administration concomitante d’ENGERIX B et de Cervarix (vaccin contre le HPV) n’a montré aucune interférence cliniquement significative sur la réponse en anticorps vis-à-vis des antigènes HPV. La moyenne géométrique des concentrations en anticorps anti-HBs a été plus faible lors de l’administration simultanée, mais la signification clinique de cette observation n’est pas connue étant donné que les taux de séroprotection sont restés inchangés. Le pourcentage de sujets ayant atteint une concentration en anticorps anti-HBs ≥ 10mUI/mL a été de 97,9% lors de la vaccination concomitante et de 100% lors de la vaccination par ENGERIX B seul.
Ces différents vaccins injectables doivent toujours être administrés dans des sites d’injection différents.
ENGERIX B peut être utilisé pour compléter un schéma de primovaccination commencé avec un vaccin contre l’hépatite B dérivé du sang ou produit par génie génétique, ou si une dose de rappel doit être administrée, il peut être administré à des sujets ayant été primovaccinés avec un vaccin contre l’hépatite B dérivé du plasma, ou produit par génie génétique.
On peut s'attendre à ce que chez les patients recevant un traitement immunosuppresseur ou les patients présentant une immunodéficience, une réponse immunitaire adéquate ne soit pas obtenue (voir rubrique 4.4).
4.6. Fertilité, grossesse et allaitement
Grossesse
L'effet de l'AgHBs sur le développement fœtal n'a pas été évalué.
Cependant, comme pour tous les vaccins viraux inactivés, des effets néfastes chez le fœtus ne sont pas attendus. ENGERIX B ne doit être utilisé chez la femme enceinte que s’il est jugé clairement nécessaire, les avantages escomptés devant l’emporter par rapport aux risques éventuels pour le fœtus.
L'effet sur les nourrissons allaités de l’administration d’ENGERIX B à leur mère n'a pas été étudié dans des études cliniques puisque l’information concernant l’excrétion dans le lait maternel n’est pas disponible.
Aucune contre-indication n’a été déterminée.
Fertilité
ENGERIX B 10 microgrammes/0,5 mL n’a pas été évalué dans des études de fertilité.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
Résumé du profil de sécurité
Le profil de sécurité présenté ci-dessous est basé sur des données provenant de 5 329 sujets suivis au cours de 23 études cliniques.
La formulation actuelle d’ENGERIX B 10 microgrammes/0,5 mL ne contient pas de thiomersal (un composé organomercuriel).
Les effets indésirables ci-après ont été rapportés après l’utilisation de la formulation du vaccin avec ou sans thiomersal.
Dans une étude clinique conduite avec la formulation actuelle (formulation sans thiomersal), l’incidence de douleur, rougeur, gonflement, somnolence, irritabilité, perte d’appétit et fièvre était comparable à celle observée au cours des essais cliniques réalisés avec les précédentes formulations de vaccin contenant du thiomersal.
Liste des effets indésirables
Les fréquences par dose sont définies comme suit :
Très fréquent : (>1/10)
Fréquent : (>1/100 et <1/10)
Peu fréquent : (>1/1 000 et <1/100)
Rare : (>1/10 000 et < 1/1 000)
Très rare : (<1/10 000)
|
Système classe organe |
Fréquence |
Effets indésirables |
||
|
Essais cliniques |
|
|||
|
Affections hématologiques et du système lymphatique |
Rare |
Lymphadénopathie |
||
|
Troubles du métabolisme et de la nutrition |
Fréquent |
Perte d’appétit |
||
|
Affections psychiatriques |
Très fréquent |
Irritabilité |
||
|
Affections du système nerveux |
Très fréquent |
Céphalées |
||
|
Fréquent |
Somnolence |
|||
|
Peu fréquent |
Sensations vertigineuses |
|||
|
Rare |
Paresthésies |
|||
|
Affections gastrointestinales |
Fréquent |
Symptômes gastro-intestinaux (tels que : nausées, vomissements, diarrhées, douleurs abdominales) |
||
|
Affections de la peau et du tissu sous-cutané |
Rare |
Urticaire, prurit, rash |
||
|
Affections musculo-squelettiques et systémiques |
Peu fréquent |
Myalgie |
||
|
Rare |
Arthralgie |
|||
|
Troubles généraux et anomalies au site d’administration |
Très fréquent |
Douleur et rougeur au site d’injection, fatigue |
||
|
Fréquent |
Fièvre (³37,5°C), malaise, gonflement au site d’injection, réaction au site d’injection (comme une induration) |
|||
|
Peu fréquent |
Syndrome pseudo-grippal |
|||
|
Surveillance post-commercialisation |
|
|||
|
Infections et infestations |
Fréquence indéterminée (ne peut être estimée sur la base des données disponibles) |
Méningite |
||
|
Affections hématologiques et du système lymphatique |
Fréquence indéterminée (ne peut être estimée sur la base des données disponibles) |
Thrombocytopénie |
||
|
Affections du système immunitaire |
Fréquence indéterminée (ne peut être estimée sur la base des données disponibles) |
Anaphylaxie, réactions allergiques incluant des réactions anaphylactoïdes et pseudo maladie sérique |
||
|
Affections du système nerveux |
Fréquence indéterminée (ne peut être estimée sur la base des données disponibles) |
Encéphalite, encéphalopathie, convulsions, paralysie, névrite (y compris syndrome de Guillain-Barré, névrite optique et sclérose en plaques), neuropathie, hypoesthésie |
||
|
Affections vasculaires |
Fréquence indéterminée (ne peut être estimée sur la base des données disponibles) |
Vascularite, hypotension |
||
|
Affections respiratoires, thoraciques et médiastinales |
Fréquence indéterminée (ne peut être estimée sur la base des données disponibles) |
Apnée chez les grands prématurés (nés à 28 semaines de grossesse ou moins) (voir rubrique 4.4) |
||
|
Affections de la peau et du tissu sous-cutané |
Fréquence indéterminée (ne peut être estimée sur la base des données disponibles) |
Erythème polymorphe, œdème de Quincke, lichen plan |
||
|
Affections musculo-squelettiques et systémiques |
Fréquence indéterminée (ne peut être estimée sur la base des données disponibles) |
Arthrite, faiblesse musculaire |
||
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr/.
Des cas de surdosage ont été rapportés pendant la surveillance post-commercialisation. Les événements indésirables rapportés après surdosage ont été similaires à ceux rapportés après administration d’une dose habituelle de vaccin.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Classe pharmacothérapeutique : vaccin contre l’hépatite B, code ATC : J07BC01.
Mécanisme d’action
ENGERIX B 10 microgrammes/0,5 mL induit la production d'anticorps d’origine humorale spécifiques contre l'AgHBs (anticorps anti-HBs). Une concentration en anticorps anti-HBs supérieure ou égale à 10 mUI/mL est considérée comme protectrice vis-à-vis de l’infection par le virus de l’hépatite B.
Effets pharmacodynamiques
Sujets présentant un risque accru d'exposition au virus de l’hépatite B :
Des études d'efficacité ont montré que le taux de protection est compris entre 95 % et 100 % chez les nouveau-nés, les enfants et les adultes à risque.
Une efficacité protectrice de 95 % (IgG sérique anti-HBs ≥10m UI/mL) a été montrée, chez des nouveau-nés sains de mères AgHBe positif en zone à risque élevé, un mois après la dernière dose de vaccin administrée selon les schémas 0, 1, 2, 12 mois ou 0, 1, 6 mois, sans administration concomitante d’immunoglobulines anti-hépatite B (IgHB) à la naissance. Toutefois, l'administration simultanée d'immunoglobulines anti-hépatite B et du vaccin à la naissance augmente l'efficacité protectrice à 98 %.
Des nouveau-nés de mères porteuses du virus de l’hépatite B (AgHBs positifs avec ou sans AgHBe) et n’ayant pas reçu d’IgHB à la naissance, ont reçu une dose de rappel du vaccin ENGERIX B 10 microgrammes/0,5 mL, vingt ans après la primo-vaccination (schéma en 3 ou 4 doses).
Le taux de séroprotection avant et après la dose de rappel a été évalué :
|
Taux de séroprotection |
N |
n |
% |
IC 95 % |
|
|
LI |
LS |
||||
|
Avant rappel |
72 |
39 |
54,2 |
42,0 |
66,0 |
|
Après rappel |
75 |
74 |
98,7 |
92,8 |
100 |
N = nombre de sujets avec des résultats disponibles
n = nombre de sujets avec une concentration égale ou supérieure à 10 mUI/mL
% = pourcentage de sujets avec une concentration égale ou supérieure à 10 mUI/mL
IC 95 % = Intervalle de Confiance à 95 % ; LI = Limite Inférieure, LS = Limite Supérieure
Avant rappel = au moment de l’administration de la dose de rappel
Après rappel = un mois après la dose de rappel
La réponse anamnestique selon le statut sérologique avant la dose de rappel a été aussi évaluée :
|
|
Réponse anamnestique |
||||
|
|
IC 95 % |
||||
|
Statut avant la dose de rappel |
N |
n |
% |
LI |
LS |
|
Sujets < 10 mUI/mL |
33 |
31 |
93,9 |
79,8 |
99,3 |
|
Sujets ≥ 10 mUI/mL |
39 |
39 |
100 |
91,0 |
100 |
|
Total |
72 |
70 |
97,2 |
90,3 |
99,7 |
Stratification basée sur le dernier temps disponible avant la dose de rappel :
- sujets < 10 mUI/mL = sujets avec une concentration d’anticorps inférieure à 10 mUI/mL avant la dose de rappel
- sujets ≥ 10 mUI/mL = sujets avec une concentration d’anticorps supérieure ou égale à 10 mUI/mL avant la dose de rappel
La réponse anamnestique est définie comme :
- des concentrations d’anticorps anti-HBs ≥ 10 mUI/mL chez les sujets séronégatifs avant la dose de rappel, ou
- une augmentation des concentrations en anticorps anti-HBs d’au moins 4 fois chez les sujets séropositifs avant la dose de rappel.
N = nombre de sujets avec des résultats disponibles avant et après vaccination
n = nombre de répondeurs à la vaccination
% = pourcentage de répondeurs
IC 95 % = Intervalle de Confiance à 95% ; LI = Limite Inférieure, LS = Limite Supérieure
Population pédiatrique générale :
· Taux de séroprotection chez les sujets jusqu'à l'âge de 15 ans inclus :
Le tableau ci-dessous résume les taux de séroprotection (c’est-à-dire le pourcentage de sujets ayant une concentration en anticorps anti-HBs ≥ 10 mUI/mL) obtenus lors des essais cliniques avec les différents schémas de vaccination mentionnés dans la rubrique Posologie :
|
Population
|
Schéma de vaccination |
Taux de séroprotection |
|
Sujets sains jusqu’à 15 ans inclus |
mois : 0, 1, 6 |
7ème mois : ³ 96 %
|
|
|
mois: 0, 1, 2 – 12 |
1er mois : 15 % |
Les données du tableau ci-dessus sont issues d’études réalisées avec des vaccins contenant du thiomersal. Dans deux études cliniques additionnelles la formulation actuelle d’ENGERIX B, qui ne contient pas de thiomersal, induit des taux de séroprotection similaires à ceux obtenus avec les précédentes formulations d’ENGERIX B, contenant du thiomersal, chez des enfants et des adultes sains.
· Persistance de la réponse immunitaire chez les sujets âgés de 11 à 15 ans inclus :
La réponse immunitaire à long terme a été évaluée lors d’une étude clinique réalisée chez des sujets de 11 à 15 ans inclus au moment de la primo-vaccination. Les taux de séroprotection (c’est-à-dire le pourcentage de sujets ayant une concentration en anticorps anti-HBs ≥ 10 mUI/mL) obtenus dans une étude comparative avec les deux dosages et les 2 schémas de vaccination ont été évalués jusqu’à 66 mois après la première dose de la primo-vaccination et sont présentés dans le tableau ci-dessous (cohorte ATP pour l’efficacité) :
|
Schéma de vaccination |
Mois après la première dose de vaccination |
||||||
|
2 |
6 |
7 |
30 |
42 |
54 |
66 |
|
|
Taux de séroprotection |
|||||||
|
ENGERIX B 10 microgrammes/0,5 mL (Mois : 0, 1, 6) |
55,8 % |
87,6 % |
98,2 %* |
96,9 % |
92,5 % |
94,7 % |
91,4 % |
|
ENGERIX B 20 microgrammes/ 1 mL (Mois : 0, 6) |
11,3 % |
26,4 % |
96,7 %* |
87,1% |
83,7 % |
84,4 % |
79,5 % |
*Au 7ème mois, 97,3% et 88,8% des sujets âgés de 11 à 15 ans vaccinés par ENGERIX B 10 microgrammes/0,5 mL (schéma : 0, 1, 6 mois) ou ENGERIX B 20 microgrammes/1 mL (schéma : 0, 6 mois) respectivement présentaient une concentration en anticorps anti-HBs supérieure ou égale à 100mUI/mL. Les Moyennes Géométriques des Concentrations en anticorps (MGC) étaient respectivement de 7 238 mUI/mL et 2 739 mUI/mL.
Dans les deux groupes de vaccination, tous les sujets (N=74) ont reçu une dose de rappel 72 à 78 mois après la primo-vaccination. Un mois après, tous les sujets ont présenté une réponse anamnestique avec des MGC augmentées de 108 et 95 fois, entre avant et après la dose de rappel, pour les schémas de primo-vaccination à 2 et 3 doses respectivement. Tous les sujets étaient séroprotégés. Ces données suggèrent qu’une mémoire immunitaire a été induite chez tous les sujets ayant répondu à la primo-vaccination même ceux qui ensuite n’étaient plus séroprotégés au 66ème mois.
· Persistance de la réponse immunitaire et dose de rappel chez des sujets âgés de 15 à 16 ans, 14 ans après la primo-vaccination :
Les taux de séroprotection avant et après la dose de rappel ont été évalués chez des sujets âgés de 15 à 16 ans, vaccinés avant l’âge de deux ans avec 3 doses d’ENGERIX B :
|
Taux de séroprotection |
N |
n |
% |
IC 95% |
|
|
LI |
LS |
||||
|
Avant rappel |
292 |
191 |
65,4 |
59,6 |
70,9 |
|
Après rappel |
292 |
286 |
97,9 |
95,6 |
99,2 |
N = nombre de sujets avec des résultats disponibles
n = nombre de sujets avec une concentration égale ou supérieure à 10 mUI/mL
% = pourcentage de sujets avec une concentration égale ou supérieure à 10 mUI/mL
IC 95% = Intervalle de Confiance à 95 % ; LI = Limite Inférieure ; LS = Limite Supérieure
Avant rappel = avant l’administration du premier rappel
Après rappel = un mois après l’administration de la dose de rappel
La réponse anamnestique a été évaluée selon le statut sérologique avant la dose de rappel chez des sujets âgés de 15 à 16 ans vaccinés avant l’âge de deux ans avec 3 doses d’ENGERIX B :
|
|
Réponse anamnestique |
||||
|
|
IC 95% |
||||
|
Statut avant la dose de rappel |
N |
n |
% |
LI |
LS |
|
Sujets < 10 mUI/mL |
101 |
95 |
94,1 |
87,5 |
97,8 |
|
Sujets ≥ 10 mUI/mL |
190 |
187 |
98,4 |
95,5 |
99,7 |
|
Total |
291 |
282 |
96,9 |
94,2 |
98,6 |
Stratification basée sur le dernier temps disponible avant la dose de rappel :
- sujets < 10 mUI/mL = sujets avec une concentration d’anticorps < 10 mUI/mL avant la dose de rappel
- sujets ≥ 10 mUI/mL = sujets avec une concentration d’anticorps ≥ 10 mUI/mL avant la dose de rappel
La réponse anamnestique est définie comme :
- des concentrations d’anticorps anti-HBs ≥ 10 mUI/mL chez les sujets séronégatifs avant la dose de rappel ou
- une augmentation des concentrations d’anticorps anti-HBs d’au moins 4 fois chez des sujets séropositifs avant la dose de rappel.
N = nombre de sujets avec des résultats disponibles avant et après la vaccincation
n = nombre de répondeurs
% = pourcentage de répondeurs
IC 95% = intervalle de confiance à 95% ; LI = Limite Inférieure ; LS = Limite Supérieure
Le critère d'évaluation principal de l'étude, défini comme le pourcentage de sujets présentant des concentrations d'anticorps anti-HBs ≥ 100 mIU/mL un mois après la dose de rappel, a été calculé à 90,8 % (IC 95 % : 86,8 ; 93,8). Le taux d'anticorps anti-HBs a été multiplié par 156 (de 26,5 à 4134,9 mUI/mL) en réponse à la dose de rappel.
Des données similaires concernant les taux de séroprotection et la réponse anamnestique ont été obtenues chez des sujets (N=279) âgés de 12 à 13 ans.
· Réduction de l'incidence des carcinomes hépatocellulaires chez les enfants :
Un lien clair a été démontré entre l'infection par le virus de l'hépatite B et la survenue de carcinome hépatocellulaire. La prévention de l'hépatite B par vaccination entraîne une réduction de l'incidence de carcinome hépatocellulaire, comme cela a été observé à Taiwan, chez des enfants âgés de 6 à 14 ans.
5.2. Propriétés pharmacocinétiques
5.3. Données de sécurité préclinique
Les données de sécurité précliniques satisfont aux exigences de l’OMS.
Phosphate disodique dihydraté,
Phosphate monosodique,
Eau pour préparations injectables.
Pour les adsorbants, voir rubrique 2.
3 ans.
6.4. Précautions particulières de conservation
A conserver au réfrigérateur (entre 2°C et 8°C).
Ne pas congeler.
A conserver dans l'emballage d’origine à l’abri de la lumière.
Les données de stabilité indiquent qu'ENGERIX B10 microgrammes/0,5 mL est stable à des températures allant jusqu'à 37°C pendant 3 jours ou jusqu'à 25°C pendant 7 jours. Ces données sont uniquement destinées à guider les professionnels de la santé en cas d'excursion temporaire de la température.
6.5. Nature et contenu de l'emballage extérieur
0,5 mL de suspension en seringue préremplie (verre de type I) munie d'un bouchon-piston (caoutchouc butyle) et d’un embout protecteur en caoutchouc.
Boîtes de 1 et 10, avec ou sans aiguille(s).
L’embout protecteur et le bouchon-piston en caoutchouc de la seringue préremplie sont fabriqués avec du caoutchouc synthétique.
Toutes les présentations peuvent ne pas être commercialisées.
6.6. Précautions particulières d’élimination et de manipulation
Lors de sa conservation, le contenu peut présenter un fin dépôt blanc avec un surnageant limpide et incolore. Après agitation, le vaccin est légèrement opaque.
Le vaccin doit être inspecté visuellement pour mettre en évidence la présence de particules étrangères et/ou une altération de l’aspect physique avant administration. Dans l’un ou l’autre de ces cas, n’administrez pas le vaccin.
Le contenu du récipient mono-dose doit être vidé entièrement et utilisé immédiatement.
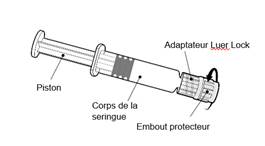
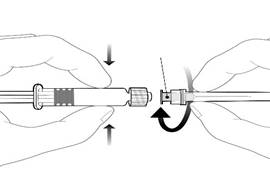
Instructions d’utilisation de la seringue préremplie
|
|
Tenir la seringue par le corps de la seringue et non par le piston.
Dévisser l’embout protecteur de la seringue en le tournant dans le sens inverse des aiguilles d’une montre.
|
||
|
Embase de l’aiguille |
Pour fixer l’aiguille, connecter l’embase de l’aiguille sur l’adaptateur Luer Lock et tourner d’un quart de tour dans le sens des aiguilles d’une montre jusqu’à sentir un blocage.
Ne pas tirer le piston en dehors du corps de la seringue. Si cela se produit, ne pas administrer le vaccin. |
Instructions d’élimination
Tout médicament non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
23, RUE FRANCOIS JACOB
92500 RUEIL-MALMAISON
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· 34009 300716 4 9 : 0,5 mL de suspension en seringue préremplie (verre) munie d’un bouchon-piston (caoutchouc butyle) – avec aiguille. Boîte de 10.
· 34009 300716 5 6 : 0,5 mL de suspension en seringue préremplie (verre) munie d’un bouchon-piston (caoutchouc butyle) – sans aiguille. Boîte de 1.
· 34009 300716 6 3 : 0,5 mL de suspension en seringue préremplie (verre) munie d’un bouchon-piston (caoutchouc butyle) – sans aiguille. Boîte de 10.
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
[À compléter ultérieurement par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE
[À compléter ultérieurement par le titulaire]
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Liste I.
ANSM - Mis à jour le : 13/06/2024
ENGERIX B 10 microgrammes/0,5 mL, suspension injectable en seringue préremplie
Vaccin de l’hépatite B (ADNr), (adsorbé) (VHB)
· Gardez cette notice. Vous pourriez avoir besoin de la relire.
· Si vous avez d’autres questions, interrogez votre médecin ou votre pharmacien.
· Ce vaccin a été personnellement prescrit pour vous/votre enfant. Ne le donnez pas à d’autres personnes. Il pourrait leur être nocif, même si les signes de leur maladie sont identiques aux vôtres/à ceux de votre enfant.
· Si vous ou votre enfant ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
Dans cette notice, toute référence à « vous » peut aussi vouloir dire « votre enfant ».
1. Qu'est-ce que ENGERIX B 10 microgrammes/0,5 mL, suspension injectable en seringue préremplie et dans quels cas est-il utilisé ?
2. Quelles sont les informations à connaître avant d'utiliser ENGERIX B 10 microgrammes/0,5 mL, suspension injectable en seringue préremplie ?
3. Comment utiliser ENGERIX B 10 microgrammes/0,5 mL, suspension injectable en seringue préremplie ?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver ENGERIX B 10 microgrammes/0,5 mL, suspension injectable en seringue préremplie ?
6. Contenu de l’emballage et autres informations.
1. QU’EST-CE QUE ENGERIX B 10 microgrammes/0,5 mL, suspension injectable en seringue préremplie ET DANS QUELS CAS EST-IL UTILISE ?
Classe pharmacothérapeutique - code ATC :
Sans objet.
Ce vaccin peut être administré aux nouveau-nés, aux enfants et aux adolescents jusqu’à l’âge de 15 ans inclus.
L'hépatite B est une maladie infectieuse du foie causée par un virus. Certaines personnes portent le virus de l'hépatite B dans leur organisme, mais ne peuvent pas s’en débarrasser. Elles peuvent toujours infecter d’autres personnes et sont considérées comme porteuses du virus. La maladie est propagée par le virus qui pénètre dans l'organisme après un contact avec des fluides corporels, le plus souvent par le sang d'une personne infectée.
Si la mère est porteuse du virus ; elle peut le transmettre à son bébé à la naissance. Il est également possible d'attraper le virus d’un porteur, par exemple, par le biais de rapports sexuels non protégés, de partage d’aiguilles d'injection ou lors d’un traitement par un équipement médical n’ayant pas été correctement stérilisé.
Les principaux signes de la maladie incluent maux de tête, fièvre, nausées et jaunisse (jaunissement de la peau et des yeux) mais, chez environ 3 patients sur 10 il n'y a aucun signe de maladie.
Chez les personnes infectées par l'hépatite B, 1 adulte sur 10 et jusqu’à 9 bébés sur 10 deviendront porteurs du virus et seront susceptibles de continuer à développer des lésions hépatiques graves et, dans certains cas un cancer du foie.
Comment ENGERIX B 10 microgrammes/0,5 mL fonctionne :
ENGERIX B 10 microgrammes/0,5 mL contient une petite quantité de « l’enveloppe externe » du virus de l'hépatite B. Cette « enveloppe externe » n'est pas contagieuse et ne peut pas vous rendre malade.
· Lorsque l’on vous administrera le vaccin, il va déclencher le système immunitaire de votre corps pour le préparer à se protéger contre ces virus dans le futur.
· ENGERIX B 10 microgrammes/0,5 mL ne vous protègera pas si vous êtes déjà infecté par le virus de l'hépatite B.
· ENGERIX B 10 microgrammes/0,5 mL peut seulement vous aider à vous protéger contre l'infection par le virus de l'hépatite B.
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT D’UTILISER ENGERIX B 10 microgrammes/0,5 mL, suspension injectable en seringue préremplie ?
N’utilisez jamais ENGERIX B 10 microgrammes/0,5 mL, suspension injectable en seringue préremplie :
· si vous êtes allergique (hypersensible) à ENGERIX B 10 microgrammes/0,5 mL, ou à l’un des autres composants contenus dans ce vaccin, mentionnés dans la rubrique 6.
· Si vous avez une fièvre importante.
ENGERIX B 10 microgrammes/0,5 mL ne doit pas vous être administré si vous êtes dans l’une des situations mentionnées ci-dessus.
En cas de doute, il est indispensable de demander l’avis de votre médecin ou de votre pharmacien avant de vous faire vacciner par ENGERIX B 10 microgrammes/0,5 mL.
Informez votre médecin ou votre pharmacien si vous avez des allergies ou si vous avez déjà eu des problèmes de santé après vous être fait vacciner.
Avertissements et précautions
Adressez-vous à votre médecin ou pharmacien avant de recevoir ENGERIX B 10 microgrammes/0,5 mL.
· Si vous êtes dialysé pour un problème rénal ou avez une maladie qui peut affecter votre système immunitaire. ENGERIX B 10 microgrammes/0,5 mL peut tout de même être administré par le médecin aux personnes dialysées, ou avec des problèmes hépatiques chroniques, ou aux porteurs de l’hépatite C ou aux séropositifs au VIH car les infections par le virus de l’hépatite B peuvent être graves chez ces patients. Des informations complémentaires concernant les personnes dialysées et les problèmes rénaux sont indiquées en rubrique 3.
Si vous n’êtes pas sûr d’être concerné par l’une des situations mentionnées ci-dessus, parlez-en à votre médecin avant de vous faire vacciner par ENGERIX B 10 microgrammes/0,5 mL.
Un évanouissement peut survenir (surtout chez les adolescents) après, voire même avant, toute injection avec une aiguille. Aussi parlez-en à votre médecin ou infirmier(e) si vous vous êtes évanoui lors d’une précédente injection.
Comme d’autres vaccins, ENGERIX B 10 microgrammes/0,5 mL peut ne pas vous protéger totalement contre l’hépatite B. Un certain nombre de facteurs comme, l’âge avancé, le sexe, le surpoids, le tabagisme et certaines maladies chroniques diminuent votre réponse immunitaire au vaccin. Si cela vous concerne, votre médecin pourra décider de vous faire faire une analyse sanguine ou de vous administrer une dose supplémentaire d’ENGERIX B 10 microgrammes/0,5 mL pour être sûr que vous soyez protégé.
Autres médicaments et ENGERIX B 10 microgrammes/0,5 mL, suspension injectable en seringue préremplie
Informez votre médecin ou pharmacien si vous prenez, avez récemment pris ou pourriez prendre tout autre médicament.
ENGERIX B 10 microgrammes/0,5 mL peut être utilisé en même temps que la plupart des autres vaccins usuels. Votre médecin veillera à ce que les vaccins soient injectés séparément et sur des sites d’injections différents.
ENGERIX B 10 microgrammes/0,5 mL, suspension injectable en seringue préremplie avec des aliments
Sans objet.
Si vous êtes enceinte ou que vous allaitez, si vous pensez être enceinte ou planifiez une grossesse, demandez conseil à votre médecin ou pharmacien avant d’utiliser ce vaccin.
Conduite de véhicules et utilisation de machines
Il est peu probable qu’ENGERIX B 10 microgrammes/0,5 mL affecte votre capacité à conduire des voitures ou à utiliser des machines. Toutefois, ne conduisez pas ou n’utilisez pas de machines si vous ne vous sentez pas bien.
ENGERIX B 10 microgrammes/0,5 mL, suspension injectable en seringue préremplie contient du sodium.
Ce vaccin contient moins de 1 mmol de sodium (23 mg) par dose, c'est-à-dire qu’il est quasiment sans sodium.
3. COMMENT UTILISER ENGERIX B 10 microgrammes/0,5 mL, suspension injectable en seringue préremplie ?
Comment est administré votre vaccin :
Votre médecin vous administrera la dose recommandée d’ENGERIX B 10 microgrammes/0,5 mL.
ENGERIX B 10 microgrammes/0,5 mL sera injecté :
· chez les enfants et les adolescents, dans le muscle au niveau de la partie supérieure du bras.
· chez les bébés et les jeunes enfants, dans le muscle de la cuisse.
· si vous êtes facilement sujet aux bleus ou avez des problèmes de coagulation, sous la peau.
En quelle quantité est-il administré
Vous recevrez une série d’injections d’ENGERIX B 10 microgrammes/0,5 mL. Une fois que vous aurez terminé le schéma d’administration, vous pouvez vous attendre à avoir une protection à long terme contre l’hépatite B.
· Les nouveau-nés, les enfants et adolescents jusqu'à 15 ans inclus recevront le vaccin dosé à 10 microgrammes/0,5 mL (ENGERIX B 10 microgrammes/0,5 mL).
Il y a plusieurs schémas d’administration d’ENGERIX B 10 microgrammes/0,5 mL. Votre médecin choisira le schéma le plus approprié pour vous :
Schéma 1 - Pour les nouveau-nés, les enfants et les adolescents jusqu’à l’âge de 15 ans inclus
1ière injection : à une date donnée
2ième injection : 1 mois après la première injection
3ième injection : 6 mois après la première injection
Schéma 2 – Pour les nouveau-nés, les enfants et les adolescents jusqu’à l’âge de 15 ans inclus
1ière injection : à une date donnée
2ième injection : 1 mois après la première injection
3ième injection : 2 mois après la première injection
4ième injection : 12 mois après la première injection
· Chez les nouveau-nés, le schéma 2 permettra l’injection d’ENGERIX B 10 microgrammes/0,5 mL en même temps que d'autres vaccins de routine de l’enfance.
· Ce schéma 2 peut également être utilisé si vous devez vous faire vacciner suite à une exposition récente au virus de l’hépatite B car il apportera une protection plus rapidement.
Il est très important que vous vous présentiez aux moments recommandés pour recevoir vos injections. Si vous avez des questions concernant la dose vaccinale qui va vous être administrée, parlez-en à votre médecin.
Vaccination et accouchement
Si vous avez une hépatite B et que vous venez d’accoucher, le schéma 1 ou 2 peut être utilisé pour vacciner votre bébé.
· Votre médecin peut également décider d’administrer à votre bébé des immunoglobulines (anticorps humains) contre l’hépatite B au moment de la première injection.
Cela aidera à protéger votre bébé contre l'hépatite B. Elles seront administrées en un site d'injection séparé.
Problèmes rénaux et de dialyse
Si votre enfant a un problème rénal ou est sous dialyse, votre médecin peut décider de faire une analyse sanguine ou de donner des doses supplémentaires de vaccin afin de s’assurer que votre enfant est protégé.
Si vous avez utilisé plus de ENGERIX B 10 microgrammes/0,5 mL, suspension injectable en seringue préremplieque vous n’auriez dû
Sans objet.
Si vous oubliez d’utiliser ENGERIX B 10 microgrammes/0,5 mL, suspension injectable en seringue préremplie
Si vous arrêtez d’utiliser ENGERIX B 10 microgrammes/0,5 mL, suspension injectable en seringue préremplie
Sans objet.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
Les effets indésirables suivants peuvent survenir avec ce vaccin :
Réactions allergiques
Si vous avez une réaction allergique, consultez immédiatement votre médecin. Les signes peuvent inclure :
· gonflement du visage
· baisse de la pression sanguine
· difficulté à respirer
· bleuissement de votre peau
· perte de connaissance
Généralement ces signes débutent très rapidement après l’injection. Consultez immédiatement un médecin s’ils se produisent après avoir quitté le cabinet du médecin.
Autres effets indésirables :
Très fréquent (pouvant survenir pour plus d’1 dose de vaccin sur 10) : maux de tête, douleur et rougeur au site d’injection, fatigue, irritabilité.
Fréquent (pouvant survenir jusqu’à 1 dose de vaccin sur 10) : somnolence, nausées ou vomissements, diarrhées ou douleurs abdominales, perte d’appétit, température élevée (fièvre), sensation générale de malaise, gonflement au site d’injection, réactions au site d’injection comme une bosse dure.
Peu fréquent (pouvant survenir jusqu’à 1 dose de vaccin sur 100) : sensations vertigineuses, douleurs musculaires, syndrome pseudo-grippal.
Rare (pouvant survenir jusqu’à 1 dose de vaccin sur 1 000) : gonflement des ganglions, urticaire, éruption cutanée et démangeaisons, douleurs articulaires, sensation de picotement, de fourmillement.
Les effets indésirables rapportés durant la commercialisation d’ENGERIX B 10 microgrammes/ 0,5 mL incluent : bleus ou impossibilité à arrêter un saignement en cas de coupure, pression artérielle basse, inflammation de vaisseaux sanguins, brusque gonflement du visage autour de la bouche et la gorge (œdème de Quincke), incapacité à bouger les muscles (paralysie), inflammation des nerfs (névrite) qui peut entrainer une perte de sensibilité ou un engourdissement, y compris une inflammation temporaire des nerfs provoquant douleurs, faiblesse et paralysie des extrémités et progressant souvent vers la poitrine et le visage (syndrome de Guillain-Barré), atteinte du nerf de l'œil pouvant entraîner une baisse ou perte de la vision (névrite optique) et affection démyélinisante du système nerveux central (sclérose en plaques), engourdissement ou faiblesse au niveau des bras et des jambes (neuropathie), inflammation ou infection du cerveau (encéphalite), atteinte du cerveau (encéphalopathie), infection autour du cerveau (méningite), convulsions, perte de la sensibilité de la peau à la douleur ou au toucher (hypoesthésie), tâches violettes ou marron rouge sur la peau (lichen plan), boutons rouges, articulations douloureuses et raides (arthrite), faiblesse des muscles.
Chez les grands prématurés (28 semaines de grossesse ou moins), des arrêts respiratoires plus longs que la normale peuvent survenir dans les 2 à 3 jours suivant la vaccination.
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin, votre pharmacien ou à votre infirmier/ère. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr/.
En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.
5. COMMENT CONSERVER ENGERIX B 10 microgrammes/0,5 mL, suspension injectable en seringue préremplie ?
Tenir ce médicament hors de la vue et de la portée des enfants.
N’utilisez pas ce vaccin après la date de péremption indiquée sur l’étiquette et l’emballage après EXP. La date de péremption fait référence au dernier jour de ce mois.
A conserver au réfrigérateur (entre 2°C et 8°C).
Ne pas congeler.
Conserver dans l’emballage d’origine à l’abri de la lumière.
Ne jetez aucun médicament au tout-à-l’égout ou avec les ordures ménagères. Demandez à votre pharmacien d’éliminer les médicaments que vous n’utilisez plus. Ces mesures contribueront à protéger l’environnement.
6. CONTENU DE L’EMBALLAGE ET AUTRES INFORMATIONS
Ce que contient ENGERIX B 10 microgrammes/0,5 mL, suspension injectable en seringue préremplie
· La substance active est l’« enveloppe externe » du virus de l’hépatite B. Chaque dose contient 10 microgrammes/0,5 mL de la protéine issue de cette enveloppe externe adsorbée sur l’hydroxyde d’aluminium hydraté.
· Les autres composants sont : le chlorure de sodium, le phosphate disodique dihydraté, le phosphate monosodique et l’eau pour préparations injectables.
Qu’est-ce que ENGERIX B 10 microgrammes/0,5 mL et contenu de l’emballage extérieur
ENGERIX B 10 microgrammes/0,5 mL est un liquide blanc et trouble.
ENGERIX B 10 microgrammes/0,5 mL est disponible en seringue préremplie de 1 dose, sans aiguille ou avec aiguille(s) séparée(s), en boîtes de 1 et 10.
Toutes les présentations peuvent ne pas être commercialisées.
Titulaire de l’autorisation de mise sur le marché
LABORATOIRE GLAXOSMITHKLINE
23, RUE FRANCOIS JACOB
92500 RUEIL-MALMAISON
Exploitant de l’autorisation de mise sur le marché
LABORATOIRE GLAXOSMITHKLINE
23, RUE FRANCOIS JACOB
92500 RUEIL-MALMAISON
GLAXOSMITHKLINE BIOLOGICALS SA
RUE DE L’INSTITUT 89
1330 RIXENSART
BELGIQUE
Noms du médicament dans les Etats membres de l'Espace Economique Européen
Ce médicament est autorisé dans les Etats membres de l'Espace Economique Européen sous les noms suivants : Conformément à la réglementation en vigueur.
[À compléter ultérieurement par le titulaire]
La dernière date à laquelle cette notice a été révisée est :
[À compléter ultérieurement par le titulaire]
Des informations détaillées sur ce médicament sont disponibles sur le site Internet de l’ANSM (France).
Les informations suivantes sont destinées exclusivement aux professionnels de santé :
Lors de sa conservation, le contenu peut présenter un fin dépôt blanc avec un surnageant limpide et incolore.
Après agitation, le vaccin est légèrement opaque.
Le vaccin doit être inspecté visuellement pour rechercher la présence de particules étrangères et/ou une altération de l’aspect physique avant administration. Dans l’un ou l’autre de ces cas, ne pas administrer le vaccin.
L’intégralité du contenu de la seringue monodose doit être administrée et utilisée immédiatement.
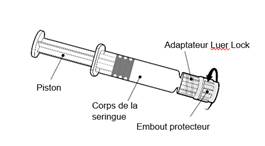
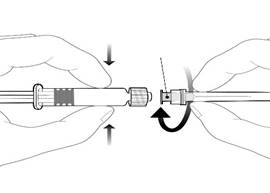
Instructions d’utilisation de la seringue préremplie
|
|
Tenir la seringue par le corps de la seringue et non par le piston.
Dévisser l’embout protecteur de la seringue en le tournant dans le sens inverse des aiguilles d’une montre. |
||
|
Embase de l’aiguille |
Pour fixer l’aiguille, connecter l’embase de l’aiguille sur l’adaptateur Luer Lock et tourner d’un quart de tour dans le sens des aiguilles d’une montre jusqu’à sentir un blocage.
Ne pas tirer le piston en dehors du corps de la seringue. Si cela se produit, ne pas administrer le vaccin. |
Instructions d’élimination
Tout médicament ou déchet non utilisé doit être éliminé conformément à la réglementation en vigueur.