Dernière mise à jour le 02/02/2026
TIXOCORTOL ARROW 1 %, suspension nasale
Indications thérapeutiques
Classe pharmacothérapeutique : décongestionnants et corticostéroïdes - code ATC : R01AD07
Ce médicament est indiqué pour une utilisation dans les narines seulement, dans les manifestations inflammatoires et allergiques du rhino-pharynx : rhinites allergiques, rhinites saisonnières, rhinites congestives aiguës et chroniques, rhinites vaso-motrices.
Présentations
> 1 flacon(s) pulvérisateur(s) polyéthylène de 10 ml avec pompe(s) doseuse(s) avec embout(s) nasal(aux)
Code CIP : 34009 302 018 2 4
Déclaration de commercialisation : 27/07/2021
Cette présentation est agréée aux collectivités
- Prix hors honoraire de dispensation : 1,79 €
- Honoraire de dispensation : 1,02 €
- Prix honoraire compris : 2,81 €
- Taux de remboursement :30 %
Service médical rendu (SMR)
Amélioration du service médical rendu (ASMR)
Ce médicament étant un générique, l'ASMR n'a pas été évalué par la commission de la transparence (CT), il est possible de se référer à la /aux spécialité(s) de référence du groupe générique auquel appartient ce médicament (cliquez ici pour aller à la rubrique des groupes génériques)
ANSM - Mis à jour le : 06/06/2024
TIXOCORTOL ARROW 1 %, suspension nasale
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Tixocortol (pivalate de)......................................................................................................... 1,000 g
Pour 100 g de suspension nasale.
Excipient à effet notoire : chaque ml de suspension nasale contient 5 mg d’alcool benzylique.
Pour la liste complète des excipients, voir rubrique 6.1.
4.1. Indications thérapeutiques
4.2. Posologie et mode d'administration
1 à 2 pulvérisations dans chaque narine 2 à 4 fois par jour.
Mode d’administration
Voie nasale.
Agiter avant chaque emploi.
Hypersensibilité à la substance active ou à l’un des excipients mentionnés à la rubrique 6.1.
Epistaxis.
TIXOCORTOL ARROW ne doit pas être utilisé en présence d’une infection virale localisée impliquant la muqueuse nasale, telle que Herpès simplex.
TIXOCORTOL ARROW ne doit pas être utilisé en présence d’une infection fongique locale, telle que la candidose.
En raison de l’effet inhibiteur des corticostéroïdes sur la cicatrisation des plaies, les patients qui ont subi une intervention chirurgicale ou un traumatisme nasal récent, ne doivent pas utiliser TIXOCORTOL ARROW jusqu’à la guérison.
4.4. Mises en garde spéciales et précautions d'emploi
Des effets systémiques peuvent apparaître lors de traitement au long cours avec des doses élevées de corticoïdes par voie nasale. Le risque de retentissement systémique reste néanmoins moins important qu'avec les corticoïdes oraux et peut varier en fonction de la susceptibilité individuelle et de la composition de la spécialité corticoïde utilisée. Les effets systémiques possibles sont syndrome de Cushing ou symptômes cushingoïdes, amincissement cutané, hématomes sous cutanés, insuffisance surrénalienne, retard de croissance chez les enfants et les adolescents, diminution de la densité osseuse, cataracte et glaucome et plus rarement, troubles psychologiques et du comportement comprenant hyperactivité psychomotrice, troubles du sommeil, anxiété, dépression ou agressivité (en particulier chez l'enfant).
Des évènements de lipomatose épidurale, de choriorétinopathie séreuse centrale et de crise de phéochromocytose ont été associés avec une administration des corticoïdes par voie systémique. Une administration à long terme par voie inhalée ou topique des corticoïdes pourrait être associée à ces effets systémiques potentiels.
Troubles visuels
Des troubles visuels peuvent apparaitre lors d’une corticothérapie par voie systémique ou locale. En cas de vision floue ou d’apparition de tout autre symptôme visuel apparaissant au cours d’une corticothérapie, un examen ophtalmologie est requis à la recherche notamment d’une cataracte, d’un glaucome, ou d’une lésion plus rare telle qu’une choriorétinopathie séreuse centrale, décrits avec l’administration de corticostéroïdes par voie systémique ou locale.
Précautions d'emploi
A utiliser après mouchage ou nettoyage soigneux du nez.
En cas de manifestation générale d'une atteinte bactérienne, une antibiothérapie par voie générale doit être envisagée.
Excipient
Ce médicament contient 5 mg d’alcool benzylique par ml de suspension nasale. L’alcool benzylique peut provoquer des réactions allergiques.
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
Aucun cas d'interaction médicamenteuse n'a été rapporté avec le tixocortol.
4.6. Fertilité, grossesse et allaitement
Une étude de toxicité par voie orale sur la fécondité et le développement conduite chez le rat n'a démontré aucun effet sur la fécondité, ni aucun effet tératogène du tixocortol, bien qu’une étude chez des lapins ait montré un effet tératogène (voir rubrique 5.3).
Dès lors que des études sur la procréation n’ont pas été effectuées avec le tixocortol, ce médicament ne doit être utilisé pendant la grossesse et l'allaitement qu'après évaluation approfondie du rapport bénéfice- risque pour la mère et pour le fœtus ou l’enfant.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
Ce médicament ne devrait pas affecter l'aptitude à conduire des véhicules et à utiliser des machines.
Les effets indésirables sont listés ci-dessous par Classe de Systèmes d’Organes (SOC) (dictionnaire MedDRA) et par catégorie de fréquence selon la convention standard. Ils sont présentés par ordre décroissant de gravité dans chaque groupe de fréquence.
|
Classes de systèmes d’organes MedDRA |
Très fréquent ≥ 1/10 |
Fréquent ≥ 1/100 à < 1/10 |
Peu fréquent ≥ 1/1 000 à < 1/100 |
Rare ≥ 1/10 000 à < 1/1000 |
Très Rare < 1/10 000 |
Fréquence indéterminée (ne peut être estimée sur la base des données disponibles) |
|
Affections oculaires |
|
|
|
|
Cataracte Glaucome |
Vision floue (voir rubrique 4.4) |
|
Affections du système immunitaire |
|
|
|
|
|
Hypersensibilité* |
|
Affections respiratoires, thoraciques et médiastinales |
|
|
|
|
|
Sécheresse nasale* Rhinalgie Epistaxis |
|
Affections de la peau et du tissu sous-cutané |
|
|
|
|
|
Angiœdème * |
|
Troubles généraux et anomalies au site d'administration |
|
|
|
|
|
Œdème de la face* |
|
* Ces réactions régressent à l'arrêt du traitement. Peut apparaître en début de traitement. |
|
|||||
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr/ .
Il n'existe actuellement aucun cas connu de surdosage du tixocortol.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Classe pharmacothérapeutique : décongestionnants et corticostéroïdes, code ATC : R01AD07.
Le pivalate de tixocortol possède l'efficacité locale des corticostéroïdes de référence, mais il est dépourvu chez l’homme d’activité corticostéroïde significative à distance du site d'application.
L'administration chez l'Homme, de 130 fois la dose thérapeutique quotidienne, n'entraîne aucun effet glucocorticoïde systémique.
La forme TIXOCORTOL ARROW 1 %, suspension nasale respecte le drainage nasal par les battements ciliaires de la muqueuse pituitaire.
5.2. Propriétés pharmacocinétiques
Les études conduites chez l'animal et chez l'homme ont montré une métabolisation extrêmement rapide du pivalate de tixocortol, expliquant l'absence d'effets corticostéroïdes systémiques significatifs chez l’homme.
Le pivalate de tixocortol est bien absorbé par voie orale ; cependant, même après administration par voie orale d'une dose très importante (2 g), on ne retrouve dans la circulation générale que des métabolites inactifs, dépourvus d'action glucocorticoïde. Ceci est dû à une dégradation extrêmement rapide du pivalate de tixocortol, principalement hépatique.
5.3. Données de sécurité préclinique
Dans une étude de toxicité orale sur la fertilité et le développement chez les rats, il n’y a pas eu d’effet sur la fertilité.
Les études de toxicité sur le développement prénatal ont montré une faible augmentation des pertes post implantatoires, une diminution du poids fœtal et le tixocortol n’était pas tératogène. Il n’y a pas eu d’effets indésirables sur le développement post-natal.
Dans une étude de développement embryofoetale le pivalate de tixocortol a été administré chaque jour par gavage oral à des lapins femelles à des stades de gravidité connus, à des doses allant jusqu’à 360 mg/kg/jour depuis le 6ème jour de gestation jusqu’au 18ème jour.
A des doses ≥ 120 mg/kg/jour, auxquelles la toxicité maternelle a été observée, il y avait une réduction des poids fœtaux et des augmentations de l’incidence de malformations majeures (hydrocéphalie, fente palatine et malformations du squelette). Une augmentation des pertes post-implantatoires, une diminution de la taille des portées et des anomalies du squelette ont également été observées à 360 mg/kg/jour. En se basant sur les mg/kg, les doses administrées dans cette étude, ont largement excédé les doses de ce produit administrées à l’homme par voie topique.
Le tixocortol n’a pas produit d’effet clastogène sur des lymphocytes humains et une réponse négative a été obtenue par le test du micronucleus in vivo chez des souris. Le tixocortol n’a pas montré de potentiel carcinogénique dans des études de gavage oral pendant 2 ans à des doses allant jusqu’à 250 mg/kg/jour chez les rats et jusqu’à 100 mg/kg/jour chez les souris.
Avant ouverture : 3 ans.
Après ouverture : 1 mois.
6.4. Précautions particulières de conservation
Avant ouverture : pas de précautions particulières de conservation.
Après ouverture : pas de précautions particulières de conservation.
6.5. Nature et contenu de l'emballage extérieur
Flacon pulvérisateur en polyéthylène de 10 ml avec pompe doseuse et embout nasal.
6.6. Précautions particulières d’élimination et de manipulation
Pas d’exigences particulières.
Tout médicament non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
26 AVENUE TONY GARNIER
69007 LYON
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· 34009 302 018 2 4 : 10 ml en flacon (PE) avec pompe doseuse.
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
[à compléter ultérieurement par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE
[à compléter ultérieurement par le titulaire]
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Liste II.
ANSM - Mis à jour le : 06/06/2024
TIXOCORTOL ARROW 1 %, suspension nasale
· Gardez cette notice. Vous pourriez avoir besoin de la relire.
· Si vous avez d’autres questions, interrogez votre médecin ou votre pharmacien.
· Ce médicament vous a été personnellement prescrit. Ne le donnez pas à d’autres personnes. Il pourrait leur être nocif, même si les signes de leur maladie sont identiques aux vôtres.
· Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
1. Qu'est-ce que TIXOCORTOL ARROW 1 %, suspension nasale et dans quels cas est-il utilisé ?
2. Quelles sont les informations à connaître avant d’utiliser TIXOCORTOL ARROW 1 %, suspension nasale ?
3. Comment utiliser TIXOCORTOL ARROW 1 %, suspension nasale ?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver TIXOCORTOL ARROW 1 %, suspension nasale ?
6. Contenu de l’emballage et autres informations.
1. QU’EST-CE QUE TIXOCORTOL ARROW 1 %, suspension nasale ET DANS QUELS CAS EST-IL UTILISE ?
Classe pharmacothérapeutique : décongestionnants et corticostéroïdes - code ATC : R01AD07
Ce médicament est indiqué pour une utilisation dans les narines seulement, dans les manifestations inflammatoires et allergiques du rhino-pharynx : rhinites allergiques, rhinites saisonnières, rhinites congestives aiguës et chroniques, rhinites vaso-motrices.
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT D’UTILISER TIXOCORTOL ARROW 1 %, suspension nasale ?
N'utilisez jamais TIXOCORTOL ARROW 1 %, suspension nasale :
· si vous êtes allergique au pivalate de tixocortol ou à l’un des autres composants contenus dans ce médicament, mentionnés dans la rubrique 6 ;
· si vous avez une épistaxis (saignements de nez) ;
· si vous avez une infection virale au niveau de la muqueuse nasale ;
· si vous avez une infection fongique locale ;
· si vous avez subi une intervention chirurgicale ou un traumatisme nasal récent.
EN CAS DE DOUTE, VOUS DEVEZ DEMANDER L'AVIS DE VOTRE MEDECIN OU DE VOTRE PHARMACIEN.
Avertissements et précautions
A utiliser après mouchage ou nettoyage soigneux du nez.
Contactez votre médecin en cas de vision floue ou d’autres troubles visuels.
Adressez-vous à votre médecin ou pharmacien avant d’utiliser TIXOCORTOL ARROW 1 %, suspension nasale.
Enfants et adolescents
Sans objet.
Autres médicaments et TIXOCORTOL ARROW 1 %, suspension nasale
TIXOCORTOL ARROW 1 %, suspension nasale avec des aliments et boissons et de l’alcool
Ce médicament ne doit être utilisé pendant la grossesse et l’allaitement qu’après évaluation approfondie du rapport bénéfice-risque pour la mère et pour le fœtus ou l’enfant.
D'une façon générale, il convient de demander conseil à votre médecin ou à votre pharmacien avant de prendre tout médicament.
Conduite de véhicules et utilisation de machines
Ce médicament ne devrait pas affecter l’aptitude à conduire des véhicules et à utiliser des machines.
TIXOCORTOL ARROW 1 %, suspension nasale contient de l’alcool benzylique
3. COMMENT UTILISER TIXOCORTOL ARROW 1 %, suspension nasale ?
Posologie
SE CONFORMER A LA PRESCRIPTION MEDICALE.
Mode et voie d'administration
Voie nasale.
Pour une utilisation dans les narines seulement, ne pas pulvériser dans les yeux ou la bouche.
Ne pas avaler.
Mode d’emploi
|
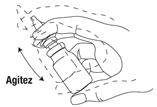
1- Agiter énergiquement le flacon de bas en haut avant chaque utilisation. Puis ôter le capuchon de protection.
|
|
|
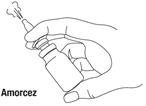
2- Amorcer la pulvérisation par 4 à 5 pressions successives avant la première utilisation et éventuellement au cours du traitement. |
|
|
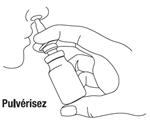
3- Introduire l'embout verticalement dans la narine et pressez à fond. Remettre le capuchon de protection après chaque utilisation. |
|
Durée du traitement
La durée d'administration de ce médicament sera la plus courte possible (quelques jours). Se conformer à l'ordonnance de votre médecin.
Si vous avez utilisé plus de TIXOCORTOL ARROW 1 %, suspension nasale que vous n’auriez dû
Consultez immédiatement votre médecin ou votre pharmacien.
Dans tous les cas, se conformer à l’ordonnance de votre médecin. Ne pas augmenter ou diminuer la dose sans l’avis de votre médecin ou de votre pharmacien.
Si vous oubliez d’utiliser TIXOCORTOL ARROW 1 %, suspension nasale
Si vous arrêtez d’utiliser TIXOCORTOL ARROW 1 %, suspension nasale
Sans objet.
Si vous avez d’autres questions sur l’utilisation de ce médicament, demandez plus d’informations à votre médecin ou à votre pharmacien.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
Les effets suivants été rapportés avec une fréquence non déterminée (la fréquence ne peut être estimée à partir des données disponibles) :
· des réactions indésirables, soit épistaxis, soit à type de sécheresse de la muqueuse nasale, soit de type allergique, d’œdèmes (infiltration de liquide dans les tissus superficiels du visage et/ou des muqueuses et exceptionnellement laryngé) ont été signalées. Elles cèdent à l'arrêt du traitement ;
· des douleurs nasales peuvent apparaître en début de traitement ;
· une vision floue.
Très rarement : possibilité de glaucome (augmentation de la pression à l’intérieur de l’œil), cataracte (opacification du cristallin de l’œil).
Si vous remarquez des effets indésirables non mentionnés dans cette notice, ou si certains effets indésirables deviennent graves, veuillez en informer votre médecin ou votre pharmacien.
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr/
En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.
5. COMMENT CONSERVER TIXOCORTOL ARROW 1 %, suspension nasale ?
Tenir ce médicament hors de la vue et de la portée des enfants.
N’utilisez pas ce médicament après la date de péremption indiquée sur l’emballage après EXP. La date de péremption fait référence au dernier jour de ce mois.
Avant ouverture : ce médicament ne nécessite pas de précautions particulières de conservation.
Après ouverture : la suspension nasale se conserve 1 mois sans précautions particulières de conservation.
Ne jetez aucun médicament au tout-à-l’égout ou avec les ordures ménagères. Demandez à votre pharmacien d’éliminer les médicaments que vous n’utilisez plus. Ces mesures contribueront à protéger l’environnement.
6. CONTENU DE L’EMBALLAGE ET AUTRES INFORMATIONS
Ce que contient TIXOCORTOL ARROW 1 %, suspension nasale
· La substance active est :
Pivalate de tixocortol...................................................................................................... 1,000 g
Pour 100 g de suspension nasale.
· Les autres composants sont : chlorure de N-cétylpyridinium, alcool benzylique, chlorure de sodium, phosphate monosodique dihydraté, hydroxyde de sodium (pour ajustement du pH), eau purifiée.
Qu’est-ce que TIXOCORTOL ARROW 1 %, suspension nasale et contenu de l’emballage extérieur
Ce médicament se présente sous forme de suspension pour pulvérisation nasale.
Flacon pulvérisateur en polyéthylène de 10 ml avec pompe doseuse et embout nasal.
Titulaire de l’autorisation de mise sur le marché
26 AVENUE TONY GARNIER
69007 LYON
Exploitant de l’autorisation de mise sur le marché
ARROW GENERIQUES
26 AVENUE TONY GARNIER
69007 LYON
ZA LA CROIX BONNET
21 RUE JACQUES TATI
78390 BOIS D’ARCY
Noms du médicament dans les Etats membres de l'Espace Economique Européen
Sans objet.
La dernière date à laquelle cette notice a été révisée est :
[à compléter ultérieurement par le titulaire]
Des informations détaillées sur ce médicament sont disponibles sur le site Internet de l’ANSM (France).