Dernière mise à jour le 02/02/2026
OPALGYNE 0,1 %, solution vaginale en récipient unidose
Ce médicament n'est ou ne sera bientôt plus disponible sur le marché.
Si vous prenez actuellement ce médicament, il vous est recommandé d'en parler avec votre médecin
ou avec votre pharmacien qui pourra vous orienter vers un autre traitement.
Indications thérapeutiques
Classe pharmacothérapeutique : ANTI-INFLAMMATOIRE et ANTALGIQUE A ADMINISTRATION VAGINALE (G - SYSTEME GENITO URINAIRE ET HORMONES SEXUELLES) - code ATC : G02CC03
· Ce médicament est utilisé pour traiter les douleurs provoquées par une inflammation du vagin (dans les maladies appelées vaginites aiguës).
Service médical rendu (SMR)
Pas de SMR disponible pour ce médicament ( plus d'informations dans l'aide )
Amélioration du service médical rendu (ASMR)
Pas d'ASMR disponible pour ce médicament (plus d'informations dans l'aide )
ANSM - Mis à jour le : 04/03/2020
OPALGYNE 0,1%, solution vaginale en récipient unidose
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Pour 100 ml.
Excipient à effet notoire : chlorure de benzalkonium (28 mg par récipient unidose de 140 ml).
Pour la liste complète des excipients, voir rubrique 6.1.
Solution vaginale en récipient unidose.
4.1. Indications thérapeutiques
4.2. Posologie et mode d'administration
Une administration vaginale 2 fois par jour pendant 3 jours.
Mode d’administration
Introduire délicatement la canule dans le vagin et comprimer le flacon jusqu’à ce qu’il soit pratiquement vide.
Population pédiatrique
Le dispositif d’administration n’est pas adapté pour une utilisation chez l’enfant. L’efficacité et la sécurité d’OPALGYNE n’ont pas été établies chez l’enfant.
Ce médicament est contre-indiqué dans les situations suivantes :
· hypersensibilité à la substance active ou à l’un des excipients mentionnés à la rubrique 6.1,
· à partir du début du 6ème mois de la grossesse soit 24 semaines d’aménorrhée (voir rubrique 4.6),
· chez l’enfant, le dispositif d’administration n’est pas adapté à cette population.
4.4. Mises en garde spéciales et précautions d'emploi
Le traitement par ce produit ne doit pas exclure le traitement étiologique, chaque fois que nécessaire.
En raison de la présence de chlorure de benzalkonium, ce médicament peut provoquer une irritation locale.
Précautions d’emploi
En cas de traitement spécifique associé par la même voie, l’administration de ce produit sera pratiquée avant ce traitement afin d’en éviter l’élimination mécanique.
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
Les données disponibles à ce jour ne laissent pas supposer l’existence d’interactions cliniquement significatives.
4.6. Fertilité, grossesse et allaitement
Grossesse
(Par extension des autres voies d’administration) :
L’inhibition de la synthèse des prostaglandines peut affecter le déroulement de la grossesse et/ou le développement de l’embryon ou du fœtus. Les données des études épidémiologiques suggèrent une augmentation du risque de fausse-couche, de malformations cardiaques et de gastroschisis, après traitement par un inhibiteur de la synthèse des prostaglandines en début de grossesse.
Le risque absolu de malformation cardiovasculaire est passé de moins de 1%, à approximativement 1,5%. Le risque paraît augmenter en fonction de la dose et de la durée du traitement. Chez l’animal, il a été montré que l’administration d’un inhibiteur de la synthèse des prostaglandines provoquait une perte pré et post-implantatoire accrue et une augmentation de la létalité embryo-fœtale. De plus, une incidence supérieure de certaines malformations, y compris cardiovasculaires, a été rapportée chez des animaux ayant reçu un inhibiteur de la synthèse des prostaglandines au cours de la phase d’organogénèse de la gestation. Sauf nécessité absolue, les AINS ne doivent donc pas être prescrits au cours des 24 premières SA (5 mois de grossesse révolus). Si un AINS est administré chez une femme souhaitant être enceinte ou enceinte de moins de six mois, la dose devra être la plus faible possible et la durée du traitement la plus courte possible.
Au-delà de 24 semaines d’aménorrhée (5 mois révolus), tous les inhibiteurs de la synthèse des prostaglandines peuvent exposer le fœtus à :
· une toxicité cardio-pulmonaire (fermeture prématurée du canal artériel et hypertension artérielle pulmonaire),
· un dysfonctionnement rénal pouvant évoluer vers une insuffisance rénale à un oligohydramnios.
En fin de grossesse, la mère et le nouveau-né peuvent présenter :
· un allongement du temps de saignement du fait d’une action anti-agrégante pouvant survenir même après administration de très faibles doses de médicament,
· une inhibition des contractions utérines entraînant un retard de terme ou un accouchement prolongé.
En conséquence, les AINS sont contre-indiqués au cours du troisième trimestre de la grossesse au-delà de 24 semaines d’aménorrhée (5 mois révolus).
Les AINS passant dans le lait maternel, par mesure de précaution, il convient d’éviter de les administrer chez la femme qui allaite.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
Des cas exceptionnels d’irritations locales ont été rapportés.
Possibilité de réaction allergique ou de photosensibilisation (fréquence inconnue).
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : www.signalement-sante.gouv.fr.
Aucun cas de surdosage n’a été rapporté. En cas de surdosage, rincer abondamment à l’eau.
Une intoxication ne devrait survenir qu'en cas d'ingestion accidentelle de quantités importantes de benzydamine (> 300 mg).
Les symptômes associés à un surdosage résultant de l'ingestion de benzydamine sont majoritairement des symptômes de nature gastro-intestinale et des symptômes associés au système nerveux central. Les symptômes gastro-intestinaux les plus fréquents sont les nausées, les vomissements, les douleurs abdominales et l'irritation œsophagienne. Les symptômes associés au système nerveux central comprennent des vertiges, des hallucinations, de l'agitation, de l'anxiété et de l'irritabilité.
En cas de surdosage aigu, seul un traitement symptomatique est envisageable. Les patients doivent faire l'objet d'une surveillance étroite et un traitement de soutien doit être administré. Une hydratation suffisante devra être maintenue.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Le chlorhydrate de benzydamine, principe actif de ce produit, est un anti-inflammatoire non stéroïdien, appartenant à la classe chimique des indazoles.
L’action de la benzydamine sur les phénomènes locaux de l’inflammation se manifeste par :
· une réduction de la perméabilité vasculaire,
· une diminution de l’œdème et des réactions exsudatives,
· une sédation de la douleur inflammatoire.
La benzydamine antagonise peu la biosynthèse des prostaglandines. Elle est inhibitrice de l’action vaso-active des médiateurs de l’inflammation (histamine et sérotonine) ; elle réduit la libération par les cellules inflammatoires des radicaux libres et des enzymes lytiques ; de plus, ses propriétés anti-agrégantes plaquettaires et érythrocytaire contribuent à l’amélioration des conditions hémodynamiques locales du foyer inflammatoire.
5.2. Propriétés pharmacocinétiques
5.3. Données de sécurité préclinique
*Arôme rose : acétate de linalyle, acétate de géranyle, 1-linalol, citral, octanol, alcool phényléthylique, 1-citronellol, géraniol, nérol, eugénol, méthyl-eugénol, aldéhyde nonylique, rhodinol.
6.4. Précautions particulières de conservation
Sans objet.
6.5. Nature et contenu de l'emballage extérieur
Solution vaginale en récipient unidose - Boîte de 6 flacons avec canule (PE) de 140 ml.
Solution vaginale en récipient unidose - Boîte de 2 flacons avec canule (PE) de 140 ml.
6.6. Précautions particulières d’élimination et de manipulation
Pas d’exigences particulières.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
LABORATOIRE INNOTECH INTERNATIONAL
22 AVENUE ARISTIDE BRIAND
94110 ARCUEIL
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· 34009 328 465 3 5 : solution vaginale en récipient unidose – Boîte de 6 flacons avec canule (PE) de 140 ml.
· 34009 329 662 7 1 : solution vaginale en récipient unidose – Boîte de 2 flacons avec canule (PE) de 140 ml.
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
[à compléter ultérieurement par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE
[à compléter ultérieurement par le titulaire]
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Liste II
Ce médicament n'est ou ne sera bientôt plus disponible sur le marché.
Si vous prenez actuellement ce médicament, il vous est recommandé d'en parler avec votre médecin
ou avec votre pharmacien qui pourra vous orienter vers un autre traitement.
ANSM - Mis à jour le : 04/03/2020
OPALGYNE 0,1%, solution vaginale en récipient unidose
Chlorhydrate de benzydamine
· Gardez cette notice. Vous pourriez avoir besoin de la relire.
· Si vous avez d’autres questions, interrogez votre médecin ou votre pharmacien.
· Ce médicament vous a été personnellement prescrit. Ne le donnez pas à d’autres personnes. Il pourrait leur être nocif, même si les signes de leur maladie sont identiques aux vôtres.
· Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
1. Qu'est-ce que OPALGYNE et dans quels cas est-il utilisé ?
2. Quelles sont les informations à connaître avant d'utiliser OPALGYNE ?
3. Comment utiliser OPALGYNE ?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver OPALGYNE ?
6. Contenu de l’emballage et autres informations.
1. QU’EST-CE QUE OPALGYNE ET DANS QUELS CAS EST-IL UTILISE ?
Classe pharmacothérapeutique : ANTI-INFLAMMATOIRE et ANTALGIQUE A ADMINISTRATION VAGINALE (G - SYSTEME GENITO URINAIRE ET HORMONES SEXUELLES) - code ATC : G02CC03
· Ce médicament est utilisé pour traiter les douleurs provoquées par une inflammation du vagin (dans les maladies appelées vaginites aiguës).
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT D’UTILISER OPALGYNE ?
· si vous êtes allergique (hypersensible) à la substance active (la benzydamine) ou à l’un des autres composants contenus dans ce médicament, mentionnés dans la rubrique 6,
· à partir du début du 6ème mois de la grossesse (soit 24 semaines depuis vos dernières règles).
· chez l’enfant.
Avertissements et précautions
Adressez-vous à votre médecin ou pharmacien avant d’utiliser OPALGYNE.
Consultez votre médecin si les symptômes persistent ou si de nouveaux symptômes apparaissent durant votre traitement par OPALGYNE.
Enfants
Ne pas utiliser OPALGYNE chez l’enfant. Le dispositif d'administration n'est pas adapté à cette population.
Autres médicaments et OPALGYNE
Informez votre médecin ou pharmacien si vous prenez, avez récemment pris ou pourriez prendre tout autre médicament.
Si vous prenez un autre traitement par la voie vaginale, l'administration de ce traitement doit se faire avant l'application d'OPALGYNE afin d'éviter que votre vagin élimine cet autre traitement.
OPALGYNE avec des aliments et des boissons
Sans objet.
Grossesse et allaitement
Si vous êtes enceinte ou que vous allaitez, si vous pensez être enceinte ou planifiez une grossesse, demandez conseil à votre médecin ou pharmacien avant de prendre ce médicament.
Grossesse
· Ce médicament ne sera utilisé pendant les 5 PREMIERS MOIS de la grossesse que sur les conseils de votre médecin.
· A partir du 6ème mois de grossesse, vous ne devez EN AUCUN CAS prendre de VOUS-MEME ce médicament. Bien que le passage de ce médicament dans le sang soit faible, il ne peut être exclu. Dans ce cas, l’effet de ce médicament sur votre enfant pourrait avoir des conséquences graves, notamment sur son cœur, ses poumons et ses reins, et cela, même avec une seule application.
Allaitement
· Les médicaments de la même famille qu’OPALGYNE (également appelés A.I.N.S.) passent dans le lait maternel.
· Par mesure de précaution, vous devez éviter d’utiliser ce médicament si vous allaitez.
Conduite de véhicules et utilisation de machines
Sans objet.
OPALGYNE contient du chlorure de benzalkonium (28 mg par récipient unidose de 140 ml).
Le chlorure de benzalkonium peut provoquer une irritation locale.
3. COMMENT UTILISER OPALGYNE ?
Posologie
Vous devez faire une administration vaginale 2 fois par jour pendant 3 jours.
Mode et voie d’administration
· Ce médicament doit être utilisé par voie vaginale uniquement. Vous ne devez pas l’avaler.
· Le médicament est contenu dans un flacon unidose ce qui signifie que le flacon contient suffisamment de solution pour une seule et unique administration.
· Pour chaque nouvelle administration, vous devrez utiliser un nouveau flacon.
· Il peut apparaître un dépôt blanc à la base de la canule, sans aucun inconvénient pour l’utilisation.
Pour administrer ce médicament, suivez bien les instructions qui suivent :
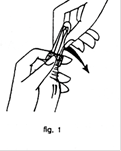
1) Otez le capuchon protecteur en le cassant à la base (fig.1).
|
|
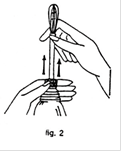
2) Tirez à fond sur la canule d’irrigation vers le haut jusqu’à obtention d’un déclic (fig.2).
|
|
3) Vous pouvez administrer la solution soit en étant debout soit en étant assise :
a) Introduisez l’extrémité perforée de la canule d’irrigation doucement et profondément à l’intérieur du vagin.
b) Pressez lentement le flacon et sans à-coups jusqu’à ce qu’il soit pratiquement vide. Après avoir agi dans le vagin, le liquide s’écoule ensuite normalement hors du vagin au fur et à mesure.
c) Après emploi, utilisez le capuchon protecteur pour enfoncer la canule dans le flacon vide.
d) Jetez le flacon.
Il est normal que le flacon ne se vide pas complètement. La dose de traitement nécessaire est toutefois respectée.
Si vous avez pris plus d’OPALGYNE que vous n’auriez dû
Informez-en votre médecin ou votre pharmacien.
Si vous avez accidentellement avalé votre médicament, demandez immédiatement conseil à votre médecin ou pharmacien.
Si vous oubliez de prendre OPALGYNE
Ne prenez pas de dose double pour compenser la dose que vous avez oublié de prendre.
Si vous arrêtez de prendre OPALGYNE
Sans objet.
Si vous avez d’autres questions sur l’utilisation de ce médicament, demandez plus d’informations à votre médecin ou à votre pharmacien.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
Ce médicament peut provoquer des irritations locales, des réactions allergiques ou de photosensibilisation.
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : www.signalement-sante.gouv.fr
En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.
5. COMMENT CONSERVER OPALGYNE ?
Tenir ce médicament hors de la vue et de la portée des enfants.
N’utilisez pas ce médicament après la date de péremption indiquée sur la boîte. La date de péremption fait référence au dernier jour de ce mois.
Utiliser OPALGYNE dès son ouverture, ne pas conserver un flacon à demi ouvert.
Ne jetez aucun médicament au tout-à-l’égout ou avec les ordures ménagères. Demandez à votre pharmacien d’éliminer les médicaments que vous n’utilisez plus. Ces mesures contribueront à protéger l’environnement.
6. CONTENU DE L’EMBALLAGE ET AUTRES INFORMATIONS
· La substance active est : le chlorhydrate de benzydamine (100 mg pour 100 ml de solution vaginale).
· Les autres composants sont :
Chlorure de benzalkonium, édétate de sodium, , polysorbate 20, alcool éthylique à 95°C, arôme rose*, eau purifiée.
*Arôme rose : acétate de linalyle, acétate de géranyle, 1-linalol, citral, octanol, alcool phényléthylique, 1-citronellol, géraniol, nérol, eugénol, méthyl-eugénol, aldéhyde nonylique, rhodinol.
Qu’est-ce que OPALGYNE et contenu de l’emballage extérieur
Ce médicament se présente sous forme de solution vaginale en récipient unidose (flacon).
Chaque boîte contient 2 ou 6 flacons avec leurs canules.
Titulaire de l’autorisation de mise sur le marché
LABORATOIRE INNOTECH INTERNATIONAL
22 AVENUE ARISTIDE BRIAND
94110 ARCUEIL
Exploitant de l’autorisation de mise sur le marché
LABORATOIRE INNOTECH INTERNATIONAL
22 AVENUE ARISTIDE BRIAND
94110 ARCUEIL
RUE RENE CHANTEREAU, CHOUZY-SUR-CISSE
41150 VALLOIRE-SUR-CISSE
Noms du médicament dans les Etats membres de l'Espace Economique Européen
Sans objet.
La dernière date à laquelle cette notice a été révisée est :
[à compléter ultérieurement par le titulaire]
< {MM/AAAA}>< {mois AAAA}.>
Des informations détaillées sur ce médicament sont disponibles sur le site Internet de l’ANSM (France).