Dernière mise à jour le 01/12/2025
VITAMINE B12 GERDA 1000 µg/4 ml, solution injectable (IM) et buvable
Indications thérapeutiques
Classe pharmacothérapeutique - code ATC : B03BA01.
Ce médicament destiné aux adultes, enfants et nourrissons contient de la vitamine B12. Il est indiqué :
· pour traiter les anémies (diminution du nombre de globules rouges dans le sang) et prévenir des atteintes neurologiques chez les personnes ayant un apport en vitamine B12 insuffisant.
· dans le cas de maladies susceptibles de diminuer l’absorption de la vitamine B12, telles que la maladie de Biermer, de la maladie d’Imerslund, chez les personnes ayant subi l’ablation de l’estomac ou d’une partie de l’intestin.
Présentations
> 6 ampoule(s) en verre de 4 ml
Code CIP : 311 363-8 ou 34009 311 363 8 5
Déclaration de commercialisation : 19/01/1955
Cette présentation est agréée aux collectivités
- Prix hors honoraire de dispensation : 2,57 €
- Honoraire de dispensation : 1,02 €
- Prix honoraire compris : 3,59 €
- Taux de remboursement :65%
- Manque de Vitamine B12 chez les personnes atteintes de certaines maladies qui en diminuent l'absorption par l'organisme.
- Manque de Vitamine B12 chez les végétaliens (personnes ne mangeant aucun produit d'origine animale comme par exemple de la viande) stricts depuis plus de 4 ans. ; JOURNAL OFFICIEL ; 01/08/93
Service médical rendu (SMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprès de la HAS (plus d'informations dans l'aide). Les avis et synthèses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur du SMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| Important | Avis du 13/12/2017 | Renouvellement d'inscription (CT) | Le service médical rendu par VITAMINE B12 GERDA 1 000 µg/4 mL, solution injectable (IM) et buvable reste important dans les indications de l’AMM. |
Amélioration du service médical rendu (ASMR)
Pas d'ASMR disponible pour ce médicament (plus d'informations dans l'aide )
ANSM - Mis à jour le : 06/12/2021
VITAMINE B12 GERDA 1000 µg/4 ml, solution injectable (IM) et buvable
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Cyanocobalamine................................................................................................................ 1000 µg
Pour une ampoule de 4 ml.
Pour la liste complète des excipients, voir rubrique 6.1.
Solution injectable IM et buvable.
4.1. Indications thérapeutiques
Ce médicament est indiqué chez les adultes, enfants et nourrissons.
Traitement de la carence en vitamine B12 dû à un apport alimentaire insuffisant.
Traitement de la carence en vitamine B12 dû à un défaut d’absorption notamment dans les cas suivants :
· maladie de Biermer,
· maladie d’Imerslund,
· gastrectomie totale,
· résection de l’iléon terminal.
4.2. Posologie et mode d'administration
Posologie
La posologie est similaire chez les adultes, enfants et nourrissons.
L’usage de la voie injectable est réservé au traitement des carences liées à une malabsorption digestive de la vitamine B 12 ou au traitement de la carence liée à un apport alimentaire insuffisant lorsque le recours à la voie orale n’est pas possible.
· Par voie injectable intramusculaire (IM) :
o En traitement d'attaque : une ampoule par jour ou trois fois par semaine en IM, soit 10 ampoules au total.
o En traitement d'entretien : une ampoule en IM par mois.
· Par voie orale : verser le contenu de l'ampoule dans un verre d'eau.
o En traitement d'attaque : une ampoule par jour pendant 15 jours à 1 mois.
o En traitement d'entretien : une posologie de 2 000 µg/semaine est recommandée soit 2 ampoules par semaine.
La posologie devra être adaptée en fonction de l’intensité de la carence.
Une posologie par voie orale de 4 000 µg (durant les 2 premiers trimestres de la grossesse) et 5 000 µg (durant le 3ème trimestre et l’allaitement) tous les 15 jours chez les femmes enceintes/allaitantes ayant un apport en vitamine B12 insuffisant.
Une posologie par voie orale de 2000 µg/semaine est recommandée si elle n’est pas apportée par l’allaitement chez le nourrisson.
Mode d’administration
Voies injectable IM et orale.
Pour la voie orale, ce médicament doit être pris de préférence à distance des repas pour éviter d’entrer en compétition avec l’absorption de la vitamine B12 provenant de l’alimentation.
Antécédents d'allergie aux cobalamines (vitamine B12 et substances apparentées).
4.4. Mises en garde spéciales et précautions d'emploi
Une surveillance hématologique et neurologique régulière doit être menée tout au long du traitement.
La kaliémie doit être attentivement surveillée durant les deux premiers jours de traitement par la vitamine B12 chez les sujets présentant une anémie mégaloblastique : une hypokaliémie peut survenir en raison de l'augmentation des besoins érythrocytaires en potassium.
En l'absence de réponse thérapeutique lors de l'administration de vitamine B12 au cours d'anémies mégaloblastiques, le diagnostic d'un déficit du métabolisme de l'acide folique doit être considéré. Des doses journalières supérieures à 10 µg peuvent conduire à une réponse hématologique chez les sujets présentant un déficit en acide folique. Aussi, une administration sans distinction préalable du déficit risque de fausser le diagnostic précis.
Il conviendra de surveiller l’efficacité du traitement en mesurant l’acide méthylmalonique dans les urines ou la transcobalamine sanguine en particulier en cas d’insuffisance urinaire.
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
Associations à prendre en compte
+ Antisécrétoires antihistaminiques H2
Risque de carence en cyanocobalamine après traitement prolongé (quelques années), la réduction de l'acidité gastrique par ces médicaments pouvant diminuer l'absorption digestive de la vitamine B12.
+ Antisécrétoires inhibiteurs de la pompe à protons
Risque de carence en cyanocobalamine après traitement prolongé (quelques années), la réduction de l'acidité gastrique par ces médicaments pouvant diminuer l'absorption digestive de la vitamine B12.
4.6. Fertilité, grossesse et allaitement
Compte tenu des données disponibles, l'utilisation en cas de carence chez la femme enceinte ou qui allaite est possible.
Grossesse et Allaitement
La vitamine B12 peut être administrée aux femmes enceintes chaque fois que nécessaire. La vitamine B12 est excrétée dans le lait maternel, mais son utilisation est compatible avec l’allaitement, et même recommandée lorsque la quantité de cyanocobalamine transmise à l’enfant est insuffisante.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
Sans objet.
Les effets indésirables pouvant survenir avec VITAMINE B12 GERDA 1000 µg/4 ml, solution injectable (IM) et buvable sont listés ci-dessous par classe de systèmes d’organes et par fréquence selon la convention suivante : très fréquent (≥ 1/10) ; fréquent (≥ 1/100, < 1/10) ; peu fréquent (≥ 1/1 000, < 1/100) ; rare (≥ 1/10 000, < 1/1 000) ; très rare (< 1/10 000) et fréquence indéterminée (ne peut être estimée sur la base des données disponibles).
Tableau des effets indésirables :
|
Classe système organique |
Fréquence |
Effet(s) indésirable(s) |
|
Affections du système immunitaire |
Indéterminée |
Réactions d’hypersensibilité comprenant prurit, urticaire, eczéma, érythème, œdème, pouvant être sévères, donnant lieu à une nécrose cutanée, un œdème généralisé, un angioedème, voire un choc anaphylactique |
|
Affections de la peau et du tissu cutané |
Indéterminée |
Acné |
|
Affections du rein et des voies urinaires |
Indéterminée |
Coloration rouge des urines (correspondant à l’élimination urinaire de la vitamine B12) |
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : www.signalement-sante.gouv.fr.
Aucun cas de surdosage n'a été rapporté.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Classe pharmacothérapeutique : ANTIANEMIQUE - VITAMINE B12, code ATC : B03BA01.
Cyanocobalamine : Facteur hématopoïétique.
5.2. Propriétés pharmacocinétiques
La vitamine B12 est absorbée au niveau de l'iléon terminal par deux mécanismes :
· un mécanisme passif lorsque les quantités sont importantes et,
· un mécanisme actif qui permet l'absorption des doses physiologiques et pour lequel la présence du facteur intrinsèque est indispensable.
Le pic sérique est atteint une heure après l'injection intramusculaire.
L'excrétion se fait principalement par la bile.
5.3. Données de sécurité préclinique
Non renseigné.
Acide chlorhydrique concentré, chlorure de sodium, eau pour préparations injectables.
En l'absence d'étude de compatibilité, ce médicament ne doit pas être mélangé avec d'autres médicaments.
4 ans.
Après ouverture : le produit doit être utilisé immédiatement.
6.4. Précautions particulières de conservation
A conserver à l'abri de la lumière.
6.5. Nature et contenu de l'emballage extérieur
Ampoule de verre incolore (type I) de 4 ml.
6.6. Précautions particulières d’élimination et de manipulation
Pas d'exigences particulières.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
SUBSTIPHARM
24 RUE ERLANGER
75016 PARIS
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· 34009 311 363 8 5 : 4 ml en ampoule (verre incolore), boîte de 6.
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
[à compléter ultérieurement par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE
[à compléter ultérieurement par le titulaire]
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Sans objet.
Médicament non soumis à prescription médicale.
ANSM - Mis à jour le : 06/12/2021
VITAMINE B12 GERDA 1000 µg/4 ml, solution injectable (IM) et buvable
Cyanocobalamine
Veuillez lire attentivement cette notice avant d’utiliser ce médicament car elle contient des informations importantes pour vous.
Vous devez toujours utiliser ce médicament en suivant scrupuleusement les informations fournies dans cette notice ou par votre médecin ou votre pharmacien.
· Gardez cette notice. Vous pourriez avoir besoin de la relire.
· Adressez-vous à votre pharmacien pour tout conseil ou information.
· Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
· Vous devez vous adresser à votre médecin si vous ne ressentez aucune amélioration ou si vous vous sentez moins bien.
1. Qu'est-ce que VITAMINE B12 GERDA 1000 µg/4 ml, solution injectable (IM) et buvable et dans quels cas est-il utilisé ?
2. Quelles sont les informations à connaître avant d'utiliser VITAMINE B12 GERDA 1000 µg/4 ml, solution injectable (IM) et buvable ?
3. Comment utiliser VITAMINE B12 GERDA 1000 µg/4 ml, solution injectable (IM) et buvable ?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver VITAMINE B12 GERDA 1000 µg/4 ml, solution injectable (IM) et buvable ?
6. Contenu de l’emballage et autres informations.
1. QU’EST-CE QUE VITAMINE B12 GERDA 1000 µg/4 ml, solution injectable (IM) et buvable ET DANS QUELS CAS EST-IL UTILISE ?
Classe pharmacothérapeutique - code ATC : B03BA01.
Ce médicament destiné aux adultes, enfants et nourrissons contient de la vitamine B12. Il est indiqué :
· pour traiter les anémies (diminution du nombre de globules rouges dans le sang) et prévenir des atteintes neurologiques chez les personnes ayant un apport en vitamine B12 insuffisant.
· dans le cas de maladies susceptibles de diminuer l’absorption de la vitamine B12, telles que la maladie de Biermer, de la maladie d’Imerslund, chez les personnes ayant subi l’ablation de l’estomac ou d’une partie de l’intestin.
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT D’UTILISER VITAMINE B12 GERDA 1000 µg/4 ml, solution injectable (IM) et buvable ?
N’utilisez jamais VITAMINE B12 GERDA 1000 µg/4 ml, solution injectable (IM) et buvable :
· si vous êtes allergique (hypersensible) à la cyanocobalamine ou à l’un des autres composants contenus dans ce médicament, mentionnés dans la rubrique 6.
Avertissements et précautions
Adressez-vous à votre médecin ou pharmacien avant d’utiliser VITAMINE B12 GERDA 1000 µg/4 ml, solution injectable (IM) et buvable.
· Ce médicament ne sera administré que lorsque le déficit en vitamine B12 sera établi.
· Durant le traitement, des prises de sang et des examens neurologiques doivent être effectués.
· En cas d'anémie mégaloblastique, le taux de potassium dans le sang (kaliémie) doit être attentivement surveillé pendant les deux premiers jours de traitement.
· Il conviendra de surveiller l’efficacité du traitement en mesurant l’acide méthylmalonique dans les urines ou la transcobalamine sanguine en particulier en cas d’insuffisance urinaire.
Enfants
Sans objet.
Autres médicaments et VITAMINE B12 GERDA 1000 µg/4 ml, solution injectable (IM) et buvable
Informez votre médecin ou pharmacien si vous utilisez, avez récemment utilisé ou pourriez utiliser tout autre médicament.
VITAMINE B12 GERDA 1000 µg/4 ml, solution injectable (IM) et buvable avec des aliments et boissons
Pour la voie orale, ce médicament doit être pris de préférence à distance des repas.
Grossesse et allaitement
La vitamine B12 peut être administrée aux femmes enceintes chaque fois que nécessaire. La vitamine B12 est excrétée dans le lait maternel, mais son utilisation est compatible avec l’allaitement, et même recommandée lorsque la quantité de vitamine B12 transmise à l’enfant est insuffisante.
D'une façon générale, il convient de demander conseil à votre médecin ou à votre pharmacien avant de prendre tout médicament.
Conduite de véhicules et utilisation de machines
Sans objet.
VITAMINE B12 GERDA 1000 µg/4 ml, solution injectable (IM) et buvable contient
Sans objet.
3. COMMENT UTILISER VITAMINE B12 GERDA 1000 µg/4 ml, solution injectable (IM) et buvable ?
Veillez à toujours utiliser ce médicament en suivant exactement les indications de votre médecin ou pharmacien. Vérifiez auprès de votre médecin ou pharmacien en cas de doute.
Posologie
Dans tous les cas se conformer strictement à l'ordonnance de votre médecin.
L’usage de la voie injectable est réservé au traitement des carences liées à une malabsorption digestive de la vitamine B 12 ou au traitement de la carence liée à un apport alimentaire insuffisant lorsque le recours à la voie orale n’est pas possible.
· Par voie injectable intramusculaire (IM) :
o En traitement d'attaque : une ampoule par jour ou trois fois par semaine en IM, soit 10 ampoules au total.
o En traitement d'entretien : une ampoule en IM par mois.
· Par voie orale : verser le contenu de l'ampoule dans un verre d'eau.
o En traitement d'attaque : une ampoule par jour pendant 15 jours à 1 mois.
o En traitement d'entretien : une posologie de 2 000 µg/semaine est recommandée soit 2 ampoules par semaine.
La posologie devra être adaptée en fonction de l’intensité de la carence.
Chez la femme enceinte ou qui allaite : une posologie par voie orale de 4 000 µg (durant les 2 premiers trimestres de la grossesse) et 5 000 µg (durant le 3ème trimestre et l’allaitement) tous les 15 jours chez les femmes enceintes/allaitantes ayant un apport en vitamine B12 insuffisant.
Chez le nourrisson : une posologie par voie orale de 2000 µg/semaine est recommandée si elle n’est pas apportée par l’allaitement.
Mode et voie d'administration
Voies injectable intramusculaire et orale.
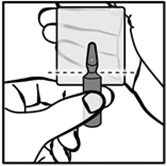
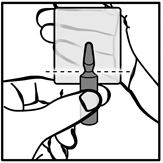
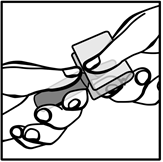
Mode d’emploi pour ouvrir les ampoules de type O.P.C.
|
|
Ampoules du site Haupt Pharma Livron |
Ampoules du site Laboratórios Basi |
|
|
Tenir le corps de l’ampoule d’une main, entre le pouce et l’index replié, la tête de l’ampoule dirigée vers le haut. Tapoter le haut de l’ampoule pour faire descendre l’éventuel liquide prisonnier de la tête de l’ampoule. La rupture de l’ampoule se fera au niveau du rétrécissement entre la tête et le corps de l’ampoule, sous le point coloré où est présent un trait de prédécoupe, comme indiqué par le trait en pointillé sur le schéma (et non au niveau des traits colorés situés sur la tête de l’ampoule). |
Tenir le corps de l’ampoule d’une main, entre le pouce et l’index replié, la tête de l’ampoule dirigée vers le haut. Tapoter le haut de l’ampoule pour faire descendre l’éventuel liquide prisonnier de la tête de l’ampoule. La rupture de l’ampoule se fera au niveau du rétrécissement entre la tête et le corps de l’ampoule, sous le point coloré où est présent un trait de prédécoupe, comme indiqué par le trait en pointillé sur le schéma. |
|
|
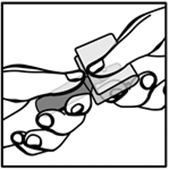
Le point coloré imprimé sur la tête de l’ampoule, doit être dirigé vers le haut et face à vous. Avec la deuxième main recouvrir la tête de l’ampoule d’une compresse, tenir la tête de l’ampoule serrée entre le pouce sur le point coloré et l’index replié, par-dessus la compresse. |
Le point coloré imprimé sur la tête de l’ampoule, doit être dirigé vers le haut et face à vous. Avec la deuxième main recouvrir la tête de l’ampoule d’une compresse, tenir la tête de l’ampoule serrée entre le pouce sur le point coloré et l’index replié, par-dessus la compresse. |
|
|
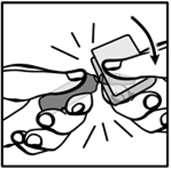
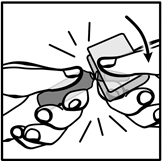
L’ampoule s’ouvre en exerçant une pression avec le pouce (effet de levier) vers le bas en résistant avec l’index opposé replié (point d’appui). Précautions lors de l’ouverture : Les deux mains ne doivent ni s’écarter (effet d’arrachement), ni se rapprocher l’une de l’autre, ni exercer de torsion. La pression appliquée doit être constante et ne doit pas être disproportionnée par rapport à la force que nécessite l’ouverture de l’ampoule. |
L’ampoule s’ouvre en exerçant une pression avec le pouce (effet de levier) vers le bas en résistant avec l’index opposé replié (point d’appui). Précautions lors de l’ouverture : Les deux mains ne doivent ni s’écarter (effet d’arrachement), ni se rapprocher l’une de l’autre, ni exercer de torsion. La pression appliquée doit être constante et ne doit pas être disproportionnée par rapport à la force que nécessite l’ouverture de l’ampoule. |
ou
Mode d’emploi pour ouvrir les ampoules de type scoring
|
|
Ampoules du site Haupt Pharma Livron |
Ampoules du site Laboratórios Basi |
|
|
Tenir le corps de l’ampoule d’une main, entre le pouce et l’index replié, la tête de l’ampoule dirigée vers le haut. Tapoter le haut de l’ampoule pour faire descendre l’éventuel liquide prisonnier de la tête de l’ampoule. La rupture de l’ampoule se fera au niveau du rétrécissement entre la tête et le corps de l’ampoule où est présent un trait de prédécoupe, comme indiqué par le trait en pointillé sur le schéma. |
Tenir le corps de l’ampoule d’une main, entre le pouce et l’index replié, la tête de l’ampoule dirigée vers le haut. Tapoter le haut de l’ampoule pour faire descendre l’éventuel liquide prisonnier de la tête de l’ampoule. La rupture de l’ampoule se fera au niveau du rétrécissement entre la tête et le corps de l’ampoule où est présent un trait de prédécoupe, comme indiqué par le trait en pointillé sur le schéma. |
|
|
Avec la deuxième main recouvrir la tête de l’ampoule d’une compresse, tenir la tête de l’ampoule serrée entre le pouce et l’index replié, par-dessus la compresse. |
Avec la deuxième main recouvrir la tête de l’ampoule d’une compresse, tenir la tête de l’ampoule serrée entre le pouce et l’index replié, par-dessus la compresse. |
|
|
L’ampoule s’ouvre en exerçant une pression avec le pouce (effet de levier) vers le bas en résistant avec l’index opposé replié (point d’appui). Précautions lors de l’ouverture : Les deux mains ne doivent ni s’écarter (effet d’arrachement), ni se rapprocher l’une de l’autre, ni exercer de torsion. La pression appliquée doit être constante et ne doit pas être disproportionnée par rapport à la force que nécessite l’ouverture de l’ampoule. |
L’ampoule s’ouvre en exerçant une pression avec le pouce (effet de levier) vers le bas en résistant avec l’index opposé replié (point d’appui). Précautions lors de l’ouverture : Les deux mains ne doivent ni s’écarter (effet d’arrachement), ni se rapprocher l’une de l’autre, ni exercer de torsion. La pression appliquée doit être constante et ne doit pas être disproportionnée par rapport à la force que nécessite l’ouverture de l’ampoule. |
Dans le cas où l'ampoule ne se casserait pas correctement (présence de particules de verre), celle-ci ne doit pas être utilisée.
Durée du traitement
Se conformer à l'ordonnance de votre médecin.
Si vous avez utilisé plus de VITAMINE B12 GERDA 1000 µg/4 ml, solution injectable (IM) et buvable que vous n’auriez dû
Sans objet.
Si vous oubliez d’utiliser VITAMINE B12 GERDA 1000 µg/4 ml, solution injectable (IM) et buvable
Sans objet.
Si vous arrêtez d’utiliser VITAMINE B12 GERDA 1000 µg/4 ml, solution injectable (IM) et buvable
Sans objet.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
Comme tous les médicaments, ce médicament peut provoquer des effets indésirables, mais ils ne surviennent pas systématiquement chez tout le monde.
La fréquence de ces effets indésirables est indéterminée (ne peut être estimée sur la base des données disponibles).
Interrompez votre traitement et consultez immédiatement votre médecin si vous observez une réaction allergique. Elle peut se manifester notamment par des démangeaisons, une urticaire, un eczéma, une rougeur de la peau, un œdème (gonflement), pouvant être sévères, un œdème généralisé, un brusque gonflement du visage et du cou (œdème de Quincke), voire un malaise intense et brutal avec chute de la pression artérielle (choc).
· Acné
· Coloration en rouge des urines (due à l’élimination urinaire de la vitamine B12)
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : www.signalement-sante.gouv.fr
En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.
5. COMMENT CONSERVER VITAMINE B12 GERDA 1000 µg/4 ml, solution injectable (IM) et buvable ?
Tenir ce médicament hors de la vue et de la portée des enfants.
N’utilisez pas ce médicament après la date de péremption indiquée sur le conditionnement extérieur.
A conserver à l'abri de la lumière.
Après ouverture : le produit doit être utilisé immédiatement.
Ne jetez aucun médicament au tout-à-l’égout ou avec les ordures ménagères. Demandez à votre pharmacien d’éliminer les médicaments que vous n’utilisez plus. Ces mesures contribueront à protéger l’environnement.
6. CONTENU DE L’EMBALLAGE ET AUTRES INFORMATIONS
Ce que contient VITAMINE B12 GERDA 1000 µg/4 ml, solution injectable (IM) et buvable
· La substance active est :
Cyanocobalamine.......................................................................................................... 1000 µg
Pour une ampoule de 4 ml.
· Les autres composants sont :
Acide chlorhydrique concentré, chlorure de sodium, eau pour préparations injectables.
Ce médicament se présente sous forme de solution injectable IM et buvable en ampoule. Boîte de 6 ampoules de 4 ml.
Titulaire de l’autorisation de mise sur le marché
SUBSTIPHARM
24 RUE ERLANGER
75016 PARIS
Exploitant de l’autorisation de mise sur le marché
SUBSTIPHARM
24 RUE ERLANGER
75016 PARIS
HAUPT PHARMA LIVRON
1 RUE COMTE DE SINARD
26250 LIVRON-SUR-DROME
ou
LABORATÓRIOS BASI
INDÚSTRIA FARMACÊUTICA, S.A.
PARQUE INDUSTRIAL MANUEL LOURENÇO FERREIRA
LOTES 8, 15 E 16, MORTÁGUA, 3450-232,
PORTUGAL
Noms du médicament dans les Etats membres de l'Espace Economique Européen
Sans objet.
La dernière date à laquelle cette notice a été révisée est :
[à compléter ultérieurement par le titulaire]
Des informations détaillées sur ce médicament sont disponibles sur le site Internet de l’ANSM (France).