Dernière mise à jour le 01/12/2025
LOCERYLPRO 5 %, vernis à ongles médicamenteux
Indications thérapeutiques
LOCERYLPRO est utilisé pour traiter les mycoses des ongles (infections dues à un champignon), touchant au maximum 2 ongles chez l’adulte. Une mycose se traduit en général par une modification de coloration (blanc, jaune ou brun), et un épaississement de l’ongle, bien que l’aspect puisse varier considérablement.
Si l’infection est limitée à la partie supérieure de l’ongle, comme sur la photo n°1 ci-dessous, suivez les conseils de votre pharmacien. Si l’infection ressemble aux photos n°2 ou 3, vous devez consulter votre médecin.

Présentations
> 1 flacon(s) en verre de 2,5 ml avec spatule(s) intégrée au bouchon avec 30 limes et 30 lingettes nettoyantes.
Code CIP : 34009 300 720 1 1
Déclaration de commercialisation : 06/04/2017
Cette présentation n'est pas agréée aux collectivités
Service médical rendu (SMR)
Amélioration du service médical rendu (ASMR)
Ce médicament étant un générique, l'ASMR n'a pas été évalué par la commission de la transparence (CT), il est possible de se référer à la /aux spécialité(s) de référence du groupe générique auquel appartient ce médicament (cliquez ici pour aller à la rubrique des groupes génériques)
ANSM - Mis à jour le : 27/06/2023
LOCERYLPRO 5%, vernis à ongles médicamenteux
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Quantité correspondant à amorolfine base............................................................................. 5,000 g
Pour 100 ml.
Excipient à effets notoire :
Ce médicament contient 0,552g d’alcool (éthanol) dans chaque gramme de vernis, ce qui équivaut à 55,2% p/p.
Pour la liste complète des excipients, voir rubrique 6.1.
Vernis à ongles médicamenteux.
Liquide incolore à presque incolore.
4.1. Indications thérapeutiques
4.2. Posologie et mode d'administration
Appliquer LOCERYLPRO sur les ongles atteints à la posologie d’une fois par semaine.
Mode d’administration
Pour appliquer le vernis, suivre attentivement les recommandations suivantes :
A. Avant la première application de LOCERYLPRO, faire une toilette soigneuse des ongles. Eliminer toute trace de vernis résiduel avec un dissolvant, limer à l’aide d’une lime la surface de l’ongle (en particulier la zone atteinte), aussi complètement que possible. Prendre la précaution de ne pas limer la peau péri-unguéale.
B. Nettoyer la surface de l’ongle et la dégraisser au moyen d’une des lingettes nettoyantes fournies.
C. Appliquer le vernis à l’aide d’une des spatules réutilisables sur la totalité de l’ongle atteint. Nettoyer la spatule réutilisable entre chaque passage d’un ongle à l’autre avec une des lingettes nettoyantes fournies, afin d’éviter la contamination du vernis. Ne pas essuyer la spatule sur le bord du flacon.
D. Il est important de bien nettoyer la spatule à l’aide d’une des lingettes nettoyantes fournies après chaque application avant de la réutiliser pour un autre ongle afin d’éviter la contamination du vernis.
E. S’il a été déposé du vernis sur l’extérieur du bouchon lors de la manipulation, il est important de le nettoyer à l’aide d’une des lingettes nettoyantes fournies afin d’éviter d’appliquer ce vernis sur la peau.
F. Reboucher hermétiquement le flacon.
Répéter l’ensemble des opérations ci-dessus pour chaque ongle atteint.
Après chaque utilisation de LOCERYLPRO, il est important de se laver les mains. Cependant lors des applications sur les ongles des mains, il est nécessaire d’attendre le séchage complet du vernis avant.
Le traitement doit être conduit sans interruption jusqu’à régénération complète de l’ongle et que les zones atteintes soient complètement guéries.
La durée de traitement est en général de 6 mois pour les ongles des mains et 9 mois pour les ongles des pieds (elle dépend essentiellement de l’intensité, de la localisation de l’infection, du taux de croissance de l’ongle et de la hauteur de l’atteinte de l’ongle).
Après 3 mois d’utilisation en absence d’amélioration, un médecin doit être consulté.
Instructions particulières :
· Ne pas réutiliser les limes à ongles pour des ongles sains.
· Avant chaque nouvelle application, éliminer le vernis résiduel, limer, si nécessaire, les ongles atteints et dans tous les cas, les nettoyer à l’aide d’une des lingettes nettoyantes.
Hypersensibilité à la substance active ou à l’un des excipients mentionnés à la rubrique 6.1.
4.4. Mises en garde spéciales et précautions d'emploi
LOCERYLPRO ne doit pas être appliqué sur la peau autour de l'ongle.
Eviter tout contact de LOCERYLPRO avec les yeux, les oreilles ou les muqueuses.
En l’absence de données cliniques, les enfants ne devraient pas être traités avec LOCERYLPRO.
Le traitement devra être déterminé par un médecin dans les cas suivants : patients atteints de troubles circulatoires périphériques, diabète, maladies du système immunitaire ainsi que ceux présentant une dystrophie de l’ongle ou des ongles gravement endommagés (plus des deux tiers de la plaque unguéale est atteint). Dans ces cas un traitement systémique devrait être envisagé.
Les patients devraient demander un conseil médical avant de commencer le traitement, s’ils présentent des antécédents de blessure, d’affections cutanées comme le psoriasis ou d’autre affection cutanée chronique, d’œdème, de trouble de la respiration (syndrome des ongles jaunes), de douleur au niveau de l’ongle, d’ongles déformés/endommagés ou d’autres symptômes.
Ne pas utiliser de vernis à ongles cosmétique ni des faux ongles durant l’utilisation de LOCERYLPRO. Si des solvants organiques sont manipulés, des gants imperméables doivent être portés, sinon le vernis sera dissous.
Une réaction allergique systémique ou locale pourrait survenir après l'utilisation de ce produit. Si cela arrive, le produit doit être arrêté immédiatement et un avis médical doit être demandé.
Retirez délicatement le produit en utilisant une solution de dissolvant pour ongles.
Le produit ne doit pas être réappliqué.
Ce médicament contient de l’éthanol, ce qui peut entrainer une sensation de brulure sur une peau lésée. L'éthanol est une substance inflammable et ne doit pas être utilisé à proximité d'une flamme, d'une cigarette allumée ou de certains appareils (par exemple les sèche-cheveux).
Précautions d’emploi
En l’absence de données, l’utilisation de LOCERYLPRO n’est pas recommandée chez les patients âgés de moins de 18 ans.
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
4.6. Fertilité, grossesse et allaitement
Il existe des données limitées sur l’utilisation de l’amorolfine chez la femme enceinte et allaitante. Seulement un faible nombre de grossesse exposée à l’amorolfine topique a été rapporté après la mise sur le marché, ainsi le risque potentiel est inconnu.
Les études effectuées chez l’animal ont mis en évidence une toxicité sur la reproduction à fortes doses orales (voir rubrique 5.3).
On ne sait pas si l’amorolfine est excrété dans le lait maternel.
LOCERYLPRO ne doit pas être utilisé durant la grossesse et l’allaitement, sauf en cas de réelle nécessité.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
|
Système Organe Classe |
Fréquence |
Effets indésirables |
|
Affections du système immunitaire |
Fréquence indéterminée (ne peut pas être estimée sur la base des données disponibles)* |
Hypersensibilité (réaction allergique systémique)* |
|
Affections de la peau et du tissu sous-cutané |
Rare (³ 1/10 000, < 1/1 000) |
Anomalie des ongles, décoloration des ongles, ongles cassants (onychoclasie), ongles fragiles (onychorrhexie) |
|
Très rare (< 1/10 000) |
Sensation de brûlure cutanée |
|
|
Fréquence indéterminée (ne peut pas être estimée sur la base des données disponibles)* |
Erythème*, prurit*, dermite de contact*, urticaire*, phlyctène* |
*Données recueillies après la mise sur le marché
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr.
Aucun signe systémique de surdosage n’est attendu après application topique de LOCERYLPRO.
En cas d’ingestion accidentelle, les mesures symptomatiques appropriées doivent être prises.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Classe pharmacothérapeutique : Autres antifongiques à usage topique, code ATC : D01AE16.
LOCERYLPRO est un antimycosique topique. Le principe actif, l’amorolfine, dérivé de la morpholine, appartient à une nouvelle classe chimique d’antimycosiques. Son effet fongistatique et fongicide est fondé sur une altération de la membrane cellulaire fongique dirigée principalement sur la biosynthèse des stérols.
La teneur en ergostérol est réduite. Une accumulation de stérols atypiques conduit à des modifications morphologiques des membranes et organites cellulaires qui provoquent la mort de la cellule fongique.
L’amorolfine possède un large spectre antimycosique. Elle est très efficace contre les agents habituels ou occasionnels d’onychomycoses :
Les levures :
Candida albicans et autres espèces de Candida,
Les dermatophytes :
Trichophyton rubrum, Trichophyton interdigitale et Trichophyton mentagrophytes, autres espèces de Trichophyton,
Epidermophyton floccosum,
Mycrosporum.
Moisissures :
Scopulariopsis.
Les dematiées (champignons noirs) :
Hendersonula, Alternaria, Cladosporium.
Espèces peu sensibles :
Aspergillus, Fusarium, mucorales.
5.2. Propriétés pharmacocinétiques
L’absorption générale du principe actif est négligeable, la concentration plasmatique restant inférieure au seuil de sensibilité, même après un an d’utilisation.
5.3. Données de sécurité préclinique
Des études de toxicologie sur la reproduction réalisées sur des animaux de laboratoire ont donné des preuves de tératogénicité, d’embryotoxicité et de foetotoxicité mais ces effets ont été observés à une exposition excédant de loin l'exposition humaine ; ce qui indique qu’aucun risque n’est attendu pour les femmes enceintes. Le potentiel génotoxique de l’amorolfine a été évalué in vitro et in vivo. Aucun potentiel génotoxique n'a été observé.
Aucune étude de cancérogénicité n'a été menée.
L'administration topique d’amorolfine sous forme de vernis à ongles à l’animal a montré une toxicité cutanée sous conditions occlusives. L’amorolfine sous forme de vernis à ongles n'a pas induit de sensibilisation.
Après 1ère ouverture, 6 mois de conservation.
6.4. Précautions particulières de conservation
A conserver à l’abri de la chaleur.
Reboucher hermétiquement le flacon après l’utilisation.
6.5. Nature et contenu de l'emballage extérieur
Flacon en verre de couleur ambre de type I avec pas de vis et bouchon en plastique
Ou
Flacon en verre de couleur ambre de type III avec pas de vis et bouchon en plastique contenant une spatule intégrée
1,25 ml ou 2,5 ml en flacon verre avec accessoires (limes, lingettes nettoyantes, applicateur).
Toutes les présentations peuvent ne pas être commercialisées.
6.6. Précautions particulières d’élimination et de manipulation
Pas d’exigences particulières.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
Tour Europlaza - La Défense 4
20, avenue André Prothin
92927 LA DEFENSE Cedex
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· 34009 397 176 7 8 : Flacon de verre de 2,5 ml avec rajout d’accessoires (30 limes, 30 lingettes nettoyantes, 30 spatules).
· 34009 300 720 1 1 : Flacon de verre de 2,5 ml contenant une spatule intégrée au bouchon avec 30 limes et 30 lingettes nettoyantes.
· 34009 300 720 0 4 : Flacon de verre de 1,25 ml contenant une spatule intégrée au bouchon avec 30 limes et 30 lingettes nettoyantes.
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
[à compléter ultérieurement par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE
[à compléter ultérieurement par le titulaire]
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Médicament non soumis à prescription médicale.
ANSM - Mis à jour le : 27/06/2023
LOCERYLPRO 5%, vernis à ongles médicamenteux
Amorolfine
Vous devez toujours utiliser ce médicament en suivant scrupuleusement les informations fournies dans cette notice ou par votre médecin ou votre pharmacien.
· Gardez cette notice. Vous pourriez avoir besoin de la relire.
· Adressez-vous à votre pharmacien pour tout conseil ou information.
· Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
· Vous devez vous adresser à votre médecin si vous ne ressentez aucune amélioration ou si vous vous sentez moins bien après 3 mois.
1. Qu'est-ce que LOCERYLPRO 5%, vernis à ongles médicamenteux et dans quels cas est-il utilisé ?
2. Quelles sont les informations à connaître avant d'utiliser LOCERYLPRO 5%, vernis à ongles médicamenteux ?
3. Comment utiliser LOCERYLPRO 5%, vernis à ongles médicamenteux ?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver LOCERYLPRO 5%, vernis à ongles médicamenteux ?
6. Contenu de l’emballage et autres informations.
1. QU’EST-CE QUE LOCERYLPRO 5%, vernis à ongles médicamenteux ET DANS QUELS CAS EST-IL UTILISE ?
LOCERYLPRO est utilisé pour traiter les mycoses des ongles (infections dues à un champignon), touchant au maximum 2 ongles chez l’adulte. Une mycose se traduit en général par une modification de coloration (blanc, jaune ou brun), et un épaississement de l’ongle, bien que l’aspect puisse varier considérablement.
Si l’infection est limitée à la partie supérieure de l’ongle, comme sur la photo n°1 ci-dessous, suivez les conseils de votre pharmacien. Si l’infection ressemble aux photos n°2 ou 3, vous devez consulter votre médecin.

2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT D’UTILISER LOCERYLPRO 5%, vernis à ongles médicamenteux ?
N’utilisez jamais LOCERYLPRO 5%, vernis à ongles médicamenteux :
· si vous êtes allergique (hypersensible) à l’amorolfine ou à l’un des autres composants contenus dans ce médicament, mentionnés dans la rubrique 6.
· si vous avez moins de 18 ans.
Avertissements et précautions
· Ne pas appliquer LOCERYLPRO sur la peau autour de l’ongle
· Eviter tout contact avec les yeux, les oreilles ou les muqueuses.
· En l’absence de donnée clinique, les enfants ne devraient pas être traités avec LOCERYLPRO.
· Demandez l’avis de votre médecin ou de votre pharmacien :
o si vous avez du diabète,
o si vous êtes traité pour une maladie du système immunitaire (maladie diminuant les défenses de l’organisme),
o si vous avez une mauvaise circulation au niveau des mains ou des pieds,
o si vous avez des antécédents de blessure au niveau de l'ongle, d'affection cutanée comme le psoriasis, d'autres affections cutanées chroniques, d’œdème, d’ongles jaunis associés à des troubles de la respiration, de douleur au niveau des ongles, des ongles déformés/endommagés ou d’autre anomalie autour de votre ongle.
o si votre ongle est gravement endommagé (plus des deux tiers de l’ongle est atteint) ou infecté. Dans ces cas, votre médecin pourrait éventuellement ajouter un traitement oral en plus de votre vernis médicamenteux.
· Ne pas utiliser de vernis à ongles cosmétique ni des faux ongles durant l’utilisation de LOCERYLPRO. Si des solvants organiques sont manipulés, des gants imperméables doivent être portés, sinon le vernis sera dissous.
· Ce produit contient de l’éthanol (alcool). Une utilisation trop fréquente ou une mauvaise application peuvent provoquer une irritation et une sécheresse de la peau entourant l’ongle.
· Tous les médicaments peuvent provoquer des réactions allergiques; bien que la plupart soient légers, certains peuvent être sérieux. Si cela arrive, arrêtez d'appliquer le produit, retirez immédiatement le produit avec un dissolvant de vernis à ongles ou les tampons nettoyants fournis avec l'emballage et consultez un médecin. Le produit ne doit pas être réappliqué.
Vous devez recevoir une aide médicale urgente si vous présentez l'un des symptômes suivants:
o Vous avez des difficultés à respirer
o Votre visage, vos lèvres, votre langue ou votre gorge gonflent
o Votre peau développe une éruption cutanée sévère
Enfants
Sans objet.
Autres médicaments et LOCERYLPRO 5%, vernis à ongles médicamenteux
Informez votre médecin ou pharmacien si vous utilisez, avez récemment utilisé ou pourriez utiliser tout autre médicament.
LOCERYLPRO 5%, vernis à ongles médicamenteux avec des aliments
Sans objet.
Il existe des données limitées sur l’utilisation de l’amorolfine chez la femme enceinte et allaitante.
LOCERYLPRO ne doit pas être utilisé durant la grossesse et l’allaitement, sauf en cas de réelle nécessité.
Si vous êtes enceinte ou que vous allaitez, si vous pensez être enceinte ou planifiez une grossesse, demandez conseil à votre médecin ou à votre pharmacien avant de prendre tout médicament.
Conduite de véhicules et utilisation de machines
Sans objet.
LOCERYLPRO 5%, vernis à ongles médicamenteux contient de l’éthanol, une substance inflammable, et ne doit pas être utilisé à proximité d’une flamme, d’une cigarette allumée ou de certains appareils (par exemple les sèche-cheveux).
3. COMMENT UTILISER LOCERYLPRO 5%, vernis à ongles médicamenteux ?
Avant de commencer le traitement
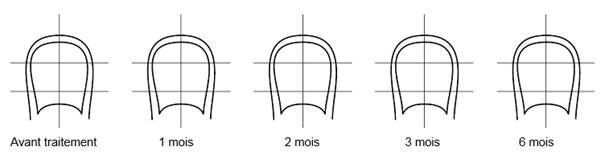
Sur le schéma ci-dessous, hachurez la surface de l’ongle atteinte par l’infection. Ceci vous aidera à vous souvenir de l’aspect initial de votre ongle lorsque vous évaluerez l’efficacité du traitement. Tous les 3 mois, hachurez la surface atteinte jusqu’à ce que l’ongle infecté ait complètement repoussé. Si deux ongles sont touchés, sélectionnez-le plus atteint. Emportez cette notice pour demander l’avis de votre pharmacien ou de votre médecin.
Posologie
Les ongles doivent être traités une fois par semaine.
Vous devez poursuivre le traitement jusqu’à la repousse totale de l’ongle sain soit environ 6 mois pour les ongles des mains, et pendant 9 à 12 mois pour les ongles des pieds.
Les ongles poussant lentement, il faut 2 à 3 mois avant de voir une amélioration. Il est important de continuer à utiliser le vernis jusqu’à la disparition de l’infection et la repousse totale d’un ongle sain.
Cependant, si vous n’observez pas d’amélioration après 3 mois d’utilisation, vous devez consulter un médecin.
Mode d’administration
Les étapes suivantes doivent être respectées scrupuleusement pour traiter chaque ongle :
|
|
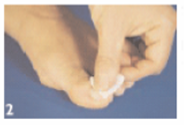
Etape 1 : préparation de l’ongle Eliminez d’éventuelles couches des vernis précédentes à l’aide d’un dissolvant. A l’aide d’une lime neuve, limez toute la surface de l’ongle et en particulier la partie infectée. ATTENTION : n’utilisez jamais la même lime pour les ongles sains afin d’éviter de propager l’infection. Faites attention que personne d’autre n’utilise vos limes. |
|
|
Etape 2 : nettoyage de l’ongle Utilisez l’une des lingettes nettoyantes fournies dans la boîte pour nettoyer l’ongle. Gardez-la pour nettoyer la spatule plus tard.
|
|
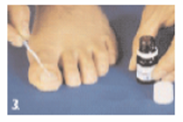
|
Etape 3 : traitement de l’ongle Plongez la spatule dans le flacon de vernis. Le vernis ne doit pas être essuyé sur le bord du flacon. Appliquez le vernis largement, sur toute la surface de l’ongle. Laissez sécher pendant environ 3 minutes. |
Répétez l’ensemble des opérations ci-dessus pour chaque ongle infecté.
Avant d’utiliser le flacon la fois suivante, éliminez les couches de vernis résiduel, limez l’ongle de nouveau. Re-nettoyez avec la lingette et réappliquez le vernis comme expliqué ci-dessus.
Après chaque application de LOCERYLPRO
· Pour éviter de contaminer les autres ongles, la spatule doit être nettoyée soigneusement avec la lingette. Utilisez la lingette que vous avez utilisée pour nettoyer l’ongle. Ne touchez pas les ongles traités avec la lingette.
· Eliminez, à l’aide de l’une des lingettes fournies, le vernis éventuellement présent sur l’extérieur du bouchon.
· Refermez soigneusement le flacon.
· Jetez la lingette avec précaution car elle est inflammable.
· Lavez-vous soigneusement les mains. Cependant, lors des applications sur les ongles des mains, attendez le séchage complet du vernis avant.
Attention
· N’utilisez pas de faux ongles pendant toute la durée du traitement.
· Attendez que le vernis soit sec pour vous laver les mains ou les pieds selon les cas. En effet, lorsque le vernis est sec, il résiste à l’eau et au savon : vous pouvez donc laver vos mains et vos pieds normalement.
Durée d’utilisation
Il est important de continuer à utiliser le vernis jusqu’à ce que l’infection soit guérie et qu’un nouvel ongle sain ait repoussé. Ceci demande environ 6 mois pour les mains et 9 à 12 mois pour les pieds. Vous verrez apparaître l’ongle sain et disparaître l’ongle malade.
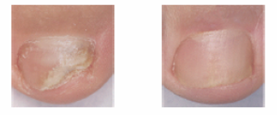
Avant traitement Après traitement
Si vous n’observez pas d’amélioration après 3 mois d’utilisation, vous devez consulter un médecin.
Important
· Si vous recevez du vernis LOCERYLPRO 5% dans les yeux ou les oreilles, lavez-les immédiatement à l’eau et contactez immédiatement votre médecin, votre pharmacien ou l’hôpital le plus proche.
· Evitez le contact du vernis avec les muqueuses (par exemple la bouche et les narines). Ne respirez pas le vernis.
· Si vous, ou quelqu’un d’autre, avale accidentellement du vernis, contactez immédiatement votre médecin, votre pharmacien ou l’hôpital le plus proche.
Si vous avez utilisé plus de LOCERYLPRO 5%, vernis à ongles médicamenteux que vous n’auriez dû
Sans objet.
Si vous oubliez d’utiliser LOCERYLPRO 5%, vernis à ongles médicamenteux
Si vous arrêtez d’utiliser LOCERYLPRO 5%, vernis à ongles médicamenteux
Sans objet.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
Des cas d’anomalies de l’ongle ont été rapportés (ongle décoloré, ongle fragile ou ongle cassant) et des cas de sensation de brûlure cutanée et des allergies de contact.
Cependant, ces anomalies peuvent être liées directement à la maladie de l’ongle.
Effets indésirables rares (touchant moins de 1 personne sur 1 000) :
Ongles abîmés, décoloration de l’ongle, ongle fragile ou cassant
Effets indésirables très rares (touchant moins de 1 personne sur 10 000) :
Sensation de brûlure de la peau
Effets indésirables de fréquence d’apparition non connue (ne peut être déterminée avec les données disponibles) :
Réaction allergique systémique (une réaction allergique grave pouvant être associée à un gonflement du visage, des lèvres, de la langue ou de la gorge, une difficulté à respirer et / ou une éruption cutanée sévère)
Rougeurs, démangeaisons, urticaires (éruptions cutanées), vésicules cutanées, allergies de contact
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr
En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.
5. COMMENT CONSERVER LOCERYLPRO 5%, vernis à ongles médicamenteux ?
Tenir ce médicament hors de la vue et de la portée des enfants.
Ne pas utiliser ce médicament après la date de péremption mentionnée sur l’emballage et le flacon après EXP. La date de péremption fait référence au dernier jour de ce mois.
Après 1ère ouverture, 6 mois de conservation.
Ce médicament doit être conservé à l’abri de la chaleur. Reboucher hermétiquement le flacon après usage.
Ne jetez aucun médicament au tout-à-l’égout ni avec les ordures ménagères. Demandez à votre pharmacien d’éliminer les médicaments que vous n’utilisez plus. Ces mesures contribueront à protéger l’environnement.
6. CONTENU DE L’EMBALLAGE ET AUTRES INFORMATIONS
Ce que contient LOCERYLPRO 5%, vernis à ongles médicamenteux
· La substance active est :
Chlorhydrate d’amorolfine............................................................................................... 5,574 g
Quantité correspondant à amorolfine base....................................................................... 5,000 g
Pour 100 ml.
· Les autres composants sont :
Copolymère d’ammonio-méthacrylate de type A (EUDRAGIT RL 100), triacétine, acétate de butyle, acétate d’éthyle, éthanol absolu.
Qu’est-ce que LOCERYLPRO 5%, vernis à ongles médicamenteux et contenu de l’emballage extérieur
Ce médicament se présente sous forme de vernis à ongles médicamenteux.
Flacon de 1,25 ml ou 2,5 ml avec spatule intégrée dans le bouchon ou spatules séparées, lingettes nettoyantes et limes.
Titulaire de l’autorisation de mise sur le marché
Tour Europlaza - La Défense 4
20, avenue André Prothin
92927 LA DEFENSE Cedex
Exploitant de l’autorisation de mise sur le marché
Tour Europlaza - La Défense 4
20, avenue André Prothin
92927 LA DEFENSE Cedex
Z.I. MONTDESIR
74540 ALBY SUR CHERAN
Noms du médicament dans les Etats membres de l'Espace Economique Européen
Ce médicament est autorisé dans les Etats membres de l'Espace Economique Européen sous les noms suivants : Conformément à la réglementation en vigueur.
[À compléter ultérieurement par le titulaire]
La dernière date à laquelle cette notice a été révisée est :
[à compléter ultérieurement par le titulaire]
Des informations détaillées sur ce médicament sont disponibles sur le site Internet de l’ANSM (France).
{Conseil d’éducation sanitaire : }
La mycose des ongles (onychomycose) : quels sont les facteurs de risque ?
· microtraumatismes répétés de l’ongle ou des pieds, malposition des orteils,
· port de chaussures fermées et/ou en matières plastiques ou de chaussettes en tissu synthétique, qui favorisent la macération,
· professions exposées nécessitant le port de bottes, de chaussures de protection qui facilitent la transpiration,
· sports à risque surtout pratiqués pieds nus : natation, judo, marathon.
Pour les ongles des mains :
· Présence d’une mycose des pieds (appelée dermatophytose) à rechercher.
· Contacts répétés avec l’eau (qui peut provoquer un type de mycose appelée candidose),
· Traumatisme ou irritation de l’ongle par :
o microtraumatismes répétés (jardinage ),
o utilisation manuelle de détergent (lessive et autres produits corrosifs),
o professions exposées (coiffeur, manucure, podologue).
La mycose des ongles (onychomycose) : comment prévenir et éviter la contamination ?
· Désinfectez les chaussettes et les chaussures. Demandez conseil à votre pharmacien si nécessaire.
· Traitez toute atteinte cutanée (de la peau) entre les orteils et plantaire (sous les pieds) le plus rapidement possible.
· Utilisez des serviettes individuelles afin d’éviter la contamination des autres personnes.
· Séchez minutieusement les espaces inter-orteils et l’ensemble des pieds après la douche ou le bain afin d’éviter la contamination des autres ongles et de la peau.
La mycose des ongles (onychomycose) : pourquoi est-il important de bien suivre le traitement ?
Pour être efficace, le traitement doit être pris pendant toute la durée prévue jusqu’à la repousse complète de l’ongle, sans interruption.
NE PAS SE DECOURAGER !
· Cela peut prendre 6 mois pour les ongles des mains et 9 à 12 mois pour les ongles de pieds.
· Tous les traitements sont longs, car c’est le temps de la repousse de l’ongle sain qui montre l’efficacité.
Pour toute autre information concernant les onychomycoses.