Dernière mise à jour le 02/02/2026
DEXAMETHASONE MEDISOL 20 mg/5 ml, solution injectable
Indications thérapeutiques
Classe pharmacothérapeutique - code ATC H02AB02 : CORTICOÏDES A USAGE SYSTEMIQUE NON ASSOCIES
La substance active contenue dans ce médicament est la dexaméthasone qui est un corticoïde de synthèse. La dexaméthasone est indiquée dans certaines maladies, où elle est utilisée pour son effet anti-inflammatoire.
II peut être utilisé en injection locale, en dermatologie et en rhumatologie.
Présentations
> 10 ampoule(s) en verre de 5 ml
Code CIP : 34009 302 180 4 4
Déclaration de commercialisation : 22/02/2021
Cette présentation est agréée aux collectivités
Service médical rendu (SMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprès de la HAS (plus d'informations dans l'aide). Les avis et synthèses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur du SMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| Important | Avis du 02/06/2021 | Extension d'indication | Le service médical rendu par DEXAMETHASONE MEDISOL (dexaméthasone) est important dans la nouvelle indication de l’AMM à savoir le traitement de l’infection à coronavirus SARS-COV-2 2019 (COVID-19) chez les adultes et les adolescents (âgés de 12 ans et pesant plus de 40 kg) qui nécessite une oxygénothérapie. |
| Important | Avis du 19/05/2021 | Modification des conditions d'inscription (CT) | Le service médical rendu par les spécialités DEXAMETHASONE MEDISOL (dexaméthasone), solution injectable est important dans les indications de l’AMM. |
Amélioration du service médical rendu (ASMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprés de la HAS (plus d'informations dans l'aide). Les avis et synthéses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur de l'ASMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| III (Modéré) | Avis du 02/06/2021 | Extension d'indication | Compte tenu : • de la démonstration de la supériorité de l’ajout de la dexaméthasone (6 mg une fois par jour per os ou IV pendant 10 jours) aux soins standards par rapport aux soins standards seuls sur la réduction de la mortalité toute cause à J28 (critère de jugement principal) chez des patients hospitalisés ayant besoin d'une oxygénothérapie, dans une étude académique anglaise (RECOVERY) : o avec une quantité d’effet cliniquement pertinente sur la réduction relative du risque de décès de 17 % (HR = 0,83 [0,75 . 0,93] . p < 0,001), o avec un impact sur la sortie d’hospitalisation dans les 28 jours (critère de jugement secondaire) : 67,2 % versus 63,5 % (HR = 1,10 [1,03 . 1,17]) . • des données issues de la méta-analyse de l’OMS qui confortent l’intérêt de la corticothérapie systématique en particulier la dexaméthasone chez les patients atteints de forme critique de COVID-19 en termes de réduction de la mortalité (OR = 0,66 [0,53 . 0,82] . p < 0,001) . • de l’usage déjà établi de la corticothérapie systémique dans le traitement des formes sévères de COVID-19, seul et unique traitement à avoir démontré son impact sur la réduction de la mortalité dans la COVID-19 . la Commission considère que les spécialités DEXAMETHASONE MEDISOL (dexaméthasone) apporte une amélioration du service médical rendu modérée (ASMR III), au même titre que les spécialités DEXAMETHASONE MYLAN, DEXAMETHASONE KRKA et DEXAMETHASONE PANPHARMA dans la prise en charge des patients adultes et adolescents (âgés de 12 ans et plus avec un poids corporel d'au moins 40 kg) atteints de la COVID-19 qui nécessitent une oxygénothérapie complémentaire. |
| V (Inexistant) | Avis du 19/05/2021 | Modification des conditions d'inscription (CT) | Les spécialités DEXAMETHASONE MEDISOL (dexaméthasone), solution injectable n’apporte pas d’amélioration du service médical rendu (ASMR V) par rapport aux spécialités à base de dexaméthasone déjà inscrites. |
ANSM - Mis à jour le : 10/03/2025
DEXAMETHASONE MEDISOL 20 mg/5 ml, solution injectable
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Phosphate sodique de dexaméthasone
Quantité correspondant en phosphate de dexaméthasone................................................... 20,00 mg
Pour une ampoule de 5 ml.
Pour la liste complète des excipients, voir rubrique 6.1.
Solution injectable.
Solution limpide
pH : 7,8-8,2, osmolalité : 140 -200 mOsmol/kg
4.1. Indications thérapeutiques
Les indications sont :
· celles de la corticothérapie générale per os, lorsque la voie parentérale est nécessaire en cas d'impossibilité de la voie orale (vomissements, aspiration gastrique, troubles de la conscience) ;
· les affections nécessitant un effet thérapeutique rapide :
Allergiques :
· œdème de Quincke sévère en complément des anti-histaminiques,
· choc anaphylactique en complément de l’adrénaline.
Infectieuses :
· fièvre typhoïde sévère, en particulier avec confusion mentale, choc, coma,
· laryngite striduleuse (laryngite sous-glottique) chez l'enfant,
· Infection à coronavirus SARS-COV-2 2019 (COVID-19) chez les adultes et les adolescents (âgés de 12 ans et pesant plus de 40 kg) qui nécessite une oxygénothérapie.
Neurologiques :
· œdème cérébral (tumeurs, abcès à toxoplasme...)
ORL:
· dyspnée laryngée.
USAGE LOCAL
Ce sont celles de la corticothérapie locale, lorsque l'affection justifie une forte concentration locale. Toute prescription d'injection locale doit faire la part du danger infectieux notamment du risque de favoriser une prolifération bactérienne.
Ce produit est indiqué dans les affections :
Dermatologiques :
· cicatrices chéloïdes,
Rhumatologiques :
· injections péri-articulaires : tendinites, bursites,
· injections des parties molles : talalgies, syndrome du canal carpien, maladie de Dupuytren.
4.2. Posologie et mode d'administration
Cette spécialité n'est pas adaptée à l'administration par voie inhalée par nébulisateur.
Equivalence anti-inflammatoire (équipotence) pour 5 mg de prednisone : 0,75 mg de dexaméthasone.
Posologie
Usage systémique
INJECTIONS I.V. OU I.M.
La posologie est variable en fonction du diagnostic, de la sévérité de l'affection, du pronostic, de la réponse du patient et de la tolérance au traitement.
Cette solution peut être diluée dans une solution de chlorure de sodium ou de glucose.
Lorsqu'il est associé à une solution à perfuser, le mélange doit être utilisé dans les 24 heures.
La posologie initiale peut varier de 2 à 20 mg/j, selon le type de maladie à traiter.
L'éventail de posologie par voie parentérale est habituellement de 1/3 à 1/2 des doses orales administrées toutes les 12 heures.
Traitement de la COVID-19
Adultes : 6 mg par voie intraveineuse, une fois par jour pour une durée maximum de 10 jours.
Adolescents (âgés de 12 ans et plus et pesant plus de 40 kg) : 6 mg par voie intraveineuse, une fois par jour pour une durée maximum de 10 jours.
La durée de traitement sera déterminée au cas par cas en fonction de l’état clinique du patient.
Patients âgés, insuffisance rénale, insuffisance hépatique :
Aucun ajustement posologique n’est nécessaire.
En cas d'œdème cérébral :
D'abord 10 mg (2,5 ml) en I.V. puis 4 mg (1 ml) en I.M., toutes les 6 heures jusqu'à régression de la symptomatologie de l'œdème cérébral. On obtient habituellement un résultat thérapeutique en 12 à 24 heures.
Des doses élevées sont recommandées pour débuter un traitement intensif à court terme dans le cas d'œdème cérébral aigu mettant en danger la vie du malade.
Schéma posologique recommandé à fortes doses dans l'œdème cérébral :
|
Voie I.V. |
Posologie initiale |
J1 à J3 |
J4 |
J5 à J8 |
Ensuite diminuer de |
|
Adultes |
50 mg |
8 mg/2h |
4 mg/2h |
4 mg/4h |
4 mg/jour |
|
Enfants (>35 kg) |
25 mg |
4 mg/2h |
4 mg/4h |
4 mg/6h |
2 mg/jour |
|
Enfants (<35 kg) |
20 mg |
4 mg/3h |
4 mg/6h |
2 mg/6h |
1 mg/jour |
Modalités d’arrêt du traitement
En cas de traitement prolongé ou à forte dose, la posologie doit être réduite progressivement avant arrêt du traitement.
USAGE LOCAL
A titre indicatif, exemples de doses uniques habituellement utilisées :
|
|
en ml |
en mg |
|
Bourses séreuses |
0,5 - 0,75 |
2 - 3 |
|
Gaines tendineuses |
0,1 - 0,25 |
0,4 - 1 |
|
Infiltration des parties molles |
0,5 - 1,5 |
2 - 6 |
La fréquence des injections varie de une tous les 3 à 5 jours, à une toutes les 2 à 3 semaines.
Ce médicament est généralement contre-indiqué dans les situations suivantes (il n'existe toutefois aucune contre-indication absolue pour une corticothérapie d'indication vitale) :
· tout état infectieux à l'exclusion des indications spécifiées (voir rubrique 4.1),
· certaines viroses en évolution (notamment hépatites, herpès, varicelle, zona),
· états psychotiques encore non contrôlés par un traitement,
· vaccins vivants (voir rubrique 4.5),
· hypersensibilité à la substance active ou à l’un des excipients mentionnés à la rubrique 6.1,
· troubles de la coagulation, traitement anticoagulant en cours en cas d'injection intramusculaire (contre-indication liée à la voie d'administration IM),
· en association avec la rilpivirine, sauf en cas de traitement à dose unique de DEXAMETHASONE MEDISOL (voir rubrique 4.5).
USAGE LOCAL
Ce médicament est contre-indiqué dans les situations suivantes :
· infection locale ou générale, ou suspicion d'infection,
· troubles sévères de la coagulation, traitement anticoagulant en cours,
· hypersensibilité à l'un des constituants.
4.4. Mises en garde spéciales et précautions d'emploi
Chez les patients atteints de la COVID-19 mais ne nécessitant pas d’oxygénothérapie, la corticothérapie systémique (orale) en cours pour d’autres pathologies (p. ex., une bronchopneumopathie chronique obstructive) ne doit pas être interrompue.
L'attention est attirée chez les sportifs, cette spécialité contenant un principe actif pouvant induire une réaction positive des tests pratiqués lors des contrôles antidopages.
Il est prévu que l’administration concomitante d’inhibiteurs du CYP3A, y compris de produits contenant du cobicistat, augmente le risque d’effets secondaires systémiques. L’association doit être évitée, sauf si les bénéfices sont supérieurs au risque accru d’effets secondaires systémiques des corticostéroïdes; dans ce cas, les patients doivent être surveillés en vue de détecter les éventuels effets secondaires systémiques des corticostéroïdes.
Au cours de l'expérience de post-commercialisation, un syndrome de lyse tumorale (SLT) a été signalé chez des patients présentant des tumeurs malignes hématologiques après l'utilisation de la dexaméthasone seule ou en association avec d'autres agents chimiothérapeutiques. Le patient à haut risque de SLT, comme les patients avec un taux élevé de prolifération, une charge tumorale élevée et une sensibilité élevée aux agents cytotoxiques, doit être surveillé étroitement et une précaution appropriée doit être prise.
Troubles visuels
Des troubles visuels peuvent apparaitre lors d'une corticothérapie par voie systémique ou locale. En cas de vision floue ou d'apparition de tout autre symptôme visuel apparaissant au cours d'une corticothérapie, un examen ophtalmologique est requis à la recherche notamment d'une cataracte, d'un glaucome, ou d'une lésion plus rare telle qu'une choriorétinopathie séreuse centrale, décrits avec l'administration de corticostéroïdes par voie systémique ou locale.
Population pédiatrique
Chez les nouveau-nés prématurés, les données disponibles suggèrent des effets indésirables sur le développement neurologique à long terme après un traitement précoce (initié dans les premières 96 heures qui suivent la naissance) des nouveau-nés prématurés atteints de maladie pulmonaire chronique à des doses de départ de 0,25 mg/kg deux fois par jour.
Cardiomyopathie hypertrophique
Une cardiomyopathie hypertrophique a été rapportée après une administration systémique de corticostéroïdes incluant de la dexaméthasone à des nourrissons prématurés. Dans la majorité des cas signalés, cette situation était réversible à l’arrêt du traitement. Chez les nourrissons prématurés traités par dexaméthasone systémique, une évaluation diagnostique et une surveillance de la fonction et de la structure cardiaques doivent être réalisées (rubrique 4.8).
Crise de phéochromocytome :
Une crise de phéochromocytome, qui peut être fatale, a été rapportée après l'administration de corticostéroïdes systémiques. Les corticostéroïdes ne doivent être administrés aux patients présentant un phéochromocytome suspecté ou identifié qu'après une évaluation appropriée du rapport bénéfice/risque.
USAGE SYSTEMIQUE
Mises en garde
De rares cas de réactions de type anaphylactique étant survenus chez des patients traités par une corticothérapie parentérale, une attention particulière sera portée avant toute administration chez des sujets présentant un terrain atopique.
En cas d'ulcère gastro-duodénal, la corticothérapie n'est pas contre-indiquée si un traitement anti-ulcéreux est associé.
En cas d'antécédents ulcéreux, la corticothérapie peut être prescrite avec une surveillance clinique et, au besoin, après fibroscopie.
Un traumatisme crânien par lui-même, quelle qu’en soit la gravité, ne représente pas une indication d’administration de corticoïdes par voie injectable. Les résultats d’une étude multicentrique, randomisée contrôlée versus placebo ont montré une augmentation de la mortalité précoce (à deux semaines) et tardive (à six mois) après un traumatisme crânien chez les patients recevant de l’hémisuccinate de méthylprednisolone, comparé au groupe placebo. Les causes de la surmortalité dans le groupe méthylprednisolone n’ont pas été établies.
La corticothérapie peut favoriser la survenue de diverses complications infectieuses dues notamment à des bactéries, des levures et des parasites. La survenue d'une anguillulose maligne est un risque important. Tous les sujets venant d'une zone d'endémie (régions tropicale, subtropicale, sud de l'Europe) doivent avoir un examen parasitologique des selles et un traitement éradicateur systématique avant la corticothérapie.
Les signes évolutifs d'une infection peuvent être masqués par la corticothérapie.
Il importe, avant la mise en route du traitement, d'écarter toute possibilité de foyer viscéral, notamment tuberculeux, et de surveiller, en cours de traitement, l'apparition de pathologies infectieuses.
En cas de tuberculose ancienne, un traitement prophylactique anti-tuberculeux est nécessaire s'il existe des séquelles radiologiques importantes et si l'on ne peut s'assurer qu'un traitement bien conduit de 6 mois par la rifampicine a été donné.
L'emploi des corticoïdes nécessite une surveillance particulièrement adaptée, notamment chez les sujets âgés et en cas de colites ulcéreuses (risque de perforation), diverticulites, anastomoses intestinales récentes, insuffisance rénale, insuffisance hépatique, ostéoporose, myasthénie grave.
Ce médicament est généralement déconseillé en association avec le mifamurtide et l’acide acétylsalicylique à des doses anti-inflammatoires (>= 1g par prise et/ou >= 3g par jour) (voir rubrique 4.5).
Précautions d’emploi
Un traitement par voie orale sera institué en relais dès que possible.
Une rétention hydrosodée est habituelle, responsable en partie d'une élévation éventuelle de la pression artérielle. L'apport sodé sera réduit.
La supplémentation potassique n'est justifiée que pour des traitements à fortes doses, prescrits pendant une longue durée ou en cas de risque de troubles du rythme ou d'associations à un traitement hypokaliémiant.
Lorsque la corticothérapie est indispensable, le diabète et l'hypertension artérielle ne sont pas des contre-indications mais le traitement peut entraîner leur déséquilibre. Il convient de réévaluer leur prise en charge.
Les patients doivent éviter le contact avec des sujets atteints de varicelle ou de rougeole.
Syndrome de sevrage à l’arrêt du traitement : l'arrêt brusque du traitement peut entraîner un risque de dépression des fonctions surrénaliennes en cas de traitement prolongé ou à forte dose. Par conséquent, la dose doit être réduite progressivement si le traitement doit être interrompu.
USAGE LOCAL
En l'absence de données concernant le risque de calcification, il est préférable d'éviter l'administration d'un corticoïde en intra-discal.
Du fait d'une diffusion systémique potentielle, il faut prendre en compte certaines contre-indications des corticoïdes par voie générale, en particulier si les injections sont multiples (plusieurs localisations) ou répétées à court terme :
· certaines viroses en évolution (notamment hépatites, herpès, varicelle, zona),
· états psychotiques encore non contrôlés par un traitement,
· vaccins vivants.
La corticothérapie peut favoriser la survenue de diverses complications infectieuses.
Des injections multiples (plusieurs localisations) ou répétées à court terme peuvent entraîner des symptômes cliniques et biologiques d'hypercorticisme.
Il est nécessaire d'observer une asepsie rigoureuse.
L'injection locale de corticoïdes peut déséquilibrer un diabète, un état psychotique, une hypertension artérielle sévère.
L'administration devra être prudente chez les patients à risque élevé d'infection, en particulier les hémodialysés ou les porteurs de prothèse.
Ne pas injecter en intratendineux.
Ce médicament contient moins de 1 mmol par ml (23 mg) de sodium par ampoule, c’est-à-dire qu’il est essentiellement « sans sodium ».
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
Hypokaliémiants
L'hypokaliémie est un facteur favorisant l'apparition de troubles du rythme cardiaque (torsades de pointes, notamment) et augmentant la toxicité de certains médicaments, par exemple la digoxine. De ce fait, les médicaments qui peuvent entraîner une hypokaliémie sont impliqués dans un grand nombre d'interactions. Il s'agit des diurétiques hypokaliémiants, seuls ou associés, des laxatifs stimulants, des glucocorticoïdes, du tétracosactide et de l'amphotéricine B (voie IV).
Associations contre-indiquées (voir rubrique 4.3)
+ Rilpivirine
Avec la dexaméthasone par voie systémique (sauf en cas de traitement à dose unique), risque de diminution des concentrations plasmatiques de rilpivirine par augmentation de son métabolisme hépatique par la dexaméthasone.
+ Vaccins vivants atténués
A l'exception des voies inhalées et locales, et pour des posologies supérieures à 10 mg/j d’équivalent-prednisone (ou > 2 mg/kg/j chez l’enfant ou > 20 mg/j chez l’enfant de plus de 10 kg) pendant plus de deux semaines et pour les « bolus » de corticoïdes : risque de maladie vaccinale généralisée éventuellement mortelle. Ce risque est majoré chez les sujets déjà immunodéprimés par la maladie sous-jacente.
Les vaccins vivants atténués sont contre-indiqués pendant les 3 mois suivant l'arrêt de la corticothérapie.
Utiliser un vaccin inactivé lorsqu'il existe (poliomyélite).
Associations déconseillées (voir rubrique 4.4)
+ Mifamurtide
Risque de moindre efficacité du mifamurtide.
Majoration du risque hémorragique. Une association avec l’acide acétylsalicylique à des doses anti-inflammatoires (>= 1g par prise et/ou >= 3g par jour) est déconseillée.
Associations faisant l'objet de précautions d’emploi
+ Acide acétylsalicylique par voie générale et par extrapolation autres salicylés
Diminution de la salicylémie pendant le traitement par les corticoïdes et risque de surdosage salicylé après son arrêt, par augmentation de l'élimination des salicylés par les corticoïdes.
Adapter les doses de salicylés pendant l'association et après l'arrêt du traitement par les corticoïdes.
+ Substances susceptibles de donner des torsades de pointes (amiodarone, amisulpride, arsenieux, chloroquine, chlorpromazine, citalopram, cocaine, crizotinib, cyamemazine, disopyramide, domperidone, dronedarone, droperidol, erythromycine, escitalopram, flupentixol, fluphenazine, halofantrine, haloperidol, hydroquinidine, hydroxychloroquine, hydroxyzine, levomepromazine, lumefantrine, mequitazine, methadone, moxifloxacine, pentamidine, pimozide, pipamperone, pipéraquine, pipotiazine, quinidine, sotalol, spiramycine, sulpiride, tiapride, toremifene, vandétanib, vincamine, zuclopenthixol)
Risque majoré de troubles du rythme ventriculaire, notamment de torsades de pointes.
Corriger toute hypokaliémie avant d’administrer le produit et réaliser une surveillance clinique, électrolytique et électrocardiographique.
+ Anticoagulants oraux (acenocoumarol, apixaban, dabigatran, édoxaban, fluindione, phenindione, rivaroxaban, warfarine)
Impact éventuel de la corticothérapie sur le métabolisme de l'anticoagulant oral et sur celui des facteurs de la coagulation.
Risque hémorragique propre à la corticothérapie (muqueuse digestive, fragilité vasculaire) à fortes doses ou en traitement prolongé supérieur à 10 jours.
Lorsque l'association est justifiée, renforcer la surveillance : contrôle biologique au 8e jour, puis tous les 15 jours pendant la corticothérapie et après son arrêt.
+ Autres hypokaliémiants (altizide, amphotericine b, bendroflumethiazide, betamethasone, bisacodyl, boldo, bourdaine, bumetanide, cascara, cascara sagrada, chlortalidone, cicletanine, clopamide, cortisone, cortivazol, fludrocortisone, furosemide, hydrochlorothiazide, hydrocortisone, indapamide, methyclothiazide, methylprednisolone, piretanide, prednisolone, prednisone, reglisse, rhubarbe, ricin, ricinus communis, sene, sene de l'inde, sodium (docusate de), sodium (picosulfate de), sodium (ricinoleate de), tetracosactide, triamcinolone)
Risque accru d'hypokaliémie par effet additif.
Surveiller la kaliémie, la corriger si besoin, surtout en cas de thérapeutique digitalique.
+ Digitaliques
Hypokaliémie favorisant les effets toxiques des digitaliques.
Surveiller la kaliémie, la corriger si besoin, et éventuellement ECG.
+ Héparines par voie parentérale
Aggravation par l'héparine du risque hémorragique propre à la corticothérapie (muqueuse digestive, fragilité vasculaire) à fortes doses ou en traitement prolongé supérieur à 10 jours.
L'association doit être justifiée, renforcer la surveillance.
+ Inducteurs enzymatiques (apalutamide, carbamazepine, cénobamate, dabrafénib, efavirenz, enzalutamide, eslicarbazépine, fosphenytoine, létermovir, lorlatinib, lumacaftor, nevirapine, oxcarbazepine, phenobarbital, phenytoine, pitolisant, primidone, rifabutine, rifampicine, sotorasib)
Diminution des taux plasmatiques et de l'efficacité des corticoïdes par augmentation de leur métabolisme hépatique. Les conséquences sont particulièrement importantes chez les addisoniens et en cas de transplantation.
Surveillance clinique et biologique, adaptation de la posologie des corticoïdes pendant l'association et après arrêt de l'inducteur enzymatique.
+ Insuline, metformine, sulfamides hypoglycémiants
Elévation de la glycémie avec parfois cétose (diminution de la tolérance aux glucides par les corticoïdes). Prévenir le patient et renforcer l'autosurveillance sanguine et urinaire, surtout en début de traitement. Adapter éventuellement la posologie de l'antidiabétique pendant le traitement par les corticoïdes et après son arrêt.
+ Isoniazide (décrit pour la prednisolone).
Diminution des taux plasmatiques de l'isoniazide. Mécanisme invoqué : augmentation du métabolisme hépatique de l'isoniazide et diminution de celui des glucocorticoïdes. Surveillance clinique et biologique.
Augmentation du risque hémorragique. Surveillance clinique.
+ Praziquantel
Diminution des concentrations plasmatiques de praziquantel, avec risque d’échec du traitement, par augmentation du métabolisme hépatique du praziquantel par la dexaméthasone. Décaler l’administration des deux médicaments d’au moins une semaine.
Associations à prendre en compte
Augmentation du risque d’ulcération et d’hémorragie gastro-intestinale.
+ Antihypertenseurs
Diminution de l'effet antihypertenseur (rétention hydrosodée des corticoïdes).
+ Interféron alpha
Risque d'inhibition de l'action de l'interféron.
+ Fluoroquinolones (ciprofloxacine, délafloxacine, enoxacine, levofloxacine, lomefloxacine, moxifloxacine, norfloxacine, ofloxacine, pefloxacine)
Possible majoration du risque de tendinopathie, voire de rupture tendineuse (exceptionnelle), particulièrement chez les patients recevant une corticothérapie prolongée.
+ Acide acétylsalicylique
Majoration du risque hémorragique. Une association avec l’acide acétylsalicylique à des doses antalgiques ou antipyrétiques (>=500mg par prise et/ou <3g par jour) est à prendre en compte.
+ Curares non dépolarisants (atracurium, cisatracurium, rocuronium, vecuronium)
Avec les glucocorticoïdes par voie IV : risque de myopathie sévère, réversible après un délai éventuellement long (plusieurs mois).
USAGE LOCAL
Les risques d'interactions des glucocorticoïdes avec d'autres médicaments sont exceptionnels par voie injectable locale dans les circonstances usuelles d'emploi. Ces risques seraient à considérer en cas d'injections multiples (plusieurs localisations) ou répétées à court terme.
Associations faisant l'objet de précautions d’emploi
+ Ritonavir, cobicistat (décrit chez des patients HIV)
Risque d’insuffisance surrénale aiguë, même en cas d’injection unique. L’articulation peut constituer un réservoir relarguant de façon continue le corticoïde CYP3A4-dépendant dans la circulation générale, avec augmentation possiblement très importante des concentrations du corticoïde à l’origine d’une freination de la réponse hypothalamo-hypophysaire. Préférer un corticoïde non CYP3A4-dépendant (hydrocortisone)
4.6. Fertilité, grossesse et allaitement
USAGE SYSTEMIQUE
Grossesse
Chez l'animal, l'expérimentation met en évidence un effet tératogène variable selon les espèces.
L'administration de corticostéroïdes à des animaux gravides peut causer des anomalies du développement fœtal, incluant une fente palatine, un retard de croissance intra-utérin et des effets sur la croissance et le développement du cerveau. Il n'existe aucune preuve que les corticostéroïdes entraînent une augmentation de la fréquence des anomalies congénitales, comme la fente palatine / labio-palatine chez l'homme. Voir aussi la section 5.3 du RCP.
Dans l'espèce humaine, il existe un passage transplacentaire. Cependant, les études épidémiologiques n'ont décelé aucun risque malformatif lié à la prise de corticoïdes lors du premier trimestre.
Les études ont montré un risque accru d’hypoglycémie néonatale à la suite de l’administration de corticostéroïdes, y compris de dexaméthasone, pendant une courte période chez des femmes à risque d’accouchement prématuré tardif.
Lors de maladies chroniques nécessitant un traitement tout au long de la grossesse, un léger retard de croissance intra-utérin est possible. Une insuffisance surrénale néonatale a été exceptionnellement observée après corticothérapie à doses élevées.
Il est justifié d'observer une période de surveillance clinique (poids, diurèse) et biologique du nouveau-né.
En conséquence, les corticoïdes peuvent être prescrits pendant la grossesse si besoin.
En cas de traitement à doses importantes et de façon chronique, l'allaitement est déconseillé.
USAGE LOCAL
Grossesse
Le risque des corticoïdes par voie systémique est à considérer en cas d'injections multiples (plusieurs localisations) ou répétées à court terme : avec les corticoïdes par voie systémique, un léger retard de croissance intra-utérin est possible. Une insuffisance surrénale néonatale a été observée exceptionnellement après corticothérapie à dose élevée.
Allaitement
En cas de traitement à doses importantes, l'allaitement est déconseillé.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
Résumé du profil de sécurité
Les évènements indésirables sont listés par classe de système d’organes selon la classification MedDRA. La convention suivante a été utilisée pour la classification par fréquence : très fréquent (≥1/10), fréquent (≥1/100 à <1/10), peu fréquent (≥1/1 000 à <1/100), rare (≥1/10 000 à <1/1 000), très rare (<1/10 000) et fréquence indéterminée (ne peut être estimée sur la base des données disponibles).
USAGE SYSTEMIQUE
|
Fréquence |
Effets indésirables |
|
|
Infections et infestations |
Indéterminée |
Infection* |
|
Affections hématologiques et du système lymphatique |
Indéterminée |
Hyperleucocytose modérée |
|
Affections du système immunitaire |
Rare |
Réaction anaphylactique (rapportée chez des patients traités par des corticostéroïdes par voie parentérale - voir rubrique 4.4) |
|
Affections endocriniennes |
Indéterminée |
Syndrome de Cushing iatrogène, inertie de la sécrétion d'ACTH, atrophie corticosurrénalienne (parfois définitive) |
|
Troubles du métabolisme et de la nutrition |
Indéterminée |
Hypokaliémie, alcalose métabolique, rétention hydrosodée, diminution de la tolérance au glucose, révélation d'un diabète latent, arrêt de la croissance chez l'enfant, prise de poids |
|
Affections psychiatriques |
Fréquent |
Euphorie, insomnie, excitation |
|
Rare |
Accès d'allure maniaque, états confusionnels ou confuso-oniriques |
|
|
Indéterminée |
Etat dépressif à l'arrêt du traitement |
|
|
Affections du système nerveux |
Rare |
Convulsions |
|
Affections oculaires |
Indéterminée |
Glaucome, cataracte, choriorétinopathie, vision floue (voir rubrique 4.4) |
|
Affections cardiaques |
Indéterminée |
Troubles du rythme cardiaque (liés à l’administration intraveineuse), insuffisance cardiaque congestive, cardiomyopathie hypertrophique chez les nourrissons prématurés (voir rubrique 4.4) |
|
Affections vasculaires |
Indéterminée |
Hypertension artérielle, risque accru de thrombose |
|
Affections gastro-intestinales |
Indéterminée |
Hoquet, ulcère gastroduodénal, ulcération du grêle, perforation intestinale, hémorragie digestive, pancréatite aiguë (surtout chez l'enfant) |
|
Affections de la peau et du tissu sous-cutané |
Indéterminée |
Acné, purpura, ecchymose, hypertrichose, retard de cicatrisation |
|
Affections musculo-squelettiques |
Indéterminée |
Atrophie musculaire précédée par une faiblesse musculaire (augmentation du catabolisme protidique), ostéoporose, fractures pathologiques en particulier tassements vertébraux, ostéonécrose aseptique des têtes fémorales, ruptures tendineuses (en particulier en co-prescription avec les fluoroquinolones) |
|
Affections des organes de reproduction et du sein |
Indéterminée |
Irrégularités menstruelles |
* La dexaméthasone étant un corticostéroïde, la suppression de la réponse inflammatoire et de la fonction immunitaire peut augmenter la sensibilité aux infections et leur gravité.
USAGE LOCAL
Les effets indésirables systémiques des glucocorticoïdes ont un faible risque de survenue après administration locale, compte-tenu des faibles taux sanguins, mais le risque d'hypercorticisme (rétention hydrosodée, déséquilibre d'un diabète et d'une hypertension artérielle...) augmente avec la dose et la fréquence des injections.
|
Classes de systèmes d’organes |
Fréquence |
Effets indésirables |
|
Affections du système immunitaire |
Indéterminée |
Réaction allergique, bouffées vasomotrices* |
|
Troubles du métabolisme et de la nutrition |
Indéterminée |
Rétention hydrosodée, déséquilibre d'un diabète |
|
Affections du système nerveux |
Indéterminée |
Céphalées* |
|
Affections cardiaques |
Indéterminée |
Cardiomyopathie hypertrophique chez les nourrissons prématurés (voir rubrique 4.4) |
|
Affections vasculaires |
Indéterminée |
Hypertension artérielle |
|
Affections gastro-intestinales |
Indéterminée |
Hoquet |
|
Affections musculo-squelettiques |
Indéterminée |
Arthrite aiguë à microcristaux (avec suspension microcristalline - de survenue précoce) |
|
Troubles généraux et anomalies au site d’administration |
Indéterminée |
Réaction au site d’injection, infection locale (arthrite ), atrophie musculaire, sous-cutanée et cutanée, rupture tendineuse (en cas d’injection dans les tendons), calcification, réaction allergique |
· * Céphalées et bouffées vasomotrices (flush) disparaissent habituellement en un jour ou deux.
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr/.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Classe pharmacothérapeutique : CORTICOIDES A USAGE SYSTEMIQUE NON ASSOCIES, code ATC : H02AB02.
Les glucocorticoïdes physiologiques (cortisone et hydrocortisone) sont des hormones métaboliques essentielles. Les corticoïdes synthétiques, incluant la dexaméthasone, sont utilisés principalement pour leur effet anti-inflammatoire. A forte dose, ils diminuent la réponse immunitaire. Leur effet métabolique et de rétention sodée est moindre que celui de l'hydrocortisone.
L’essai RECOVERY (Randomised Evaluation of COVid-19 thERapY,)[1] est un essai institutionnel, randomisé, contrôlé, conduit en ouvert à partir d’une plateforme adaptative destinée à évaluer les traitements potentiels de la COVID-19 chez les patients hospitalisés.
L’essai a été mené dans 176 centres hospitaliers au Royaume-Uni.
Au total, 6 425 patients ont été randomisés pour être traités par la dexaméthasone (2 104 patients), ou par les soins de support usuels seuls (4 321 patients). Pour 89 % des patients l’infection par le virus SARS-CoV-2 était confirmée par un test en laboratoire.
Au moment de la randomisation, 16 % des patients recevaient une ventilation mécanique invasive ou étaient placés sous oxygénation par membrane extracorporelle, 60 % recevaient un apport en oxygène associé ou non à une ventilation non invasive, et 24 % ne recevaient pas d’oxygénothérapie.
L’âge moyen des patients était de 66,1 ± 15,7 ans. 36 % des patients étaient de sexe féminin. 24 % des patients présentaient des antécédents de diabète, 27 % présentaient des antécédents de pathologies cardiaques et 21 %, des antécédents de maladie pulmonaire chronique.
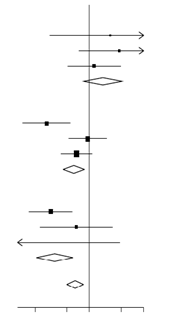
Critère de jugement principal
La mortalité à 28 jours était significativement plus faible dans le groupe recevant la dexaméthasone que dans le groupe recevant les soins usuels seuls ; 482 décès (22,9 %) ayant été rapportés sur 2 104 patients et 1 110 (25,7 %) sur 4 321 patients (risque relatif 0,83 ; [intervalle de confiance : IC 95 % : 0,75 à 0,93 ; P < 0,001].
Le taux de décès était plus faible dans le groupe recevant la dexaméthasone que dans le groupe recevant les soins usuels chez les patients recevant une ventilation mécanique invasive (29,3 % contre 41,4 % ; risque relatif 0,64 [IC 95 % : 0,51 à 0,81] et chez les patients recevant une oxygénothérapie sans ventilation mécanique invasive (23,3 % contre 26,2 % ; risque relatif 0,82 [IC 95 % : 0,72 à 0,94].
Il n’a pas été observé d’effet significatif de la dexaméthasone dans le groupe de patients ne recevant pas de support respiratoire au moment de la randomisation (17,8 % contre 14,0 % ; risque relatif 1,19 [IC 95 % : 0,91 à 1,55].
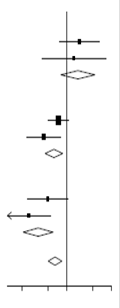
Critères de jugement secondaires
Les patients du groupe dexaméthasone ont eu une durée d’hospitalisation plus courte que celle du groupe recevant les soins usuels seuls (médiane, 12 jours contre 13 jours) et une probabilité de sorite d’hôpital en vie dans les 28 jours plus élevée (risque relatif 1,10 ; [IC 95 % : 1,03 à 1,17].
Comme pour le critère de jugement principal, l’effet le plus significatif en termes de sortie en vie de l’hôpital sous 28 jours a été observé chez les patients qui recevaient une ventilation mécanique invasive au moment de la randomisation (risque relatif 1,48 [IC 95 % : 1,16 à 1,90], puis chez les patients recevant de l’oxygène sans ventilation mécanique invasive (risque relatif, 1,15 [IC 95 % : 1,06 à 1,24]. Aucun effet bénéfique n’a été observé chez les patients qui ne recevaient pas d’oxygène (risque relatif, 0,96 [IC 95 % : 0,85 à 1,08].
|
Résultats |
Dexaméthasone (N=2104) |
Traitement standard (N=4321) |
Taux ou risque relatif (95% IC)* |
|
nb/nb total de patients (%) |
|||
|
Critère principal : |
|||
|
Mortalité à 28 jours |
482/2104 (22.9) |
1110/4321 (25,7) |
0,83 (0,75-0,93) |
|
Critères secondaires : |
|||
|
Sortie d’hôpital dans les 28 jours |
1413/2104 (67,2) |
2745/4321 (63,5) |
1,10 (1,03-1,17) |
|
Ventilation mécanique invasive ou décès |
456/1780 (25,6) |
994/3638 (27,3) |
0,92 (0,84-1,01) |
|
Ventilation mécanique invasive |
102/1780 (5,7) |
285/3638 (7,8) |
0,77 (0,62-0,95) |
|
Décès |
387/1780 (21,7) |
827/3638 (22,7) |
0,93 (0,84-1,03) |
* Les risques relatifs ont été ajustés sur l’âge en fonction du taux de mortalité à 28 jours et du délai de sortie en vie de l’hôpital. Les risques relatifs ont été ajustés sur l’âge en fonction du taux de progression vers ventilation mécanique invasive ou de décès et des sous-composants.
Les patients qui recevaient une ventilation mécanique invasive au moment de la randomisation ont été exclus de cette catégorie.
Données de sécurité
Quatre effets indésirables (EI) graves ont été observés en lien avec le traitement à l’étude : deux cas graves d’hyperglycémie, un cas grave de psychose induite par la corticothérapie et un cas d’hémorragie digestive haute. Les évènements ont tous été résolus.
Analyses en sous-groupes
Effets de l’administration de la DEXAMÉTHASONE sur la mortalité à 28 jours, en fonction de l’âge et de l’assistance respiratoire reçue au moment de la randomisation2
|
|
Dexaméthasone |
|
RR (IC 95 %) |
||||||||
|
Pas d’oxygène ( |
|
|
|||||||||
|
< 70 |
10/197 (5,1 %) |
18/462 (3,9 %) |
1,31 (0,60 à 2,83) |
||||||||
|
> 70 < 80 |
25/114 (21,9 %) |
35/224 (15,6 %) |
1,46 (0,88 à 2,45) |
||||||||
|
≥ 80 |
54/190 (28,4 %) |
92/348 (26,4 %) |
1,06 (0,76 à 1,49) |
||||||||
|
Sous-total |
89/501 (17,8 %) |
145/1034 (14,0 %) |
1,19 (0,91 à 1,55) |
||||||||
|
Oxygène uniquement ( |
|
|
|||||||||
|
< 70 |
53/675 (7,9 %) |
193/1 473 (13,1 %) |
0,58 (0,43 à 0,78) |
||||||||
|
≥ 70 < 80 |
104/306 (34,0 %) |
178/531 (33,5 %) |
0,98 (0,77 à 1,25) |
||||||||
|
≥ 80 |
141/298 (47,3 %) |
311/600 (51,8 %) |
0,85 (0,70 à 1,04) |
||||||||
|
Sous-total |
298/1 279 (23,3 %) |
682/2 604 (26,2 %) |
0,82 (0,72 à 0,94) |
||||||||
|
Ventilation mécanique ( |
|
|
|||||||||
|
< 70 |
66/269 (24,5 %) |
217/569 (38,1 %) |
0,61 (0,46 à 0,81) |
||||||||
|
≥ 70 < 80 |
26/49 (53,1 %) |
58/104 (55,8 %) |
0,85 (0,53 à 1,34) |
||||||||
|
≥ 80 |
3/6 (50,0 %) |
8/10 (80,0 %) |
0,39 (0,10 à 1,47) |
||||||||
|
Sous-total |
95/324 (29,3 %) |
283/683 (41,4 %) |
0,64 (0,51 à 0,81) |
||||||||
|
Total des participants |
482/2104 (22,9 %) |
1110/4321 (25,7 %) |
0,83 (0,75 à 0,93) |
||||||||
|
|
|
|
p < 0,001 |
||||||||
|
|
|
0,5 |
0,75 |
1 |
1,5 |
2 |
|
||||
|
|
|
|
Supériorité de la dexaméthasone |
Supériorité des soins usuels seuls |
|
||||||
|
|
Dexaméthasone |
Soins usuels |
|
RR (IC 95 %) |
|||||||
|
Pas d’oxygène ( |
|
|
|||||||||
|
Pathologie antérieure |
65/313 (20,8 %) |
100/598 (16,7 %) |
1,22 (0,89 à 1,66) |
||||||||
|
Aucune pathologie antérieure |
24/188 (12,8 %) |
45/436 (10,3 %) |
1,12 (0,68 à 1,83) |
||||||||
|
Sous-total |
89/501 (17,8 %) |
145/1034 (14,0 %) |
1,19 (0,91 à 1,55) |
||||||||
|
Oxygène uniquement ( |
|
|
|||||||||
|
Pathologie antérieure |
221/702 (31,5 %) |
481/1 473 (32,7 %) |
0,88 (0,75 à 1,03) |
||||||||
|
Aucune pathologie antérieure |
77/577 (13,3 %) |
201/1 131 (17,8 %) |
0,70 (0,54 à 0,91) |
||||||||
|
Sous-total |
298/1279 (23,3 %) |
682/2 604 (26,2 %) |
0,82 (0,72 à 0,94) |
||||||||
|
Ventilation artificielle ( |
|
|
|||||||||
|
Pathologie antérieure |
51/159 (32,1 %) |
150/346 (43,4 %) |
0,75 (0,54 à 1,02) |
||||||||
|
Aucune pathologie antérieure |
44/165 (26,7 %) |
133/337 (39,5 %) |
0,56 (0,40 à 0,78) |
||||||||
|
Sous-total |
95/324 (29,3 %) |
283/683 (41,4 %) |
0,64 (0,51 à 0,81) |
||||||||
|
Tous les participants |
482/2104 (22,9 %) |
1110/4 321 (25,7 %) |
0,83 (0,75 à 0,93) |
||||||||
|
|
|
|
p < 0,001 |
||||||||
|
|
|
0,5 |
0,75 |
1 |
1,5 |
2 |
|
||||
|
|
|
|
Supériorité de la dexaméthasone |
Supériorité des soins de routine |
|
||||||
2,3 (source: Horby P. et al. 2020; https://www.medrxiv.org/content/10.1101/2020.06.22.20137273v1 ; doi: https://doi.org/10.1101/2020.06.22.20137273)
5.2. Propriétés pharmacocinétiques
5.3. Données de sécurité préclinique
Phosphate de sodium dihydraté, acide phosphorique dilué, eau pour préparations injectables.
2 ans.
Après dilution :
La stabilité physico-chimique en cours d'utilisation a été démontrée pendant 24 heures à température ambiante et à l’abri de la lumière dans des poches PVC-free de 100 ml. D'un point de vue microbiologique, sauf si la méthode d'ouverture/ de dilution prévient tout risque de contamination microbienne, le produit doit être utilisé immédiatement. En cas d’utilisation non immédiate, les durées et conditions de conservation en cours d'utilisation relèvent de la responsabilité de l’utilisateur.
6.4. Précautions particulières de conservation
A conserver à une température ne dépassant pas 25°C.
A conserver dans l’emballage d'origine.
Ne pas mettre au réfrigérateur.
Pour les conditions de conservation du médicament après ouverture/ dilution, voir rubrique 6.3.
6.5. Nature et contenu de l'emballage extérieur
5 ml en ampoule en verre. Boîte de 5, 10, 20 ampoules.
Toutes les présentations peuvent ne pas être commercialisées.
6.6. Précautions particulières d’élimination et de manipulation
DEXAMETHASONE MEDISOL est de préférence administré par injection intraveineuse directe ou injecté dans une ligne de perfusion. La solution injectable est compatible avec les solutions de perfusion suivantes et est destinée à être utilisée dans les conditions décrites en rubrique 6.3 :
Solution de chlorure de sodium à 0,9%
Solution de glucose à 5%
Tout médicament non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
13 COURS VALMY
TOUR PACIFIC HALL OUEST
92800 PUTEAUX
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· 34009 302 179 9 3 : 5 ampoule(s) en verre de 5 ml.
· 34009 302 180 4 4 : 10 ampoule(s) en verre de 5 ml.
· 34009 302 180 5 1 : 20 ampoule(s) en verre de 5 ml.
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
[à compléter ultérieurement par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE
[à compléter ultérieurement par le titulaire]
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
ANSM - Mis à jour le : 10/03/2025
DEXAMETHASONE MEDISOL 20 mg/ 5 ml, solution injectable
Phosphate de dexaméthasone
· Gardez cette notice. Vous pourriez avoir besoin de la relire.
· Si vous avez d'autres questions, interrogez votre médecin ou votre pharmacien.
· Ce médicament vous a été personnellement prescrit. Ne le donnez pas à d’autres personnes. Il pourrait leur être nocif, même si les signes de leur maladie sont identiques aux vôtres.
· Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s'applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
1. Qu'est-ce que DEXAMETHASONE MEDISOL 20 mg/ 5 ml, solution injectable et dans quels cas est-il utilisé ?
2. Quelles sont les informations à connaître avant d’utiliser DEXAMETHASONE MEDISOL 20 mg/ 5 ml, solution injectable ?
3. Comment utiliser DEXAMETHASONE MEDISOL 20 mg/ 5 ml, solution injectable ?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver DEXAMETHASONE MEDISOL 20 mg/ 5 ml, solution injectable ?
6. Contenu de l’emballage et autres informations.
1. QU’EST-CE QUE DEXAMETHASONE MEDISOL 20 mg/ 5 ml, solution injectable ET DANS QUELS CAS EST-IL UTILISE ?
Classe pharmacothérapeutique - code ATC H02AB02 : CORTICOÏDES A USAGE SYSTEMIQUE NON ASSOCIES
La substance active contenue dans ce médicament est la dexaméthasone qui est un corticoïde de synthèse. La dexaméthasone est indiquée dans certaines maladies, où elle est utilisée pour son effet anti-inflammatoire.
II peut être utilisé en injection locale, en dermatologie et en rhumatologie.
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT D’UTILISER DEXAMETHASONE MEDISOL 20 mg/ 5 ml, solution injectable ?
USAGE PAR VOIE INTRAVEINEUSE OU INTRAMUSCULAIRE
N’utilisez jamais DEXAMETHASONE MEDISOL 20 mg/ 5 ml, solution injectable dans les cas suivants:
· la plupart des infections,
· certaines maladies virales en évolution (hépatites virales, herpès, varicelle, zona),
· certains troubles mentaux non traités,
· vaccination par des vaccins vivants,
· antécédent d'allergie à la substance active ou à l’un des autres composants contenus dans ce médicament, mentionnés dans la rubrique 6,
· troubles de la coagulation, traitement anticoagulant en cours en cas d'injection intramusculaire (contre-indication liée à la voie d'administration IM).
· en association avec la rilpivirine, sauf en cas de traitement à dose unique de DEXAMETHASONE MEDISOL.
Consultez votre médecin ou votre pharmacien avant de prendre DEXAMETHASONE MEDISOL 20 mg/ 5 ml, solution injectable
USAGE LOCAL
Ce médicament NE DOIT PAS ETRE UTILISE dans les cas suivants :
· infections,
· allergie à l'un des constituants,
· troubles de la coagulation ou traitement anticoagulant en cours.
Avertissements et précautions
Adressez-vous à votre médecin ou pharmacien avant d’utiliser DEXAMETHASONE MEDISOL 20 mg/ 5 ml, solution injectable.
Informer votre médecin dans l’une des situations suivantes :
· les symptômes du syndrome de lyse tumorale tels que les crampes musculaires, la faiblesse musculaire, la confusion, la perte visuelle ou des troubles et l'essoufflement, au cas où vous souffrez de malignité hématologique.
· si vous avez ou êtes suspecté d'avoir un phéochromocytome (une tumeur des glandes surrénales).
Contactez votre médecin en cas de vision floue ou d’autres troubles visuels.
Veuillez avertir votre médecin si vous prenez ou avez pris récemment tout autre médicament, y compris des médicaments obtenus sans prescription.
Certains médicaments peuvent augmenter les effets de DEXAMETHASONE MEDISOL 20 mg/ 5 ml, solution injectable et il est possible que votre médecin souhaite vous surveiller attentivement si vous prenez ces médicaments (y compris certains médicaments pour traiter l’infection à VIH: ritonavir, cobicistat).
Le traitement avec ce médicament peut provoquer une crise de phéochromocytome, qui peut être fatale. Le phéochromocytome est une tumeur rare des glandes surrénales. Une crise peut survenir avec les symptômes suivants : maux de tête, transpiration, palpitations et hypertension. Contactez immédiatement votre médecin si vous ressentez ces signes.
Si la dexaméthasone est administrée à un bébé prématuré, une surveillance de la fonction et de la structure cardiaques est nécessaire.
Enfants et adolescents
Sans objet.
Faites attention avec DEXAMETHASONE MEDISOL 20 mg/5 ml, solution injectable :
Mises en garde
Ce médicament doit être pris sous stricte surveillance médicale.
Dexaméthasone ne doit pas être utilisé de manière systématique chez les nouveau-nés prématurés présentant des problèmes respiratoires.
Sportifs, attention cette spécialité contient un principe actif pouvant induire une réaction positive des tests pratiqués lors de contrôles antidopage.
USAGE PAR VOIE INTRAVEINEUSE OU INTRAMUSCULAIRE
AVANT LE TRAITEMENT:
Prévenir votre médecin en cas d'antécédent d'allergie, de maladies virales en cours (hépatite virale, herpès, varicelle, zona), de vaccination récente, en cas d'ulcère digestif, de maladies du colon, d'intervention chirurgicale récente au niveau de l'intestin, de diabète, d'hypertension artérielle, d'infection (notamment antécédents de tuberculose), d'insuffisance hépatique, d'insuffisance rénale, d'hémodialyse, d'ostéoporose, de myasthénie grave (maladie des muscles avec fatigue musculaire), de port de prothèse.
Prévenir votre médecin en cas de séjour dans les régions tropicale, subtropicale ou le sud de l'Europe, en raison du risque de maladie parasitaire.
PENDANT ET APRES LE TRAITEMENT:
Les corticoïdes oraux ou injectables peuvent favoriser l'apparition de tendinopathie, voire de rupture tendineuse (exceptionnelle). Prévenir votre médecin en cas d'apparition de douleur tendineuse.
Eviter le contact avec les sujets atteints de varicelle ou de rougeole.
Prévenir votre médecin si des douleurs ou de la fièvre apparaissent après l’injection.
Les injections répétées risquent d'entraîner des symptômes d'hypercorticisme (prise de poids, gonflement, hypertension ...) et de déséquilibrer un diabète, des troubles mentaux ou une hypertension artérielle sévère.
Vous devez informer votre médecin si vous réduisez soudainement la dose de ce médicament après un traitement prolongé car cela peut entraîner une insuffisance de la production d'hormones par la glande surrénale, une tension artérielle anormalement basse et la mort (pour les symptômes du sevrage aux corticoïdes, voir la rubrique 4 « Quels sont les effets indésirables éventuels ? »).
USAGE LOCAL
En l'absence de données concernant le risque de calcification, il est préférable d'éviter l'administration d'un corticoïde en intra-discal.
Prévenir votre médecin en cas de vaccination récente et de maladies virales en évolution (hépatite virale, herpès, varicelle, zona).
Ce médicament doit être pris sous stricte surveillance médicale.
Prévenir votre médecin si des douleurs ou de la fièvre apparaissent après l'injection.
Les injections répétées risquent d'entraîner des symptômes d'hypercorticisme (prise de poids, gonflement, hypertension ...) et de déséquilibrer un diabète, des troubles mentaux ou une hypertension artérielle sévère.
Précautions d'emploi
En cas de traitement au long cours par corticoïdes, votre médecin pourra vous conseiller de suivre un régime, en particulier pauvre en sel de sodium, en sucres rapides et riche en protéines.
Un apport en calcium, vitamine D et éventuellement en potassium pourra également vous être prescrit.
Autres médicaments et DEXAMETHASONE MEDISOL 20 mg/5 ml, solution injectable
USAGE PAR VOIE INTRAVEINEUSE OU INTRAMUSCULAIRE.
Informez votre médecin ou pharmacien si vous prenez, avez récemment pris ou pourriez prendre tout autre médicament.
Vous ne devez jamais recevoir DEXAMETHASONE MEDISOL :
· si vous venez de vous faire vacciner par un vaccin vivant atténué,
· si vous prenez de la rilpivirine (médicament utilisé dans le traitement de l’infection par le virus de l’immunodéficience humaine (VIH)), sauf en cas de prise unique de DEXAMETHASONE MEDISOL.
Sauf avis contraire de votre médecin, vous ne devez pas recevoir DEXAMETHASONE MEDISOL:
· si vous prenez du mifamurtide (médicament indiqué dans le traitement du cancer des os),
· si vous prenez de l’acide acétylsalicylique (aspirine) à dose anti-inflammatoire (≥ 1 g par prise et/ou ≥ 3 g par jour).
En principe, vous ne devez pas prendre en même temps d’autres traitements corticoïdes, sauf si votre médecin vous a dit de le faire. En cas de doute, ne pas hésiter à demander à votre médecin.
DEXAMETHASONE MEDISOL 20 mg/5 ml, solution injectable avec des aliments et boissons
Sans objet.
Grossesse et allaitement
Si vous êtes enceinte ou que vous allaitez, si vous pensez être enceinte ou planifiez une grossesse, demandez conseil à votre médecin ou pharmacien avant de prendre ce médicament.
USAGE PAR VOIE INTRAVEINEUSE OU INTRAMUSCULAIRE
Grossesse
Ce médicament ne sera utilisé pendant la grossesse qu'en cas de nécessité. Si vous découvrez que vous êtes enceinte pendant le traitement, consultez votre médecin car lui seul peut juger de la nécessité de poursuivre ce traitement.
Les nouveau-nés de mères ayant reçu DEXAMETHASONE MEDISOL vers la fin de la grossesse peuvent présenter de faibles taux de sucre dans le sang après la naissance.
Allaitement
L'allaitement est à éviter pendant le traitement en raison du passage dans le lait maternel.
Demandez conseil à votre médecin ou à votre pharmacien avant de prendre tout médicament.
USAGE LOCAL
Demander l'avis de votre médecin en cas de grossesse ou d'allaitement.
Conduite de véhicules et utilisation de machines
Sans objet.
DEXAMETHASONE MEDISOL 20 mg/5 ml, solution injectable contient du sodium.
Ce médicament contient moins de 1 mmol (23 mg) de sodium par ampoule c’est-à-dire qu’il est essentiellement « sans sodium ».
3. COMMENT UTILISER DEXAMETHASONE MEDISOL 20 mg/ 5 ml, solution injectable ?
La dose à utiliser est déterminée par votre médecin, en fonction de votre poids et de la maladie traitée.
Elle est strictement individuelle.
Traitement de la COVID-19 :
Chez l’adulte et l’adolescent (âgés de 12 ans ou plus et pesant plus de 40 kg), la dose recommandée est de 6 mg par jour pendant une durée allant jusqu’à 10 jours.
Prenez le traitement en respectant la prescription de votre médecin. Votre médecin décidera de la durée pendant laquelle vous devrez prendre la dexaméthasone. Vérifiez auprès de votre médecin ou pharmacien en cas de doute.
Mode d’administration
VOIES INJECTABLES INTRAVEINEUSE, INTRAMUSCULAIRE OU LOCALE.
Ne pas injecter dans les tendons.
Durée du traitement
Elle est déterminée par votre médecin.
Si vous avez utilisé plus de DEXAMETHASONE MEDISOL 20 mg/ 5 ml, solution injectable que vous n’auriez dû :
Consultez immédiatement votre médecin ou votre pharmacien.
Si vous oubliez d’utiliser DEXAMETHASONE MEDISOL 20 mg/ 5 ml, solution injectable :
Sans objet.
Si vous arrêtez d’utiliser DEXAMETHASONE MEDISOL 20 mg/ 5 ml, solution injectable :
Suivez toujours le schéma posologique prescrit par le médecin. N'arrêtez pas de prendre ce médicament brusquement, car cela pourrait être dangereux. Votre médecin vous expliquera comment le traitement sera progressivement réduit. DEXAMETHASONE MEDISOL ne doit jamais être interrompu sans autorisation, d'autant plus qu'un traitement à long terme ou à fortes doses peut entraîner une diminution de la production de glucocorticoïdes par l'organisme.
Si vous avez d’autres questions sur l’utilisation de ce médicament, demandez plus d’informations à votre médecin ou à votre pharmacien.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
USAGE PAR VOIE INTRAVEINEUSE OU INTRAMUSCULAIRE
Ce médicament, indispensable est le plus souvent bien toléré lorsque l’on suit les recommandations et notamment le régime (voir Précautions d'emploi). Il peut néanmoins entraîner, selon la dose et la durée du traitement, des effets plus ou moins gênants.
Des manifestations allergiques liées à l'administration intraveineuse ont été décrites.
Une réduction trop rapide de la dose après un traitement à long terme peut provoquer un syndrome de sevrage avec des symptômes tels que des douleurs musculaires et articulaires.
Les effets indésirables suivants peuvent survenir avec ce médicament :
Fréquents (susceptibles de survenir chez 1 à 10 patients sur 100) :
· excitation, troubles du sommeil, euphorie.
Rares (susceptibles de survenir chez moins de 1 patient sur 1 000) :
· gonflement et rougeur du visage (réaction anaphylactique),
· troubles du comportement, confusions, convulsions.
Les effets indésirables suivants ont été rapportés avec une fréquence indéterminée :
· apparition et aggravation des infections,
· augmentation modérée du nombre de globules blancs dans le sang,
· troubles de la sécrétion de la glande surrénale,
· modification de certains paramètres biologiques (sel, sucre, potassium) pouvant nécessiter un régime ou un traitement complémentaire, augmentation du pH sanguin, révélation d’un diabète latent,
· trouble de la croissance chez l'enfant,
· prise de poids,
· état dépressif à l'arrêt du traitement,
· troubles visuels, vision floue, perte de vision, glaucome (augmentation de la pression à l'intérieur de l'œil), cataracte (opacification du cristallin), maladie affectant la rétine et la membrane choroïde (choriorétinopathie),
· troubles du rythme cardiaque, atteinte cardiaque (insuffisance cardiaque congestive), épaississement du muscle cardiaque (cardiomyopathie hypertrophique) chez les bébés nés prématurément (qui revient généralement à la normale après l’arrêt du traitement),
· élévation de la tension artérielle, risque accru de thrombose,
· hoquet, ulcères de l'estomac ou de l'intestin, perforations et hémorragies digestives, inflammation du pancréas,
· troubles de la peau: acné, petites taches rouges (purpura), pilosité importante, retard de cicatrisation, apparition de bleus,
· faiblesse des muscles, diminution de la musculature, fragilité osseuse (ostéoporose, fractures),
· règles irrégulières.
USAGE LOCAL
Les effets indésirables suivants ont été rapportés avec une fréquence indéterminée :
· réactions allergiques locales et générales,
· symptômes d'hypercorticisme (prise de poids, gonflement, hypertension), déséquilibre d’un diabète, hypertension artérielle (en cas d’injections répétées),
· maux de tête, bouffées de chaleur (disparaissant habituellement en un ou deux jours),
· réaction au site d’injection : infection, lésion, inflammation et calcifications de l'articulation,
· ruptures tendineuses (en particulier en co-prescription avec les fluoroquinolones),
· fragilisation de la peau.
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr/
En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.
5. COMMENT CONSERVER DEXAMETHASONE MEDISOL 20 mg/ 5 ml, solution injectable ?
Tenir ce médicament hors de la vue et de la portée des enfants.
N’utilisez pas ce médicament après la date de péremption indiquée sur l’étiquette et l’emballage. La date de péremption fait référence au dernier jour de ce mois.
A conserver à une température inférieure à 25°C.
A conserver dans l’emballage d'origine.
Ne pas mettre au réfrigérateur.
Après dilution :
La stabilité physico-chimique en cours d'utilisation a été démontrée pendant 24 heures à température ambiante et à l’abri de la lumière dans des poches PVC-free de 100 ml. D'un point de vue microbiologique, sauf si la méthode d'ouverture / de dilution prévient tout risque de contamination microbienne, le produit doit être utilisé immédiatement.
En cas d’utilisation non immédiate, les durées et conditions de conservation en cours d'utilisation relèvent de la responsabilité de l’utilisateur.
Ne jetez aucun médicament au tout-à-l’égout ou avec les ordures ménagères. Demandez à votre pharmacien d’éliminer les médicaments que vous n’utilisez plus. Ces mesures contribueront à protéger l’environnement.
6. CONTENU DE L’EMBALLAGE ET AUTRES INFORMATIONS
Ce que contient DEXAMETHASONE MEDISOL 20 mg/ 5 ml, solution injectable
· La substance active est :
Phosphate sodique de dexaméthasone
Quantité correspondant en phosphate de dexaméthasone................................................... 20,00 mg
Pour une ampoule de 5 ml.
· Les autres composants sont :
Phosphate de sodium dihydraté, acide phosphorique dilué, eau pour préparations injectables.
Ce médicament se présente sous forme de solution injectable limpide.
Boîtes de 5, 10, 20 ampoules.
Toutes les présentations peuvent ne pas être commercialisées.
Titulaire de l’autorisation de mise sur le marché
13 COURS VALMY
TOUR PACIFIC HALL OUEST
92800 PUTEAUX
Exploitant de l’autorisation de mise sur le marché
medisol
13 COURS VALMY
TOUR PACIFIC HALL OUEST
92800 PUTEAUX
1 RUE COMTE DE SINARD
26250 LIVRON SUR DROME
Noms du médicament dans les Etats membres de l'Espace Economique Européen
Sans objet.
La dernière date à laquelle cette notice a été révisée est :
[à compléter ultérieurement par le titulaire]
Des informations détaillées sur ce médicament sont disponibles sur le site Internet de l’ANSM (France).