Dernière mise à jour le 01/12/2025
BRINZOLAMIDE/TIMOLOL VIATRIS 10 mg/5 mg par mL, collyre en suspension
Indications thérapeutiques
BRINZOLAMIDE/TIMOLOL VIATRIS contient deux principes actifs, brinzolamide et timolol, qui agissent ensemble pour réduire la pression à l'intérieur de l'œil.
BRINZOLAMIDE/TIMOLOL VIATRIS est utilisé pour traiter une pression élevée à l’intérieur des yeux, appelée aussi glaucome ou hypertension oculaire, chez les patients adultes de plus de 18 ans et pour qui une pression élevée dans les yeux ne peut pas être contrôlée efficacement par un seul médicament.
Présentations
> 1 flacon(s) polyéthylène basse densité (PEBD) de 5 ml avec embout(s) de dispensation polyéthylène basse densité (PEBD)
Code CIP : 34009 301 993 0 5
Déclaration de commercialisation : 08/06/2020
Cette présentation est agréée aux collectivités
- Prix hors honoraire de dispensation : 3,86 €
- Honoraire de dispensation : 1,02 €
- Prix honoraire compris : 4,88 €
- Taux de remboursement :65 %
Service médical rendu (SMR)
Amélioration du service médical rendu (ASMR)
Ce médicament étant un générique, l'ASMR n'a pas été évalué par la commission de la transparence (CT), il est possible de se référer à la /aux spécialité(s) de référence du groupe générique auquel appartient ce médicament (cliquez ici pour aller à la rubrique des groupes génériques)
ANSM - Mis à jour le : 11/01/2024
BRINZOLAMIDE/TIMOLOL VIATRIS 10 mg/5 mg par mL, collyre en suspension
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Un mL de suspension contient 10 mg de brinzolamide et du maléate de timolol, correspondant à 5 mg de timolol.
Excipient à effet notoire : Un mL de suspension contient 0,10 mg de chlorure de benzalkonium.
Pour la liste complète des excipients, voir rubrique 6.1.
Collyre en suspension (collyre).
Suspension uniforme blanche à blanchâtre, pH 7,2 (environ).
4.1. Indications thérapeutiques
4.2. Posologie et mode d'administration
Utilisation chez les adultes et les sujets âgés
La posologie est d’une goutte de BRINZOLAMIDE/TIMOLOL VIATRIS dans le cul-de-sac conjonctival de l’œil ou des yeux atteint(s) deux fois par jour.
Le passage systémique peut être réduit par une occlusion nasolacrymale ou la fermeture des paupières. Cette méthode peut contribuer à diminuer les effets indésirables systémiques et à augmenter l'efficacité locale (voir rubrique 4.4).
Si une instillation est oubliée, le traitement doit être poursuivi avec l'instillation suivante comme prévu. La posologie ne doit pas excéder une goutte deux fois par jour dans l’œil (les yeux) atteint(s).
En cas de remplacement d’un autre médicament antiglaucomateux ophtalmique par BRINZOLAMIDE/ TIMOLOL VIATRIS, interrompre l’autre médicament et commencer BRINZOLAMIDE/TIMOLOL VIATRIS le jour suivant.
Populations spécifiques
Population pédiatrique
La sécurité et l’efficacité de BRINZOLAMIDE/TIMOLOL VIATRIS chez les enfants et les adolescents âgés de 0 à 18 ans n’ont pas encore été établies. Aucune donnée n’est disponible.
Insuffisance hépatique et rénale
Aucune étude n'a été effectuée avec le brinzolamide/timolol ou avec timolol 5 mg/mL collyre chez les patients ayant une insuffisance hépatique ou rénale. Aucune adaptation posologique n’est nécessaire chez les patients ayant une insuffisance hépatique ou chez les patients ayant une insuffisance rénale légère à modérée.
Le brinzolamide/timolol n’a pas été étudié chez les patients présentant une insuffisance rénale sévère (clairance de la créatinine < 30 mL/min) ou chez les patients présentant une acidose hyperchlorémique (voir rubrique 4.3). Étant donné que le brinzolamide et son principal métabolite sont excrétés majoritairement par le rein, BRINZOLAMIDE/TIMOLOL VIATRIS est par conséquent contre-indiqué chez les insuffisants rénaux sévères (voir rubrique 4.3).
BRINZOLAMIDE/TIMOLOL VIATRIS doit être utilisé avec précaution chez les patients ayant une insuffisance hépatique sévère (voir rubrique 4.4).
Mode d’administration
Voie ophtalmique.
Les patients doivent être informés de la nécessité de bien agiter le flacon avant utilisation. Après ouverture du bouchon, si le dispositif de sécurité du col du flacon est trop lâche, retirez-le avant d’utiliser ce produit.
Pour éviter la contamination de l’embout compte-gouttes et de la suspension, il faut faire attention de ne pas toucher les paupières, les surfaces voisines ou d’autres surfaces avec l’embout compte-gouttes du flacon. Les patients doivent être informés de la nécessité de conserver le flacon bien fermé quand il n’est pas utilisé.
En cas d’utilisation de plusieurs médicaments topiques ophtalmiques, les administrations de médicament doivent être espacées d’au moins 5 minutes. Les pommades ophtalmiques doivent être administrées en dernier.
· Hypersensibilité aux substances actives ou à l’un des excipients mentionnés à la rubrique 6.1.
· Hypersensibilité aux autres bêta-bloquants.
· Hypersensibilité aux sulfonamides (voir rubrique 4.4).
· Pathologies associées à une hyperréactivité bronchique notamment asthme bronchique ou antécédents d’asthme bronchique ou bronchopneumopathie chronique obstructive sévère.
· Bradycardie sinusale, maladie du sinus, bloc sino-auriculaire, bloc auriculo-ventriculaire du second ou du troisième degré non contrôlé par un pacemaker, insuffisance cardiaque confirmée ou choc cardiogénique.
· Rhinite allergique sévère
· Acidose hyperchlorémique (voir rubrique 4.2).
· Insuffisance rénale sévère.
4.4. Mises en garde spéciales et précautions d'emploi
· Le brinzolamide et le timolol passent dans la circulation générale. Du fait de la présence d’un bêta-bloquant, le timolol, des effets indésirables cardiovasculaires, pulmonaires et d’autres effets indésirables identiques à ceux rencontrés avec les agents bêta-bloquants administrés par voie systémique peuvent se produire. La fréquence des effets indésirables systémiques après administration par voie ophtalmique locale est plus faible qu’après administration par voie générale. Pour réduire l’absorption systémique, voir rubrique 4.2.
· Des réactions d’hypersensibilité communes à tous les dérivés des sulfonamides peuvent se produire chez des patients recevant BRINZOLAMIDE/TIMOLOL VIATRIS, car il passe dans la circulation générale.
· Brinzolamide est un sulfonamide inhibiteur de l’anhydrase carbonique qui même administré localement, est absorbé par voie générale. Les effets indésirables des sulfonamides peuvent aussi être observés avec la voie locale, y compris le syndrome de Stevens-Johnson (SSJ) et la nécrolyse épidermique toxique (NET). Lors de la prescription, les patients doivent être informés des signes et symptômes et les réactions dermiques doivent être surveillées de près. Si des signes de réactions graves ou d’hypersensibilité apparaissent, brinzolamide doit être immédiatement arrêté.
Troubles cardiaques
Chez les patients atteints de maladies cardiovasculaires (par exemple : maladie coronarienne, angor de Prinzmetal et insuffisance cardiaque) et d'hypotension, le traitement par bêta-bloquants doit être soigneusement évalué et un traitement avec d'autres substances actives doit être considéré. Chez ces patients, une surveillance doit être effectuée afin de rechercher des signes d’aggravation de ces pathologies ou des effets indésirables.
En raison de leur effet dromotrope négatif, les bêta-bloquants ne devront être prescrits qu’avec prudence aux patients atteints d’un bloc cardiaque de premier degré.
Troubles vasculaires
Les patients atteints de troubles circulatoires périphériques sévères (c'est-à-dire de formes sévères de la maladie de Raynaud ou du syndrome de Raynaud) doivent être traités avec prudence.
Hyperthyroïdie
Les bêta-bloquants peuvent aussi masquer les signes d'hyperthyroïdie.
Faiblesse musculaire
Il a été rapporté que les médicaments bêta-bloquants pouvaient aggraver la faiblesse musculaire accompagnant certains symptômes de la myasthénie (par ex., diplopie, ptosis et faiblesse générale).
Troubles respiratoires
Chez les patients asthmatiques, des manifestations respiratoires pouvant aller jusqu'au décès par bronchospasme ont été rapportées après administration de certains bêta-bloquants ophtalmiques.
BRINZOLAMIDE/TIMOLOL VIATRIS doit être administré avec prudence chez les patients souffrant de bronchopneumopathie chronique obstructive (BPCO) légère à modérée et seulement si le bénéfice potentiel semble supérieur au risque potentiel.
Hypoglycémie / diabète
Les bêta-bloquants doivent être administrés avec prudence chez les patients sujets à des hypoglycémies spontanées ou chez les patients présentant un diabète instable dans la mesure où les bêta-bloquants sont susceptibles de masquer les signes et symptômes d’une hypoglycémie aiguë.
Troubles acido-basiques
BRINZOLAMIDE/TIMOLOL VIATRIS contient du brinzolamide, qui est un sulfonamide. Les réactions indésirables attribuables aux sulfonamides peuvent être observées avec la voie locale. Des déséquilibres acido-basiques ont été rapportés avec des inhibiteurs de l’anhydrase carbonique par voie orale. Ce médicament doit être utilisé avec précaution chez des patients ayant un risque d’insuffisance rénale en raison du risque possible d’acidose métabolique. Si des signes de réactions graves ou d’hypersensibilité apparaissent, ce médicament doit être arrêté.
Vigilance mentale
Les inhibiteurs de l’anhydrase carbonique par voie orale peuvent diminuer l’aptitude aux tâches nécessitant une vigilance mentale et/ou une coordination physique. BRINZOLAMIDE/TIMOLOL VIATRIS présentant une absorption systémique ceci peut aussi se produire après administration locale.
Réactions anaphylactiques
Les patients, traités par bêta-bloquants et ayant des antécédents d'atopie ou de réactions anaphylactiques graves à différents allergènes, peuvent être plus réactifs à des administrations répétées de tels allergènes et ne pas répondre aux doses d'adrénaline habituellement utilisées pour traiter les réactions anaphylactiques.
Décollement de la choroïde
Des décollements de la choroïde ont été observés après chirurgie filtrante lors de l'administration de traitements diminuant la sécrétion d'humeur aqueuse (ex : timolol, acétazolamide).
Anesthésie chirurgicale
Les préparations ophtalmologiques à base de bêta-bloquants peuvent bloquer les effets des agents bêta-agonistes systémiques tels que l'adrénaline. L’anesthésiste doit être informé lorsque le patient reçoit du timolol.
Traitement concomitant
L'effet sur la pression intraoculaire ou les effets connus des bêta-bloquants par voie systémique peuvent être majorés en cas d'administration de timolol à des patients recevant déjà un bêta-bloquant systémique. La réponse de ces patients devra être étroitement surveillée. L'utilisation de deux bêta-bloquants topiques ou de deux inhibiteurs de l’anhydrase carbonique locaux n'est pas recommandée (voir rubrique 4.5).
Il existe des effets additionnels par rapport aux effets systémiques connus d’inhibition de l’anhydrase carbonique chez les patients prenant un inhibiteur de l’anhydrase carbonique par voie orale et BRINZOLAMIDE/TIMOLOL VIATRIS.
L’administration concomitante de BRINZOLAMIDE/TIMOLOL VIATRIS et d’inhibiteurs de l’anhydrase carbonique par voie orale n’a pas été étudiée et n’est pas recommandée (voir rubrique 4.5).
Effets oculaires
L’expérience du traitement par brinzolamide/timolol chez des patients présentant un glaucome pseudoexfoliatif ou un glaucome pigmentaire est limitée. Il conviendra de faire particulièrement attention lors du traitement de ces patients et une surveillance étroite de la PIO est recommandée.
Le brinzolamide/timolol n’a pas été évalué chez les patients présentant un glaucome à angle étroit et son utilisation n’est pas recommandée chez ces patients.
Les bêta-bloquants ophtalmiques peuvent entraîner une sécheresse oculaire. Les patients souffrant de maladies cornéennes doivent être traités avec prudence.
Le rôle éventuel du brinzolamide sur la fonction endothéliale cornéenne n’a pas été étudié chez les patients présentant une cornée fragilisée (notamment chez les patients ayant un faible nombre de cellules endothéliales). En particulier, les patients porteurs de lentilles de contact n’ont pas été étudiés et une surveillance attentive est recommandée chez ces patients sous brinzolamide étant donné que les inhibiteurs de l’anhydrase carbonique peuvent affecter l’hydratation cornéenne. Cela peut conduire à une décompensation cornéenne et à un œdème et le port de lentilles de contact peut augmenter le risque pour la cornée. Une surveillance attentive est recommandée chez les patients ayant une cornée fragilisée, tels que les patients présentant un diabète sucré ou des dystrophies cornéennes.
Le port de lentilles de contact est possible lors de l’utilisation de BRINZOLAMIDE/TIMOLOL VIATRIS mais sous étroite surveillance (voir ci-dessous sous « Chlorure de benzalkonium »).
Chlorure de benzalkonium
BRINZOLAMIDE/TIMOLOL VIATRIS contient du chlorure de benzalkonium. Le chlorure de benzalkonium est connu pour provoquer une irritation des yeux, des symptômes du syndrome de l’œil sec et peut affecter le film lacrymal et la surface de la cornée. Doit être utilisé avec prudence chez les patients atteints d’oeil sec et ceux présentant un risque d’endommagement de la cornée. Les patients doivent être surveillés en cas d’utilisation prolongée.
Il est aussi connu pour changer la couleur des lentilles de contact souples. Le contact avec des lentilles de contact souples doit être évité. Les patients doivent être informés de retirer leurs lentilles de contact avant application de BRINZOLAMIDE/TIMOLOL VIATRIS et attendre 15 minutes après l’instillation de la dose avant de les remettre.
Des kératopathies ponctuées et/ou kératopathies ulcératives toxiques ont aussi été rapportées avec le chlorure de benzalkonium. Une surveillance étroite est nécessaire lors d’une utilisation fréquente ou prolongée.
Insuffisance hépatique
BRINZOLAMIDE/TIMOLOL VIATRIS doit être utilisé avec précaution chez les patients ayant une insuffisance hépatique grave.
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
Aucune étude d’interaction médicamenteuse spécifique n’a été réalisée avec le brinzolamide/timolol.
BRINZOLAMIDE/TIMOLOL VIATRIS contient un inhibiteur de l’anhydrase carbonique, le brinzolamide qui, bien qu’administré par voie locale, présente une absorption systémique. Des déséquilibres acido-basiques ont été rapportés avec des inhibiteurs de l’anhydrase carbonique par voie orale. La possibilité d’interactions doit être envisagée chez les patients traités avec BRINZOLAMIDE/TIMOLOL VIATRIS.
Chez les patients recevant un inhibiteur de l’anhydrase carbonique par voie orale et du brinzolamide en collyre, il existe un risque de potentialisation des effets systémiques connus de l’inhibition de l’anhydrase carbonique. Il n’est pas recommandé d’administrer de façon concomitante un collyre contenant du brinzolamide et un inhibiteur de l’anhydrase carbonique par voie orale.
Les iso-enzymes du cytochrome P-450 responsables du métabolisme du brinzolamide comprennent le CYP3A4 (principal), CYP2A6, CYP2B6, CYP2C8 et CYP2C9. Il est donc attendu que les inhibiteurs du CYP3A4 tels que le kétoconazole, l’itraconazole, le clotrimazole, le ritonavir et la troléandomycine puissent inhiber le métabolisme du brinzolamide via le CYP3A4. Il est conseillé d’être prudent lorsque les inhibiteurs du CYP3A4 sont donnés simultanément.
Cependant, l’élimination rénale étant la voie principale, l’accumulation de brinzolamide est improbable. Le brinzolamide n’est pas un inhibiteur des iso-enzymes du cytochrome P-450.
Un effet additif, entraînant une hypotension et/ou une bradycardie marquée, peut être observé lors de l’administration simultanée de solution ophtalmique de bêta-bloquant et d’inhibiteurs des canaux calciques, d’agents bloquants bêta-adrénergiques, d’antiarythmiques (notamment l’amiodarone), de glycosides digitaliques, de parasympathomimétiques, de guanéthidine administrés par voie orale.
Les bêta-bloquants peuvent diminuer la réponse à l’adrénaline utilisée pour traiter des réactions anaphylactiques. Une attention particulière doit être apportée aux patients ayant des antécédents d’atopie ou d’anaphylaxie (voir rubrique 4.4).
La poussée hypertensive réactionnelle survenant lors de l'arrêt brutal de la clonidine peut être majorée en cas d'administration de bêta-bloquants. Une attention particulière est recommandée lors de l’utilisation concomitante de ce médicament et de la clonidine.
Une potentialisation de l’effet bêta-bloquant systémique (par exemple : diminution du rythme cardiaque, dépression) a été rapportée lors de l’association de traitements inhibiteurs du CYP2D6 (par exemple : quinidine, fluoxétine, et paroxétine) et de timolol.
Une attention particulière est recommandée.
Les bêta-bloquants peuvent majorer l'effet hypoglycémiant des antidiabétiques. Les bêta-bloquants peuvent masquer les signes et les symptômes de l'hypoglycémie (voir rubrique 4.4).
Des mydriases ont été occasionnellement rapportées lorsque les bêta-bloquants ophtalmiques et l'adrénaline (épinéphrine) ont été utilisés de façon concomitante.
4.6. Fertilité, grossesse et allaitement
Grossesse
Il n'existe pas de données pertinentes concernant l'utilisation du brinzolamide ou du timolol administrés par voie oculaire chez la femme enceinte. Les études effectuées chez l’animal avec le brinzolamide ont mis en évidence une toxicité sur la reproduction après une administration systémique, voir rubrique 5.3. BRINZOLAMIDE/TIMOLOL VIATRIS ne doit pas être utilisé pendant la grossesse sauf en cas de nécessité absolue. Pour réduire l’absorption systémique, voir la rubrique 4.2.
Les études épidémiologiques n'ont pas révélé d'effet malformatif mais ont montré un risque de retard de croissance intra-utérin lorsque les bêta-bloquants sont administrés par la voie orale. De plus, les signes et les symptômes d’un effet bêta-bloquant (par exemple : bradycardie, hypotension, détresse respiratoire et hypoglycémie) ont été observés chez le nouveau-né lorsque les bêta-bloquants ont été administrés jusqu'à l'accouchement. Si BRINZOLAMIDE/TIMOLOL VIATRIS est administré jusqu’à l’accouchement, le nouveau-né doit être surveillé attentivement pendant les premiers jours de sa vie.
Il n’a pas été établi que le brinzolamide par voie oculaire était excrété dans le lait maternel humain. Les études chez l’animal après administration orale ont montré que le brinzolamide était excrété dans le lait maternel, voir rubrique 5.3.
Les bêta-bloquants sont excrétés dans le lait maternel. Cependant, aux doses thérapeutiques de timolol contenues dans les collyres, il est peu probable que la quantité passant dans le lait maternel suffise à produire les symptômes cliniques des bêta-bloquants chez le nourrisson. Pour réduire l’absorption systémique, voir la rubrique 4.2.
Cependant, un risque pour l’enfant allaité ne peut être exclu. Une décision doit être prise soit d’interrompre l’allaitement soit d’interrompre/de s’abstenir du traitement avec BRINZOLAMIDE/TIMOLOL VIATRIS en prenant en compte le bénéfice de l’allaitement pour l’enfant au regard du bénéfice du traitement pour la femme.
Fertilité
Aucune étude n’a été réalisée afin d’évaluer l’effet d’une administration topique oculaire de brinzolamide/timolol sur la fertilité humaine.
Les études non cliniques n’ont pas démontré d’effet du brinzolamide ou du timolol sur la fertilité masculine ou féminine suite à une administration orale. Aucun effet de l’utilisation du brinzolamide/timolol sur la fertilité masculine ou féminine n’est anticipé.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
Une vision floue provisoire ou d’autres troubles visuels peuvent diminuer l’aptitude à conduire des véhicules ou à utiliser des machines. En cas de vision floue survenant lors de l’instillation, le patient doit attendre que sa vision redevienne normale avant de conduire un véhicule ou d’utiliser une machine.
Les inhibiteurs de l’anhydrase carbonique peuvent diminuer l’aptitude aux tâches nécessitant une vigilance mentale et/ou une coordination physique (voir rubrique 4.4).
Résumé du profil de tolérance
Lors des études cliniques, les effets indésirables les plus fréquemment rencontrés étaient une vision floue, une irritation oculaire et une douleur oculaire, survenant chez environ 2 % à 7 % des patients.
Résumé tabulé des effets indésirables
Les effets indésirables suivants ont été rapportés au cours des essais cliniques et de la surveillance post-commercialisation du brinzolamide/timolol et de ses composants, brinzolamide et timolol, pris individuellement. Ils ont été classés de la façon suivante : très fréquents (≥ 1/10), fréquents (≥ 1/100, < 1/10), peu fréquents (≥ 1/1 000, < 1/100), rares (≥ 1/10 000, < 1/1 000), très rares (< 1/10 000) ou indéterminés (ne peuvent être estimés sur la base des données disponibles). Dans chaque groupe de fréquence, les effets indésirables sont présentés dans l’ordre décroissant de gravité.
|
Classe de systèmes d’organes |
Terme préféré MedDRA (v. 18.0) |
|
Infections et infestations |
Fréquence indéterminée : rhinopharyngite3, pharyngite3, sinusite3, rhinite3 |
|
Affections hématologiques et du système lymphatique |
Peu fréquent : baisse de la numération leucocytaire1 Fréquence indéterminée : diminution du nombre de globules rouges3, augmentation du taux de chlorure dans le sang3 |
|
Affections du système immunitaire |
Fréquence indéterminée : anaphylaxie2, choc anaphylactique1, réaction allergique systémique incluant angioedème2, rash localisé et généralisé2, hypersensibilité1, urticaire2, prurit2 |
|
Troubles métaboliques et nutritionnels |
Fréquence indéterminée : hypoglycémie2 |
|
Affections psychiatriques |
Rare : insomnie1 Fréquence indéterminée : dépression1, perte de mémoire2, apathie3, humeur dépressive3, diminution de la libido3, cauchemar2, 3, nervosité3, hallucination2 |
|
Affections du système nerveux |
Fréquent : dysgueusie1 Fréquence indéterminée : ischémie cérébrale2, accident cérébrovasculaire2, syncope2, augmentation des signes et des symptômes de la myasthénie grave2, somnolence3, dysfonctionnement de la motricité3, amnésie3, atteinte de la mémoire3, paresthésie2,3, tremblement3, hypoesthésie3, agueusie3, vertiges1, maux de tête1 |
|
Affections oculaires |
Fréquent : kératite ponctuée1, vision floue1, douleur oculaire1, irritation oculaire1 Peu fréquent : kératite1,2,3, œil sec1, présence d’une coloration naturelle de la cornée1, écoulement oculaire1, prurit oculaire1, sensation de corps étranger dans les yeux1, hyperhémie oculaire1, hyperhémie conjonctivale1 Rare : érosion cornéenne1, inflammation de la chambre antérieure de l’oeil1, photophobie1, larmoiement augmenté1, hyperhémie sclérale1, érythème de la paupière1, formation de croûtes sur le bord des paupières1 Fréquence indéterminée : augmentation du rapport excavation papillaire/disque du nerf optique3, détachement choroïdal après une chirurgie filtrante2 (voir rubrique 4), kératopathie3, anomalie de l'épithélium cornéen3, affection de l'épithélium cornéen3, augmentation de la pression intraoculaire3, dépôt oculaire3, coloration cornéenne3, œdème cornéen3, diminution de la sensibilité cornéenne2, conjonctivite3, meibomite3, diplopie2,3, éblouissements3, photopsie3, baisse d'acuité visuelle3, déficience visuelle1, ptérygion3, gêne oculaire3, kératoconjonctivite sèche3, hypoesthésie oculaire3, pigmentation sclérale3, kyste sous-conjonctival3, trouble visuel3, gonflement oculaire3, allergie oculaire3, madarose3, affection de la paupière3, œdème de la paupière1, ptôsis2 |
|
Affections de l’oreille et du labyrinthe |
Fréquence indéterminée : vertiges3, acouphène3 |
|
Affections cardiaques |
Fréquent : diminution de la fréquence cardiaque1 Fréquence indéterminée : arrêt cardiaque2, insuffisance cardiaque2, insuffisance cardiaque congestive2, bloc atrioventriculaire2, détresse cardio-respiratoire3, angine de poitrine3, bradychardie2, 3, fréquence cardiaque irrégulière3, arrythmie2,3, palpitations2,3, tachycardie3, augmentation de la fréquence cardiaque3, douleur thoracique2, oedème2 |
|
Affections vasculaires |
Peu fréquent : diminution de la pression artérielle1 Fréquence indéterminée : hypotension2, hypertension3, augmentation de la pression artérielle1, syndrome de Raynaud2, mains et pieds froids2 |
|
Affections respiratoires, thoraciques et médiastinales |
Peu fréquent : toux1 Rare : douleur oropharyngée1, rhinorrhée1 Fréquence indéterminée : bronchospasme2 (prédominant chez les patients ayant une maladie bronchospastique), dyspnée1, asthme3, épistaxis1, hyperactivité bronchique3, irritation de la gorge3, congestion nasale3, congestion des voies respiratoires supérieures3, rhinorrhée postérieure3, éternuement3, sécheresse nasale3 |
|
Troubles gastro-intestinaux |
Fréquence indéterminée : vomissements2,3, douleur abdominale haute1, douleur abdominale2, diarrhée1, bouche sèche1, nausée1, oesophagite3, dyspepsie2,3, gêne abdominale3, gêne au niveau de l’estomac3, mouvements intestinaux fréquents3, affection gastro-intestinale3, hypoesthésie orale3, paresthésie orale3, flatulence3 |
|
Affections hépato-biliaires |
Fréquence indéterminée : bilan hépatique anormal3 |
|
Affections de la peau et du tissu sous-cutané |
Fréquence indéterminée : urticaire3, rash maculopapuleux3, prurit généralisé3, tiraillements cutanés3, dermatite3, alopécie1, éruption psoriasiforme ou exacerbation du psoriasis2, éruption cutanée1, érythème1 syndrome de Stevens-Johnson (SSJ)/ nécrolyse épidermique toxique (NET)3 |
|
Affections musculosquelettiques et systémiques |
Fréquence indéterminée : myalgie1, spasmes musculaires3, arthralgie3, mal de dos3, douleur aux extrêmités3 |
|
Affections du rein et des voies urinaires |
Peu fréquent : présence de sang dans les urines1 Fréquence indéterminée : douleurs rénales3, pollakiurie3 |
|
Affections des organes de reproduction et troubles mammaires |
Fréquence indéterminée : dysfonction érectile3, dysfonction sexuelle2, diminution de la libido2 |
|
Troubles généraux et anomalies au site d'administration |
Peu fréquent : malaise1, 3 Fréquence indéterminée : douleur thoracique1, douleur3, fatigue1, asthénie2,3, gêne thoracique3, sensation de nervosité3, irritabilité3, œdème périphérique3, résidu de médicament3 |
|
Investigations |
Peu fréquent : augmentation du taux de potassium dans le sang1, augmentation du taux de lacticodéshydrogénase dans le sang1 |
1 réactions indésirables rencontrées avec l’association brinzolamide/timolol
2 réactions indésirables supplémentaires observées avec timolol en monothérapie
3 réactions indésirables supplémentaires observées avec brinzolamide en monothérapie
Description de certains effets indésirables
Un effet indésirable systémique fréquemment rapporté associé à l’utilisation de brinzolamide/timolol au cours des études cliniques a été la dysgueusie (goût amer ou inhabituel dans la bouche après instillation). Il est probablement dû au passage du collyre dans le nasopharynx par le canal nasolacrymal et il est imputable au brinzolamide.
L’occlusion nasolacrymale ou la fermeture douce des paupières après l’instillation peut contribuer à réduire la fréquence de cet effet (voir rubrique 4.2).
BRINZOLAMIDE/TIMOLOL VIATRIS contient du brinzolamide qui est un sulfonamide inhibiteur de l’anhydrase carbonique absorbé par voie systémique. Les effets gastro-intestinaux, affectant le système nerveux, hématologiques, rénaux et métaboliques sont généralement associés aux inhibiteurs de l’anhydrase carbonique systémiques. Les effets indésirables des inhibiteurs de l’anhydrase carbonique par voie orale peuvent être observés avec la voie locale.
Le timolol passe dans la circulation générale. Cela peut entraîner des réactions indésirables semblables à celles des médicaments bêta-bloquants pris par voie systémique. Les réactions indésirables mentionnées comprennent des réactions rencontrées dans la classe des bêta-bloquants ophtalmiques.
D’autres effets indésirables liés à l’utilisation d’un des composants, qui peuvent éventuellement survenir avec le brinzolamide/timolol sont mentionnés dans le tableau ci-dessus. L'incidence des réactions indésirables systémiques après une administration topique ophtalmique est inférieure à celle d’une administration systémique. Afin de réduire l'absorption systémique, voir rubrique 4.2.
Population pédiatrique
BRINZOLAMIDE/TIMOLOL VIATRIS n’est pas recommandé chez les enfants et les adolescents de moins de 18 ans en raison de l’absence de données de tolérance et d’efficacité.
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr.
En cas d’ingestion accidentelle, les symptômes d’un surdosage en bêta-bloquants peuvent inclure bradycardie, hypotension, insuffisance cardiaque et bronchospasme.
En cas de surdosage avec BRINZOLAMIDE/TIMOLOL VIATRIS collyre, le traitement devra être symptomatique et de soutien. À cause du brinzolamide, un déséquilibre hydro-électrolytique, le développement d’un état d’acidose et d’éventuels effets sur le système nerveux central peuvent survenir. L’ionogramme (en particulier le potassium) et le pH sanguin devront être surveillés. Des études ont montré que le timolol ne dialyse pas rapidement.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Mécanisme d’action
BRINZOLAMIDE/TIMOLOL VIATRIS associe deux principes actifs : le brinzolamide et le maléate de timolol. Ces deux composants réduisent la PIO élevée principalement en diminuant la sécrétion d’humeur aqueuse, ceci par différents mécanismes d’action. L'effet combiné de ces deux principes actifs permet d’obtenir une réduction supplémentaire de la pression intraoculaire par rapport à chaque composant pris isolément.
Le brinzolamide est un inhibiteur puissant de l’anhydrase carbonique II (AC-II), l’iso-enzyme prédominant de l’œil. L’inhibition de l’anhydrase carbonique dans les procès ciliaires de l’œil diminue la sécrétion d’humeur aqueuse, probablement en ralentissant la formation des ions bicarbonates, ce qui conduit à une réduction du transport de sodium et d’eau.
Le timolol est un agent non sélectif bloquant les récepteurs adrénergiques, n'ayant ni effet sympathomimétique intrinsèque, ni effet dépresseur myocardique direct, ni effet stabilisant de membrane. Des études tonographiques et fluorophotométriques chez l'Homme suggèrent que son action prédominante est liée à la réduction de formation de l’humeur aqueuse et une légère augmentation de l'écoulement.
Effets pharmacodynamiques
Effets cliniques :
Dans une étude contrôlée sur 12 mois réalisée chez des patients atteints de glaucome à angle ouvert ou d’hypertonie oculaire qui présentaient une PIO initiale moyenne de 25 à 27 mmHg, et pour lesquels l’investigateur considérait qu’un traitement combiné serait bénéfique, la baisse moyenne de PIO sous brinzolamide/timolol 10 mg/mL + 5 mg/mL, collyre en suspension administré deux fois par jour était de 7 à 9 mmHg. La non-infériorité du brinzolamide/timolol 10 mg/mL + 5 mg/mL, collyre en suspension par rapport au dorzolamide 20 mg/mL + timolol 5 mg/mL pour la réduction de la PIO moyenne a été démontrée à tous les temps pour toutes les visites.
Dans une étude contrôlée de 6 mois réalisée chez des patients atteints de glaucome à angle ouvert ou d’hypertonie oculaire, et présentant une PIO initiale moyenne de 25 à 27 mmHg, la baisse moyenne de PIO sous brinzolamide/timolol 10 mg/mL + 5 mg/mL, collyre en suspension administré deux fois par jour était de 7 à 9 mmHg et pouvait atteindre 3 mmHg de plus qu’avec le brinzolamide 10 mg/mL administré 2 fois par jour et 2 mmHg de plus qu’avec le timolol 5 mg/mL administré deux fois par jour. La réduction de PIO moyenne était statistiquement supérieure à celle obtenue avec le brinzolamide et le timolol à tous les temps et pour toutes les visites de l’étude.
Dans trois études cliniques contrôlées, la gêne oculaire lors de l'instillation de brinzolamide/timolol 10 mg/mL + 5 mg/mL, collyre en suspension était significativement plus faible que lors de l’instillation de dorzolamide 20 mg/mL + timolol 5 mg/mL.
5.2. Propriétés pharmacocinétiques
Suite à l’administration locale oculaire, le brinzolamide et le timolol sont absorbés à travers la cornée et dans la circulation générale. Dans une étude pharmacocinétique, des volontaires sains ont reçu du brinzolamide par voie orale (1 mg) deux fois par jour pendant 2 semaines avant de débuter l’administration de brinzolamide/timolol 10 mg/mL + 5 mg/mL, collyre en suspension pour diminuer le temps nécessaire pour atteindre l’état d’équilibre. Après deux administrations quotidiennes de brinzolamide/timolol 10 mg/mL + 5 mg/mL, collyre en suspension pendant 13 semaines, les concentrations de brinzolamide dans les globules rouges étaient d’environ 18,8 ± 3,29 μM, 18,1 ± 2,68 μM et 18,4 ± 3,01 μM aux semaines 4, 10 et 15 respectivement, indiquant que les concentrations érythrocytaires de brinzolamide à l’état d’équilibre étaient maintenues.
À l’état d’équilibre, à la suite de l’administration de brinzolamide/timolol 10 mg/mL + 5 mg/mL, collyre en suspension , les valeurs plasmatiques moyennes Cmax et l’ASC0-12h du timolol étaient respectivement 27 % et 28 % inférieures (Cmax : 0,824 ± 0,453 ng/mL; ASC0-12h : 4,71 ± 4,29 ng h/mL) à celles obtenues suite à l’administration du timolol 5 mg/mL (Cmax : 1,13 ± 0,494 ng/mL; ASC0-12h : 6,58 ± 3,18 ng h/mL). La plus faible exposition systémique au timolol suite à l’administration de brinzolamide/timolol 10 mg/mL + 5 mg/mL, collyre en suspension n’est pas cliniquement pertinente. Suite à l’administration de brinzolamide/timolol 10 mg/mL + 5 mg/mL, collyre en suspension, la Cmax moyenne du timolol était atteinte à 0,79 ± 0,45 heures.
Distribution
La liaison du brinzolamide aux protéines plasmatiques est modérée (environ 60 %). Le brinzolamide est séquestré dans les globules rouges en raison de sa forte affinité pour l’AC-II et, dans une moindre mesure, pour l’AC-I. Le métabolite actif N-déséthyl brinzolamide s’accumule aussi dans les globules rouges où il se lie principalement à l’AC-I. L’affinité du brinzolamide et de son métabolite pour les globules rouges et l'AC tissulaire conduit à de faibles concentrations plasmatiques.
Chez le lapin, les données de distribution dans les tissus oculaires ont montré que le timolol peut être dosé dans l’humeur aqueuse jusqu’à 48 heures après administration de brinzolamide/timolol 10 mg/mL + 5 mg/mL, collyre en suspension. À l’état d’équilibre, le timolol est détecté dans le plasma humain jusqu’à 12 heures après administration de brinzolamide/timolol 10 mg/mL + 5 mg/mL, collyre en suspension.
Biotransformation
Les voies métaboliques du brinzolamide impliquent une N-désalkylation, une O-désalkylation et une oxydation de sa chaîne N-propyl. Le N-déséthyl brinzolamide est un des principaux métabolites du brinzolamide formé chez l’Homme, qui se lie aussi à l’AC-I en présence de brinzolamide et s'accumule dans les globules rouges. Des études in vitro montrent que le métabolisme du brinzolamide implique principalement le CYP3A4 ainsi qu’au moins quatre autres isoenzymes (CYP2A6, CYP2B6, CYP2C8 et CYP2C9).
Le timolol est métabolisé selon 2 voies. La première conduit à une chaîne éthanolamine sur le cycle thiadiazole et la seconde conduit à une chaîne éthanolique sur l'azote morpholine et une seconde chaîne similaire avec un groupe carbonyle adjacent à l'azote. Le métabolisme du timolol est assuré principalement par le CYP2D6.
Élimination
Le brinzolamide est principalement éliminé par excrétion rénale (environ 60 %). Environ 20 % de la dose ont été retrouvés dans les urines sous forme de métabolite. Le brinzolamide et le N-déséthyl brinzolamide sont les principaux composants retrouvés dans les urines accompagnés des métabolites N-desméthoxypropyl et O-desméthyl à l’état de traces (< 1 %).
Le timolol et ses métabolites sont principalement excrétés par les reins. Environ 20 % d'une dose de timolol sont excrétés dans l'urine sous forme inchangée et le reste est excrété dans l'urine sous forme métabolisée. Après administration de brinzolamide/timolol 10 mg/mL + 5 mg/mL, collyre en suspension, la demi-vie plasmatique du timolol est de 4,8 heures.
5.3. Données de sécurité préclinique
Les données non cliniques issues des études conventionnelles de pharmacologie de sécurité, toxicologie en administration répétée, génotoxicité, cancérogenèse n’ont pas révélé de risque particulier du brinzolamide pour l’Homme.
Des études de toxicité développementale chez le lapin recevant des doses de brinzolamide par voie orale allant jusqu’à 6 mg/kg/jour (214 fois la dose thérapeutique journalière recommandée de 28 μg/kg/jour) n’ont pas révélé d’effet sur le développement fœtal malgré une toxicité maternelle significative. Des études similaires chez le rat ont conduit à de légères réductions de l’ossification du crâne et des barres sternales des fœtus des mères recevant du brinzolamide aux doses de 18 mg/kg/jour (642 fois la dose thérapeutique journalière recommandée) ; ces réductions n’ont pas été observées à 6 mg/kg/jour. Ces résultats sont apparus à des doses entraînant des acidoses métaboliques avec diminution du gain de poids corporel des mères et diminution des poids fœtaux. Chez les petits de mères recevant du brinzolamide par voie orale, des diminutions dose-dépendantes des poids fœtaux ont été observées, allant d’une légère diminution (environ 5-6 %) à la dose de 2 mg/kg/jour à près de 14 % à la dose de 18 mg/kg/jour. Pendant l'allaitement, la dose sans effet sur la portée était de 5 mg/kg/jour.
Timolol
Les données non cliniques issues des études conventionnelles de pharmacologie de sécurité, toxicologie en administration répétée, génotoxicité, cancérogenèse n’ont pas révélé de risque particulier du timolol pour l’Homme. Des études de toxicité de reproduction avec le timolol ont révélé un retard d’ossification du fœtus sans effet sur le développement post-natal chez le rat (à 50 mg/kg/jour ou 3 500 fois la dose thérapeutique journalière de 14 µg/kg/jour) et des augmentations de résorptions fœtales chez le lapin (à 90 mg/kg/jour ou 6 400 fois la dose thérapeutique journalière).
30 mois.
4 semaines après première ouverture.
6.4. Précautions particulières de conservation
Ce médicament ne nécessite pas de précautions particulières de conservation.
6.5. Nature et contenu de l'emballage extérieur
Flacon de 10 mL en polyéthylène basse densité (PEBD), avec un embout de dispensation en PEBD et un bouchon en polyéthylène haute densité (PEHD) contenant 5 mL de suspension.
Un étui contient 1, 3 ou 6 flacons.
Toutes les présentations peuvent ne pas être commercialisées.
6.6. Précautions particulières d’élimination et de manipulation
Pas d’exigences particulières.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
1 RUE DE TURIN
69007 LYON
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· 34009 301 993 0 5 : 5 mL en flacon (PEBD) ; boîte de 1.
· 34009 550 712 5 9 : 5 mL en flacon (PEBD) ; boîte de 3.
· 34009 550 712 6 6 : 5 mL en flacon (PEBD) ; boîte de 6.
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
[à compléter ultérieurement par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE
[à compléter ultérieurement par le titulaire]
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Liste I
ANSM - Mis à jour le : 11/01/2024
BRINZOLAMIDE/TIMOLOL VIATRIS 10 mg/5 mg par mL, collyre en suspension
Brinzolamide/timolol
· Gardez cette notice. Vous pourriez avoir besoin de la relire.
· Si vous avez d’autres questions, interrogez votre médecin ou votre pharmacien.
· Ce médicament vous a été personnellement prescrit. Ne le donnez pas à d’autres personnes. Il pourrait leur être nocif, même si les signes de leur maladie sont identiques aux vôtres.
· Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
1. Qu'est-ce que BRINZOLAMIDE/TIMOLOL VIATRIS 10 mg/5 mg par mL, collyre en suspension et dans quels cas est-il utilisé ?
2. Quelles sont les informations à connaître avant d'utiliser BRINZOLAMIDE/TIMOLOL VIATRIS 10 mg/5 mg par mL, collyre en suspension ?
3. Comment utiliser BRINZOLAMIDE/TIMOLOL VIATRIS 10 mg/5 mg par mL, collyre en suspension?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver BRINZOLAMIDE/TIMOLOL VIATRIS 10 mg/5 mg par mL, collyre en suspension ?
6. Contenu de l’emballage et autres informations.
1. QU’EST-CE QUE BRINZOLAMIDE/TIMOLOL VIATRIS 10 mg/5 mg par mL, collyre en suspension ET DANS QUELS CAS EST-IL UTILISE ?
BRINZOLAMIDE/TIMOLOL VIATRIS contient deux principes actifs, brinzolamide et timolol, qui agissent ensemble pour réduire la pression à l'intérieur de l'œil.
BRINZOLAMIDE/TIMOLOL VIATRIS est utilisé pour traiter une pression élevée à l’intérieur des yeux, appelée aussi glaucome ou hypertension oculaire, chez les patients adultes de plus de 18 ans et pour qui une pression élevée dans les yeux ne peut pas être contrôlée efficacement par un seul médicament.
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT D’UTILISER BRINZOLAMIDE/TIMOLOL VIATRIS 10 mg/5 mg par mL, collyre en suspension ?
N’utilisez jamais BRINZOLAMIDE/TIMOLOL VIATRIS 10 mg/5 mg par mL, collyre en suspension :
· si vous êtes allergique au brinzolamide, aux médicaments appelés sulfonamides (incluant par exemple des médicaments utilisés pour traiter le diabète, les infections) et aussi aux diurétiques (médicaments favorisant l’élimination de l’eau), au timolol, aux bêta-bloquants (médicaments utilisés pour diminuer la tension artérielle ou pour traiter une maladie cardiaque) ou à l’un des autres composants contenus dans ce médicament (mentionnés dans la rubrique 6) ;
· si vous avez actuellement ou avez eu dans le passé des problèmes respiratoires tels que de l'asthme, une bronchite obstructive durable grave (une maladie pulmonaire grave qui peut entraîner une respiration sifflante, une gêne respiratoire et/ou une toux persistante) ou d'autres problèmes respiratoires ;
· si vous avez un rhume des foins sévère ;
· si vous avez un rythme cardiaque lent, une insuffisance cardiaque ou des troubles du rythme cardiaque (des battements de cœur irréguliers) ;
· si vous avez trop d’acidité dans le sang (une maladie appelée acidose hyperchlorémique) ;
· si vous avez de graves problèmes rénaux.
Avertissements et précautions
Utilisez uniquement BRINZOLAMIDE/TIMOLOL VIATRIS en gouttes dans l’œil (les yeux).
Si des signes de réactions graves ou d'hypersensibilité surviennent, il convient d’interrompre l'utilisation de ce produit et d’en parler à votre médecin.
Adressez-vous à votre médecin ou pharmacien avant d’utiliser BRINZOLAMIDE/TIMOLOL VIATRIS si vous avez ou si vous avez eu dans le passé :
· une maladie coronarienne (dont les symptômes peuvent inclure une douleur ou une oppression thoracique, une difficulté à respirer ou une suffocation), une insuffisance cardiaque, une pression artérielle basse ;
· des troubles du rythme cardiaque, tels qu’un rythme cardiaque lent ;
· des problèmes respiratoires, de l’asthme ou une bronchite chronique obstructive ;
· des problèmes de circulation sanguine (tels qu’une maladie de Raynaud ou un syndrome de Raynaud) ;
· du diabète parce que le timolol peut masquer les signes et symptômes d’un faible taux de sucre dans le sang ;
· un excès d’hormones thyroïdiennes parce que le timolol peut masquer les signes et symptômes d’une maladie de la thyroïde ;
· une faiblesse musculaire (myasthénie grave) ;
· prévenez votre médecin que vous utilisez BRINZOLAMIDE/TIMOLOL VIATRIS avant une intervention chirurgicale car le timolol peut modifier les effets de certains médicaments utilisés pendant l’anesthésie ;
· si vous avez déjà développé une éruption cutanée sévère ou une desquamation de la peau, des cloques et/ou des lésions buccales suite à l’utilisation de brinzolamide ou d’autres médicaments apparentés.
· si vous avez des antécédents d’atopie (une tendance à développer une réaction allergique) et des réactions allergiques sévères, vous pouvez être plus susceptible de développer une réaction allergique en utilisant BRINZOLAMIDE/TIMOLOL VIATRIS, et le traitement par adrénaline peut ne pas s'avérer efficace pour traiter une réaction allergique. Lorsque l’on vous donne un autre traitement, informez votre médecin ou votre infirmière que vous prenez BRINZOLAMIDE/ TIMOLOL VIATRIS ;
· si vous avez des problèmes hépatiques ;
· si vous avez les yeux secs ou des problèmes de cornée ;
· si vous avez des problèmes avec vos reins.
Faites attention lors de l’utilisation de BRINZOLAMIDE/TIMOLOL VIATRIS:
Des réactions cutanées graves, y compris le syndrome de Stevens-Johnson et la nécrolyse épidermique toxique, ont été rapportées en association avec le traitement par le BRINZOLAMIDE/TIMOLOL VIATRIS. Arrêtez la prise de brinzolamide et consultez immédiatement un médecin si vous remarquez l'un des symptômes liés à ces réactions cutanées graves décrites dans la rubrique 4.
Enfants et adolescents
BRINZOLAMIDE/TIMOLOL VIATRIS n’est pas recommandé chez les enfants et les adolescents de moins de 18 ans.
Autres médicaments et BRINZOLAMIDE/TIMOLOL VIATRIS 10 mg/5 mg par mL, collyre en suspension
Informez votre médecin ou pharmacien si vous utilisez, avez récemment utilisé ou pourriez utiliser tout autre médicament.
BRINZOLAMIDE/TIMOLOL VIATRIS peut affecter ou être affecté par d'autres médicaments que vous prenez, y compris d'autres collyres pour traiter le glaucome. Informez votre médecin si vous prenez ou que vous avez l’intention de prendre des médicaments pour diminuer la tension artérielle tels que les parasympathomimétiques et la guanéthidine, ou d’autres médicaments pour le cœur tels que la quinidine (utilisée pour traiter certains problèmes cardiaques et certains types de malaria), l’amiodarone ou d’autres médicaments pour traiter les troubles du rythme du cœur et les glucosides pour traiter une insuffisance cardiaque.
Informez aussi votre médecin si vous prenez ou que vous avez l’intention de prendre des médicaments pour traiter le diabète, ou pour traiter les ulcères gastriques, ou un antifongique, ou un antiviral, ou un antibiotique ou encore des antidépresseurs tels que fluoxétine et paroxétine.
Si vous prenez un autre inhibiteur de l’anhydrase carbonique (acétazolamide ou dorzolamide), parlez-en à votre médecin.
Une augmentation de la taille de la pupille en prenant BRINZOLAMIDE/TIMOLOL VIATRIS et de l’adrénaline (épinéphrine) ensemble a été rapportée occasionnellement.
N’utilisez pas BRINZOLAMIDE/TIMOLOL VIATRIS si vous êtes enceinte ou si vous pouvez le devenir, à moins que votre médecin considère que cela est nécessaire. Parlez-en à votre médecin avant d’utiliser BRINZOLAMIDE/TIMOLOL VIATRIS.
N’utilisez pas BRINZOLAMIDE/TIMOLOL VIATRIS si vous allaitez. Le timolol peut passer dans votre lait.
Demandez conseil à votre médecin avant de prendre tout médicament, pendant que vous allaitez.
Conduite de véhicules et utilisation de machines
Ne conduisez pas de véhicules et n’utilisez pas de machines avant que votre vision ne soit redevenue claire. Vous pouvez trouver que votre vision est trouble pendant un certain temps juste après avoir utilisé BRINZOLAMIDE/TIMOLOL VIATRIS.
Un des principes actifs peut diminuer la capacité de réaliser des tâches nécessitant vigilance et/ou coordination motrice. Si vous êtes concerné(e), prenez garde à la conduite de véhicules ou à l’utilisation de machines.
BRINZOLAMIDE/TIMOLOL VIATRIS 10 mg/5 mg par mL, collyre en suspension contient du chlorure de benzalkonium
Ce médicament contient 0,0033 mg de chlorure de benzalkonium dans chaque goutte, équivalent à 0,01 % ou 0,1 mg/mL.
Le chlorure de benzalkonium est un conservateur dans BRINZOLAMIDE/TIMOLOL VIATRIS qui peut être absorbé par les lentilles de contact souples et changer leur couleur. Retirer les lentilles de contact avant application et attendre au moins 15 minutes avant de les remettre.
Le chlorure de benzalkonium peut également provoquer une irritation des yeux, surtout si vous souffrez du syndrome de l’œil sec ou de troubles de la cornée (couche transparente à l’avant de l’œil). En cas de sensation anormale, de picotements ou de douleur dans les yeux après avoir utilisé ce médicament, contactez votre médecin.
3. COMMENT UTILISER BRINZOLAMIDE/TIMOLOL VIATRIS 10 mg/5 mg par mL, collyre en suspension ?
Si vous changez de collyre pour votre glaucome et débutez BRINZOLAMIDE/TIMOLOL VIATRIS, vous devrez arrêter l’utilisation de l’autre médicament et commencer à utiliser BRINZOLAMIDE/TIMOLOL VIATRIS le lendemain. Vérifiez auprès de votre médecin ou de votre pharmacien en cas de doute.
Pour éviter de contaminer le compte-gouttes et la suspension, prendre bien soin de ne pas toucher les paupières, les zones avoisinantes ni aucune autre surface avec l'extrémité du compte-gouttes. Garder le flacon hermétiquement fermé lorsque le produit n'est pas utilisé.
La mesure suivante est utile pour limiter la quantité de médicament qui passera dans le sang après application du collyre :
· gardez la paupière fermée, tout en appuyant doucement sur le coin de l’œil proche du nez pendant au moins 2 minutes.
La dose recommandée est :
Une goutte dans l’œil ou les yeux atteint(s), deux fois par jour.
Utilisez BRINZOLAMIDE/TIMOLOL VIATRIS dans les deux yeux uniquement si votre médecin vous a dit de le faire. Prenez-le aussi longtemps que votre médecin vous l’a dit.
Comment l’utiliser
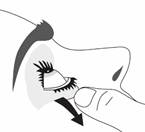
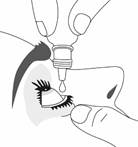
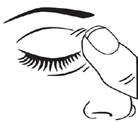
Figure 1 Figure 2 Figure 3
· Prenez le flacon et un miroir.
· Lavez-vous les mains.
· Agitez bien avant usage.
· Enlevez le bouchon du flacon. Après ouverture du bouchon, si le dispositif de sécurité du col du flacon est trop lâche, retirez-le avant d’utiliser ce produit.
· Tenez le flacon tête en bas, entre le pouce et l’index.
· Penchez la tête en arrière. Avec un doigt propre, tirez doucement votre paupière vers le bas pour créer un sillon entre la paupière et votre œil. La goutte sera déposée à cet endroit (figure 1).
· Rapprochez l’embout du flacon de l’œil. Si besoin, utilisez le miroir.
· Ne touchez pas votre œil, vos paupières, les surfaces voisines ou d’autres surfaces avec le compte-gouttes. Cela peut infecter le collyre.
· Pressez le flacon pour libérer une goutte dans le sillon formé avec la paupière (figure 2).
· Après avoir utilisé BRINZOLAMIDE/TIMOLOL VIATRIS, appuyez avec un doigt sur le coin de votre œil près du nez au moins 1 minute. Ceci permet d’empêcher la pénétration de BRINZOLAMIDE/TIMOLOL VIATRIS dans le reste du corps (figure 3).
· Si vous devez traiter les deux yeux, recommencez ces étapes pour l’autre œil.
· Refermez bien le flacon immédiatement après usage.
· Finissez entièrement un flacon avant d’ouvrir le flacon suivant.
Si une goutte tombe à côté de votre œil, recommencez.
Si vous utilisez un autre collyre ou une autre pommade ophtalmique, attendez au moins 5 minutes entre chaque médicament. Les pommades ophtalmiques doivent être administrées en dernier.
Si vous avez utilisé plus de BRINZOLAMIDE/TIMOLOL VIATRIS 10 mg/5 mg par mL, collyre en suspension que vous n’auriez dû
Rincez votre œil avec de l’eau tiède. Ne mettez pas d’autre goutte jusqu’à ce que le moment soit venu de mettre la goutte suivante.
Vous pouvez présenter une diminution du rythme cardiaque, une diminution de la tension artérielle, une insuffisance cardiaque, des difficultés à respirer et votre système nerveux peut être atteint.
Si vous oubliez d’utiliser BRINZOLAMIDE/TIMOLOL VIATRIS 10 mg/5 mg par mL, collyre en suspension, continuez avec la goutte suivante comme prévu. Ne mettez pas une double dose pour compenser la dose manquante. Ne mettez pas plus d’une goutte dans l’œil (les yeux) atteint(s), deux fois par jour.
Si vous arrêtez d’utiliser BRINZOLAMIDE/TIMOLOL VIATRIS 10 mg/5 mg par mL, collyre en suspension sans en parler à votre médecin, la pression de votre œil ne sera pas contrôlée ce qui pourrait provoquer une perte de la vue.
Si vous avez d’autres questions sur l’utilisation de ce médicament, demandez plus d’informations à votre médecin ou à votre pharmacien.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
Arrêtez d’utiliser ce médicament et contactez votre médecin immédiatement :
· si vous avez une éruption cutanée, une réaction cutanée grave ou une rougeur et une irritation graves de l’œil. Ceci peut être le signe d’une réaction allergique (la fréquence est indéterminée).
· plaques rougeâtres non surélevées, en forme de cible ou circulaires sur le tronc, souvent avec des cloques centrales, une desquamation de la peau, aphtes de la bouche, de la gorge, du nez, des organes génitaux et des yeux. Ces éruptions cutanées graves peuvent être précédées de fièvre et de symptômes pseudo-grippaux (syndrome de Stevens-Johnson, nécrolyse épidermique toxique)
Vous pouvez continuer à prendre le collyre, à moins que les effets ne soient graves. Si vous vous inquiétez, contactez votre médecin ou votre pharmacien. N’arrêtez pas votre traitement BRINZOLAMIDE/TIMOLOL VIATRIS sans en parler d’abord à votre médecin.
Effets indésirables fréquents (peuvent affecter jusqu’à 1 personne sur 10)
· Effets oculaires : inflammation de la surface de l’œil, vision floue, signes et symptômes d’irritation oculaire (par exemple : sensation de brûlure, picotements, démangeaisons, larmoiement, rougeur), douleur oculaire.
· Effets indésirables généraux : diminution de la fréquence cardiaque, goût perturbé
Effets indésirables peu fréquents (peuvent affecter jusqu’à 1 personne sur 100)
· Effets oculaires : érosion cornéenne (dommage de la partie avant du globe oculaire), inflammation de la surface de l’œil avec lésion oculaire, inflammation à l’intérieur de l’œil, coloration de la cornée, sensations anormales dans les yeux, écoulement oculaire, œil sec, yeux fatigués, démangeaison de l’œil, rougeur de l’œil, rougeur des paupières.
· Effets indésirables généraux : diminution du taux de globules blancs, diminution de la pression artérielle, toux, sang dans les urines, faiblesse corporelle.
Effets indésirables rares (peuvent affecter jusqu’à 1 personne sur 1 000)
· Effets oculaires : affection cornéenne, sensibilité à la lumière, augmentation de la production de larmes, croûtes sur les paupières.
· Effets indésirables généraux : troubles du sommeil (insomnie), mal de gorge, nez qui coule.
Fréquence indéterminée (ne peut être estimée sur la base des données disponibles)
· Effets oculaires : allergie oculaire, troubles de la vision, altération du nerf optique, augmentation de la pression intraoculaire, dépôts sur la surface oculaire, perception visuelle diminuée, inflammation ou infection de la conjonctive (blanc de l’œil), vision anormale, double ou diminuée, augmentation de la pigmentation de l’œil, excroissance sur la surface de l’œil, gonflement de l’œil, sensibilité à la lumière, diminution de la pousse ou du nombre de cils, paupière supérieure tombante (forçant l’œil à rester à moitié fermé), inflammation de la paupière et des glandes de la paupière, inflammation de la cornée et décollement de la partie en dessous de la rétine qui contient les vaisseaux sanguins à la suite d’une chirurgie filtrante, ce qui peut causer des troubles de la vision, diminution de la sensibilité cornéenne.
· Cœur et système circulatoire : modification du rythme ou de la vitesse des battements cardiaques, ralentissement du rythme cardiaque, palpitations, autre type de trouble du rythme du cœur, augmentation anormale de la fréquence cardiaque, douleur dans la poitrine, fonction cardiaque réduite, crise cardiaque, augmentation de la pression artérielle, diminution de l’irrigation sanguine du cerveau, accident cérébrovasculaire, œdème (accumulation de liquide), insuffisance cardiaque congestive (maladie cardiaque avec essoufflement et gonflement des pieds et des jambes en raison d’une accumulation de liquide), gonflement des extrémités, tension artérielle basse, décoloration des doigts, des orteils, et parfois d’autres parties du corps (syndrome de Raynaud), mains et pieds froids.
· Système respiratoire : rétrécissement des voies aériennes pulmonaires (principalement chez les patients présentant une maladie pré-existante), essoufflement ou difficulté à respirer, symptômes de rhume, encombrement des bronches, sinusite, éternuements, nez bouché, sécheresse nasale, saignements de nez, asthme, irritation de la gorge.
· Système nerveux et troubles généraux : dépression, cauchemars, perte de mémoire, maux de tête, nervosité, irritabilité, fatigue, tremblements, sensation de mal-être, évanouissement, vertiges, somnolence, faiblesse générale ou sévère, sensations inhabituelles de picotements et fourmillements, hallucination.
· Système digestif : nausées, vomissements, diarrhée, gaz intestinaux ou inconfort abdominal, inflammation de la gorge, sécheresse ou sensibilité anormale de la bouche, indigestion, maux d’estomac.
· Système sanguin : bilan hépatique anormal, augmentation du taux de chlorure dans le sang, ou diminution du nombre de globules rouges lors d’un bilan sanguin.
· Réactions allergiques : augmentation des symptômes allergiques, réactions allergiques généralisées incluant des gonflements de la peau qui peuvent survenir sur le visage et les membres, pouvant obstruer les voies aériennes et provoquer des difficultés pour respirer ou avaler, de l’urticaire, une éruption localisée ou généralisée, des démangeaisons, une réaction allergique soudaine pouvant menacer le pronostic vital.
· Oreilles : bourdonnements d’oreilles, sensation de tournis ou vertiges.
· Peau : éruption cutanée, rougeur de la peau ou inflammation, sensation cutanée anormale ou diminuée, chute de cheveux, éruption d’apparence blanc-argenté (éruption psoriasiforme) ou aggravation d’un psoriasis.
· Muscles : douleur généralisée, dans le dos, les articulations ou les muscles non provoquée par l’exercice, spasmes musculaires, douleurs aux extrémités, faiblesse/fatigue musculaire, augmentation des signes et symptômes de myasthénie gravis (trouble musculaire).
· Reins : douleurs rénales telles que douleur dans le bas du dos, envie fréquente d’uriner.
· Reproduction : troubles sexuels, diminution de la libido, problèmes sexuels masculins.
· Métabolisme : faible taux de sucre dans le sang.
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet: https://signalement.social-sante.gouv.fr
En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.
5. COMMENT CONSERVER BRINZOLAMIDE/TIMOLOL VIATRIS 10 mg/5 mg par mL, collyre en suspension ?
Tenir ce médicament hors de la vue et de la portée des enfants.
N’utilisez pas ce médicament après la date de péremption indiquée sur le flacon et sur la boîte après {EXP}. La date de péremption fait référence au dernier jour de ce mois.
Ce médicament ne nécessite pas de précautions particulières de conservation.
Jetez le flacon 4 semaines après l’avoir ouvert pour la première fois, pour prévenir les infections, et utilisez un nouveau flacon. Inscrivez la date à laquelle vous l’avez ouvert dans l’espace prévu à cet effet sur l’étiquette du flacon et sur la boîte.
Ne jetez aucun médicament au tout-à-l’égout ou avec les ordures ménagères. Demandez à votre pharmacien d’éliminer les médicaments que vous n’utilisez plus. Ces mesures contribueront à protéger l’environnement.
6. CONTENU DE L’EMBALLAGE ET AUTRES INFORMATIONS
Ce que contient BRINZOLAMIDE/TIMOLOL VIATRIS 10 mg/5 mg par mL, collyre en suspension
· Les substances actives sont le brinzolamide et le timolol.
Un mL de suspension contient 10 mg brinzolamide et du maléate de timolol, correspondant à 5 mg de timolol.
· Les autres composants sont :
chlorure de benzalkonium (voir rubrique 2 « BRINZOLAMIDE/TIMOLOL VIATRIS 10 mg/5 mg par mL, collyre en suspension contient du chlorure de benzalkonium »), carbomère, édétate disodique, mannitol (E421), eau purifiée, chlorure de sodium, acide chlorhydrique et/ou hydroxyde de sodium. Des petites quantités d’acide chlorhydrique et/ou d’hydroxyde de sodium sont ajoutées pour conserver des niveaux d’acidité (niveaux de pH) normaux.
BRINZOLAMIDE/TIMOLOL VIATRIS 10 mg/5 mg par mL, collyre en suspension est une suspension liquide uniforme blanche à blanchâtre fournie dans une boîte contenant un flacon de 10 mL en polyéthylène basse densité (PEBD), avec un embout de dispensation en PEBD et un bouchon en polyéthylène haute densité (PEHD) contenant 5 mL de suspension.
Étuis contenant 1, 3 ou 6 flacons.
Toutes les présentations peuvent ne pas être commercialisées.
Titulaire de l’autorisation de mise sur le marché
1 RUE DE TURIN
69007 LYON
Exploitant de l’autorisation de mise sur le marché
1 RUE DE TURIN
69007 LYON
LUSOMEDICAMENTA SOCIEDADE TECNICA FARMACEUTICA SA
RUA NORBERTO DE OLIVEIRA, Nº 1/5
2620-111 POVOA DE SANTO ADRIAO
PORTUGAL
Noms du médicament dans les Etats membres de l'Espace Economique Européen
Ce médicament est autorisé dans les Etats membres de l'Espace Economique Européen sous les noms suivants : Conformément à la réglementation en vigueur.
[à compléter ultérieurement par le titulaire]
La dernière date à laquelle cette notice a été révisée est :
[à compléter ultérieurement par le titulaire]
< {MM/AAAA}>< {mois AAAA}.>
Des informations détaillées sur ce médicament sont disponibles sur le site Internet de l’ANSM (France).