Dernière mise à jour le 02/02/2026
IPRATROPIUM ALMUS PHARMA 0,50 mg/2 ml ADULTES, solution pour inhalation par nébuliseur en récipient unidose
Indications thérapeutiques
Classe pharmacothérapeutique : anticholinergique - code ATC : R03BB01
Il agit en augmentant le diamètre des bronches.
Dans quels cas est-il utilisé ?
Votre médecin vous a prescrit ce médicament car vous avez besoin de recevoir de fortes doses de cette substance active afin de traiter
· une crise d’asthme grave,
· ou une difficulté à respirer provoquée par une maladie au long cours encombrant vos bronches (poussées aiguës au cours de la bronchite chronique obstructive).
Pour prendre ce médicament, vous utiliserez un appareil appelé nébuliseur qui vous permettra de prendre ce médicament en utilisant votre respiration (également appelée voie inhalée).
Si vous avez une crise d’asthme aiguë
Si vous avez une crise d’asthme aiguë grave, ce médicament ne suffit pas à lui tout seul.
Vous devez vous faire hospitaliser.
Vous devrez alors utiliser en complément un autre médicament par voie inhalée qui augmentera également le diamètre de vos bronches. Cet autre médicament contiendra une substance active appartenant à une famille de médicament appelée les bêta2 mimétiques dont l’action est rapide et de courte durée.
Présentations
> 10 récipient(s) unidose(s) polyéthylène basse densité (PEBD) suremballée(s)/surpochée(s) polyester aluminium polyéthylène de 2 ml
Code CIP : 34009 301 797 7 2
Déclaration de commercialisation : 05/02/2020
Cette présentation est agréée aux collectivités
- Prix hors honoraire de dispensation : 3,74 €
- Honoraire de dispensation : 1,02 €
- Prix honoraire compris : 4,76 €
- Taux de remboursement :65 %
Service médical rendu (SMR)
Amélioration du service médical rendu (ASMR)
Ce médicament étant un générique, l'ASMR n'a pas été évalué par la commission de la transparence (CT), il est possible de se référer à la /aux spécialité(s) de référence du groupe générique auquel appartient ce médicament (cliquez ici pour aller à la rubrique des groupes génériques)
Autres informations
- Titulaire de l'autorisation : ALMUS France
- Conditions de prescription et de délivrance :
- liste I
- prescription réservée aux spécialistes et services PEDIATRIE
- prescription réservée aux spécialistes et services PNEUMOLOGIE
- réservé à l'usage en situation d'urgence selon l'article R5121-96 du code de la santé publique
- réservé à une structure d'assistance médicale mobile ou de rapatriement sanitaire
- Statut de l'autorisation : Valide
- Type de procédure : Procédure nationale
- Code CIS : 6 548 566 5
ANSM - Mis à jour le : 08/12/2023
IPRATROPIUM ALMUS PHARMA 0,50 mg/2 ml ADULTES, solution pour inhalation par nébuliseur en récipient unidose
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Bromure d’ipratropium........................................................................................................ 0,500 mg
Sous forme de bromure d’ipratropium monohydraté.
Pour un récipient unidose de 2 ml.
Pour la liste complète des excipients, voir rubrique 6.1.
Solution pour inhalation par nébuliseur en récipient unidose.
Solution claire et transparente.
4.1. Indications thérapeutiques
Remarque: l’asthme aigu grave nécessite une hospitalisation en milieu spécialisé. Une oxygénothérapie et une corticothérapie par voie systémique doivent être associées au traitement bronchodilatateur.
4.2. Posologie et mode d'administration
Posologie
Le patient doit être informé qu’en cas de dyspnée aiguë ou présentant une aggravation rapide, un médecin doit être consulté immédiatement.
Chez l’adulte, la dose usuelle est de 0,5 mg par nébulisation, soit 1 dose unitaire de 2 ml diluée dans du sérum physiologique de façon à obtenir un volume de 5 ml.
Les nébulisations peuvent être répétées toutes les 20 à 30 minutes en fonction de l’état clinique du patient.
Mode d’administration
Cette solution d’ipratropium doit être administrée par voie inhalée à l’aide d’un appareil pour nébulisation (nébuliseur).
Ne pas injecter - ne pas avaler.
Se conformer au mode d’emploi de l’appareil utilisé.
Diluer la quantité nécessaire d’ipratropium dans du sérum physiologique de façon à obtenir un volume total de 5 ml.
Le mélange obtenu est pulsé par un débit d’air ou d’oxygène (6 à 8 litres/minute) pendant environ 10 à 15 minutes durant lesquelles le patient respire à son rythme habituel.
La technique d’utilisation par le patient doit être vérifiée régulièrement.
Après inhalation, la solution inutilisée restant dans la cuve de l’appareil doit être jetée.
La solution pour inhalation IPRATROPIUM ALMUS PHARMA est adaptée à une inhalation concomitante avec un bêta2 mimétique d’action rapide.
4.4. Mises en garde spéciales et précautions d'emploi
L’action bronchodilatatrice de l’ipratropium par voie inhalée est moins puissante que celle des bêta2 mimétiques par voie inhalée. Il convient en cas de crise d’asthme ou de bronchospasme aigu de ne pas l’utiliser en première intention ou seul mais d’administrer également un bêta2 mimétique.
L’administration d’ipratropium à l’aide d’un nébuliseur doit être réservée aux situations aiguës graves nécessitant l’inhalation d’une posologie élevée de produit par voie inhalée. Ces situations nécessitent une surveillance médicale avec possibilité de mise en place d’une réanimation (abord veineux et assistance respiratoire); une oxygénothérapie et corticothérapie par voie systémique doivent généralement y être associées.
L’apparition de signes de glaucome par fermeture de l’angle (douleur ou gêne oculaire, vision trouble, perception d’images colorées, rougeur conjonctivale, congestion de la cornée) nécessite l’interruption du traitement et un avis médical spécialisé immédiat.
Comme avec les autres médicaments inhalés, IPRATROPIUM ALMUS PHARMA peut entrainer un bronchospasme paradoxal pouvant mettre en jeu le pronostic vital. Si un bronchospasme paradoxal survient, IPRATROPIUM ALMUS PHARMA doit être arrêté immédiatement et un autre traitement doit être instauré.
Précautions d’emploi
En cas d’infection bronchique ou de bronchorrhée abondante, un traitement approprié est nécessaire afin de favoriser la diffusion optimale du produit dans les voies respiratoires.
En raison de l’activité anticholinergique de l’ipratropium, la projection accidentelle d’ipratropium dans l’œil provoque une mydriase par effet parasympatholytique. Les patients prédisposés à un risque de glaucome par fermeture de l’angle devront se protéger des risques de projection intraoculaires de ce médicament (ex : port de lunettes). Il est préférable d’administrer la solution nébulisée d’ipratropium par l’intermédiaire d’un embout buccal. Un masque d’inhalation peut également être utilisé à condition qu’il soit étanche.
Le traitement par le bromure d’ipratropium doit être prescrit avec prudence chez les personnes âgées, notamment chez les sujets masculins présentant des antécédents d’obstruction des voies urinaires (par exemple, un adénome prostatique ou une obstruction urétrale).
Le bromure d’ipratropium sera utilisé avec prudence chez les patients atteints de muscoviscidose plus souvent sujets à des troubles de la motilité gastro-intestinale.
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
Associations à prendre en compte
+ Autres médicaments atropiniques
Il faut prendre en compte le fait que les substances atropiniques peuvent additionner leurs effets indésirables et entraîner plus facilement une rétention urinaire, une poussée aiguë de glaucome, une constipation, une sécheresse de la bouche, etc...
Les divers médicaments atropiniques sont représentés par les antidépresseurs imipraminiques, la plupart des antihistaminiques H1 atropiniques, les antiparkinsoniens anticholinergiques, les antispasmodiques atropiniques, le disopyramide, les neuroleptiques phénothiaziniques ainsi que la clozapine.
+ Médicaments anticholinestérasiques
Risque de moindre efficacité de l’anticholinestérasique par antagonisme des récepteurs de l’acétylcholine par l’atropine
+ Morphiniques
Risque important d’akinésie colique, avec constipation sévère
4.6. Fertilité, grossesse et allaitement
Grossesse
Les études chez l’animal n’ont pas mis en évidence d’effet tératogène. En l’absence d’effet tératogène chez l’animal, un effet malformatif dans l’espèce humaine n’est pas attendu. En effet, à ce jour, les substances responsables de malformations dans l’espèce humaine se sont révélées tératogènes chez l’animal au cours d’études bien conduites sur deux espèces.
En clinique, aucun effet malformatif ou fœtotoxique particulier n’est apparu à ce jour. Toutefois, le suivi de grossesses exposées au bromure d’ipratropium est insuffisant pour exclure tout risque.
En conséquence, l’utilisation du bromure d’ipratropium ne doit être envisagée au cours de la grossesse que si nécessaire. En cas d’administration en fin de grossesse, tenir compte des répercussions possibles pour le nouveau-né des propriétés atropiniques de cette molécule.
En l’absence de données sur le passage dans le lait de l’ipratropium, et compte tenu de ses propriétés atropiniques son utilisation est déconseillée durant l’allaitement sauf nécessité absolue.
Fertilité
Les études précliniques réalisées avec le bromure d’ipratropium n’ont pas mis en évidence d’effets néfastes sur la fertilité (voir rubrique 5.3). Les données cliniques sur la fertilité ne sont pas disponibles pour le bromure d’ipratropium.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
Les effets sur l'aptitude à conduire des véhicules et à utiliser des machines n'ont pas été étudiés.
Les patients doivent être informés du risque de troubles de l’accommodation visuelle, de mydriase, de vision trouble et de possibles sensations vertigineuses au cours du traitement par IPRATROPIUM ALMUS PHARMA. Par conséquent, il convient de faire preuve de prudence lors de la conduite d’un véhicule ou de l’utilisation d’une machine.
La plupart des effets indésirables listés peuvent être attribués aux propriétés anticholinergiques de IPRATROPIUM ALMUS PHARMA.
Comme tous les traitements par inhalation, IPRATROPIUM ALMUS PHARMA peut engendrer des symptômes d'irritation locale.
Résumé du profil de sécurité d’emploi
Les effets indésirables les plus fréquemment signalés lors des essais cliniques étaient les céphalées, les irritations de la gorge, la toux, la sécheresse de la bouche, les troubles de la motilité gastro-intestinale (constipation, diarrhée et vomissement), les nausées et les vertiges.
Tableau résumé des effets indésirables
Les effets indésirables ont été identifiés à partir des données d’essais cliniques et de pharmacovigilance obtenues durant l'utilisation du médicament après sa mise sur le marché.
Les effets indésirables ont été classés en fonction de leur fréquence en utilisant la classification suivante :
Très fréquent (³ 1/10) ; fréquent (³ 1/100, < 1/10) ; peu fréquent (³ 1/1000, < 1/100) ; rare (³ 1/10000, < 1/1000) ; très rare (< 1/10000) ; fréquence indéterminée (ne peut être estimée sur la base des données disponibles).
|
Terme usuel MedDRA |
Fréquence |
|
Affections du système immunitaire Hypersensibilité Réaction anaphylactique |
Peu fréquent Peu fréquent |
|
Affections du système nerveux Céphalées Sensations vertigineuses |
Fréquent Fréquent |
|
Affections oculaires Glaucome par fermeture de l’angle Augmentation de la pression intraoculaire Mydriase Douleur oculaire Œdème cornéen Hyperémie conjonctivale Vision de halo Vision trouble Troubles de l’accommodation visuelle |
Peu fréquent Peu fréquent Peu fréquent Peu fréquent Peu fréquent Peu fréquent Peu fréquent Peu fréquent Rare |
|
Troubles cardiaques Tachycardie supraventriculaire Palpitations Fibrillation auriculaire Tachycardie |
Peu fréquent Peu fréquent Rare Rare |
|
Affections respiratoires, thoraciques et médiastinales Toux Irritation pharyngée Bronchospasme paradoxal Bronchospasme Laryngospasme Œdème pharyngé Sécheresse de la gorge |
Fréquent Fréquent Peu fréquent Peu fréquent Peu fréquent Peu fréquent Peu fréquent |
|
Affections gastro-intestinales Sécheresse de la bouche Nausées Troubles de la motilité gastro-intestinale Constipation Vomissements Diarrhées Œdème buccal Stomatite |
Fréquent Fréquent Fréquent Peu fréquent Peu fréquent Peu fréquent Peu fréquent Peu fréquent |
|
Affections de la peau et du tissu sous-cutané Rashs cutanés Prurit Œdème de Quincke Urticaire |
Peu fréquent Peu fréquent Peu fréquent Rare |
|
Affections du rein et des voies urinaires Rétention urinaire |
Peu fréquent |
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr/ .
La répétition abusive des inhalations peut favoriser l’apparition des effets indésirables locaux (sécheresse buccale, irritation pharyngée) et la survenue d’effets systémiques anticholinergiques.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Classe pharmacothérapeutique : anticholinergiques, code ATC : R03BB01.
L'ipratropium est un bronchodilatateur anticholinergique par voie inhalée.
Administré par voie inhalée, le bromure d’ipratropium exerce une action compétitive préférentielle au niveau des récepteurs cholinergiques du muscle lisse bronchique entraînant par effet parasympatholytique une relaxation de celui-ci et une bronchodilatation. Son effet bronchodilatateur est moins puissant que celui exercé par les bêta2 mimétiques par voie inhalée.
L’action bronchospasmolytique apparaît rapidement (3 minutes) et persiste pendant 4 à 6 heures.
Les effets, faisant suite à l’inhalation de IPRATROPIUM ALMUS PHARMA (bromure d’ipratropium), sont principalement locaux et spécifiques aux poumons, et sans caractère systémique.
5.2. Propriétés pharmacocinétiques
La quantité absorbée après administration par voie inhalée est minime et les taux sériques faibles correspondraient à l’absorption intestinale partielle de la fraction déglutie très faiblement absorbée par voie digestive. Après administration orale, cette absorption peut être évaluée entre 15 et 30 % de la quantité administrée. La demi-vie d’élimination est de l’ordre de 3,5 heures. L’excrétion se fait essentiellement par voie urinaire.
Après administration par voie inhalée, le passage de la barrière hémato-encéphalique est très faible.
L’excrétion rénale cumulée (0 à 24 heures) du composé parent est d’environ 46 % d’une dose administrée par voie intraveineuse, de moins de 1 % d’une dose orale et environ 3 à 13 % d’une dose inhalée. Sur la base de ces données, la biodisponibilité systémique totale de doses orales et inhalées de bromure d’ipratropium est estimée à respectivement 2 % et 7 à 28 %.
De ce fait, les portions de dose de bromure d’ipratropium avalées ne contribuent pas de manière importante à l’exposition systémique.
Distribution
Les paramètres cinétiques décrivant le sort de l’ipratropium ont été calculés à partir des concentrations plasmatiques après administration intraveineuse. Une baisse biphasique rapide des concentrations plasmatiques est observée. Le volume de distribution apparent à l’équilibre (Vdss) est d’environ 176 L (environ 2,4 L/kg). Le médicament se lie de manière minimale (moins de 20 %) aux protéines plasmatiques. Les données précliniques indiquent que l’amine quaternaire ipratropium ne traverse pas le placenta ni la barrière hématoencéphalique.
Biotransformation
Après administration intraveineuse, environ 60 % de la dose sont métabolisés, probablement la majeure partie dans le foie par oxydation.
Les métabolites connus, qui sont formés par hydrolyse, déshydratation ou élimination du groupe hydroxy-méthyle dans le fragment acide tropique, montrent très peu ou pas d’affinité pour les récepteurs muscariniques et doivent être considérés comme inefficaces.
Elimination
La demi-vie de la phase d’élimination terminale est d’environ 1,6 heure.
L’ipratropium possède une clairance totale de 2,3 L/min et une clairance rénale de 0,9 L/min. Dans une étude du bilan d’excrétion, l’excrétion rénale cumulée (6 jours) de la radioactivité liée au médicament (incluant le composé parent et tous ses métabolites) a représenté 72,1 % après administration intraveineuse, 9,3 % après administration orale et 3,2 % après inhalation. La radioactivité totale excrétée via les selles était de 6,3 % après administration intraveineuse, de 88,5 % après administration orale et de 69,4 % après inhalation. En ce qui concerne l’excrétion de la radioactivité liée au médicament après administration intraveineuse, l’excrétion principale se produit via les reins. La demi-vie d’élimination de la radioactivité liée au médicament (composé parent et métabolites) est de 3,6 heures.
5.3. Données de sécurité préclinique
Toxicité à dose unique
La toxicité aiguë par inhalation, administration orale et administration intraveineuse a été évaluée dans plusieurs espèces de rongeurs et de non-rongeurs.
En cas d’inhalation, la dose létale minimale chez le cochon d’Inde mâle est de 199 mg/kg.
Chez le rat, aucune mortalité n’a été observée jusqu’aux doses les plus élevées techniquement possibles (c’est-à-dire 0,05 mg/kg après 4 h d’administration ou 160 bouffées de bromure d’ipratropium, 0,02 mg/bouffée).
Les valeurs de DL50 orale chez la souris, le rat et le lapin sont respectivement de 1 585, 1 925 et 1 920 mg/kg. La DL50 intraveineuse chez la souris, le rat et le chien est, respectivement de 13,6, 15,8 et environ 18,2 mg/kg. Les signes cliniques incluent une mydriase, une sécheresse de la muqueuse buccale, une dyspnée, des tremblements, des spasmes et/ou une tachycardie.
Toxicité à dose répétée
Des études de toxicité à dose répétée ont été menées chez des rats, des lapins, des chiens et des singes Rhésus.
Dans les études d’inhalation d’une durée allant jusqu’à 6 mois chez des rats, des chiens et des singes Rhésus, la NOAEL (dose sans effet indésirable observé) était de respectivement 0,38 mg/kg/jour, 0,18 mg/kg/jour et 0,8 mg/kg/jour. Une sécheresse de la muqueuse buccale et une tachycardie ont été notées chez les chiens. Aucune lésion histopathologique liée à la substance n’a été observée dans l’appareil bronchopulmonaire ni aucun autre organe. Chez le rat, la NOAEL après 18 mois d’administration orale était de 0,5 mg/kg/jour.
Tolérance locale
Une solution aqueuse de bromure d’ipratropium (0,05 mg/kg) a été bien tolérée localement lors de l’administration à des rats par inhalation (administration unique sur 4 h). Dans les études de toxicité à dose répétée, le bromure d’ipratropium a été bien toléré localement.
Immunogénicité
Aucune anaphylaxie active ni réaction anaphylactique cutanée passive n’a été démontrée chez des cochons d’Inde.
Génotoxicité et carcinogénicité
Il n’a pas été observé de génotoxicité in vitro (test d’Ames), ni in vivo (test du micronoyau, test létal dominant chez la souris, essai cytogénétique sur des cellules de moelle osseuse de hamsters chinois).
Aucun effet tumorigène ni carcinogène n’a été démontré lors d’études à long terme chez des souris et des rats.
Toxicité de la reproduction et du développement
Des études visant à explorer l’influence possible du bromure d’ipratropium sur la fertilité, la toxicité embryonnaire et fœtale et le développement péri-/postnatal ont été conduites chez des souris, des rats et des lapins.
Des niveaux de dose orale élevés, c’est-à-dire de 1 000 mg/kg/jour chez le rat et de 125 mg/kg/jour chez le lapin, ont été associés à une toxicité maternelle dans les deux espèces et à une toxicité embryonnaire/fœtale chez le rat, où le poids des fœtus a été réduit. Il n’a pas été observé de malformations liées au traitement.
Les doses les plus élevées techniquement possibles pour l’inhalation au moyen de l’aérosol doseur, de 1,5 mg/kg/jour chez les rats et de 1,8 mg/kg/jour chez les lapins, n’ont été associées à aucun effet indésirable sur la reproduction.
Chlorure de sodium, acide chlorhydrique concentré, eau pour préparations injectables.
Ce médicament ne doit pas être mélangé à une solution contenant du chlorure de benzalkonium en raison du risque d’incompatibilité physicochimique.
Cromoglycate disodique
La solution pour inhalation IPRATROPIUM ALMUS PHARMA en ampoules unidoses et les solutions pour inhalation de cromoglycate disodique ne doivent pas être administrées simultanément dans le même nébuliseur.
3 ans.
6.4. Précautions particulières de conservation
A conserver à une température ne dépassant pas 25°C.
6.5. Nature et contenu de l'emballage extérieur
2 ml en récipient unidose (PEBD) avec un suremballage (Polyester/Aluminium/PE).
Boîte de 1, 10, 20, 30, 60 ou 100.
Toutes les présentations peuvent ne pas être commercialisées.
6.6. Précautions particulières d’élimination et de manipulation
Pas d’exigences particulières.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
211 AVENUE DES GRESILLONS
92330 GENNEVILLIERS
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· 34009 301 797 6 5 : 1 récipient(s) unidose(s) polyéthylène basse densité (PEBD) de 2 ml.
· 34009 301 797 7 2 : 10 récipient(s) unidose(s) polyéthylène basse densité (PEBD) de 2 ml.
· 34009 301 797 8 9 : 20 récipient(s) unidose(s) polyéthylène basse densité (PEBD) de 2 ml.
· 34009 301 797 9 6 : 30 récipient(s) unidose(s) polyéthylène basse densité (PEBD) de 2 ml.
· 34009 301 798 0 2 : 60 récipient(s) unidose(s) polyéthylène basse densité (PEBD) de 2 ml.
· 34009 550 650 6 7 : 100 récipient(s) unidose(s) polyéthylène basse densité (PEBD) de 2 ml.
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
[à compléter ultérieurement par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE
[à compléter ultérieurement par le titulaire]
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Liste I.
Médicament à prescription réservée aux spécialistes en pneumologie ou en pédiatrie. Médicament pouvant être administré par tout médecin intervenant en situation d’urgence ou dans le cadre d’une structure d’assistance médicale mobile ou de rapatriement sanitaire (article R. 5121-96 du code de la santé publique).
ANSM - Mis à jour le : 08/12/2023
Bromure d’ipratropium
· Gardez cette notice. Vous pourriez avoir besoin de la relire.
· Si vous avez d’autres questions, interrogez votre médecin ou votre pharmacien.
· Ce médicament vous a été personnellement prescrit. Ne le donnez pas à d’autres personnes. Il pourrait leur être nocif, même si les signes de leur maladie sont identiques aux vôtres.
· Si vous ressentez un quelconque effet indésirable parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
2. Quelles sont les informations à connaître avant d'utiliser IPRATROPIUM ALMUS PHARMA 0,50 mg/2 ml ADULTES, solution pour inhalation par nébuliseur en récipient unidose ?
3. Comment utiliser IPRATROPIUM ALMUS PHARMA 0,50 mg/2 ml ADULTES, solution pour inhalation par nébuliseur en récipient unidose ?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver IPRATROPIUM ALMUS PHARMA 0,50 mg/2 ml ADULTES, solution pour inhalation par nébuliseur en récipient unidose ?
6. Contenu de l’emballage et autres informations.
1. QU’EST-CE QUE IPRATROPIUM ALMUS PHARMA 0,50 mg/2 ml ADULTES, solution pour inhalation par nébuliseur en récipient unidose ET DANS QUELS CAS EST-IL UTILISE ?
Classe pharmacothérapeutique : anticholinergique - code ATC : R03BB01
Il agit en augmentant le diamètre des bronches.
Dans quels cas est-il utilisé ?
Votre médecin vous a prescrit ce médicament car vous avez besoin de recevoir de fortes doses de cette substance active afin de traiter
· une crise d’asthme grave,
· ou une difficulté à respirer provoquée par une maladie au long cours encombrant vos bronches (poussées aiguës au cours de la bronchite chronique obstructive).
Pour prendre ce médicament, vous utiliserez un appareil appelé nébuliseur qui vous permettra de prendre ce médicament en utilisant votre respiration (également appelée voie inhalée).
Si vous avez une crise d’asthme aiguë
Si vous avez une crise d’asthme aiguë grave, ce médicament ne suffit pas à lui tout seul.
Vous devez vous faire hospitaliser.
Vous devrez alors utiliser en complément un autre médicament par voie inhalée qui augmentera également le diamètre de vos bronches. Cet autre médicament contiendra une substance active appartenant à une famille de médicament appelée les bêta2 mimétiques dont l’action est rapide et de courte durée.
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT D’UTILISER IPRATROPIUM ALMUS PHARMA 0,50 mg/2 ml ADULTES, solution pour inhalation par nébuliseur en récipient unidose ?
· si vous êtes allergique à la substance active ou à l’un des autres composants contenus dans ce médicament, mentionnés dans la rubrique 6.
· si vous êtes allergique à une substance appartenant à la même famille (connue sous le nom d’atropine et ses dérivés).
Avertissements et précautions
Adressez-vous à votre médecin ou pharmacien avant d’utiliser IPRATROPIUM ALMUS PHARMA 0,50 mg/2 ml ADULTES, solution pour inhalation par nébuliseur en récipient unidose.
Pour agir avec efficacité, ce médicament doit atteindre l’extrémité des petites bronches.
C’est pourquoi, l’efficacité du médicament peut être diminuée :
· si vos voies respiratoires (bronches, gorge ) sont encombrées,
· si vous avez une infection.
Si vous êtes dans l’une de ces situations, vous devez consulter votre médecin afin d’instaurer un traitement adapté.
Protection des yeux
La projection de ce médicament dans l’œil peut entraîner des troubles de la vue (flou, images colorées, sensation de voile devant l’œil) associés à une gêne ou à des douleurs.
Ces effets peuvent survenir en particulier :
· si vous avez déjà eu dans le passé une maladie causée par une pression trop importante dans l’œil (appelée glaucome par fermeture de l’angle),
· ou si vous êtes une personne susceptible de faire un glaucome.
Si vous êtes dans l’une de ces situations, vous devez :
· prévenir votre médecin avant de manipuler ce médicament,
· et utiliser une protection (par exemple, porter des lunettes) afin d’éviter tout risque de projection de ce médicament dans l’œil.
Si vous avez reçu le médicament dans les yeux
· Vous pouvez ressentir les effets suivants : troubles de la vue (flou, images colorées, voile devant les yeux), dilatation des pupilles (mydriase), augmentation de la pression à l’intérieur de l’œil, douleur et rougeur de l’œil.
· Vous devez immédiatement rincer abondamment l’œil avec de l’eau. Si ces symptômes persistent, consultez d’urgence un médecin ou rendez-vous à l’hôpital le plus proche.
Groupes particuliers de patients
Il peut arriver exceptionnellement que votre médecin utilise ce médicament pour d’autres types de patients. Dans ce cas, il utilisera ce médicament avec prudence :
· chez les personnes de plus de 65 ans car ce médicament peut provoquer une difficulté voire une incapacité à uriner (et notamment chez les hommes qui ont déjà eu des troubles urinaires ou des problèmes de prostate),
· chez les personnes atteintes d’une maladie appelée mucoviscidose car elles sont plus sensibles à certains troubles digestifs lorsqu’elles utilisent ce médicament.
Pendant le traitement
Vous devez arrêter de prendre ce médicament et consulter immédiatement votre médecin :
· si vous développez une allergie. Les signes de l’allergie sont décrits à la rubrique 4,
· si une oppression du thorax associée à une toux, une respiration sifflante ou des difficultés respiratoires survenant immédiatement après l’inhalation du produit (bronchospasme paradoxal pouvant mettre en jeu votre vie) apparait.
· si des signes tels que douleur ou gêne oculaire, vision trouble, perception d’images colorées, rougeur conjonctivale, congestion de la cornée (signes de glaucome par fermeture de l’angle) apparaissent.
Enfants et adolescents
Sans objet.
Autres médicaments et IPRATROPIUM ALMUS PHARMA 0,50 mg/2 ml ADULTES, solution pour inhalation par nébuliseur en récipient unidose
Vous devez indiquer à votre médecin si vous prenez l’un des médicaments suivants car leur association avec IPRATROPIUM ALMUS PHARMA peut augmenter le risque de survenue d’effets indésirables :
· des médicaments pour traiter la dépression (les antidépresseurs imipraminiques),
· des médicaments pour traiter une allergie (les antihistaminiques H1 atropiniques),
· des médicaments pour traiter la maladie de Parkinson (les antiparkinsoniens anticholinergiques),
· des médicaments pour traiter des contractions musculaires (les antispasmodiques atropiniques),
· un médicament utilisé pour traiter certains troubles du rythme cardiaque (le disopyramide),
· des médicaments utilisés pour traiter des troubles psychiatriques (les neuroleptiques phénothiaziniques),
· un médicament utilisé pour traiter les troubles du comportement (la clozapine),
· un anticholinestérasique (médicament utilisé dans le traitement de la maladie d’Alzheimer et dans certains cas de maladie de Parkinson),
· un médicament à base de morphine (utilisé dans le traitement des douleurs importantes).
La solution pour inhalation IPRATROPIUM ALMUS PHARMA ne doit pas être mélangée avec d’autres médicaments contenant du chlorure de benzalkonium.
Informez votre médecin ou pharmacien si vous utilisez, avez récemment utilisé ou pourriez utiliser tout autre médicament.
IPRATROPIUM ALMUS PHARMA 0,50 mg/2 ml ADULTES, solution pour inhalation par nébuliseur en récipient unidose avec des aliments, boissons et de l’alcool
Sans objet.
Grossesse, allaitement et fertilité
Il est préférable de ne pas utiliser ce médicament pendant la grossesse et l’allaitement. Si vous êtes enceinte ou que vous allaitez, si vous pensez être enceinte ou planifiez une grossesse, demandez conseil à votre médecin ou pharmacien avant de prendre ce médicament.
Conduite de véhicules et utilisation de machines
Lors du traitement par IPRATROPIUM ALMUS PHARMA peuvent survenir des effets indésirables tels que sensations vertigineuses, troubles de l’accommodation visuelle, dilatation de la pupille et vision trouble. Vous devez faire preuve de prudence lors de la conduite de véhicule ou de l’utilisation d’une machine.
3. COMMENT UTILISER IPRATROPIUM ALMUS PHARMA 0,50 mg/2 ml ADULTES, solution pour inhalation par nébuliseur en récipient unidose?
Veillez à toujours utiliser ce médicament en suivant exactement les indications de votre médecin. Vérifiez auprès de votre médecin ou pharmacien en cas de doute.
Ne dépassez pas la dose quotidienne recommandée, que ce soit pendant la phase aiguë de traitement ou d’entretien.
Si le traitement n’apporte pas d’amélioration significative ou si votre état s’aggrave, demandez conseil à votre médecin qui réévaluera votre traitement. En cas d’aggravation de vos difficultés respiratoires, consultez immédiatement votre médecin.
Chez l’adulte, la dose habituelle par nébulisation est de 1 récipient unidose à diluer dans du sérum physiologique de façon à obtenir un volume de 5 ml.
Le sérum physiologique est un liquide composé d’eau et de sels minéraux qui n’est pas inclus dans la boîte de ce médicament. Demandez à votre médecin ou à votre pharmacien si vous avez besoin de vous en procurer.
La quantité totale de sérum physiologique à ajouter doit correspondre au volume requis par l’appareil de nébulisation. Référez-vous par conséquent à la notice de l’appareil pour connaître la quantité requise.
Voie d’administration
Ce médicament doit être administré par voie inhalée à l’aide d’un appareil pour nébulisation (nébuliseur).
Ce médicament ne doit ni être avalé ni être injecté.
Conseils concernant le nébuliseur
L’efficacité de ce médicament est en partie dépendante du bon usage de l’appareil utilisé.
Vous devez donc lire très attentivement le mode d’emploi. Au besoin, n’hésitez pas à demander à votre médecin de vous fournir des explications détaillées.
Protection des yeux
Il est recommandé de porter des lunettes de protection pour se protéger des risques de projection de ce médicament dans l’œil :
· si vous (ou la personne qui administre ce médicament) avez déjà eu un glaucome,
· ou si vous (ou la personne qui administre ce médicament) êtes une personne susceptible de faire un glaucome.
Mode d’administration
La solution pour inhalation IPRATROPIUM ALMUS PHARMA ADULTES 0,50 mg/2 mL est adaptée à une inhalation concomitante avec un bêta2 mimétique d’action rapide. La solution pour inhalation IPRATROPIUM ALMUS PHARMA ADULTES 0,50 mg/2 mL en ampoules unidoses et les solutions pour inhalation de cromoglycate disodique ne doivent pas être administrées simultanément dans le même nébuliseur.
1. Détachez une dose.
2. Otez la partie supérieure en tournant.
3. Pressez la dose pour en renverser le contenu dans le réservoir du nébuliseur.
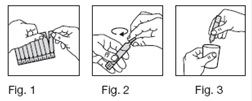
4. Ajoutez du sérum physiologique.
5. Fermez le nébuliseur.
6. Vous devez respirer le mélange obtenu pendant environ 10 à 15 minutes à votre rythme habituel.
7. Après inhalation, la solution inutilisée restant dans la cuve doit être jetée
Durée du traitement
Si les symptômes persistent après la nébulisation, vous devez contacter un médecin ou aller à l’hôpital. Vous ne devez pas répéter les inhalations si vous n’êtes pas en milieu hospitalier.
En milieu hospitalier, la nébulisation peut être renouvelée toutes les 20 à 30 minutes si votre état le nécessite.
Si vous avez utilisé plus de IPRATROPIUM ALMUS PHARMA 0,50 mg/2 ml ADULTES, solution pour inhalation par nébuliseur en récipient unidose que vous n’auriez dû :
La répétition abusive des nébulisations de ce médicament peut augmenter le risque que des effets indésirables surviennent (voir la rubrique 4 pour connaître les effets indésirables pouvant survenir avec ce médicament).
Consultez immédiatement votre médecin ou votre pharmacien.
Si vous oubliez d’utiliser IPRATROPIUM ALMUS PHARMA 0,50 mg/2 ml ADULTES, solution pour inhalation par nébuliseur en récipient unidose :
Ne prenez pas de dose double pour compenser la dose que vous avez oublié de prendre.
Si vous arrêtez d’utiliser IPRATROPIUM ALMUS PHARMA 0,50 mg/2 ml ADULTES, solution pour inhalation par nébuliseur en récipient unidose :
Sans objet.
Si vous avez d’autres questions sur l’utilisation de ce médicament, demandez plus d’informations à votre médecin ou à votre pharmacien.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
La fréquence de survenue des effets indésirables est la suivante :
· Fréquent : survient chez moins de 1 patient sur 10 mais plus de 1 patient sur 100,
· Peu fréquent : survient chez moins de 1 patient sur 100 mais plus de 1 patient sur 1000,
· Rare : survient chez moins de 1 patient sur 1000 mais plus de 1 patient sur 10000.
Les effets indésirables décrits ci-dessous ont été observés chez des patients prenant ce médicament et sont listés selon leur fréquence de survenue rapportée : fréquent, peu fréquent ou rare.
Fréquent :
· Maux de tête,
· Sensations de vertige,
· Toux,
· Irritation localisée (nez, gorge, bouche),
· Sécheresse de la bouche,
· Nausées,
· Troubles de la motilité gastro-intestinale.
Peu fréquent :
· Réaction allergique (hypersensibilité),
· Réaction allergique sévère qui se manifeste par une difficulté respiratoire, une baisse importante de la pression artérielle (réaction anaphylactique)
· Glaucome par fermeture de l’angle,
· Augmentation de la pression intraoculaire,
· Dilatation de la pupille (mydriase),
· Douleur oculaire,
· Œdème de la cornée,
· Rougeur conjonctivale,
· Vision de halos lumineux autour des images lumineuses ou colorées,
· Vision trouble,
· Une sensation anormale de perception des battements du cœur (palpitations),
· Des troubles du rythme cardiaque (battements trop rapides, trop lents ou irréguliers),
· Oppression du thorax associée à une toux, une respiration sifflante ou des difficultés respiratoires survenant immédiatement après l’inhalation du produit (bronchospasme paradoxal),
· Spasme du larynx,
· Gonflement de la gorge (œdème pharyngé),
· Sécheresse de la gorge,
· Constipation,
· Vomissements,
· Diarrhées,
· Gonflement des lèvres ou de la langue (œdème buccal),
· Inflammation de la bouche (stomatite),
· Eruption cutanée (rash),
· Démangeaisons (prurit),
· Réactions allergiques sévères entraînant un œdème du visage ou de la gorge (œdème de Quincke),
· Des difficultés à uriner.
Rare :
· Des troubles de la vue (problèmes d’accommodation visuelle),
· Irrégularité du rythme cardiaque (fibrillation auriculaire),
· Augmentation du rythme du cœur (tachycardie),
· Urticaire.
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet: https://signalement.social-sante.gouv.fr/ .
En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.
5. COMMENT CONSERVER IPRATROPIUM ALMUS PHARMA 0,50 mg/2 ml ADULTES, solution pour inhalation par nébuliseur en récipient unidose?
Tenir ce médicament hors de la vue et de la portée des enfants.
N’utilisez ce médicament après la date de péremption indiquée sur la boîte et le récipient unidose. La date de péremption fait référence au dernier jour de ce mois.
A conserver à une température ne dépassant pas 25°C.
N’utilisez pas ce médicament si vous remarquez des signes visibles de détérioration.
Ne jetez aucun médicament au tout-à-l’égout ou avec les ordures ménagères. Demandez à votre pharmacien d’éliminer les médicaments que vous n’utilisez plus. Ces mesures contribueront à protéger l’environnement.
6. CONTENU DE L’EMBALLAGE ET AUTRES INFORMATIONS
· La substance active est :
Bromure d’ipratropium................................................................................................. 0,500 mg
sous forme de bromure d’ipratropium monohydraté
Pour un récipient unidose de 2 ml.
· Les autres composants sont :
Chlorure de sodium, acide chlorhydrique concentré, eau pour préparations injectables.
Ce médicament se présente sous forme de solution pour inhalation par nébuliseur. La solution est claire et transparente.
Boîte de 1, 10, 20, 30, 60 ou 100 récipients unidoses de 2 ml dans un suremballage.
Toutes les présentations peuvent ne pas être commercialisées.
Titulaire de l’autorisation de mise sur le marché
211 AVENUE DES GRESILLONS
92330 GENNEVILLIERS
Exploitant de l’autorisation de mise sur le marché
211 AVENUE DES GRESILLONS
92330 GENNEVILLIERS
espace industrieL nord
151, RUE ANDRE DUROUCHEZ – CS 28028
80084 AMIENS CEDEX 2
Noms du médicament dans les Etats membres de l'Espace Economique Européen
Sans objet.
La dernière date à laquelle cette notice a été révisée est :
[à compléter ultérieurement par le titulaire]
Des informations détaillées sur ce médicament sont disponibles sur le site Internet de l’ANSM (France).