Dernière mise à jour le 02/02/2026
DUGRESSA 1 mg/mL + 5 mg/mL, collyre en solution
Indications thérapeutiques
De quel type de médicament s’agit-il et comment il agit ?
DUGRESSA est un collyre en solution qui contient de la lévofloxacine et de la dexaméthasone.
La lévofloxacine est un antibiotique de la famille des fluoroquinolones (parfois appelées quinolones). Son action consiste à tuer certains types de bactéries qui peuvent provoquer des infections.
La dexaméthasone est un corticostéroïde qui a une action anti-inflammatoire (arrêt des symptômes tels que la douleur, la chaleur, le gonflement et les rougeurs).
À quoi sert votre médicament ?
DUGRESSA est utilisé pour prévenir et traiter l’inflammation et prévenir une éventuelle infection de l’œil après une chirurgie de la cataracte chez l’adulte.
Présentations
> 1 flacon(s) polyéthylène basse densité (PEBD) avec compte-gouttes de 5 ml
Code CIP : 34009 302 105 3 6
Déclaration de commercialisation : 14/02/2023
Cette présentation n'est pas agréée aux collectivités
Service médical rendu (SMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprès de la HAS (plus d'informations dans l'aide). Les avis et synthèses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur du SMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| Insuffisant | Avis du 19/01/2022 | Inscription (CT) | Le service médical rendu par DUGRESSA (lévofloxacine, dexaméthasone), collyre en solution, est insuffisant dans l’indication de l’AMM, pour justifier d’une prise en charge par la solidarité nationale au regard des alternatives disponibles |
Amélioration du service médical rendu (ASMR)
Pas d'ASMR disponible pour ce médicament (plus d'informations dans l'aide )
ANSM - Mis à jour le : 12/07/2023
DUGRESSA 1 mg/mL + 5 mg/mL, collyre en solution
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Lévofloxacine (sous forme hémihydratée)................................................................................ 5 mg
Pour 1 mL de collyre en solution.
Une goutte (environ 30 microlitres) contient environ 0,03 mg de dexaméthasone et 0,150 mg de lévofloxacine.
Excipients à effet notoire :
· Un mL de collyre en solution contient 0,05 mg de chlorure de benzalkonium et une goutte contient environ 0,0015 mg de chlorure de benzalkonium.
· Un mL de collyre en solution contient 4,01 mg de phosphates et une goutte contient 0,12 mg de phosphates.
Pour la liste complète des excipients, voir rubrique 6.1.
Solution limpide, jaune verdâtre, pratiquement exempte de particules, avec un pH de 7,0 à 7,4 et une osmolalité de 270 à 330 mOsm/kg. Les gouttes apparaissent limpides et incolores.
4.1. Indications thérapeutiques
Il convient de tenir compte des recommandations officielles concernant l’utilisation appropriée des agents antibactériens.
4.2. Posologie et mode d'administration
Une goutte instillée dans le sac conjonctival toutes les 6 heures après la chirurgie. La durée du traitement est de 7 jours. Des précautions doivent être prises pour ne pas interrompre le traitement prématurément.
Si une dose est omise, il convient d’administrer la dose suivante comme prévu.
Après une semaine de traitement avec le collyre DUGRESSA, une réévaluation du patient est recommandée afin d’évaluer la nécessité de poursuivre l’administration de collyres corticostéroïdes en monothérapie. La durée de ce traitement peut dépendre des facteurs de risque du patient et du résultat de la chirurgie, et elle doit être déterminée par le médecin en fonction des examens microscopiques par lampe à fente et de la gravité du tableau clinique. Un traitement de suivi avec des collyres à base de corticostéroïdes ne doit normalement pas dépasser 2 semaines. Cependant, des précautions doivent être prises pour ne pas interrompre le traitement prématurément.
Population pédiatrique
La sécurité et l’efficacité de DUGRESSA chez les enfants et les adolescents âgés de moins de 18 ans n’ont pas été établies. Aucune donnée n’est disponible.
L’utilisation de DUGRESSA chez les enfants et les adolescents de moins de 18 ans n’est pas recommandée.
Patients âgés
Aucune adaptation posologique n’est nécessaire chez les sujets âgés.
Utilisation en cas d’insuffisance rénale/hépatique
DUGRESSA n’a pas été étudié chez les patients atteints d’insuffisance rénale ou hépatique. Ce médicament doit donc être utilisé avec précautions chez ces patients.
Mode d’administration
Voie ophtalmique.
Une goutte doit être administrée dans le canthus latéral en appliquant une pression sur le canthus médial pour maintenir le collyre au niveau de la conjonctive.
Les patients doivent être avertis de se laver les mains avant utilisation et d’éviter que l'embout du flacon n’entre en contact avec l’œil ou les structures avoisinantes, ce qui pourrait provoquer une lésion de l’œil ou une contamination de la solution.
Les patients doivent également être informés que les solutions ophtalmiques, si elles ne sont pas manipulées correctement, peuvent être contaminées par des bactéries courantes connues pour provoquer des infections oculaires. Des lésions graves de l’œil et une perte de vision peuvent résulter de l’utilisation de solutions contaminées.
Une occlusion nasolacrymale par compression des canaux lacrymaux peut réduire l’absorption systémique.
En cas de traitement concomitant avec d’autres collyres en solution, les instillations doivent être espacées de 15 minutes.
· Kératite herpétique, varicelle et autres maladies virales de la cornée et de la conjonctive.
· Infections mycobactériennes de l’œil causées, entre autres, par des bacilles acido-alcoolo-résistants tels que Mycobacterium tuberculosis, Mycobacterium leprae ou Mycobacterium avium.
· Maladies fongiques des structures oculaires.
· Infection purulente de l’œil non traitée.
4.4. Mises en garde spéciales et précautions d'emploi
Effets oculaires
DUGRESSA est destiné à un usage ophtalmique uniquement. DUGRESSA ne doit pas être injecté en conjonction avec un autre produit. La solution ne doit pas être introduite directement dans la chambre antérieure de l’œil.
Une utilisation prolongée peut induire une résistance aux antibiotiques et favoriser la prolifération d’organismes non sensibles, notamment des champignons. En cas d’infection, le traitement doit être interrompu et un autre traitement doit être mis en place. Lorsque le clinicien le juge nécessaire, le patient devra subir un examen ophtalmologique avec grossissement, par exemple au moyen d’une lampe à fente et, si nécessaire, avec coloration à la fluorescéine.
L’utilisation prolongée de corticostéroïdes ophtalmiques topiques peut provoquer une hypertension oculaire ou un glaucome ; ce qui est peu probable lorsque DUGRESSA est utilisé pendant la période de traitement recommandée (7 jours). Dans tous les cas, il convient de contrôler fréquemment la pression intraoculaire. Le risque d’augmentation de la pression intraoculaire induite par les corticostéroïdes est accru chez les patients prédisposés (par exemple chez les diabétiques).
Des troubles visuels peuvent être signalés lors de l’utilisation de corticostéroïdes systémiques ou topiques. Si un patient présente des symptômes tels qu’une vision floue ou d’autres troubles visuels, il doit être adressé à un ophtalmologiste pour une évaluation des causes possibles pouvant être liées à des complications de la chirurgie de la cataracte, au développement d’un glaucome ou à des maladies rares telles que la choriorétinopathie séreuse centrale (CSCR) qui ont été signalés après l’utilisation de corticostéroïdes systémiques ou topiques.
Les corticostéroïdes ophtalmiques topiques peuvent ralentir la cicatrisation des plaies cornéennes. Les AINS oculaires topiques sont également connus pour ralentir ou retarder la cicatrisation. L’utilisation concomitante d’AINS oculaires topiques et de corticostéroïdes topiques peut accentuer les problèmes de cicatrisation.
Dans les maladies provoquant un amincissement de la cornée ou de la sclérotique, l’utilisation de corticostéroïdes topiques peut produire des perforations.
Effets systémiques
Les fluoroquinolones ont été associées à des réactions d’hypersensibilité, même après une dose unique. En cas de réaction allergique à la lévofloxacine, arrêtez le traitement.
Une inflammation et une rupture des tendons peuvent survenir avec un traitement systémique par fluoroquinolone, y compris la lévofloxacine, en particulier chez les patients plus âgés et les patients sous corticothérapie. Par conséquent, il faut faire preuve de prudence et le traitement par DUGRESSA doit être interrompu dès les premiers signes d’inflammation des tendons (voir la rubrique 4.8).
Un syndrome de Cushing et/ou une inhibition de la fonction surrénalienne associés à l'absorption systémique de dexaméthasone ophtalmique peuvent survenir après un traitement continu intensif ou à de long terme chez des patients prédisposés, y compris chez les enfants et les patients traités par des inhibiteurs du CYP3A4 (incluant le ritonavir et le cobicistat). Dans ce cas, le traitement doit être arrêté progressivement.
Effets sur le système immunitaire
Une utilisation prolongée (généralement observée après 2 semaines de traitement) peut également entraîner des infections oculaires secondaires (bactériennes, virales ou fongiques) en raison du manque de réponse de l’hôte ou du retard de cicatrisation. De plus, les corticostéroïdes oculaires topiques peuvent favoriser, aggraver ou masquer les signes et symptômes d’infections oculaires causées par des micro-organismes opportunistes. La survenue de ces situations est limitée en cas de traitement par corticostéroïdes à court terme tel que celui proposé pour DUGRESSA.
Excipients
Chlorure de benzalkonium :
Le chlorure de benzalkonium est connu pour provoquer une irritation des yeux, des symptômes du syndrome de l’œil sec et peut affecter le film lacrymal et la surface de la cornée. Doit être utilisé avec prudence chez les patients atteints d’œil sec et ceux présentant un risque d’endommagement de la cornée. Les patients doivent être surveillés en cas d’utilisation prolongée.
Après une chirurgie de la cataracte, les patients ne doivent pas porter de lentilles de contact pendant toute la durée du traitement par DUGRESSA.
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
Aucune étude d’interaction n’a été réalisée.
Les concentrations plasmatiques maximales de lévofloxacine et de dexaméthasone après administration oculaire étant au moins 1 000 fois plus faibles que celles rapportées pour des doses orales standard, il est peu probable que des interactions avec d’autres produits à usage systémique soient cliniquement pertinentes.
L’utilisation concomitante de probénécide, de cimétidine ou de ciclosporine avec la lévofloxacine a modifié certains paramètres pharmacocinétiques de la lévofloxacine, mais pas de manière cliniquement significative.
L’utilisation concomitante de corticostéroïdes topiques et d’AINS topiques peut augmenter le risque potentiel de problèmes de cicatrisation de la cornée.
Des inhibiteurs du CYP3A4 (incluant le ritonavir et le cobicistat) peuvent diminuer la clairance de la dexaméthasone ce qui entraîne une augmentation des effets et une inhibition de la fonction surrénalienne/un syndrome de Cushing. L’association doit être évitée, sauf si le bénéfice est supérieur au risque accru d’effets secondaires systémiques des corticostéroïdes, auquel cas les patients doivent être surveillés pour les effets systémiques des corticostéroïdes.
4.6. Fertilité, grossesse et allaitement
Grossesse
Il n’existe pas ou peu de données relatives à l’utilisation de la dexaméthasone et de la lévofloxacine chez la femme enceinte. Les corticostéroïdes traversent le placenta. L’utilisation prolongée ou répétée de corticostéroïdes pendant la grossesse a été associée à un risque accru de retard de croissance intra-utérine, à un poids plus faible à la naissance, et à un risque d’hypertension artérielle, de troubles vasculaires et de résistance à l’insuline à l’âge adulte. Les nourrissons nés de mères ayant reçu des doses importantes de corticostéroïdes pendant la grossesse doivent être soigneusement surveillés afin de détecter tout signe d’hypoadrénalisme. Les études réalisées chez l’animal avec des corticostéroïdes ont mis en évidence une toxicité sur la reproduction et des effets tératogènes (notamment une fente palatine, voir la rubrique 5.3).
Étant donné qu’une exposition systémique aux corticostéroïdes ne peut être exclue après administration ophtalmique, le traitement par DUGRESSA n’est pas recommandé pendant la grossesse, et en particulier au cours des trois premiers mois. Il ne doit avoir lieu qu’après une évaluation soigneuse du rapport bénéfice/risque.
Les corticostéroïdes systémiques et la lévofloxacine sont excrétés dans le lait maternel. Aucune donnée n’est disponible en ce qui concerne les quantités de dexaméthasone présentes dans le lait maternel capables de produire des effets cliniques chez le nourrisson. L’existence d’un risque potentiel pour l’enfant allaité ne peut pas être exclue. La décision d’interrompre l’allaitement ou d’interrompre/de s’abstenir de traitement par DUGRESSA doit être prise en prenant en compte le bénéfice de l’allaitement pour l’enfant au regard du bénéfice du traitement pour la mère.
Fertilité
Les corticostéroïdes administrés par voie systémique peuvent altérer la fertilité masculine et féminine en influençant la sécrétion hormonale de l’hypothalamus et de l’hypophyse, ainsi que la gamétogenèse dans les testicules et les ovaires. Aucune donnée n’existe sur l’altération de la fertilité humaine par la dexaméthasone après un usage oculaire.
La lévofloxacine n’a provoqué aucune altération de la fertilité chez le rat à des expositions largement supérieures à l’exposition maximale chez l’homme après administration oculaire.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
Résumé du profil d’innocuité
Dans les études cliniques, 438 patients ont été traités avec DUGRESSA. Aucune réaction indésirable grave ne s’est produite. Les effets indésirables non graves les plus fréquemment signalés sont l’irritation des yeux, l’hypertension oculaire et les céphalées.
Tableau des effets indésirables
Les effets indésirables suivants ont été signalés avec DUGRESSA au cours des essais cliniques qui regroupaient des patients après une chirurgie de la cataracte (au sein de chaque groupe de fréquence, les effets indésirables sont présentés suivant un ordre décroissant de fréquence).
La fréquence des effets indésirables possibles présentés ci-dessous est définie à l’aide de la convention suivante :
|
très fréquent |
≥ 1/10 |
|
fréquent |
≥ 1/100 à < 1/10 |
|
peu fréquent |
≥ 1/1 000 à < 1/100 |
|
rare |
≥ 1/10 000 à < 1/1 000 |
|
très rare |
≤ 1/10 000 |
|
fréquence indéterminée |
ne peut être estimée sur la base des données disponibles |
DUGRESSA (association lévofloxacine/dexaméthasone)
|
Classe de systèmes d’organes |
Fréquence |
Effets indésirables |
|
Affections du système nerveux |
Peu fréquent |
Céphalées, dysgueusie |
|
Affections oculaires |
Peu fréquent |
Irritation oculaire, sensation oculaire anormale, hypertension oculaire |
|
Affection de la peau et du tissu sous-cutané |
Peu fréquent |
Prurit |
|
Investigations |
Peu fréquent |
Augmentation de la pression intraoculaire (*) |
|
(*) > 6 mmHg, ce qui signifie une augmentation significative de la pression intraoculaire |
||
Les effets indésirables qui ont été observés avec l’un des principes actifs ophtalmiques (lévofloxacine ou dexaméthasone) et qui peuvent éventuellement survenir avec DUGRESSA sont répertoriés ci-dessous :
Lévofloxacine
|
Classe de systèmes d’organes |
Fréquence |
Effets indésirables |
|
Affections du système immunitaire |
Rare |
Réactions allergiques extra-oculaires, notamment des éruptions cutanées. |
|
Très rare |
Anaphylaxie |
|
|
Affections du système nerveux |
Peu fréquent |
Maux de tête. |
|
Affections oculaires |
Fréquent |
Brûlure oculaire, baisse de la vision et écoulement muqueux. |
|
Peu fréquent |
Formation d’une pellicule sur la paupière, chémosis, réaction papillaire conjonctivale, œdème de la paupière, inconfort oculaire, démangeaisons oculaires, douleurs oculaires, hyperémie conjonctivale, follicules conjonctivaux, sécheresse oculaire, érythème de la paupière et photophobie. |
|
|
Affections respiratoires, thoraciques et médiastinales |
Peu fréquent |
Rhinite. |
|
Très rares |
Œdème du larynx. |
Dexaméthasone
|
Classe de systèmes d’organes |
Fréquence |
Effets indésirables |
|
Affections oculaires |
Très fréquent |
Augmentation de la pression intraoculaire* |
|
Fréquent |
Gêne*, irritation*, sensation de brûlure*, picotements*, démangeaisons* et vision floue* |
|
|
Peu fréquent |
Réactions allergiques et d’hypersensibilité, retard de la cicatrisation, cataracte capsulaire postérieure*, infections opportunistes, glaucome* |
|
|
Très rare |
Conjonctivite, mydriase, ptose, uvéite induite par les corticostéroïdes, calcifications de la cornée, kératopathie cristalline, changements d’épaisseur de la cornée*, œdème de la cornée, ulcération de la cornée et perforation de la cornée |
|
|
Affections de la peau et du tissu sous-cutané |
Très rare |
Œdème du visage |
|
Affections endocriniennes |
Fréquence indéterminée |
Syndrome de Cushing, inhibition de la fonction surrénalienne (voir rubrique 4.4) |
|
* voir la rubrique « Description de certains effets indésirables » |
||
Description de certains effets indésirables
Augmentation de la pression intraoculaire
Une augmentation de la pression intraoculaire (PIO) et un glaucome peuvent survenir. L’utilisation prolongée d’un traitement aux corticostéroïdes peut entraîner une hypertension oculaire ou un glaucome (en particulier chez les patients avec une PIO antérieure élevée induite par des corticostéroïdes, avec une PIO élevée ou un glaucome préexistant). Les enfants et les patients âgés peuvent être particulièrement sensibles à l’augmentation de la PIO induite par les corticostéroïdes (voir la rubrique 4.4). Les diabétiques risquent également davantage de développer des cataractes sous-capsulaires après l’administration prolongée de corticostéroïdes topiques.
Effets indésirables post-procéduraux
Des troubles oculaires (par exemple, œdème de la cornée, irritation oculaire, sensation oculaire anormale, augmentation du larmoiement, asthénopie, trouble de la cornée, sécheresse oculaire, douleur oculaire, inconfort oculaire, uvéite, vision floue, luminosité visuelle, conjonctivite) et des nausées ont été signalés au cours des essais cliniques. Ces réactions sont généralement de faible intensité et transitoires et sont liées à la chirurgie de la cataracte.
Effets indésirables possibles liés à la cornée
Dans les maladies provoquant un amincissement de la cornée, l’utilisation topique de corticostéroïdes peut entraîner une perforation de la cornée dans certains cas (voir la rubrique 4.4).
Quelques cas rares de calcifications cornéennes ont été signalés en association avec l’utilisation de gouttes contenant des phosphates chez certains patients atteints de cornées gravement endommagées.
Effets indésirables supplémentaires qui ont été observés lors d’une utilisation prolongée du principe actif lévofloxacine et qui peuvent également survenir avec DUGRESSA
Des cas de rupture de tendon au niveau des épaules, des mains et des tendons d'Achille ou d’autres tendons, qui ont nécessité le recours à une chirurgie ou entraîné une incapacité prolongée, ont été signalés chez des patients recevant des fluoroquinolones systémiques. Des études et une expérience après commercialisation avec des quinolones systémiques indiquent que le risque de ce type de rupture peut être accru chez les patients recevant des corticostéroïdes, en particulier chez les patients gériatriques et pour les tendons soumis à un stress élevé, notamment les tendons d’Achille (voir la rubrique 4.4).
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : www.signalement-sante.gouv.fr.
La quantité totale de lévofloxacine et de dexaméthasone 21-phosphate dans le flacon de DUGRESSA est trop faible pour induire des effets toxiques après une ingestion accidentelle.
En cas de surdosage topique, le traitement doit être interrompu. En cas d’irritation prolongée, l’œil ou les yeux doivent être rincés à l’eau stérile.
La symptomatologie due à une ingestion accidentelle n’est pas connue. Le médecin peut envisager un lavage gastrique ou des vomissements provoqués.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
DUGRESSA est une association à dose fixe de deux principes actifs : la lévofloxacine et la dexaméthasone.
Lévofloxacine
Mécanisme d’action
La lévofloxacine, l’isomère L actif de l’ofloxacine, est un agent antibactérien des fluoroquinolones, qui inhibe les topoisomérases bactériennes de type II - ADN gyrase et topoisomérase IV. La lévofloxacine cible de préférence l’ADN gyrase chez les bactéries à Gram négatif et la topoisomérase IV chez les bactéries à Gram positif. Le spectre d’activité contre les pathogènes oculaires comprend les micro-organismes aérobies à Gram positif (par exemple, S. aureus SASM, S. pyogenes, S. pneumoniae, les streptocoques du groupe viridans), les bactéries aérobies à Gram négatif (par exemple, E. coli, H. influenzae, M. catarrhalis, isolats de la communauté de P. aeruginosa) et d’autres organismes (par exemple, Chlamydia trachomatis).
Mécanismes de résistance
La résistance bactérienne à la lévofloxacine peut se développer principalement en raison de deux mécanismes principaux, à savoir une diminution de la concentration intrabactérienne d’un médicament ou des modifications des enzymes cibles d’un médicament. L’altération du site cible résulte de mutations dans les gènes chromosomiques codant l’ADN gyrase (gyrA et gyrB) et la topoisomérase IV (parC et parE, grlA et grlB chez Staphylococcus aureus). La résistance due à une faible concentration intrabactérienne du médicament découle de la modification des porines de la membrane externe (OmpF) conduisant à une entrée réduite des fluoroquinolones dans les bactéries à Gram négatif ou des pompes d’efflux. Une résistance induite par écoulement a été décrite chez les pneumocoques (PmrA), les staphylocoques (NorA), les anaérobies et les bactéries à Gram négatif. Enfin, une résistance plasmidique aux quinolones (déterminée par le gène qnr) a été observée chez Klebsiella pneumoniae et chez E. coli.
Résistances croisées
Une résistance croisée entre les fluoroquinolones peut survenir. Les mutations uniques ne donnent pas nécessairement lieu à une résistance clinique, mais les mutations multiples aboutissent généralement à une résistance clinique à tous les médicaments de la classe des fluoroquinolones. Les porines de la membrane externe et les systèmes d’efflux modifiés peuvent avoir une large spécificité de substrat, ciblant plusieurs classes d’agents antibactériens et conduisant à une multirésistance.
Critères d’interprétation des tests de sensibilité
Il n’y a pas de critères d’interprétation.
Dexaméthasone
Mécanisme d’action
Les corticostéroïdes tels que la dexaméthasone suppriment les molécules d’adhésion des cellules endothéliales vasculaires, la cyclooxygénase I ou II et l’expression de la cytokine. Cette action aboutit à une expression réduite des médiateurs pro-inflammatoires et à la suppression de l’adhésion des leucocytes circulants à l’endothélium vasculaire, empêchant ainsi leur migration dans le tissu oculaire enflammé. La dexaméthasone a une activité anti-inflammatoire marquée avec une activité minéralocorticoïde réduite par rapport à certains autres corticostéroïdes et c’est l’un des agents anti-inflammatoires les plus puissants.
Efficacité clinique
L’efficacité de DUGRESSA a été étudiée dans une étude contrôlée pour évaluer la non-infériorité de DUGRESSA par rapport à un traitement standard avec une formulation commerciale de tobramycine (0,3 %) et de dexaméthasone (0,1 %) en collyre pour la prévention et le traitement de l’inflammation et la prévention des infections associées à la chirurgie de la cataracte chez l’adulte. L’enquêteur chargé d’évaluer les paramètres de l’étude n’a pas été informé de l’attribution du traitement. Les patients pour lesquels la chirurgie de la cataracte s’est effectuée sans complications ont reçu du collyre DUGRESSA, 1 goutte 4 fois par jour pendant 7 jours, suivi de collyre de dexaméthasone 0,1 %, 1 goutte 4 fois par jour pendant 7 jours supplémentaires, ou le collyre de référence de tobramycine + dexaméthasone, 1 goutte 4 fois par jour pendant 14 jours.
Des données sur l’efficacité étaient disponibles chez 395 patients ayant reçu DUGRESSA et chez 393 patients ayant reçu le produit de référence après une chirurgie de la cataracte. Après 14 jours de traitement, la proportion de patients sans signe d’inflammation (critère principal de l’étude) dans le groupe de DUGRESSA suivi de dexaméthasone par rapport au groupe de tobramycine + dexaméthasone était de 95,19 % contre 94,91 %, respectivement. La différence entre les deux proportions était de 0,0028 (IC à 95 % : [-0,0275 ; 0,0331]), ce qui a démontré la non-infériorité de l’étude par rapport au schéma du traitement de référence. Aucune occurrence d’endophtalmie n’a été signalée au cours de l’étude pour l’un ou l’autre groupe. Les signes d’inflammation de la chambre antérieure étaient absents dans le groupe DUGRESSA chez 73,16 % des patients au jour 4 et chez 85,57 % des patients au jour 8 suivant la chirurgie. Dans le groupe tobramycine + dexaméthasone, les signes d’inflammation de la chambre antérieure étaient absents chez 76,84 % des patients au jour 4 et chez 86,77 % des patients au jour 8. L’hyperémie conjonctivale était déjà absente au jour 4 chez 85,75 % des patients du groupe DUGRESSA contre 82,19 % du groupe tobramycine + dexaméthasone. Le profil d’innocuité était similaire dans les deux groupes.
Population pédiatrique
L’Agence européenne des médicaments a accordé une dérogation à l’obligation de soumettre les résultats d’études réalisées avec DUGRESSA dans tous les sous-groupes de la population pédiatrique pour la prévention et le traitement de l’inflammation et la prévention des infections associées à la chirurgie de la cataracte (voir rubrique 4.2 pour les informations concernant l’usage pédiatrique).
5.2. Propriétés pharmacocinétiques
L’instillation oculaire de DUGRESSA entraîne l’absorption des deux actifs dans les tissus oculaires et, dans une bien moindre mesure, dans la circulation systémique.
Après instillation dans des yeux de lapin, les concentrations plasmatiques de lévofloxacine augmentent avec la dose après administration à la fois unique et répétée. De faibles niveaux de phosphate sodique de dexaméthasone sont mesurés dans le plasma. En fait, le phosphate sodique de dexaméthasone est rapidement métabolisé in vivo en dexaméthasone, qui est le métabolite actif. L’exposition à la dexaméthasone augmente avec la dose et, après des doses répétées, une accumulation mineure de lévofloxacine et de dexaméthasone est évidente. Les niveaux de lévofloxacine et de dexaméthasone dans les tissus oculaires (humeur aqueuse, cornée et conjonctive) sont supérieurs aux niveaux plasmatiques maximaux après des doses à la fois uniques et répétées. En particulier, après 28 jours de traitement, les niveaux de lévofloxacine et de dexaméthasone dans les tissus oculaires sont respectivement 50 à 100 fois et 3 à 4 fois supérieurs à la Cmax dans le plasma.
Cent vingt-cinq patients subissant une chirurgie de la cataracte ont été répartis en 3 groupes : lévofloxacine, dexaméthasone et DUGRESSA. Une goutte de chaque médicament a été administrée 60 et 90 minutes avant la paracentèse limbale. La moyenne des valeurs observées pour la concentration de lévofloxacine était égale à 711,899 ng/mL (IC à 95 % : 595,538 ; 828,260) dans le groupe DUGRESSA contre 777,307 ng/mL (IC à 95 % : 617,220 ; 937,394) lorsque la lévofloxacine a été administrée seule. Les concentrations de lévofloxacine dans l’humeur aqueuse sont bien supérieures aux concentrations minimales inhibitrices pour les pathogènes oculaires dans le spectre d’activité de la lévofloxacine.
Lorsque DUGRESSA a été administré, la dexaméthasone a atteint une concentration d’humeur aqueuse de 11,774 ng/mL (IC à 95 % : 9,812 ; 13,736) contre 16,483 ng/mL (IC à 95 % : 13,736 ; 18,838) lorsque la dexaméthasone a été administrée seule.
La lévofloxacine et la dexaméthasone sont éliminées par l’urine.
5.3. Données de sécurité préclinique
Des études de toxicité oculaire à doses répétées avec l’association de doses fixes de lévofloxacine/dexaméthasone pendant 28 jours chez le lapin ont révélé des toxicités systémiques attribuables à des effets pharmacologiques exagérés de la dexaméthasone (nécrose focale des cellules et glomérulopathie avec nécrose et/ou dépôts hyalins dans les reins, hypertrophie hépatique avec inclusions hyalines intracellulaires et nécrose unicellulaire, atrophie du cortex surrénalien et diminution des lymphocytes en raison de l’atrophie de la rate, du thymus et des ganglions lymphatiques).
De tels effets n’ont été observés qu’à des expositions environ 3 fois plus élevées que celles obtenues avec la dose oculaire humaine maximale recommandée, indiquant peu de pertinence clinique.
Les études sur les animaux ont montré que les inhibiteurs de gyrase provoquent des troubles de la croissance des articulations portantes. Comme les autres fluoroquinolones, la lévofloxacine a montré des effets sur le cartilage articulaire (formations de vésicules et de cavités) chez le rat et le chien après des doses orales élevées.
Génotoxicité et cancérogénicité
La dexaméthasone et la lévofloxacine n’ont pas montré de potentiel génotoxique ou cancérigène.
Toxicité pour la reproduction
La lévofloxacine n’a pas influé sur la fertilité et n’a entravé le développement embryo-fœtal chez les animaux qu’à des expositions largement supérieures à celles réalisables à la dose thérapeutique oculaire recommandée chez l’homme.
L’administration topique et systémique de la dexaméthasone a altéré la fertilité masculine et féminine et induit des effets tératogènes, notamment la formation d’une fente palatine, un retard de croissance intra-utérine et une mortalité fœtale. Une toxicité périnatale et postnatale de la dexaméthasone a également été observée.
Potentiel phototoxique
Des études sur la souris après administration orale et intraveineuse ont montré que la lévofloxacine n’avait une activité phototoxique qu’à des doses très élevées.
3 ans.
Jeter le flacon 28 jours après 1ère ouverture.
6.4. Précautions particulières de conservation
Ce médicament ne nécessite pas de conditions particulières de conservation.
6.5. Nature et contenu de l'emballage extérieur
Flacon de 5 mL en polyéthylène basse densité (PEBD) avec compte-gouttes (PEBD) et bouchon à vis en polyéthylène haute densité (PEHD).
Présentations : 1 flacon de 5 mL
6.6. Précautions particulières d’élimination et de manipulation
Tout antibiotique ou solution résiduelle d’antibiotique non utilisé, ainsi que les matériaux qui ont servi pour l’administration, doivent être éliminés conformément à la réglementation en vigueur.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
NIITTYHAANKATU 20
33720 TAMPERE
FINLANDE
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· 34009 302 105 3 6 : 5 mL en flacon (PEBD).
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
[à compléter ultérieurement par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE
[à compléter ultérieurement par le titulaire]
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Liste I.
ANSM - Mis à jour le : 12/07/2023
DUGRESSA 1 mg/mL + 5 mg/mL, collyre en solution
Dexaméthasone/Lévofloxacine
· Gardez cette notice. Vous pourriez avoir besoin de la relire.
· Si vous avez d’autres questions, interrogez votre médecin ou votre pharmacien.
· Ce médicament vous a été personnellement prescrit. Ne le donnez pas à d’autres personnes. Il pourrait leur être nocif, même si les signes de leur maladie sont identiques aux vôtres.
· Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
1. Qu'est-ce que DUGRESSA 1 mg/mL + 5 mg/mL, collyre en solution et dans quels cas est-il utilisé ?
2. Quelles sont les informations à connaître avant d'utiliser DUGRESSA 1 mg/mL + 5 mg/mL, collyre en solution ?
3. Comment utiliser DUGRESSA 1 mg/mL + 5 mg/mL, collyre en solution ?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver DUGRESSA 1 mg/mL + 5 mg/mL, collyre en solution ?
6. Contenu de l’emballage et autres informations.
1. QU’EST-CE QUE DUGRESSA 1 mg/mL + 5 mg/mL, collyre en solution ET DANS QUELS CAS EST-IL UTILISE ?
De quel type de médicament s’agit-il et comment il agit ?
DUGRESSA est un collyre en solution qui contient de la lévofloxacine et de la dexaméthasone.
La lévofloxacine est un antibiotique de la famille des fluoroquinolones (parfois appelées quinolones). Son action consiste à tuer certains types de bactéries qui peuvent provoquer des infections.
La dexaméthasone est un corticostéroïde qui a une action anti-inflammatoire (arrêt des symptômes tels que la douleur, la chaleur, le gonflement et les rougeurs).
À quoi sert votre médicament ?
DUGRESSA est utilisé pour prévenir et traiter l’inflammation et prévenir une éventuelle infection de l’œil après une chirurgie de la cataracte chez l’adulte.
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT D’UTILISER DUGRESSA 1 mg/mL + 5 mg/mL, collyre en solution ?
N’utilisez jamais DUGRESSA 1 mg/mL + 5 mg/mL, collyre en solution :
· si vous êtes allergique à la lévofloxacine (ou à d’autres quinolones), à la dexaméthasone (ou à d’autres corticostéroïdes) ou à l’un des autres composants contenus dans ce médicament (mentionnés dans la rubrique 6).
· si vous souffrez d’une infection ophtalmique pour laquelle vous n’utilisez pas de médicament, y compris une infection virale (telle qu’une kératite herpétique ou la varicelle), une infection fongique et la tuberculose de l’œil.
Un écoulement visqueux de l’œil ou un œil rouge qui n’a pas été vu par un médecin peut être le signe d’une infection.
Avertissements et précautions
Adressez-vous à votre médecin avant d’utiliser DUGRESSA 1 mg/mL + 5 mg/mL, collyre en solution.
· Si vous suivez un autre traitement antibiotique, notamment des antibiotiques oraux. Comme pour les autres anti-infectieux, une utilisation prolongée peut provoquer une résistance aux antibiotiques et entraîner une prolifération de micro-organismes pathogènes.
· Si vous souffrez d’hypertension oculaire ou si vous avez déjà souffert d’hypertension oculaire suite à la prise d’un corticostéroïde ophtalmique. Les symptômes pourraient réapparaître si vous utilisez DUGRESSA. Si vous souffrez d’hypertension oculaire, prévenez votre médecin.
· Si vous souffrez d’un glaucome.
· Si vous avez des troubles visuels ou une vision floue.
· Si vous utilisez des AINS (anti-inflammatoires non stéroïdiens) oculaires, voir la rubrique « Autres médicaments et DUGRESSA 1 mg/mL + 5 mg/mL, collyre en solution ».
· Si vous souffrez d’un trouble induisant un amincissement des tissus de l’œil, car des traitements corticostéroïdiens prolongés peuvent provoquer un amincissement supplémentaire et une éventuelle perforation.
· Si vous êtes diabétique.
Informations importantes en cas de port de lentilles de contact
Après une chirurgie de la cataracte, vous ne devez pas porter de lentilles de contact pendant toute la durée du traitement par DUGRESSA.
Enfants et adolescents
DUGRESSA n’est pas recommandé chez les enfants et les adolescents de moins de 18 ans en raison de l’absence de données concernant la tolérance et l’efficacité dans ce groupe d'âge.
Autres médicaments et DUGRESSA 1 mg/mL + 5 mg/mL, collyre en solution
Informez votre médecin ou pharmacien :
· si vous prenez, avez récemment pris ou pourriez prendre tout autre médicament, y compris un médicament obtenu sans ordonnance.
· si vous utilisez un autre type de collyre ou de pommade ophtalmique avant de commencer à utiliser DUGRESSA (voir la rubrique 3 « Comment utiliser DUGRESSA 1 mg/mL + 5 mg/mL, collyre en solution ? »).
· si vous utilisez des AINS oculaires (utilisés contre la douleur et l’inflammation de l’œil) tels que le kétorolac, le diclofénac, le bromfénac et le népafénac. L’utilisation simultanée de corticostéroïdes oculaires et d’AINS oculaires peut augmenter le risque de problèmes de cicatrisation de l’œil.
· si vous utilisez du ritonavir ou du cobicistat (utilisés dans le traitement du VIH), car cela peut augmenter la quantité de dexaméthasone dans votre sang.
· si vous utilisez du probénécide (pour traiter la goutte), de la cimétidine (pour traiter l’ulcère de l’estomac) ou de la cyclosporine (pour prévenir le rejet de greffe), car ils peuvent modifier l’absorption et le métabolisme de la lévofloxacine.
DUGRESSA 1 mg/mL + 5 mg/mL, collyre en solution avec des aliments et des boissons
Sans objet.
Si vous êtes enceinte ou que vous allaitez, si vous pensez être enceinte ou planifiez une grossesse, demandez conseil à votre médecin ou pharmacien avant de prendre ce médicament. DUGRESSA ne doit pas être utilisé pendant la grossesse ou l’allaitement.
Conduite de véhicules et utilisation de machines
Si votre vision se trouble temporairement après avoir utilisé ce médicament pendant une courte période, vous ne devez pas conduire ni utiliser de machines tant que votre vision ne s’est pas éclaircie.
DUGRESSA 1 mg/mL + 5 mg/mL, collyre en solution contient des phosphates et du chlorure de benzalkonium
· Ce médicament contient 4,01 mg de phosphates par mL, équivalent à 0,12 mg par goutte.
Si vous souffrez de dommages sévères de la cornée (couche transparente située à l’avant de l’œil, les phosphates peuvent causer, dans de très rares cas, des troubles de la vision en raison de l’accumulation de calcium pendant le traitement (nuage). Parlez-en à votre médecin, qui pourra vous prescrire un traitement sans phosphates.
· Ce médicament contient 0,05 mg de chlorure de benzalkonium par mL, équivalent à 0,0015 mg par goutte.
Le chlorure de benzalkonium peut également provoquer une irritation des yeux, surtout si vous souffrez du syndrome de l’œil sec ou de troubles de la cornée (couche transparente à l’avant de l’œil). En cas de sensation anormale, de picotement ou de douleur dans les yeux après avoir utilisé ce médicament, contactez votre médecin.
3. COMMENT UTILISER DUGRESSA 1 mg/mL + 5 mg/mL, collyre en solution ?
La dose recommandée est de 1 goutte dans l’œil concerné toutes les 6 heures. La dose maximale est de 4 gouttes par jour. Le traitement total habituel avec DUGRESSA est de 7 jours, suivi, si le médecin le juge nécessaire, de 7 jours supplémentaires de collyre corticostéroïde.
Votre médecin vous indiquera la durée d’instillation des gouttes.
Si vous mettez un autre médicament dans l’œil, vous devez attendre au moins 15 minutes entre l’instillation des différents types de gouttes. Les pommades ophtalmiques doivent être appliquées en dernier.
Mode d’administration
Si possible, demandez à quelqu’un d’autre de vous instiller les gouttes. Demandez à la personne qui instillera les gouttes de lire ces instructions avant d’administrer le traitement.
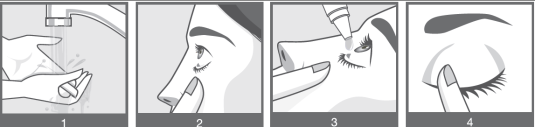
1) Lavez-vous soigneusement les mains (image 1).
2) Ouvrez le flacon. Retirez le col libre du capuchon lors de la première ouverture du flacon.
Faites particulièrement attention à ce que l’embout du flacon compte-gouttes ne touche pas l’œil, la peau autour de l’œil ou vos doigts.
3) Dévissez le capuchon du flacon. Tenez le flacon tête en bas, entre le pouce et les autres doigts.
4) Tirez doucement votre paupière inférieure vers le bas pour créer un sillon entre la paupière et votre œil. La goutte sera déposée à cet endroit (image 2).
5) Inclinez la tête en arrière et rapprochez l’embout du flacon de l’œil, appuyez doucement sur le milieu du flacon et laissez tomber une goutte dans votre œil (image 3). Quelques secondes peuvent s’écouler entre la compression du flacon et la sortie de la goutte. N’appuyez pas trop fort sur le flacon.
6) Après avoir utilisé DUGRESSA, appuyez avec un doigt sur le coin de votre œil près du nez. Cela permet d’empêcher le médicament de pénétrer dans le reste du corps (image 4).
|
|
Si une goutte tombe à côté de l’œil, recommencez. Refermez bien le flacon immédiatement après utilisation.
Si vous avez utilisé plus de DUGRESSA 1 mg/mL + 5 mg/mL, collyre en solution que vous n’auriez dû
Si vous avez utilisé plus de ce médicament que vous n’auriez dû, rincez l’excédent à l’eau tiède.
Si vous oubliez d’utiliser DUGRESSA 1 mg/mL + 5 mg/mL, collyre en solution
Si vous arrêtez d’utiliser DUGRESSA 1 mg/mL + 5 mg/mL, collyre en solution
Si vous arrêtez d’utiliser ce médicament plus tôt que prévu, parlez-en à votre médecin.
Si vous avez d’autres questions sur l’utilisation de ce médicament, demandez plus d’informations à votre médecin ou à votre pharmacien.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
Comme tous les médicaments, ce médicament peut provoquer des effets indésirables, mais ils ne surviennent pas systématiquement chez tout le monde. La plupart des effets indésirables ne sont pas graves et n’affectent que l’œil.
· Dans de très rares cas, ce médicament peut provoquer des réactions allergiques sévères (réactions anaphylactiques), accompagnées d’un gonflement et d’une obstruction des voies aériennes, ainsi que de difficultés respiratoires.
· Arrêtez d’utiliser DUGRESSA et contactez immédiatement votre médecin si l’un de ces symptômes apparaît.
· Un gonflement et une rupture des tendons se sont produits chez des personnes prenant des fluoroquinolones par voie orale ou intraveineuse, en particulier chez les patients plus âgés et les patients sous corticothérapie. Arrêtez d’utiliser DUGRESSA si vous commencez à ressentir une douleur ou un gonflement des tendons (tendinite).
Vous pouvez également ressentir certains ou l’ensemble des effets suivants dans vos yeux :
Effets indésirables très fréquents (pouvant affecter plus de 1 patient sur 10) :
· hypertension dans l’œil.
Effets indésirables fréquents (pouvant affecter jusqu’à 1 patient sur 10) :
· inconfort, picotements ou irritation, brûlure, démangeaisons dans l’œil,
· vision floue ou diminuée
· mucosités dans l’œil.
Effets indésirables peu fréquents (pouvant affecter jusqu’à 1 patient sur 100) :
· cicatrisation de la cornée plus longue que prévue
· infections oculaires
· sensation oculaire anormale
· larmoiement accru
· sécheresse et fatigue oculaire
· douleur oculaire
· vision plus lumineuse
· gonflement ou rougeur (yeux injectés de sang) de la membrane supérieure de l’œil (conjonctive)
· gonflement ou rougeur de la paupière
· sensibilité à la lumière
· paupières collantes.
Effets indésirables très rares (pouvant affecter jusqu’à 1 patient sur 10 000) :
· augmentation de la taille des pupilles
· paupières tombantes
· fixation du calcium sur la surface de l’œil (calcification de la cornée)
· larmes et sensations de sable dans l’œil (kératopathie cristalline)
· modification de l’épaisseur de la surface de l’œil
· ulcère sur la surface de l’œil
· petits trous sur la surface de l’œil (perforation de la cornée)
· gonflement de la surface de l’œil (œdème cornéen)
· inflammation de l’œil provoquant douleurs et rougeurs (uvéite).
Vous pouvez ressentir des effets indésirables dans d’autres parties du corps, notamment :
Effets indésirables peu fréquents (pouvant affecter jusqu’à 1 patient sur 100) :
· maux de tête
· altération du goût
· démangeaisons
· nez bouché ou écoulement nasal.
Effets indésirables rares (pouvant affecter jusqu’à 1 patient sur 1 000) :
· réactions allergiques telles qu’une éruption cutanée.
Effets indésirables très rares (pouvant affecter jusqu’à 1 patient sur 10 000) :
· gonflement du visage.
Effets indésirables à fréquence indéterminée (ne peut être estimée sur la base des données disponibles)
· Réduction de la fonction des glandes surrénales, pouvant se manifester par un faible taux de sucre dans le sang, une déshydratation, une perte de poids et un sentiment de confusion quant à l’endroit où vous vous trouvez
· Problèmes hormonaux : croissance de poils sur le corps (en particulier chez les femmes), faiblesse et fonte musculaire, vergetures (taches) violacées sur la peau, augmentation de la pression artérielle, règles irrégulières ou absence de règles, changements des niveaux de protéines et de calcium dans votre corps, croissance ralentie chez les enfants et les adolescents, gonflement et prise de poids du corps et du visage (appelé « syndrome de Cushing ») (voir rubrique 2 « Avertissements et précautions »).
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : www.signalement-sante.gouv.fr
En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.
5. COMMENT CONSERVER DUGRESSA 1 mg/mL + 5 mg/mL, collyre en solution ?
Tenir ce médicament hors de la vue et de la portée des enfants.
N’utilisez pas ce médicament après la date de péremption indiquée sur le flacon et sur la boîte après la mention « EXP ». La date de péremption fait référence au dernier jour de ce mois.
N’utilisez pas ce médicament si vous remarquez que la bague plastique autour du capuchon et du col est manquant ou abîmé avant de commencer un nouveau flacon.
Conservez le flacon correctement fermé. Pour prévenir les infections, vous devez jeter le flacon 28 jours après sa première ouverture et utiliser un nouveau flacon.
Ce médicament ne nécessite pas de précautions particulières de conservation.
Ne jetez aucun médicament au tout-à-l’égout ou avec les ordures ménagères. Demandez à votre pharmacien d’éliminer les médicaments que vous n’utilisez plus. Ces mesures contribueront à protéger l’environnement.
6. CONTENU DE L’EMBALLAGE ET AUTRES INFORMATIONS
Ce que contient DUGRESSA 1 mg/mL + 5 mg/mL, collyre en solution
· Les substances actives sont :
Dexaméthasone (sous forme de phosphate sodique)......................................................... 1 mg
Lévofloxacine (sous forme hémihydratée).......................................................................... 5 mg
Pour 1 mL de collyre en solution.
· Les autres composants sont :
Phosphate monosodique monohydraté, phosphate disodique dodécahydraté, citrate de sodium, chlorure de benzalkonium, hydroxyde de sodium/acide chlorhydrique (pour l’ajustement du pH), eau pour préparations injectables.
Qu’est-ce que DUGRESSA 1 mg/mL + 5 mg/mL, collyre en solution et contenu de l’emballage extérieur
DUGRESSA est une solution limpide, jaune verdâtre pratiquement exempte de particules, même si les gouttes apparaissent limpides et incolores.
Ce médicament se présente sous forme de collyre en solution en flacon en plastique blanc de 5 mL avec un compte-gouttes blanc. Le flacon en plastique est fermé par un bouchon à vis.
Titulaire de l’autorisation de mise sur le marché
NIITTYHAANKATU 20
33720 TAMPERE
FINLANDE
Exploitant de l’autorisation de mise sur le marché
TOUR W, 102 TERRASSE BOIELDIEU
92800 PUTEAUX
KELLOPORTINKATU 1
33100 TAMPERE
FINLANDE
Noms du médicament dans les Etats membres de l'Espace Economique Européen
Ce médicament est autorisé dans les Etats membres de l'Espace Economique Européen et au Royaume-Uni (Irlande du Nord) sous les noms suivants : Conformément à la réglementation en vigueur.
[À compléter ultérieurement par le titulaire]
La dernière date à laquelle cette notice a été révisée est :
[à compléter ultérieurement par le titulaire]
Des informations détaillées sur ce médicament sont disponibles sur le site Internet de l’ANSM (France).