Dernière mise à jour le 02/03/2026
GIBITER EASYHALER, 320 microgrammes/9 microgrammes/dose, poudre pour inhalation
Indications thérapeutiques
GIBITER EASYHALER est également indiqué pour traiter les symptômes de la bronchopneumopathie chronique obstructive (BPCO) chez l’adulte de plus de 18 ans.
Il contient deux substances actives différentes : le budésonide et le fumarate de formotérol.
· Le budésonide appartient à un groupe de médicaments appelés « corticoïdes ». Il agit en réduisant l'inflammation dans vos poumons.
· Le fumarate de formotérol appartient à un groupe de médicaments appelés « bronchodilatateurs » ou « bêta-agonistes (ou bêta-2 adrénergiques) de longue durée d'action ». Il agit en relâchant les muscles de vos bronches ; ce qui vous aide à respirer plus facilement.
Asthme
Pour le traitement de l’asthme, deux médicaments en inhalateurs vous seront prescrits : Gibiter Easyhaler 320/9 et un traitement de secours :
· Gibiter Easyhaler sera utilisé quotidiennement matin et soir, dans le but de prévenir la survenue des symptômes d’asthme.
· Le traitement de secours sera utilisé au moment où surviennent des symptômes d’asthme pour les soulager et pour faciliter la respiration.
Ne pas utiliser Gibiter Easyhaler 320/9 comme inhalateur de secours.
Bronchopneumopathie chronique obstructive (BPCO)
Gibiter Easyhaler est également préconisé pour le traitement de la Broncho-pneumopathie Chronique Obstructive chez l’adulte. La Bronchopneumopathie Chronique Obstructive est une maladie chronique des voies respiratoires souvent causée par le tabagisme.
Présentations
> 1 inhalateur multidose (Easyhaler) en polyéthylène basse densité (PEBD) polycarbonate styrène butadiène polypropylène polytéréphthalate de butylène de 60 dose(s)
Code CIP : 34009 300 932 4 5
Déclaration de commercialisation : 24/01/2018
Cette présentation est agréée aux collectivités
- Prix hors honoraire de dispensation : 26,25 €
- Honoraire de dispensation : 1,02 €
- Prix honoraire compris : 27,27 €
- Taux de remboursement :65%
> 3 inhalateur(s) multidose(s) (Easyhaler) en polyéthylène basse densité (PEBD) polycarbonate styrène butadiène polypropylène polytéréphthalate de butylène de 60 dose(s)
Code CIP : 34009 302 211 9 8
Déclaration de commercialisation : 07/06/2021
Cette présentation est agréée aux collectivités
- Prix hors honoraire de dispensation : 77,95 €
- Honoraire de dispensation : 1,02 €
- Prix honoraire compris : 78,97 €
- Taux de remboursement :65 %
Service médical rendu (SMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprès de la HAS (plus d'informations dans l'aide). Les avis et synthèses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur du SMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| Important | Avis du 20/01/2021 | Inscription (CT) | Le service médical rendu par GIBITER EASYHALER (budésonide / fumarate de formotérol dihydraté) 160 µg/4,5 µg/dose et 320 µg/9 µg/dose, poudre pour inhalation, est important dans l’asthme. |
| Modéré | Avis du 20/01/2021 | Inscription (CT) | Le service médical rendu par GIBITER EASYHALER (budésonide / fumarate de formotérol dihydraté) 160 µg/4,5 µg/dose et 320 µg/9 µg/dose, poudre pour inhalation, est modéré dans la BPCO. |
| Important | Avis du 22/11/2017 | Inscription (CT) | Le service médical rendu par GIBITER EASYHALER 320 µg/9 µg/inhalation et 160 µg/4,5 µg/inhalation, poudre pour inhalation, est important dans « le traitement continu de l’asthme persistant, dans les situations où l’administration par voie inhalée d’un médicament associant un corticoïde et un bronchodilatateur bêta-2 agoniste de longue durée d’action est justifiée : • chez les patients insuffisamment contrôlés par une corticothérapie inhalée et la prise d’un bronchodilatateur bêta-2 agoniste de courte durée d’action par voie inhalée à la demande • ou chez les patients contrôlés par l’administration d’une corticothérapie inhalée associée à un traitement continu par bêta-2 agoniste de longue durée d’action par voie inhalée. » |
| Modéré | Avis du 22/11/2017 | Inscription (CT) | Le service médical rendu par GIBITER EASYHALER 320 µg/9 µg/inhalation et 160 µg/4,5 µg/inhalation, poudre pour inhalation, est modéré dans « le traitement symptomatique de la BPCO chez les adultes âgés de 18 ans et plus dont le VEMS (mesuré après administration d’un bronchodilatateur) est inférieur à 70 % de la valeur théorique et ayant des antécédents d’exacerbations malgré un traitement bronchodilatateur continu ». |
Amélioration du service médical rendu (ASMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprés de la HAS (plus d'informations dans l'aide). Les avis et synthéses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur de l'ASMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| V (Inexistant) | Avis du 20/01/2021 | Inscription (CT) | Ces spécialités sont un complément de gamme qui n’apportent pas d’amélioration du service médical rendu (ASMR V) par rapport aux présentations déjà inscrites. |
| V (Inexistant) | Avis du 22/11/2017 | Inscription (CT) | Les spécialités GIBITER EASYHALER 320 µg/9 µg/inhalation et 160 µg/4,5 µg/inhalation, poudre pour inhalation sont similaires aux spécialités SYMBICORT TURBUHALER, par conséquent, la Commission considère qu’elles n’apportent pas d’amélioration du service médical rendu (ASMR V) par rapport aux spécialités SYMBICORT TURBUHALER 400/12 µg/dose et 200/6 µg/dose dans la prise en charge de l’asthme persistant et de la BPCO. |
ANSM - Mis à jour le : 14/08/2025
GIBITER EASYHALER 320 microgrammes/9 microgrammes/dose, poudre pour inhalation.
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Budésonide........................................................................................................................... 320 µg
Fumarate de formotérol dihydraté.............................................................................................. 9 µg
par dose
Chaque dose délivrée à l'embout buccal contient : budésonide, 320 microgrammes et fumarate de formotérol dihydraté, 9 microgrammes.
Avec le dispositif Easyhaler, la dose délivrée (sortant à l'extrémité de l'embout buccal du dispositif d'inhalation) contient une quantité de principes actifs similaire à celle contenue dans la dose mesurée à la sortie du réservoir de l'inhalateur (situé en amont de l'embout buccal).
Excipients à effet notoire : lactose monohydraté, 7 600 microgrammes par dose délivrée
Pour la liste complète des excipients, voir rubrique 6.1.
Poudre pour inhalation en inhalateur-doseur (Easyhaler).
Poudre blanche à jaunâtre.
4.1. Indications thérapeutiques
GIBITER EASYHALER 320 microgrammes/9 microgrammes/dose est indiqué chez l'adulte et l'adolescent âgé de 12 ans et plus, pour le traitement régulier de l'asthme lorsque l'utilisation d'une association d'un corticoïde inhalé et d'un bronchodilatateur bêta-2 agoniste de longue durée d'action est justifiée :
· chez les patients insuffisamment contrôlés par une corticothérapie inhalée et la prise d'un bronchodilatateur bêta-2 agoniste de courte durée d'action par voie inhalée à la demande.
ou
· chez les patients contrôlés par l'administration d'une corticothérapie inhalée associée à un traitement continu par bêta-2 agoniste de longue durée d'action par voie inhalée.
BRONCHOPNEUMOPATHIE CHRONIQUE OBSTRUCTIVE (BPCO)
GIBITER EASYHALER 320 microgrammes/9 microgrammes/dose est indiqué chez l'adulte (à partir de 18 ans) en traitement symptomatique chez les patients présentant une BPCO avec un volume expiratoire maximal par seconde (VEMS) post-bronchodilatateur < 70 % de la valeur théorique et des antécédents d'exacerbations répétées malgré un traitement régulier par bronchodilatateur (voir aussi rubrique 4.4).
4.2. Posologie et mode d'administration
ASTHME
GIBITER EASYHALER n'est pas indiqué en traitement initial de l'asthme.
La posologie est individuelle et le dosage utilisé de GIBITER EASYHALER sera adapté en fonction de la sévérité de la maladie.
Que ce soit à l'initiation du traitement ou pendant la phase d'adaptation de la dose d'entretien, si les dosages disponibles de l'association fixe de GIBITER EASYHALER ne permettent pas d'ajuster la posologie de chacun des principes actifs en fonction de l'état clinique du patient, les doses adaptées de bêta-2-agonistes et/ou de corticoïdes devront être administrées avec des spécialités séparées contenant chacun des principes actifs.
Posologie préconisée :
Adultes (18 ans et plus) : 1 inhalation 2 fois par jour.
Certains patients peuvent nécessiter 2 inhalations 2 fois par jour.
Adolescents (12-17 ans) : 1 inhalation 2 fois par jour.
Il convient de toujours rechercher la posologie minimale efficace permettant d'obtenir le contrôle des symptômes de l'asthme.
Le médecin vérifiera régulièrement que le dosage prescrit de GIBITER EASYHALER reste adapté pour un traitement optimal du patient. Lorsque le contrôle des symptômes est maintenu avec la dose recommandée la plus faible, l'administration d'un corticoïde inhalé seul pourra être envisagée comme étape suivante dans la recherche du traitement minimal efficace.
En pratique courante, lorsque les symptômes ont régressé avec 2 prises quotidiennes, un rythme d'administration en 1 prise par jour peut éventuellement être envisagé dans le cadre de la recherche de la dose minimale efficace si le médecin estime nécessaire de maintenir un traitement par bêta-2 adrénergique longue durée d'action en association avec un corticoïde inhalé pour le contrôle des symptômes.
Une augmentation de l’utilisation du bronchodilatateur d'action rapide pour soulager les symptômes aigus d'asthme est le signe d'une déstabilisation de l'asthme et nécessite une réévaluation du traitement.
Enfants (6 ans et plus) : un dosage plus faible (80 microgrammes/4,5 microgrammes/dose) est disponible pour les enfants de 6 à 11 ans.
Enfants de moins de 6 ans : comme seules des données limitées sont disponibles, GIBITER EASYHALER n'est pas recommandé chez les enfants de moins de 6 ans.
GIBITER EASYHALER 320 microgrammes/9 microgrammes/dose doit être utilisé exclusivement comme traitement d'entretien. Des dosages plus faibles (160 microgrammes/4,5 microgrammes/ dose et 80 microgrammes/4,5 microgrammes/dose) sont disponibles pour être utilisés à la fois pour le traitement d'entretien régulier de l’asthme et pour le traitement des symptômes aigus d'asthme.
BPCO:
Posologie préconisée :
Adultes : 1 inhalation deux fois par jour.
Informations générales
Populations spécifiques :
Sujets âgés : pas de recommandation posologique spécifique.
Insuffisance hépatique ou rénale: aucune donnée n'est disponible concernant l'utilisation de GIBITER EASYHALER chez des patients insuffisants hépatiques ou rénaux. Compte tenu de l'élimination principalement par métabolisme hépatique du budésonide et du formotérol, une augmentation de l'exposition systémique est attendue chez les patients présentant une cirrhose hépatique sévère.
Mode d’administration
Voie inhalée exclusivement
Instructions pour une utilisation correcte de l'inhalateur de GIBITER EASYHALER:
L'inhalateur est activé par l'inspiration. La poudre contenue dans le récipient est délivrée jusque dans les voies aériennes lorsque le patient inspire au travers de l'embout buccal.
Il est important de recommander aux patients de:
· lire attentivement les instructions d'utilisation contenues dans la notice fournie avec chaque inhalateur GIBITER EASYHALER.
· bien agiter et actionner l'inhalateur avant chaque inhalation.
· inspirer à fond au travers de l'embout buccal pour assurer la diffusion optimale de la poudre jusqu'au poumon.
· ne jamais expirer dans l'embout buccal, ce qui entraînerait une réduction de la dose délivrée. Si cela se produit, le patient devra tapoter l'embout buccal sur une table ou dans la paume de la main pour vider la poudre puis renouveler la procédure d'administration.
· ne jamais actionner le dispositif plus d'une fois sans inhaler la poudre. Si cela se produit, le patient devra tapoter l'embout buccal sur une table ou dans la paume de la main pour vider la poudre puis renouveler la procédure d'administration.
· toujours remettre en place le capuchon anti-poussière sur l'embout buccal (et fermer le couvercle de protection le cas échéant) après chaque utilisation pour éviter tout actionnement accidentel du dispositif; ce qui pourrait entraîner un surdosage ou un sous-dosage lors de l'utilisation suivante.
· se rincer la bouche avec de l'eau après les inhalations qui correspondent à l'administration régulière du produit en traitement d'entretien afin de minimiser le risque de candidose oropharyngée. En cas de candidose oropharyngée, les patients devront également se rincer la bouche avec de l'eau après chaque inhalation supplémentaire prise à la demande pour soulager les symptômes aigus de l'asthme.
· nettoyer régulièrement l'embout buccal avec un chiffon sec. Ne pas nettoyer l'embout buccal avec de l'eau car l'humidité peut dégrader la poudre.
· remplacer l'inhalateur GIBITER EASYHALER lorsque le compteur affiche zéro, même si de la poudre est encore visible dans l'inhalateur.
4.4. Mises en garde spéciales et précautions d'emploi
Si le contrôle des symptômes reste insuffisant à la suite du traitement par GIBITER EASYHALER ou si le patient dépasse les doses maximales recommandées de GIBITER EASYHALER, la conduite thérapeutique devra être réévaluée (voir rubrique 4.2). Une augmentation de l’utilisation du bronchodilatateur d'action rapide pour soulager les symptômes aigus d'asthme est le signe d'une déstabilisation de l'asthme et nécessite une réévaluation du traitement.
Une détérioration soudaine ou progressive du contrôle des symptômes d'asthme ou de BPCO nécessite un avis médical urgent car elle peut annoncer une évolution engageant le pronostic vital. Il conviendra alors d'envisager une augmentation de la corticothérapie (avec éventuellement une cure de corticoïdes oraux) ou une antibiothérapie en cas d'infection.
Il convient d'informer les patients qu'ils doivent avoir en permanence à leur disposition leur inhalateur de secours.
Il conviendra de rappeler aux patients qu'ils doivent prendre la dose d'entretien régulièrement en respectant la prescription médicale, même en l'absence de symptômes.
Dès que les symptômes de l'asthme sont bien contrôlés, une diminution progressive de la dose de GIBITER EASYHALER doit être envisagée. Il est important que les patients soient suivis régulièrement lors de la phase de réduction du traitement. La dose minimale efficace de GIBITER EASYHALER doit être utilisée (voir rubrique 4.2).
Le traitement par GIBITER EASYHALER ne doit pas être initié pendant une exacerbation, une aggravation significative ou une détérioration aiguë de l'asthme.
Des événements indésirables graves liés à l'asthme et des exacerbations peuvent survenir au cours du traitement par GIBITER EASYHALER. Il convient d'informer les patients de la nécessité de consulter un médecin tout en poursuivant leur traitement si les symptômes de l'asthme persistent ou s'aggravent.
Aucune étude clinique n'est disponible avec l'association budésonide/formotérol chez les patients présentant une BPCO et un VEMS pré-bronchodilatateur > 50 % de la valeur prédite et un VEMS post-bronchodilatateur < 70 % de la valeur prédite (voir rubrique 5.1).
Comme avec d'autres traitements administrés par voie inhalée, une augmentation des sibilants bronchiques et de la dyspnée juste après l'administration du produit traduit un bronchospasme paradoxal qui doit conduire à l'arrêt immédiat du traitement par GIBITER EASYHALER. La conduite thérapeutique devra être réévaluée pour envisager si nécessaire les traitements alternatifs. Le bronchospasme paradoxal sera traité immédiatement par un bronchodilatateur inhalé d'action rapide (voir rubrique 4.8).
La corticothérapie inhalée peut entraîner des effets systémiques, en particulier lors de traitements prolongés à fortes doses. La survenue de ces effets est néanmoins beaucoup moins probable avec la corticothérapie inhalée qu'avec la corticothérapie par voie systémique. Les effets systémiques possibles incluent un syndrome de Cushing, un tableau cushingoïde, une inhibition de la fonction surrénalienne, un retard de croissance chez les enfants et les adolescents, une diminution de la densité minérale osseuse, une cataracte et un glaucome et, plus rarement, des troubles psychologiques et comportementaux, notamment hyperactivité psychomotrice, troubles du sommeil, anxiété, dépression ou agressivité (en particulier chez l'enfant) (voir rubrique 4.8).
Des troubles visuels peuvent apparaitre lors d'une corticothérapie par voie systémique ou locale. En cas de vision floue ou d'apparition de tout autre symptôme visuel survenant au cours d'une corticothérapie, un examen ophtalmologique est requis à la recherche notamment d'une cataracte, d'un glaucome ou d'une lésion plus rare telle qu'une choriorétinopathie séreuse centrale, qui sont des troubles rapportés avec l'administration de corticoïdes par voie systémique ou locale.
L'effet potentiel de la corticothérapie sur la densité minérale osseuse, en particulier lors de traitements prolongés à fortes doses, doit être pris en considération chez les patients présentant des facteurs de risque associés d'ostéoporose. Des études long terme conduites chez des enfants recevant des doses quotidiennes moyennes de 400 µg ou chez des adultes recevant des doses quotidiennes de 800 µg de budésonide par voie inhalée n'ont pas montré d'effets significatifs sur la densité minérale osseuse. Il n'y a pas de donnée disponible concernant les effets de doses plus élevées.
En cas de suspicion d’inhibition de la fonction surrénalienne en relation avec une corticothérapie préalable par voie systémique, une attention particulière sera portée lors de la mise en route d’un traitement par GIBITER EASYHALER.
L’administration de budésonide par voie inhalée favorise la diminution du recours aux corticoïdes oraux pour le traitement des symptômes de l’asthme, mais elle ne prévient pas le risque d'insuffisance surrénale qui peut persister longtemps lors du sevrage des patients notamment corticodépendants traités préalablement par une corticothérapie orale. Dans ces situations, la fonction de l’axe hypothalamo-hypophyso-surrénalien (HHS) doit être surveillée régulièrement.
Le traitement prolongé par corticoïdes inhalés à fortes doses, notamment à des doses supérieures aux doses recommandées, peut également entraîner une inhibition de la fonction surrénalienne cliniquement significative. Une corticothérapie orale de supplémentation devra être envisagée dans les périodes de stress, en cas d'infection sévère ou de chirurgie programmée.
La diminution rapide de la dose de corticoïdes peut entraîner une insuffisance surrénale aiguë. Celle-ci peut se manifester par des symptômes atypiques, tels que: anorexie, douleurs abdominales, perte de poids, fatigue, céphalées, nausées, vomissements, troubles de la conscience, convulsions, hypotension et hypoglycémie.
La corticothérapie orale de supplémentation et le traitement par budésonide inhalé ne doivent pas être interrompus brutalement.
La corticothérapie par voie inhalée exerce une activité corticoïdes moins importante que la corticothérapie systémique. Lors du relais de la corticothérapie orale par GIBITER EASYHALER peuvent apparaitre des symptômes évocateurs d'allergie ou d'arthrite tels qu'une rhinite, un eczéma, des myalgies et/ou des arthralgies. Un traitement adapté sera envisagé. Dans de rares cas, des symptômes tels que fatigue, céphalées, nausées et vomissements peuvent être observés et doivent faire suspecter une insuffisance cortico-surrénalienne. Il peut être nécessaire d’augmenter temporairement la dose de glucocorticoïdes oraux.
Afin de réduire le risque de candidose oropharyngée (voir rubrique 4.8), il sera recommandé aux patients de se rincer la bouche avec de l'eau après chaque prise du traitement d'entretien.
L'administration concomitante d'itraconazole, de ritonavir ou d'autres inhibiteurs puissants du CYP3A doit être évitée (voir rubrique 4.5). Si cela n'est pas possible, l'intervalle de temps entre l'administration des médicaments doit être aussi long que possible.
GIBITER EASYHALER doit être administré avec précaution chez les patients présentant les pathologies suivantes: thyrotoxicose, phéochromocytome, diabète sucré, hypokaliémie non traitée, cardiomyopathie obstructive, sténose aortique sous-valvulaire idiopathique, hypertension artérielle sévère, anévrisme ou autres troubles cardiovasculaires sévères, tels que cardiopathie ischémique, tachyarythmies ou insuffisance cardiaque sévère.
La prudence est requise chez les patients présentant un allongement de l'intervalle QTc. Le formotérol peut lui-même provoquer un allongement de l'intervalle QTc.
Le bénéfice de la corticothérapie inhalée et sa posologie devront être réévalués en cas de tuberculose pulmonaire active ou quiescente ou d'infections respiratoires fongiques ou virales.
Des doses élevées d'agonistes des récepteurs β2 adrénergiques peuvent entraîner une hypokaliémie potentiellement grave. L’administration concomitante de bêta-2 adrénergiques avec des médicaments hypokaliémiants ou pouvant potentialiser cet effet, tels que les dérivés xanthiques, les corticoïdes ou les diurétiques, peut induire une augmentation du risque d’hypokaliémie. La prudence est particulièrement recommandée chez les patients ayant un asthme instable et une utilisation variable de bronchodilatateurs "à la demande" pour traiter des symptômes aigus, car le risque associé peut être majoré par l'hypoxémie au cours d’un épisode aigu d'asthme sévère ou par toutes les situations susceptibles d'induire une hypokaliémie. Dans ces cas, une surveillance de la kaliémie est recommandée.
Comme avec tous les bêta-2 agonistes, des contrôles supplémentaires de la glycémie peuvent être justifiés chez les patients diabétiques.
Pneumonie chez les patients présentant une BPCO
Une augmentation de l’incidence des cas de pneumonie, ayant ou non nécessité une hospitalisation, a été observée chez les patients présentant une BPCO et recevant une corticothérapie inhalée. Bien que cela ne soit pas formellement démontré dans toutes les études cliniques disponibles, ce risque semble augmenter avec la dose de corticoïde administré.
Les données disponibles ne permettent pas de considérer que le niveau du risque de survenue de pneumonie varie en fonction du corticoïde inhalé utilisé.
Il convient de rester vigilant quant au risque de développer une pneumonie chez les patients présentant une BPCO, les symptômes de pneumonie pouvant s'apparenter aux manifestations cliniques d'une exacerbation de BPCO.
Le tabagisme, un âge avancé, un faible indice de masse corporelle (IMC) ainsi que la sévérité de la BPCO sont des facteurs de risques de survenue de pneumonie chez les patients présentant une BPCO.
GIBITER EASYHALER contient environ 8 mg de lactose par dose. Les faibles quantités administrées n’ont en général pas de conséquence chez les personnes intolérantes au lactose. Le lactose présent en tant qu'excipient peut néanmoins contenir des protéines de lait en faible quantité pouvant entraîner des réactions allergiques.
Population pédiatrique
La croissance des enfants recevant une corticothérapie au long cours devra être surveillée régulièrement. En cas de ralentissement de la croissance, le traitement devra être réévalué afin, si possible, de réduire les doses du corticoïde inhalé jusqu'à la dose minimale efficace pour le contrôle des symptômes d'asthme. Le bénéfice attendu de la corticothérapie devra être soigneusement évalué en tenant compte du risque possible d'inhibition de la croissance. L’avis d’un spécialiste pneumo-pédiatre peut être requis.
Des données limitées, issues d'études cliniques à long terme, semblent indiquer que la plupart des enfants et des adolescents traités par budésonide en inhalation atteindront leur taille adulte attendue. Toutefois, une réduction initiale, limitée mais transitoire, de la croissance (de l'ordre de 1 cm) a été observée, survenant généralement pendant la première année de traitement.
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
Interactions pharmacocinétiques
Les inhibiteurs puissants du CYP3A (tels que: kétoconazole, itraconazole, voriconazole, posaconazole, clarithromycine, télithromycine, néfazodone, cobicistat et inhibiteurs de la protéase du VIH) peuvent entraîner une augmentation significative des concentrations plasmatiques de budésonide. L'administration concomitante doit être évitée. Si ces traitements ne peuvent être évités, l'intervalle de temps entre l'administration des médicaments doit être le plus long possible (voir rubrique 4.4).
Le kétoconazole, inhibiteur puissant du CYP3A4, administré à la dose quotidienne de 200 mg, a entraîné une augmentation de 6 fois, en moyenne, des concentrations plasmatiques du budésonide administré par voie orale (dose unique de 3 mg). Lorsque le kétoconazole a été administré 12 heures après le budésonide, la concentration a été, en moyenne, multipliée seulement par 3, ce qui suggère qu'une administration en respectant un intervalle de temps permet de réduire l'augmentation des concentrations plasmatiques de budésonide. Les données limitées disponibles avec le budésonide inhalé administré à des doses élevées (dose unique de 1 000 µg) ont mis en évidence une augmentation marquée des concentrations plasmatiques de budésonide (augmentation d'un facteur 4 en moyenne) lors de l'administration concomitante d'itraconazole, à la dose de 200 mg une fois par jour.
Une augmentation du risque d'effets indésirables systémiques est attendue avec l'administration concomitante de cobicistat. L'association de budésonide avec des produits contenant du cobicistat doit donc être évitée, sauf si le bénéfice attendu avec la corticothérapie est supérieur au risque d'effets indésirables systémiques des corticoïdes. Dans ce cas, une surveillance accrue des effets indésirables des corticoïdes est nécessaire.
Interactions pharmacodynamiques
Les inhibiteurs bêta-adrénergiques peuvent diminuer ou antagoniser l'activité du formotérol. Sauf en cas de nécessité absolue, l'administration concomitante de GIBITER EASYHALER avec les inhibiteurs bêta-adrénergiques (y compris en collyres) n'est pas recommandée.
Un traitement concomitant avec la quinidine, le disopyramide, le procaïnamide, les phénothiazines, les anti-histaminiques (terfénadine) et les antidépresseurs tricycliques peut prolonger l'intervalle QTc et augmenter le risque d'arythmies ventriculaires.
De plus, la L-Dopa, la L-thyroxine, l'ocytocine et l'alcool peuvent diminuer la tolérance cardiaque envers les β2 adrénergiques.
L'administration concomitante des inhibiteurs de la monoamine oxydase, y compris les produits exerçant une activité similaire tels que la furazolidone et la procarbazine, peut favoriser les poussées hypertensives.
Le risque d'arythmie est augmenté en cas d'anesthésie concomitante par hydrocarbures halogénées.
L'utilisation concomitante d'autres médicaments bêta-adrénergiques ou anticholinergiques peut potentialiser l'effet bronchodilatateur.
L'hypokaliémie favorise le risque d'arythmies chez les patients traités par glycosides digitaliques.
L'hypokaliémie peut être entraînée par un traitement par bêta-2 agoniste et peut être potentialisée par un traitement concomitant avec des dérivés de la xanthine, des corticoïdes et des diurétiques (voir rubrique 4.4).
Il n'a pas été observé d'interaction entre le budésonide et le formotérol et d'autres médicaments utilisés dans le traitement de l'asthme.
Populations pédiatriques
Les études d’interaction n’ont été réalisées que chez l’adulte.
4.6. Fertilité, grossesse et allaitement
Grossesse
Il n'y a pas d'étude clinique évaluant les effets de GIBITER EASYHALER ou d'un traitement associant formotérol et budésonide chez les femmes enceintes. Les données issues d'une étude du développement embryonnaire et fœtal chez le rat n'ont pas mis en évidence d'effets spécifiques liés à l'association de formotérol et de budésonide.
Il n'existe pas de données pertinentes concernant l'utilisation du formotérol chez la femme enceinte. Dans des études de la reproduction conduites chez l'animal, le formotérol a provoqué des effets indésirables à des niveaux d'exposition systémique très élevés (voir rubrique 5.3).
Les données portant sur environ 2 000 grossesses exposées indiquent l'absence d'augmentation du risque tératogène associé à l'utilisation du budésonide inhalé. Les études animales ont mis en évidence l'apparition de malformations avec les glucocorticoïdes (voir rubrique 5.3). La pertinence de ces observations pour l'homme aux doses préconisées n'est pas établie.
Des études conduites chez l'animal avec de fortes doses de glucocorticoïdes administrés en période prénatale ont mis en évidence une augmentation du risque de retard de croissance intra-utérine, d'atteintes cardiovasculaires à l'âge adulte et des modifications irréversibles de la densité en récepteurs aux glucocorticoïdes, de la recapture des neurotransmetteurs et du comportement avec des expositions systémiques inférieures à celles obtenues aux doses tératogènes.
GIBITER EASYHALER ne doit être utilisé pendant la grossesse que lorsque les bénéfices sont supérieurs aux risques potentiels. Il conviendra d'utiliser la dose efficace de budésonide la plus faible possible nécessaire au contrôle de l'asthme.
Allaitement
Le budésonide passe dans le lait maternel. Cependant, à des doses thérapeutiques, aucun effet n'est attendu pour l'enfant allaité. Le passage du formotérol dans le lait maternel n'est pas connu. Chez le rat, de petites quantités de formotérol ont été détectées dans le lait maternel. L'administration de GIBITER EASYHALER chez la femme qui allaite ne doit être envisagée que si le bénéfice attendu pour la mère est supérieur au risque potentiel pour l'enfant.
Fertilité
Aucune donnée n'est disponible concernant l'effet potentiel du budésonide sur la fertilité. Des études de la reproduction chez l'animal menées avec le formotérol ont montré une légère réduction de la fertilité chez les rats mâles avec des expositions systémiques élevées (voir rubrique 5.3).
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
Les effets indésirables de GIBITER EASYHALER sont ceux susceptibles de survenir avec chacune des substances actives qu'il contient : budésonide et formotérol. Il n'a pas été observé d'augmentation de l'incidence des effets indésirables après administration concomitante des deux composés. Les effets indésirables les plus fréquents sont les effets indésirables connus des β2 agonistes, tels que tremblements et palpitations. Ces effets indésirables sont en général d'intensité légère et disparaissent le plus souvent rapidement après quelques jours de traitement.
Les effets indésirables associés au budésonide ou au formotérol sont énumérés ci-dessous par classe de systèmes d'organes et par fréquence. La fréquence de survenue est définie comme suit : très fréquent (≥ 1/10), fréquent (≥ 1/100 à < 1/10), peu fréquent (≥ 1/1 000 à < 1/100), rare (≥ 1/10 000 à < 1/1 000) et très rare (< 1/10 000).
Tableau 1
|
Classe d'organe |
Fréquence |
Événement indésirable médicamenteux |
|
Infections et infestations |
Fréquent |
Candidose oropharyngée, pneumonie (chez les patients présentant une BPCO) |
|
Troubles du système immunitaire |
Rare |
Réactions d'hypersensibilité immédiate et retardée, tels que exanthème, urticaire, prurit, dermatite, angiœdème et réactions anaphylactiques |
|
Troubles endocriniens |
Très rare |
Syndrome de Cushing, inhibition surrénalienne, retard de croissance, diminution de la densité minérale osseuse |
|
Troubles du métabolisme et de la nutrition |
Rare |
Hypokaliémie |
|
Très rare |
Hyperglycémie |
|
|
Troubles psychiatriques |
Peu fréquent
|
Agressivité, hyperactivité psychomotrice, anxiété, troubles du sommeil |
|
Très rare |
Dépression, trouble du comportement (principalement chez l'enfant) |
|
|
Troubles du système nerveux |
Fréquent |
Céphalées, tremblement |
|
Peu fréquent |
Sensations d'étourdissements |
|
|
Très rare |
Dysgueusie |
|
|
Troubles oculaires |
Peu fréquent |
Vision trouble (voir rubrique 4.4) |
|
Très rare |
Cataracte et glaucome |
|
|
Troubles cardiaques |
Fréquent |
Palpitations |
|
Peu fréquent |
Tachycardie |
|
|
Rare |
Troubles du rythme cardiaque, tels que fibrillation auriculaire, tachycardie supraventriculaire, extrasystoles |
|
|
Très rare |
Angor, allongement de l'intervalle QTc |
|
|
Troubles vasculaires |
Très rare |
Variations de la pression artérielle |
|
Troubles respiratoires, thoraciques et médiastinaux |
Fréquent |
Légère irritation de la gorge, toux, dysphonie, y compris l’enrouement |
|
Rare |
Bronchospasme |
|
|
Troubles gastro-intestinaux |
Peu fréquent |
Nausées |
|
Troubles cutanés et du tissu sous-cutané |
Peu fréquent |
Ecchymoses |
|
Troubles musculo-squelettiques et systémiques |
Peu fréquent |
Crampes musculaires |
La candidose oropharyngée est liée au dépôt du budésonide. Il convient de recommander au patient de se rincer la bouche avec de l'eau après chaque prise du traitement de fond afin de réduire le risque. Les candidoses oropharyngées peuvent en général être traitées par antifongique locaux sans qu'il soit nécessaire d'interrompre la corticothérapie inhalée. Si une candidose oropharyngée survient, les patients devront également se rincer la bouche à l’eau après les inhalations prises en cas de besoin.
Comme avec d'autres traitements par voie inhalée, un bronchospasme peut survenir, très rarement (moins de 1 personne sur 10 000), se manifestant par une augmentation des sibilants bronchiques et de la dyspnée immédiatement après l'administration. Le bronchospasme paradoxal devra être immédiatement traité par un bronchodilatateur inhalé d'action rapide. Le traitement par GIBITER EASYHALER sera interrompu immédiatement et la conduite thérapeutique devra être réévaluée pour envisager, si nécessaire, les alternatives thérapeutiques (voir rubrique 4.4).
La corticothérapie par voie inhalée peut entraîner des effets systémiques, en particulier lors de traitements à fortes doses ou prolongés. La survenue de ces effets est moins probable qu’au cours d’une corticothérapie par voie orale. Les effets systémiques possibles sont: syndrome de Cushing, tableau cushingoïde, inhibition de la fonction surrénalienne, retard de croissance chez les enfants et les adolescents, diminution de la densité minérale osseuse, cataracte et glaucome. Une augmentation du risque d'infection et une diminution de la capacité d'adaptation au stress sont également possibles. Les effets semblent dépendants de la dose administrée, de la durée d'exposition, de l'effet cumulé avec une corticothérapie associée ou antérieure et à une sensibilité individuelle.
Un traitement par bêta-2 agoniste peut entraîner une augmentation des taux sanguins d'insuline, des acides gras libres, du glycérol et des corps cétoniques.
Population pédiatrique
Il est recommandé de surveiller régulièrement la taille des enfants recevant une corticothérapie inhalée au long cours (voir rubrique 4.4).
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr
Les effets attendus lors d'un surdosage en formotérol correspondent à une exacerbation de l'activité agoniste des récepteurs β2 adrénergiques, tels que tremblement, céphalées, palpitations. Les symptômes rapportés dans le cadre de cas isolés sont : tachycardie, hyperglycémie, hypokaliémie, allongement de l'intervalle QTc, arythmies, nausées et vomissements. Une surveillance clinique et un traitement symptomatique sont préconisés. L'administration de 90 microgrammes de formotérol sur une période de 3 heures à des patients présentant une obstruction bronchique aiguë n'a pas entraîné d'effet délétère cliniquement significatif.
Il n'est pas attendu d'effets délétères cliniquement significatifs en cas de surdosage aigu de budésonide, même à des doses excessives. En cas d'utilisation chronique à des doses excessives, les effets systémiques des glucocorticoïdes peuvent apparaître, tels que hypercorticisme et inhibition de la fonction surrénalienne.
Si le traitement par GIBITER EASYHALER doit être arrêté en raison d'une dose trop importante de formotérol, il convient d'envisager un traitement adapté par corticoïde inhalé seul.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Mécanisme d’action et effets pharmacodynamiques
Les substances actives de GIBITER EASYHALER sont le formotérol et le budésonide, dont les mécanismes d’action diffèrent. Il résulte de leur association un effet additif en termes de réduction des exacerbations de l'asthme.
Le mécanisme d'action de chacun des principes actifs est décrit ci-après.
Budésonide
Le budésonide est un glucocorticoïde qui, administré par voie inhalée, exerce un effet anti-inflammatoire local dose-dépendant, entraînant une réduction des symptômes et du nombre d'exacerbations d'asthme. Le budésonide administré par voie inhalée induit des effets indésirables moins sévères que les corticoïdes administrés par voie systémique. Le mécanisme d'action exact à l'origine de l'activité antiinflammatoire exercée par les glucocorticoïdes n'est pas connu.
Formotérol
Le formotérol est un agoniste sélectif des récepteurs β2 adrénergiques qui, administré par voie inhalée, entraîne une relaxation rapide et durable du muscle lisse bronchique chez les patients présentant une broncho-constriction réversible. L'effet bronchodilatateur est dose-dépendant et débute 1 à 3 minutes après l'administration. La durée de l'effet est d'au moins 12 heures après une seule dose.
Efficacité et sécurité clinique (sauf mention spécifique, les essais cliniques décrits ci-dessous n’ont pas été réalisés avec GIBITER EASYHALER)
ASTHME
Efficacité clinique pour le traitement d'entretien par budésonide/formotérol
Données d'efficacité clinique concernant le traitement régulier d'entretien de l'asthme par budésonide/formotérol
Au cours des essais cliniques réalisés chez l'adulte, il a été mis en évidence une amélioration du contrôle de l'asthme et de la fonction respiratoire ainsi qu'une réduction des exacerbations lorsque le formotérol était ajouté au traitement par budésonide.
Dans deux études de 12 semaines, l'effet de l'association budésonide/formotérol sur la fonction respiratoire était identique à celui d'un traitement associant budésonide et formotérol administrés séparément, et supérieur à celui d'un traitement par budésonide seul. Dans tous les groupes de patients comparés, un bêta-2 mimétique de courte durée d'action était utilisé à la demande. Il n'a été pas observé d'épuisement de l'effet thérapeutique du traitement au cours du temps.
Une étude randomisée, en double aveugle, incluant 72 adultes asthmatiques âgés de 18 à 70 ans, a comparé l'efficacité de l'association budésonide/formotérol Easyhaler à celle de Symbicort Turbuhaler après l'administration d'une dose unique. Les patients inclus présentaient un asthme stable avec un contrôle sub-optimal. La moyenne des VEMS était de 1,92 L (soit 62 % de la valeur prédite). L'étude comparait l'administration d'une dose de formoterol de 9 µg et de 36 µg (soit 1 et 4 inhalations avec le dosage 320/9 µg). La différence observée entre les 2 groupes sur le critère principal qui était le VEMS moyen sur 12 heures, n'était pas significative. À la dose la plus faible, la différence entre les traitements (Easyhaler - Turbuhaler) était de 0,013 L (IC 95 %: -0,047 ; 0,073 L) et, à la dose la plus élevée, elle était de -0,028 L (IC 95 % : -0,087 ; 0,032 L). Au vu des résultats de l'étude l'efficacité bronchodilatatrice était considérée équivalente entre l'association budésonide/formotérol Easyhaler et Symbicort Turbuhaler.
Deux études pédiatriques de 12 semaines ont été réalisées, au cours desquelles un total de 265 enfants de 6 à 11 ans ont reçu un traitement d'entretien avec l'association budésonide/formotérol (2 inhalations de 80 microgrammes/4,5 microgrammes/dose 2 fois par jour) et ont utilisé un agoniste des récepteurs bêta-2 adrénergiques "à la demande". Dans les deux études, la fonction respiratoire a été améliorée et le traitement a été bien toléré, comparativement aux groupes traités par budésonide seul à la dose correspondante.
BPCO
Deux études de 12 mois ont évalué l’effet sur la fonction pulmonaire et la fréquence des exacerbations (définies par la prise de corticoïdes oraux et/ou la prise d’antibiotiques et/ou des hospitalisations) chez des patients souffrant de BPCO modérée à sévère. Le critère d’inclusion pour les 2 études était un VEMS pré-bronchodilatateur <50% de la valeur théorique. Le VEMS médian à l’inclusion dans les essais était de 42 % (exprimé en pourcentage de la valeur théorique). Le nombre moyen d’exacerbations par an (comme défini plus haut) était significativement réduit avec l’association budésonide/formotérol, par rapport au formotérol seul ou au placebo (fréquence moyenne de 1,4 contre 1,8-1,9 dans le groupe placebo/formotérol). Au cours des 12 mois, le nombre moyen de jours de traitement par corticoïdes oraux/patient était légèrement diminué dans le groupe budésonide/formotérol (7-8 jours/patient/an) par rapport au groupe placebo (11-12 jours/patient/an) et au groupe formotérol (9-12 jours/patient/an). En ce qui concerne les changements au niveau des paramètres de la fonction pulmonaire, comme le VEMS, l’association budésonide/formotérol ne s’est pas révélée supérieure au formotérol seul.
5.2. Propriétés pharmacocinétiques
La bioéquivalence a été établie entre les associations fixes budésonide/formotérol GIBITER EASYHALER et Symbicort Turbuhaler en termes d'exposition systémique totale et pulmonaire. La bioéquivalence a été établie en termes d'exposition systémique au budésonide et au formotérol, entre l'association fixe Symbicort Turbuhaler et chacun des principes actifs budésonide et formotérol administrés séparément. Néanmoins, une légère augmentation de l'inhibition de la fonction corticotrope a été observée après administration de l'association fixe, comparativement à l'administration de chaque substance individuellement. Cette différence a été considérée comme n'ayant pas de retentissement clinique sur le plan de la tolérance.
Il n'a pas été mis en évidence d'interaction pharmacocinétique entre le budésonide et le formotérol. Les paramètres pharmacocinétiques de chacune des substances actives ont été comparables après administration de budésonide et de formotérol seuls ou avec l'association fixe. Pour le budésonide, l'aire sous la courbe des concentrations plasmatiques (ASC) a été légèrement supérieure, l'absorption plus rapide et la concentration plasmatique maximale (Cmax) plus élevée après administration de l'association fixe. Pour le formotérol, la concentration plasmatique maximale a été similaire après administration de l'association fixe. Le budésonide inhalé est rapidement absorbé et la concentration plasmatique maximale est atteinte dans les 30 minutes suivant l'inhalation. Dans les études, le dépôt pulmonaire moyen de budésonide après inhalation avec l'inhalateur de poudre a été de 32 % à 44 % de la dose délivrée. La biodisponibilité systémique est d'environ 49 % de la dose délivrée. Le dépôt pulmonaire chez l'enfant de 6 à 16 ans est du même ordre que celui observé chez l'adulte pour une même dose administrée. Les concentrations plasmatiques atteintes n'ont pas été déterminées.
Le formotérol inhalé est rapidement absorbé et la concentration plasmatique maximale est atteinte dans les 10 minutes suivant l'inhalation. Dans les études, le dépôt pulmonaire moyen de formotérol après inhalation avec l'inhalateur de poudre a été de 28 % à 49 % de la dose délivrée. La biodisponibilité systémique est d'environ 61 % de la dose délivrée.
Distribution et biotransformation
La liaison aux protéines plasmatiques est de 50% pour le formotérol et de 90% pour le budésonide. Le volume de distribution est d'environ 4 l/kg pour le formotérol et de 3 l/kg pour le budésonide. Le formotérol est métabolisé par conjugaison en métabolites O-déméthylés et déformylés retrouvés principalement sous forme de conjugués inactifs. Le budésonide subit un effet de premier passage hépatique important (≈ 90 %), résultant en la formation de métabolites présentant une faible activité glucocorticoïde. L'activité glucocorticoïde des métabolites majeurs, le 6-bêta-hydroxy-budésonide et le 16-alfa-hydroxy-prednisolone, est inférieure à 1 % de celle du budésonide. Les données disponibles ne suggèrent pas l'existence d'interactions au niveau du métabolisme ou de la liaison aux protéines plasmatiques entre le formotérol et le budésonide.
Élimination
Le formotérol subit un métabolisme hépatique important, et est ensuite éliminée par voie urinaire. Après inhalation, 8 % à 13 % de la dose délivrée de formotérol est excrétée sous forme non métabolisée dans l'urine. La clairance systémique du formotérol est élevée (environ 1,4 l/min) et sa demi-vie d'élimination terminale est en moyenne de 17 heures.
Le budésonide est éliminé par métabolisme, catalysé principalement par l'enzyme CYP3A4. Les métabolites du budésonide sont éliminés dans l'urine sous forme conjuguée ou sous forme inchangée. Le budésonide est retrouvé sous forme inchangée en quantité négligeable dans les urines. La clairance systémique du budésonide est élevée (environ 1,2 l/min) et sa demi-vie d'élimination plasmatique après administration par voie intraveineuse est de 4 heures en moyenne.
Les données pharmacocinétiques du formotérol et du budésonide chez les enfants et les insuffisants rénaux ne sont pas connues. L'exposition au budésonide et au formotérol peut augmenter chez les patients présentant une insuffisance hépatique.
Linéarité/non-linéarité
La pharmacocinétique du budésonide et du formotérol est linéaire aux doses thérapeutiques.
Relations pharmacocinétique/pharmacodynamique
La bioéquivalence entre GIBITER EASYHALER et une autre spécialité à base d'une association fixe de formotérol et de budésonide a été établie en termes d'exposition systémique totale et pulmonaire par des études de pharmacocinétiques réalisées avec et sans ingestion de charbon actif.
5.3. Données de sécurité préclinique
La toxicité observée dans les études animales avec le budésonide et le formotérol administrés en association ou séparément se caractérise par des effets associés à une exacerbation de l'activité pharmacologique.
Dans les études de la reproduction conduites chez l'animal, les corticoïdes, comme le budésonide, ont entrainé des malformations (fente palatine, malformations squelettiques). Cependant, ces résultats expérimentaux obtenus chez l'animal ne semblent pas pertinents pour l'homme aux doses thérapeutiques. Des études de la reproduction menées chez l'animal avec le formotérol ont montré une légère réduction de la fertilité des rats mâles avec une exposition systémique élevée et des pertes d'implantation ainsi qu'une réduction de la survie post-natale précoce et du poids de naissance, pour des expositions systémiques très supérieures à celles atteintes lors de l'utilisation clinique. Cependant, ces résultats expérimentaux obtenus chez l'animal ne semblent pas pertinents chez l'homme.
Lactose monohydraté (contient des protéines de lait).
Dans l'emballage d'origine : 2 ans.
Après première ouverture du sachet plastifié : 4 mois. Conserver à une température ne dépassant pas les 25°C et à l’abri de l’humidité.
6.4. Précautions particulières de conservation
Ce médicament ne nécessite pas de précautions particulières de conservation.
Pour les conditions de conservation du médicament après première ouverture, voir la rubrique 6.3
6.5. Nature et contenu de l'emballage extérieur
L'inhalateur de poudre multidoses comporte sept éléments en plastique et un ressort en acier inoxydable. Les matériaux plastiques de l'inhalateur sont le téréphtalate de polybutylène, le polyéthylène basse densité, le polycarbonate, le styrène, le butadiène, le polypropylène. L'inhalateur est présenté dans un sachet plastifié scellé et emballé avec ou sans couvercle de protection (polypropylène et élastomère thermoplastique) dans une boîte en carton.
Conditionnements :
GIBITER EASYHALER 320 microgrammes/9 microgrammes/dose, poudre pour inhalation :
60 doses
60 doses + couvercle de protection
180 doses (3 x 60 doses)
Toutes les présentations peuvent ne pas être commercialisées
6.6. Précautions particulières d’élimination et de manipulation
Pas d’exigences particulières.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
MENARINI INTERNATIONAL OPERATIONS LUXEMBOURG S.A.
1 AVENUE DE LA GARE
1611 LUXEMBOURG
LUXEMBOURG
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· 34009 300 932 4 5 : Inhalateur-doseur (Easyhaler) de 60 doses
· 34009 300 932 5 2 : Inhalateur-doseur (Easyhaler) de 60 doses avec couvercle de protection
· 34009 302 211 9 8 : Inhalateur-doseur (Easyhaler) de 60 doses. Boîte de 3 inhalateurs
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
[à compléter ultérieurement par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE
[à compléter ultérieurement par le titulaire]
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Liste I
ANSM - Mis à jour le : 14/08/2025
GIBITER EASYHALER 320 microgrammes/9 microgrammes/dose, poudre pour inhalation
Budésonide/fumarate de formotérol dihydrate
Veuillez lire attentivement cette notice avant de prendre ce médicament car elle contient des informations importantes pour vous.
· Gardez cette notice. Vous pourriez avoir besoin de la relire.
· Si vous avez d’autres questions, interrogez votre médecin ou votre pharmacien.
· Ce médicament vous a été personnellement prescrit. Ne le donnez pas à d’autres personnes. Il pourrait leur être nocif, même si les signes de leur maladie sont identiques aux vôtres.
· Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
1. Qu'est-ce que GIBITER EASYHALER 320 microgrammes/9 microgrammes/dose, poudre pour inhalation et dans quels cas est-il utilisé ?
2. Quelles sont les informations à connaître avant d'utiliser GIBITER EASYHALER 320 microgrammes/9 microgrammes/dose, poudre pour inhalation ?
3. Comment utiliser GIBITER EASYHALER 320 microgrammes/9 microgrammes/dose, poudre pour inhalation ?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver GIBITER EASYHALER 320 microgrammes/9 microgrammes/dose, poudre pour inhalation ?
6. Contenu de l’emballage et autres informations.
1. QU’EST-CE QUE GIBITER EASYHALER 320 microgrammes/9 microgrammes/dose, poudre pour inhalation ET DANS QUELS CAS EST-IL UTILISE ?
GIBITER EASYHALER est également indiqué pour traiter les symptômes de la bronchopneumopathie chronique obstructive (BPCO) chez l’adulte de plus de 18 ans.
Il contient deux substances actives différentes : le budésonide et le fumarate de formotérol.
· Le budésonide appartient à un groupe de médicaments appelés « corticoïdes ». Il agit en réduisant l'inflammation dans vos poumons.
· Le fumarate de formotérol appartient à un groupe de médicaments appelés « bronchodilatateurs » ou « bêta-agonistes (ou bêta-2 adrénergiques) de longue durée d'action ». Il agit en relâchant les muscles de vos bronches ; ce qui vous aide à respirer plus facilement.
Asthme
Pour le traitement de l’asthme, deux médicaments en inhalateurs vous seront prescrits : Gibiter Easyhaler 320/9 et un traitement de secours :
· Gibiter Easyhaler sera utilisé quotidiennement matin et soir, dans le but de prévenir la survenue des symptômes d’asthme.
· Le traitement de secours sera utilisé au moment où surviennent des symptômes d’asthme pour les soulager et pour faciliter la respiration.
Ne pas utiliser Gibiter Easyhaler 320/9 comme inhalateur de secours.
Bronchopneumopathie chronique obstructive (BPCO)
Gibiter Easyhaler est également préconisé pour le traitement de la Broncho-pneumopathie Chronique Obstructive chez l’adulte. La Bronchopneumopathie Chronique Obstructive est une maladie chronique des voies respiratoires souvent causée par le tabagisme.
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT D’UTILISER GIBITER EASYHALER 320 microgrammes/9 microgrammes/dose, poudre pour inhalation ?
N’utilisez jamais GIBITER EASYHALER 320 microgrammes/9 microgrammes/dose, poudre pour inhalation :
· si vous êtes allergique au budésonide, au formotérol ou aux protéines de lait qui sont présentes à l'état de traces dans le lactose qui est l’autre composant contenu dans ce médicament, mentionné dans la rubrique 6.
Avertissements et précautions
Demandez l'avis de votre médecin ou pharmacien avant d’utiliser GIBITER EASYHALER dans les situations suivantes:
· si vous êtes diabétique
· si vous avez une infection pulmonaire
· si vous avez une hypertension ou si vous avez déjà présenté un problème cardiaque, y compris des troubles du rythme cardiaque (battements cardiaques irréguliers ou trop rapides), une sténose artérielle (rétrécissement des artères) ou une insuffisance cardiaque
· si vous avez des problèmes de thyroïde ou de glandes surrénales
· si vous avez un taux de potassium trop faible dans le sang.
· si vous avez des problèmes hépatiques sévères.
Contactez votre médecin si votre vision devient floue ou en cas d'apparition de tout autre trouble visuel. Rincez-vous la bouche après avoir inhalé votre dose pour éviter les mycoses dans la bouche.
Enfants et adolescents
Sans objet.
Autres médicaments et GIBITER EASYHALER 320 microgrammes/9 microgrammes/dose, poudre pour inhalation
Informez votre médecin ou pharmacien si vous prenez, avez récemment pris ou pourriez prendre tout autre médicament, y compris les médicaments obtenus sans ordonnance.
Certains médicaments peuvent augmenter les effets de GIBITER EASYHALER et votre médecin peut considérer qu'il est nécessaire de faire une surveillance particulière si vous prenez ces médicaments (y compris certains médicaments contre le VIH : ritonavir, cobicistat).
En particulier, si vous prenez l’un des médicaments suivants, informez-en votre médecin ou votre pharmacien avant d'utiliser GIBITER EASYHALER :
· Bêta-bloquants (comme l'aténolol ou le propranolol qui sont utilisés dans le traitement de l'hypertension), y compris en collyre (comme le timolol pour le glaucome).
· Médicaments pour des battements cardiaques rapides ou irréguliers (comme la quinidine).
· Médicaments comme la digoxine, souvent utilisés pour traiter l'insuffisance cardiaque.
· Diurétiques (comme le furosémide). Ces médicaments sont utilisés pour traiter l'hypertension
· Corticoïdes pris par voie orale (comme la prednisolone).
· Xanthines (comme la théophylline ou l'aminophylline). Ces médicaments sont souvent utilisés pour traiter l'asthme.
· Autres bronchodilatateurs (comme le salbutamol).
· Antidépresseurs tricycliques (comme l'amitriptyline) et l'antidépresseur néfazodone.
· Phénothiazines (comme la chlorpromazine et la prochlorpérazine).
· Médicaments pour traiter des infections (comme le kétoconazole, l'itraconazole, le voriconazole, le posaconazole, la clarithromycine et la télithromycine).
· Médicaments destinés à traiter la maladie de Parkinson (comme la lévo-dopa).
· Médicaments destinés à traiter l'insuffisance thyroïdienne (comme la lévo-thyroxine).
Si vous devez subir une anesthésie générale pour une intervention chirurgicale ou dentaire, informez-en votre médecin ou votre pharmacien.
· Si vous êtes enceinte ou que vous allaitez, si vous pensez être enceinte ou planifiez une grossesse, demandez conseil à votre médecin ou à votre pharmacien avant d'utiliser ce médicament.
· N'utilisez GIBITER EASYHALER qu'après avis de votre médecin.
· Si vous devenez enceinte pendant votre traitement par GIBITER EASYHALER, n'arrêtez pas d'utiliser GIBITER EASYHALER mais contactez votre médecin qui déterminera le traitement le mieux adapté à votre cas.
Conduite de véhicules et utilisation de machines
GIBITER EASYHALER n'a aucun effet ou qu’un effet négligeable sur l'aptitude à conduire des véhicules ou à utiliser des machines.
GIBITER EASYHALER 320 microgrammes/9 microgrammes/dose, poudre pour inhalation contient du lactose:
Le lactose est un type de sucre. Si votre médecin vous a informé que vous présentiez une intolérance à certains sucres, contactez-le avant de prendre ce médicament. La quantité de lactose contenue dans ce médicament ne pose normalement pas de problèmes aux personnes qui sont intolérantes au lactose.
Le lactose peut contenir des protéines de lait qui peuvent déclencher des réactions allergiques chez les personnes allergiques aux protéines de lait. Si vous êtes allergiques aux protéines de lait, n'utilisez pas ce médicament. Contactez votre médecin.
3. COMMENT UTILISER GIBITER EASYHALER 320 microgrammes/9 microgrammes/dose, poudre pour inhalation ?
· Il est important d'utiliser GIBITER EASYHALER tous les jours, même lorsque vous n'avez pas de symptômes respiratoires.
· Votre médecin vérifiera régulièrement comment vos symptômes respiratoires évoluent.
Si vous prenez des corticoïdes sous forme de comprimés pour traiter votre asthme ou votre BPCO, votre médecin peut décider d'en réduire progressivement le nombre lorsque vous commencerez votre traitement avec GIBITER EASYHALER. Si vous prenez des corticoïdes en comprimés depuis longtemps, votre médecin pourra vous demander de faire des analyses de sang périodiquement s'il juge qu'il est nécessaire de faire une surveillance particulière. Lors de la réduction du nombre de comprimés de corticoïdes, vous pourrez ressentir une sensation de malaise général, alors même que vos symptômes respiratoires s'améliorent. Les symptômes suivants peuvent se manifester : sensation de nez bouché ou écoulement nasal, faiblesse ou douleur musculaire ou articulaire, éruption cutanée (exemple: eczéma). Si vous êtes gêné(e) par l’un ou l’autre de ces symptômes ou en cas d’apparition de symptômes tels que maux de tête, fatigue, nausées ou vomissements, contactez immédiatement votre médecin. Si des symptômes d'allergie ou d'arthrite apparaissent, un autre médicament peut s'avérer nécessaire pour traiter ces symptômes. N'arrêtez pas votre traitement sans demander l'avis de votre médecin.
Votre médecin pourra envisager d’ajouter des corticoïdes en comprimés à votre traitement habituel au cours des périodes de stress (par exemple, en cas d'infection respiratoire ou avant une intervention chirurgicale).
Informations importantes sur vos symptômes d'asthme ou de BPCO
Si vous êtes plus essoufflé que d'habitude ou vous ressentez un sifflement respiratoire malgré votre traitement en cours, vous devez continuer à prendre votre traitement par GIBITER EASYHALER mais il est nécessaire que vous consultiez votre médecin le plus rapidement possible, il se peut que vous ayez besoin d’un traitement supplémentaire.
Contactez rapidement votre médecin si :
· votre respiration se détériore ou si vous vous réveillez plus fréquemment la nuit à cause de l'asthme.
· vous ressentez une oppression dans la poitrine le matin ou si cette oppression persiste plus longtemps que d'habitude.
Ces signes peuvent indiquer que votre asthme ou votre BPCO n'est pas bien contrôlé et vous avez peut-être besoin d'un traitement différent ou d'un traitement supplémentaire rapidement.
ASTHME
Utilisez GIBITER EASYHALER tous les jours. Cela aide à prévenir les symptômes d'asthme.
Adultes (18 ans et plus)
· La dose usuelle est de 1 inhalation deux fois par jour (matin et soir).
Votre médecin peut augmenter cette dose jusqu'à 2 inhalations deux fois par jour (matin et soir).
Lorsque vos symptômes ont régressé et que votre asthme est contrôlé, votre médecin peut vous prescrire ce médicament en une seule prise par jour.
Adolescents (12 à 17 ans)
· La dose usuelle est de 1 inhalation deux fois par jour.
· Lorsque les symptômes d'asthme ont régressé et que votre asthme est contrôlé, votre médecin peut vous prescrire ce médicament en une seule prise par jour.
Un dosage plus faible de GIBITER EASYHALER est disponible pour les enfants de 6 à 11 ans. Gibiter Easyhaler n’est pas recommandé chez les enfants de moins de 6 ans.
Votre médecin adaptera votre traitement afin de déterminer la dose la plus faible de ce médicament qui permet le bon contrôle de vos symptômes d'asthme. Ne cherchez pas à adapter vous-même votre traitement sans en parler à votre médecin auparavant.
L'autre médicament (bronchodilatateur) qui vous sera prescrit sera utilisé au moment de la survenue des symptômes d’asthme pour les soulager. Vous devez toujours avoir sur vous ce médicament "de secours" pour pouvoir l’utiliser en cas de besoin au moment où surviennent les symptômes d’asthme. C’est cet inhalateur, et non GIBITER EASYHALER, qu’il convient d’utiliser en cas de besoin pour traiter les symptômes qui surviennent.
BRONCHOPNEUMOPATHIE CHRONIQUE OBSTRUCTIVE (BPCO)
· Cette indication est réservée à l'adulte (à partir de 18 ans).
· La dose habituelle est de 1 inhalation deux fois par jour (matin et soir).
Votre médecin pourra également vous prescrire d'autres médicaments bronchodilatateurs, par exemple des anticholinergiques (comme le tiotropium ou le bromure d'ipratropium) pour votre BPCO.
Si vous avez utilisé plus de GIBITER EASYHALER 320 microgrammes/9 microgrammes/dose, poudre pour inhalation que vous n’auriez dû
Il est important que vous preniez votre dose en suivant les indications de votre médecin. Ne dépassez pas la dose prescrite sans consulter un médecin.
Les symptômes les plus fréquents pouvant apparaitre si vous utilisez plus de GIBITER EASYHALER 320 microgrammes/9 microgrammes/dose, poudre pour inhalation que vous n'auriez dû sont : tremblements, maux de tête et battements cardiaques trop rapides.
Si vous oubliez d’utiliser GIBITER EASYHALER 320 microgrammes/9 microgrammes/dose, poudre pour inhalation
· Si vous avez oublié de prendre une dose, prenez-la dès que vous vous en souvenez sauf si le moment prévu de la prochaine dose est proche.
· Ne prenez pas de dose double pour compenser la dose que vous avez oubliée de prendre.
Si vous avez d'autres questions sur l’utilisation de ce médicament, demandez plus d'informations à votre médecin ou à votre pharmacien.
Les instructions d'utilisation de l'inhalateur se trouvent à la fin de la notice.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
Si les symptômes décrits ci-dessous apparaissent, arrêtez d'utiliser GIBITER EASYHALER et contactez immédiatement votre médecin :
· gonflement du visage, en particulier autour de la bouche (langue et/ou gorge et/ou difficulté à avaler), urticaire accompagné de difficultés à respirer (angiœdème) et/ou malaise brutal. Ceci peut indiquer que vous avez une réaction allergique. Cela ne se produit que rarement, survenant chez moins de 1 personne sur 1 000.
· sifflement respiratoire ou essoufflement apparaissant immédiatement après l'utilisation de l'inhalateur. Dans ce cas, ne pas renouveler l'inhalation de GIBITER EASYHALER et utilisez le médicament « de secours » qui vous a été prescrit pour traiter les symptômes aigus. Contactez votre médecin immédiatement car il peut s'avérer nécessaire de modifier votre traitement de l'asthme. Cette situation ne se produit que très rarement, survenant chez moins de 1 personne sur 10 000.
Si les symptômes suivants apparaissent en cours de traitement par GIBITER EASYHALER, contactez votre médecin, car il peut s'agir de symptômes d'une infection des poumons :
· fièvre ou frissons,
· augmentation ou changement de coloration des expectorations (crachats),
· augmentation de la toux ou des difficultés à respirer.
La pneumonie (infection des poumons) est un effet secondaire fréquent chez les patients atteints de BPCO (peut toucher jusqu'à 1 personne sur 10).
Autres effets indésirables possibles :
Fréquent (peut toucher jusqu'à 1 personne sur 10)
· Palpitations (perception anormale des battements du cœur), tremblements. Si ces effets se produisent, ils sont habituellement légers et ils disparaissent le plus souvent lorsque l'on continue à utiliser GIBITER EASYHALER.
· Muguet dans la bouche (myccose buccale). Le risque de survenue de cet effet peut être diminué en vous rinçant la bouche avec de l'eau, et en la recrachant, après avoir utilisé GIBITER EASYHALER.
· Léger mal de gorge, toux et voix enrouée.
· Mal de tête.
Peu fréquent (peut toucher jusqu'à 1 personne sur 100)
· Agitation, nervosité.
· Problèmes de sommeil.
· Vertiges.
· Nausées.
· Battements trop rapides du cœur.
· Ecchymoses (« bleus »).
· Crampes musculaires.
· Vision floue.
Rare (peut toucher jusqu'à 1 personne sur 1 000)
· Éruption cutanée, démangeaison.
· Bronchospasme (contraction des muscles des voies respiratoires entraînant le rétrécissement du calibre des bronches et un sifflement respiratoire). Si le sifflement respiratoire apparaît soudainement après administration de GIBITER EASYHALER, arrêtez d'utiliser GIBITER EASYHALER et contactez immédiatement votre médecin.
· Faibles taux de potassium dans le sang.
· Battements irréguliers du cœur.
Très rare (peut toucher jusqu'à 1 personne sur 10 000)
· Dépression.
· Modification du comportement, en particulier chez l'enfant.
· Angine de poitrine (douleur ou sensation d'oppression dans la poitrine).
· Augmentation de la quantité de sucre (glucose) dans le sang.
· Modifications de la perception du goût, par exemple goût désagréable dans la bouche.
· Modifications de la pression artérielle.
· Les corticoïdes inhalés peuvent perturber le fonctionnement de vos glandes surrénales et la quantité d'hormones stéroïdes qu'elles produisent dans votre corps, en particulier si vous utilisez des doses élevées de GIBITER EASYHALER pendant longtemps.
· Les effets d'un traitement au long cours avec les corticoïdes incluent :
o modifications de la densité minérale osseuse (fragilisation des os)
o cataracte (opacification du cristallin de l’œil)
o glaucome (augmentation de la pression dans l’œil)
o ralentissement de la croissance chez l'enfant et l'adolescent
o effet sur les glandes surrénales (petites glandes qui se situent juste au-dessus des reins).
Ces effets sont néanmoins moins fréquents avec les corticoïdes inhalés qu'avec les corticoïdes en comprimés.
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet: https://signalement.social-sante.gouv.fr
En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.
5. COMMENT CONSERVER GIBITER EASYHALER 320 microgrammes/9 microgrammes/dose, poudre pour inhalation ?
Tenir ce médicament hors de la vue et de la portée des enfants.
N’utilisez pas ce médicament après la date de péremption indiquée sur la boîte, le sachet plastifié, et l’étiquette de l’inhalateur après EXP. La date de péremption fait référence au dernier jour de ce mois.
Après ouverture du sachet plastifié, à conserver à une température ne dépassant pas 25 °C et à l’abri de l'humidité. Vous pouvez utiliser un couvercle de protection avec votre Easyhaler.
Si GIBITER EASYHALER est mouillé, remplacez-le par un nouvel inhalateur.
GIBITER EASYHALER peut être utilisé jusqu’à 4 mois après ouverture du sachet plastifié. Notez la date d'ouverture du sachet pour ne pas l'oublier. ![]()
Ne jetez aucun médicament au tout-à-l’égout ou avec les ordures ménagères. Demandez à votre pharmacien d’éliminer les médicaments que vous n’utilisez plus. Ces mesures contribueront à protéger l’environnement.
6. CONTENU DE L’EMBALLAGE ET AUTRES INFORMATIONS
Ce que contient GIBITER EASYHALER 320 microgrammes/9 microgrammes/dose, poudre pour inhalation
· Les substances actives sont :
Le budésonide et le fumarate de formotérol dihydraté. Chaque dose inhalée contient 320 microgrammes de budésonide et 9 microgrammes de fumarate de formotérol dihydraté.
· L’autre composant est : le lactose monohydraté (qui contient des protéines de lait).
Toutes les présentations peuvent ne pas être commercialisées.
Votre boîte peut contenir un couvercle de protection disponible selon le pays. Si vous avez besoin d'un couvercle de protection, veuillez contacter le titulaire de l'AMM (coordonnées ci-dessous).
Titulaire de l’autorisation de mise sur le marché
MENARINI INTERNATIONAL OPERATIONS LUXEMBOURG S.A.
1 AVENUE DE LA GARE
1611 LUXEMBOURG
LUXEMBOURG
Exploitant de l’autorisation de mise sur le marché
MENARINI FRANCE
1/7 rue du Jura
94633 RUNGIS Cedex
ORION PHARMA
ORIONINTIE 1
FI-02200 ESPOO
FINLANDE
Noms du médicament dans les Etats membres de l'Espace Economique Européen
[À compléter ultérieurement par le titulaire]
La dernière date à laquelle cette notice a été révisée est :
[à compléter ultérieurement par le titulaire]
Des informations détaillées sur ce médicament sont disponibles sur le site Internet de l’ANSM (France).
Des informations détaillées et réactualisées sur comment utiliser ce médicament sont disponibles en scannant ce code QR (également inclus sur l'emballage extérieur et l'étiquette de l'inhalateur) avec un smartphone.
Les mêmes informations sont également disponibles sur l'URL suivante: www.https://meneh.eu/video/gifr.mp4
Code QR vers www.https://meneh.eu/video/gifr.mp4
Comment utiliser l'inhalateur Easyhaler
À propos de votre Easyhaler
GIBITER EASYHALER peut être différent des inhalateurs que vous avez pu utiliser dans le passé. Il est donc très important que vous l'utilisiez correctement car une utilisation incorrecte peut vous empêcher de recevoir la bonne quantité de médicament. Cela pourrait vous rendre très malade ou empêcher votre asthme et BPCO d'être traité comme il se doit.
Votre médecin, infirmière ou pharmacien vous montrera comment utiliser correctement votre inhalateur. Assurez-vous de comprendre la manière correcte d'utiliser l'inhalateur. En cas de doute, contactez votre médecin, votre infirmière ou votre pharmacien. Comme pour tous les inhalateurs, le personnel soignant doit s'assurer que les enfants auxquels GIBITER EASYHALER est prescrit utilisent la bonne technique d'inhalation, comme décrite ci-dessous. Vous pouvez également utiliser la vidéo d'instructions sur www.https://meneh.eu/video/gifr.mp4
Lorsque vous recevez votre Easyhaler pour la première fois
|
L'Easyhaler est livré dans un sachet plastifié. N'ouvrez pas le sachet plastifié tant que vous n'êtes pas prêt à commencer à utiliser le médicament car cela aide à garder la poudre sèche dans l'inhalateur.
Lorsque vous êtes prêt à commencer le traitement, ouvrez le sachet et notez la date, par exemple dans votre agenda.
Utilisez l'inhalateur dans les 4 mois suivant son retrait du sachet plastifié. |
|
COMMENT UTILISER CORRECTEMENT LE DISPOSITIF
|
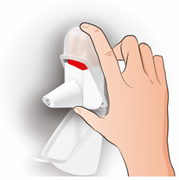
Étape 1: AGITER
Retirez le capuchon anti-poussière Agitez l'inhalateur 3 à 5 fois en le maintenant en position verticale |
AGITER x 3-5
|
Points importants à retenir
Il est important de garder l'inhalateur en position verticale Si vous cliquez accidentellement pendant que vous secouez l'inhalateur, videz la poudre de l'embout buccal comme indiqué ci-dessous |
|
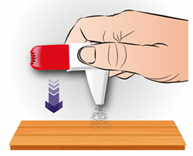
Étape 2: CLIQUER
Maintenez l'inhalateur à la verticale entre votre index et votre pouce Pressez jusqu'à ce que vous entendiez un clic et relâcher l’inhalateur jusqu’à ce que vous entendiez de nouveau un clic. Cela libère une dose Pressez une seule fois vers le bas
|
CLIQUER x 1
|
Points importants à retenir
L'inhalateur ne cliquera pas si le capuchon anti-poussière est toujours en place Ne pressez qu’une seule fois vers le bas Si vous pressez accidentellement plusieurs fois, videz la poudre de l'embout buccal, voir ci-dessous Pressez pour libérer la dose avant d'inhaler, pas en même temps Gardez l'inhalateur à la verticale lorsque vous pressez dessus et lorsque vous inhalez la dose. Si vous l'inclinez, la poudre pourrait tomber avant que vous ne puissiez l'inhaler
|
|
Étape 3: INHALER
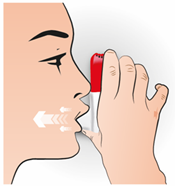
Continuez à tenir l'inhalateur à la verticale Expirez normalement Placez l'embout buccal dans votre bouche entre vos dents et fermez bien vos lèvres autour de l'embout buccal Prenez une inspiration forte et profonde Retirez l'inhalateur de votre bouche, puis expirez normalement.
|
INHALER
|
Points importants à retenir
Assurez-vous que tout l'embout buccal est bien à l'intérieur de votre bouche pour que le médicament pénètre dans vos poumons Assurez-vous que vos lèvres forment une bonne étanchéité autour de l'embout buccal N'expirez pas dans l'inhalateur. Ceci est important: cela pourrait obstruer l'inhalateur. Si vous avez expiré dans l'inhalateur, videz la poudre de l'embout buccal, voir ci-dessous
|
Si vous devez prendre une autre inhalation, veuillez répéter les étapes 1 à 3 Agiter-Cliquer-Inhaler.
Après avoir utilisé l'inhalateur:
· Remettez le capuchon anti-poussière sur l'embout buccal. Il empêche l'inhalateur de de déclencher accidentellement.
· Après avoir pris la dose, rincez-vous la bouche avec de l'eau et recrachez-la.
|
Comment vider la poudre de l'embout buccal Si vous avez pressé accidentellement l'inhalateur, ou si vous avez pressé plus d'une fois, ou si vous avez expiré dedans, videz l'embout buccal. Tapotez l'embout buccal pour vider la poudre sur une table ou dans la paume de votre main. Puis recommencez avec les étapes Agiter-Cliquer-Inhaler. |
|
Nettoyage de l'Easyhaler
Gardez votre inhalateur sec et propre. Si nécessaire, vous pouvez essuyer l'embout buccal de votre inhalateur avec un chiffon sec ou un mouchoir en papier. N'utilisez pas d'eau: la poudre de l'Easyhaler est sensible à l'humidité.
|
Utilisation de l'Easyhaler avec un couvercle de protection Vous pouvez utiliser un couvercle de protection avec votre inhalateur. Cela contribue à améliorer la longévité du produit. Lorsque vous insérez votre inhalateur pour la première fois dans le couvercle de protection, assurez-vous que le capuchon anti-poussière est sur l'inhalateur, car cela l'empêche de se déclencher accidentellement. Vous pouvez utiliser l'inhalateur sans le retirer du couvercle de protection.
Suivez les mêmes instructions que ci-dessus, 1. Agiter - 2. Cliquer - 3. Inhaler. Se souvenir de: Garder l'inhalateur en position verticale lorsque vous pressez dessus Remettre le capuchon anti-poussière après avoir pris la dose, car cela empêche l'inhalateur de se déclencher accidentellement. |
|
|
Quand passer à un nouvel Easyhaler Le compteur de doses indique le nombre de doses restantes. Le compteur tourne tous les 5 clics. Lorsque le compteur de doses commence à devenir rouge, il reste 20 doses. Si vous n'avez pas encore de nouvel Easyhaler, contactez votre médecin pour une nouvelle prescription. Lorsque le compteur atteint 0 (zéro), vous devez remplacer l'Easyhaler. Si vous utilisez le couvercle de protection, vous pouvez la conserver et y insérer votre nouvel inhalateur. |
|
|
Rappellez-vous
1. Agiter - 2. Cliquer - 3. Inhaler Après avoir pris la dose, rincez-vous la bouche avec de l'eau et recrachez-la. Ne mouillez pas votre inhalateur, protégez-le de l'humidité. |
Si vous avez d'autres questions sur l'utilisation de ce produit, interrogez votre médecin ou votre pharmacien.