Dernière mise à jour le 08/01/2026
IZINOVA, solution à diluer pour solution buvable
Indications thérapeutiques
Classe pharmacothérapeutique - code ATC : Laxatif osmotique.
IZINOVA est utilisé chez l’adulte pour nettoyer l’intestin avant un examen médical ou une intervention chirurgicale de l’intestin.
IZINOVA n'est pas un traitement de la constipation.
IZINOVA doit être dilué avant utilisation avec la quantité d'eau indiquée dans le mode d'administration (voir rubrique 3).
Présentations
> 2 flacon(s) polytéréphtalate (PET) de 176 ml avec fermeture de sécurité enfant avec gobelet(s) doseur(s) polypropylène
Code CIP : 269 952-4 ou 34009 269 952 4 9
Déclaration de commercialisation : 31/08/2015
Cette présentation est agréée aux collectivités
- Prix hors honoraire de dispensation : 8,20 €
- Honoraire de dispensation : 1,02 €
- Prix honoraire compris : 9,22 €
- Taux de remboursement :65%
Service médical rendu (SMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprès de la HAS (plus d'informations dans l'aide). Les avis et synthèses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur du SMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| Important | Avis du 05/11/2014 | Inscription (CT) | Le service médical rendu par IZINOVA est important dans l’indication de l’AMM. |
Amélioration du service médical rendu (ASMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprés de la HAS (plus d'informations dans l'aide). Les avis et synthéses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur de l'ASMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| V (Inexistant) | Avis du 05/11/2014 | Inscription (CT) | IZINOVA n’apporte pas d’amélioration du service médical rendu (ASMR V, inexistante) dans le lavage colique, par rapport aux préparations coliques de référence à base de PEG. |
ANSM - Mis à jour le : 21/08/2025
IZINOVA, solution à diluer pour solution buvable
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Ce médicament est une solution saline concentrée à base de sulfates, qui doit être diluée dans de l'eau avant administration (voir rubrique 4.2). Un traitement comprend la prise de deux flacons. Le contenu de chacun des deux flacons est identique. Les quantités de substances actives contenues dans 1 et 2 deux flacons sont mentionnées ci-dessous :
|
|
1 flacon contenant environ 176 ml de solution à diluer (195.375 g) |
2 flacons correspondant à environ 2 x 176 ml de solution à diluer (390.750 g) |
|
Sulfate de sodium anhydre |
17,510 g |
35,020 g |
|
Sulfate de magnésium heptahydraté |
3,276 g |
6,552 g |
|
Sulfate de potassium |
3,130 g |
6,260 g |
La teneur totale en électrolytes est la suivante :
|
|
Contenu en g |
Contenu en mmol |
||
|
|
1 flacon |
2 flacons |
1 flacon |
2 flacons |
|
Sodium* |
5,684 |
11,367 |
247,1 |
494,2 |
|
Potassium |
1,405 |
2,81 |
35,9 |
71,8 |
|
Magnésium |
0,323 |
0,646 |
13,3 |
26,6 |
|
Sulfate |
14,845 |
29,69 |
154,5 |
309,0 |
* provenant du sulfate de sodium (substance active) et du benzoate de sodium (excipient).
Pour la liste complète des excipients, voir rubrique 6.1.
Solution à diluer pour solution buvable.
Solution limpide à légèrement trouble.
4.1. Indications thérapeutiques
IZINOVA n'est pas un traitement de la constipation.
4.2. Posologie et mode d'administration
Adulte
Deux flacons d’IZINOVA sont nécessaires pour effectuer un lavage colique correct. Avant administration, le contenu de chaque flacon doit être dilué dans de l'eau, à l'aide du godet fourni, pour obtenir un volume total d'environ 0,5 litres. Pour chaque flacon, la prise doit être accompagnée, au cours des 2 heures suivantes, par l’ingestion supplémentaire de 1 litre d'eau ou de liquide clair.
Les liquides clairs autorisés sont : l'eau, le thé ou le café (pas de lait ou de crème), les sodas gazeux ou non, les jus de fruit sans pulpe (sauf ceux de couleur rouge ou violette), le bouillon ou la soupe moulinée pour éliminer les morceaux solides.
Avant l’intervention, l’ingestion d’un volume total de 3 litres de liquide est nécessaire pour réaliser le lavage colique. Il est possible d’administrer ce médicament soit en prise fractionnée (sur deux jours, avec le premier flacon à prendre la veille au soir de l'intervention, et le second à prendre le lendemain matin), soit en prise sur une journée, comme décrit ci-dessous (voir Mode d'administration). Les modalités exactes et le rythme d’administration d’IZINOVA seront déterminés par le médecin.
Si le délai avant l’intervention le permet, le schéma d’administration en prise fractionnée sur 2 jours doit être privilégié par rapport au schéma en prise sur une journée. Le schéma d’administration en prise sur une journée peut être une alternative potentiellement utile.
Mode d’administration
Schéma d’administration en prise fractionnée (sur deux jours)
La veille de l’intervention :
Au début de la soirée précédant l’intervention (par exemple vers 18 h), les instructions suivantes doivent être suivies :
· Le contenu d'un flacon d’IZINOVA doit être versé dans le godet fourni dans la boite et doit être dilué avec de l'eau jusqu'à la ligne de remplissage (environ 0,5 litre).
· Le patient doit boire cette solution diluée, puis, au cours des deux heures suivantes, boire deux godets supplémentaires, remplis jusqu’à la ligne de remplissage avec de l'eau ou un liquide clair (soit environ 1 litre).
Le jour de l’intervention :
Le matin de l’intervention (10 à 12 heures après la dose du soir), les instructions de la veille doivent être répétées :
· Le contenu du second flacon d’IZINOVA doit être versé dans le godet fourni dans la boite et doit être dilué avec de l'eau jusqu'à la ligne de remplissage (environ 0,5 litres).
· Le patient doit boire cette solution diluée, puis au cours des deux heures suivantes, boire deux godets supplémentaires, remplis jusqu’à la ligne de remplissage avec de l'eau ou un liquide clair (soit environ 1 litre).
La prise de la totalité de la solution diluée d’IZINOVA et du liquide supplémentaire (eau ou boisson claire) doit être terminée :
· En l’absence d’anesthésie : au moins 1 heure avant le début de l’intervention.
· En cas d’anesthésie : habituellement au moins 2 heures avant le début de l’intervention, en se référant aux instructions du médecin anesthésiste.
Schéma d’administration en prise sur une journée (schéma posologique alternatif, à utiliser en fonction des besoins cliniques du patient)
La veille de l’intervention :
Au début de la soirée précédant l’intervention (par exemple vers 18 h) :
· Le contenu d'un flacon d’IZINOVA doit être versé dans le godet fourni dans la boite et doit être dilué avec de l'eau jusqu'à la ligne de remplissage (environ 0,5 litre).
· Le patient doit boire cette solution diluée, puis boire au cours des deux heures suivantes, deux godets supplémentaires, remplis jusqu’à la ligne de remplissage avec de l'eau ou avec un liquide clair (soit environ 1 litre).
Environ 2 heures après le début de la première dose (par exemple vers 20 h):
· Le contenu du second flacon d’IZINOVA doit être versé dans le godet fourni dans la boite et être dilué avec de l'eau jusqu'à la ligne de remplissage (environ 0,5 litre).
· Le patient doit boire cette solution diluée, puis boire au cours des deux heures suivantes, deux godets supplémentaires, remplis jusqu’à la ligne de remplissage avec de l'eau ou avec un liquide clair (environ 1 litre).
La prise de la totalité de la solution diluée d’IZINOVA et du liquide supplémentaire (eau ou boisson claire) doit être terminée :
· En l’absence d’anesthésie : au moins 1 heure avant le début de l’intervention.
· En cas d’anesthésie : habituellement au moins 2 heures avant le début de l’intervention, en se référant aux instructions du médecin anesthésiste.
Après l’intervention
Afin de compenser les pertes liquidiennes survenues lors de la préparation de l’intervention, les patients doivent être incités à boire une quantité suffisante de liquide après l’intervention afin de maintenir un niveau d’hydratation suffisant.
Restrictions alimentaires
La veille de l'intervention, il est possible de prendre un petit déjeuner léger. Ensuite, le patient devra ingérer uniquement des liquides clairs au déjeuner, au dîner ou à tout autre repas, jusqu'à l’intervention. Les liquides rouges et violets, le lait et les boissons alcoolisées doivent être évités.
Populations particulières
Personnes âgées
Globalement, il n’a pas été observé de différence en terme de sécurité ou d'efficacité entre les patients âgés et les autres patients au cours du développement clinique d’IZINOVA (voir rubrique 5.1). Aucun ajustement posologique n'est nécessaire chez les sujets âgés. Cependant, des précautions particulières doivent être prises dans cette population, comme dans toute population à haut risque (voir rubrique 4.4).
Insuffisance rénale
Il n’existe pas de données suffisantes dans cette population. Aucun ajustement posologique n'est nécessaire chez les patients présentant une insuffisance rénale légère à modérée. Cependant, des précautions particulières doivent être prises dans cette population, comme dans toute population à haut risque. IZINOVA ne doit pas être utilisé en cas d’insuffisance rénale sévère (voir rubriques 4.3 et 4.4).
Insuffisance hépatique
Il n’existe pas de données suffisantes dans cette population. Aucun ajustement posologique n'est nécessaire chez les patients présentant une insuffisance hépatique. Cependant, des précautions particulières doivent être prises dans cette population, comme dans toute population à haut risque (voir rubrique 4.4).
Population pédiatrique
La sécurité et l'efficacité d’IZINOVA dans la population pédiatrique (de moins de 18 ans) n'ont pas encore été établies. Aucune donnée n'est disponible (voir rubrique 5.1).
IZINOVA est contre-indiqué dans les cas suivants :
· Hypersensibilité aux substances actives ou à l'un des excipients mentionnés à la rubrique 6.1.
· Insuffisance cardiaque congestive.
· Altérations graves de l’état général telles que déshydratation sévère.
· Phase aiguë sévère d’une maladie inflammatoire active de l’intestin (y compris maladie de Crohn, rectocolite hémorragique).
· Perforation gastro-intestinale connue ou suspectée.
· Colite toxique ou mégacôlon toxique
· Patients susceptibles de présenter ou ayant déjà un iléus
· Patients susceptibles de présenter ou ayant déjà une occlusion gastro-intestinale ou une sténose
· Troubles de la vidange gastrique (par exemple : gastroparésie, stase gastrique).
· Affections abdominales aiguës relevant de la chirurgie comme une appendicite aiguë
· Nausées et vomissements
· Ascite
· Insuffisance rénale sévère (débit de filtration glomérulaire < 30 ml/min/1,73m2).
4.4. Mises en garde spéciales et précautions d'emploi
Troubles électrolytiques et déshydratation :
· Compte tenu du risque potentiel de troubles électrolytiques graves, le rapport bénéfice / risque d’IZINOVA doit être soigneusement évalué avant l'initiation du traitement dans les populations à risque. Lors de la prescription d’IZINOVA chez tout patient, une attention particulière doit être accordée aux contre-indications connues et aux précautions d'emploi, notamment à l'importance d'une hydratation adaptée.
· Tous les patients doivent être informés sur la nécessité d’une hydratation suffisante avant, pendant et après la prise d’IZINOVA. Si un patient présente des vomissements importants ou des signes de déshydratation après avoir pris le médicament, des mesures de réhydratation doivent être mises en oeuvre afin d'éviter le risque potentiel de survenue de complications graves associées aux perturbations hydro-électrolytiques (telles que convulsion et arythmie cardiaque). En outre, la réalisation d’examens de laboratoire avant l’intervention (électrolytes, créatinine et urée sanguins) doit être envisagée. Le patient doit être informé de la nécessité de boire autant d'eau ou de liquides clairs que nécessaire pour maintenir un niveau adéquat d'hydratation.
· La déshydratation peut entraîner une insuffisance rénale fonctionnelle réversible avec l'administration de liquides appropriés.
Patients à risque :
· Chez les patients fragilisés, les sujets âgés, ceux présentant une insuffisance rénale, hépatique ou cardiaque significative et les sujets à risque de déséquilibre électrolytique, le médecin doit envisager de réaliser un bilan électrolytique et un bilan de la fonction rénale avant et après traitement.
· Avant toute administration de la préparation pour lavage colique, une déshydratation ou des anomalies électrolytiques doivent avoir été corrigées. En outre, la prudence s’impose chez les patients souffrant de pathologies ou prenant des médicaments qui augmentent le risque de déséquilibre hydro-électrolytique (dont hyponatrémie et hypokaliémie) ou qui peuvent augmenter le risque de complications potentielles. Dans ce cas, les patients doivent être surveillés de façon appropriée.
· Il existe un risque théorique d’allongement de l'intervalle QT, pouvant survenir secondairement à un déséquilibre électrolytique.
Utiliser avec prudence en cas de :
· Altération du réflexe pharyngé et chez les patients prédisposés aux régurgitations ou aux fausses routes. Ces patients doivent être placés sous surveillance au cours de l'administration de la préparation pour lavage colique.
· Hypomotilité gastro-intestinale ou antécédents de maladie ou de chirurgie gastro-intestinale qui prédisposent à une hypomotilité.
Hyperuricémie :
· IZINOVA peut provoquer une augmentation transitoire de l’acide urique, légère à modérée (voir rubrique 4.8). Le risque d'élévation de l’acide urique doit être pris en compte avant d'administrer IZINOVA chez les patients ayant des antécédents de manifestation goutteuse ou d’hyperuricémie (voir rubrique 4.8).
Colite ischémique :
· Les laxatifs osmotiques pourraient induire des ulcérations aphtoïdes de la muqueuse colique. Des cas graves de colite ischémique nécessitant une hospitalisation ont été rapportés. Par conséquent, ce diagnostic est à envisager en cas de douleurs abdominales qu’elles soient, ou non, accompagnées de rectorragies suite à l’administration d’IZINOVA.
Informations complémentaires :
· IZINOVA n'est pas destiné à être ingéré directement. L'ingestion directe de la solution non diluée peut augmenter le risque de nausée, de vomissements, de déshydratation et de troubles électrolytiques. Chaque flacon doit être dilué avec de l'eau et associé à une prise supplémentaire de liquide, conformément aux recommandations, pour en assurer la tolérance.
· Ce médicament contient du sodium. Ce médicament contient 247,1 mmol (ou 5,684 g) de sodium par flacon. A prendre en compte chez les patients soumis à un régime hyposodé strict.
· Ce médicament contient du potassium. Ce médicament contient 35,9 mmol (ou 1,405 g) de potassium par flacon. Cette quantité doit être prise en compte chez les patients insuffisants rénaux ou chez les patients suivant un régime hypokaliémiant.
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
Comme pour toute solution de lavage colique :
· Utiliser avec prudence chez les patients traités par inhibiteurs calciques, diurétiques, lithium, ou autres médicaments qui pourraient modifier les taux d'électrolytes.
· La prudence est requise en cas de prise de médicaments qui allongent l'intervalle QT.
· La diarrhée étant un effet attendu, les médicaments concomitants administrés par voie orale dans les 3 heures suivant le début du traitement et jusqu'à la fin du lavage colique peuvent être éliminés du tractus digestif sans être correctement absorbés. L'effet thérapeutique des médicaments régulièrement pris par voie orale et possédant un index thérapeutique étroit ou une demi-vie courte (par exemple, les contraceptifs oraux, les antiépileptiques, les antidiabétiques, les antibiotiques, la lévothyroxine, la digoxine, ...) peut être particulièrement affecté.
4.6. Fertilité, grossesse et allaitement
Grossesse
Aucune étude de reproduction chez l'animal n’a été conduite avec les sulfates de sodium, de magnésium et de potassium (voir rubrique 5.3).
Il n'existe aucune donnée concernant l'utilisation de ce produit chez la femme enceinte.
IZINOVA n'est pas recommandé pendant la grossesse.
Allaitement
Le passage d’IZINOVA dans le lait maternel n’est pas connu.
Un risque pour les nouveau-nés ou les nourrissons ne peut être exclu.
L'allaitement doit être interrompu au cours du traitement par IZINOVA, jusqu’à 48 heures après la seconde dose.
Fertilité
Aucune donnée concernant la fertilité n’est disponible.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
IZINOVA n'a pas d’influence sur l'aptitude à conduire ou à utiliser des machines.
Résumé du profil de sécurité
La diarrhée est le résultat attendu d’une préparation pour lavage colique et survient donc après la prise d’IZINOVA. Comme pour toute intervention de ce type, des effets indésirables surviennent chez la majorité des patients. Les effets indésirables fréquemment rapportés au cours des études cliniques et après commercialisation sont la gêne, la distension abdominale, les douleurs abdominales, les nausées et les vomissements.
Au cours des essais cliniques, les vomissements ont été rapportés par un plus grand nombre de patients lorsqu’IZINOVA était administré en prise sur une journée, comparativement à la prise fractionnée sur 2 jours.
Tableau récapitulatif des effets indésirables
La fréquence des effets indésirables d’IZINOVA est décrite comme suit :
Très fréquent (≥ 1/10), fréquent (≥ 1/100 à < 1/10), peu fréquent (≥ 1/1 000 à < 1/100), rare (≥ 1/10 000 à <1/1 000), très rare (<1/10 000), inconnu (ne peut être estimé à partir des données disponibles).
Le tableau ci-dessous présente les effets indésirables rapportés au cours des essais cliniques, et inclut des événements observés chez des patients isolés. Les événements indésirables rapportés après commercialisation sont également mentionnés.
|
Classe de système d’organe |
Fréquence |
Effets indésirables |
|
Affections du système immunitaire |
inconnu (données post-marketing) |
Hypersensibilité (incluant urticaire, prurit, éruption cutanée, érythème, dyspnée, sensation de gorge serrée) |
|
Troubles du métabolisme et de la nutrition |
inconnu (données post-marketing) |
Déshydratation |
|
inconnu (données post-marketing) |
Déséquilibre électrolytique |
|
|
Troubles psychiatriques |
inconnu (données post-marketing) |
Etat confusionnel* |
|
Affections du système nerveux |
Peu fréquent |
Céphalées, sensation vertigineuse |
|
inconnu (données post-marketing) |
Perte de conscience* |
|
|
inconnu (données post-marketing) |
Tremblement* |
|
|
Troubles cardiaques |
inconnu (données post-marketing) |
Arythmie cardiaque*, Palpitations* |
|
Affections gastro-intestinales |
Très fréquent |
distension abdominale, douleurs abdominales, nausées, vomissements |
|
Peu fréquent |
Inconfort anorectal, bouche sèche |
|
|
inconnu (données post-marketing) |
Colite ischémique |
|
|
Affections de la peau et du tissu sous-cutané |
inconnu (données post-marketing) |
Hyperhidrose* |
|
Affections musculosquelettiques et du tissu conjonctif |
inconnu (données post-marketing) |
Spasmes musculaires* |
|
Affections du rein et des voies urinaires |
Peu fréquent |
Dysurie |
|
Troubles généraux et anomalies au site d'administration |
Très fréquent |
Gêne |
|
Peu fréquent |
Frissons |
|
|
inconnu (données post-marketing) |
Asthénie* |
|
|
Investigations |
Peu fréquent |
Aspartate aminotransférase augmentée, créatine phosphokinase sanguine augmentée, lactate déshydrogénase sanguine augmentée, phosphore sanguin augmenté, hyperbilirubinémie, anomalies biochimiques comprenant hyponatrémie, hypokaliémie, hypocalcémie et hyperuricémie |
*Conséquences cliniques de la déshydratation et/ou du déséquilibre électrolytique.
Informations complémentaires dans les populations particulières
Des élévations transitoires de l'acide urique ont été observées au cours des essais cliniques. Pour les patients ayant des antécédents de manifestation goutteuse ou présentant une hyperuricémie, voir la rubrique 4.4.
Globalement, au cours du développement clinique d’IZINOVA, aucune différence en termes de sécurité d’emploi n'a été observée entre les patients âgés et les autres patients (voir rubrique 5.1). Cependant, des précautions particulières d'emploi doivent être prises chez les patients âgés, comme dans toute population à haut risque (voir rubrique 4.4).
Chez les patients présentant une insuffisance rénale ou hépatique, voir les rubriques 4.3 et 4.4.
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr/.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Classe pharmacothérapeutique : Laxatif osmotique.
Code ATC : A06AD10 (sels minéraux en association).
Mécanisme d'action
IZINOVA est un laxatif osmotique. Son mécanisme d'action repose principalement sur le processus de transport actif des sulfates, limité et saturable. La saturation du mécanisme de transport gastro-intestinal entraîne un maintien des sulfates dans l'intestin. L'effet osmotique des sulfates non absorbés provoque la rétention d'eau dans l'intestin et permet le lavage colique.
Effets pharmacodynamiques
Lorsqu'ils sont administrés avec un grand volume d'eau, l'effet osmotique des ions non-absorbés provoque une diarrhée aqueuse abondante. Dans les essais cliniques, le délai moyen de survenue d’une diarrhée claire était d'environ 6,3 heures lorsque les prises étaient espacées de 12 heures et d’environ 2,8 heures quand elles étaient espacées d’1 heure.
Efficacité clinique et sécurité
L'efficacité clinique d’IZINOVA a été démontrée dans deux études cliniques pivotales de phase III randomisées, contrôlées, multicentriques, en aveugle pour l'investigateur.
L'analyse du critère principal d'efficacité reposait sur le taux de succès ou d’échec du lavage colique, déterminé pour chaque sujet. Pour l'analyse statistique, un lavage colique jugé « bon » ou « excellent » était considéré comme un « succès », tandis qu’un lavage colique jugé « assez bon » ou « médiocre » était considéré comme un « échec ». Les patients n’ayant pas subi la coloscopie ont été considérés comme des échecs au traitement.
Les résultats de ces études comparant IZINOVA à une solution de 2 litres de polyéthylène glycol (PEG) associée à des électrolytes, respectivement administrés soit en prises fractionnées (379 patients randomisés, 356 patients dans la population per protocole (PP)) soit en prise sur une journée (408 patients randomisés, 364 patients dans la population PP), démontrent sur le critère principal d'évaluation la non-infériorité d’IZINOVA par rapport à la solution de 2 litres à base de PEG pour les deux schémas d’administration : la proportion de lavages coliques jugés « bon » ou « excellent » était similaire dans le groupe IZINOVA et dans le groupe traité par la solution de 2 litres à base de PEG (résultats en PP) :
- Pour le schéma en prises fractionnées : respectivement 97,2 % et 96,1 %, pour IZINOVA et pour la solution de 2 litres à base de PEG [IC95 % : -2,7 à 4,8 dans la borne prédéfinie de 15 %] ;
- Pour le schéma en prise sur une journée : respectivement 84% et 82,9 %, pour IZINOVA et pour la solution de 2 litres à base de PEG [IC95 % ; - 6,5 à 8,8 dans la borne prédéfinie de 15 %.
Les effets indésirables étaient principalement gastro-intestinaux, ce qui est attendu pour tout produit de lavage colique. Les symptômes les plus fréquemment rapportés étaient : distension abdominale, nausées, douleurs abdominales et vomissements.
Population pédiatrique
L'Agence européenne des médicaments a accordé une dérogation à l’obligation de soumettre les résultats d’études avec IZINOVA chez les nourrissons de la naissance à 6 mois, et a différé l'obligation de soumettre les résultats d'études dans le reste de la population pédiatrique, c’est à dire chez les enfants de 6 mois à 17 ans inclus (voir rubrique 4.2 les informations concernant l'usage pédiatrique).
5.2. Propriétés pharmacocinétiques
L'exposition systémique (ASC et Cmax) en sulfate après administration d’IZINOVA a également été comparée entre des volontaires sains, six patients présentant une insuffisance rénale modérée (clairance de la créatinine de 30 à 49 ml / min) et six patients présentant une insuffisance hépatique légère à modérée (classe de Child-Pugh A (n = 5) et B (n = 1)). L’insuffisance rénale a entraîné une diminution de la quantité de sulfate excrétée dans les urines. Par conséquent, les valeurs moyennes de l'ASC et de la Cmax étaient d’environ 50 % plus élevées que chez les sujets sains. L'exposition systémique au sulfate n'a pas été modifiée par l'insuffisance hépatique. Les concentrations sériques de sulfate sont revenues au niveau initial 6 jours après l’administration d’IZINOVA dans les trois groupes étudiés. Dans cette étude, l’administration d’IZINOVA n'a pas conduit à une hypersulfatémie cliniquement significative chez les patients présentant une insuffisance hépatique ou rénale.
5.3. Données de sécurité préclinique
Les données non cliniques limitées ne révèlent aucun risque particulier chez l'homme selon les études de toxicité à doses répétées.
Les sels de sulfate de sodium, de magnésium et de potassium sont peu susceptibles de représenter un risque pour l'environnement ; aucune mesure particulière de précaution ou de sécurité ne sont nécessaires pour le stockage et la manipulation des médicaments contenant ces substances. Pour les précautions particulières d'élimination, voir rubrique 6.6.
Acide citrique anhydre
Acide malique
Sucralose
Eau purifiée
Arôme cocktail de fruits.
Composition de l'arôme cocktail de fruits :
Arômes naturels et synthétiques, propylèneglycol (E1520), alcool éthylique, acide acétique et acide benzoïque (E210).
Après première ouverture du flacon et / ou dilution dans l'eau, la solution doit être utilisée immédiatement.
6.4. Précautions particulières de conservation
A conserver dans l’emballage d’origine à l’abri de la lumière.
Pour les conditions de conservation après première ouverture ou dilution du médicament, voir rubrique 6.3.
6.5. Nature et contenu de l'emballage extérieur
Un godet (polypropylène), comportant une ligne de remplissage qui définit un volume d'environ un demi-litre, est fourni avec les flacons. Ce godet doit être utilisé comme dispositif de dilution et d'administration.
Boîte de 2 flacons et un godet, 24 boîtes de 2 flacons et 1 godet, 6x24 (=144) boîtes de 2 flacons et 1 godet ou 14x24 (=336) boîtes de 2 flacons et 1 godet.
Toutes les présentations peuvent ne pas être commercialisées.
6.6. Précautions particulières d’élimination et de manipulation
Pas d'exigences particulières d'élimination.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
3 PLACE RENAULT
92500 RUEIL-MALMAISON
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
[à compléter par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE
[à compléter par le titulaire]
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Sans objet.
Liste I.
ANSM - Mis à jour le : 21/08/2025
IZINOVA, solution à diluer pour solution buvable
Sulfate de sodium anhydre, sulfate de magnésium heptahydraté, sulfate de potassium
· Gardez cette notice. Vous pourriez avoir besoin de la relire.
· Si vous avez d’autres questions, interrogez votre médecin ou votre pharmacien.
· Ce médicament vous a été personnellement prescrit. Ne le donnez pas à d’autres personnes. Il pourrait leur être nocif, même si les signes de leur maladie sont identiques aux vôtres.
· Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
1. Qu'est-ce que IZINOVA, solution à diluer pour solution buvable et dans quels cas est-il utilisé ?
2. Quelles sont les informations à connaître avant de prendre IZINOVA, solution à diluer pour solution buvable ?
3. Comment prendre IZINOVA, solution à diluer pour solution buvable ?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver IZINOVA, solution à diluer pour solution buvable ?
6. Contenu de l’emballage et autres informations.
1. QU’EST-CE QUE IZINOVA, solution à diluer pour solution buvable ET DANS QUELS CAS EST-IL UTILISE ?
Classe pharmacothérapeutique - code ATC : Laxatif osmotique.
IZINOVA est utilisé chez l’adulte pour nettoyer l’intestin avant un examen médical ou une intervention chirurgicale de l’intestin.
IZINOVA n'est pas un traitement de la constipation.
IZINOVA doit être dilué avant utilisation avec la quantité d'eau indiquée dans le mode d'administration (voir rubrique 3).
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT DE PRENDRE IZINOVA, solution à diluer pour solution buvable ?
Ne prenez jamais IZINOVA, solution à diluer pour solution buvable :
· Si vous êtes allergique au sulfate de sodium, au sulfate de magnésium ou au sulfate de potassium ou à l'un des autres composants contenus dans ce médicament (voir la liste à la rubrique 6).
· Vous avez des problèmes cardiaques graves (insuffisance cardiaque congestive).
· En cas d’altérations graves de votre état général telles que déshydratation sévère.
· Vous souffrez d'une maladie inflammatoire active de l’intestin en phase aiguë sévère (y compris maladie de Crohn, rectocolite hémorragique).
· Vous souffrez de l’un des problèmes suivants au niveau de l’estomac ou de l’intestin :
o Une perforation de la paroi de l'intestin connue ou suspectée.
o Une atteinte toxique du colon (colite toxique ou mégacôlon toxique).
o Une paralysie de l'intestin.
o Une occlusion de l'intestin ou une sténose.
o Un problème de vidange de l'estomac (comme la gastroparésie, stase gastrique).
o D’affections abdominales aiguës relevant de la chirurgie comme une appendicite aiguë
o De nausées et de vomissements.
· Vous avez une ascite.
· Vous avez un problème rénal grave (insuffisance rénale sévère).
Si vous n'êtes pas sûr, demandez l’avis de votre médecin avant de prendre IZINOVA.
Avertissements et précautions
· Vous êtes déshydraté (les symptômes peuvent comporter : sécheresse de la bouche, sensation de soif, maux de tête, étourdissements, urines moins abondantes que d'habitude, grande fatigue, palpitations cardiaques et confusion).
· Vous avez déjà eu un taux de sodium ou de potassium anormal dans le sang.
· Vous avez un problème cardiaque.
· IZINOVA peut modifier le rythme du cœur en raison de modifications de la concentration des sels dans le sang. Votre médecin pourra être amené à exercer une surveillance pendant le traitement.
· Vous avez des problèmes rénaux (insuffisance rénale).
· La déshydratation peut causer des problèmes rénaux (insuffisance rénale) réversibles avec un traitement approprié.
· Vous avez un problème au niveau du foie.
· Vous avec des problèmes d’"acide urique" (goutte ou autre problème)
· Vous avez un problème pour avaler.
· Vous avez du "reflux" (renvois acides), c’est-à-dire que de l'acide de votre estomac passe dans votre œsophage.
· Vous êtes physiquement affaibli ou dans un état de santé fragile.
· Vous souffrez d’une diminution des mouvements de tout ou partie de vos intestins (hypomotilité).
· Vous avez des antécédents médicaux ou avez subi une intervention chirurgicale gastro-intestinale qui prédisposent à une diminution de la motilité de l’intestin.
Si vous êtes fragilisé ou âgé (65 ans ou plus), si vous avez une maladie grave des reins, du foie ou des problèmes cardiaques ou si vous présentez des risques de modification du taux d’électrolytes (sels) dans votre corps (désordres électrolytiques), votre médecin peut décider de mettre en place une surveillance spécifique avant et après l’examen. Vous devez également être particulièrement attentif aux recommandations données dans cette rubrique de la notice ainsi que dans la rubrique « Utilisation d’autres médicaments et IZINOVA » et « Comment prendre IZINOVA ».
Si vous souffrez de vomissements importants ou si vous ressentez des symptômes de déshydratation après avoir pris ce médicament (par exemple, la bouche sèche, une sensation de soif), contactez votre médecin qui mettra en œuvre des mesures de réhydratation.
En cas de douleurs abdominales sévères ou persistantes, et/ou des saignements de l’anus suite à l’administration d’IZINOVA, parlez-en à votre médecin. En effet, IZINOVA a été associé à de rares cas d’inflammation intestinale (colite).
Si l'un des cas ci-dessus s’applique à vous (ou si vous n'êtes pas sûr), parlez-en à votre médecin avant de prendre IZINOVA.
Après la prise du médicament, vous aurez des selles fréquentes et liquides. Cela est normal et indique que le médicament agit. Assurez-vous de rester à proximité des toilettes jusqu'à ce que l'effet du médicament ait disparu.
Il est impératif de suivre exactement les instructions d'utilisation d’IZINOVA et boire autant d'eau ou de liquide clair qu’indiqué pour éviter de vous déshydrater.
Enfants
IZINOVA ne doit pas être utilisé chez les patients de moins de 18 ans. Sa tolérance et son efficacité n'ont pas encore été établies dans cette population.
Autres médicaments et IZINOVA, solution à diluer pour solution buvable
Utilisation d'autres médicaments et IZINOVA
Informez votre médecin ou pharmacien si vous prenez, avez récemment pris ou pourriez prendre tout autre médicament, y compris si cela concerne des médicaments obtenus sans ordonnance ou des médicaments à base de plantes.
Si vous devez prendre d'autres médicaments, prenez- les 1 à 3 heures avant de prendre IZINOVA ou au moins 1 heure après la fin de la procédure de lavage colique. En raison de la diarrhée provoquée par IZINOVA, les médicaments peuvent être éliminés de l’organisme sans agir comme prévu.
Il faut faire particulièrement attention avec :
· Les médicaments qui peuvent modifier les quantités de liquide ou d’électrolytes (sels) dans le sang (comme les diurétiques, les inhibiteurs calciques ou le lithium) ou les médicaments qui modifient le rythme du cœur.
· Les médicaments pris habituellement par voie orale : par exemple, les contraceptifs oraux, les médicaments contre l'épilepsie, le diabète ou les antibiotiques, la lévothyroxine (hormone destinée à traiter une diminution du fonctionnement de la glande thyroïde), ou la digoxine (utilisée pour les problèmes cardiaques). IZINOVA peut retarder ou empêcher complètement l'absorption de ces médicaments par voie orale, ce qui les rend moins efficaces ou inefficaces.
IZINOVA, solution à diluer pour solution buvable avec des aliments et des boissons
Sans objet.
Grossesse et allaitement
· Si vous êtes enceinte ou si vous allaitez, si vous pensez que vous pourriez être enceinte ou si vous envisagez de l’être, demandez conseil à votre médecin ou à votre pharmacien avant de prendre ce médicament.
· Si vous allaitez, vous devez interrompre l’allaitement, et cela pendant les 48 heures qui suivent la prise de la seconde dose d’IZINOVA.
Conduite de véhicules et utilisation de machines
Izinova n'est pas susceptible d'affecter votre capacité à conduire ou à utiliser des outils ou des machines.
IZINOVA, solution à diluer pour solution buvable contient du sodium et du potassium.
Si vous êtes soumis à un régime pauvre en sel (de sodium ou de potassium), notez que chaque flacon d’IZINOVA contient 5,684 g (247,1 mmol) de sodium et 1,405 g (35,9 mmol) de potassium.
3. COMMENT PRENDRE IZINOVA, solution à diluer pour solution buvable ?
Prise de ce médicament
· Prenez ce médicament par voie orale.
· La veille de l’intervention, vous pouvez prendre un petit déjeuner léger. Après le petit déjeuner, vous devrez absorber uniquement des liquides clairs pour le déjeuner, le dîner ou tout autre repas jusqu'à la fin de l’intervention. Ne buvez pas de liquides rouges ou violet, de lait ou de boissons alcoolisées.
· IZINOVA se présente sous forme de 2 flacons emballés dans une boîte contenant un godet, qui doit être utilisé pour diluer et boire le médicament. Vous avez besoin de tout cela pour votre traitement.
· Ne buvez pas le contenu des deux flacons en même temps.
· Ne buvez pas le contenu des flacons avant de les avoir dilués.
· N’oubliez pas de boire la quantité supplémentaire d'eau ou de liquide clair autorisé.
· Votre médecin vous donnera un formulaire pour noter l’heure de début de votre traitement et la quantité de liquide que vous avez bue au cours de la préparation pour lavage colique.
Vous devez suivre les instructions à la lettre et boire autant d'eau ou de liquide clair que nécessaire pour éviter de vous déshydrater.
· Les « liquides clairs » sont l'eau, le thé ou le café (pas de lait ni de crème), les sodas pétillants ou non, les jus de fruit sans pulpe (sauf ceux de couleur rouge ou violette), le bouillon ou la soupe moulinée pour éliminer les morceaux solides.
Ne buvez pas de boissons alcoolisées.
Comment et quand prendre ce médicament
IZINOVA peut être pris selon un protocole d’administration en « deux jours » ou selon un protocole d’administration en « un jour ». Votre médecin décidera quel protocole d’administration vous devrez utiliser et à quel moment vous devrez effectuer les prises.
· En l’absence d’anesthésie : Vous devez arrêter de boire tout liquide au moins 1 heure avant le début de l’intervention.
· En cas d’anesthésie : Vous devez arrêter de boire tout liquide habituellement au moins 2 heures avant le début de l’intervention, en vous référant aux instructions du médecin-anesthésiste.
Protocole d’administration « en deux jours »
Les prises sont réparties entre le soir précédant l'intervention et le matin du jour de l'intervention.
La veille de l'intervention :
· Commencez la première partie du protocole d’administration (premier flacon) en début de soirée (c'est à dire au plus tard vers 18 heures).
Le jour de l'intervention :
· Commencez la deuxième partie du protocole d’administration (deuxième flacon) tôt le matin, 10 à 12 heures après le début de la première partie du protocole d’administration (premier flacon).
§ Protocole d’administration « en un jour »
Les prises sont débutées et terminées la veille de l’intervention.
La veille de l'intervention :
· Commencez la première partie du protocole d’administration (premier flacon) en début de soirée (c'est à dire au plus tard vers 18 heures).
· Commencez la deuxième partie du protocole d’administration (deuxième flacon) environ 2 heures après le début de la première partie du protocole d’administration (premier flacon).
Quel que soit le protocole d’administration choisi par votre médecin, les étapes suivantes doivent être respectées, aussi bien pour la première partie que pour et la deuxième partie du protocole :
|
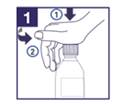
1) Ouvrez la bouteille en appuyant sur le bouchon de sécurité et en tournant dans le sens contraire des aiguilles d’une montre. |
|
|
|
|
|
|
|
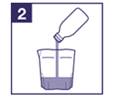
2) Versez le contenu d’un flacon d’IZINOVA dans le godet. |
|
|
|
|
|
|
|
3) Ajoutez de l'eau au médicament jusqu'à ce que le niveau de liquide atteigne la ligne figurant sur le godet. |
|
|
|
|
|
|
|
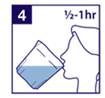
4) Prenez votre temps (sur une durée d’une demi-heure à une heure) pour boire tout le liquide contenu dans le godet. |
|
|
|
|
|
|
|
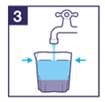
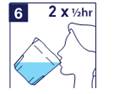
5) IMPORTANT : Buvez 2 autres godets remplis d'eau ou de liquide clair. A chaque fois, remplir le godet avec de l'eau ou du liquide clair jusqu’à la ligne. |
|
|
|
|
|
|
|
6) Prenez votre temps (sur une durée d’une demi-heure) pour boire tout le liquide contenu dans chaque godet. |
|
|
|
|
|
|
|
Les étapes 1 à 6 doivent prendre environ 2 heures et devront être répétées pour la deuxième partie du protocole d’administration. Quel que soit le protocole d’administration, vous devez arrêter de boire tout liquide : · En l’absence d’anesthésie, au moins 1 heure avant le début de l’intervention. · En cas d’anesthésie, habituellement au moins 2 heures avant le début de l’intervention, en vous référant aux instructions du médecin-anesthésiste. |
|
|
Si vous avez pris plus de IZINOVA, solution à diluer pour solution buvable que vous n’auriez dû :
Si vous pensez que vous avez pris trop d’IZINOVA, ou si vous ne l’avez pas dilué selon les instructions, ou si vous n’avez pas bu assez d'eau supplémentaire, parlez-en à votre médecin et buvez suffisamment d'eau ou de liquide clair pour éviter de vous déshydrater.
Si vous oubliez de prendre IZINOVA, solution à diluer pour solution buvable :
Si vous arrêtez de prendre IZINOVA, solution à diluer pour solution buvable :
Sans objet.
Si vous avez d’autres questions sur l’utilisation de ce médicament, demandez plus d’informations à votre médecin ou à votre pharmacien.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
Comme tous les médicaments, ce médicament peut provoquer des effets indésirables, mais ils ne surviennent pas systématiquement chez tout le monde.
Arrêtez de prendre IZINOVA et consultez immédiatement un médecin si vous remarquez l'un des effets suivants :
· Une réaction allergique - les signes peuvent inclure une éruption cutanée ou des rougeurs, des démangeaisons, des difficultés à respirer ou un gonflement de la gorge.
Les autres effets secondaires sont :
Très fréquents (pouvant toucher plus d'1 personne sur 10)
· Une gêne générale
· Une envie de vomir (nausées) ou des vomissements
· Des ballonnements ou des douleurs abdominales
Peu fréquents (pouvant toucher jusqu'à 1 personne sur 100)
· Des frissons
· Une bouche sèche
· Des maux de tête
· Une sensation de vertiges
· Des difficultés/ douleurs au moment d'uriner
· Un inconfort au niveau de l’anus ou du rectum
· Une modification du taux de certains composés dans votre sang, par exemple : une augmentation de l’aspartate aminotransférase, de la créatine phosphokinase, de la lactate déshydrogénase, du phosphore, de la bilirubine ou de l’acide urique et une diminution du sodium, du potassium ou du calcium.
Fréquence indéterminée (ne peut être estimée à partir des données disponibles) :
· Ulcères de l'intestin ou problèmes intestinaux (colite ischémique). Informez immédiatement votre médecin si vous ressentez des douleurs intenses dans la région de l'estomac (abdomen) ou avez des saignements rectaux.
· Déshydratation, modifications des sels sériques, fatigue, tremblements, transpiration, rythme cardiaque anormal ou irrégulier (arythmie), palpitations, perte de conscience (convulsions), confusion, crampes musculaires.
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr/
En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.
5. COMMENT CONSERVER IZINOVA, solution à diluer pour solution buvable ?
Tenir ce médicament hors de la vue et de la portée des enfants.
N’utilisez pas ce médicament après la date de péremption indiquée sur la boîte et sur le flacon après EXP.
La date de péremption fait référence au dernier jour de ce mois.
Ce médicament ne nécessite pas de précautions particulières de conservation concernant la température.
A conserver dans l’emballage d’origine à l’abri de la lumière.
Après première ouverture du flacon et /ou dilution avec de l'eau, la solution doit être utilisée immédiatement.
Ne jetez aucun médicament au tout-à-l’égout ou avec les ordures ménagères. Demandez à votre pharmacien d’éliminer les médicaments que vous n’utilisez plus. Ces mesures contribueront à protéger l’environnement.
6. CONTENU DE L’EMBALLAGE ET AUTRES INFORMATIONS
Ce que contient IZINOVA, solution à diluer pour solution buvable
· Les substances actives sont : le sulfate de sodium anhydre, le sulfate de magnésium heptahydraté et le sulfate de potassium.
Chaque flacon d'environ 176 ml de solution à diluer contient 17,510 g de sulfate de sodium anhydre, 3,276 g de sulfate de magnésium heptahydraté et 3,130 g de sulfate de potassium.
La teneur totale en électrolytes est la suivante :
|
|
Contenu en g |
Contenu en mmol |
||
|
|
1 flacon |
2 flacons |
1 flacon |
2 flacons |
|
Sodium* |
5,684 |
11,367 |
247,1 |
494,2 |
|
Potassium |
1,405 |
2,81 |
35,9 |
71,8 |
|
Magnésium |
0,323 |
0,646 |
13,3 |
26,6 |
|
Sulfate |
14,845 |
29,69 |
154,5 |
309,0 |
* provenant du sulfate de sodium (substance active) et du benzoate de sodium (excipient).
· Les autres composants sont :
Benzoate de sodium (E211), acide citrique anhydre, acide malique, sucralose, eau purifiée et arôme cocktail de fruits*.
*Composition de l’arôme cocktail de fruits : arômes naturels et synthétiques, propylène glycol (E1520), alcool éthylique, acide acétique et acide benzoïque (E210).
Qu’est-ce que IZINOVA, solution à diluer pour solution buvable et contenu de l’emballage extérieur
Ce médicament est une solution à diluer pour solution buvable, limpide ou légèrement trouble.
Ce médicament est disponible sous forme de 2 flacons de 176 ml environ conditionnés dans une boîte contenant un godet d’un volume d’un demi-litre environ, destiné à la dilution et à l’administration du médicament.
Présentations :
Boîte de 2 flacons et un godet.
24 boîtes de 2 flacons et un godet.
6x24 boîtes (=144) de 2 flacons et un godet.
14x24 boîtes (=336) de 2 flacons et un godet.
Toutes les présentations peuvent ne pas être commercialisées.
Titulaire de l’autorisation de mise sur le marché
3 PLACE RENAULT
92500 RUEIL-MALMAISON
Exploitant de l’autorisation de mise sur le marché
MAYOLY PHARMA FRANCE
3 PLACE RENAULT
92500 RUEIL-MALMAISON
20 Rue Ethé Virton
28100 Dreux
Noms du médicament dans les Etats membres de l'Espace Economique Européen
Ce médicament est autorisé dans les Etats membres de l'Espace Economique Européen sous les noms suivants : Conformément à la réglementation en vigueur.
[À compléter ultérieurement par le titulaire]
La dernière date à laquelle cette notice a été révisée est :
[À compléter ultérieurement par le titulaire]
Des informations détaillées sur ce médicament sont disponibles sur le site Internet de l’ANSM (France).