Dernière mise à jour le 02/02/2026
CONFIDEX 1000 UI, poudre et solvant pour solution injectable
Indications thérapeutiques
Qu’est-ce que CONFIDEX ?
CONFIDEX se présente sous forme d’une poudre et d’un solvant. Poudre blanche ou légèrement colorée, ou solide friable. La solution reconstituée est administrée par injection dans une veine.
CONFIDEX est obtenu à partir de plasma humain (qui est la partie liquide du sang) et contient les facteurs II, VII, IX et X humains de la coagulation. Les concentrés contenant ces facteurs de la coagulation sont appelés produits de complexe prothrombique. Les facteurs II, VII, IX et X de la coagulation dépendent de la vitamine K et sont importants pour la coagulation du sang. En l’absence de l’un de ces facteurs, le sang ne coagule pas aussi rapidement qu’il le devrait, et il existe ainsi une tendance accrue aux saignements. Le remplacement des facteurs II, VII, IX et X par CONFIDEX permet de rétablir les mécanismes de la coagulation.
Dans quel cas CONFIDEX est-il utilisé ?
CONFIDEX est administré pour la prévention (pendant une intervention chirurgicale) et le traitement des hémorragies dues à un déficit acquis ou congénital en l’un des facteurs II, VII, IX et X de la coagulation dépendant de la vitamine K et présents dans le sang, quand des formulations purifiées de facteurs spécifiques de la coagulation ne sont pas disponibles.
Composition en substances actives
-
Poudre ( Composition pour 1 ml de solution reconstituée )
- > facteur II de coagulation humain 20 - 48 UI
- > facteur VII de coagulation humain 10 - 25 UI
- > facteur IX de coagulation humain 20 - 31 UI
- > facteur X de coagulation humain 22 - 60 UI
- > protéine C humaine 15 - 45 UI
- > protéine S 12 - 38 UI
-
Solvant ( Composition )
- > Pas de substance active.
Présentations
> 1 flacon(s) en verre - 1 flacon(s) en verre de 40 ml avec dispositif(s) de transfert 20/20 muni d’un filtre
Code CIP : 585 161-3 ou 34009 585 161 3 9
Déclaration de commercialisation : 06/01/2014
Cette présentation est agréée aux collectivités
Service médical rendu (SMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprès de la HAS (plus d'informations dans l'aide). Les avis et synthèses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur du SMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| Important | Avis du 02/10/2013 | Inscription (CT) | Le service médical rendu par ce nouveau dosage de CONFIDEX est important dans les indications de l’AMM. |
Amélioration du service médical rendu (ASMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprés de la HAS (plus d'informations dans l'aide). Les avis et synthéses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur de l'ASMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| V (Inexistant) | Avis du 02/10/2013 | Inscription (CT) | Cette spécialité est un complément de gamme qui n’apporte pas d’amélioration du service médical rendu (ASMR V, inexistante) par rapport aux autres présentations déjà inscrites. |
Autres informations
- Titulaire de l'autorisation : CSL BEHRING GmbH
- Conditions de prescription et de délivrance :
- liste I
- prescription hospitalière
- Statut de l'autorisation : Valide
- Type de procédure : Procédure décentralisée
- Code CIS : 6 511 153 2
ANSM - Mis à jour le : 01/07/2025
CONFIDEX 1000 UI, poudre et solvant pour solution injectable
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
CONFIDEX se présente sous forme d’une poudre et d’un solvant pour solution injectable contenant du complexe prothrombique humain. Le produit contient nominalement les quantités suivantes (UI) de facteurs de coagulation humains :
|
Composants |
Après reconstitution (UI/ml) |
CONFIDEX 1000 UI quantité par flacon (UI) |
|
Substances actives |
|
|
|
Facteur II de coagulation humain |
20 – 48 |
800 – 1920 |
|
Facteur VII de coagulation humain |
10 – 25 |
400 – 1000 |
|
Facteur IX de coagulation humain |
20 – 31 |
800 – 1240 |
|
Facteur X de coagulation humain |
22 – 60 |
880 – 2400 |
|
Autres composants actifs |
|
|
|
Protéine C |
15 – 45 |
600 – 1800 |
|
Protéine S |
12 – 38 |
480 – 1520 |
La quantité totale de protéine par flacon est de 6 – 14 mg/ml de solution reconstituée.
L’activité spécifique du facteur IX est de 2,5 UI par mg de protéine totale.
Les activités de tous les facteurs de coagulation, ainsi que de la protéine C et S (antigènes) ont été déterminées conformément aux standards de l’OMS.
Excipient à effet notoire :
Sodium jusqu’à 343 mg (environ 15 mmol) par 100 ml de solution.
Pour la liste complète des excipients, voir rubrique 6.1.
Poudre et solvant pour solution injectable.
Poudre blanche ou légèrement colorée ou solide friable.
4.1. Indications thérapeutiques
· Traitement et prophylaxie péri-opératoire des hémorragies dans les cas de déficit congénital de l’un des facteurs de coagulation vitamine K dépendants, lorsque le facteur de coagulation spécifique purifié n’est pas disponible.
4.2. Posologie et mode d'administration
Les posologies recommandées ci-dessous sont données à titre indicatif. Le traitement doit être initié sous la surveillance d'un médecin spécialiste des troubles de la coagulation. La posologie et la durée du traitement de substitution dépendent de l’indication thérapeutique, de la sévérité du trouble, de la localisation et de l'étendue de l'accident hémorragique, ainsi que de l'état clinique du patient.
La dose et la fréquence d'administration doivent être calculées sur la base de chaque cas individuel. L'intervalle entre les administrations doit être adapté en fonction des demi-vies des différents facteurs de coagulation du complexe prothrombique (voir rubrique 5.2). La posologie individuelle nécessaire peut uniquement être déterminée sur la base des évaluations régulières des taux plasmatiques du facteur de coagulation à corriger ou sur la base d’un test global évaluant le taux de complexe prothrombique (temps de Quick, INR), et en fonction d’un suivi régulier de l’état clinique du patient.
Dans le cas d'interventions chirurgicales majeures, il est essentiel de réaliser un suivi précis du traitement de substitution à l'aide de tests de coagulation (tests spécifiques évaluant les facteurs de coagulation et/ou test global évaluant le taux de complexe prothrombique).
· Traitement et prophylaxie péri-opératoire des hémorragies lors d'un traitement par anti-vitamine K.
La dose dépendra de l’INR avant traitement et de l’INR cible. L’INR avant traitement doit être mesuré juste avant l’administration afin de calculer la dose appropriée de CONFIDEX. Le tableau suivant indique les doses approximatives (ml/kg de poids corporel de produit reconstitué et UI de FIX/kg de poids corporel) requises dans le cadre de la correction de l’INR (par ex. ≤ 1,3) pour des taux d’INR initiaux différents.
|
INR avant traitement |
2,0 – 3,9 |
4,0 – 6,0 |
> 6,0 |
|
Dose approximative en ml/kg de poids corporel |
1 |
1,4 |
2 |
|
Dose approximative de facteur IX en UI/kg de poids corporel |
25 |
35 |
50 |
La dose maximale unique dépend du poids corporel qui ne doit pas excéder 100 kg. Pour les patients, qui pèsent plus de 100 kg, la dose (en Unités Internationales de facteur IX) ne doit pas dépasser :
o 2500 UI quand l’INR avant traitement est situé dans l’intervalle 2,0 – 3,9
o 3500 UI quand l’INR avant traitement est situé dans l’intervalle 4,0 – 6,0
o 5000 UI quand l’INR avant traitement est supérieur à 6.
La correction des troubles de l’hémostase induits par l’anti-vitamine K est généralement obtenue approximativement 30 minutes après l'injection. L’administration simultanée de vitamine K doit être prise en compte chez les patients recevant CONFIDEX pour une correction rapide des antagonistes de la vitamine K, étant donné que les effets de celle-ci, sont habituellement obtenus en 4 à 6 heures.
Il n’y a pas de données cliniques sur l’administration répétée du CONFIDEX chez des patients nécessitant une correction rapide des antagonistes de la vitamine K. Par conséquent, celle-ci n’est pas recommandée.
Ces recommandations reposent sur les données d’études cliniques menées chez un nombre limité de sujets. La récupération et la durée de l’effet thérapeutique peuvent varier, en conséquence le suivi de l’INR est obligatoire au cours du traitement.
· Traitement et prophylaxie péri-opératoire des hémorragies dans les cas de déficit congénital en l’un des facteurs de coagulation vitamine K dépendants, lorsque le facteur de coagulation spécifique purifié n’est pas disponible.
Le calcul de la dose requise de concentré de complexe prothrombique repose sur des données issues d’études cliniques :
· 1 UI de facteur IX par kg de poids corporel est supposée augmenter l’activité facteur IX plasmatique de 1,3 % (0,013 UI/ml) par rapport à la normale
· 1 UI de facteur VII par kg de poids corporel augmente l’activité facteur VII plasmatique de 1,7 % (0,017 UI/ml) par rapport à la normale
· 1 UI de facteur II par kg de poids corporel augmente l’activité facteur II plasmatique de 1,9 % (0,019 UI/ml) par rapport à la normale
· 1 UI de facteur X par kg de poids corporel augmente l’activité facteur X plasmatique de 1,9 % (0,019 UI/ml) par rapport à la normale.
La posologie d'un facteur spécifique administré est exprimée en Unités Internationales (UI) par rapport au standard de l'OMS en vigueur pour chaque facteur. L'activité plasmatique d’un facteur de coagulation spécifique est exprimée soit en pourcentage (de l’activité normale du plasma humain), soit en Unités Internationales (par rapport à l’étalon international pour le facteur de coagulation spécifique).
Une Unité Internationale (UI) de l'activité d’un facteur de coagulation correspond à la quantité de ce facteur contenue dans un ml de plasma humain normal.
Par exemple, le calcul de la dose requise de facteur X repose sur des observations montrant qu’une unité internationale (UI) de facteur X par kg de poids corporel augmente l’activité du facteur X plasmatique de 0,019 UI/ml.
La posologie requise est déterminée en utilisant la formule suivante :
Nombre d'unités requises = poids corporel (kg) x augmentation de facteur X souhaitée (UI/ml) x 53 où 53 (ml/kg) correspond à l’inverse de la récupération estimée.
Le calcul est basé sur des données provenant de patients recevant des antagonistes de la vitamine K. Un calcul basé sur des données provenant de sujets sains donnerait une estimation plus faible de la dose requise.
Si la récupération individuelle est connue, cette valeur doit être utilisée pour le calcul.
Les données spécifiques sur le produit sont issues d’études cliniques chez des volontaires sains (N = 15), recevant des antagonistes de la vitamine K dans le traitement de saignement majeur aigu ou en prophylaxie péri-opératoire des saignements (N = 98, N = 43) (voir rubrique 5.2).
Population pédiatrique
La sécurité et l’efficacité de CONFIDEX chez les enfants et les adolescents n'a pas encore été établie dans des études cliniques contrôlées (voir rubriques 4.4 et 5.2).
Personnes âgées
La posologie et le mode d’administration chez les personnes âgées (> 65 ans) sont identiques aux recommandations générales.
Mode d'administration
Pour obtenir les instructions sur la reconstitution du médicament avant administration, voir rubrique 6.6. La solution reconstituée doit être administrée par voie intraveineuse (ne pas excéder 8 ml/minute*).
La solution doit être claire ou légèrement opalescente.
* dans les essais cliniques avec CONFIDEX, les patients avec un poids inférieur à 70 kg ont été traités avec une dose dont la vitesse de perfusion maximale était de 0,12 ml/ kg (moins de 8 ml/ min).
Hypersensibilité connue à la substance active ou à l’un des excipients mentionnés à la rubrique 6.1.
En cas de coagulation intravasculaire disséminée, les préparations à base de complexe prothrombique ne peuvent être administrées qu’après la fin de la phase de consommation.
Antécédent de thrombocytopénie induite par l’héparine.
4.4. Mises en garde spéciales et précautions d'emploi
Chez les patients atteints d’un déficit acquis en facteurs de coagulation vitamine K dépendants (par exemple, induit par un traitement par anti-vitamine K), CONFIDEX ne doit être administré qu’en cas de nécessité de corriger rapidement les taux du complexe prothrombique, comme en cas d’hémorragie majeure ou d’intervention chirurgicale urgente. Dans d’autres cas, une réduction de la dose de l’anti-vitamine K et/ou l’administration de vitamine K est habituellement suffisante.
Les patients recevant des anti-vitamines K peuvent se trouver dans un état d’hypercoagulabilité sous-jacent et la perfusion de complexe prothrombique humain est susceptible d’exacerber cet état.
Dans les cas de déficit congénital en l’un des facteurs vitamine K dépendants, il convient d’utiliser les produits de facteurs de coagulation spécifiques lorsqu’ils sont disponibles.
En cas de réaction allergique ou de type anaphylactique, l’administration de CONFIDEX devra être immédiatement interrompue (c’est-à-dire, arrêt de l’injection) et un traitement approprié doit être initié. Les mesures thérapeutiques dépendent du type et de la sévérité de l’effet indésirable. Le traitement médical standard de l’état de choc doit être respecté.
Il existe un risque de thrombose ou de coagulation intravasculaire disséminée lorsque les patients présentant un déficit congénital ou acquis sont traités par le complexe prothrombique humain, particulièrement en cas d'administrations répétées.
Ce risque est plus important dans le cas du traitement d'un déficit isolé en facteur VII, puisque les autres facteurs de coagulation vitamine K dépendants, présentant des demi-vies plus longues, peuvent s’accumuler jusqu’à des taux beaucoup plus élevés que la normale. Les patients traités par un complexe prothrombique humain doivent être surveillés étroitement pour détecter les signes ou symptômes évocateurs d'une coagulation intravasculaire disséminée ou d'une thrombose.
En raison du risque de complications thromboemboliques, un suivi étroit doit être réalisé lorsque CONFIDEX est administré aux patients présentant des antécédents de maladie coronarienne ou d’infarctus du myocarde, aux patients atteints de pathologies hépatiques, aux patients en période péri ou postopératoire, aux nouveau-nés ou aux patients présentant un risque de manifestations thromboemboliques ou de coagulation intravasculaire disséminée ou un déficit concomitant en inhibiteur.
Dans chacune de ces situations, le bénéfice potentiel du traitement par CONFIDEX doit être évalué par rapport au risque éventuel de complications de ce type.
Chez les patients présentant une coagulation intravasculaire disséminée, il peut être nécessaire, dans certaines circonstances, d’instaurer un traitement substitutif par facteurs de la coagulation du complexe prothrombique. Cependant, ce traitement ne peut être instauré qu’après la fin de la phase de consommation (par traitement de la cause sous-jacente, normalisation persistante du taux d’antithrombine III).
Les patients recevant des antagonistes de la vitamine K sont exposés au risque thromboembolique de leur état d’hypercoagulabilité sous-jacente. La reprise de l’anticoagulation doit être envisagée dès que possible.
Les réactions indésirables peuvent inclure le développement d’une thrombocytopénie induite par l’héparine, de type II (TIH, type II). Les signes caractéristiques d’une TIH sont une diminution de la numération plaquettaire de plus de 50 % et/ ou l’apparition de complication thromboemboliques nouvelles ou inexpliquées durant le traitement par héparine. Les symptômes débutent généralement 4 à 14 jours après le début du traitement par héparine, mais ils peuvent apparaitre également dans les 10 heures chez des patients ayant reçu récemment de l’héparine (dans les 100 jours précédents).
Le syndrome néphrotique a été rapporté dans des cas isolés chez les patients atteints d’hémophilie B et avec des antécédents de réaction allergique, après l’induction d’une tolérance immune avec des inhibiteurs du facteur IX.
Aucune information n’est disponible sur l’utilisation de CONFIDEX en cas d'hémorragie périnatale due à un déficit en vitamine K du nouveau-né.
CONFIDEX contient jusqu’à 343 mg de sodium (environ 15 mmol) par 100 ml. Cette quantité est à prendre en compte chez les patients suivant un régime alimentaire avec apport contrôlé de sodium.
Les mesures habituelles de prévention du risque de transmission d’agents infectieux par les médicaments préparés à partir de sang ou de plasma humain comprennent la sélection clinique des donneurs, la recherche des marqueurs spécifiques d’infection sur chaque don et sur les mélanges de plasma ainsi que la mise en œuvre dans le procédé de fabrication d’étapes pour l’inactivation/élimination virale. Cependant, lorsque des médicaments préparés à partir de sang ou de plasma humain sont administrés, le risque de transmission d’agents infectieux ne peut pas être totalement exclu. Ceci s’applique également aux virus inconnus ou émergents ou autres types d’agents infectieux.
Les mesures prises sont considérées comme efficaces vis-à-vis des virus enveloppés tels que le virus de l'immunodéficience humaine (VIH), le virus de l’hépatite B (VHB) et le virus de l’hépatite C (VHC) et le virus non-enveloppé de l’hépatite A et le parvovirus B19.
Une vaccination appropriée (hépatite A et B) doit être envisagée chez les patients recevant régulièrement ou de façon répétée des médicaments à base de complexes prothrombiques dérivés du plasma humain.
Il est fortement recommandé d’enregistrer le nom et le numéro du lot du produit chaque fois que CONFIDEX est administré à un patient, afin de conserver un lien entre le patient et le numéro de lot du produit.
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
Le complexe prothrombique humain neutralise les effets d'un traitement par anti-vitamines K, mais aucune interaction avec d’autres spécialités pharmaceutiques n'est connue.
Lors de la réalisation de tests de la coagulation sensibles à l’héparine chez un patient recevant des doses élevées de complexe prothrombique humain, l’héparine entrant dans la constitution du produit administré doit être prise en compte.
4.6. Fertilité, grossesse et allaitement
Grossesse et allaitement
La sécurité du complexe prothrombique humain lors de l'utilisation chez la femme enceinte et lors de l'allaitement n’a pas été établie. Les études chez l’animal ne permettent pas de statuer sur la sécurité d’utilisation pendant la grossesse, le développement embryo-fœtal, l’accouchement ou le développement post-natal.
Ainsi, le complexe prothrombique humain ne doit être utilisé au cours de la grossesse et de l’allaitement qu’en cas d’indication absolue.
Fertilité
Aucune donnée sur la fertilité n’est disponible.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
Résumé du profil de sécurité
Des réactions de type allergique ou anaphylactique, y compris des réactions anaphylactiques graves, ont été fréquemment observées (voir rubrique 4.4).
Une thérapie de remplacement peut conduire à la formation d’anticorps circulants inhibant un ou plusieurs facteurs du complexe prothrombique humain.
L’apparition de ces inhibiteurs se manifeste par une mauvaise réponse clinique. Dans ce cas, il est recommandé de consulter, pour avis, un centre spécialisé dans le traitement de l’hémophilie. Des réactions anaphylactiques ont été observées chez des patients ayant des anticorps contre les facteurs contenus dans CONFIDEX.
Une augmentation de la température corporelle a été fréquemment observée.
Il existe un risque d’épisodes thromboemboliques suite à l’administration du complexe prothrombique humain (voir rubrique 4.4).
Tableau récapitulatif des effets indésirables de CONFIDEX
Les effets indésirables suivants sont basés sur les données des essais cliniques, l’expérience post-commercialisation, ainsi que la littérature scientifique.
Le tableau présenté ci-dessous est selon la classification système MedDRA (SOC et termes préconisés). Les fréquences ont été estimées sur la base de données des essais cliniques, selon la convention suivante ; très fréquent (≥1/10) ; fréquent (≥1/100 à <1/10) ; peu fréquent (≥1/1,000 à <1/100) ; rare (≥1/10,000 à <1/1,000) ; très rare (<1/10,000) ou fréquence indéterminée (ne peut être estimée à partir des données disponibles)
|
Classification MedDRA Classe de systèmes d’organes |
Effets indésirables (Termes préférentiels MedDRA, PT) |
Fréquence |
|
Affections vasculaires |
Evènements thromboemboliques* |
Fréquent |
|
Affections hématologiques et du système lymphatique |
Coagulation intravasculaire disséminée |
Indéterminée |
|
Affections du système immunitaire |
Réactions d’hypersensibilité ou allergiques |
Peu fréquent |
|
Réactions anaphylactiques, y compris choc anaphylactique |
Indéterminée |
|
|
Développement d’anticorps |
Indéterminée |
|
|
Affections du système nerveux |
Céphalées |
Fréquent |
|
Troubles généraux et anomalies au site d’administration |
Augmentation de la température corporelle |
Fréquent |
*y compris des cas fatals
Pour les informations relatives au risque infectieux, voir rubrique 4.4.
Population pédiatrique
Aucune donnée n’est disponible concernant l’utilisation de CONFIDEX dans la population pédiatrique.
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance – Site internet : https://signalement.social-sante.gouv.fr/.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Les facteurs de la coagulation II, VII, IX et X, qui sont synthétisés dans le foie grâce à la vitamine K, sont communément appelés complexe prothrombique. En plus des facteurs de la coagulation, CONFIDEX contient de la protéine C et de la protéine S, inhibiteurs de la coagulation dépendant de la vitamine K.
Le facteur VII est le zymogène du facteur VIIa, sérine protéase active par laquelle la voie extrinsèque de la coagulation sanguine est initiée. Le complexe facteur thromboplastine tissulaire/facteur VIIa active les facteurs IX et X de la coagulation, ce qui donne naissance aux facteurs IXa et Xa. Au cours de l'activation de la cascade de la coagulation, la prothrombine (facteur II) est activée et transformée en thrombine. Sous l’action de la thrombine, le fibrinogène est converti en fibrine, ce qui résulte en la formation du caillot. Une production normale de thrombine est également d'une importance capitale pour la fonction plaquettaire dans le cadre de l'hémostase primaire.
Un déficit sévère isolé en facteur VII aboutit à une réduction de la formation de thrombine et à une tendance hémorragique due à une altération de la formation de fibrine et de l'hémostase primaire. Un déficit isolé en facteur IX est l’une des formes classiques de l'hémophilie (hémophilie B). Le déficit isolé en facteur II ou X est très rare mais, dans sa forme sévère, est la cause d’une tendance hémorragique similaire à celle observée dans l’hémophilie classique.
Les autres substances, les protéines C et S inhibitrices de la coagulation, sont également synthétisées par le foie. L’activité biologique de la protéine C est renforcée par la protéine S, qui est son cofacteur.
La protéine C activée inhibe la coagulation en inactivant les facteurs Va et VIIIa. La protéine S, à titre de cofacteur de la protéine C, renforce l'inactivation de la coagulation. Un déficit en protéine C est associé à un accroissement du risque de thrombose.
Un déficit acquis en facteurs de la coagulation dépendant de la vitamine K survient lors d’un traitement par anti- vitamine K. Si ce déficit devient sévère, une tendance hémorragique également sévère apparaît et se caractérise par des saignements rétro-péritonéaux ou cérébraux plutôt que par des hémorragies musculaires et articulaires. Une insuffisance hépatique sévère induit également une forte réduction du taux des facteurs de la coagulation dépendant de la vitamine K et en une tendance hémorragique cliniquement significative. Toutefois, le processus est souvent complexe en raison d’une coagulation intravasculaire simultanée continue, d’un faible taux de plaquettes, d’un déficit en inhibiteurs de la coagulation et d’une perturbation de la fibrinolyse.
L’administration du complexe prothrombique humain permet d’augmenter le taux plasmatique des facteurs de la coagulation dépendant de la vitamine K et peut transitoirement corriger l’anomalie de la coagulation chez les patients présentant un déficit en un ou plusieurs de ces facteurs.
5.2. Propriétés pharmacocinétiques
Etude chez des volontaires sains :
15 volontaires sains ont reçu 50 UI/ kg de CONFIDEX. La RIV (récupération in vivo) représente l’augmentation des niveaux de facteurs mesurables dans le plasma (UI/ ml) que l’on peut attendre après une perfusion de facteurs (UI/ kg) administrée en une dose de CONFIDEX. La progression des RIV des facteurs II, VII, IX et X et pour les protéines C et S ont été évaluées. Les niveaux maximums de tous les composants ont été atteints dans un intervalle de 3 heures. La progression moyenne des RIV se situait entre 0.016 UI/ ml pour les facteurs IX et 0.028 pour la protéine C. La médiane des demi-vies et la progression des RIV sont indiqués ci-après.
|
Paramètre |
Médiane des demi-vies plasmatiques (intervalle)/ heures |
Progression des récupérations in vivo (UI/ ml par UI/ kg poids corporel) |
||||
|
|
|
Moyenne géométrique |
90% ICϯ |
|||
|
60 (25 – 135) |
0.022 |
(0.020 – 0.023) |
||||
|
Facteur VII: |
4 (2 – 9) |
0.024 |
(0.023 – 0.026) |
|||
|
Facteur IX : |
17 (10 – 127)* |
0.016 |
(0.014 – 0018) |
|||
|
Facteur X : |
31 (17 – 44) |
0.021 |
(0.020 – 0.023) |
|||
|
Protéine C : |
47 (9 – 22)* |
0.028 |
(0.027 – 0.030) |
|||
|
Protéine S : |
49 (33 – 83)* |
0.020 |
(0.018 – 0.021) |
|||
*demi-vie terminale ; modèle à deux compartiments
Ϯ IC : intervalle de confiance
CONFIDEX est distribué et métabolisé dans l’organisme de la même façon que les facteurs de la coagulation II, VII, IX et X endogènes.
Le produit étant administrée par voie intraveineuse, sa biodisponibilité est immédiate et proportionnelle à la dose administrée.
Etude sur la correction des antagonistes de la vitamine K dans le traitement des hémorragies aiguës majeures :
La moyenne de récupération in vivo (RIV) a été calculée chez 98 sujets recevant CONFIDEX pour le traitement des hémorragies au cours d’un traitement par des antagonistes de la vitamine K. En réponse à ce traitement, la progression des RVI variaient entre 0.016 UI/ ml pour le Facteur VII et 0.019 UI/ ml pour la Protéine C.
Etude sur la correction des antagonistes de la vitamine K dans le traitement des hémorragies aiguës majeures ou en prophylaxie péri-opératoire des hémorragies :
La moyenne des récupérations in vivo (RIV) a été calculée chez 43 sujets recevant CONFIDEX pour le traitement des hémorragies ou en prophylaxie péri-opératoire des hémorragies au cours d’un traitement par des antagonistes de la vitamine k. L’administration intraveineuse d’1 UI/ kg de CONFIDEX augmentait les taux plasmatiques de facteurs de coagulation dépendant de la vitamine K de 0,013 à 0,023 UI/ ml.
5.3. Données de sécurité préclinique
Les études toxicologiques après administration unique du produit précédent pasteurisé, mais non nanofiltré, ont montré une toxicité modérée chez la souris après administration de 200 UI/kg, dose maximale testée. Une seule dose i.v. du produit pasteurisé et nanofiltré allant jusqu’à 100 UI/kg a été tolérée chez les rats.
Des études précliniques d’administration répétées (toxicité chronique, potentiel cancérogène et toxicité pour la reproduction) ne peuvent être réalisées dans des modèles animaux en raison de l’apparition d’anticorps suite à l’administration de protéines humaines hétérologues.
La tolérance locale de CONFIDEX injecté par voie intraveineuse a été établie chez le lapin. Une étude de la néoantigénicité chez le lapin n’a révélé aucun signe de production d’un néoépitope dû au processus de pasteurisation.
Solvant : eau pour préparations injectables.
La stabilité physico-chimique a été démontrée pendant 24 heures à température ambiante (jusqu’à un maximum de 25 °C). Toutefois d’un point de vue microbiologique, le produit doit être utilisé immédiatement.
6.4. Précautions particulières de conservation
A conserver à une température ne dépassant pas 25 °C.
Ne pas congeler. Conserver le flacon dans l'emballage extérieur à l'abri de la lumière.
Pour les conditions de conservation du médicament après reconstitution, voir rubrique 6.3.
6.5. Nature et contenu de l'emballage extérieur
Poudre en flacon (verre incolore de type II) muni d’un bouchon (caoutchouc bromobutyle) et d’un sertissage (aluminium) avec un opercule de type « flip off » (plastique) + 40 ml de solvant (eau pour préparations injectables) en flacon pour injection (verre incolore de type I) muni d’un bouchon pour perfusion (caoutchouc chlorobutyle ou bromobutyle) et d’un sertissage (aluminium) avec un opercule de type « flip off » (plastique), fourni avec un dispositif de transfert 20/20 muni d’un filtre.
Toutes les présentations peuvent ne pas être commercialisées.
6.6. Précautions particulières d’élimination et de manipulation
Mode d’administration
Instructions générales
La solution doit être limpide ou légèrement opalescente. Après filtration et prélèvement (voir plus bas), la solution reconstituée doit être inspectée visuellement afin de mettre en évidence la présence de particules éventuelles ou un changement de coloration éventuel avant l’administration.
Ne pas utiliser une solution trouble ou contenant des dépôts.
La reconstitution et le prélèvement doivent être effectués dans des conditions aseptiques.
Reconstitution
Amener le solvant à température ambiante. S’assurer que les capuchons protecteurs des flacons de poudre et de solvant sont retirés et que les bouchons sont nettoyés avec une solution antiseptique puis laisser sécher avant l’ouverture de l’emballage du Mix2vial.
|
|
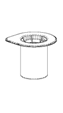
1. Ouvrir l’emballage du Mix2Vial en retirant l’opercule. Ne retirez pas le Mix2Vial de l'emballage blister! |
|
|
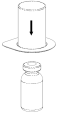
2. Placer le flacon de solvant sur une surface plane et propre et le maintenir fermement. En tenant le dispositif Mix2Vial à travers son emballage blister, pousser l’extrémité bleue tout droit à travers le bouchon du flacon de solvant. |
|
|
3. Retirer avec précaution l’emballage blister du dispositif Mix2Vial en maintenant le bord du dispositif et en tirant verticalement vers le haut. Bien s’assurer que seul cet emballage est retiré, et que le dispositif Mix2Vial reste bien en place. |
|
|
4. Poser le flacon de produit sur une surface plane et rigide. Retourner l’ensemble flacon de solvant-dispositif Mix2Vial et pousser sa partie transparente tout droit à travers le bouchon du flacon de produit. Le solvant coule automatiquement dans le flacon de poudre. |
|
|
5. En maintenant la partie produit reconstitué d’une main et la partie solvant de l’autre, séparer soigneusement les flacons en dévissant le dispositif Mix2Vial dans le sens inverse des aiguilles d’une montre. Jeter le flacon de solvant avec l’adaptateur Mix2Vial bleuattaché. |
|
|
6. Agiter délicatement le flacon de produit avec l’adaptateur transparent attaché jusqu’à ce que la substance soit totalement dissoute. Ne pas secouer. |
|
|
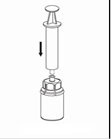
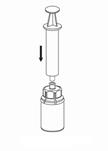
7. Remplir d’air une seringue stérile vide. Tout en maintenant verticalement le flacon de produit reconstitué, connecter la seringue au Luer Lock du dispositif Mix2Vial en vissant dans le sens horaire. Injecter l’air dans le flacon de produit. |
Prélèvement et administration
|
|
8. En maintenant le piston de la seringue appuyé, retourner l’ensemble et prélever la solution dans la seringue en tirant lentement sur le piston. |
|
|
9. Une fois la solution transféré dans la seringue, tenir le corps de la seringue fermement (piston dirigé vers le bas) et déconnecter le dispositif adaptateur transparent Mix2Vial de la seringue en dévissant dans le sens inverse des aiguilles d’une montre. |
Veiller à ce que du sang ne pénètre pas dans la seringue remplie de produit en raison d'un risque de coagulation dans la seringue et d'administration de caillots de fibrine au patient.
Dans le cas où plusieurs flacons de CONFIDEX sont nécessaires, il est possible d’utiliser plusieurs flacons de CONFIDEX à la fois, via un dispositif de perfusion disponible dans le commerce.
La solution de CONFIDEX ne doit pas être diluée.
La solution reconstituée doit être administrée par voie intraveineuse (ne pas excéder 8 ml/ minute*)
* dans les essais cliniques avec CONFIDEX, les patients avec un poids inférieur à 70 kg ont été traités avec une dose dont la vitesse de perfusion maximale était de 0,12 ml/ kg (moins de 8 ml/ min).
Tout produit non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
EMIL-VON-BEHRING-STRASSE 76
35041 MARBURG
ALLEMAGNE
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
[à compléter ultérieurement par le titulaire]
Date de première autorisation :{JJ mois AAAA}
10. DATE DE MISE A JOUR DU TEXTE
[à compléter ultérieurement par le titulaire]
{JJ mois AAAA}
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Liste I
Médicament soumis à prescription hospitalière.
ANSM - Mis à jour le : 01/07/2025
CONFIDEX 1000 UI, poudre et solvant pour solution injectable
Complexe prothrombique humain
Veuillez lire attentivement cette notice avant d’utiliser ce médicament car elle contient des informations importantes pour vous.
· Gardez cette notice. Vous pourriez avoir besoin de la relire.
· Si vous avez d’autres questions, interrogez votre médecin ou votre pharmacien.
· Ce médicament vous a été personnellement prescrit. Ne le donnez pas à d’autres personnes. Il pourrait leur être nocif, même si les signes de leur maladie sont identiques aux vôtres.
· Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
1. Qu'est-ce que CONFIDEX 1000 UI, poudre et solvant pour solution injectable et dans quels cas est-il utilisé ?
2. Quelles sont les informations à connaître avant d'utiliser CONFIDEX 1000 UI, poudre et solvant pour solution injectable ?
3. Comment utiliser CONFIDEX 1000 UI, poudre et solvant pour solution injectable ?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver CONFIDEX 1000 UI, poudre et solvant pour solution injectable ?
6. Contenu de l’emballage et autres informations.
1. QU’EST-CE QUE CONFIDEX 1000 UI, poudre et solvant pour solution injectable ET DANS QUELS CAS EST-IL UTILISE ?
Qu’est-ce que CONFIDEX ?
CONFIDEX se présente sous forme d’une poudre et d’un solvant. Poudre blanche ou légèrement colorée, ou solide friable. La solution reconstituée est administrée par injection dans une veine.
CONFIDEX est obtenu à partir de plasma humain (qui est la partie liquide du sang) et contient les facteurs II, VII, IX et X humains de la coagulation. Les concentrés contenant ces facteurs de la coagulation sont appelés produits de complexe prothrombique. Les facteurs II, VII, IX et X de la coagulation dépendent de la vitamine K et sont importants pour la coagulation du sang. En l’absence de l’un de ces facteurs, le sang ne coagule pas aussi rapidement qu’il le devrait, et il existe ainsi une tendance accrue aux saignements. Le remplacement des facteurs II, VII, IX et X par CONFIDEX permet de rétablir les mécanismes de la coagulation.
Dans quel cas CONFIDEX est-il utilisé ?
CONFIDEX est administré pour la prévention (pendant une intervention chirurgicale) et le traitement des hémorragies dues à un déficit acquis ou congénital en l’un des facteurs II, VII, IX et X de la coagulation dépendant de la vitamine K et présents dans le sang, quand des formulations purifiées de facteurs spécifiques de la coagulation ne sont pas disponibles.
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT D’UTILISER CONFIDEX 1000 UI, poudre et solvant pour solution injectable ?
N’utilisez jamais CONFIDEX 1000 UI, poudre et solvant pour solution injectable :
· si vous êtes allergique aux principes actifs ou à l’un des autres composants contenus dans ce médicament, mentionnés dans la rubrique 6.
Veuillez informer votre médecin si vous êtes allergique à tout médicament ou aliment.
· si vous êtes plus susceptibles de souffrir d’un dysfonctionnement de la coagulation sanguine que la normale (patients à risque de coagulation intravasculaire disséminée).
· si vous présentez une allergie à l’héparine induisant une diminution du nombre des plaquettes sanguines (thrombocytopénie induite par l’héparine de type II).
Veuillez informer votre médecin ou votre pharmacien si vous êtes dans l’un des cas ci-dessus.
Avertissements et précautions
Adressez-vous à votre médecin ou à votre pharmacien avant d’utiliser CONFIDEX en cas de :
· Déficit acquis en facteurs de la coagulation dépendant de la vitamine K. Ce déficit peut être induit par un traitement médicamenteux inhibant l’effet de la vitamine K. CONFIDEX ne doit être utilisé que lorsqu’une correction rapide du taux de complexe prothrombique est nécessaire, par exemple en cas d’hémorragie majeure ou de chirurgie d’urgence.
· Déficit congénital en l’un des facteurs dépendant de la vitamine K. Dans ce cas, vous devez recevoir une formulation du facteur de la coagulation correspondant, s’il est disponible.
· Réaction allergique ou anaphylactique (réaction allergique grave qui provoque des difficultés respiratoires sévères ou des sensations vertigineuses), dans ce cas, l’injection de CONFIDEX doit être immédiatement arrêtée.
· Risque accru de formation de caillots dans un vaisseau sanguin (thrombose), particulièrement :
o si vous avez eu une crise cardiaque (antécédents de maladie coronaire ou d’infarctus du myocarde)
o si vous avez une maladie du foie
o si vous venez d’être opéré(e) (période péri – ou postopératoire)
o chez un nouveau-né
o si vous êtes exposé(e) à un risque plus élevé de formation de caillots sanguins (patients à risque de phénomène thromboembolique, de coagulation intravasculaire disséminée ou de déficit concomitant en inhibiteur de la coagulation).
· Risque accru de coagulation en raison d’une augmentation de la consommation de plaquettes sanguines ou de facteurs de la coagulation. Le traitement par CONFIDEX ne peut être instauré qu’après le traitement de la cause sous-jacente.
· Réduction du nombre de plaquettes sanguines due à l’héparine (thrombocytopénie induite par l’héparine de type II). L’héparine (protéine qui dissout les caillots sanguins) est un des composants de CONFIDEX 1000 UI poudre et solvant pour solution injectable. La forme sévère d’une diminution des plaquettes sanguines peut être associée à :
o des caillots sanguins dans une veine ou un membre,
o une augmentation de la formation des caillots sanguins,
o dans certains cas, éruptions cutanée au site d’injection,
o des saignements en forme de piqûres d’épingle,
o des selles noires.
Dans ces cas, l’effet de l’héparine peut être diminué (tolérance à l’héparine). Si ces troubles surviennent, vous devez cesser immédiatement d’utiliser ce produit et joindre votre médecin. A l’avenir, vous ne devrez plus recevoir de produits contenant de l’héparine.
· Une forme spéciale d’inflammation des reins a été rapportée après traitement de patients hémophiles B qui présentaient des inhibiteurs du facteur IX. Ces patients avaient également des antécédents connus de réactions allergiques.
Votre médecin évaluera attentivement les bénéfices d’un traitement par CONFIDEX au risque de survenue de ces complications.
Sécurité virale
Lorsque des médicaments sont préparés à partir de sang ou de plasma humain, des mesures de prévention de la transmission d’agents infectieux sont mises en place.
Celles-ci comprennent :
· une sélection soigneuse des donneurs de sang et de plasma de façon à exclure les donneurs risquant d’être porteurs d’infections
· le contrôle de chaque don et des mélanges de plasma pour la présence de virus/d’infection,
· l’inclusion d’étapes d’inactivation ou d’élimination des virus dans la préparation du sang ou du plasma.
Cependant, lorsque des médicaments préparés à partir de sang ou de plasma humain sont administrés, le risque de transmission de maladies infectieuses ne peut être totalement exclu. Ceci s’applique également à tous les virus inconnus ou émergents ou autres types d’agents infectieux.
Les mesures prises sont considérées comme efficaces vis-à-vis des virus enveloppés tels que le virus de l’immunodéficience humaine (VIH), le virus de l’hépatite B et le virus de l’hépatite C et le virus non-enveloppé de l’hépatite A et le parvovirus.
Votre médecin peut vous recommander une vaccination contre les hépatites A et B si vous recevez régulièrement ou de façon répétée des médicaments à base complexes prothrombiques dérivés du plasma humain.
Il est fortement recommandé d’enregistrer le nom et le numéro de lot de chaque dose de CONFIDEX qui vous est administrée, afin de disposer d’un enregistrement des lots utilisés.
Autres médicaments et CONFIDEX 1000 UI, poudre et solvant pour solution injectable
· Informez votre médecin ou votre pharmacien si vous prenez, avez pris récemment ou pourriez prendre tout autre médicament.
· CONFIDEX peut inhiber l’effet d’un traitement par anti-vitamine K. Aucune interaction avec d’autres médicaments n’est connue.
· CONFIDEX ne doit pas être mélangé à d’autres médicaments, exceptés ceux mentionnés dans la rubrique 6.
Grossesse, allaitement et fertilité
· Si vous êtes enceinte ou que vous allaitez, si vous pensez être enceinte ou vous planifiez de l’être demandez conseil à votre médecin ou à votre pharmacien avant de prendre ce médicament.
· Au cours de la grossesse et de l’allaitement, CONFIDEX ne doit être administré que s’il est clairement indiqué.
· Aucune donnée sur la fertilité n’est disponible.
Conduite de véhicules et utilisation de machines
Les effets sur l’aptitude à conduire des véhicules et à utiliser des machines n’ont pas été étudiés.
CONFIDEX 1000 UI, poudre et solvant pour solution injectable contient du sodium
CONFIDEX contient jusqu’à 343 mg de sodium (environ 15 mmol) par 100 ml. Prenez cette quantité en compte si vous suivez un régime à apport contrôlé en sodium.
3. COMMENT UTILISER CONFIDEX 1000 UI, poudre et solvant pour solution injectable ?
Posologie
La quantité de facteurs II, VII, IX et X et la durée du traitement dépendent de plusieurs facteurs tels que votre poids corporel, la sévérité de votre maladie, le site et l’intensité du saignement ou la nécessité de prévenir un saignement au cours d’une opération ou d’une exploration (voir rubrique « Les informations suivantes sont destinées exclusivement aux professionnels de santé »).
Si vous avez d'autres questions sur l’utilisation de ce médicament, demandez plus d’informations à votre médecin ou votre pharmacien.
Surdosage
Votre médecin devrait vérifier régulièrement votre taux de caillot sanguin pendant le traitement. D’importants taux de complexe prothrombique ont été associés à des cas de crise cardiaque, à une coagulation intravasculaire disséminée et à une formation accrue de caillots de sang dans un vaisseau sanguin chez les patients présentant un risque de complications.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
Les effets indésirables suivants ont été observés fréquemment (pouvant affecter jusqu’à 1 personne sur 10) :
· Il existe un risque de formation de caillots sanguins (voir rubrique 2)
· Maux de tête
· Augmentation de la température corporelle
L’effet indésirable suivant a été observé peu fréquemment (pouvant affecter jusqu’à 1 personne sur 100) :
· Une hypersensibilité ou des réactions allergiques (voir rubrique 2)
La fréquence des effets indésirables suivants n’est pas connue (ne peut être estimée à partir des données disponibles) :
· Coagulation excessive entrainant une hémorragie sévère
· Des réactions anaphylactiques, y compris choc (voir rubrique 2)
· Formation d’anticorps inhibant un ou plusieurs facteurs de coagulation.
Population pédiatrique
Aucune donnée n’est disponible concernant l’utilisation de CONFIDEX dans la population pédiatrique.
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin, à votre pharmacien ou à votre infirmier/ère. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance – Site internet : https://signalement.social-sante.gouv.fr/.
En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.
5. COMMENT CONSERVER CONFIDEX 1000 UI, poudre et solvant pour solution injectable ?
Tenir ce médicament hors de la vue et de la portée des enfants.
N’utilisez pas ce médicament après la date de péremption indiquée sur l’étiquette et l’emballage après EXP.
A conserver à une température ne dépassant pas 25 °C. Ne pas congeler.
Conserver le flacon dans l'emballage extérieur à l'abri de la lumière.
CONFIDEX ne contient pas de conservateur. La solution reconstituée doit donc être de préférence administrée immédiatement.
Ne jetez aucun médicament au tout-à-l’égout ou avec les ordures ménagères. Demandez à votre pharmacien d’éliminer les médicaments que vous n’utilisez plus. Ces mesures contribueront à protéger l’environnement.
6. CONTENU DE L’EMBALLAGE ET AUTRES INFORMATIONS
Ce que contient CONFIDEX 1000 UI, poudre et solvant pour solution injectable
CONFIDEX 1000 UI contient 800 à 1240 UI de facteur IX humain de la coagulation par flacon.
· La substance active est :
Un concentré de facteurs II, VII, IX et X humains de la coagulation, des protéines C et S.
· Les autres composants sont :
Antithrombine III humaine, héparine, albumine humaine, chlorure de sodium, citrate de sodium, HCl ou NaOH (pour ajustement du pH).
Solvant : Eau pour préparations injectables.
CONFIDEX se présente sous forme d’une poudre blanche ou légèrement colorée et est fourni avec de l’eau pour préparations injectables utilisé comme solvant. La poudre doit être dissoute dans 40 ml d’eau pour préparations injectables. La solution reconstituée doit être limpide ou légèrement opalescente c’est-à-dire qu’elle peut briller quand elle est examinée à la lumière, mais ne doit contenir aucune particule visible).
Présentation
Un conditionnement de 1000 UI contient :
· Un flacon de poudre
· Un flacon de 40 ml d’eau pour préparations injectables
· Un dispositif de transfert avec filtre 20/20
Toutes les présentations peuvent ne pas être commercialisées.
Titulaire de l’autorisation de mise sur le marché
EMIL-VON-BEHRING-STRASSE 76
35041 MARBURG
ALLEMAGNE
Exploitant de l’autorisation de mise sur le marché
CARRE SUFFREN
31-35 RUE DE LA FEDERATION
75015 PARIS
EMIL-VON-BEHRING-STRASSE 76
35041 MARBURG
ALLEMAGNE
Noms du médicament dans les Etats membres de l'Espace Economique Européen
Ce médicament est autorisé dans les Etats membres de l'Espace Economique Européen sous les noms suivants : Conformément à la réglementation en vigueur.
[à compléter ultérieurement par le titulaire]
La dernière date à laquelle cette notice a été révisée est :
[à compléter ultérieurement par le titulaire]
{mois AAAA}
Des informations détaillées sur ce médicament sont disponibles sur le site Internet de l’ANSM (France).
Les informations suivantes sont destinées exclusivement aux professionnels de santé:
Composition qualitative et quantitative
CONFIDEX 1000 UI contient nominalement les quantités suivantes (UI) de facteurs de coagulation humains :
|
Composants |
Après reconstitution (UI/ml) |
CONFIDEX 1000 UI quantité par flacon (UI) |
|
Substances actives |
|
|
|
Facteur II de coagulation humain |
20 – 48 |
800 – 1920 |
|
Facteur VII de coagulation humain |
10 – 25 |
400 – 1000 |
|
Facteur IX de coagulation humain |
20 – 31 |
800 – 1240 |
|
Facteur X de coagulation humain |
22 – 60 |
880 – 2400 |
|
Autres composants actifs |
|
|
|
Protéine C |
15 – 45 |
600 – 1800 |
|
Protéine S |
12 – 38 |
480 – 1520 |
La quantité totale de protéine par flacon est de 6 – 14 mg/ml de solution reconstituée.
L’activité spécifique du facteur IX est de 2,5 UI par mg de protéine totale.
Les activités de tous les facteurs de coagulation, ainsi que de la protéine C et S (antigènes) ont été déterminées conformément aux standards de l’OMS.
Posologie et mode d’administration
Posologie
Les posologies recommandées ci-dessous sont données à titre indicatif.
La dose et la fréquence d’administration doivent être calculées sur la base de chaque cas individuel. L’intervalle entre les administrations doit être adapté en fonction des demi-vies des différents facteurs de coagulation de complexe prothrombique. La posologie individuelle nécessaire peut uniquement être déterminée sur la base des évaluations régulières des taux plasmatiques du facteur de coagulation à corriger ou sur la base d’un test global évaluant le taux du complexe prothrombique (temps de Quick, INR), et en fonction d’un suivi régulier de l’état clinique du patient.
Dans le cas d'interventions chirurgicales majeures, il est essentiel de réaliser un suivi précis du traitement de substitution à l’aide des tests de coagulation (tests spécifiques évaluant les facteurs de coagulation et/ou test global évaluant le taux de complexe prothrombique).
· Traitement et prophylaxie péri-opératoire des saignements lors d’un traitement par anti-vitamine K.
La dose dépendra de l’INR avant traitement et de l’INR cible. L’INR avant traitement doit être mesuré juste avant l’administration afin de calculer la dose appropriée de CONFIDEX. Le tableau suivant indique les doses approximatives (ml/kg de poids corporel de produit reconstitué et UI de Facteur IX/kg de poids corporel) requises dans le cadre de la correction de l’INR (par ex. ≤ 1,3) pour des taux d’INR initiaux différents.
|
INR avant traitement |
2,0 – 3,9 |
4,0 – 6,0 |
> 6,0 |
|
Dose approximative en ml/kg de poids corporel |
1 |
1,4 |
2 |
|
Dose approximative de facteur IX en UI/kg de poids corporel |
25 |
35 |
50 |
La dose maximale unique dépend du poids corporel qui ne doit pas excéder 100 kg. Pour les patients, qui pèsent plus de 100 kg, la dose (en Unités Internationales de facteur IX) ne doit pas dépasser :
· 2500 UI quand l’INR avant traitement est situé dans l’intervalle 2,0 – 3,9
· 3500 UI quand l’INR avant traitement est situé dans l’intervalle 4,0 – 6,0
· 5000 UI quand l’INR avant traitement est supérieur à 6.
La correction des troubles de l’hémostase induits par l’anti-vitamine K est généralement obtenue au plus tard 30 minutes après l'injection. L’administration simultanée de vitamine K doit être prise en compte chez les patients recevant CONFIDEX pour une correction rapide des antagonistes de la vitamine K, étant donné que celles-ci, sont habituellement obtenus en 4 à 6 heures. Il n’y a pas de données cliniques sur l’administration répétée du CONFIDEX chez des patients nécessitant une correction rapide des antagonistes de la vitamine K. Par conséquent, celle-ci n’est pas recommandée.
Ces recommandations reposent sur les données d’études cliniques menées chez un nombre limité de sujets. La récupération et la durée de l’effet thérapeutique peuvent varier, en conséquence le suivi de l’INR est obligatoire au cours du traitement.
· Traitement et prophylaxie péri-opératoire des saignements dans le déficit congénital en l’un des facteurs de coagulation vitamine K dépendants, lorsque le facteur de coagulation spécifique purifié n’est pas disponible.
Le calcul de la dose requise de concentré de complexe prothrombique repose sur des données issues d’études cliniques.
· 1 UI de facteur IX par kg de poids corporel est supposée augmenter l’activité facteur IX plasmatique de 1,3 % (0,013 UI/ml) par rapport à la normale.
· 1 UI de facteur VII par kg de poids corporel augmente l’activité facteur VII plasmatique de 1,7 % (0,017 UI/ml) par rapport à la normale.
· 1 UI de facteur II par kg de poids corporel augmente l’activité facteur II plasmatique de 1,9 % (0,019 UI/ml) par rapport à la normale.
· 1 UI de facteur X par kg de poids corporel augmente l’activité facteur X plasmatique de 1,9 % (0,019 UI/ml) par rapport à la normale.
La posologie d’un facteur spécifique administré est exprimée en Unités Internationales (UI), par rapport au standard de l'OMS en vigueur pour chaque facteur. L’activité plasmatique d’un facteur de coagulation spécifique est exprimée soit en pourcentage (par rapport au plasma humain) ou en Unités Internationales (par rapport à l’étalon international pour le facteur de coagulation spécifique).
Une unité internationale (UI) de l’activité d’un facteur de la coagulation correspond à la quantité de ce facteur contenue dans un ml de plasma humain normal.
Par exemple, le calcul de la dose requise de facteur X repose sur des observations montrant qu’une unité internationale (UI) de facteur X par kg de poids corporel augmente de 0,019 UI/ml l’activité plasmatique facteur X.
La posologie requise est déterminée en utilisant la formule suivante :
Nombre d’unités requises = poids corporel (kg) x augmentation de facteur X souhaitée (UI/ml) x 53 où 53 (ml/kg) correspond à l’inverse de la récupération estimée.
Le calcul est basé sur des données provenant de patients recevant des antagonistes de la vitamine K. Un calcul basé sur des données provenant de sujets sains donnerait une estimation plus faible de la dose requise.
Si la récupération individuelle est connue, cette valeur doit être utilisée pour le calcul.
Les données spécifiques sur le produit sont issues d’études cliniques chez des volontaires sains (N = 15), recevant des antagonistes de la vitamine K dans le traitement de saignement majeur aigu ou en prophylaxie péri-opératoire des saignements (N = 98, N = 43) (voir rubrique 5.2).
Population pédiatrique
La sécurité et l’efficacité de CONFIDEX chez les enfants et les adolescents n'a pas encore été établie dans des études cliniques contrôlées (voir rubriques 4.4 et 5.2).
Personnes âgées
La posologie et le mode d’administration chez les personnes âgées (> 65 ans) sont identiques aux recommandations générales.
Mode d’administration
Instructions générales
· La solution doit être limpide ou légèrement opalescente. Après filtration et prélèvement (voir plus bas), le produit reconstitué doit être inspecté visuellement pour mettre en évidence la présence de particules ou un changement de coloration avant administration.
· Ne pas utiliser de solutions troubles ou contenant des dépôts.
· La reconstitution et le prélèvement doivent être effectués dans des conditions aseptiques.
Reconstitution
Amener le solvant à température ambiante. S’assurer que les capuchons protecteurs des flacons de poudre et de solvant sont retirés et que les bouchons sont nettoyés avec une solution antiseptique puis laisser sécher avant l’ouverture de l’emballage du Mix2vial.
|
|
1. Ouvrir l’emballage du Mix2Vial en retirant l’opercule. Ne retirez pas le Mix2Vial de l'emballage blister! |
|
|
2. Placer le flacon de solvant sur une surface plane et propre et le maintenir fermement. En tenant le dispositif Mix2Vial à travers son emballage blister, pousser l’extrémité bleue tout droit à travers le bouchon du flacon de solvant. |
|
|
3. Retirer avec précaution l’emballage blister du dispositif Mix2Vial en maintenant le bord du dispositif et en tirant verticalement vers le haut. Bien s’assurer que seul cet emballage est retiré, et que le dispositif Mix2Vial reste bien en place. |
|
|
4. Poser le flacon de produit sur une surface plane et rigide. Retourner l’ensemble flacon de solvant-dispositif Mix2Vial et pousser sa partie transparente tout droit à travers le bouchon du flacon de produit. Le solvant coule automatiquement dans le flacon de poudre. |
|
|
5. En maintenant la partie produit reconstitué d’une main et la partie solvant de l’autre, séparer soigneusement les flacons en dévissant le dispositif Mix2Vial dans le sens inverse des aiguilles d’une montre. Jeter le flacon de solvant avec l’adaptateur Mix2Vial bleu attaché |
|
|
6. Agiter délicatement le flacon de produit avec l’adaptateur transparent attaché jusqu’à ce que la substance soit totalement dissoute. Ne pas secouer. |
|
|
7. Remplir d’air une seringue stérile vide. Tout en maintenant verticalement le flacon de produit reconstitué, connecter la seringue au Luer Lock du dispositif Mix2Vial en vissant dans le sens horaire. Injecter l’air dans le flacon de produit. |
Prélèvement et administration
|
|
8. En maintenant le piston de la seringue appuyé, retourner l’ensemble et prélever la solution dans la seringue en tirant lentement sur le piston. |
|
|
9. Une fois la solution transférée dans la seringue, tenir le corps de la seringue fermement (piston dirigé vers le bas) et déconnecter le dispositif adaptateur transparent Mix2Vial de la seringue en dévissant dans le sens inverse des aiguilles d’une montre. |
Veiller à ce que du sang ne pénètre pas dans la seringue remplie de produit en raison d'un risque de coagulation dans la seringue et d'administration de caillots de fibrine au patient.
Dans le cas où plusieurs flacons de CONFIDEX sont nécessaires, il est possible d’utiliser plusieurs flacons de CONFIDEX à la fois, via un dispositif de perfusion disponible dans le commerce.
La solution de CONFIDEX ne doit pas être diluée.
La solution reconstituée doit être administrée par voie intraveineuse (ne pas excéder 8 ml/minute*).
* dans les essais cliniques avec CONFIDEX, les patients avec un poids inférieur à 70 kg ont été traités avec une dose dont la vitesse de perfusion maximale était de 0,12 ml/ kg (moins de 8 ml/ min).
Tout produit médicamenteux non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.
Mises en garde spéciales et précautions d’emploi
Aucune donnée n’est disponible quant à l'utilisation de CONFIDEX en cas d'hémorragie périnatale due à un déficit en vitamine K chez un nouveau-né.
Note pour le contrôle de la numération plaquettaire :
La numération plaquettaire doit être étroitement contrôlée.
Interactions avec d’autres médicaments et autres formes d’interaction
Lors de la réalisation d’examens de la coagulation sensibles à l’héparine chez un patient recevant des doses élevées de complexe prothrombique humain, l’héparine entrant dans la constitution du produit administré doit être prise en compte.
 2
2