Dernière mise à jour le 01/12/2025
BECLOMETASONE CHIESI 400 microgrammes/1 ml, suspension pour inhalation par nébuliseur
Indications thérapeutiques
BECLOMETASONE CHIESI est indiqué dans le traitement de l'asthme lorsque les inhalateurs pressurisés ou à poudre sèche ne peuvent être utilisés ou sont inadaptés.
BECLOMETASONE CHIESI est aussi indiqué pour le traitement chez les enfants jusqu’à 5 ans qui présentes des épisodes récurrents de respiration sifflante.
Présentations
> 4 sachet(s) polytéréphtalate (PET) aluminium polyéthylène de 5 récipient(s) polyéthylène de 1 ml
Code CIP : 34009 300 815 4 9
Déclaration de commercialisation : 30/10/2017
Cette présentation est agréée aux collectivités
- Prix hors honoraire de dispensation : 8,90 €
- Honoraire de dispensation : 1,02 €
- Prix honoraire compris : 9,92 €
- Taux de remboursement :65%
- Asthme chez l'enfant, lorsque l'utilisation des appareils inhalateurs classiques s'avère impossible ou trop difficile. ; JOURNAL OFFICIEL ; 08/03/18
Service médical rendu (SMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprès de la HAS (plus d'informations dans l'aide). Les avis et synthèses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur du SMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| Important | Avis du 22/02/2017 | Inscription (CT) | Le service médical rendu par BECLOMETASONE CHIESI 400 microgrammes/1 ml et BECLOMETASONE CHIESI 800 microgrammes/2 ml, suspension pour inhalation par nébuliseur est important dans l’indication de l’AMM actuellement remboursables du princeps à savoir « en traitement continu de l’asthme chez l’enfant, lorsque les inhalateurs pressurisés ou à poudre sèche ne peuvent être utilisés ou sont inadaptés ». |
Amélioration du service médical rendu (ASMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprés de la HAS (plus d'informations dans l'aide). Les avis et synthéses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur de l'ASMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| V (Inexistant) | Avis du 22/02/2017 | Inscription (CT) | Dans l’indication du traitement continu de l’asthme chez l’enfant, ces spécialités n’apportent pas d’amélioration du service médical rendu (ASMR V) par rapport aux princeps BECLOSPIN 400 microgrammes/1 ml et BECLOSPIN 800 microgrammes/2 ml, suspension pour inhalation par nébuliseur en récipient unidose. |
ANSM - Mis à jour le : 02/08/2024
BECLOMETASONE CHIESI 400 microgrammes/1 ml, suspension pour inhalation par nébuliseur
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Dipropionate de béclométasone anhydre.............................................................. 400 microgrammes
Pour la liste complète des excipients, voir rubrique 6.1.
Suspension pour inhalation par nébuliseur.
Suspension blanchâtre
4.1. Indications thérapeutiques
BECLOMETASONE CHIESI est indiqué:
· en traitement continu de l’asthme chez l’adulte et l'enfant, lorsque les inhalateurs pressurisés ou à poudre sèche ne peuvent être utilisés ou sont inadaptés;
· en traitement des enfants agés de 5 ans ou moins ayant des épisodes récurrents de sibilances (voir rubriques 4.2 et 4.4 population pédiatrique).
4.2. Posologie et mode d'administration
La dose initiale de dipropionate de béclométasone en nébulisation sera déterminée en fonction de la fréquence et de la sévérité des symptômes.
Les doses initiales recommandées sont :
· adultes et adolescents (à partir de 12 ans) : 800 à 1 600 microgrammes deux fois par jour soit 2 à 4 récipients unidoses à nébuliser 2 fois par jour (correspondant à une dose journalière totale : de 1600 à 3200 microgrammes)
· enfants (jusqu’à 11 ans) : 400 à 800 microgrammes deux fois par jour soit 1 à 2 récipients unidoses à nébuliser 2 fois par jour (correspondant à une dose journalière totale : 800 à 1600 microgrammes)
Dans la majorité des cas, la dose quotidienne de 3200 microgrammes chez l’adulte et l’adolescent, et la dose de 1600 microgrammes chez l’enfant jusqu’à l'âge de 11 ans, ne doivent pas être dépassées.
Dès l'amélioration du contrôle de l’asthme ou la disparition des sibilants, il convient de réduire la dose journalière jusqu'à la dose minimale efficace et d'envisager l'administration en 1 seule prise par jour.
BECLOMETASONE CHIESI doit être administré quotidiennement et de façon régulière ; la durée du traitement sera fonction des symptômes.
Chez les enfants présentant des épisodes récurrents de sifflements bronchiques, le traitement par BECLOMETASONE CHIESI devra être arrêté si aucun bénéfice clinique n’est observé dans les 2-3 mois. Sauf si le diagnostic d'asthme est confirmé, le traitement par BECLOMETASONE CHIESI ne doit pas être maintenu plus de 3 mois pour éviter une exposition prolongée injustifiée (voir rubrique 4.4).
Mode d’administration
Voie inhalée exclusivement.
BECLOMETASONE CHIESI ne doit pas être injecté, ni administré par voie orale.
BECLOMETASONE CHIESI doit être administré à l'aide d'un embout buccal ou d’un masque facial adapté relié à un nébuliseur à air comprimé (ou pneumatique) associé à un compresseur.
Il convient d’informer les patients qu’ils doivent suivre attentivement les instructions du fabricant pour l’utilisation de l’appareil de nébulisation. Une mauvaise utilisation de l’appareil de nébulisation peut conduire à l'administration inadaptée du traitement.
L’utilisation de nébuliseurs ultrasoniques n’est pas recommandée car ceux-ci ne sont pas adaptés pour l'administration de BECLOMETASONE CHIESI.
Instructions concernant la préparation et la dilution du médicament : voir la rubrique 6.6.
Il doit être recommandé aux patients de se rincer la bouche avec de l’eau après chaque séance de nébulisation afin de diminuer le risque de candidose oropharyngée (voir rubrique 4.4).
Hypersensibilité à la substance active ou à l’un des excipients mentionnés à la rubrique 6.1.
4.4. Mises en garde spéciales et précautions d'emploi
BECLOMETASONE CHIESI n’est pas destiné à soulager les symptômes aigus d’asthme. Dans ces situations, il faut avoir recours à un bêta-2 agoniste inhalé de courte durée d’action que chaque patient doit avoir à sa disposition en permanence en tant que traitement de secours.
Une augmentation de la consommation de bronchodilatateurs pour soulager les symptômes, en particulier de bêta-2 agonistes inhalés de courte durée d’action, est le signe d'une détérioration du contrôle de l’asthme. Si le patient ressent une diminution de l'effet de son traitement de secours ou s’il a besoin d’un plus grand nombre d’inhalations que d’habitude, un avis médical est requis. La conduite thérapeutique doit être réévaluée et une augmentation du traitement anti-inflammatoire (augmentation de la dose de corticoïdes inhalés ou corticoïdes oraux en cure courte) doit être envisagée.
Les exacerbations sévères d’asthme relèvent du traitement standard (c’est-à-dire augmentation de la dose de dipropionate de béclométasone inhalée et, si nécessaire, corticothérapie systémique et/ou antibiothérapie, et recours aux bêta-2 agonistes).
Des effets systémiques peuvent apparaitre lors d’un traitement par corticostéroïde inhalé, particulièrement lorsque des doses élevées sont administrées au long cours. Le risque de retentissement systémique reste néanmoins moins important avec les corticoïdes inhalés qu’avec les corticoïdes oraux. Les effets systémiques possibles sont : freination de l’axe hypothalamo-hypophyso-surrenalien, retard de croissance chez les enfants et les adolescents, diminution de la densité minérale osseuse, cataracte et glaucome et, plus rarement, troubles psychologiques et comportementaux incluant : hyperactivité psychomotrice, troubles du sommeil, anxiété, dépression ou agressivité (en particulier chez les enfants). Par conséquent, il convient de surveiller l'état clinique des patients régulièrement et de toujours veiller à rechercher la posologie minimale efficace de corticoïdes inhalés permettant de maintenir le contrôle de l’asthme.
A l'arrêt de la corticothérapie systémique certains patients peuvent ressentir une sensation de malaise général pendant environ 2 semaines alors même que leur fonction respiratoire est stable, voire s’améliore. Ces patients doivent être encouragés à continuer le traitement par dipropionate de béclométasone par voie inhalée sans reprendre la corticothérapie systémique, sauf si apparaissent des signes cliniques objectifs d’insuffisance surrénale.
La mise en route d’un traitement par BECLOMETASONE CHIESI en relais d'une corticothérapie systémique prolongée ou à fortes doses doit être réalisée avec précautions car l'inhibition de la fonction cortico-surrénalienne peut persister pendant un certain temps. Dans tous les cas, le dipropionate de béclométasone sera administré sans interrompre la corticothérapie systémique. Après environ une semaine, celle-ci sera progressivement diminuée selon un rythme déterminé en fonction de la dose d’entretien de la corticothérapie systémique et sous surveillance régulière, avec éventuellement des tests de la fonction cortico-surrénalienne afin d'ajuster la dose de dipropionate de béclométasone inhalée.
La prudence est requise chez les patients présentant une tuberculose pulmonaire évolutive ou latente ou d'autres types d'infections. Les patients présentant une tuberculose doivent recevoir un traitement antituberculeux lors de la mise en route du traitement par le dipropionate de béclométasone.
La prudence est requise chez les patients présentant des infections virales, bactériennes ou fongiques oculaires, buccales, ou au niveau des voies respiratoires. En cas d’infection bactérienne des voies respiratoires, une antibiothérapie adaptée concomitante pourra être nécessaire.
La survenue de candidoses oropharyngées semble être d'autant plus fréquente que la dose de corticoïde est élevée et que le traitement est prolongé. Cette infection répond en général à un traitement antifongique adapté administré en application locale, sans interrompre le dipropionate de béclométasone.
Il doit être recommandé aux patients de se rincer la bouche avec de l’eau immédiatement après l’inhalation pour réduire le risque de survenue de candidoses buccales.
L’enrouement qui peut apparaitre avec le traitement est réversible et disparaît à l'arrêt du traitement et/ou avec la mise au repos de la voix.
Un bronchospasme paradoxal peut survenir, se manifestant par une majoration des sibilants, une dyspnée et une toux immédiatement après la prise du médicament. Le bronchospasme doit être immédiatement traité par bronchodilatateur inhalé d’action rapide. Le traitement par BECLOMETASONE CHIESI devra être arrêté immédiatement et la conduite thérapeutique sera réévaluée pour envisager, le cas échéant, un traitement alternatif.
La diminution ou la suppression de la corticothérapie orale peut révéler des signes cliniques évocateurs d'un syndrome de Churg-Strauss ou une hyperéosinophilie.
Le remplacement d’une corticothérapie par voie systémique par un traitement inhalé peut parfois révéler l'existence d'allergies se manifestant par une rhinite allergique ou un eczéma précédemment contrôlé(e) par la corticothérapie systémique. Un traitement symptomatique incluant des antihistaminiques et/ou un traitement corticoïde par voie topique sont préconisés.
L'attention des sportifs sera attirée sur le fait que cette spécialité contient un principe actif pouvant induire une réaction positive des tests pratiqués lors de contrôles antidopage.
Troubles visuels
Des troubles visuels peuvent apparaitre lors d'une corticothérapie par voie systémique ou locale. En cas de vision floue ou d'apparition de tout autre symptôme visuel apparaissant au cours d'une corticothérapie, un examen ophtalmologique est requis à la recherche notamment d'une cataracte, d'un glaucome, ou d'une lésion plus rare telle qu'une choriorétinopathie séreuse centrale, décrits avec l'administration de corticostéroïdes par voie systémique ou locale.
Population pédiatrique
La décision d’instaurer un traitement inhalé par dipropionate de béclometasone chez l’enfant de moins de 5 ans présentant des épisodes récurrents de sifflements bronchiques doit tenir compte de la sévérité et de la fréquence des épisodes de sibilants. Un suivi régulier est essentiel afin de réévaluer la réponse au traitement. Si aucun bénéfice clinique n’est observé sous traitement dans les 2-3 mois, ou si le diagnostic d’asthme n’est pas confirmé, le traitement par BECLOMETASONE CHIESI devra être arrêté afin d’éviter une exposition prolongée non justifiée aux corticostéroides inhalés et les risques associés de retard de croissance (voir rubrique 4.8).
La croissance des enfants recevant un traitement prolongé par corticoïdes inhalés doit être régulièrement contrôlée. En cas de ralentissement de la croissance, le traitement devra être réévalué afin de réduire la dose du corticoïde inhalé. Il conviendra de soigneusement évaluer les bénéfices attendus de la corticothérapie face aux risques éventuels de ralentissement de la croissance. L'avis d'un spécialiste en pneumo-pédiatrie peut être requis.
Les données disponibles concernant l'effet de la corticothérapie inhalé sur la croissance des nourrissons et les jeunes enfants de moins de 2 ans sont limitées.
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
Interactions pharmacocinétiques
Aucune étude pharmacocinétique spécifique d’interaction médicamenteuse n’a été conduite.
Le dipropionate de béclométasone subit un métabolisme pré-systémique très rapide par des enzymes estérases, sans intervention du cytochrome P450.
Le métabolisme de la béclométasone est moins dépendant du CYP3A que celui de certains autres corticostéroïdes, et les interactions sont peu probables dans la majorité des cas. Néanmoins, en cas d’utilisation concomitante d’inhibiteurs puissants du CYP3A (ex : ritonavir, cobicistat), le risque d’effets systémiques ne peut pas être exclu. La prudence et une surveillance adaptée sont requises en cas de traitement concomitant.
Interactions pharmacodynamiques
L'administration concomitante de corticostéroïdes par voies systémique ou intranasale exerce un effet inhibiteur additif sur la fonction surrénalienne.
4.6. Fertilité, grossesse et allaitement
Grossesse
Selon des données publiées, aucun effet tératogène n'a été mis en évidence chez la femme enceinte utilisant la béclométasone en inhalation. Un éventuel effet sur le développement du fœtus après inhalation de fortes doses de dipropionate de béclométasone ne peut cependant être exclu.
Les études effectuées chez l’animal ont mis en évidence une toxicité sur la reproduction (voir rubrique 5.3).
Les risques éventuels pour le fœtus ou le nouveau-né devront être pris en considération au regard du bénéfice éventuel de l'inhalation du dipropionate de béclométasone pour la mère. Si le traitement s'avère nécessaire au cours de la grossesse, la dose efficace la plus faible de dipropionate de béclométasone devra être utilisée.
Les nouveau-nés et nourrissons nés de mère ayant reçu des doses significatives de dipropionate de béclométasone pendant la grossesse devront être surveillés afin de détecter une éventuelle inhibition de la fonction surrénalienne.
Comme les autres glucocorticoïdes, il est probable que le dipropionate de béclométasone et ses métabolites soient excrétés dans le lait maternel. Néanmoins, à la dose thérapeutique de dipropionate de béclométasone, aucun effet n’est attendu chez les nouveau-nés/nourrissons allaités.
Aucun effet délétère des glucocorticoïdes n’a été mis en évidence chez les nourrissons allaités. Les bénéfices de l'allaitement doivent prévaloir sur un risque théorique.
Le dipropionate de béclométasone peut être utilisé pendant l’allaitement. Il est cependant préférable, en cas d'inhalation d'une forte dose de dipropionate de béclométasone, d’éviter d'allaiter dans les 4 h suivant l'administration.
Fertilité
Aucune étude spécifique n’a été menée concernant l'effet du dipropionate de béclométasone sur la fertilité humaine. Les études effectuées chez l’animal ont mis en évidence une certaine diminution de la fertilité, mais ne survenant qu'à de fortes doses.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
Résumé du profil de sécurité :
Les effets indésirables les plus fréquents observés lors des essais cliniques avec le dipropionate de béclométasone dans le traitement de l’asthme et chez les enfants ayant des sifflements bronchiques ont été des laryngites, des pharyngites et des candidoses bucco-pharyngées.
De rares cas de réactions d'hypersensibilité graves incluant un œdème des paupières, du visage, des lèvres et de la gorge (œdème de Quincke) ont été signalés.
Un bronchospasme paradoxal peut apparaître suite à l’administration du produit.
Résumé tabulé des effets indésirables :
Les effets indésirables observés dans les essais cliniques réalisés avec la béclométasone par voie inhalée dans le traitement de l’asthme et des sifflements bronchiques de l'enfant sont listés dans le tableau ci-dessous par classe de systèmes d'organes MedDRA et fréquences : très fréquent (≥ 1/10) ; fréquent (≥ 1/100, < 1/10) ; peu fréquent (≥ 1/1 000, < 1/100) ; rare (≥ 1/10 000, < 1/1 000) ; très rare (< 1/10 000), fréquence indéterminée (ne peut être estimée sur la base des données disponibles).
|
Classe de systèmes d’organes |
Effet indésirable |
Fréquence |
|
Infections et infestations |
Laryngite, pharyngite |
Très fréquent |
|
Candidose bucco-pharyngée |
Fréquent |
|
|
Herpès simplex |
*Rare |
|
|
Troubles endocriniens |
Inhibition de la fonction surrenalienne** |
Très rare |
|
Troubles du système immunitaire |
Réactions d'hypersensibilité: angio-œdème, éruption cutanée, urticaire, prurit |
*Rare |
|
Troubles psychiatriques |
Hyperactivité psychomotrice, troubles du sommeil, anxiété, dépression, agressivité, troubles du comportement (principalement chez l’enfant) |
Fréquence indéterminée |
|
Troubles du système nerveux |
Céphalée |
Peu fréquent |
|
Tremblement |
*Rare |
|
|
Troubles respiratoires, thoraciques et médiastinaux |
Toux |
Fréquent |
|
Irritation de la gorge, enrouement, dysphonie, bronchospasme paradoxal, sibilants |
Peu fréquent |
|
|
Dyspnée |
Rare |
|
|
Troubles oculaires |
Cataracte**, glaucome** |
Très rare |
|
|
Vision floue (voir rubrique 4.4) |
Fréquence indéterminée |
|
Troubles gastro-intestinaux |
Nausée, dyspepsie |
Fréquent |
|
Troubles musculo-squelettiques et du tissu conjonctif |
Retard de croissance *(chez enfant et adolescent), baisse de la densité minérale osseuse* |
Très rare |
|
Troubles généraux et anomalies au site d’administration |
Asthénie |
*Rare |
* effets indésirables issus des notifications spontanées
** effets systémiques des corticostéroïdes inhalés
Description de certains effets indésirables :
Les effets systémiques des corticoïdes inhalés (tels que le dipropionate de béclométasone) peuvent survenir particulièrement en cas d’administration au long cours de fortes doses. Sont rapportés inhibition de la fonction surrénalienne, diminution de la densité minérale osseuse, retard de croissance chez l’enfant et l’adolescent, cataracte et glaucome (voir la rubrique 4.4 « Mises en garde spéciales et précautions d’emploi »).
Les précautions visant à réduire le risque de survenue de candidose buccale, enrouement et bronchospasme paradoxal sont décrites en rubrique 4.4.
Population pédiatrique
Un retard de croissance et des troubles du comportement sont plus fréquemment observés chez les enfants que chez les adultes, en particulier en cas d’administration de fortes doses au long cours.
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr/
Le traitement par BECLOMETASONE CHIESI peut être poursuivi à la dose minimale efficace permettant le contrôle des symptômes (asthme ou sibilants) (voir rubrique 4.4).
L'administration d'une forte dose de corticoïdes sur une très courte période peut entrainer une freination de l’axe hypothalamo-hypophyso-surrénalien. Dans ce cas, il n’y a pas lieu d'entreprendre un traitement spécifique d'urgence. La fonction de l’axe hypothalamo-hypophyso-surrénalien est rétablie dans la majorité des cas en 1 à 2 jours.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Mécanisme d’action
L’affinité du dipropionate de béclométasone et de son principal métabolite actif, le monopropionate de béclométasone (17-MPB), pour le récepteur aux glucocorticoïdes humain est établie. La puissance du 17-MPB est environ 30 fois supérieure à celle de la molécule mère. Par conséquent, la majorité des effets observés est liée à l’exposition systémique au 17-MPB.
Effets pharmacodynamiques
Le dipropionate de béclométasone est un glucocorticoïde ayant une activité anti-inflammatoire puissante et une activité minéralocorticoïde limitée. Après administration par voie inhalée, un effet local est obtenu au niveau des voies respiratoires basses.
Les effets pharmacodynamiques systémiques du dipropionate de béclométasone et de son métabolite actif 17-MPB ont été évalués en mesurant les effets sur la fonction de l’axe hypothalamo-hypophyso-surrénalien.
Les résultats obtenus chez le volontaire sain ont montré l'absence d'effet sur l’excrétion du cortisol urinaire pendant 24 h après administration par nébulisation d'une dose unique de 1600μg de dipropionate de béclometasone, alors qu'une diminution d'environ 10% de l’excrétion du cortisol urinaire était observée après une dose unique de 3200 μg, sans que la différence entre les deux doses soit significative. Il n’a pas été rapporté d’effet significatif sur les taux de cortisol sérique du matin après administration par nébulisation de 1600 et 3200 μg répartis en 2 prises par jour pendant 3 semaines chez des patients asthmatiques.
Efficacité et sécurité clinique
Les études décrites ci-dessous sont issues de la littérature en tant que données s'ajoutant à l'expérience acquise par l’utilisation de la béclometasone inhalée dans le traitement de l’asthme et des sifflements bronchiques.
Asthme :
Une étude dont l'objectif était de comparer l’efficacité et la sécurité du dipropionate de béclométasone en nébulisation par rapport à une suspension pour nébulisation de propionate de fluticasone a été menée chez 205 adultes asthmatiques (âgés de 18 à 65 ans) randomisés sur une période de 12 semaines de traitement. Les résultats présentés montrent une efficacité similaire entre les deux traitements sur le contrôle de l'asthme à la fin de l'étude en termes de fonction respiratoire, d'exacerbations d’asthme, de symptômes et de consommation de salbutamol en traitement symptomatique à la demande (Terzano et al. 2003).
Population pédiatrique
Asthme :
Une étude multicentrique, en double aveugle, double placebo, randomisée, en deux groupes parallèles a comparé l'efficacité du dipropionate de béclométasone en nébulisation et du dipropionate de béclométasone administrés à l'aide d'un aérosol-doseur chez 151 patients âgés de 6 à 16 ans présentant un asthme modéré à sévère et traités pendant 4 semaines. L'amélioration entre le début et la fin de l’étude étaient similaires entre les deux groupes de traitements en termes de débit expiratoire de pointe matinal (critère primaire), de scores des symptômes et de consommation de salbutamol en traitement symptomatique à la demande. Les deux traitements ont été bien tolérés, de façon équivalente (Bisca et al, 2003).
L'efficacité et la sécurité du dipropionate de béclométasone dans le traitement de l'asthme persistant sévère du nourrisson et du jeune enfant âgés de 6 mois à 6 ans ont été évaluées en comparaison avec une suspension pour nébulisation de budésonide dans le cadre d'une étude ouverte multicentrique, randomisée et contrôlée sur 14 semaines. Dans cette étude, respectivement 40,4 % et 51,7 % des patients des groupes dipropionate de béclométasone et budésonide n'ont pas présenté d'exacerbation sévère (critère primaire). Les deux traitements ont été associés à une diminution significative des sifflements bronchiques nocturnes et du nombre de jours d'utilisation des corticostéroïdes. Les deux traitements n'ont pas eu d'effet sur le cortisol urinaire, ni sur les courbes de taille et de poids. L'absence d'effet du dipropionate de béclométasone nébulisé sur le métabolisme osseux a été confirmé (Delacourt et al, 2003).
Episodes de sifflements bronchiques :
Le dipropionate de béclométasone en nébulisation a été évalué chez 276 enfants âgés de 1 à 4 ans présentant des épisodes fréquents de sibilants dans le cadre d'un essai randomisé, en double aveugle et contrôlé de 12 semaines. Une augmentation significative du pourcentage de jours sans symptômes (critère principal définit par l’absence de sifflements bronchiques, toux, dyspnée et réveil nocturne des enfants/parents sur 24 heures) a été observée dans le groupe traité par le dipropionate de béclométasone administré par nébulisations régulières associé au salbutamol en traitement symptomatique à la demande (69,6% ± 20.89 [SD]; p = 0.034) comparativement au groupe de patients recevant un placebo associé au salbutamol en traitement symptomatique à la demande (61.0 ± 24.83 [SD]). Il n'a pas été retrouvé de différence comparativement au groupe traité par dipropionate de béclométasone en nébulisation et salbutamol, tous deux administrés en traitement symptomatique à la demande (64.9 ± 24.74 [SD]). Ces résultats n'étaient pas influencés par la présence de facteurs favorisant la survenue de symptômes d'asthme. En outre, le délai de survenue de la première exacerbation d'asthme était plus long chez les enfants traités par le dipropionate de béclométasone en nébulisation.
En termes de sécurité, il n'a pas été mis en évidence de variation dans les valeurs du cortisol salivaire matinal (Papi et al. 2009).
5.2. Propriétés pharmacocinétiques
Absorption
Après inhalation, le DPB est absorbé sous forme inchangée principalement au niveau du poumon. L'absorption digestive de la fraction déglutie est négligeable. Le principal métabolite actif circulant, le 17-MPB, résulte de la déposition pulmonaire et de l’absorption digestive de la fraction déglutie.
La biodisponibilité du DPB administré par voie orale est négligeable, mais environ 40 % de la partie déglutie sont absorbés sous forme de 17-MPB. La biodisponibilité absolue après inhalation est respectivement d’environ 2 % et 62 % de la dose nominale pour le DPB et le 17-MPB.
Distribution
La liaison aux protéines plasmatiques est modérée. Après administration intraveineuse, la clairance plasmatique du DPB et de son métabolite actif, le 17-MPB, est importante (respectivement 150 L/h et 120 L/h), avec un faible volume de distribution à l’état d’équilibre pour le DPB (20 L) et une distribution tissulaire plus importante pour son métabolite actif (424 L).
Biotransformation
Le principal métabolite est le métabolite actif (17-MPB). Des métabolites inactifs, le 21-monopropionate de béclométasone (21-MPB) et la béclométasone (BOH), sont également formés en faible quantité mais contribuent peu à l’exposition systémique.
Élimination
Le DPB est très rapidement éliminé de la circulation systémique après métabolisation par des enzymes estérases localisées dans la plupart des tissus de l'organisme. L’excrétion rénale du DPB et de ses métabolites est négligeable. L’excrétion fécale est la principale voie d’élimination du DPB, essentiellement sous forme de métabolites polaires. Les demi-vies d’élimination terminales sont de 0,5 h pour le DPB et 2,7 h pour le 17-MPB.
Linéarité/non-linéarité
Les concentrations plasmatiques mesurées du métabolite actif 17-MPB montrent une cinétique quasi linéaire.
Populations particulières
La pharmacocinétique du DPB n’a pas été étudiée chez les patients insuffisants rénaux ou hépatiques. Cependant, le DPB est très rapidement métabolisé en métabolites polaires 21-MPB, 17-MPB et BOH par les enzymes estérases digestives, sériques, pulmonaires et hépatiques. Par conséquent, il n'est pas attendu de modification de la pharmacocinétique, ni du profil de sécurité du DPB en cas d'insuffisance hépatique. Aucune trace de DPB ou de ses métabolites n’ayant été retrouvée dans les urines, il n'est pas attendu d'augmentation de l’exposition systémique chez les patients insuffisants rénaux.
5.3. Données de sécurité préclinique
Dans les études de toxicité en doses répétées, l’administration par nébulisation du dipropionate de béclométasone chez des rats (pendant 180 jours) et chez des chiens (pendant 90 jours) n’a pas eu d'effet sur le poids corporel et les cellules sanguines ou sur la muqueuse des voies aériennes. Les fonctions hépatique et rénale sont restées dans les limites des valeurs normales.
Une embryolétalité et un effet tératogène ont été retrouvés après administration de béclométasone par voie sous-cutanée ou par voie orale chez l'animal. Les études effectuées chez l’animal indiquent que l’administration de glucocorticoïdes pendant la gestation peut entraîner un retard de croissance intra-utérin, l'apparition de troubles cardiovasculaires et/ou métaboliques et/ou des troubles neurocomportementaux chez les animaux adultes.
Il n'a pas été mis en évidence d'effet génotoxique du dipropionate de béclométasone.
Une étude de 95 semaines chez des rats traités par inhalation n'a pas mis en évidence d'effet carcinogène.
Polysorbate 20, laurate de sorbitan, chlorure de sodium, eau purifiée.
2 ans.
Utiliser les récipients dans les 3 mois suivant la première ouverture du sachet.
6.4. Précautions particulières de conservation
6.5. Nature et contenu de l'emballage extérieur
Chaque récipient en polyéthylène contient 1 ml (BECLOMETASONE CHIESI 400 microgrammes) de suspension pour inhalation par nébuliseur.
Les récipients sont conditionnés par 5 dans un sachet thermoscellé de PET/Al/PE (polyéthylène téréphthalate/aluminium/polyéthylène).
Chaque boîte contient 2, 4 ou 8 sachets, soit 10, 20 ou 40 récipients.
Toutes les présentations peuvent ne pas être commercialisées.
6.6. Précautions particulières d’élimination et de manipulation
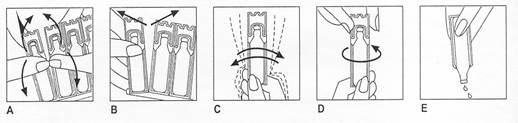
Le flacon doit être utilisé conformément aux instructions suivantes :
|
|
1. Plier le récipient vers l’arrière et vers l’avant (Figure A).
2. Détacher soigneusement un nouveau récipient de la plaquette, en commençant par le haut, puis le milieu (Figure B), en laissant les autres récipients dans le sachet.
3. Agiter vigoureusement et retourner de haut en bas le récipient afin d’homogénéiser la suspension. Renouveler cette opération jusqu’à ce que la totalité du contenu soit complètement dispersée et mélangée (Figure C).
4. Ouvrir le récipient en tournant la partie supérieure, comme indiqué par la flèche ci-dessus (Figure D).
5. Appuyer doucement sur le récipient pour en verser le contenu dans le réservoir du nébuliseur (Figure E).
Le récipient doit être ouvert immédiatement avant l’administration.
Le récipient de 400 microgrammes est à usage unique.
BECLOMETASONE CHIESI peut être dilué. Dans ce cas, le contenu de récipient doit être vidé dans le réservoir du nébuliseur. La quantité requise de solution de chlorure de sodium à 9 mg/ml (0,9 %) y sera ajoutée. Après avoir refermé le réservoir du nébuliseur, agiter délicatement le nébuliseur pour mélanger le contenu.
SEULE une solution de chlorure de sodium 9 mg/ml (0,9%) doit être utilisée.
Suivre les instructions du fabricant pour l’utilisation, l’entretien et le nettoyage du nébuliseur.
Tout médicament non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
17 avenue de l’Europe
92270 Bois Colombes
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· 34009 300 815 4 9 : Sachet thermoscellé (polyéthylène téréphthalate/aluminium/polythylène) contenant 5 récipients en polyéthylène. Boite de 4 sachets, soit 20 récipients.
· 34009 300 815 5 6 : Sachet thermoscellé (polyéthylène téréphthalate/aluminium/polythylène) contenant 5 récipients en polyéthylène. Boite de 8 sachets, soit 40 récipients.
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
[à compléter ultérieurement par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE
[à compléter ultérieurement par le titulaire]
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Liste I
ANSM - Mis à jour le : 02/08/2024
BECLOMETASONE CHIESI 400 microgrammes/1 ml, suspension pour inhalation par nébuliseur
Dipropionate de béclométasone
· Gardez cette notice. Vous pourriez avoir besoin de la relire.
· Si vous avez d’autres questions, interrogez votre médecin ou votre pharmacien.
· Ce médicament vous a été personnellement prescrit. Ne le donnez pas à d’autres personnes. Il pourrait leur être nocif, même si les signes de leur maladie sont identiques aux vôtres.
· Si vous ressentez un quelconque effet indésirable, qu’il soit mentionné ou non dans cette notice, parlez-en à votre médecin ou votre pharmacien. Voir rubrique 4.
1. Qu'est-ce que BECLOMETASONE CHIESI 400 microgrammes/1 ml, suspension pour inhalation par nébuliseur et dans quels cas est-il utilisé ?
2. Quelles sont les informations à connaître avant d'utiliser BECLOMETASONE CHIESI 400 microgrammes/1 ml, suspension pour inhalation par nébuliseur ?
3. Comment utiliser BECLOMETASONE CHIESI 400 microgrammes/1 ml, suspension pour inhalation par nébuliseur ?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver BECLOMETASONE CHIESI 400 microgrammes/1 ml, suspension pour inhalation par nébuliseur ?
6. Contenu de l’emballage et autres informations.
1. QU’EST-CE QUE BECLOMETASONE CHIESI 400 microgrammes/1 ml, suspension pour inhalation par nébuliseur ET DANS QUELS CAS EST-IL UTILISE ?
BECLOMETASONE CHIESI est indiqué dans le traitement de l'asthme lorsque les inhalateurs pressurisés ou à poudre sèche ne peuvent être utilisés ou sont inadaptés.
BECLOMETASONE CHIESI est aussi indiqué pour le traitement chez les enfants jusqu’à 5 ans qui présentes des épisodes récurrents de respiration sifflante.
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT D’UTILISER BECLOMETASONE CHIESI 400 microgrammes/1 ml, suspension pour inhalation par nébuliseur ?
· Si vous êtes allergique aux corticoïdes ou à l’un des autres composants contenus dans ce médicament mentionnés dans la rubrique 6.
Avertissements et précautions
Adressez-vous à votre médecin avant d’utiliser BECLOMETASONE CHIESI si vous êtes concernés par l’une ou l’autre des situations suivantes :
· Vous êtes, ou avez déjà été, traité(e) pour une tuberculose.
· Votre asthme semble s’aggraver, votre respiration devient de plus en plus sifflante, et/ou vous vous sentez plus essoufflé(e) que d’habitude, et/ou les nébulisations semblent être moins efficaces. Votre médecin pourrait alors augmenter la dose de BECLOMETASONE CHIESI ou vous prescrire des comprimés de corticostéroïdes, voire de totalement modifier votre traitement.
· Vous présentez une infection pulmonaire. Votre médecin peut vous prescrire un traitement par antibiotiques.
· Si vous avez une infection des fosses nasales et des sinus, vous devez être traité(e) par des traitements adaptés, mais cela ne constitue pas une contre-indication spécifique à l’utilisation de BECLOMETASONE CHIESI.
· En cas de vision floue ou d’autres troubles visuels.
· Si vous ressentez une augmentation des sifflements bronchiques, de votre essoufflement ou de votre toux immédiatement après la prise de BECLOMETASONE CHIESI, vous devez interrompre le traitement, ne pas renouveler la prise de BECLOMETASONE CHIESI et contacter votre médecin.
Immédiatement après l’inhalation, il est nécessaire de se rincer la bouche avec de l’eau pour réduire le risque d'apparition de mycose dans la bouche.
Relais d’un traitement par comprimés de corticostéroïdes par BECLOMETASONE CHIESI
Lors du remplacement d’un traitement par comprimés de corticostéroïdes par un traitement par corticostéroïdes inhalés (Béclométasone Chiesi), vous pouvez ressentir une sensation de malaise général, ou peuvent apparaitre une éruption cutanée, un eczéma ou des symptômes de rhinite se manifestant par un écoulement nasal et des éternuements.
Vous devez consulter votre médecin dès que possible si vous présentez ces symptômes. N’arrêtez pas le traitement par BECLOMETASONE CHIESI tant que votre médecin ne vous l'a pas dit.
Si vous avez reçu un traitement à fortes doses ou pendant une période prolongée par des comprimés de corticostéroïdes, celui-ci pourra être diminué progressivement environ une semaine après le début du traitement par BECLOMETASONE CHIESI. Au cours de cette période de diminution de la dose, votre médecin peut être amené à faire des contrôles sanguins.
Si vous avez été traité(e) pendant une période prolongée avec de fortes doses de corticostéroïdes inhalés, il est possible que, dans les situations de stress, vous ayez besoin d’un traitement par corticostéroïdes supplémentaires.
Ainsi, par exemple :
· au cours d’une hospitalisation suite à un grave accident,
· avant une opération chirurgicale,
· ou si survient une infection pulmonaire ou une autre maladie grave.
votre médecin peut juger nécessaire de vous prescrire un traitement de courte durée par corticostéroïdes en comprimés ou, le cas échéant, une injection de corticostéroïdes. Il vous indiquera également pendant combien de temps vous devrez prendre les comprimés de corticostéroïdes et de quelle façon vous devrez diminuer les doses lorsque vous serez rétabli.
Enfants et adolescents
Si votre enfant a moins de 5 ans et qu’il reçoit un traitement prolongé par BECLOMETASONE CHIESI en raison d'épisodes récurrents de respiration sifflante, votre médecin devra mesurer régulièrement sa taille afin de détecter un possible retard de croissance et décider si le traitement doit être arrêté.
Autres médicaments et BECLOMETASONE CHIESI 400 microgrammes/1 ml, suspension pour inhalation par nébuliseur
Veuillez avertir votre médecin si vous prenez ou avez pris récemment tout autre médicament, y compris des médicaments obtenus sans prescription.
Certains médicaments peuvent augmenter les effets de BECLOMETASONE CHIESI et il est possible que votre médecin juge qu’une surveillance spécifique est nécessaire si vous prenez ces médicaments (incluant certains médicaments pour traiter l’infection à VIH : ritonavir, cobicistat).
Informez vote médecin si vous prenez d’autres corticostéroides car il peut y avoir des interactions avec BECLOMETASONE CHIESI qui pourraient favoriser le risque de survenue d’effets indésirables.
BECLOMETASONE CHIESI 400 microgrammes/1 ml, suspension pour inhalation par nébuliseur avec des aliments et boissons
Sans objet.
Grossesse, allaitement et fertilité
Si vous êtes enceinte ou que vous allaitez, si vous pensez être enceinte ou que vous envisagez une grossesse, demandez conseil à votre médecin ou pharmacien avant de prendre ce médicament.
Le risque de retard de croissance et d'effets néfastes pour l'enfant à naître ne peut être exclu lors d'un traitement prolongé par des corticostéroïdes (tels que le dipropionate de béclométasone contenu dans le BECLOMETASONE CHIESI) pendant la grossesse. Votre médecin jugera de la nécessité d'un traitement par BECLOMETASONE CHIESI pour votre asthme.
De faibles quantités de corticostéroïdes passent dans le lait maternel. Aucun effet néfaste n'a été rapporté chez les nourrissons allaités à ce jour. Par mesure de précaution, vous devez néanmoins éviter d'allaiter dans les 4 h suivant la nébulisation en cas de traitement par dipropionate de béclométasone à fortes doses.
Conduite de véhicules et utilisation de machines
BECLOMETASONE CHIESI est peu susceptible d’influer sur votre aptitude à conduire des véhicules et à utiliser des machines. Cependant, si vous ressentez des effets indésirables tels qu’un étourdissement et/ou des tremblements, votre aptitude à conduire des véhicules ou à faire fonctionner des machines pourra être modifiée.
BECLOMETASONE CHIESI 400 microgrammes/1 ml, suspension pour inhalation par nébuliseur contient
Sans objet.
3. COMMENT UTILISER BECLOMETASONE CHIESI 400 microgrammes/1 ml, suspension pour inhalation par nébuliseur ?
La dose initiale doit vous être prescrite par votre médecin en fonction de la fréquence et de la sévérité de votre maladie. La dose pourra ensuite être ajustée par votre médecin afin d'obtenir un contrôle efficace des symptômes.
Les doses initiales recommandées sont :
Adultes et adolescents (à partir de 12 ans) :
· 800 à 1 600 microgrammes 2 fois par jour soient 2 à 4 récipients unidoses à nébuliser 2 fois par jour (ce qui correspond à une quantité journalière totale de 1600 à 3200 microgrammes soit 4 à 8 récipients unidoses).
Enfants (jusqu’à 11 ans) :
· 400 à 800 microgrammes 2 fois par jour soit 1 à 2 récipients unidoses à nébuliser 2 fois par jour (ce qui correspond à une dose journalière totale de 800 à 1 600 microgrammes soit 2 à 4 récipients unidoses).
La dose quotidienne de 3200 microgrammes chez l’adulte et l’adolescent et de 1600 microgrammes chez l’enfant jusqu’à 11 ans, ne doivent pas être dépassée dans la majorité des cas.
Au cours du traitement de l’asthme, BECLOMETASONE CHIESI doit être utilisé régulièrement chaque jour. Votre médecin décidera de la durée de votre traitement.
La durée du traitement de devra pas dépasser 3 mois chez les enfants traités par BECLOMETASONE CHIESI en raison d'épisodes fréquents de respiration sifflante, sauf si votre pédiatre juge qu'il est nécessaire de prolonger le traitement.
Mode d’administration
BECLOMETASONE CHIESI est destiné à être administré par voie inhalée exclusivement.
Ne pas l’injecter dans une veine ou le prendre par voie orale.
BECLOMETASONE CHIESI doit être administré par inhalation à l’aide d’un appareil de nébulisation à air comprimé en suivant les indications de votre médecin.
BECLOMETASONE CHIESI ne doit pas être administré avec des appareils de nébulisation ultrasoniques.
Indications d’utilisation :
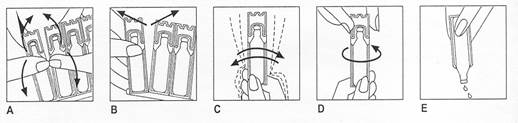
Utiliser le récipient conformément aux instructions suivantes :
|
|
1. Plier le récipient vers l’arrière et vers l’avant (Figure A).
2. Détacher soigneusement un nouveau récipient de la plaquette, en commençant par le haut, puis le milieu (Figure B), en laissant les récipients restant dans le sachet.
3. Agiter vigoureusement et retourner de haut en bas le récipient afin d’homogénéiser la suspension. Renouveler cette opération jusqu’à ce que la totalité du contenu soit complètement dispersée et mélangée (Figure C).
4. Ouvrir le récipient en tournant la partie supérieure, comme indiqué par la flèche ci-dessus (Figure D).
5. Appuyer doucement sur le récipient pour en verser le contenu dans le réservoir du nébuliseur (Figure E).
Le récipient doit être ouvert immédiatement avant l’administration.
Le récipient de 400 microgrammes est destiné à un usage unique.
Dilution :
Votre médecin pourra juger nécessaire de diluer le contenu du récipient. Dans ce cas, le contenu du récipient doit être vidé dans le réservoir du nébuliseur. La quantité de solution de chlorure de sodium à 9 mg/ml (0,9 %) prescrite par votre médecin sera ensuite ajoutée pour diluer le produit. Refermer le réservoir du nébuliseur, puis agiter délicatement le nébuliseur pour mélanger le contenu.
La dose de suspension à nébuliser peut être diluée afin d’obtenir un volume final qui correspond au nébuliseur utilisé, pour faciliter l’administration de faibles volumes ou si l’on souhaite prolonger la durée de la nébulisation.
Pendant la nébulisation :
Mettre le masque ou l’embout buccal en place.
Activer l’appareil de nébulisation.
Respirer normalement. La séance de nébulisation dure au maximum 10 à 15 minutes.
Après la nébulisation :
Ne pas oublier de se rincer à l’eau la bouche, les lèvres et la région du visage couverte par le masque.
Après l’inhalation, toute suspension non utilisée restant dans la cuve du nébuliseur doit être jetée.
Nettoyage :
Suivre les instructions du fabricant pour le nettoyage du nébuliseur. Il est important que votre nébuliseur reste propre.
Si vous avez utilisé plus de BECLOMETASONE CHIESI 400 microgrammes/1 ml, suspension pour inhalation par nébuliseur que vous n’auriez dû :
Informez-en votre médecin dès que possible. Votre médecin souhaitera peut-être vérifier les taux de corticostéroïdes dans votre sang et, par conséquent, peut éventuellement demander un prélèvement sanguin.
Il est important de respecter la dose prescrite par le médecin. Vous ne devez ni augmenter ni diminuer la dose sans demander conseil à un professionnel de santé.
Si vous oubliez d’utiliser BECLOMETASONE CHIESI 400 microgrammes/1 ml, suspension pour inhalation par nébuliseur :
Si vous oubliez d’utiliser une dose, prenez-la dès que vous vous rendez compte de votre oubli. Si l’heure de votre dose suivante est proche, ne prenez pas la dose oubliée mais uniquement la dose suivante au moment prévu. Ne prenez pas de dose double pour compenser la dose que vous avez oublié de prendre.
Si vous avez d’autres questions sur l’utilisation de ce médicament, demandez plus d’informations à votre médecin ou à votre pharmacien.
Si vous arrêtez d’utiliser BECLOMETASONE CHIESI 400 microgrammes/1 ml, suspension pour inhalation par nébuliseur :
Sans objet.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
Les effets indésirables suivants ont été signalés. Informez votre médecin dès que possible si vous présentez l’un de ces effets indésirables mais n’arrêtez pas le traitement sans l’avis de votre médecin. Afin de réduire ces effets indésirables, votre médecin déterminera avec vous la dose minimale efficace de Béclométasone Chiesi qui est adaptée à votre cas.
Effets indésirables très fréquents (pouvant toucher plus de 1 personne sur 10) :
· mal de gorge (pharyngite, laryngite). Cet effet peut être prévenu par des gargarismes avec de l’eau immédiatement après l’inhalation.
Effets indésirables fréquents (pouvant toucher jusqu’à 1 personne sur 10) :
· toux,
· nausées et douleurs à l’estomac,
· mycose (communément appelé « muguet ») dans la bouche, sur la langue et dans la gorge. Ces effets peuvent être prévenus en se rinçant la bouche ou en faisant des gargarismes avec de l’eau immédiatement après l’inhalation.
Effets indésirables peu fréquents (pouvant toucher jusqu’à 1 personne sur 100) :
· maux de tête,
· irritation de la gorge, voix enrouée,
· aggravation de l’essoufflement, de la toux et de la respiration sifflante immédiatement après l’administration (connue sous le nom de bronchospasme paradoxal). Si cela se produit, arrêtez le traitement et ne renouvelez pas la prise de BECLOMETASONE CHIESI. Ensuite, contactez immédiatement votre médecin. Celui-ci réévaluera avec vous votre traitement, et, si nécessaire, vous prescrira un autre traitement. Il est possible que vous ne puissiez plus utiliser BECLOMETASONE CHIESI.
· Vision floue
Effets indésirables rares (peuvent toucher jusqu’à 1 personne sur 1 000) :
· boutons de fièvre (herpès simplex), vésicules douloureuses semblables à des cloques sur vos lèvres et/ou dans votre bouche,
· tremblements (involontaires),
· sensation de fatigue,
· réaction allergique (gonflement des yeux, du visage, des lèvres et de la gorge entraînant une gêne respiratoire importante, des éruptions cutanées, de l’urticaire, des démangeaisons ou des rougeurs de la peau)
Les effets indésirables suivants peuvent également survenir, principalement chez les enfants.
· troubles du sommeil, dépression ou anxiété, agitation, nervosité, surexcitation ou comportement irritable
S'il est utilisé à fortes doses pendant une période prolongée, BECLOMETASONE CHIESI peut modifier la production normale de corticostéroïdes dans l’organisme. Les enfants et adolescents traités par BECLOMETASONE CHIESI, peuvent avoir un retard de croissance, il est donc important que le médecin vérifie leur taille régulièrement. De plus, un amincissement des os et des problèmes oculaires, comprenant une opacification du cristallin (cataracte) et une augmentation de la pression dans l’œil (glaucome) ont été signalés.
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien ou à votre infirmier/ère. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : www.signalement.social-sante.gouv.fr
En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.
5. COMMENT CONSERVER BECLOMETASONE CHIESI 400 microgrammes/1 ml, suspension pour inhalation par nébuliseur ?
Tenir ce médicament hors de la vue et de la portée des enfants.
Ne pas utiliser BECLOMETASONE CHIESI après la date de péremption indiquée sur la boîte, le sachet et le récipient.
Conserver les récipients en position verticale dans l’emballage d’origine (étui en carton) afin de les protéger de la lumière.
Après la première ouverture du sachet en aluminium, écrivez la date d’ouverture sur le sachet. N’utilisez pas les récipients après un délai de 3 mois suivant la date de la première ouverture du sachet.
N’utilisez pas BECLOMETASONE CHIESI si l’emballage est endommagé.
Ne jetez aucun médicament au tout-à-l’égout. Demandez à votre pharmacien d’éliminer les médicaments que vous n’utilisez plus. Ces mesures contribueront à protéger l’environnement.
6. CONTENU DE L’EMBALLAGE ET AUTRES INFORMATIONS
· La substance active est :
Dipropionate de béclométasone................................................................... 400 microgrammes
Pour 1ml.
· Les autres composants sont : le polysorbate 20, le laurate de sorbitan, le chlorure de sodium et l’eau purifiée.
BECLOMETASONE CHIESI est une suspension de couleur blanchâtre pour nébuliseur.
BECLOMETASONE CHIESI 400 microgrammes/1 ml, suspension pour inhalation par nébuliseur existe en récipient de 1 ml.
Les récipients sont conditionnés par 5 dans un sachet scellé, en boîtes de 10 récipients (2 sachets), 20 récipients (4 sachets) ou 40 récipients (8 sachets).
Toutes les présentations peuvent ne pas être commercialisées.
Titulaire de l’autorisation de mise sur le marché
17 AVENUE DE L’EUROPE
92270 BOIS COLOMBES
Exploitant de l’autorisation de mise sur le marché
17 AVENUE DE L’EUROPE
92270 BOIS COLOMBES
VIA San LEONARDO 96
43122 PARMA
ITALie
Noms du médicament dans les Etats membres de l'Espace Economique Européen
Sans objet.
La dernière date à laquelle cette notice a été révisée est :
[à compléter ultérieurement par le titulaire]
Des informations détaillées sur ce médicament sont disponibles sur le site Internet de l’ANSM (France).